陆树洋医生的科普号
- 医学科普 医生,心脏开刀我的骨头要被拿掉一块吗?
心脏外科手术让很多患者有种莫名的恐惧,因为未知、所以恐惧,可以理解。很多患者对心脏外科手术还有很多认识上的误区,常常听到患者问到的一个问题:医生,心脏开刀我的骨头要被拿掉吗?心脏外科手术的种类很多,不同的手术方式,手术入路也不尽相同,但是可以肯定的回答是:心脏手术不需要取掉患者身上的骨头。传统经典的心脏外科手术入路是胸骨正中切开术,胸骨由三部分构成:胸骨柄、胸骨体、剑突构成,胸骨正中开胸是沿着胸骨正中线打开,手术结束后再采用钢丝或胸骨固定装置(钢板、扎带等)进行胸骨复位固定,通常两三个月骨头可以愈合。随着心血管外科技术的进步,有很多心脏外科,如主动脉瓣、二尖瓣、升主动脉手术,手术可以通过部分胸骨切开的方式来完成,这样切口更加小、美容效果更佳优越。还有一些单纯瓣膜病变,如二尖瓣手术,主动脉瓣手术,可以通过肋间手术切口完成,可以有效保持胸骨和肋骨的完整性,术后患者的康复也非常快速。总而言之,心血管外科手术并不像广大患者所认为的,手术非常危险,开了胸,整个人就不完整了。目前心脏外科技术、体外循环技术、心血管麻醉技术、重症监护技术及护理团队的进步,已经让心血管外科手术变得非常安全。
 陆树洋 副主任医师 上海中山医院 心脏外科375人已读
陆树洋 副主任医师 上海中山医院 心脏外科375人已读 - 医学科普 心血管外科患者务必重视华法林的使用
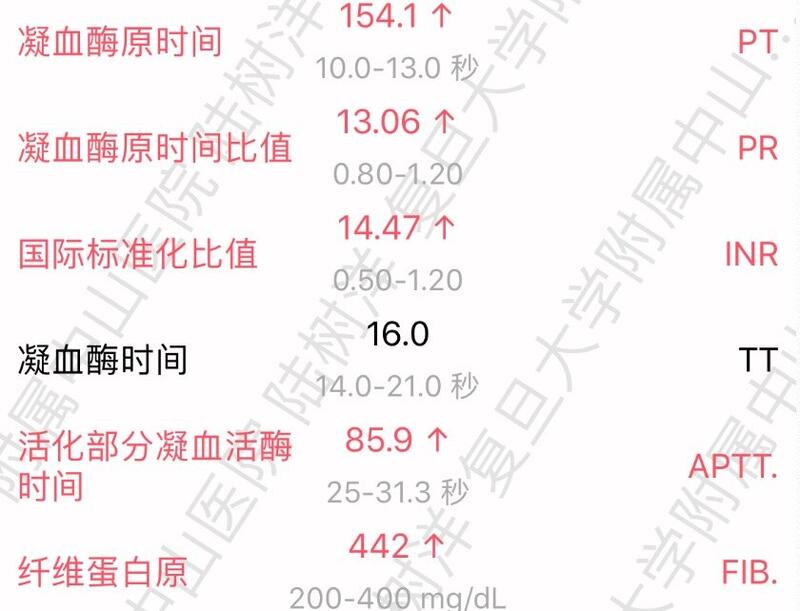
对于很多心血管外科的患者,华法林是一种极其常用的药物。但是,对于华法林的使用又是一把双刃剑,使用合理,可以有效发挥其抗凝抗栓作用,使用不当,后果不堪设想。心血管外科行瓣膜置换的患者,特别是机械瓣膜置换术后患者,指南推荐必须终生服用华法林进行抗凝治疗,生物瓣膜置换术后患者,原则上服用三个月至半年华法林抗凝治疗,随后改服拜阿司匹林进行终生抗血小板治疗,有利于维持生物瓣的远期功能。服用华法林的剂量需要通过监测凝血功能,通常以国际标准化比值(INR)参考,动态调整华法林的剂量。INR低于1.5,血栓形成的风险会逐渐增高,INR高于3.5,对于中国人群,出血的风险会大大增高。因此,在心血管外科瓣膜置换术后早期,通常要求患者频繁监测凝血指标,待指标相对稳定,再逐渐延长查血的时间。分享本人既往接诊的1例患者,惊心动魄的华法林用药经历,给各位病友一点借鉴。患者女性,69岁,二尖瓣关闭不全,三尖瓣关闭不全,房颤。先于当地医院就诊,当地医院建议上级医院手术治疗,同时给予药物对症处理,包括华法林的抗凝治疗(方案1/2片,一天一次)。患者转诊至我处,入院身上多处淤青,口腔黏膜出血。追问病史,该患者理解成一天1-2片。入院时INR指标达到14.47,给予维生素K20mg,静脉滴注,效果不佳。复测凝血功能INR20.20,再次补充维生素K20mg,凝血酶原复合物静脉滴注2瓶。复测凝血功能INR恢复至1.53。再次提醒各位心血管疾病患者,务必谨慎应用华法林,当您对治疗方案不够清晰时,务必在专科医生指导下使用。
 陆树洋 副主任医师 上海中山医院 心脏外科211人已读
陆树洋 副主任医师 上海中山医院 心脏外科211人已读 - 医学科普 小切口解决“大问题”& 大幅提高移植效果 中山创新故事
微创技术:小切口解决“大问题” 在很多人的印象中,做心脏手术需要开胸,不仅风险高、创伤大、出血多、多数患者需要输血,术后恢复也相当慢。对于高龄和全身情况较差的患者而言,开胸手术是“不能承受之重”;对心外科医生而言,为这类高危患者实施心脏手术也是巨大挑战。正因如此,如何通过微创手术来解决上述问题成为近年来国内外研究的热点。 中山医院心脏外科自20 世纪90 年代末就开始尝试开展微创心脏瓣膜手术。2009 年起常规开展微创二尖瓣置换/ 成形术、微创主动脉瓣置换术、微创三尖瓣成形术,至今已完成微创瓣膜手术近2000 例。无论数量,还是手术效果,均在国内居领先地位,并将技术推广至国内20 多家医院。近年来, 中山医院心脏外科还将微创心脏手术适应证拓展到胸骨上段小切口微创二尖瓣、主动脉瓣双瓣置换术,微创升主动脉置换术等。 自2010 年8 月起,中山医院心外科开始开展达·芬奇机器人辅助二尖瓣成形术。该术式仅通过胸壁上几个小孔,即可完成二尖瓣成形术,且病灶观察更仔细、手术操作更精确,是目前国际上最先进的微创二尖瓣修复技术。 2014 年,中山医院又针对高龄、高危患者开展经导管主动脉瓣置换术, 不开胸,无须体外循环和心脏切开,即可置换病变的主动脉瓣。该技术不但可以治疗主动脉瓣狭窄,而且可以治疗主动脉瓣关闭不全。 改良心脏移植技术:大幅提高移植效果 通俗地说,心力衰竭是心脏功能发生了衰竭,包括收缩(泵血)功能衰竭和舒张(血液回流至心脏)功能衰竭。目前,全球心衰患者总数高达2300 万人,我国心衰患者的数量没有准确的统计数据,预计我国的心衰患者数应该在千万人以上。心衰患者的死亡率高,30 天标化死亡率为10.8%, 再住院率高达24.5%,5 年死亡率高达50%。心力衰竭发展至终末期时, 心脏移植是最为有效的治疗方法。 复旦大学附属中山医院心外科自2000 年成功实施第一例心脏移植以来,经过十余年的探索与发展,在移植技术与移植患者的围手术期管理等方面积累了丰富经验, 心脏移植已成为科室及医院主要特色之一。截至目前,中山医院心外科已完成心脏移植400 余例,心肺联合移植10 例,其中包括国内首例儿童心脏移植(12 岁),首例再次心脏移植,年龄最大的心脏移植(77 岁), 亚洲首例心肝联合移植,亚洲首例肝、心、肾序贯移植等特殊病例。心肺联合移植患者最长已存活14 年(国内文献报道存活时间最长);心脏移植手术成功率达97. 8%,1 年、3 年、5 年存活率分别为90.7%、83.6%、75.1%,移植数量和成功率在国内处于领先水平,已达到国外大规模移植中心水平。 1 、改良供体心脏保存方法 原位心脏移植手术时,医生需要从患者的胸骨正中开胸,暴露纵隔,打开心包,切断大血管后通过体外循环机(人工心肺机) 进行辅助循环,并将衰竭的心脏分离出来。随后,供体心脏被植入原心脏部位,与受体的血管和剩余左心房组织吻合。供体心脏复跳后,可脱离体外循环机,缝合关胸。 一般地说,供体的心脏在取出前需要经心脏停跳液处理,使心脏停搏;取出后须灌注心肌保护液,同时放入冰水中保存。通常,供体心脏可以在冰水中保存4 ~ 6 小时。中山医院心外科采用自创的长缺血时间供体心脏保存方法,使心脏保存时限从4 小时延长至8 小时,且该保存方法可应用于“无心跳供心”的获取,大大拓展了供心来源。 2 、改良心脏吻合技术 中山医院心外科对心脏吻合技术进行了创新改良。传统心脏移植一般按照心脏解剖顺序自后向前完成吻合,具体顺序为: 左房-下腔静脉-主动脉-肺动脉-上腔静脉。传统手术时间长,心脏复跳后负荷重, 心功能损害大。中山医院心脏外科提出“生理顺序”的心脏吻合技术,即先进行“左心吻合”(左房、主动脉吻合完成后,即可实现心脏复跳),再完成“右心吻合”(下腔静脉-肺动脉-上腔静脉),使心脏缺血时间和手术总时间缩短20% ~ 30%,心脏复跳后负荷小,可有效促进供心恢复, 大大改善患者预后。 3、完善术后管理 中山医院心外科设立心脏移植随访专家门诊,指导患者术后康复和抗排异治疗。由专人负责资料收集与管理,全面掌握心脏移植患者术后情况,积极拓宽随访途径与方式,使心脏移植术后随访率达100%, 现已积累国内最大样本的心脏移植随访数据库。 借助中山医院大型综合性医疗中心的资源优势,心外科还积极整合心内科、心理科、心超室等资源,对心脏移植患者的术后康复、药物治疗、心理调整等各方面提供全面指导和干预,帮助患者进一步提高疗效,改善生活质量。 作者 王春生 陆树洋
 陆树洋 副主任医师 上海中山医院 心脏外科1584人已读
陆树洋 副主任医师 上海中山医院 心脏外科1584人已读 - 临床经验 胸骨正中劈开术后如何复位固定胸骨才是最佳的?
作者简介 陆树洋 医学博士,复旦大学附属中山医院心脏外科主治医师,从事心血管外科的基础与临床研究。 主持与参与的课题包括国家自然科学基金,中山医院青年基金,上海市重大疾病联合攻关项目。 在心血管外科领域发表论文20余篇,SCI 13篇。 已申请获得授权实用新型专利5项。 胸骨正中劈开是心脏外科手术的经典入路,就在当前,80%的心脏外科手术仍然采用这一传统的经典的手术入路,手术结束后采用胸骨带针钢丝复位固定胸骨,继之后来出现的胸骨钛板固定系统。那么问题来了,如何复位固定胸骨才是正确的呢?仁者见仁,智者见智。事实上,我们临床上见到的现象是,有的医生喜欢采用钢丝穿骨质结构,有的喜欢穿肋间固定,有的喜欢单针间断固定,有的喜欢8字固定,有的喜欢钢丝结合钛板固定。如此多的固定方法,孰优孰劣,笔者疑惑多年,仅仅是师徒传承,还是仅仅因为习惯吗?切身体会过穿骨质结构固定,也体会过穿过肋间固定,追随不同的老师,总有不同的见地。为了更加科学地复位固定胸骨,笔者结合自身的临床体会,仔细阅读文献、查阅资料,试图寻求胸骨复位固定的一些基本答案。 关于胸骨复位固定文献怎么说? 胸骨正中开胸最早由Milton医生1897年提出,这一手术入路直到1957年以后,由于Julian及其同事的推广,才真正得到盛行普及,同时,针对术后胸骨闭合,他们提出了钢丝环扎术(Wire cerclage)。当然,在此基础上,随后诸多学者衍生出了许许多多的胸骨复位固定方法,如8字固定(图1),胸骨带固定(Sterna-band)(图2),Robicsek固定,改良Robicsek固定,Multi-twist固定(图3),钛板固定法等。一种完美的固定方法必须尽可能满足如下特点:机械力学(可以抵抗最大的应力,如咳嗽、打喷嚏),是否可以透视(通过检查观察胸骨的移位),生物相容性,可操作性(尽可能短的固定时间,最大化的固定强度),是否容易移除(当必须要去除时),成本效益比(Alhalawani et al,2013)。 目前绝大部分关于胸骨复位固定的研究文献,主要瞄准机械力学分析点来展开。Wilson等研究得出结论带状8字固定法的生物机械力学优于传统的钢丝8字固定,可以减少术后胸骨并发症的发生(图4)。 于有糖尿病、肥胖等特殊人群的胸骨固定方法,预防性胸骨编织增强固定(Robiscek)优于传统的8字固定,可以有效减少胸骨裂开等并发症的发生(Aykut et al,2011)。 关于胸骨钢丝固定单纯固定,8字固定,穿骨质结构还是肋间之争?Khasati et al得出的结论是8字固定并不优于单针固定技术。Casha et al认为单纯肋间固定优于穿骨质的单纯固定及8字固定方法,降低胸骨切割的概率。 胸骨钛板固定的优越性,诸多文献已有所说明,可以获得更好的胸骨稳定性,减少术后纵隔感染的发生(图5)(Raman et al,2007,2012)。除了获得良好的胸骨稳定性,Hirose et al 认为与传统钢丝固定相比,术后伤口疼痛更少,恢复更快(Hirose et al,2011)。与改良胸骨钢丝固定法相比,对于高危患者,钛板固定同样适合且效果更佳,减少术后纵隔感染等胸骨并发症的发生(Park et al,2016)。Hirose et al明确指出骨质疏松及胸骨质量较差的患者不适合钛板固定,易出现锚定不牢,更适合钢丝固定,如年长人群、女性人群更多。 总结一下文献结论,似乎单纯肋间固定优于经肋间8字固定,后者优于单纯经骨质固定,最不推荐的为经骨质8字固定法。若不考虑经济因素,胸骨质量良好者,亦可采用钛板固定法,可以获得更好的结果。 真实世界中的胸骨复位固定是怎么做的? 若按照Alhalawani et al 提出的一种完美的固定方法必须尽可能满足如下特点:机械力学,是否可以透视,生物相容性,可操作性,是否容易移除,成本效益比。钢丝环扎法无疑是目前最为经典标准的胸骨固定方法,具备了上述的所有优点。钛板固定如诸多文献所述,如何优越,显而易见的弊端是,阻挡透视,操作时间长,遇到紧急开胸移除困难,代价昂贵等等。 胸骨由胸骨柄、胸骨体、剑突构成,L1-L7肋骨通过肋软骨直接连接于胸骨,L8-L10通过共同肋软骨形成肋弓连接于L7,L11-L12为浮肋(图6)。 如肋骨解剖所示,采用肋间固定法,可以利用的肋间有L1-L5,L6-L7基本融为一体,如果全部采用肋间固定法,理论上可以单针固定最多5针,8字固定理论上最多4针(重叠交错固定)。临床实践中,L1-L2肋间狭小,胸骨柄处解剖宽大,肋间远离胸骨正中,难以触及,此处肋间固定操作难度较大。真实世界中,胸骨柄处采用穿骨质结构常见。L2-L5易触及,穿肋间易取。 穿骨质结构固定法,理论上不受肋间限制,根据胸骨结构长短自由决策钢丝根数。若遇骨质结构较差患者,出现胸骨切割风险明显增加,可能不适合此法固定。 当然胸骨复位固定远不止于穿完钢丝这么简单,还要面临胸骨钢丝止血,缝合胸部伤口等后续环节,且后续环节并不完全独立于胸骨钢丝固定。若遇出血,显而易见,穿肋间固定,相对容易缝合止血,穿骨质结构相对困难,可采取的措施:电凝,缝合胸骨后骨膜等,较为窘迫。有医生认为,虽然穿骨质结构出血难以处理,即便不处理一般亦会自行止住,很少导致开胸止血,穿肋间则不然,笔者持保留态度。 真实世界中,为了规避穿骨质结构,肋间派者,大多喜欢钛板联合肋间固定法,胸骨柄处采用钛板固定,L2-L5处采用肋间固定。看似很完美?真的完美吗? 胸骨固定除了要考虑胸骨、肋骨等骨质结构的解剖,还要胸部整体的解剖。除了骨质结构,胸部还有肋间肌、胸小肌、胸大肌、皮肤脂肪层等结构(图7)。肋间固定法明显的缺点是为了缝合肋间将肌肉皮下组织层自胸骨正中向两侧推移了,直接导致皮下肌肉层缝合张力过大,甚至难以缝合,胸骨前形成空腔,大大增加术后伤口愈合不良风险。 肋间派说服不了骨质派,骨质派亦否定不了肋间派,对于骨质结构优良的情况,似乎难分伯仲,而临床实践中,大部分患者骨质结构似乎允许任何一种固定方法,加之许多医生术后常规嘱患者3个月胸骨绑带辅助治疗,术后更加难以观察出差异。 我们需要怎样的胸骨复位固定? 没有一种胸骨固定方法是十全十美的,谁也难以完完全全说服对方。结合文献及临床实践,笔者体会胸骨柄处采用骨质结构固定,胸骨体部采用肋间固定,单针固定、还是8字固定依据个人喜好,若一定要推荐,建议单针固定。 参考文献 1. Dalton ML, Connally SR, SealyWC. Julian's reintroduction of Milton's operation. Ann Thorac Surg. 1992;53:532–533. 2. Alhalawani AM, Towler MR. A reviewof sternal closure techniques. J Biomater Appl. 2013;28:483–497. 3. Wilson R M, Ghareeb P A, Mcclellan W T, et al. Biomechanical analysis of the FlatWire Figure 8 sternal fixation device.[J]. Plast Surg. 2014;22(3):188. 4. AykutK, CelikB,AckelU. Figure-of-eight versus prophylactic sternalweave closure of median sternotomy in diabetic obese patients undergoing coronary artery bypass grafting. Ann Thorac Surg. 2011;92:638–641. 5. Khasati N, Sivaprakasam R, Dunning J. Is the figure-of-eight superior to the simple wire technique for closure of the sternum? Interact Cardiovasc Thorac Surg. 2004;3:191–194. 6. Raman J, Lehmann S, Zehr K, et al. Sternal closure with rigid plate fixation versus wire closure: a randomized controlled multicenter trial.[J]. Ann Thorac Surg. 2012; 94(6):1854-1861. 7. Raman J, Straus D, Song DH. Rigid plate fixation of the sternum. Ann Thorac Surg. 2007;84:1056–1058. 8. Hirose H, Yamane K, Youdelman BA, et al. Rigid sternal fixation improves postoperative recovery. Open Cardiovasc Med J. 2011;5:148–152. 8. Park J S, Kuo J H, Young J N, et al. Rigid Sternal Fixation Versus Modified Wire Technique for Poststernotomy Closures: A Retrospective Cost Analysis[J]. Ann Plast Surg. 2016; 78(5):537.
 陆树洋 副主任医师 上海中山医院 心脏外科1.2万人已读
陆树洋 副主任医师 上海中山医院 心脏外科1.2万人已读





