仇惠英医生的科普号
- 精选 青少年和年轻成人急性淋巴细胞白血病
青少年和年轻成人ALL患者(AYA)很少,但是所碰到临床问题具有挑战性甚至明确这组患者的年龄范围是一问题,目前普通能接受年龄在15~30岁之间,这一年龄组范围并不是绝对的,SEER研究组以每5年划分群体以描述肿瘤发生率和死亡率,比如,目前部分儿童ALL临床试验允许30岁以下年轻成人加入,更者,一些成人研究机构临床试验,包括M.D.Anderson肿瘤中心(MDACC)纳入更高龄ALL患者,甚至到55岁“年轻成人”,范围取决于书写研究计划的执行人员。 一、在青少年和年轻成人中急性淋巴细胞白血病发生率SEER统计年轻成人ALL发生率在2001~2005年期间,在美国发生率为1.6/100,000,年龄在15~29岁之间,在所有新诊断侵袭性肿瘤中大约占6%,与更高年龄组相比,15~29岁患者ALL发生率最低,其他白血病发生率较低。在美国,15~29岁之间新诊断ALL患者绝对数据大约在540例。二、青少年和年轻成人患者(AYA)治疗方法在临床实践中,这一群患者,特别是更年轻青少年,可出现在儿童或成人肿瘤组,导致研究结果在二组相比较,很多发表研究报导儿童组治疗结果OS和EFS均优于成人治疗组。对>21岁年龄组没有可比性研究,在这一年龄组应用儿童治疗方案,到目前为止所报导毒性似乎均可接受,一些在成人组采用儿童治疗方案研究显示:Ⅲ—Ⅳ级毒性非常少。在MDACC,>21岁30例成人接受儿童方案,不包括预期血液学毒性,大约20%出现Ⅲ—Ⅳ级不良事件,相关毒性可接受和可操作性。儿童方案在年轻成人中作用仍不明确,需要更多时间和更长随访期去证实。在成人和儿童临床试验中存在很多不同因素,(1)对疾病的熟悉程度,在儿童患者中ALL是最常见恶性肿瘤,大多数儿童肿瘤学家非常熟悉照料这些患者,给儿科肿瘤学家提供治疗优势,另一方面,ALL在成人中不是很常见,因此成人肿瘤学家可能不会集中关注这些少见疾病,这些在ALL中特别重要,患者处理和治疗非常复杂。(2)儿童肿瘤患者通常在良好医学中心治疗,大部分成人白血病患者在普通病房治疗,在儿童白血病临床方面非常强调方案治疗—试验审核严格,≧21岁年轻成人进入试验很差。(3)儿童患者有父母监视和支持,无条件选择,按时间访视医生,按时用药,一个方案可以很容易持续3年。(4)最后,儿童患者与年轻成人ALL生物学特征有所不同,比如TEL-AML易位和超二倍体发生率明显低于儿童组,而Ph+ALL,高白细胞计数,T细胞ALL发生率均高于儿童组。青少年患者ALL在儿童白血病中心,选择有效方案,另外,可接受正在进行之中的国家方案,目前儿童肿瘤组方案,对患者年龄开放到30岁,根据Berlin-Frankfurt-Muenster(BFM)治疗,在这一试验中研究结果报道:对治疗快速反应患者81%获得6年EFS和89%获得6年总生存率,在各年龄组差异很小,快速反应指在7天治疗后原始细胞<25%,诱导治疗第28天获得形态学完全缓解。试验采用强化VCR,门冬酰胺酶和甲氨喋呤,应用于青少年或其它高危因素ALL(在MDACC儿童临床中心如果家庭不希望参加国家实验方案),其它选择已知对青少年患者具有显著疗效方案包括Dana Farber Cancer研究所(DFCI),高危ALL方案和BFM治疗方案采用高剂量MTX,DFCI研究方案采用强化门冬酰胺酶治疗,一组年龄15~18岁,采用2个连续DFCI试验治疗结果显示这些患者获得78%EFS,DFCI 95-01方案对所有>15岁患者采用颅脑放射治疗,对青少年T-ALL,儿童肿瘤组(PCG)9404方案同样显示显著疗效,这一试验同样应用强化门冬酰胺酶和高剂量甲氨喋呤,有趣的是最近对青少年T-ALL高危患者治疗临床试验取得与前B细胞ALL相似疗效。在成人临床组,青少年经常被放在成人ALL方案组,例如hyper-CVAD方案,hyper-CVAD交替疗程采用分次环磷酰胺、长春新碱、糖皮质激素和阿霉素与中剂量甲氨喋呤和高剂量阿糖胞苷相交替,包括鞘内治疗,通过中枢神经系统疾病危险度和首次腰穿脑脊液检查状况,这一方案至少获得95%完全缓解率;除了脊髓神经系统侵犯,不采用脑脊髓放疗,中枢神经系统复发率<5%,已发表hyper-CVAD5年EFS在38%(包括所有患者),ALL采用强化治疗可获得相似完全缓解率,采用相对高剂量蒽环类,以及高剂量Ara-c和甲氨喋呤,治疗期限与儿童方案相比相对较短,不延长维持治疗期,Pre-B-ALL用这一方案治疗,对所有患者5年EFS大约52%,对高白细胞或MLL基因重排的患者达不到这样疗效,肿瘤和白血病组(CALGB)8811例研究显示,对<30岁前B-ALL的5年EFS在69%。但更大的ECOG研究组结果并不令人鼓舞,在这一试验中,包括4药联合诱导化疗。紧随第2期诱导采用环磷酰胺和阿糖胞苷,这一初始治疗与儿童ALL治疗方案非常相似,而后期治疗与儿童方案有所不同采用中等剂量,在ECOG试验组治疗的15~19岁患者,5年总生存率44%,有趣的是,在20~29岁患者OS与青少年组类似OS在45%。三、疾病特异治疗成人ALL治疗策略进入快速阶段,针对不同亚型正在尝试,前B-ALL表达CD20, 成人患者采用抗CD20单抗美罗华加hyper-CVAD与非-T-CD20+ALL回顾性研究结果相比,在<30岁患者美罗华可提高无病生存率(62%相对28%)。但在更高年龄患者,对OS和DFS提高无统计学意义,因此,对青少年期和年轻成人ALL在标准化疗基础上加用抗CD20单抗可能是一种吸引人的选择,需要积累更多病例。很多成人组对ph+-ALL,目前都采用在化疗同时加入赖氨酸激酶TKIS,成人研究显示如果检测到ph染色体,伊马替尼可以在化疗时就加入,耐受很好,对一组平均年龄51岁(17~84岁)ph+-ALL采用hyper-CVAD联合伊马替尼长期随访研究,93%患者获得完全形态学缓解,巢式PCR检测52%患者获得分子反应,与单用hyper-CVAD相比,3年DFS和OS明显提高(66% VS 14%以及55% VS 15%P<0.001)。第二代TKI,达沙替尼与hyper-CVAD联合正在被用于ph+-ALL,目前时间太早尚未得出明确结论。年轻成人T-ALL采用hyper-CVAD联合nelarabin与儿童肿瘤组(COG)治疗策略相似,将nelarabin加入到BFM,治疗联合高剂量甲氨四、中枢神经系统治疗所有用于治疗ALL策略均预防CNS复发或对CNS白血病具有治疗作用, 但是针对CNS治疗需要多少疗程?什么样病人需要接受针对CNS白血病治疗?最近,一些研究小组采用BFM为基础治疗提出对维持高治愈率是否颅脑放疗非常重要?BFM组发现对中危组前B-ALL患者并不需要放疗治疗。中危组包括前B-ALL青少年患者对激素反应好,儿童肿瘤组(COG)临床试验采用提前BFM治疗,尽管放疗剂量很小而且并不包括脊髓放疗所有显示早期反应,一些临床试验均包括颅脑放疗,而另一些治疗方法即便诊断时以往有CNS白血病患者也不采用颅脑放疗,对脑白患者采用hyper-CVAD方案加上强化鞘内注射以及采用放疗患者相比较,采用hyper-CVAD组中枢神经系统复发率更低,可能与应用高剂量阿糖胞苷有关。因此,不采用颅脑照射,单用联合化疗在青少年和年轻成人ALL中也可获得部分治愈。鞘内注射次数是有争议性的,可能取决于所选择的全身化疗方案,鞘内注射范围在hyper-CVAD方案8次到25次,以上对早期反应慢采用儿童方案治疗患者,大多数鞘注次数处于中间。目前,年轻成人前B-ALL在MDACC中心治疗接受提高BFM治疗和门冬酰胺酶方案患者接受15次鞘注。另外,在CNS预防腰穿的时候由于损伤可能把白血病细胞带入CNS,有报道ALL起始有损伤鞘内注射ALL患者预后更差,由于AYA群体越来越肥胖鞘注损伤有所增加,建议对于肥胖病人延迟首次鞘内注射直到循环中原始细胞被清除,降低CNS污染的机会。年轻成人患者采用儿童为基础治疗方法,最令人关注的毒性似乎可接受,如以上提到的根据强化门冬酰胺酶为基础治疗,耐受性很好,标准4~5种药物联合诱导结合鞘内注射可以很好执行,在诱导治疗后达到很高的完全缓解率,儿童方案与成人方案相比总体上所需住院时间较短,在儿童方案中加入TKIS、美罗华或nelarabine是否安全有效仍不清楚,这些研究可能会在不久将来进行。五、造血干细胞移植针对非常高危前B-ALL患者在儿童方案中目前推荐移植方法,这组患者包括以下几种:根据形态学标准诱导失败,或持续存在微小残留病灶(MRD);ph染色体,MLL重排对治疗反应差,亚二倍体染色体44条或在白血病原始细胞中DNA指数<0.81,如果有配对相关供体或者一个抗原不合相关供体,除了HLA-DR位点,在初始化疗后缓解中患者进入移植程序。青少年和年轻成人ALL中骨髓移植作用是什么?成人ALL在首次缓解后移植EFS总体上在30~40%,在第二次CR期后移植效果更差,EFS在不同年龄组不同,但另一些研究,年龄并不影响生存,另一些研究者发现对首次缓解患者<30岁年龄组LFS高于30岁年龄组,移植后LFS可能优于化疗后LFS。对高危组成人ALL研究中,对这些起病时白细胞高,ph染色体阳性,对化疗反应慢或对原发诱导耐药,或者含有MLL重排对化疗非常差,在这种情况下,在首次缓解后强烈推荐干细胞移植治疗,与儿童组相反,亚二倍体不会经常提到作为成人ALL高危特征。儿童方案应用于年轻成人群体,目前对这一群体尚无对新化疗策略与干细胞移植有效性对比分析,对高危年轻成人有必要将移植加入到新的化疗方案。六、复发和难治性ALL年轻成人ALL复发后,治疗围绕骨髓移植,如果有可接受供体,可获得第二次缓解,随后尽快转入移植程序,最大的困难在于决定供体以及诱导再次缓解,在第一次复发后尽管患者实施移植,维持缓解状态非常困难。由于中枢神经系统复发数据很少,强化鞘内化疗结合系统全身治疗可成功达到缓解,但是长期生存非常差。hyper-CVAD方案,加上VCR、门冬酰胺酶和地塞米松,大约45%患者可达到第二次缓解。对年轻成人采用儿童方案复发后患者这是一种有活力选择,相反,如果采用hyper-CVAD方案复发患者可能对儿童方案为基础的诱导方案有效。七、总结年轻成人ALL(AYA)治疗处于儿童与成人方案交叉路口,导致这一群体被划到成人或儿童组,在交叉路口可能有所益处,不只是对年轻成人患者,同时对各个年龄组ALL,中间组年轻成人ALL,患者具有将成人和儿童试验结合起来潜力,推动新的试验在年轻和老年ALL群体中开展,比如TKI早期应用到ph+ALL治疗的方案,最近被加入到儿童ALL治疗。第二代和后期TKIS正在AYA群体中开展临床试验,如果成功,将会强力支持推进这些药物应用于儿童ph+-ALL前沿治疗。另外一个例子抗CD20单抗美罗华,对年轻成人ALL治疗被证实带来益处,可能值得在高危儿童CD20+非T-ALL中试验应用,对成人急性白血病,目前兴趣在于将儿童样化疗方案应用于成人,可能提高生存期、减少住院天数,另外,儿童注重于后期效应,特别是认知功能,同时也被应用于成年患者,在将来,对AYA类ALL患者治疗将希望继续借鉴于成人和儿童试验。MRD,成人和儿童组正在研究怎样应用MRD治疗ALL。对青少年和儿童ALL和持续存在MRD可能会考虑移植治疗。
仇惠英 主任医师 苏州大学附属第一医院 血液科1.6万人已读 - 精选 外周T细胞淋巴瘤治疗进展
一. 治疗PTCL-NOS是一组异质性较大的疾病,目前在全球范围内尚无统一的治疗原则,各研究组采用的化疗药物和剂量强度也不尽相同。但目前对该病治疗方面的共识是:PTCL-NOS属于侵袭性淋巴瘤,其生物学行为与B细胞淋巴瘤不同,往往表现为化疗敏感度低、病情迁延反复、易于复发、预后不佳。NCCN 2009指南建议:对于aaIPI属于低危或低中危的I~II期PTCL-NOS患者,采取6~8疗程的联合化疗,同时辅以受累野局部放疗(30-40Gy);对于aaIPI属于高中危或高危的I~II期或III~IV期PTCL-NOS患者,推荐接受6~8疗程联合化疗,不一定同时辅以受累野局部放疗;治疗结束后全面评估治疗效果,根据疗效的不同采取相应的措施(具体见图2)。对于复发难治的PTCL-NOS患者,若有条件行高剂量化疗,则可予二线方案(表8)治疗,待获得完全缓解后行高剂量化疗联合自体干细胞移植或异基因造血干细胞移植;若不能获得缓解,则仅给予支持治疗或姑息放疗。若患者不适宜接受高剂量治疗,则予推荐的二线方案(表8)治疗或姑息放疗。对于复发、耐药且拟行造血干细胞移植的PTCL-NOS患者可采用DHAP、ESHAP、ICE、MiniBEAM、MINE等方案作为二线治疗;而作为姑息治疗,则采用单药,如denileukin diftitox、吉西他滨、阿仑单抗治疗,或采用GDP方案等。Pellatt J等(26)对120例成熟T细胞淋巴瘤患者的回顾性研究显示:PTCL-U化疗后复发率为37%(13/35),相对于间变性大T细胞淋巴瘤(ALCL)患者60%的5年生存率,PTCL-U患者的5年生存率只有40%。这与一项世界性的淋巴瘤病理分类的研究结果相符。PTCL-U在治疗中多采用联合方案化疗,尽管有效率在40~70%,但多数患者缓解期很短。Zaja F(27)等对于23例接受CHOP或F-MACHP方案均获得不同程度的缓解,但中位无进展时间为10个月,总生存时间为24个月。(一) 化疗(1) CHOP或类CHOP方案在常规免疫分型还未被用于疾病诊断的WF分型诊断时期(19世纪80年代),大规模国际合作试验已经指出:对于弥漫大B细胞淋巴瘤(DLBCL)而言,CHOP方案与第二代、第三代强化疗方案相比疗效相当,但毒副作用相对较低(28)。正是鉴于CHOP方案对DLBCL的良好疗效,其才被广泛用于治疗PTCL。然而不幸的是,CHOP对PTCLs(除外ALK阳性的间变T细胞淋巴瘤,ALCL)的疗效很差,因此尽管CHOP或其变更方案(即所谓的类CHOP方案)被广泛用于PTCL患者的治疗,却并没有作为一个优先或者说是特别有效的方案那样被确定下来,目前关于PTCLs初治时采用CHOP方案与其它化疗方案疗效差异的研究报道亦极少。此外,一些证据显示蒽环类药物也许并不能改善PTCL的预后,尤其对于伴有1个以上不良因素的PTCL-NOS患者。ITLP对PTCL-NOS患者的研究发现:与以蒽环类药物为基础的联合化疗方案相比,两组总生存率无明显差异(图3)(29),提示我们类CHOP方案也许并不是PTCL的最佳化疗方案。(2) 其它新的联合化疗方案许多研究小组对于增加剂量或者加入其他药物的强化疗疗法的评价优于标准剂量的CHOP方案。来自M.D. Aderson肿瘤中心(30)的研究者们在一组经过挑选的患者身上比较了CHOP和其他一些更加强烈的方案的效果,这些方案包括:Hyper-CVAD (环磷酰胺, 美司钠、多柔比星, 长春新碱, 强的松, 甲氨喋呤、阿糖胞苷), 大剂量CHOP以及替代的三联疗法:ASHOP (多柔比星, 甲基强的松龙, 阿糖胞苷, 顺铂)、MBACOS (博莱霉素, 多柔比星, 环磷酰胺, 长春新碱, 甲基强的松龙, 甲氨喋呤)及MINE方案 (异环磷酰胺, 美斯钠,米托蒽醌,依托泊甙)。这些研究中大多数患者都是PTCL中最常见的三种亚型:PTCL-NOS、ALCL和AITL。选择CHOP方案和强烈化疗的两组患者之间3年总生存率无显著差异(分别为62% 和56%),两组之间的完全缓解率也相近(CHOP和强化治疗组分别是58%和59%)。对于高危患者倾向于选择更强烈的方法,而对于一些有利的患者(包括大多数ALCL),则倾向于选择CHOP方案。当把这部分ALCL患者从研究中去除,两组的治疗效果都要差一些,但仍然没有显著差异(CHOP和强化治疗组分别为62% 和56%)。为进一步研究此种方法,之前的研究小组试验性的改进了大剂量CVAD方案,在T细胞淋巴瘤患者使用HCVID(用盐酸脂质体阿霉素代替聚乙二醇阿霉素), 同时排除了ALK阳性的ALCL患者(31)。一项38例患者的初步研究结果显示很高的总体应答率,但完全缓解率与以前的方案相当。与传统的CHOP治疗方案在无进展生存率及总体生存率方面的比较还需要更长时间的后续研究。国际T细胞淋巴瘤临床与病理研究组发现:包含与不包含蒽环类药物的方案在治疗效果方面并无明显差异(32)。PTCL对蒽环类药物不敏感可能部分由于P糖蛋白的表达(33)。因此,加入对这种耐药机制不敏感的化学制剂和生物制剂或者非化学制剂是很有前景的一种设想。表8 NCCN 2009推荐的化疗方案 (按字母排序)一线治疗方案● 临床试验● CHOP (环磷酰胺、多柔比星、长春新碱、强的松)● EPOCH (依托泊甙、强的松、长春新碱、环磷酰胺、多柔比星)● 高剂量甲氨喋呤及高剂量阿糖胞苷改良的Hyper-CVAD(环磷酰胺、长春新碱、多柔比星、地塞米松) 一线巩固方案除aaIPI低危外,所有患者均需接受高剂量化疗及干细胞支持二线治疗方案(适合高剂量治疗的患者)● 临床试验● DHAP (地塞米松、顺铂、阿糖胞苷)● ESHAP (依托泊甙、甲基强的松龙、阿糖胞苷、顺铂)● GDP (吉西他滨、地塞米松、顺铂)● GemOx (吉西他滨、奥沙利铂)● ICE (异环磷酰胺、卡铂、依托泊甙)● miniBEAM(卡莫司汀、依托泊甙、阿糖胞苷、马法兰)● MINE (美司钠、异环磷酰胺、米托蒽醌、依托泊甙)二线治疗方案(不适合高剂量治疗的患者)● 临床试验● 抗CD52单克隆抗体● 硼替佐米● 地尼白介素● 吉西他滨● 放疗(二) 大剂量化疗联合自体造血干细胞移植(HDT-ASCT)PTCL患者接受CHOP方案诱导治疗后再选择使用大剂量化疗和自体干细胞抑制(HDT-ASCT)作为巩固治疗,此是从治疗高危和复发的DLBL中延伸出的方案,许多文献均有报道(见表9)。几个回顾性的研究提示这是一种有前途的治疗方案。西班牙GEL-TAMO研究在一疗程缓解的患者中采用这种治疗方案更是取得了良好的结果。此研究回顾性分析了115例多中心治疗的患者,共历时10年。5年总生存率(OS)和无病生存率(DFS)分别是56%和60%。患者主要病理类型是PTCL-NOS(62.6%),其次是ALCL(22%)。37例患者(32%)在第一次完全缓解期(CR1)行HDT-ASCT,5年OS和DFS分别是80%和79%,存活超过2年的患者无一例复发。上述研究中除了中位年龄是31岁外,CR1期患者没有其他良好的预后因素,其中73%的患者aaIPI评分为2-3。这项研究再次强调了CR是一个重要的良好预后指标,CR期患者接受HDT-ASCT治疗的5年OS和DFS分别是68%和63%。排除ALCL后,其5年PFS降至55%(34)。目前用于HDT-ASCT治疗前的诱导化疗方案有:ACVBP(多柔比星、环磷酰胺、长春地辛、博莱霉素、强的松);CEOP(环磷酰胺、表柔比星、长春新碱、强的松);ECVBP(表柔比星、环磷酰胺、长春地辛、博莱霉素、强的松);BEAM(卡莫司汀、表柔比星、马法兰);ESHAP(依托泊甙、甲强龙、阿糖胞苷、顺铂)等。考虑到PTCL患者很高的诱导失败率,在西班牙进行了一项前瞻性的研究(35)。41例PTCL患者计划在大剂量CHOP和ESHAP方案(VP16、甲强龙、Arac-C、顺铂)诱导后行HSCT。49%的患者为PTCL-NOS,29%为AITL。按IPI分组46%患者为中高危或高危,PIT分组结果与其相似(16)。17/41(41%)的患者疾病进展后进行移植,整个队列的4年PFS和OS分别为30%和39%。诱导有效的患者行HDT-ASCT的预后明显好于诱导失败的患者,其中59%的CR患者5年EFS超过4年。ALIT患者OS 为18%,低于PTCL-NOS的48%。但此结果明显差异于另一项大规模多中心的回顾性研究结果。该研究包括了146例AITL患者,均在CR期接受ASCT,4年OS和PFS达到59%和56%(36)。HDT-ASCT作为CR1期患者巩固治疗方案的潜在价值被几个研究进一步证实。在英国和澳大利亚登记处登记的82例患者中,64例接受了HDT-ASCT,其中约半数的患者处于CR1期。CR1期患者2年OS和PFS分别是62%和59%,均好于预期(37)。芬兰登记处在CR1和PR1期患者中取得了相似的研究结果(38)。CR1和PR1期接受HDT-ASCT的患者5年OS和PFS分别是63%和64%,而其它患者5年PFS仅为28%。包含ALCL患者使得解释这一结果存在困难。许多研究结果表明:大剂量化疗后是否处于缓解状态与行自体干细胞移植后的OS、EFS明显相关。北欧淋巴瘤协作组的一项大规模前瞻性研究发现:CR期患者行移植的OS和EFS分别为48%和47%,优于未获CR的患者,后者的OS和EFS分别为22%和11%。这种差异在PTCL-NOS患者中尤其突出,CR期的患者EFS为62%,而未获CR的患者EFS仅为10%(39)。 然而,并非所有在CR1期接受HDT-ASCT治疗的PTCL患者均获得了良好的预后,几个研究提示部分患者晚期复发的机会较大。HDT-ASCT治疗PTCL失败的主要原因是本病进展,而治疗相关并发症和死亡率相对较低。接受HDT-ASCT治疗的患者容易出现晚期复发,这提示我们需进一步观察HDT-ASCT能否象治疗套细胞淋巴瘤那样提高PFS、延缓复发。上述HDT-ASCT治疗PTCL的研究存在以下局限性:(1) 缺少ASCT作为巩固治疗的前瞻性研究,使选择偏差进一步加大;(2) 绝大多数有关该治疗策略的研究是单中心的、病例样本数小,不足以进一步分析PTCL各种亚型对预后的影响;(2)当独立分析PTCL各亚型时,只有伴t(2;5)易位的ALCL被认为预后相对良好(其预后相当于DLBCL)。对于其他亚型,大多数学者认为预后不良,但缺少进一步研究证实;(3)当除外ALCL后,许多中心HDT-ASCT治疗方案的OS和EFS会大打折扣。例如:目前最大的一项HDT-ASCT单中心研究,即多伦多大学关于HDT-ASCT治疗难治复发PTCL的研究结果显示:其3年OS和EFS分别为48%和37%;但当排除ALCL后,其3年EFS降至23%;(4)目前绝大多数评估HDT-ASCT疗效的研究多优先选择那些对大剂量化疗反应相对较好的病例(CR、CRu或PR者),在病例选择方面具有明显的倾向性。(三) 异基因干细胞移植 (Allo-HSCT)最近有报道提示异基因干细胞移植有可能是淋巴瘤的有效治疗方法之一。其治疗淋巴瘤的两个主要理论依据如下:1.与自体骨髓或外周血干细胞采集物中可能含有少量肿瘤细胞不同,异基因来源的干细胞中不含有肿瘤细胞,因而使移植后本病复发率大大降低;2.移植物抗淋巴瘤效应。因此,目前认为异基因移植是难治/复发恶性淋巴瘤的一种有效的挽救性治疗。尽管异基因移植治疗后的复发率低于自体干细胞移植,但其治疗相关死亡率(TRM)相对较高。Corradini等关于此报道了一项Ⅱ期临床试验,包括17例患者,其中大多数患者接受过ASCT(40)。其结果是喜人的,DFS和OS分别达64%和80%。多次复发的患者对供体淋巴细胞输注有效,提示存在移植物抗淋巴瘤效应。最初报道的TRM为6%;最新长期随访中的TRM为13%。尽管存在很高的毒副作用,法国一项大规模回顾行研究得出了类似的治疗结果(41)。此研究报道了77例PTCL患者(65例患者为ALCL、PTCL-NOS或者AITL),其中57例患者接受清髓性预处理。Allo-SCT的患者中只有35例移植时处于CR期。5年OS和EFS分别为57%和33%。然而,与意大利的研究结果不同的是,由于采用了清髓性的预处理,治疗相关毒性很高,1年TRM达32%。Steven等的一项回顾性分析发现:接受异基因移植治疗前患者所处的疾病状态(稳定、进展或难治等)已经是否发生III~IV度GVHD是影响患者总体生存率的主要因素。而HLA配型的相合程度则与治疗相关死亡率明显相关。Dhedin等分析了73例接受清髓性Auto-HSCT治疗的患者,其中16例为复发的T细胞淋巴瘤,57例为侵袭性B细胞淋巴瘤。结果显示5年OS和DFS分别为41%和40%。值得注意的是,上述病例中获CR后行移植的,其5年OS为76%,而未获CR的患者5年OS仅为44%。 Rodrignez等报道了7例接受清髓性Allo-HSCT的PTCL,其中4例死于治疗相关并发症。AT Peniket等分析了1185例接受Allo-HSCT治疗的淋巴瘤患者,也得出相似的结论。较清髓性Allo-HSCT而言,非清髓性Allo-HSCT能减少治疗相关死亡率。为评价其在PTCL治疗中的作用,PaoloCorradini等开展了一项Ⅱ期临床研究以评价减毒预处理方案(RIC)在PTCL治疗中的地位。17例患者均为耐药或复发,其中8例为自体干细胞移植后复发,采用的是含福达拉滨的非清髓性预处理方案。中位随访时间为28个月时,14例患者仍存活(12例CR、1例PR、1例SD);另有2例患者死于疾病进展;1例死于GVHD相关的败血症。3年OS和PFS分别是81%和64%。2例移植后出现病情进展的患者接受供体淋巴细胞输注(DLI)后获得了缓解。尽管上述研究的病例数有限,其结果提示RIC-Allo-HSCT在PTCL治疗中是可行、有效的。另一项多中心的研究采用含阿伦单抗(抗CD52单抗)的RIC方案治疗37例难治复发的恶性淋巴瘤患者,其结果显示:100天内的TRM为27%,3年复发率、PFS、OS分别为52%、34%和34%。该研究结果并未能证实RIC的优越性,这可能与患者处于本病复发的状态有关,可能需行HDT使本病缓解行RIC移植,以便使GVL效应得到充分发挥。另有学者提出,自体干细胞移植后再行非清髓Allo-HSCT有望减少TRM,而尽可能保留其GVL效应。但对于有HLA相合供体者的高危组恶性淋巴瘤(如骨髓侵犯、缓解时间短、化疗不敏感)患者可考虑直接行Allo-HSCT。尽管如此,异基因移植在PTCL-NOS等淋巴瘤治疗中的地位尚需要足够多的病例数来阐明。异基因移植临床研究病例数OS%(随访期限)EFS%(随访期限)TRM%(随访期限)Steven Le Gouill7757(5)53(5)33(5)Dhedin7342(5)40(5)Rodrignez757(四) 其它新的治疗方法迄今为止,PTCLs的治疗主要来源于对侵袭性B细胞淋巴瘤治疗方案的借鉴。研究结果表明,这些方案的疗效不尽如人意。因而,目前尚无针对初发以及复发/难治的PTCL的统一的、最佳治疗方案。对PTCL发病机制的深入研究已为新治疗方法的开发奠定了良好的基础,这些新疗法包括现有药物的新应用及研发T淋巴瘤特异性的新药,其中免疫治疗、抗代谢药物及组氨酸去乙酰化酶抑制剂的应用是三种最为突出的新疗法,已初步显示了令人鼓舞的疗效。其它可用于PTCL的新治疗还包括:蛋白酶体抑制剂、激酶抑制剂以及抗血管新生药物等。(1) 免疫治疗近年来,随着单克隆抗体研究的进步,Campath-1H(CD52单抗)、T101、90Y-T101(CD5单抗)、Anti-CD4、Anti-CD7/Ricin A及众多的CD25单抗被用于治疗T细胞淋巴瘤。但由于PTCL-U免疫组化表达的不确定性,目前针对PTCL-U的单克隆抗体治疗的临床研究数量有限。CD52是一种细胞表面糖蛋白,在包括T细胞、B细胞、自然杀伤细胞在内的几乎所有淋巴细胞以及单核细胞、精子细胞表面都有表达。阿仑单抗(Alemtuzumab)是一种人源化的抗CD52单克隆抗体,对CD52表达阳性的细胞具有强大的杀伤作用。其对淋巴系统肿瘤的疗效最先在B细胞性慢性淋巴细胞白血病(B-CLL)中得到证实,此后有报道显示其在CTCL及T细胞性白血病中的总体应答率约为55-75%,该单抗对PTCL亦有活性(42)。基于抗CD20单克隆抗体-美罗华联合CHOP方案能够明显提高弥漫大B细胞淋巴瘤(DLBL)的疗效,在这一模式的基础上,阿仑单抗联合CHOP方案最近正用于PTCL患者的治疗,并显示出明显的疗效。然而与美罗华不同的是,阿仑单抗具有广泛的免疫抑制作用和3-4级的感染风险。Enblad G等报道了应用阿仑单抗(CD52单克隆抗体)治疗14例III、IV期PTCL-U患者的研究(阿仑单抗3mg,d1,10mg d3,然后20mg 3/周,最多接受12周的治疗)(42)。在全部14例患者中,接受治疗的中位疗程是6周(3~12周),仅1例患者接受了12周的治疗。该项研究中,3例CR,缓解期分别为2个月、6个月、12个月;2例PR,4例SD,5例PD。在Gallamini A等报道的临床研究中,18例初治患者接受了CHOP+阿仑单抗治疗,其中11例获得CR(43)。GITIL研究小组(43)在一项多中心的前瞻性临床试验中,采用阿仑单抗联合CHOP方案治疗新诊断的PTCL患者。这些患者并不都是CD52表达阳性的。此研究包含了24例连续的病例。其中19例患者有组织学证据:PTCL-NOS 8例、AITL 7例、ALK阴性的ALCL 3例、肠病相关的T细胞淋巴瘤(EATCL)1例。根据DLBL的IPI评分进行评估,24例患者中只有9例具有3或4个危险因素。方案的安全性在4例患者的治疗中得到初步证实后,剩余的20例患者接受了8个疗程的CHOP+阿仑单抗(每个疗程的第一天静脉应用阿仑单抗30mg)治疗。24例患者中17例(71%)获得完全缓解(CRs)。接下来平均为期16个月的随访中,24例患者中13例(54%)达到无病生存及预期的2年总生存率,其无治疗失败生存率分别为53%,其余患者的无治疗失败生存率为48%。 4例CD52阴性的患者2例在治疗过程中疾病出现进展。阿仑单抗加入细胞毒性化疗方案中后,免疫抑制成为一个值得关注的问题,淋巴细胞减少及中性粒细胞减少是最常见的治疗不良反应,即便进行预防也很难避免发生严重的感染。最多见的感染包括多瘤病毒的再激活、曲霉菌、葡萄球菌败血症、肺炎及巨细胞病毒的再激活。此项研究中患者达到的完全缓解率是令人鼓舞的,但在另外一组相对比较有利的PTCL患者中,其长期总体生存率及无事件生存率并不比传统的CHOP方案优越。另一项阿仑单抗联合CHOP方案的研究尽管显示了80%的总体应答率,但由于明显的感染发生率及血液学毒性,其中包括2例治疗相关的死亡,不得不在研究初期就终止(44)。NCI的一项正在开展的研究用阿仑单抗联合调整剂量后的EPOCH方案治疗CD52阳性的PTCL患者,这项研究的早期结果显示了一个很高的治疗应答率。但随这种治疗方法治疗作用的增加,其免疫抑制作用也呈现出来,进而出现了一些罕见或者机会性的感染,如曲霉菌、毛霉菌、BK病毒感染等。再者,所有患者都出现了4级中性粒细胞减少症,当阿仑单抗的剂量加大时,还出现了骨髓造血功能障碍(45)。因此,需慎重平衡阿仑单抗在治疗过程中的安全性和毒性。此外,由于PTCL患者CD52表达的异质性,治疗方案中是否需要加用阿仑单抗也是一个需要慎重考虑的问题。与B系淋巴瘤细胞几乎都表达CD52不同,只有35-40%的PTCL-NOS患者CD52表达阳性(8)。因此,如上面所提到的,在GITIL的试验中,4例CD52表达阴性的患者中2例在治疗过程中出现疾病进展。其他一些研究小组也发现在T细胞淋巴瘤中存在CD52表达的异质性,这一变异性归因于检测CD52表达的方法的不同。免疫组织化学方法检测不到低水平的CD52表达,而流式细胞术是一种比较可靠的检测CD52表达的方法。随着阿仑单抗联合常规或者大剂量化疗药物的大规模前瞻性临床试验在欧洲的展开,关于目的基因的表达及治疗毒性等问题还需要进一步被证实。除了阿仑单抗,还有几种新的单克隆抗体在治疗PTCL时表现出一定的活性,如靶向作用于CD2、CD4及CCR4的单克隆抗体。Zanolimumab是一种抗人CD4单抗,目前还处于临床研究阶段,可作用于正常T细胞及绝大多数PTCL细胞表面的CD4抗原。该药治疗难治复发PTCL的Ⅱ期临床试验目前正在进行中。该临床研究已得出以下初步的结果:24例PTCL患者总反应率为24%,没有发生严重感染(46)。另一项试验中采用 Zanolimumab治疗21例CD4阳性复发/难治PTCL患者,其中2例患者获得完全应答、3例患者获得部分应答。而一项关于CHOP联合Zanolimumab治疗PTCL的试验也正在进行中。Siplizumab是一种抗人CD2单抗,目前也正处于临床研究阶段(47)。一项有关Siplizumab治疗CD2阳性的T细胞性白血病及淋巴瘤的Ⅰ期临床试验的初步结果显示:9例PTCL患者中1例获得完全应答。趋化因子受体4(CCR4)是另一个具有潜在治疗靶点价值的T细胞表面标记物,约88%的成人T细胞白血病/淋巴瘤患者及约38%的PTCL患者可检测到CCR4表达,其表达同PTCL的不良预后相关(17)。目前,抗人CCR4单抗(KW-0761)治疗成人T细胞白血病/淋巴瘤及PTCL已进入早期临床研究阶段。白细胞介素2受体(IL-2R)是T细胞分化的标志之一,人IL-2R以3种形式存在:低亲和力(CD25)、中等度亲和力(CD122/CD132)及高亲和力(CD25/CD122/CD132)。IL-2R的CD25亚单位表达于皮肤T细胞淋巴瘤、PTCL-U和CD30阳性的ALCL等特殊类型的白血病及淋巴瘤(2)。地尼白介素(denileukin diftitox, Ontak)是一种 IL-2和白喉毒素的融合蛋白,靶向作用于T细胞表面具有中度或高度亲和力的IL-2受体,临床多用于皮肤型CTCL的治疗。一项Ⅱ期临床试验将地尼白介素单药用于复发PTCL的治疗,结果发现总反应率为48%,其中部分CD25(即高亲和力IL-2受体)阴性的患者对治疗也有反应。一项以CHOP联合地尼白介素作为PTCL初始诱导治疗方案的Ⅱ期临床试验正在进行中,其初步结果显示:在31例可评价的患者中,22例患者获完全临床反应,6例患者获部分反应,中位反应时间为13个月。另一项正在进行的Ⅱ期临床试验的初步结果显示,CHOP联合地尼白介素-2对之前未接受过治疗的PTCL患者具有临床疗效,其总体应答率为90%(48)。该方案与CHOP相比,并不增加治疗相关的毒性。尽管地尼白介素在PTCL治疗中显示了一定的疗效,但其显著的毒副作用引起了人们得重视,其常见不良反应包括超敏反应、周围性水肿、白蛋白减少等。另一种单克隆抗体daclizumab(抗-Tac)能特异性识别IL-2R的α亚单位,后者在正常细胞表达极低,而在异常T细胞或T细胞白血病/淋巴瘤中有一定程度表达。目前有关daclizumab、耦联有抗Tac重组免疫毒素的daclizumab(含破坏的假外毒素)、90钇标记的抗Tac的单抗对PTCL的疗效已进入临床研究(2)。约30%的PTCL-NOS患者表达CD30,目前有几种抗CD30单克隆抗体亦已用于PTCL的治疗:如MDX-060(人源化抗CD30单抗)(49)、SGN-30(嵌合性抗CD30抗体)(50)等。两者在ALCL中都表现出一定的活性及很好的耐受性、治疗相关毒性小,但其在PTCL-NOS中的作用尚待进一步研究证实。(2) 抗代谢药物吉西他滨(gemcitabin)是一种毒性较低的嘧啶类似物,对各种实体瘤有效,最近有研究发现其对淋巴系来源的血液肿瘤亦具有活性。吉西他滨的作用机制主要是通过与天然胞嘧啶竞争,从而抑制DNA的合成及核糖核苷酸还原酶的作用(2)。一项有关吉西他滨单药治疗复发/难治性PTCL的研究结果发现:总反应率(OR)为60-69%,完全反应率(CR)为8-20%。由于多项研究发现吉西他滨单药在T细胞淋巴瘤中具有高度活性,许多研究小组开发了以吉西他滨为基础的联合治疗方案方案。Arkenau HT等采用GEM-P方案(吉西他滨,顺铂,甲基强的松龙)治疗16例已接受过其它方案治疗PTCL,11例有效,总反应率为69%(51)。在一组含有10例PTCL患者的研究中,吉西他滨联合长春瑞滨及非格司亭显现了高达70%的总应答率(52)。在一项大系列、复发的异质性群体霍奇金病和非霍奇金淋巴瘤的研究中,该方案的总有效率为53%。一项包含有26例PTCL患者的研究表明,更强烈的方案CHOP-EG(环磷酰胺、阿霉素、长春新碱、强的松、足叶乙甙和吉西他滨)用于PTCL患者的一线治疗是可行的。接下来平均1年的随访中,77%的患者仍存活;然而,其平均无事件生存期(EFS)仅7月,这表明大部分患者并未获得持续缓解(53)。为了正式验证这些治疗策略,西南肿瘤研究中心在一组进行一项成熟T细胞淋巴瘤的II期临床试验中展开了一项新的一线方案的研究,即PEGS(顺铂,足叶乙甙,吉西他滨和甲基强的松龙制剂)。在英国的一项临床研究中,16例患者接受了吉西他滨+顺铂+甲强龙的治疗,CR3例,PR8例。喷司他丁、福达拉滨、克拉曲滨等嘌呤类似物可以和天然的嘌呤核苷酸竞争抑制DNA的合成与修复,从而抑制DNA的合成。此类药物对PTCL亦具有一定疗效。一项研究以喷司他丁单药治疗5例复发/难治PTCL患者,结果4例有效。此外,新的嘌呤类似物奈拉滨(Nelarabine)和Forodesine与嘌呤核苷酸磷酸化酶之间存在相互作用,因而对T细胞具有更高的选择性。奈拉滨主要用于T细胞性急性淋巴细胞性白血病的治疗,但肿瘤和白血病研究组B小组(CALBG)进行的一项该药治疗PTCL的临床试验中并没有发现该药具有明显疗效。尽管有报道显示Forodesine在CTCL治疗中取得了令人满意的结果,有关其对PTCL治疗的研究尚在进行中。脱氧胍嘧啶类似物506U78是阿糖胞苷G(Ara-G)的一种前体药物,曾作为单药用于PTCL的治疗,因总反应率低(仅10.5%),且具有较强的神经毒性及较高的早期治疗相关死亡率,故未得到进一步的开发。Pralatrexate是一种新的叶酸拮抗剂,与RFC-1有很强的亲和力,可增加酪氨酸多聚化,从而增加细胞的药物摄取率并延长药物在肿瘤细胞中的作用时间,从而提高肿瘤细胞内的药物浓度。Pralatrexate在一项Ⅰ-Ⅱ期临床试验中显示了一定疗效,该项研究中4例PTCL患者获得CR(54)。随后的研究进一步将Pralatrexate应用于24例复发/难治PTCL患者,50%的患者对治疗有反应,16例可评估的患者中有9例获得CR(55)。总体上,患者可以很好的耐受Pralatrexate的毒副作用。其剂量限制的毒性包括血小板减少和口腔炎,大部分口腔炎都可以通过补充叶酸和维生素B12得到缓解。另一个多中心的关于Pralatrexate治疗复发/难治PTCL的多中心临床Ⅱ试验刚刚登记完成,该试验纳入了100余例患者,如果该试验研究结果能够验证以前的试验结果,Pralatrexate有望成为FDA批准的第一个用于特异性治疗PTCL的药物。考虑到临床前研究发现Pralatrexate和吉西他滨具有体外协同作用,已有Ⅰ期临床试验联合使用Pralatrexate和吉西他滨。(3) 组蛋白去乙酰化酶抑制剂乙酰化的增加影响着多种基因的表达,去乙酰化酶调节核小体组蛋白和其他蛋白的乙酰化作用,而组蛋白去乙酰化抑制剂(HDACi)能抑制该酶的活性,进而调节靶基因的表达。除了组蛋白以外,HDACi还对细胞内许多其他物质具有广泛的脱乙酰基作用,这些物质包括转录因子、分子伴侣、细胞骨架蛋白等。研究表明:包括PTCL在内的多种恶性肿瘤都存在生长调节相关基因启动子区的异常组蛋白去乙酰基作用。因此,HDACi有望成为一类具有应用前景的治疗PTCL的新药。因HDACs类型多样,且每个类别中都含有多个家族成员,HDACi亦有不同类型,通常根据其活性及毒性作用范围对HDACi进行分类。Vorinostat (suberoylanilide hydroxamic acid),是FDA批准的第一个用于肿瘤治疗的HDACi药物,在复发/难治的CTCL患者中具有约30%总反应率,其最常见的毒副作用为胃肠道不良反应及血小板减少,该药对PTCL的疗效尚待进一步评估(56)。Romodepsin(depsipeptide),也是一种HDACi,最先在针对CTCL的临床Ⅰ期试验中显示出一定的疗效;NCI的Ⅰ期临床试验发现,Depsipeptide对PTCL具有一定疗效,随后的Ⅱ期临床研究将Depsipeptide用于治疗复发/难治的PTCL患者,结果发现总应答率为28%;一项Depsipeptide治疗CTCL的前瞻性多中心临床Ⅱ期试验目前已完成登记,而另一项Depsipeptide治疗PTCL的国际性多中心临床试验也正在登记注册之中。此外,另一种HDACi-Belinostat(PXD101)目前也已进入对CTCL及PTCL的临床研究阶段,其中一项正在进行的Ⅱ期临床试验初步结果表明:经Belinostat治疗的11例PTCL患者中,2例获得了完全反应(CR)、5例疾病无进展。值得引起注意的是,HDACi可引起QT间期延长,具有潜在的心脏毒性,但就目前已公布的临床试验的结果而言,该不良反应的发生率不到5%。而选择性HDAC抑制剂目前尚处于研发之中。(4) 蛋白酶体抑制剂蛋白酶体抑制剂,特别是硼替佐米(Bortezomib)在多种类型肿瘤中具有明确的抗肿瘤效应。硼替佐米具有抑制肿瘤细胞(包括髓系及淋巴系肿瘤细胞)增殖和/或促进肿瘤细胞凋亡的作用,这些作用可能是通过抑制NF-κB途径实现的,而PTCL-NOS中存在NF-κB信号通路相关多种基因失调,故近年来有研究将其用于PTCL-NOS的治疗。最近一项研究将硼替佐米用于复发或难治性PTCL-NOS的治疗,但目前仅10例患者入组,尚未得出最终结论(2)。(5) 其它激酶抑制剂激酶抑制剂已经用于淋巴瘤靶向治疗的研究,其中正在进行中的多个临床试验都纳入了PTCL患者。蛋白激酶C(PKC)、磷脂酰肌醇3蛋白激酶(PI3K)、AKT、mTOR、细胞周期素依赖性蛋白激酶(CDK)、Aurora激酶以及各种酪氨酸蛋白激酶的抑制剂目前正处于早期临床试验之中。SYK是一种酪氨酸蛋白激酶受体,表达于约94%的PTCL,且与t(5;9)染色体易位阳性的PTCL-NOS相关,故SYK有望成为一个特别有效的治疗靶点(6)。UCN-01(hydroxystaurosporine)是一种蛋白激酶C和周期素依赖性蛋白激酶的抑制剂,同时也可以抑制ALK,目前正处对ALCL临床治疗试验之中。(6) 抗血管新生药物研究表明,由VEGF及其它生长调节因子介导的血管新生与淋巴系统肿瘤发病相关,例如:VEGF-A高表达于AITL患者的淋巴瘤细胞及内皮细胞,且部分AITL患者对沙利度安治疗有反应。人源化的抗VEGF单克隆抗体-贝伐单抗也已用于AITL的治疗(57)。ECOG一项正在进行的临床试验初步结果表明:贝伐单抗、美罗华联合CHOP方案治疗B细胞淋巴瘤具有一定疗效、耐受性及安全性好(58)。尽管如此,沙利度安、贝伐单抗等抗血管新生药物及其与化疗的联合应用对PTCL-NOS的疗效尚未得到肯定的结论。小结及展望:PTCL-NOS是一组由多种不常见的临床病理综合征组成的疾病,其在形态学、免疫表型、细胞和分子遗传学及基因表达谱等方面无特异性,是一种排他性的诊断。PTCL-NOS预后较差,生存期短,不如侵袭性的B细胞淋巴瘤。多数情况下CHOP方案的疗效并不令人满意,迫切需要针对PTCL-NOS的特异性治疗方案。值得庆幸的是,多数医生和患者已逐渐意识到PTCL-NOS的治疗存在独特的挑战性,只有通过精心设计的临床试验,如新的联合化疗方案、HDT-ASCT、新的药物等,才能对这些新的临床方案或新的药物有更深入的了解,最终摆脱CHOP作为一线治疗方案的局限性,使PTCL-NOS患者的预后得到改善。
仇惠英 主任医师 苏州大学附属第一医院 血液科1.1万人已读 - 诊后必读 苏州白血病患者之家系列教育五—移植后免疫抑制剂的调节
只要供体不是自己的,别人的都是异体移植,异体移植都涉及到排异问题,也就是GVHD,移植后供体细胞一旦在患者体内植入(大概进仓移植后12天左右)就要面临排异问题,排异有大有小,在三个月内发生的是急性排异,三个月后发生的为慢性排异,但是也有三个月后发生急性排异的。 急性排异反应有皮肤的,表现为大量的皮疹,皮肤瘙痒;肝脏排异表现为黄胆,肝酶升高;肠道排异:腹泻、呕吐、严重的有便血,严重的肠道排异不容易控制,有遗憾而离开的。慢性排异从头到脚都可以出现,头皮屑多、眼睛红、干、口唇脱皮、口腔溃疡、皮肤粗糙、脱皮、毛发稀少、变白、指甲凹陷、指甲不长、关节僵硬疼痛、四肢肌肉变紧、僵硬、生殖器溃疡、肺部排异气短等等。 移植后免疫抑制剂的调节非常重要,免疫抑制剂包括(环孢菌素或者普乐可复、骁悉、激素、芦可替尼等),这些药物患者不能自行减量或者随意停用,我一直开玩笑说,减停免疫抑制剂,就好比飞机降落一样,要平稳着落,否则急停容易飞机坠毁起火,也有一些患者免疫抑制剂是停不了的,有慢性排异的患者必须坚持少量的服用,停用后会出现排异的加重,或者慢性排异转急性排异反应,再控制会很难,影响生活质量,有的会终生存在,所以不是所有的病人能全部停用,是病人不能追求完美,有一些病人就想全部恢复正常,最好什么药都不吃,但是由于排异反应存在,不可能不吃,越停越严重。排异是供体和受体之间的磨合过程,有的磨合的快,有的磨合的慢。 患者在住院期间有医生监护,出院后要定期门诊随访,一般刚从疗养院出来的一周复查一次,三个月后二周一次,六个月后一个月一次,有病情变化的要随时就诊,如果发现皮疹和腹泻等必须随时与医生联系,不能拖延的,需要及时处理,急性排异好比山上树林起火一样,不及时破灭就变成森林大火,无法控制。患者出现情况可以去门诊就诊、微信、好大夫网站联系或者直接去出院的疗养院再住院,刚移植后早期反复住院很常见的,好比一项工程做完了,还需要修修补补。 总之,为了提高移植成功率,是一个长期的系统工程,需要患者和医生之间长期合作,操之过急容易失败。所以移植成功,并不是出仓了,就成功了,后面还是路漫漫....
仇惠英 主任医师 苏州大学附属第一医院 血液科78人已购买 - 诊后必读 苏州白血病患者之家系列教育四—-预防新冠病毒有感而发,谈白血病患者移植前后长期的呼吸道感染的防护
2020年春节期间新冠病毒大流行,武汉死亡病例数千,特别是有一些知名人士的死亡,家庭多人和医生、护士死亡对大家的感触非常深刻,每人心理多多少少有一些恐惧情绪。 政府采取了强有力的措施:封城、关闭公共场所、追踪感染者的活动轨迹,隔离(居家、集体隔离方舱医院、机场附近酒店隔离),宣传可能被感染的途径,延迟企业和学校的复工,个人防护, 几乎是全民佩戴口罩,减少外出,非常有效的遏制病毒蔓延。 这次全民参与的防新冠病毒感染的措施,有个意外的惊喜发现,今年移植后病人的感染也少了很多,几乎没有,往年一到冬天,年年有不少患者会感染流感病毒,也有因此住院和死亡的,作为移植后医生也是头疼的事情,不停接到电话说发热了,感染了,要床位了,呼吸困难要抢救了,呼吸科、ICU要联系床位,经常没有床位,抢救床位更加一床难求,每年都有少数移植后成功的患者因流感而死亡。特别是移植后早期患者,曾经有一例移植后4年在市场做生意的患者因呼吸道感染,上呼吸机抢救失败,非常遗憾离开了,对医生来说也是非常可惜的,所有的努力付之东流。 今年过年非常太平,没有接到病人和家属求救电话,预防新冠的措施同时有效的预防了呼吸道各种感染,说明这些措施是非常有效的,新冠病毒遏制了,但是我们的病人依然免疫功能低下,移植后原来具有的对以往已知的病毒所产生的免疫,移植过程受到了摧毁,而且重建免疫功能是个漫长的过程,以年计算,移植后二年,成功停用免疫抑制剂的,免疫功能恢复的程度在百分之七十左右,而那些有慢性排异,无法停药的,恢复免疫功能更加漫长。依然容易感染细菌、真菌、病毒,对于病毒来说,即使新冠没有了,还有流感病毒,甲流、乙流,每年这些病毒也是肆虐猖狂。 呼吸道感染性疾病,特别是流感,冬季好发,容易传染,以往认为患者自己佩戴好口罩就可以了,另外有时建议病人冬天去热带地方,现在看来与患者密切接触的家属的预防也是非常重要,家属也要做到与其他人群的隔离,勤洗手,尽量不要去公共场所,比如:菜场、商场、医院、公共场合,外出要佩带口罩,少乘电梯,少聚餐和不坐公共交通工具。一旦家属有呼吸道感染,当务之急与患者隔离,避免传染。移植后的学生尽量在家上网课自学,去学校集体场所非常容易被传播到病毒。希望大家好好珍惜来之不易的生命的延续,在家安心等待免疫功能的恢复。不要急于工作和上学,最好不要与小朋友生活在一起(幼儿园、学校很容易被传染到病毒,出现流感),家属做好防护常带口罩,常洗手,减少把病毒从外面带回来的可能。移植经历了艰苦的历程,不要因为小小的流感断送生命,希望大家好好保护自己,活着,一切都会有。
仇惠英 主任医师 苏州大学附属第一医院 血液科4133人已读 - 医学科普 苏州白血病患者之家系列教育三:有关HLA配型的时机和供体的选择
有关HLA配型的时机和供体的选择 1:为什么要配型? 急性白血病也就是血癌,联合化疗百分之七十的患者可以达到完全缓解,缓解之后需要联合巩固治疗,少数患者在反复巩固化疗后不复发,大部份患者在化疗期间或者停用化疗后会复发,特别是中高危组患者复发率高,为了彻底根除白血病,最佳治疗方式采取骨髓移植手术,也就是异基因移植治疗,为减少GVHD也就是排异反应,必须行HLA配型(HLA配型与血型没有关系),即HLA相关组织相容性检测。 2:什么时候配型? 初始发病患者,首先要行联合化疗,化疗前血液中含大量白血病细胞,可能因恶性细胞突变影响检测结果,因此初发的时候不建议立刻做配型,联合化疗后,白细胞急剧下降,血像非常低的时候细胞数太低,抽提的DNA太少也不适合配型,所以一般在化疗结束2-3周,血像回升后行HLA配型,初治患者通常在住院三周到四周准备出院前配型,也可以在下次住院巩固化疗前配型(周一至周五工作日期间),配型结果二周出报告。 3:供体在外地怎么办?我们会碰到一些患者的亲戚在外地工作,或者出差了,或者在读书,或者是患者来自遥远的边缘地区,一时半会没有空过来,路上旅途费成本高,这个时候供体不一定亲自来苏州,可以抽血快递到苏大附一院的配型实验室,抽血的要求是血常规管子(紫色的,EDTA抗凝),每管抽2毫升血,必须清楚注明供体姓名,身份证号码,抽血管子也可以由家属带到苏州,气温不高的秋冬季节常温保存,放一个小盒子里,夏天气温太高的情况下,建议放保温杯或者泡沫盒里,用毛巾包好,里面放一个冰好的矿泉水。 4:配上的概率问题 一般父母和子女都是半相合,但是我们也碰到少数父母与子女之间全相合的情况,这种情况的发生率很少。兄弟姐妹同胞之间有全相合、半相合、不合的可能,如果父母年龄大,没有子女或者子女太小的,表兄妹和唐兄妹之间也可以配型,或者舅舅、叔叔、姨妈也可以来配型,但一定要有血缘关系亲属。 5:无关供体的寻找 配型二周出报告,自己的HLA配型结果出来后,可以到中华骨髓库登记,我院在11号楼一楼常老师处登记,登记后需要经常去跟踪是否有配上的情况,一般一周去询问一次,低配相合的,需要进一步做高分辨配型,如果有配上的,接下来行供体的体检,无关配型前后一般需要2-3个月时间。 6:供体的选择原则 供体年纪轻的比年纪大的好,男性比女性好,所以原则上选择年轻的男性供体,但是在没有的情况下,年纪大的,身体健康的父母也可以选择,一般供体不超过70岁。有全相合的选择全合的,现在移植技术的提高,另外由于独生子女政策的影响,越来越多的患者百分之六十以上采用半相合移植治疗。 最后祝每位患者都能找到合适的供体!
 仇惠英 主任医师 苏州大学附属第一医院 血液科5181人已读
仇惠英 主任医师 苏州大学附属第一医院 血液科5181人已读 - 医学科普 苏州白血病患者之家系列教育二血型问题
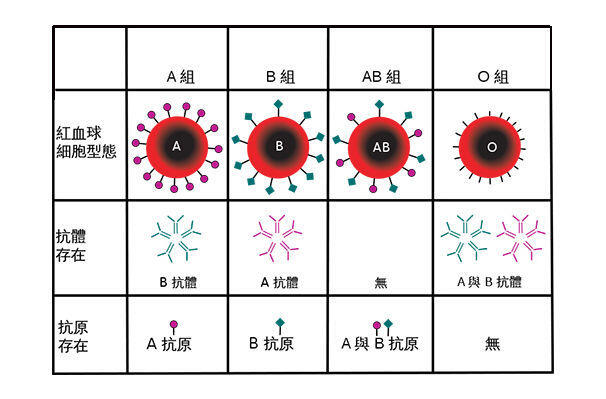
有关血型问题,血型一般常分A、B、AB和O四种,另外还有RH、MNS、P等极为稀少的10余种血型系统。 其中,AB型可以接受任何血型的血液输入,因此被称作万能受血者,O型可以输出给任何血型的人体内,因此被称作万能供血者。 血型A型阳性(+)表示这个人的血型是A型血,以及是Rh阳性(+)血型(这是和ABO血型是一样的,是另外一种血型分型,中国人大部分是Rh阳性血,RH阴性血的也就是常说的熊猫血)。 移植前我们通常输注相同血型的血,比如A型Rh阳性的输给A型Rh阳性患者,移植过程中存在供体和受体血型不一样的情况,所以移植后会改变输血的类型,比如A供B,属于大不合,会输注O型红细胞和AB型血小板,所以家属要理解怎么移植前后输的血型不同。患者家属及亲朋好友无偿献血的,在化疗期间无偿献血与患者同血型的红细胞和血小板,无偿献血的时机:患者的血红蛋白在70以下、血小板在50以下要准备起来。移植期间如果供体和受体血型不同,无偿献血不同血型的红细胞和血小板,什么血型的可以具体咨询床位医生,O型红细胞和AB型血小板任何血型患者均可以输注。 移植后少数患者因为血型不同,出现溶血现象,另外少数患者会出现红细胞延迟植入纯红再障。 血小板输注后大部分患者血小板会上升,但是,少数病人存在血小板输注无效现象,特别是反复输注以后体内出现抗血小板抗体,导致输血小板无效。这类患者临床上处理麻烦,有出血风险甚至于危及生命。 移植后红细胞血型会转变,开始存在混合现象,一般三个月后逐步转变成供体的血型。
 仇惠英 主任医师 苏州大学附属第一医院 血液科3713人已读
仇惠英 主任医师 苏州大学附属第一医院 血液科3713人已读 - 医学科普 白血病患者冬天如何预防呼吸道感染
冬天如何预防呼吸道感染 上感是人类最常见的传染病之一,都发生于冬春季节,一般为散发,有时候在气候突变的时候,可以有小规模的流行病毒,主要通过患者喷嚏和含有病毒的飞沫,空气传播或者经污染的手和用具接触传播,可引起上感的病原体大多数是自然界中广泛存在的各种类型的病毒,同时健康人群也可以携带,机体对其感染后产生的免疫力弱而短暂,病毒之间没有交叉免疫,所以上感可以反复发病。 呼吸道感染在临床和生活中是最常遇到的一种感染,主要分为上呼吸道感染和下呼吸道感染,上呼吸道感染就是平时说的感冒,主要表现为鼻塞、流涕、咽痛,大多是由于病毒感染引起来的,在早期的时候,可以吃一些抗病毒的药物后期容易合并细菌感染,如果合并细菌感染,就要吃一些抗生素。而下呼吸道感染,往往是一些肺炎或者支气管炎,这些感染大多数是细菌感染,但是也有病毒感染,病毒性肺炎,同时也有混合感染,轻的口服一些抗病毒药物和抗生素,严重的需要住院治疗,一些免疫功能低下的,还会合并真菌感染,如果合并真菌感染,就是要抗真菌药物的治疗。 冬天如何预防呼吸道感染我们要做到以下几点1.注意手卫生,经常洗手,要用肥皂水或洗手液洗手,洗手六步骤。 2.注意保暖,一般情况下,在温暖的地方跟平时穿衣一样,白血病患者适当比正常人多穿点,不出汗为宜,建议舒适透气柔软的衣服,到户外就要添加一件外套,我们经常看到冬天患者到诊室全副武装,满头大汗,这个也是不恰当的,风一吹的话,也会着凉。到室内外衣脱掉,建议随身再携带一件薄外套,到室内脱掉厚的改成薄外套。3.要注意隔离,白血病患者化疗或者移植后免疫功能低下,病人尽量不要跟太多的亲戚朋友聚会,不要去公共场所,要去的话戴医用外科口罩,市面上布口罩和海绵口罩不起作用,而且口罩要勤换,建议去正规药店购买。4.要注意多喝温水。5.注意室内空气流通通风,1天内至少早晚通风二次,室内放空气净化器可以减少感染。6.保持室内温度,特别是洗澡的时候当心着凉。一定要在浴室温度到20度以上后洗澡,洗完及时毛巾擦拭,吹干头发。怕感冒的可以擦拭身体减少洗澡。7.注意隔离,感冒具有非常强的空气传播传染性,如果家属有感冒的,一定要远离,换其他家属陪护。8.如果出现感冒的话,要及时服药,多喝水,可以服用抗病毒药,比如柴胡冲剂,板蓝根,中重度的服用奥司他韦,奥司他韦感冒高发季节经常缺货,建议提前家里备好。 有的患者回到当地,需要到医院复诊检查,又碰到极端气候的情况下,为减少路途户外感染可能,可以有家属代诊,家属到门诊开具检查项目,然后到门诊二楼血液科专科检查窗口,领取各种抽血管子,回到当地医院抽血,然后由家属送到苏州检查化验,等化验结果出来后,家属再到门诊代诊,病人的情况可以通过文字、拍照、视频描述给医生,减少路途中感染的机会和车马劳顿辛苦,最好患者移植后在医院附近住半年左右,有利于复诊维护。 不要小看小小的感冒,我们曾经碰到不少因流感肺炎而离开的患者,特别是甲流感染(非典),禁忌冬天骑电动车摩托车吹风,禁忌早晚风大,没有太阳的时候出门,冬天多穿衣服或者室内暖气取暖,避免着凉,最后祝大家早日康复!
 仇惠英 主任医师 苏州大学附属第一医院 血液科8426人已读
仇惠英 主任医师 苏州大学附属第一医院 血液科8426人已读 - 就诊指南 慢粒患者的生育问题
随着靶向药物的应用,长期生存的患者增加,对于年轻患者,特别是没有生育的,是否可以怀孕生育,成为大家关注的重要问题. 什么时候可以生育?有计划性的受孕:建议用靶向药物三年后,定量PCR检测bcr-abl达到完全分子生物学的缓解二年,准备生育前停药,但是在停药后每周查血常规,每个月查基因定量
仇惠英 主任医师 苏州大学附属第一医院 血液科1614人已读 - 引用 服用TKI慢粒患者能升级做父母吗?
随着靶向药物酪氨酸激酶抑制剂(以下简称TKI)的普遍应用,服用TKI药物的慢粒患者生存期接近健康同龄人,生活质量也显著提高,家庭的完整性是其中不可忽略的一部分。很多年轻的慢粒患者都会面对这样一个问题:“吃着TKI药物,还能拥有健康的孩子吗?下面我们来解答服药期间的生育问题。男性患者可以正常当爸爸服用TKI药物期间,极少数男性的精子数量和活性会减少,但是生育能力不会下降。成年男性慢粒患者可以正常生育,胎儿的畸形率与普通人相比没有提高。服用TKI的男性患者,不需要因为生育需求而停药。如果患者担心服药后精子数量减少影响受孕,可以在服药前将精子冷冻起来,为以后的生育做准备。女性患者服药期间怀孕了怎么办?相对来说,女性患者的生育限制就要多很多。首先,医生会建议服用TKI药物的女性患者避孕。因为调查显示,孕期服用TKI药物,可以增加流产的风险和胎儿畸形的发生,畸胎的概率接近10%,显著高于正常人。尤其是在怀孕前三个月,服用TKI药物的危险特别大。服药期间怀孕,应考虑到TKI药物对胎儿的毒性。如果发现怀孕时已经服药了,需要权衡药物对胎儿的影响,以及停药对妈妈疾病的影响,咨询有经验的医生,再决定胎儿的去留。正常生育后的患者需尽快开始服药,避免母乳喂养。因为药物会进入乳汁,对胎儿造成影响。本文系江倩医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载
江倩 主任医师 北京大学人民医院 血液病研究所1.2万人已读 - 经典问答 化疗几率有多高
苏州大学附属第一医院血液内科仇惠英回复:如果想根除最好移植治疗,化疗可以缓解,但是大部分患者会复发的,移植最好用全相合的同胞供体,其次全相合的无关供体,实在找不到全合的再考虑半相合的亲属或者脐带血干细胞,费用要看并发症的,全相合的费用低一些 患者提问:可以自体移植么 移植后是不是会没有生育能力 如果移植治愈的可能性有多高 苏州大学附属第一医院血液内科仇惠英回复:可以自体移植,移植会影响生育的,有的病人移植前先保存精子,自体移植前必须经过多疗程巩固,残留病灶越少越好,再动员干细胞准备自体移植用,自体移植治愈可能百分之40左右,自体移植比异体移植复发率高 患者提问:我现在已经已经第三疗程 化疗三天用的药是阿糖胞干和环磷酰胺 而且没有激素 这个疗程是什么方案 如果自体移植大概要巩固几个疗程 自体移植风险大么 有排异么 如果用骨髓库全相合移植治愈可能性大概有多少 如果用骨髓库全相合费用大概要准备多少 苏州大学附属第一医院血液内科仇惠英回复: 一般巩固4个疗程做自体移植,自体移植风险主要感染和出血,自体没有排异的,无关供体全相合治愈率在百分之70到80左右,费用在50万左右,有并发症更高
仇惠英 主任医师 苏州大学附属第一医院 血液科5395人已读





