唐顺医生的科普号
- 精选 一日两台骨盆肿瘤手术
昨天完成两台骨盆手术。都是17岁男孩,第一台是初治患者,骨盆骨肉瘤,完整切除骨盆肿瘤,保住了髋臼和髋关节功能,重建了骨盆连续性,2个小时完成。第二台是个当地手术后复发的骨盆低度恶性肿瘤,由于当地手术切除范围不够又术后感染,多次清创,左半骨盆巨大包块合并到骶后肿瘤污染,手术不但要完整切除肿瘤,更要切除肿瘤周围反应区域,重建半骨盆并皮瓣转移修复软组织缺损。由于患者在当地初次手术计划不足,这次手术是患者治愈的最后机会。最终按预想计划完成了手术。保住了坐骨神经的功能,希望患者有个好的结果。手术五个小时,出血不多。一日两台骨盆手术考验外科医生的能力,现在骨盆,骶骨等复杂骨肿瘤手术的病人越多越多,四肢关节翻修的手术也很复杂,患者到这里往往是最后的希望了,只能尽全力去帮助他们。
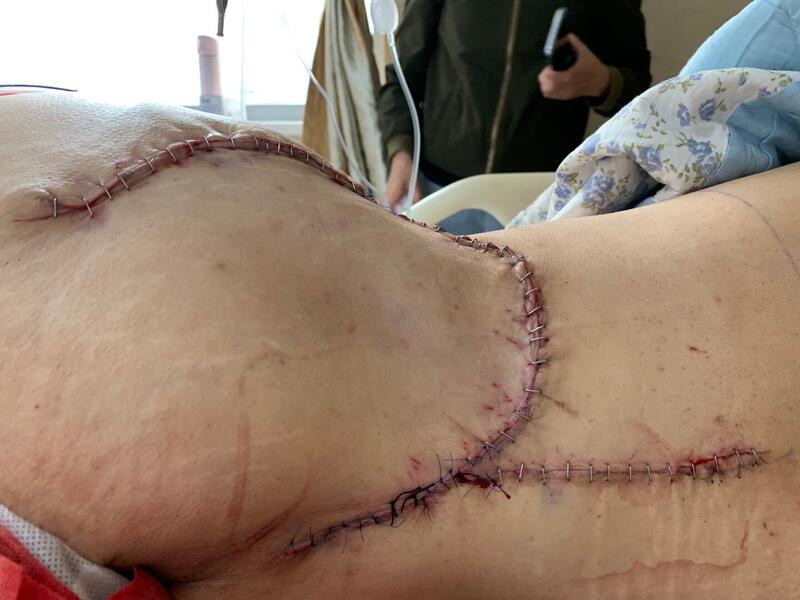 唐顺 主任医师 北京大学人民医院 骨肿瘤科2254人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科2254人已读 - 精选 胸壁巨大恶性肿瘤的外科手术切除
胸壁巨大肿瘤的外科手术,向来以解剖结构复杂,手术风险极大而著称,包括许多知名医院和著名专家也往往望而止步。手术的成功不仅需要丰富的手术经验,更需要多学科合作的手术团队,周密的计划,密切的合作和勇于承担不惧风险的勇气。 老年男性,71岁,前胸壁巨大肿瘤,穿刺活检病理考虑梭形细胞恶性肿瘤,累及左侧胸锁关节,胸骨柄,第1-3前肋,挤压气管食管,肿瘤血运丰富,同侧的无名静脉,颈总静脉及锁骨下静脉内瘤栓形成。 手术完成切除肿瘤及静脉瘤栓,重建左侧上胸壁缺损,希望大家的努力能有一个最好的结果
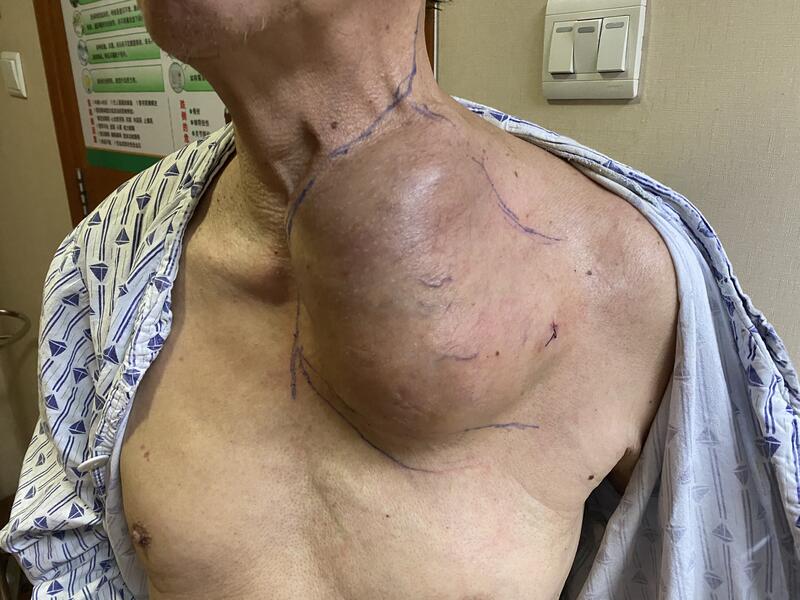 唐顺 主任医师 北京大学人民医院 骨肿瘤科2047人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科2047人已读 - 精选 一例复杂骨盆肿瘤的保肢手术治疗
60岁女性患者,发现左侧腹股沟肿块三个月,有间断左下肢肿胀,休息后可缓解。 术前检查考虑肿瘤侵犯骨盆的耻骨、坐骨及髋臼内侧,股骨的小粗隆及骨干内侧皮质,左侧股神经,髂股动、静脉被肿瘤挤压包绕关系不清。 术中采用骨盆关节外完整切除,小心分离出股动脉和股静脉,分离结扎进入肿瘤内的股深动脉及股深静脉。彻底切除肿瘤,肿瘤切除边界充分 这例肿瘤保肢困难,患者术前也做好了截肢的准备,我们通过努力做到彻底切除肿瘤并保存下来肢体,同时达到和截肢相同的外科切除边界,术中出血不多。希望患者能有一个最好的治疗结果。
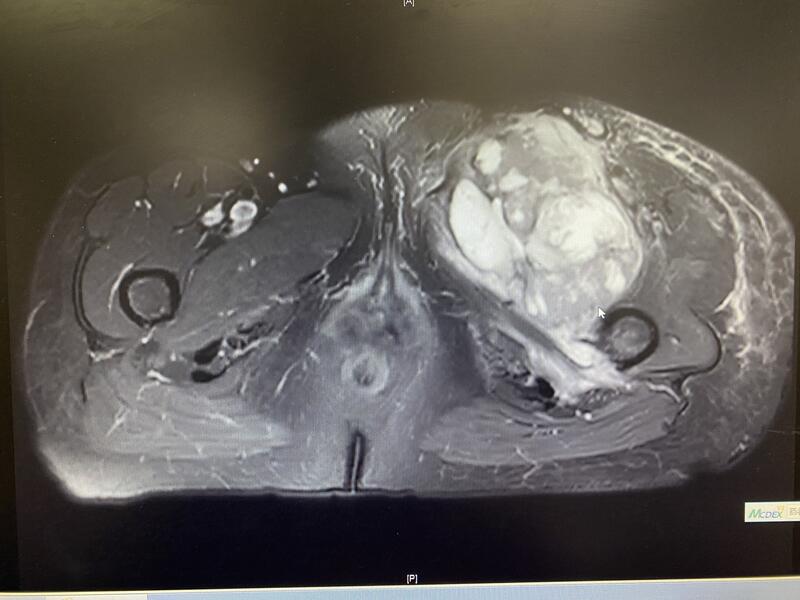 唐顺 主任医师 北京大学人民医院 骨肿瘤科1351人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科1351人已读 - 精选 一例巨大超半盆离断+全盆腔脏器清除,结肠造瘘+双侧输尿管造瘘
患者为54岁女性,骶骨脊索瘤术后多次复发,又先后接受了粒子植入手术,双侧肾盂插管,输尿管支架等手术。接受过化疗及靶向药物治疗,肿瘤对多种治疗方法均无效果。 术前肿瘤情况: 联合普外科,泌尿外科,妇产科;在麻醉科和外科监护的支持下,肿瘤得到了彻底切除。 手术切除情况: 谢谢各位好友的点赞评论[ 抱拳],几个问题统一回答一下:1.肿瘤是原发的低度恶性,之前所有能用的方法都试过了,效果不佳。2.肿瘤做到了彻底切除,切除的外科边界很好,患者有治愈的机会,当然还有很多工作要做,还要继续随访观察,标本照片太血腥。3.虽然创伤很大,但术中病人一直很平稳,特别感谢麻醉团队,这样的手术在人民医院的麻醉医生看来,经历的太多,都不是事儿[强]。4.这种手术需要多学科的MDT团队紧密配合,术前精心设计手术方案,术中术后环环紧扣,一个人单打独斗难以成功,北大人民医院在这方面有无可比拟的优势。5.谢谢大家为我点赞,这样巨大的肿瘤手术不常遇上,风险极大,术前我也和患者及其家属充分交流,没有辜负他们对我和北大人民医院骨肿瘤科的信任。
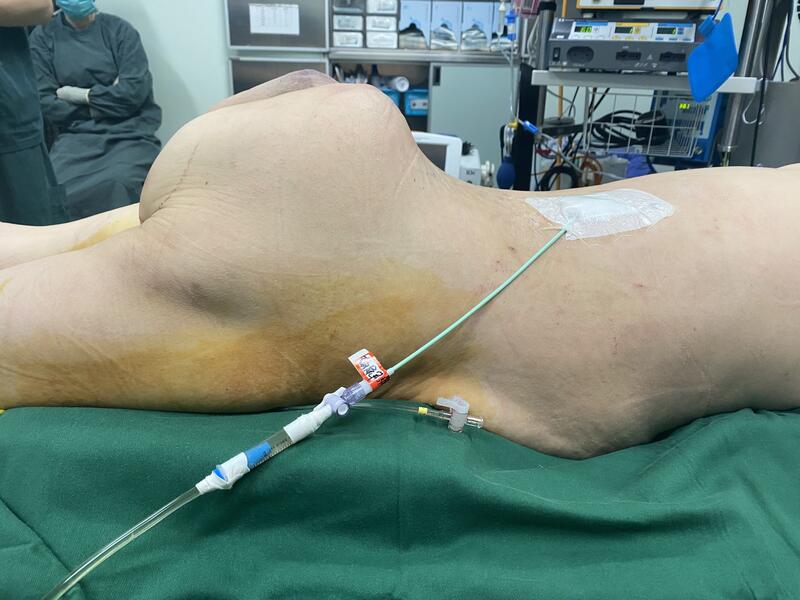 唐顺 主任医师 北京大学人民医院 骨肿瘤科1358人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科1358人已读 - 精选 对于骨盆肿瘤外科治疗的几点思考:肿瘤是否能彻底切除?能否在切除肿瘤的同时,保留肢体?
最近常常有患者和家属向我咨询有关骨盆肿瘤手术治疗的相关问题。主要集中在以下两个方面:一个是手术前,一个是手术后。 今天我们来说说术前: 一般来说,一个有经验的骨盆肿瘤外科医生会在术前和患者详细交流手术的相关问题。这主要包括以下几点: 1.肿瘤是否能彻底切除。这在很大程度上取决于肿瘤的实际情况,对于能够达到广泛切除边界的肿瘤,手术彻底切除应该是患者的第一选择。当然这也取决于医生的水平。 2.能否在切除肿瘤的同时,保留肢体。随着手术切除技术的提高,实际上多数可以彻底切除的肿瘤都是能够做到保留肢体的,保留肢体也并不会减低患者的生存机会。当然,保肢手术的复杂程度远远高于截肢,医生需要有高超的技术,充沛的体力和高度的责任感才能为患者实现治愈肿瘤并且保留肢体的愿望。患者往往由于医学知识的不对等,失去了保肢手术的机会。或者有时是接受了缺乏骨盆肿瘤手术经验的专家的建议,放弃了机会,十分可惜。 3.保留肢体的功能。这往往也是患者最关心的问题。很大程度上,取决于肿瘤的大小和位置,是否侵犯了重要的组织结构。所以说如何保留肢体,并保留一个有功能的肢体,是每个骨盆肿瘤外科医生追求的目标。 下一次我再和大家说说术后的那些事儿
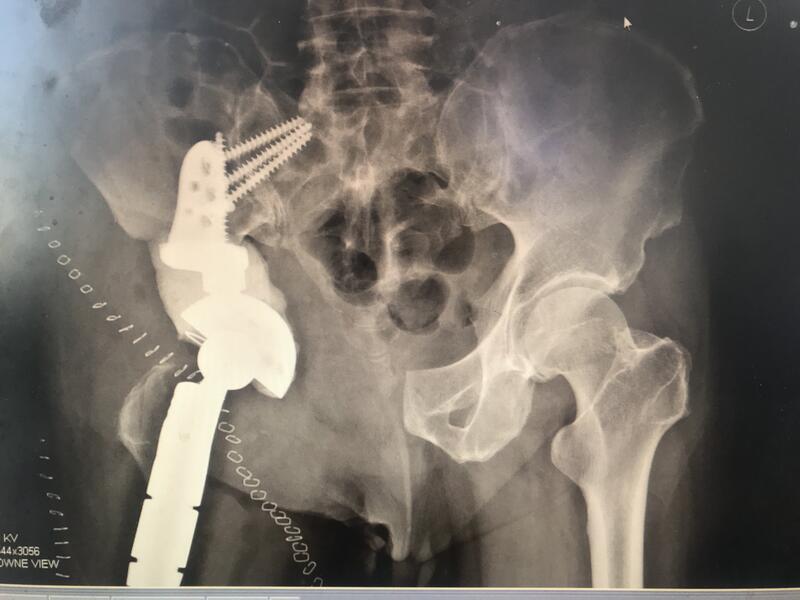 唐顺 主任医师 北京大学人民医院 骨肿瘤科2733人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科2733人已读 - 精选 全骶骨肿瘤切除
做为全国骨肿瘤治疗的引领者,在郭主任的带领下,我们有全世界最大宗的病例积累。这是一例18岁尤文肉瘤的男孩,来的时候大小便不能自理,已经康复出院一年,有一个基本正常的功能,祝福他有个美好的未来。
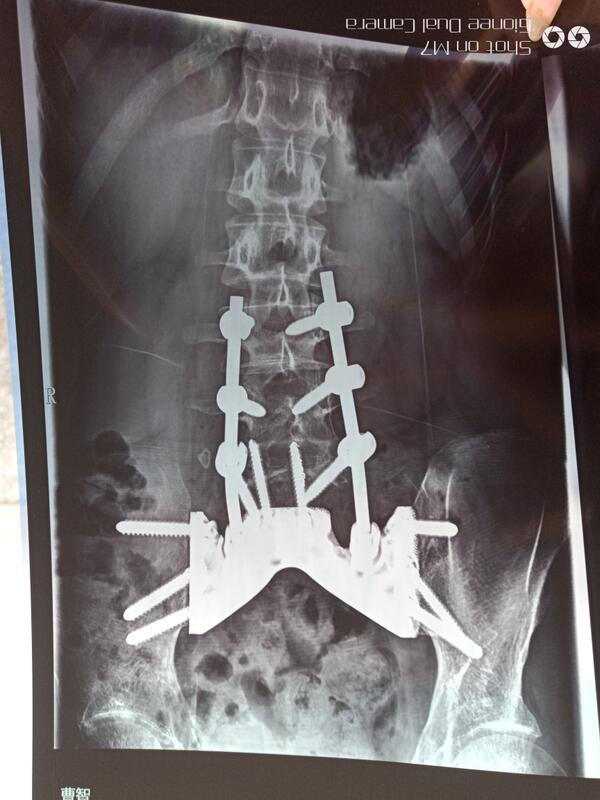 唐顺 主任医师 北京大学人民医院 骨肿瘤科1873人已读
唐顺 主任医师 北京大学人民医院 骨肿瘤科1873人已读 - 精选 骨肉瘤
第19章 骨肉瘤概述骨肉瘤曾经是一种致命的骨的恶性肿瘤,造成超过80%的患者在诊断后5年内死亡。随着对于这种疾病认识水平的提高,现在的治疗方案可以治愈大约70%的原发肢体肿瘤而无转移表现的患者。经典的骨肉瘤被定义为高度恶性的梭形细胞肉瘤并可产生骨样基质。全美每年大约可以诊断900例骨肉瘤,是除多发性骨髓瘤以外最常见的骨的原发恶性肿瘤。骨肉瘤的发生率在美国约为3/10,000。在骨肉瘤数据库中有超过10,000例的登记病例,在麻省总医院(Massachusetts General Hospital, MGH)的肿瘤中心自1972年来共诊断了670例此类病例。骨肉瘤更常见于男性患者,主要好发于生命过程的第二个十年里,其第二个好发高峰在成人的晚期,主要是由于与Paget’s病相关的骨肉瘤。骨肉瘤的病因目前还不清楚(与绝大多数其它骨肿瘤一样)。当有家族成员得了骨肉瘤,应考虑是否有遗传学的因素。对于遗传性的视网膜母细胞瘤和Li-Fraumeni综合症的患者更易并发骨肉瘤。病毒诱发骨肉瘤的证据在于动物实验证明,特定的病毒可以在所选择的动物身上诱发各种骨的肉瘤。放射引起的骨肉瘤占总数的3%,多见于其它类型肿瘤患者应用放射治疗和烷化剂治疗的情况。继发性的骨肿瘤的风险性见于,增加药物的剂量,化疗方案中烷化剂的应用可以潜在的增强放射效应从而继发骨肉瘤。对于受侵犯的骨应用放疗治疗比其它组织更易于继发肉瘤的产生。快速生长的肿瘤的好发部位与发病患者的年龄提示这种肿瘤的病理与骨的生长发育紧密相关。骨肉瘤好发于长骨的干骺段。其中最常见的部位是远端股骨,近端胫骨和肱骨,这些都是青少年生长发育最快的部位。扁骨较少累及。在MGH患者组的研究中,最常见的部位是膝关节(其中远端股骨,32%;近端胫骨,16%)。高度恶性的骨肉瘤应该被认作一种系统性的疾病,因为在做出诊断时多数已有微小转移灶的存在。无转移的患者在化疗和手术切除后一年或更长时间出现了新发肺部转移,其预后要好于那些在诊断时就有肺部转移灶的病人。大约有10%-20%的骨肉瘤患者在诊断时就有了转移的影像学表现,这类患者根据肌肉骨骼系统肿瘤协会的分期标准(Musculoskeletal Tumor Society, MSTS)归为III期骨肉瘤。在MGH的骨肉瘤患者中,大多数的患者(73%)为MSTS IIB期的肿瘤,12%的患者存在远处转移。这些转移灶的部位常通过胸部CT扫描和全身骨扫描来进行检测。转移灶的部位包括肺,其次是骨,更为少见的部位包括其它一些内脏器官,如胸膜、心包、肾、肾上腺、淋巴结和脑。少数患者存在骨和肺部的转移,转移造成的死亡多数肺部病灶控制的失败,如肺内的广泛转移,肺内出血,气胸,或腔静脉的阻塞等。绝大多数死于肿瘤转移的患者在死亡时都有肺的受累。临床表现患者通常存在疼痛和局部的软组织肿块。症状可以存在3个月或更长的时间,并且开始于一次受伤后。创伤并不认为是肿瘤的诱发因素,虽然许多的研究者试图证明创伤后的微小骨折可以诱导肿瘤的形成。症状可以时轻时重,导致诊断的困难。伴随的疼痛持续而逐渐加重。疼痛可以在休息时或夜间存在,并且与活动无关。常常没有全身性的症状。最重要的体检发现是软组织肿块的存在。软组织肿块的大小差别很大,但通常相当大并且可以触及。可以存在关节内的渗出,或存在有病理性骨折。特定的实验室检查常常是异常的,如碱性磷酸酶或乳酸脱氢酶水平,两者在诊断时可以是升高的。异常的升高,尤其是乳酸脱氢酶,常常提示预后不良。影像学表现在大多数的病例,影像学表现和临床信息可以帮助预测肿瘤的病理学诊断。骨肉瘤的典型的影像学表现显示为位于长骨干骺端的侵袭性病损。肿瘤破坏正常的骨小梁结构,边界不清,没有任何可见的骨内膜的骨反应。显见的放射线高密度的成骨区和低密度的溶骨区相混合。骨膜新生骨形成并升起于皮质表面,伴有Codman三角形成和“星放射状”表现。相关的软组织肿块有不同程度的骨化,取决于成骨和成软骨区域的范围。(Fig.1)病理学表现骨肉瘤被经典的定义为由高度恶性的肉瘤样基质和恶性成骨细胞直接产生肿瘤性骨样组织或骨的一类肿瘤。肿瘤常出现中心矿化,周围为不成熟的,缺乏矿化的骨组织,肿瘤细胞常出现间变,伴有异型细胞核和双着丝点。肿瘤可以有向成软骨细胞或成纤维细胞分化的区域,但只要存在小片区域的肿瘤骨样基质区域就可以诊断为骨肉瘤。(Figs.2,3)肿瘤分期骨肉瘤的分期与其它的高度恶性肉瘤相同。需要进行彻底的组织学和体格检查。血液学检查,包括要了解乳酸脱氢酶和碱性磷酸酶水平。此外需行包括病变部位骨和胸部平片检查,全身骨扫描,胸部CT扫描,局部MRI检查。MRI可能是决定是否可以施行保肢术或必须行截肢术以达到局部控制的最为重要的检查。冠状位T1相可以显示肿瘤髓腔内侵犯的范围。整个骨都需要被扫描到以排除骨内的跳跃转移灶。关节需要仔细评估有无肿瘤的侵犯。给予强化造影剂(钆)后的动态显像有助于了解术前化疗后肿瘤坏死的范围。肿瘤的分类本章节重点讨论经典的,高度恶性的,中心型骨肉瘤,但还有一些其它的类型。骨肉瘤根据其恶性程度分级,肿瘤部位数量,位于骨的部位不同和发病原因可以分为多种不同的亚型。表面型骨肉瘤的组织学分级就可以分为高度、中间型、或低度恶性。骨旁骨肉瘤典型的骨旁骨肉瘤表现为由组织学低度恶性的成纤维细胞组成的,产生编织样或层状的成骨。发病年龄比典型的骨肉瘤要大,多见于20-40岁之间。远端股骨后方是最常见的骨旁骨肉瘤的好发部位,其它长骨也可以受侵犯。肿瘤为来源于皮质骨的基底广泛的病变。病变后期肿瘤可以侵入皮质骨进入髓腔。治疗以外科手术切除为主,生存率为80%-90%。(Fig.4)骨膜骨肉瘤所谓骨膜骨肉瘤是一种中度恶性程度的成软骨细胞来源的表面骨病损,好发于胫骨近端。发病年龄与经典型骨肉瘤相同。转移的发生较低度恶性的皮质旁肿瘤多见但少于经典的中心型骨肉瘤。辅助化疗所起的作用在骨膜骨肉瘤并不明确,但是由于有约20%的发生转移的几率,多数的肿瘤治疗中心都对其应用化疗。高度恶性的表面型骨肉瘤(皮质旁骨肉瘤)传统的高度恶性的骨肉瘤也可发生于骨的表面,并且可与骨旁骨肉瘤或骨膜骨肉瘤向混淆。治疗方法与传统的骨肉瘤相同。(Fig.5)继发性骨肉瘤继发性骨肉瘤好发于患有Paget’s病和先前曾经接受放射治疗的患者。纤维结构不良而未经放疗的患者极少见继发性骨肉瘤。多中心骨肉瘤这种类型的骨肉瘤十分罕见,但是有时候患者在诊断时同时存在多个部位的肿瘤病灶,与原发肿瘤表现相似。这时候很难判断这些肉瘤是来源于多个部位或是应该被认为是转移灶。所有这样的病例,预后很差。多中心骨肉瘤也可以在治疗第一个病灶后的几年内在其它部位的骨上发生。毛细血管扩张型骨肉瘤毛细血管扩张型骨肉瘤在平片上表现为一个溶骨性的病灶伴有少量的钙化或肿瘤骨形成。在影像学上易与许多良性的病变相混淆,如动脉瘤样骨囊肿。这是一个高度恶性的,血管损害伴有少量骨样组织产生的肿瘤。患者的年龄分布和治疗原则与其它的经典的高度恶性骨肉瘤相同。虽然毛细血管扩张型骨肉瘤被认为是一种侵袭性更高的类型,但它对于辅助化疗的反应与其它类型传统骨肉瘤是相似的。通过穿刺活检获得病理诊断所需的组织常常是比较困难的,因为其通常表现为富含血管且缺乏实性区域的多囊的肿瘤组织。预后因素肿瘤侵犯的范围对于提示预后非常重要,患者有转移病灶预后较差。转移灶的存在是极差的预后因素,如果患者不能行外科治疗清除病灶,几乎没有能够长期生存的可能。对于存在的转移灶进行治疗是必须的,为的是改善患者的预后。治疗的方法包括:如有可能切除肺部的转移灶,调整化疗的方案。有时,适合于施行对于转移灶的放射治疗。原发肿瘤的部位也是重要的预后因素,因为中轴骨和四肢近端的肿瘤预后较差。肿瘤的大小被认为重要的预后因素。跳跃转移灶,指同一骨内与原发病灶相同的另一病灶,是与肺部转移相同的预后不良的指征。诊断时的病理性骨折也是不良的预后因素。对于化疗后手术切除标本的组织学坏死率的评估,是许多研究都指出的对药物反应效果的预后因素。反应差者(常被定义为坏死率小于95%)较易发生远处转移,不论是否继续进行术后的化疗,转移发生的可能高于坏死率大于95%者。原发肿瘤对于化疗的反应率作为预后因素已被多个研究的结果所证实。多种评估系统用于对经过术前化疗的手术切除的肿瘤标本进行坏死率的评估。现在,大多数认为满意的反应率为原发肿瘤的坏死率大于98%,而不满意的情况是仍然存在存活的肿瘤组织。大多数情况下,但并非全部,当患者有好的反应率时预后很好,而当术前化疗后组织学反应率不满意时往往会出现转移。化疗反应的组织学分级提供了一种在治疗过程中早期分辨患者是否有复发的高危因素的方法。其初衷是对于化疗反应差的患者增加新的药物进行挽救治疗,虽然这种愿望还未实现,但却是一个值得继续进行研究的领域。治疗化疗骨肉瘤的患者的治疗包括对于原发肿瘤进行完全的,广泛性的切除或截肢术,和全身的辅助化疗。系统性的全身辅助化疗的应用使骨肉瘤患者的预后得到了很大的改善(参见第18章关于骨肉瘤辅助化疗的专题内容)。早期的研究认为,化疗对于微小转移灶有效,所以在截肢术后应用化疗。方案包括阿霉素,大剂量甲氨喋呤,顺铂和其它一些药物,多项研究表明将无病生存率从不应用化疗的10%-20%提高到了50%-65%。化疗的好处最初并未被广为接受,尽管如此,一项比较术后即刻进行辅助化疗和延迟应用化疗(只在出现转移的患者应用)的随机研究被着手进行。其结果和其它的研究都清楚的显示进行辅助化疗的实验组有更好的无病生存率和总的生存率。最近研究的热点集中在切除肿瘤前应用术前化疗(新辅助化疗)。这种方法有几个优点,如可以根据获得的组织反应率确定预后,减小肿瘤的大小使手术更易于实施,增加肿瘤的坏死,可能有些外科医生会认为能使保肢手术更安全。由于这些原因新辅助化疗已经成为多数肿瘤中心的标准化疗方案。尽管如此,但也有一些潜在的缺点,包括可能有一些患者对于化疗反应并不好,将使耐药的肿瘤细胞增加。儿科肿瘤研究组(Pediatric Oncology Group)的一项研究表明,在总的生存率和无病生存率方面术前化疗并不比术后化疗有优势。这项研究并未得到足够的关注。儿科肿瘤研究组和儿童肿瘤研究组(Children’s Cancer Group)的另一项研究提出,在应用阿霉素,大剂量MTX和顺铂的方案中增加异环磷酰氨和/或免疫刺激剂(MTP-PE)可以有效的提高生存率,这项研究的结果尚未发表。不管化疗方案如何改进,仍有20%-40%的患者最终死于骨肉瘤。最近的研究证实了一些肿瘤对于看上去有效的治疗出现抵抗的机制。其中主要的一点原因是出现了化疗药物的耐药,使化疗药物对于肿瘤细胞不能起作用。骨肉瘤出现多药耐药的机制有多种,其中之一是P-糖蛋白。P-糖蛋白是由MDR-1(多药耐药)基因编码的一种膜结合糖蛋白,在多种肿瘤和正常组织中表达。它是一种三磷酸腺苷依赖性的膜转运糖蛋白,能够将不同分类的药物,如阿霉素泵出细胞外。有推测认为化疗反应差的主要原因是存在P-糖蛋白;当前有多项研究表明表达P-糖蛋白的肿瘤患者其无病生存率和总的生存率比在肿瘤中不能测得P-糖蛋白表达的患者要显著降低。在一项研究中,P-糖蛋白的表达与组织坏死率并不相关,并且是比肿瘤坏死率更重要的预后因素。MDR逆转剂,可以阻断P-糖蛋白功能,能使药物积聚在细胞内,以克服其副作用。不幸的是,目前的逆转剂毒性均十分显著,对于其在其它肿瘤的研究中的作用并不显著;但是克服药物耐药是目前值得重点研究的领域。确定化疗“无效者”并对其提供个体治疗避免不必要的药物毒性可能可以改善预后。手术术前化疗被认为增加了保肢手术的可能并且由于肿瘤的体积缩小可以使保肢手术更加易于实施。然而直到今天,并没有一个随机性的研究来支持这个观点,而骨肉瘤由于其基质成分,虽然可见肿瘤内的矿化,但较少见新辅助化疗后肿瘤体积的缩小。虽然如此,绝大多数的外科医生认为在化疗后切除原发的骨肉瘤从肿瘤学的观点上来说更加安全。Rizzoli研究所的一项研究证明了外科手术的边界及化疗反应(肿瘤坏死率)与局部复发危险性之间存在关系。当患者未能达到广泛性的切除和未能达到良好的化疗反应时,局部复发的危险性增加。相对的,一项儿童肿瘤研究组的近期尚未发表的长期性研究(DJ Schwartzenruber, MD, AM Goorin, MD, MC Gebhardt, MD, et al, Washington, DC, unpublished data, 1999)结果显示,对未经过术前化疗的患者施行保肢手术也可获得很好的肿瘤局部控制。绝大多数的研究中心现在都应用术前化疗对于准备进行保肢手术的患者进行治疗。不断改进的重建技术以及肿瘤外科医生不断增加的经验和自信心使得保肢手术的数量不断增加。现在,大约80%的肢体骨肉瘤患者进行了保肢手术。达到肿瘤周围正常组织的阴性边界是十分重要的手术原则,但我们并不能确切的知道所需的正常组织的厚度,许多的标本都有至少一处的邻近边缘切除的手术区域。我们需要知道的是,在下肢截肢术后的肢体功能往往很好,尤其在儿童是这样。在保肢手术中往往不能保证足够的局部控制,而局部复发又常是致命的。当能达到广泛的手术切除边界时,行截肢术和保肢术的无病生存率和总的生存率是相同的,这个结论在关于远端股骨骨肉瘤的回顾性研究中已得到证明。选择适合的患者进行保肢手术是十分重要的。所选择的手术方式不能违背肿瘤治疗的目的。虽然有些研究者报道经过化疗可以使病理性骨折愈合,以利于实施保肢手术,但病理性骨折仍可能是保肢手术的禁忌症。并没有有关对于病理性骨折后患者实施保肢手术的大量研究报告,绝大多数研究者通常选择截肢术而非保肢术,其原因是因为局部过于保守的治疗往往带来不能接受的高局部复发率。同时,出现病理性骨折患者的继发的全身转移的发生率也更高。尽管如此,那些并无移位的出现骨折的肿瘤患者,如果有好的化疗反应,也许应该是行局部切除手术的适应症。特定部位,如胫骨近段,因为难以达到足够的软组织切除边界而较难进行保肢切除手术。同样地,下肢的保肢手术对于十分年轻的还未完全发育的患者也是不适合的。这将造成他们将来出现下肢的不等长,虽然可以通过人工关节制造使之成为相对禁忌症。外科手术技术的进步使更多的患者适合行保肢手术,多种新的技术被用来修复肿瘤骨切除后残留的缺损。我们将简单谈及其中几个方面。可牺牲的骨,如尺骨、腓骨、肩胛骨和肋骨,切除后不需进行骨的重建。这些部位的骨肉瘤的手术方式已被很好的描述,而术后出现的功能障碍微乎其微。骨盆骨肉瘤的手术切除十分复杂,这里不再讨论细节。手术方式为半盆切除术或内半盆切除术。切除髂骨或耻骨支不需进行重建,而如果髋臼受累及,切除术后功能将受显著的影响。重建需采用异体骨或马鞍式关节,但其术后并发症发生率相对高而术后功能却常常不理想。许多外科医生宁愿让近端股骨和剩余的骨盆骨或骶骨间形成一个假关节,尤其是当大量的软组织被切除后。幸运的是,脊柱和骶骨的骨肉瘤十分罕见,对于其需要进行结合手术,化疗和放疗的个体化的治疗。绝大多数的骨肉瘤的保肢手术需要修复肩或膝关节结构的完整性。临床的经验集中在对于生物材料和金属关节装置的应用上。两种方法都有其优缺点,并没有有关哪一种方法更好的有说服力的对比性研究。异体骨重建可以提供重建的关节表面、韧带和肌腱附着点。假体可以提供立即的关节稳定和机械性的固定,从而允许早期的行走和使用。对于具体患者如何选择合适的手术方式取决于患者的年龄,需要修复的缺损和术者与患者本人的偏好。近端肱骨 上肢的功能只要有可能都应该予以保留。在多数病例,可以进行保留肿瘤周围正常组织的关节内或关节外切除术。这样做常常意味着丧失三角肌以及部分或全部的肩袖肌腱。肩胛盂或部分的肩胛骨可能需要切除,这完全取决于病变侵犯的范围。如果整个肩胛骨被切除(称作Tikhoff-Linberg切除术),只要保留血管神经束和正常的手的功能,其结果仍好于截肢术。关节内切除术后的重建方法包括异体骨,金属假体,或异体骨-假体复合关节。异体骨的优点在于它可以提供肩袖肌肉和其它肌肉的附着点;但是异体骨的并发症发生率较高。一项最近的16名患者的研究显示有70%的功能评分并保留了手的灵活性,但肩关节的功能也显著丧失,不能进行体育活动,脱位/半脱位,感染,骨折的发生率较高。这些作者不再使用这种方法进行重建,但仍有一些中心继续这样做。金属假体更耐用,但软组织的重建修复受到限制,肩袖的功能很差。一项有关假体重建的大样本的随访研究表明,肱骨近端与其它部位相比有最好的功能(MSTS评分系统30分中的26分)和最低的局部并发症发生率。翻修率为10%(29例中的3例)。其它研究显示常见的问题为脱位和肩关节不稳定,但肱骨的骨水泥腔松动发生率较低。异体骨-假体复合关节能够结合两者的优点而在这个部位提供最好的解决方法。对于渴望有外展功能的患者,或肩袖和三角肌被切除的患者,施行肩关节融合术应是可取的方法。异体骨移植,自体腓骨移植,或异体骨与带血管蒂的腓骨移植相结合来用于关节的融合。一项最近的研究比较了上述重建方法后患侧的手和前臂与对侧(健侧)的功能发现,对于远端肢体功能的保持水平较高,尤其是抓力和前臂旋前的力量,患者的满意程度是可以接受的。股骨的远端和胫骨的近端 对于切除膝关节周围肿瘤所积累的经验相当丰富。常常能够达到肿瘤的广泛性切除并膝关节动力的重建保留部分股四头肌的功能。关节融合术较少采用。膝关节周围的结构必须仔细的评估以确定肿瘤是否通过关节囊侵及膝关节或造成了骨折。如果有疑问,应该在手术开始时通过小的关节切口了解关节情况,并在确定关节受累后及时行关节外的切除术。在多数情况下,重建的方法包括异体关节移植,金属假体或复合关节。异体骨移植的优点在于可以保留相邻的关节的表面,在儿童可以保留骺板,但是异体骨的术后并发症发生率较高。一项近期的870例患者的长期随访报道指出,异体骨移植术后感染率为10%,骨折发生率为19%。16%的异体关节移植最终需要性全膝关节置换术,其平均的时间间隔为6年,但75%的患者其长期的功能随访(Mankin评分)是成功的。在儿童和青少年,异体骨移植能够克服金属假体的缺点,包括金属假体必须切除未侵润的骺板且有使用的寿命问题。一项104例膝关节异体骨移植的长期研究显示,5年的异体骨移植寿命为73%,而保肢成功率为93%。股骨的异体骨移植结果要好于胫骨移植,其5年的寿命分别为76%和67%。在其中86例存活2年及以上的患者中最主要的并发症为感染15%和骨折2%。化疗是影响移植骨和宿主愈合的原因,在另一项研究中指出,有49%的接受辅助化疗的骨肉瘤患者出现异体骨的不愈合。许多的并发症限制了金属假体的使用。在成人,金属假体是常用的重建方法,但是随着骨肉瘤患者的生存期的延长,必须要考虑儿童和青少年患者的假体的寿命。现在的设计应用标准的假体提高了人工关节的功能性,所以特制的人工关节已较少使用。虽然新的使假体柄更紧密贴合的设计能够增加假体的可靠性,但是最主要的潜在问题仍是假体的松动和机械性的损伤。假体表面的羟磷灰石涂层能够有效的避免松动的出现。在一项68例应用组配或特制假体重建的病例研究报告中,假体的5年生存率为83%,10年生存率为67%。12例假体进行了翻修,其中11例翻修成功。在胫骨近端的肿瘤中翻修率最高(6/13),而股骨远端的翻修率仅为10%(3/31)。11例患者(13%)出现感染,其中6例需行截肢术。胫骨近端的肿瘤患者术后的功能评分(MSTS)也是最低的。此部位假体应用的一项主要缺点是不能将膑腱有效的固定于假体上。生长发育期儿童的手术重建 由于绝大多数的骨肉瘤发生在儿童和青少年的膝关节周围,对于他们来说生长发育和肢体的功能是将来的主要问题。在应用异体骨移植治疗的患者来说,肢体的等长取决于骨骺愈合的时间或肢体的延长术。如果肿瘤位于骨干或干骺端,则骨骺有可能并未受累。这需要对于高质量的MRI进行仔细的分析,但如有可能,保留骨骺可以保留关节面和生长板 。被保留的骨骺的生长可能并不正常,但一项最近的有关儿童的研究显示,对于胫骨近段肿瘤行经骨骺的切除术后肢体的短缩小于3.5cm并常常能够达到正常的功能。这些作者采用带血管蒂的腓骨结合异体骨进行重建。另一种办法是应用可延长的假体。假体的延长方法很多,对于这种方法的经验还十分有限,但一些随访已经证实对于膝关节周围肿瘤切除术后可以达到下肢的等长。对于假体的选择取决于手术的医生。一种方法是使用标准的假体并定期调整假体体部的长度。这就需要进行多次手术并在儿童完全发育后最终更换成人假体。对于假体进行延长,由于需要切除包裹假体的纤维瘢痕组织,所以常常是困难的。现在更多的是采用新的设计使假体的延长不用通过手术就能实现。旋转成形术 这种术式适合于少儿股骨远端巨大肿瘤的患者,但有时也适用于青少年患者,肿瘤巨大,有骨内跳跃转移灶或病理性骨折,或术后希望继续进行体育活动的患者。其术后功能与膝下截肢术相同,除了其外形,易于被所选择的患者接受。让患者及其家人与一位曾经接受过旋转成形术的患者相交流或至少观看相关的录像资料并与有经验的康复师进行谈话是有意义的。在一项最近的136例患者的关于无转移的骨肉瘤的非随机性研究提示,其手术并发症的发生率较低,而术后的功能结果(MSTS)要好于其它那些保肢术。行截肢术的患者也有很低的并发症发生率,但行旋转成形术后的患者比截肢术的患者或其它各种保肢手术的术后功能更好。虽然外科医生和患者常常愿意选用其它的保肢方法,但是旋转成形术仍是十分有用一种选择。转移性骨肉瘤 对于仅存在肺转移的患者施行保肢手术可达到大约40%的生存率。各协作组不断的改进对于转移性骨肉瘤的治疗方案。并应用新的化疗药物进行II期临床实验。这些实验的目的是评价药物对肿瘤的反应率,如etoposide(VP16)和大剂量异环磷酰胺及粒细胞集落刺激因子等,都可用于转移性骨肉瘤的治疗。这些患者也可进行肺部转移灶的切除术,辅助进行化疗,所有骨和肺部的肿瘤病灶都应该手术切除。如果能达到上述条件,而且患者对于化疗敏感,则患者有30%-50%的机会可以达到长期存活,其生存率与肿瘤侵犯的范围有关。仅存在肺部转移的患者其预后要好于出现骨转移的患者。
唐顺 主任医师 北京大学人民医院 骨肿瘤科2.1万人已读 - 精选 肾癌骨转移的治疗
患者:2001年因肾脏占位切除,病理为肾盂移型细胞瘤。一个月前体检时发现左股骨髓腔内有肿物,周围骨质轻微破坏,为恶性。请问:是否适合手术?北京大学人民医院骨肿瘤科唐顺:肾癌患者预后较好,即使出现骨转移经过积极正确的治疗仍可有良好的结果,是否手术需要根据患者的影像学资料来决定,如果根据肿瘤破坏情况考虑患者有发生病理性骨折的可能,则手术有清除病灶,预防骨折的作用。
唐顺 主任医师 北京大学人民医院 骨肿瘤科3859人已读 - 精选 骶骨转移癌的外科治疗
骶骨转移瘤患者的综合评估: 骶骨转移癌的手术方式比较复杂,并且周围丰富的血供和肿瘤异常增生的血管使手术的风险比其他位置肿瘤的手术风险要高的多,术后对患者的严密观察以及护理需要丰富的经验。手术之前要对患者的全身状况进行充分的评估,同时结合原发肿瘤的性质、骨转移灶的数量、骶骨病变的范围、及内脏转移的情况进行综合评定, 掌握好适应症。骶骨转移瘤的类型包括:仅有骨转移,骨转移伴内脏转移,孤立性骨转移伴内脏转移,多发骨转移伴内脏转移等。肺癌患者多无内脏转移,但多为多发骨转移, 预后较差;肝癌患者多同时出现内脏及骨转移,预后最差;乳腺癌、肾癌、甲状腺癌患者, 较少出现内脏转移,对于孤立性骶骨转移的乳腺癌、肾癌、甲状腺癌患者,应采取积极的外科手术治疗,术后辅以放疗,预后较好。比较特殊的直肠癌复发累及骶骨,可以进行大块切除以争取治愈患者1。手术适应症: 既往对骶骨转移癌手术治疗的适应症掌握方面并没有明确的文献可供参考。对适应症以及手术方式的选择首先要在明确外科治疗目的的情况下做到个体化。骶骨转移癌外科治疗适应症包括:1、解除肿瘤对神经压迫造成的剧烈疼痛,提高生存质量,减少镇痛药物的使用2; 2、解除肿瘤对神经的压迫,恢复神经功能;3、放疗后疼痛症状缓解不满意;4、肿瘤累及腰骶椎导致腰骶或骶髂关节不稳定3; 5、累及骶3以下的单发骨转移。没有明确的证据表明转移癌的手术治疗可以延长患者的生存时间,因此对骶骨转移癌治疗有一条重要的原则,即手术不应增加患者的痛苦。目前,骶骨转移瘤的外科治疗仍然面临许多问题,其中最重要的问题是如何综合判断患者的手术适应症及手术时机。骶骨转移癌患者的术前准备: 多数转移癌患者的一般情况相对较差,术前要对患者的心肺功能、肝肾功能、电解质情况等进行多方面的检查,纠正负氮平衡,纠正贫血等不利手术恢复得因素。骶骨周围局部解剖关系复杂,毗邻的重要组织和结构较多,并且肿瘤血供比较丰富,术前一定要充分认识到手术的风险。术前的周密准备对手术成功至关重要。除了常规的术前准备之外,术前要进行肠道准备和控制出血的准备。对出血的控制:骶骨转移癌的手术治疗出血量一般在1000-5000ml左右,对血供丰富的肿瘤以及体积比较大的肿瘤甚至出血量可以达到10000ml以上。根据临床经验,出血量大于4000-5000ml时,术中可以明显出现凝血功能的异常,主要表现为创面大量渗血,血液明显稀释,凝血速度减慢。因为骶骨周围的血管比较多,并且骶骨前方为比较疏松的组织,没有能力将血肿局限于切口的周围,渗出的血液可能沿腹膜后的间隙向周围延伸,如果不及时补充血浆以及凝血因子,术后可能会出现致命性的出血。因此术前要准备充足的血源包括血浆、血小板以及相应的凝血因子。除了术前准备充足的血源以外,术前进行肿瘤血管栓塞是控制出血的有效手段4。对血供比较丰富的转移癌例如肾癌、肝癌、肺癌等,如果肿瘤体积较大,应该常规进行术前栓塞。栓塞应该在手术的当天或者前一天进行。过早的栓塞因为肿瘤周围血管增生导致栓塞失效。栓塞后最常见的并发症是术后发热以及供血区域的疼痛,无需特殊处理。最有效的控制出血的手段是临时血管阻断术,包括术前放置腹主动脉球囊阻断以及术中临时阻断腹主动脉同时进行髂内动脉的结扎, 能够明显的控制手术当中的出血,降低术中大出血的危险。 前侧入路进行腹主动脉临时阻断以及髂内动脉结扎也是控制出血的有效手段。骶骨转移癌的手术方式骶骨转移癌的手术目的是缓解症状, 最大可能的切除肿瘤, 减少局部复发。 骶骨肿瘤手术入路包括单纯前方入路、单纯后方入路和前后方联合入路5。因为转移癌的治疗以刮除为主,因此对转移癌而言,最常用的手术方式是后侧入路。有时候进行后侧入路的同时辅助进行前方入路以控制出血。前后方联合入路可提高骶骨截除术的安全性。现在由于栓塞技术和腹主动脉阻断技术比较成熟,已经取代了前侧入路的血管阻断术。目前常用后路和前后方联合入路。手术中的重要步骤之一是控制出血。控制出血可以使手术野清晰,有利于比较彻底的清除肿瘤及保护神经根。腹主动脉阻断的时机应该选择在将骶骨后方的软组织分开之后,进入肿瘤之前。在分离骶骨后侧的软组织过程中要注意沿组织的解剖间隙进行,尽量避免出血。清除骶骨肿瘤过程要快速有效,避免不必要的重复步骤。手术中要和麻醉医师相互协作,避免出现血容量的快速降低。 肿瘤清除后,可以采用适当的填充物填塞肿瘤切除后形成的残腔,一方面可以填充肿瘤切除术后形成的残腔,另一方面能够有效的控制出血。缝合过程要快速,同时对切除肿瘤的部位进行加压止血。神经功能的保护: 骶骨转移癌累及的重要神经包括坐骨神经部分功能和阴部内神经的功能。骶1神经根支配小腿后群肌,骶2神经主要支配大腿后群肌。骶2-骶4神经组成阴部内神经,和加入的交感、副交感神经纤维共同支配膀胱和直肠括约肌功能和性功能。大多数骶骨转移癌都会累及骶1和骶2,并且采取的手术方案多为肿瘤刮除术,因此术中要尽量保留患者的神经完整性。骶1神经保留可保持正常步态;保留双侧骶1、骶2神经, 40%患者有正常肠道功能,25%有正常膀胱功能; 保留双侧骶1、骶2神经及单侧骶3神经的,有上述两项功能者分别为67%和60%; 保留双侧骶1~骶3神经,有正常肠道功能和正常膀胱功能的分别达到100%和69%; 保留单侧骶1~骶5神经,87%患者有正常肠道功能, 89%有正常膀胱功能; 单侧骶1~骶5神经切除后同侧会阴部感觉麻木, 但不影响性功能6, 骶骨转移癌的手术治疗多为对症治疗和姑息治疗,在手术条件允许的情况下尽量保留患者得神经功能,以提高患者得生存质量。根据具体情况,在不影响肿瘤较为彻底切除的条件下, 尽可能保留双侧骶1~2及至少一侧骶3神经根,或一侧骶1~3神经根,配合适当的功能锻炼以最大限度保留行走、大小便及性功能。骨盆的稳定性重建: 骶骨参与构成骶髂关节,是负责将躯体部分的重量向下肢传导,骶髂关节受到损伤后将对脊柱的稳定性造成重要的影响。 对于骶骨肿瘤切除后是否进行骶骨重建一直存在争论。并且不同阶段的骶骨肿瘤切除后对骶髂关节的稳定性影响也不相同。Wuisman认为是否行重建术取决于髂骨翼切除范围及患者的情况,应避免出现严重并发症,使病人能够得到更快的康复7。全骶骨或次全骶骨切除后如果不进行骶骨重建,患者术后需要长时间的卧床,依靠骶骨和骨盆之间、骶骨和脊柱之间的韧带组织和残留的关节以及术后形成的疤痕组织维持稳定性,因此患者需要长时间卧床。并且术后对脊柱的稳定性有一定的影响。近年来,脊柱内固定器械发展很快,因而,许多医生对于全骶骨或次全骶骨切除后的患者进行了内固定手术,重建脊柱骶骨的稳定性8。骶2是参与构成骶髂关节的大部分关节面,因此我们对切除范围在骶2以上的患者常规进行辅助固定以加强骨盆环的稳定性。转移癌患者的情况和原发肿瘤患者不同,治疗目的不同,对于转移癌患者而言,减轻症状、恢复患者一定的生活自理能力是最终的手术目的,因此加强骶髂关节的稳定性可以使患者早期下地活动,对转移癌患者而言也许更有意义。骶骨转移癌术后并发症的处理骶骨转移癌手术的主要并发症包括大出血、神经损伤、切口感染不愈合、直肠损伤等。骶骨转移瘤血供较丰富,容易造成大出血。我们对血供丰富的转移瘤以及肿瘤体积较大的患者常规进行术前栓塞和腹主动脉临时阻断的方法,可以明显减少术中出血量,降低大出血引起的一系列并发症。术后要注意检查电解质、血常规、凝血功能等,及时纠正贫血以及凝血功能的异常。手术后后侧的皮瓣血运明显减少,同时手术肿瘤切除后造成局部较大的残腔形成,容易出现术后皮瓣的缺血坏死。肿瘤切除的彻底性和肿瘤的显露密切相关,但是同时对皮瓣的血运有很大影响,手术时要在两者之间进行权衡。转移癌患者一般处于免疫抑制状态,术中无菌操作要求更严格,术后抗生素合理使用非常重要。直肠的损伤往往会导致伤口的严重感染,通常需要进行结肠造瘘处理,并进行伤口的清创手术。脑脊液漏的患者通过伤口加压包扎、抬高床尾即可以治愈。
唐顺 主任医师 北京大学人民医院 骨肿瘤科8684人已读 - 精选 骶骨巨细胞瘤的手术治疗
骨巨细胞瘤(giant cell tumors,GCT)占原发骨肿瘤的5~8%。约5%的GCT发生于扁骨,以骨盆为最多见。椎骨之中最长发生于骶骨,其它椎骨较少累及(1-4)。骶骨GCT常发生在上位骶骨,局部侵袭性较高、血管神经解剖复杂、治疗困难,至今对骶骨GCT的治疗仍没有确定的理想方案。本文探讨了在有效控制出血的前提下,采用切刮术治疗骶骨GCT的局部复发率、并发症等。资料与方法(一)一般资料:自2000年7月至2007年7月我院共收治骶骨GCT43例。有随访记录的35例。 其中男 18例,女 17例。年龄最小16岁,最大61岁,平均年龄约32岁。所有患者术前常规拍摄病变部位正侧位X线片、CT或/和MRI检查, 确定肿瘤的影像学分级。发生在S1-S5的GCT有5例,发生在S1-S4的GCT有9例,发生在S1-S3的GCT有12个病人,发生在S1-S2的有3例,发生在S2-S5的GCT有2例;发生在S3-S5的GCT有1例;发生在L5-S1的GCT有3例。(二)手术方法:本组35例患者中,来本院之前在外院行手术后局部复发转来本院8例。行3次手术者3例,行2次手术者8例。 骶骨GCT患者的治疗方式包括31例患者进行了病灶内边缘切除 (切刮) 术,有4例患者进行了广泛边缘切除术。由于骶骨GCT血供丰富, 手术中出血较多,对23例骶骨GCT采用了术中腹主动脉临时阻断术,其中6例采用了前路手术腹膜后分离腹主动脉, 用鞋带临时阻断腹主动脉血流; 17例采用了术前X线介入下腹主动脉植入球囊, 术中临时阻断腹主动脉血流的方法。未行术前血管阻断12例。(三)腹主动脉血流临时阻断方法:1.髂内动脉栓塞及腹主动脉球囊留置术方法:在手术前一天或手术当天术前,采用Seldinger穿刺法,穿刺股动脉,逆行将导管经股动脉向近心端插入,经腹主动脉造影后插入两侧或单侧髂内动脉造影了解肿瘤部位,性质,范围及血供情况,采用明胶海绵及弹簧栓子为栓塞物,将双侧或单侧髂内动脉(一般为肿瘤侵犯较重的一侧)及其他可栓塞的靶血管栓塞。腹主动脉再造影确定栓塞效果,于肾动脉在腹主动脉分叉1cm以下留置球囊,进行阻断实验并复查造影,以造影剂不向远端流动且不阻断双侧肾动脉血流为佳,全部病例在DSA机上施行。2.单侧髂内动脉结扎及腹主动脉临时阻断技术:患者取右侧卧位,采用左侧大麦氏切口,切开三层腹肌,将腹膜向内侧推开,显露同侧髂总血管及髂内动脉,髂外动脉。分辨髂内动脉分离并予以结扎,向上游离显露腹主动脉,以纱条套橡胶管于肾动脉分叉以下临时阻断。(四)重建方式:35例骶骨GCT的病例中,对29例患者采用了钉棒系统进行了腰骶部的重建, 6例未影响骶髂关节稳定性的病例未进行重建。结 果一例患者在外院手术后复发,肿瘤巨大、表面溃烂, 再次手术后2周死于严重感染。余34例患者,随访时间12个月至7年, 平均随访时间37个月。1例恶性骶骨骨巨细胞瘤死于术后15个月。1例骶骨骨巨细胞瘤术后肉瘤变,二次手术后给与局部放疗,死于术后13个月。2例骶骨巨细胞瘤患者术后2年出现肺转移,给与阿霉素、顺伯、异环磷酰胺化疗1周期。随访1年,肺部病灶无明显增大。术中出血:血管阻断组平均失血量为3278ml,未行血管阻断的骨巨细胞瘤手术平均失血量为5150ml,血管阻断显著减少了术中的出血量,因而对于骶骨巨细胞瘤术前行血管阻断是十分必要的,可以增加手术的安全性。局部复发: 血管阻断组局部复发率为30.43%(7/23),血管未阻断组局部复发率为66.67%(8/12)。 其中复发2次的患者5例;复发1次的患者10例。从表1可以看到血管阻断组与非血管阻断组比较出血量有显著性的差异(P=0.006)。考虑术中出血量是由多因素共同作用的结果,我们就影响出血量的相关因素进行多元回归分析,比较患者的性别、年龄、肿瘤大小以及血管阻断对于术中出血量的影响,发现肿瘤大小和血管阻断是影响出血量多少的主要影响因素。对于骶骨巨细胞瘤手术采用血管阻断技术对于远期肿瘤复发的影响进行Kaplan-Meier生存曲线分析(见图1),发现血管阻断组与非血管阻断组比较肿瘤复发率有显著性差异(P=0.03),不同阻断方式对于局部复发率的差异不大,从生存曲线中我们可以看到绝大多数复发都发生在术后6个月内,所有复发都发生在术后1年以内,非血管阻断组的总的复发率达到66.67%,血管阻断组的总复发率为30.43%。神经并发症:7例仅保全双侧骶2神经根的患者,4例出现膀胱控尿功能及大便控制能力的部分受损;双侧骶3神经根得到保全的13例患者,术后括约肌功能均能保全;单侧骶3神经根得到保全的11例患者,术后7例括约肌功能得到保全。4例切除1侧骶2,3 的患者,术后括约肌功能未出现异常。只有1例患者出现运动功能障碍。术中切除了单侧的骶1神经根,术后出现轻度瘫痪,但可借助手杖行走。伤口并发症:14例患者术后出现伤口并发症 (40%),11例患者需手术引流、清创、二期闭合伤口。2例患者因皮肤缺损较大,需行局部皮瓣转移。7例患者术后出现不同程度的脑脊液漏,均经抬高床尾、抗生素等非手术治疗愈合。讨 论(一)骶骨骨巨细胞瘤的特点骶骨骨巨细胞瘤少见,文献中报告的病例很少,最大宗的病例总结为Mayo Clinic的Turcotte 医生报告的26例(CORR 1993)(5)。本组35例骶骨骨巨细胞瘤是目前国际上报告的最大宗病例。骶骨的骨巨细胞瘤早期不易发现,生长到较大压迫骶神经时出现坐骨神经痛,严重时出现大小便异常。生长在骶骨的骨巨细胞瘤, 很少有Campanacci分级I级的病例。 骶骨的骨巨细胞瘤Campanacci III 级的病例明显多于四肢Campanacci III 级的病例 (6-8)。文献报告骨巨细胞瘤女性多见,Turcotte 报告的26例骶骨GCT中,女性患者占70%(5)。本组病例中,女性患者为17/35例,与多数文献报告的不同,不知是否与种族不同有关。尽管骶骨GCT是一种良性肿瘤,但在骶骨骨巨细胞瘤的治疗上十分具有挑战性。一方面是因为解剖部位的原因,另一方面是因为骶骨的巨细胞瘤往往长的很大才被发现,因而术中出血很多。治疗的方法包括放疗、病灶内边缘切除、病灶内边缘切除联合放疗、病灶内边缘切除辅助冷冻术和广泛边缘切除。放疗的明显的优点是避免外科治疗的并发症的发生率。放疗的主要缺点是控制肿瘤的生长效果不佳和引发约10%的病例肉瘤变(9-11)。本组35例患者中,均未接受过放疗,只有一例局部复发患者出现了肉瘤变。 病灶内边缘切除能避免伤及神经根、骨盆环的完整、髋关节和血管结构等。但这种手术的缺点是肿瘤的局部复发率较高。广泛边缘切除能将复发率降到最低,但是会增加外科治疗的并发症发生率(12-14)。本组病例中,无一例患者接受过放疗,骶骨骨巨细胞瘤术后局部复发为11/35 (31.4%)。 与Turcotte报告的局部复发率(33%)相近,但他们的病例术后多数接受过55Gy的放疗(5)。本组病例中局部复发2次的患者3例;复发1次的患者8例。位于骶骨的骨巨细胞瘤, 由于骶神经及盆腔脏器的缘故,不易实施整块切除, 因而局部复发率高。(二)骶骨骨巨细胞瘤手术方式的选择骨巨细胞瘤的侵袭性非常强,绝对不能够按照一般良性肿瘤的处理方法进行治疗,位于骶骨部位的骨巨细胞瘤手术难度更大,复发率高。对于病灶位于骶3节段及以远的患者,应采用广泛边缘切除;而对于病灶涉及的骶椎节段较高(S1-2)的患者,采用切刮术较多。但对于肿瘤位于骶1-5的骨巨细胞瘤病例,则采取广泛边沿切除骶2以远部分,切刮近端(S1-2)部分。发生在骶骨的骨巨细胞瘤的局部复发率要远高于发生在其他部位的GCT,主要是由于解剖部位的复杂性和肿瘤在诊断前通常长得很大的缘故。骶骨的骨巨细胞瘤局部复发率高,疾病的转归也差。除了对肿瘤进行广泛边缘切除术外,其他所有治疗后的局部复发率都在40%-50%。实际的局部复发率可能会更高,因为更长时间后也可能发生复发(11,12)。发生在肢体上的骨巨细胞瘤的推荐治疗方法是扩大刮除术。对于骶骨的骨巨细胞瘤,由于希望保留骶神经的缘故,多数病例进行了病灶内边缘切除术,局部复发率可达50%以上,但对于较低平面(骶3以下)的骶骨肿瘤应该进行广泛的边缘切除,可以保留直肠和膀胱功能。最近的研究报告,对肿瘤进行病灶内边缘切除联合放疗治疗的优势与之进行单独一种治疗没有统计学差异。 这种联合治疗增加了外科治疗并发症发生率和局部放疗后引起肉瘤变的风险,而且在统计学上并没有降低局部复发率。病灶内边缘切除术和放疗后的局部复发率没有统计学差异。大剂量的放疗也不能明显地降低局部复发率(12)。对肿瘤进行广泛边缘切除术能明显降低局部复发率但要增加外科治疗并发症的发生率。对于作为外科治疗后的辅助治疗的冷冻治疗的病例数量太少,不足以进行统计学计算(15)。目前没有证据支持对骶骨骨巨细胞瘤进行肿瘤病灶内边缘切除术联合放疗。肿瘤广泛边缘切除术可能会引起骶神经损害,但由于局部复发率很低,所以仍为治疗的最好手段。在对骶骨上发生的骨巨细胞瘤的治疗,要考虑治疗后的局部复发率和外科治疗的并发症发生率等可能发生的情况,权衡利弊而选择治疗方案。(三)骶骨骨巨细胞瘤术中出血控制比较各组术中平均失血量,血管阻断组平均失血量为3278ml,非血管阻断组平均失血量为5150ml,两组比较有显著的统计学差异(P=0.006)。表明对于骶骨巨细胞瘤术前行血管阻断确实是十分必要的,可以显著减少术中的出血量,增加手术的安全性。对于各组进行复发率的比较,血管阻断组复发率明显低于非血管阻断组,两组相比较复发率有显著性差异(P<0.05),而不同阻断方式对于复发率的影响并没有显著差异。这可能与血管阻断组术中失血量少,手术视野显露清楚,有利于肿瘤的彻底切除有关。骶骨巨细胞瘤的局部复发率要远高于发生在其他部位的骨巨细胞瘤,主要是由于解剖部位的复杂性和肿瘤在诊断前通常长得很大的缘故。此外,骶骨巨细胞瘤多位于高位骶骨,术中为尽量保护双侧骶3以上神经根,故采用切刮术较多。因为肿瘤血运丰富,术中出血很多,造成手术局部显露不清,不易彻底刮除肿瘤。Turcotte报告的26个GCT病例中(5),平均术中失血量为7500ml, 局部复发率53.8%(14/26)。血管阻断后术中失血量少,手术视野显露清楚,有利于肿瘤的彻底切除。临床证据表明控制术中出血是完全切除肿瘤、降低复发率的重要措施。根据我们的临床资料,通过对于不同手术方式复发率的Kaplan-Meier曲线分析我们发现,骶骨巨细胞瘤的复发绝大多数在术后6个月以内,这就提示我们肿瘤的复发与术中残留病灶难以彻底清除有关,降低术中出血量有助于提高手术彻底性,提高治愈率。目前传统上的控制术中出血的方法主要有两类,一类是术中行前路切口,结扎患侧髂内动脉,临时阻断腹主动脉,这样可以有效的控制术中出血。第二类是术前行血管造影,选择性单侧或双侧髂内动脉及肿瘤供血血管栓塞。根椐我们的经验,多数情况下,单纯栓塞后术中控制出血效果不满意。我们应用血管造影技术,在行髂内动脉栓塞的同时,在腹主动脉预先留置球囊,当术中出血较多时,通过向球囊内注入生理盐水打起球囊临时阻断腹主动脉,可以起到与前路手术阻断腹主动脉同样的控制出血效果,同时显著缩短了手术时间。并且由于避免了前路手术分离阻断血管造成的相应并发症,提高了手术的安全性。对于骶骨肿瘤应用腹主动脉球囊行术中临时阻断作为一种新技术是有效减少术中出血的新的尝试。(四)骶骨切除后的重建问题 以往对大部分全骶骨或次全骶骨切除后的病人没有进行骶骨重建,病人术后须要较长时间的卧床,依靠手术瘢痕限制脊柱的下沉。 多数病人能够直立行走, 对脊柱的稳定性没有很大影响。 近年来,脊柱内固定器械发展很快, 因而,许多医生对于全骶骨或次全骶骨切除后的病人进行了内固定手术,重建脊柱骶骨的稳定性(14)。病人可以早期下床活动,没有由于脊柱不稳而产生的神经根症状。 但是, 骶骨部位的内固定手术也存在许多并发症, 由于骶骨切除后, 局部留有很大空腔,背侧没有肌肉层,只留有一层皮瓣覆盖, 因而, 容易出现局部积液, 甚至感染。 如果局部出现感染,内固定器械就必须取出。 本组35例骶骨巨细胞瘤病例中,对29例患者采用了钉棒系统进行了腰骶部的重建内固定手术。 其中, 有1例病人因术后伤口感染,不得已于术后二个月取出了内固定器械。对于高位骶骨切除或双侧骶髂关节切除的病人, 应进行了内固定,重建脊柱骶骨的稳定性。但一定要考虑到伤口感染的可能性。对于保留骶1,2或骶髂关节完整的病人, 无须进行骶骨重建。随访中, 未见钉棒系统松动的病例。应用钉棒系统重建髂骨肿瘤切除后缺损的优点在于,固定确实、坚强,术后早期承重,术后一周即可下地进行功能锻炼。参考文献:1 CDM. Fletcher, KK. Unni and F. Mertens. Pathology and Genetics of Tumors of Soft Tissue and Bone. WHO, 2002, p309-313.2 F. Schajowicz. Tumors and Tumorlike Lesions of Bone. 2nd edition. Springer-Verlag, 1996, p257-295.3 KK. Unni. Dahlin’s Bone Tumors. 5th Edition. Lippincott-Raven, 1996, p263-289.4 Guo W, Xu W, Huvos AG, et al. Comparative frequency of bone sarcomas among different racial groups. Chin Med J(English Ed) , 1999, 112: 1101-1104. 5 Turcotte RE, Sim FH, and Unni KK. Giant Cell Tumor of the Sacrum. Clin Orthop, 1993, 291: 215-221.6 JC. Cheng, JO. Johnston. Giant-cell tumor of bone: prognosis and treatment of pulmonary metastases. Clin Orthop, 1997, 338: 205-214.7 M. Campanacci. Bone and Soft Tissue Tumors. 2nd edition. Springer-Verlag, 1999, p99-136. 8 Smith J, Wixon D, and Watson RC. Giant-cell tumor of the sacrum: Clinical and radiologic features in 13 patients. J Can Assoc Radiol, 1979, 30:34.9 Rock MG, Sim FH, Unni KK, et al. Secondary malignant giant-cell tumor of bone: Clinicopathological assessment of nineteen patients. J Bone Joint Surg, 1986, 68A:1073.10 Dahlin DC and Unni KK: Bone Tumors: General Aspects and Data on 8542 Cases,ed.4. Springfield, Illinois, Charles C Thomas, 1986, p119-140.11 McDonald DJ, Sim FH, Mcleod RA, et al. Giant-cell tumor of bone. J Bone Joint Surg, 1986, 68A:235.12 Leggon RE, Zlotecki R, Reith J, et al. Giant Cell Tumor of the Pelvis and Sacrum. Clin Orthop, 2004, 423:196-20713 Biagini R, Demitri S, Orsini U, et al. Giant Cell Tumor of the Sacrum. Proceedings of the 10th International Symposium on Limb Salvage 51, 1999.14 Doita M, Harada T, Iguchi T, rt al. Total Sacrectomy and Reconstruction for Sacral Tumors. Spine, 2003, 28:E296-E301.15 Marcove RC, Sheth DS, Brien EW, et al. Conservative surgery for giant cell tumors of the sacrum: The role of cryosurgery as a supplement to curettage and partial excision. Cancer, 1994, 74: 1253-1260.
唐顺 主任医师 北京大学人民医院 骨肿瘤科6344人已读





