郑炳鑫医生的科普号
- 精选 【国内领先】全股骨组配式假体治疗长节段受累的股骨恶性肿瘤
病例简介患者:单某,男,67岁主诉:左髋部肿物术后1年余,复发半年余现病史:患者1年余前左髋部出现一肿物,伴进行性酸痛不适,活动无力。患者于外院穿刺示软骨肉瘤,遂行左股骨头置换术。半年前感左髋部再次肿胀疼痛,活动障碍,行检查提示肿瘤复发。今为行进一步治疗来我院,门诊以“肢体肿物”收入院。目前诊断:肢体肿物(左髋部)术前讨论:患者内生软骨瘤病累及多骨,局部恶变为软骨肉瘤,尤其整个股骨受累,以股骨近段为著,第一次外院手术前已发生病理性骨折,当地行手术治疗后肿瘤局部复发,形成巨大软组织肿块,且患侧大腿因行动困难,肌肉萎缩明显。相比于初次手术,此次手术整体难度及挑战性较大。根据患者目前病情,制定手术方案:一、整个股骨长节段受累,近段形成巨大包块,远段髓腔内肿瘤已突入膝关节腔内,具备全股骨切除指征,拟利用组配式全股骨假体完成骨重建;二、股骨近段肿瘤浸润髋关节周围肌群,肿瘤整块切除后缺乏软组织覆盖,假体极易脱位,且大腿肌肉废用性萎缩明显,拟利用LARS人工韧带重建髋关节囊及周围肌群,完成软组织重建。术前检查MRI:左侧髋关节见人工关节。左侧股骨大转子骨质破坏,周围团状长T1长T2信号影,邻近软组织间隙片状水肿,截面大小约120mm×160mm×119mm,考虑软骨肉瘤可能性大。CT:左侧股骨头及股骨干走行区可见人工关节影伴放射状伪影。大转子区域骨质破坏,周围见软组织肿块及条片状钙质密度影。假体设计组配式的全股骨假体,术中可以根据患者股骨长度选择不同长度的组件完成组配肿瘤切除术中仔细分离出股血管神经束及坐骨神经,完整切除股骨肿瘤!术后照片病例总结股骨是原发恶性骨肿瘤的好发部位之一,也是骨转移癌的好发部位,亦会受到周围软组织肉瘤的累及。股骨恶性肿瘤切除后骨缺损的重建方式多种多样,包括假体重建、异体骨重建、自体骨/异体骨-假体复合体重建、钢板-假体复合体、自体骨重建、关节融合等。其中假体重建为应用最广的重建方式,其重建操作简便,可在重建后恢复一定的关节功能。全股骨置换术是股骨恶性肿瘤保肢的重要手术方式之一。当股骨受到肿瘤的广泛侵袭时,该术式可以在切除肿瘤的同时重建股骨的完整性,避免了髋关节离断或半骨盆截肢,同时让患者更早地恢复负重和行走功能,提高患者生存质量。此类手术目前仅见于国内为数不多的骨肿瘤中心。近年来青大附院骨肿瘤科已常规开展各类肿瘤型关节假体置换手术,涵盖髋关节、膝关节、肩关节、肘关节等恶性骨肿瘤常见发病位置,包括全肱骨肿瘤切除+全肱骨假体置换、全股骨肿瘤切除+全股骨假体置换等。术前完整评估患者肿瘤切除范围,联合应用3D打印技术,实现术中精准化截骨,个体化适配假体,在保证肿瘤切除边界的前提下尽可能保留患肢功能。同时针对儿童青少年患者,利用可延长假体和保留对侧骨骺的假体技术,解决儿童恶性骨肿瘤的保肢难题,极大改善了患者的生存质量,延长了患者的生存期,为广大胶东半岛的骨与软组织肿瘤患者提供更好的医疗服务。
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科383人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科383人已读 - 精选 【医学科普】关于骨转移,你不得不知道的那些事
骨转移是恶性肿瘤常见并发症之一,几乎所有癌症到了晚期都会发生骨转移。一旦发生骨转移,坚持常规的抗肿瘤治疗固然重要,患者还必须及时启动骨保护治疗,以预防或改善可能产生的骨相关事件(Skeletal Related events,SREs)。青岛大学附属医院骨肿瘤科郑炳鑫01预防和治疗骨相关事件(SREs)是晚期骨转移患者的主要治疗目标之一骨相关事件(Skeletal Related events,SREs)是指在恶性肿瘤骨转移或骨病患者中,由于疾病进展带来的一系列骨骼并发症总和,包括以下四种:病理性骨折、脊髓压迫、骨骼手术和骨骼放射性治疗。病理性骨折是由于恶性肿瘤细胞侵蚀骨骼导致的骨折。除了疼痛,这种骨折还会导致严重的损伤和残疾,是晚期癌症患者最常见的SREs类型。脊髓压迫是由于脊髓受到肿瘤压迫,出现的一系列神经压迫甚至肢体瘫痪、大小便功能障碍的严重症状。骨骼手术可有效解决癌症骨转移造成骨强度下降、病理性骨折及肿瘤压迫神经的问题,并可减轻疼痛、恢复肢体功能。它既是一种治疗方式,也是一种SRE。放疗是对骨转移瘤进行姑息性治疗的有效方法,具有较明显的止痛效果。它既是一种治疗方式,也是一种SRE。骨相关事件还会引发并发症,如骨痛、病理性骨折、高钙血症、疼痛等症状,脊椎转移甚至还可能导致脊髓压迫乃至截瘫1。SREs不仅降低患者的生活质量、限制行动能力,同时还可能增加治疗费用,严重的情况还会增加死亡风险,缩短生存时间,对患者情绪和生活质量带来极大的影响。真实世界显示,未使用骨改良药物干预的骨转移患者,平均每人每年会发生多次SREs,其中肺癌等实体肿瘤患者平均每人每年发生6.5次2。因此,2020年《中华肿瘤杂志》公布的一项骨转移专家共识指出,预防或延缓SREs发生、改善生活质量、恢复功能、延长生存期是骨转移综合治疗的主要目标3。02把握骨转移确诊后3个月的黄金治疗时间 越早治疗越多获益ESMO指南工作组建议在骨转移诊断后应立即开始骨改良药物治疗,以延缓骨转移引发的首次和随后的骨相关事件4。一项回顾性研究纳入2008年1月至2015年3月MarketSacn数据库中47000余例病例,分析显示,约30-40%的实体肿瘤骨转移患者在确诊后三个月内至少发生一次骨相关事件。不同实体肿瘤骨转移患者三个月内SRE发生率略有不同,肺癌、乳腺癌和前列腺癌分别达到41%,30%和23%5。另一项关键研究表明,骨转移确诊后3个月以内启动预防治疗的患者SRE发生率仅4%,3个月以后启动治疗的发生率是42.3%,两者相差10倍6。如果患者发生过至少一种SREs,那么他发生其他SREs的风险将成倍增加7,大大降低了患者的生活质量和功能,因此骨转移后尽早治疗是有效预防SREs的关键。03创新机制的骨靶向药物带来更多生存获益目前全球各大指南和专家推荐的骨保护药物主要有地舒单抗和双膦酸盐8-10。双膦酸盐类药物为骨吸收抑制剂,是焦膦酸盐分子的稳定类似物,其特征为含有P-C-P基团,临床可用于骨质疏松症、高钙血症、骨痛及骨相关事件(SREs)等。常用的双膦酸盐包括唑来膦酸等,唑来膦酸具有一定的肾脏毒性,随着治疗时间的延长,肾脏毒性会逐渐加重,可能会导致治疗的中断。地舒单抗(安加维)是目前首个且唯一的骨靶向药——RANKL抑制剂。2020年11月,国家药品监督管理局(NMPA)批准了地舒单抗用于预防实体瘤骨转移和多发性骨髓瘤中的SREs。为什么要抑制RANKL呢?首先要了解一下RANKL是什么。我们的骨骼里面有两种重要的细胞,成骨细胞和破骨细胞,成骨细胞负责新骨形成,破骨细胞负责骨分解与吸收。RANKL是由成骨细胞分泌的蛋白,可与破骨细胞前体、成熟的破骨细胞表面的RANK受体结合。二者结合可以启动和诱导破骨细胞的分化与成熟,发挥骨吸收作用。正常情况下,两者维持着动态平衡。肿瘤细胞会促进成骨细胞过度释放RANKL,加速了骨质的溶解,释放促成肿瘤细胞生长的细胞因子。这一恶性循环的过程不仅加速了骨质破坏的过程,还促进了骨转移瘤的进一步增殖。地舒单抗通过与RANKL结合,从而阻断RANKL激活破骨细胞及其前体表面的受体RANK,抑制破骨细胞的形成、功能和存活,达到抑制肿瘤生长和减少骨质破坏的目的。多项研究证实,相比唑来膦酸,地舒单抗能够有效延缓患者首次和随后发生SREs的时间,降低SREs的发生风险11、12。同时地舒单抗组也能显著延缓中重度疼痛的出现,在乳腺癌骨转移患者中推迟了9.7个月13,在去势抵抗型前列腺癌骨转移患者中推迟了8.3个月14,在其他实体瘤组中推迟了5.6个月。安全性方面,地舒单抗组的肾脏损害、急性期反应、疼痛等相关不良反应低于唑来膦酸组。尤其对于肾功能有损伤的患者,地舒单抗不通过肾脏代谢,治疗无需减量,从而最大化治疗获益。04即使更换抗肿瘤治疗方案,骨改良药物建议继续持续规律使用根据地舒单抗注射液的药代动力学研究,地舒单抗需要每28天注射一次,以更好地预防SREs15。一项纳入60例接受地舒单抗治疗的患者的回顾性、队列研究研究表明,每隔31-56天皮下注射一次地舒单抗的患者相比每隔27-30天皮下注射一次的患者,SREs发生率翻倍16。此外,专家指出,骨改良药物治疗应和分类治疗原则指导下抗肿瘤治疗联合使用,即使在骨以外病灶进展而更换抗肿瘤治疗方案的时候,仍然维持。目前,关于在单个或少数骨转移病灶已经获得良好控制的前提下是否可停用骨改良药物,依据尚不充分。05总结肿瘤骨转移患者应提升对SREs的重视。很简单,记住六个字:及早,规律,长期。一旦确诊骨转移应尽早治疗,并持续规律用药,对骨骼进行全程保护,从而拥有更长的生存期和更高的生活质量。参考文献:1.路阳.中华医学信息导报, 2005, 20(006):16-16.2.Alison Stopecka, et al, JOURNAL OF MEDICAL ECONOMICS, 2020, VOL. 23, NO. 1,37-473.中国结直肠癌骨转移多学科综合治疗专家共识(2020版)[J].中华肿瘤杂志,2020,42(06):433-437.4.Coleman R, et al. Ann Oncol. 2014;25 Suppl 3:iii124-37.5.Debajyoti Bhowmik, et al.Curr Med Res Opin . 2019 Mar;35(3):513-523.6.Yunpeng Yang, YuxiangMa, et al. Chin J Cancer.2016; 35: 40.7.Kaminski et al. J Clin Onco 2004,90: Abstract 857.8.中华医学会骨科学分会骨肿瘤学组.中国医学前沿杂志(电子版),2010,02(2):65-73.9.江泽飞,陈佳艺,牛晓辉,等.中华医学杂志,2015,95(4):241-247.10.Coleman R, Hadji P, Body J-J, et al.Annals of Oncology. 2020;31(12):1650-1663.11.Stopeck AT,Lipton A, Body JJ, et al. J Clin Oncol 2010;28:5132-9.12.FizaziK,Carducci M, Smith M, et al. Lancet 2011;377:813-22.13.Stopeck AT, Lipton A, Body JJ, et al. J Clin Oncol 2010;28:5132-9.14.FizaziK, Carducci M, Smith M, et al. Lancet 2011;377:813-22.15.安加维(地舒单抗注射液)说明书.16.Kettle JK,et al. J Oncol Pharm Pract. 2018;24(5):343-347.
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科1.2万人已读 - 精选 青岛大学附属医院骨肿瘤科简介
青岛大学附属医院骨肿瘤科郑炳鑫 青岛大学附属医院骨肿瘤科郑炳鑫 青大附院骨肿瘤科是我院国家级临床重点专科——骨科六大专业之一,是从事骨与软组织良恶性肿瘤综合治疗的专业科室,于2016年正式成立。成立后于青岛市医学会骨科学分会下创立了骨肿瘤专业学组,搭建了青岛市骨肿瘤专业学术交流、发展的平台。近年来,在医院大力支持及科室带头人岳斌主任的带领下,青大附院骨肿瘤科在青岛市及胶东半岛地区已颇具影响力,逐渐成为青岛市及胶东半岛地区广大骨肿瘤患者首选的就诊科室,促进了青岛市及周边地区骨肿瘤患者的规范化精准治疗。目前我院骨肿瘤科是青岛市医学会骨肿瘤学组主任委员单位。 骨肿瘤团队成员目前包括副主任医师1名,主治医师3名,均为毕业于海内外知名高校的医学博士。每年门诊诊治各类骨与软组织肿瘤患者1000余人次,年手术量达400余例。建科以来已完成各类骨肿瘤手术2000余例,其中包括各类高危风险的颈、胸椎肿瘤及复杂骶骨/骨盆肿瘤的手术切除功能重建。 目前我科主要以各类原发良、恶性骨肿瘤、软组织肿瘤以及骨转移癌的外科手术治疗为主。自专科成立以来,我科先后开展多项复杂骨肿瘤手术:包括骨与软组织肉瘤的新辅助化疗+肿瘤根治性切除保肢重建+术后放化疗、基因检测联合靶向药物治疗等规范化综合性治疗;利用计算机三维重建系统术中精确切除高风险脊柱(颈、胸、腰、骶椎及椎管内)肿瘤、骨盆肿瘤并重建中轴稳定性及功能;精确切除肢体肿瘤进行肿瘤髋、膝、肩、肘关节置换;全肱骨置换、节段性假体置换、3D打印假体重建等保肢手术等。此外,还熟练掌握软组织肉瘤的间室切除、根治性切除,并辅以术中射频灭活有效降低肿瘤复发率等一系列骨肿瘤专业技术。 我科牵头成立骨与软组织肿瘤MDT(多学科会诊)团队,组建了以骨科为核心的,包含影像科、病理科、肿瘤内科、放疗科、介入科等相关专业的专家团队,定期开展疑难病例讨论,为胶东半岛骨与软组织肿瘤疑难疾病的诊疗提供新的平台和希望。目前建立青岛市首个骨与软组织肿瘤生物标本库,积极开展骨肿瘤的临床和基础研究,承担及参与多项国家级、省部级课题,发表SCI论文20余篇。 2016年3月,我院聘请北京大学人民医院郭卫教授(国际著名骨肿瘤专家,国际保肢学会前任主席、亚太地区骨肿瘤学会前任主席、中华医学会骨科学会骨肿瘤学组前任组长、中华医学会肿瘤学会骨肿瘤学组组长)为名誉主任及客座教授,目前指导我科团队开展复杂骨肿瘤手术,促进了骨肿瘤科的专业发展及学术交流,使科室发展迈上了新的台阶。目前科室已初具规模,现有病床10张,科室负责人岳斌主任目前担任青岛市医学会骨科学分会骨肿瘤学组主任委员、青岛市医学会骨科学分会副主任委员,处于青岛市及胶东半岛地区骨肿瘤外科专业的领导地位。 全科医护人员正齐心协力,为解除骨肿瘤病人病痛而不懈努力!病房位置:青大附院崂山院区2号楼7楼骨肿瘤科门诊信息:周一上午、周三上午、周四上午(崂山院区)周二上午(西海岸院区)周三上午(市南院区)预约挂号:1.电话预约:全天候24小时客服电话96166(青岛市外拨打0532-96166)2.自助机预约:门诊楼自助机(方法:在自助机上点击预约挂号预约的科室预约日期预约的专家就诊的时间段确认预约预约成功打印预约凭证)3.网站预约:https://yuyue.qdyy.cn:8081/4.APP预约:应用市场下载“掌上青医”,完善个人信息,按提示预约挂号5.微信预约:微信添加公众号“青大附院”并关注。或扫描二维码添加关注。6.支付宝预约:支付宝钱包中添加服务窗“青岛大学附属医院”并关注。或扫描二维码添加关注。7.官方微信公众号:微信直接搜索“青岛市骨与软组织肿瘤诊疗平台”并关注。或扫描下方二维码添加关注。
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科3078人已读 - 精选 骨肿瘤科郑炳鑫博士荣获2019CSCO“最具潜力青年肿瘤医师”、“最佳人气奖”
近日,第22届全国临床肿瘤学大会暨2019年CSCO学术年会在厦门召开,这一肿瘤领域一年一度的盛事在今年共吸引了3万余名国内外肿瘤领域的专家学者共赴厦门参会。本届大会的主题为“创新精准研究、探索智慧医疗”,影响巨大而广泛。我院崂山院区骨肿瘤科郑炳鑫博士在2019CSCO优秀青年肿瘤医师风采展示活动中荣获“最具潜力青年肿瘤医师”、“最佳人气奖”。 该活动旨在为优秀青年肿瘤医生搭建展示风采的平台,提供与CSCO名医互动交流的机会,提高青年肿瘤医生各项技能,帮助青年肿瘤医生成长。此次活动全面升级,分不同专项单元,包括专业技能(内科、外科、放疗等方向)、学术科研、患教科普、基层服务、姑息宁养等方向,分开进行展示PK,最终经过两轮技能PK赛、一轮线上CSCO名医指导打分、一轮网络投票等环节决出最终结果,全面展示了我院青年肿瘤医师的风采及扎实的专业水平。
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科2765人已读 - 医学科普 【医学科普】关于上皮样肉瘤,你需要了解的那些知识
概述上皮样肉瘤(epithelioidsarcoma,ES)是一种少见的、组织起源未定的软组织恶性肿瘤。1970年由Enzinger首次命名,因瘤细胞具有上皮样形态并表达某些上皮标记而得名。1997年Guillou又根据肿瘤发生部位的不同,命名了近端型上皮样肉瘤(proximaltypevariant),经典的上皮样肉瘤也被称作远端型(distal typevariant)。近端型与远端型(经典型)在组织学特征和生物学行为等方面有着很大的差异。上皮样肉瘤在软组织肉瘤中发生率小于1%,美国报道ES的发病率为4.1/1000万。中外文献大部分为个案报道,少有大宗病例分析。因此,发病率很低,临床及病理医师对其认识欠缺,导致误诊、误治非常常见。由于上皮样肉瘤病早期缺乏明显症状,且进展缓慢,因此容易被忽视。手术切除是上皮样肉瘤的主要治疗方式,但手术后容易复发,化放疗效果不佳,往往导致较差预后。近年来,致病机制的进展和分子靶向药的出现给疾病的治疗提供一定帮助。临床表现远端型(经典型)上皮样肉瘤好发于中青年,年龄为10—35岁。主要发病部位在四肢,以手部或前臂最多见,其次为膝关节周围、臀、下肢或足部。临床表现表现为无痛性缓慢生长的的单发质硬结,主要位于真皮、皮下组织或深部软组织,结节表面可出现破溃、出血和坏死。可与肌腱、神经或骨膜粘连,可延神经束或血管生长和浸润,引起引起疼痛或压迫症状。近端型上皮样肉瘤在发病年龄和生物学行为方面和经典型有明显的差异。多见于中老年,主要发病部位在骨盆、会阴和生殖器,通常表现为深部多发的软组织肿块,可体积较大引起压迫症状,可侵犯深部组织,当侵蚀淋巴管或血管时,可引起远隔淋巴结或肺转移。对比经典型上皮样肉瘤,近端型侵袭性更强,恶性程度更高,更易早期复发和转移。上皮样肉瘤局部生长相对缓慢,但容易发生淋巴结和远处转移,特别是近端型,早期切除后仍容易复发转移。近年来研究报道:初次就诊为M0的患者,经过手术等综合治疗,随访5年的远处转移发生率也高达33%。最常见的远处转移部位为肺,可以表现为双肺结节、气胸、胸腔积液、双肺囊泡等,易误诊。病理学特点上皮样肉瘤发病率低,临床表现不具特异性,因此极易误诊和漏诊。病理是诊断上皮样肉瘤的重要标准。远端型上皮样肉瘤低倍镜下表现为肿瘤结节状弥漫性生长,中央有明显坏死;高倍镜下可以见到嗜酸性上皮样细胞和梭形细胞两种形态。近端型上皮样肉瘤的肿瘤细胞主要由上皮样细胞构成,细胞体积较大,异形明显,核呈空泡状,常有横纹肌样细胞的特征,可见肿瘤性坏死。近端型和远端型在免疫组织化学检测上表现基本相同。ES具有间叶和上皮双向分化的特点,因此上皮标记(如CK、EMA)和间叶标记(如Vimentin、CD34)常同时阳性,但ES一般不表达CD68、CD31、S100、HMB-45和Desmin。INI阴性是诊断ES的有力证据,但需要与恶性横纹肌样瘤进行鉴别。肿瘤标记物CA125在上皮样肉瘤病例中阳性表达率高,可作为诊断和检测此病的有效指标,对于判断肿瘤疗效评估和随访观察具有重要的临床意义。常见阳性EMAKLICKI9CAMVimetin CD34CK7常见阴性S-100desminFil-1CK20CEAHMB-45SMA LCACD31INI鉴别诊断上皮样肉瘤因为疾病特点和表现,极易误诊和漏诊,因此,鉴别诊断非常重要。1.上皮肉瘤样血管内皮细胞瘤:与上皮样肉瘤的主要诊断区别为病理检测可以发现胞质内空泡,细胞核异型性不明显,且缺少坏死。肿瘤细胞表达CD31、FLl-1,而不表达CD34。上皮肉瘤样血管内皮细胞瘤缺少远处转移,预后较好。2. 上皮样恶性周围神经鞘膜瘤:其临床表现常伴发神经症状,如麻痹、疼痛、肌肉功能障碍。肿瘤与周围界限清楚,不侵犯表皮组织。病理诊断光镜下可见梭形细胞,伴间质黏液变;电镜下显示神经细胞特征性的雪旺细胞分化。免疫组化表达PGP9.5、S-100蛋白、Vim、NSE和NF,不表达CK。3.无色素型恶性黑色素瘤肿瘤多累及表皮和黏膜,免疫组化表达HMB-45、S-100,以上在上皮样肉瘤成阴性表达;黑色素瘤不表达CK,且在电镜下可发现黑色素小体。4.多形性横纹肌肉瘤该肿瘤好发年龄50-60岁,一般只发生于下肢深部软组织,临床表现为快速发展的疼痛性肿块,由未分化圆形至梭形细胞及胞质明显嗜酸的梭形、蝌蚪形和球拍样多边形细胞构成,瘤细胞表达MyoD、desmin,不表达CK和EMA。5.滑膜肉瘤滑膜肉瘤大多发生于下肢大关节附近,如膝关节。其中双相性滑膜肉瘤有上皮样成分,但镜下可见梭形细胞成分。近端型上皮样肉瘤多数缺少梭形细胞成分,可鉴别。但是,单相上皮样滑膜肉瘤及上皮样肉瘤伴经典型特征时,鉴别相对困难,常导致混淆和误诊。免疫组化有助于鉴别。滑膜肉瘤弥漫表达Bcl-2,部分表达CD99、CD56,一般不表达CD34。单相上皮样滑膜肉瘤可出现CK阳性表达,但是比较近端性上皮样肉瘤,相对局限。6.上皮样组织细胞瘤为一种少见的良性纤维组织细胞瘤,与近端型上皮样肉瘤鉴别,肿瘤表浅,主要位于真皮层,呈膨胀性生长,境界清楚。组织学细胞分布均匀,大小一致,镜下可鉴别。7.低分化鳞癌和腺癌原发性癌可与表皮及皮下附属组织存在关联,呈鳞状细胞或腺样分化。免疫组化vimentin、CD34阴性表达,可作为鉴别。转移性癌可与表皮及皮下附属组织无关联,鉴别主要依赖免疫组化,vimentin、CD34阴性表达及临床上存在原发病灶。另外,vimentin阳性的癌为肉瘤样癌,可见梭形细胞成分有助鉴别。8.其他此外,多形性横纹肌肉瘤、上皮样平滑肌肉瘤、上皮样间皮瘤、间变性大细胞淋巴瘤等,也需与上皮样肉瘤进行鉴别。免疫组化检测MyoDl、CDll7、MSA、SMA、desmin、calretinin、CK5/6和CIM5等多数阴性表达有助于鉴别。治疗1.手术治疗手术行肿瘤切除是上皮样肉瘤的首选治疗方法。综合肿瘤的大小、部位、淋巴结转移和患者的意愿等情况,可选择局部切除、扩大切除、淋巴结清扫和截肢等术式。对比切除范围和重建效果满意的保肢手术,截肢并不能提高总生存率。但如果出现局部切除不完整、边界肿瘤残余等,肿瘤复发率和转移率均会增加。另外,肿瘤出现复发后,再次手术切除仍然是行之有效的治疗方法。2.化疗上皮样肉瘤易发生转移,当出现远处淋巴或血性转移,化疗被认为是主要治疗方式。目前公认有效的化疗方案中,蒽环类药物单用或联合异环磷酰胺治疗晚期上皮样肉瘤有效。另外,吉西他滨联合多西他赛同样对上皮样肉瘤治疗有一定疗效。3.放疗对于手术边界难以保证或不可切除的上皮样肉瘤,可考虑进行放疗作为辅助治疗手段。4.靶向治疗目前针对上皮样肉瘤的靶向药尚在研究和实验阶段:首先,血管内皮生长因子受体(VEGFR)抑制药,作为目前已应用于多数软组织肉瘤二线治疗的靶向药物,如帕唑帕尼、安罗替尼等,被报道对上皮样肉瘤治疗有效。根据分子机制,INll基因缺失的上皮样肉瘤存在P13K/AKT/mToR、c-MET信号通路的活化,可尝试应用mTOR抑制药单药或联合c-MET抑制药治疗。EGFR酪氨酸激酶抑制药和mTOR抑制药联合也可尝试作为靶向治疗选择。通过抑制组蛋白去乙酰化酶,调节蛋白的乙酰化水平,达到调控基因表达的目的,进而抑制肿瘤细胞增殖、诱导凋亡。因此,各类组蛋白去乙酰化酶抑制药可尝试进行治疗选择。另外,有研究报道发现Tazemetostat对上皮样肉瘤治疗有效,其作用机制为阻滞甲基化转移酶EZH2的活性,从而抑制肿瘤生长。目前是FDA批准的首种用于治疗上皮样肉瘤的药物。预后上皮样肉瘤的总体5年生存率为60%~75%。其中处于局限期,年龄相对较小,可手术达到完整切除的上皮样肉瘤患者,预后相对较好;发生了淋巴结或远处转移的患者,总体预后较差。总结综上,上皮样肉瘤是一种罕见的恶性肿瘤,临床表现不典型,预后相对一般。有远端型和近端型之分,远端型好发于青壮年,近端型好发于中老年。上皮样肉瘤需与多种肿瘤进行鉴别诊断,其中病理检测和免疫组化可助于鉴别。INI基因失活是ES的重要发病机制,同时包括其他一些分子或信号通路机制。肿瘤早期以手术治疗为主,但术后容易复发,中晚期可以考虑化疗、放疗和靶向治疗。【参考文献】EnzingerFM.Epithelioidsarcoma:asarcomasimulatingagranulomaoracarcinoma. Cancer,1970,2:26.HenryB.Armah,AnilV.Parwani. EpithelioidSarcoma. ArchPatholLabMed. 2009,133(5):814-9.NoemiSimeone,AnnaMariaFrezza, NadiaZaffaroni, SilviaStacchiotti.Tazemetostatforadvancedepithelioidsarcoma:currentstatusandfutureperspectives.FutureOncol. 2021,17(10):1253-1263.AsanoN, YoshidaA, OguraK, etal. Prognosticvalueofrelevantclinicopathologicvariablesinepithelioidsarcoma:amulti-institutionalretrospectivestudyof44patients. AnnSurgOncol,2015,22(8):2624-2632.IrimuraS,NishimotoK,KikutaK,eta1.Successfultreatmentwithpazopanibformultiplelungmetastasesofinguinalepithelioidsarcoma:acasereport.Oncol, 2015, 8(3):378-384.GuillouL,KanekoY.EpithelioidSarcoma[A].FletcherCDM,UnniKK,MerfensF.WorldHealthOrganizationclassificationoftumours,Pathologyandgeneticsoftumoursofsofttissueandbone[M].Lyon:IARCPress,2002:205-207.deVisscherSA,vanGinkelRJ.WobbesT.eta1.Epithelioidsalvoma:stillanonlysurgicallycurabledisease[J].Cancer,2006,107:606—612.JawadMU,ExteinJ,MinES,eta1.Prognosticfactorsforsurvivalinpatientswithepithelioidsarcoma:441casesfromtheSEERdatabase[J].ClinOrthopRelatRes,2009,467(11):2939-2948.HasegawaT,MatsunoY,ShimodaT,eta1.Proximal-typeepithelioldsarcoma:aclinicopathologicstudyof20cases[J],ModPathol,2001,14(7):655—663.LevyA,LeP&houxC,TerrierP,eta1.Epithelioidsarcoma:needforamultimodalapproachtomaximizethechancesofcurativeconservativetreatment[J].AnnSurgOncol,2014,21(1):269-276.JeonSY,YhimHY,LeeNR.Epithelioidsarcomawithspontaneouspneumothoraxandmassivepleuraleffusion[J].KoreanJInternMed,2016,31(1):191—193.KohashiK,YamadaY,HotokebuchiY,eta1.ERGandSALL4expressionsinSMARCBl/INll-deficienttumors:ausefultoolfordistinguishingepithelioidsalvomafrommalignantrhabdoidtumor[J].HumPathol,2015,46(2):225-230.JonesRL,ConstantinidouA,OlmosD,eta1.Roleofpalliativechemotherapyinadvancedepithelioidsarcoma[J].AmJClinOncol,2012,35(4):351-357.PinkD,RichterS,GerdesS,eta1.Gemcitabineanddoeetaxelforepithelioidsarcoma:resultsfromaretrospective,multi—Institutionalanalysis[J].Oncology,2014,87(2):95—103.ImuraY,YasuiH,OutaniH,eta1.CombinedtargetingofmTORandc—METsignalingpathwaysforeffectivemanagementofepithelioidsarcoma[J].MolCancer,2014,13:185.XieX,GhadimiMP,YoungED,eta1.CombiningEGFRandmTORblockadeforthetreatmentofepithelioidsarcoma[J].ClinCancerRes,2011,17(18):5901.5912.LopezG,SongY,LamR,eta1.HDACinhibitionforthetreatmentofepithelioidsarcoma:novelcrosstalkbetweenepigeneticcom.
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科341人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科341人已读 - 医学科普 【医学科普】基因检测在骨与软组织肿瘤诊断与治疗中的应用和意义
骨与软组织肿瘤属罕见肿瘤,恶性骨肿瘤仅占所有恶性肿瘤的0.2%,软组织肉瘤在成人恶性实体瘤中所占比例也不足1%。肉瘤亚型多、恶性程度高、预后差,临床诊治难度巨大。肉瘤的治疗基本为扩大切除手术辅以放疗的局部治疗以及蒽环类为基础的化疗。但是,经过治疗后仍有高达40%的肉瘤患者会发生转移,发生转移的肉瘤患者总体生存率为12-18个月。近年来,骨与软组织肿瘤分子遗传学发展十分迅速。随着新的分子检测手段的开展和应用,基于特定基因异常的新病种也在不断涌现,以往一些分化不明或未分化的肿瘤经过分子检测也得到了重新认识,骨与软组织肿瘤分类的基础正在从形态学分类转向分子分类。二代基因测序(nextgenerationsequencing,NGS),又称为高通量测序技术,能一次对几十万至几百万条DNA序列片段/读长进行测序分析,从而识别基因变异。通过分析基因变异、肿瘤突变负荷(tumormutationalburden,TMB)及微卫星不稳定(microsatelliteinstability,MSI)状态等特征,NGS可以提示与化疗、靶向和免疫治疗的相关信息,并根据患者基因检测结果寻找匹配的FDA(美国食品药品监督管理总局)批准药物和临床试验药物,从而辅助临床制定治疗方案。因此,分子遗传学检测的发展不仅在临床病理诊断中起到了重要作用,在临床个性化治疗方案制定和肿瘤生物学行为预测等方面也发挥了重要价值、提供了新的思路。一、NGS在骨与软组织肿瘤诊断中的意义骨与软组织肿瘤的病理诊断基于传统的形态学观察,辅以免疫组织化学(immunohistochemistry,IHC)标记方法。荧光原位杂交(fluorescenceinsituhybridization,FISH)和基因突变检测(一代测序)为骨与软组织肿瘤的病理诊断提供了极大帮助,部分通过细胞和分子遗传学研究发现的基因变异成为广泛应用的分子诊断指标。随着分子检测技术的不断开展和推广,以NGS为代表的新型检测技术在骨与软组织肿瘤的诊治和预后判断中将会发挥越来越重要的作用。1.推荐常规病理学检查不能明确诊断的骨与软组织肿瘤患者进行NGS检测临床实践中,部分骨与软组织肿瘤难以通过IHC、FISH等常规病理检查确诊,此时需要借助NGS检测来鉴别是否存在分子遗传学异常,从而辅助病理诊断。例如一部分骨与软组织小圆细胞未分化肉瘤和某些共表达CD34和S-100蛋白的梭形细胞肿瘤,通过常规病理学手段难以做出明确的诊断,但通过NGS检测可发现这些非常相似的肿瘤分别发生了基因重排,即可采用基因名称进行命名诊断。另外,基因突变不明的肿瘤诊断,NGS检测效率明显优于FISH。2.推荐常规分子学检测结果为阴性的骨与软组织肿瘤患者使用(DNA+RNA)NGS技术或平台进行复检传统基因检测方法因实用性高和单次检测成本较低而广泛应用于临床,但也存在一些技术缺陷和临床应用局限。相比之下,NGS检测在技术和临床诊疗中具有一定优势:1)可以同时涵盖数百个基因,检测范围更广;2)同时检测所有位点的多种变异类型,避免遗漏某些变异类型,可为初诊患者提供完整的精准分型及治疗策略指导;3)可以评估肿瘤突变负荷(tumormutationburden,TMB)和微卫星不稳定性(microsatelliteinstability,MSI)等免疫治疗相关的分子标志物;4)避免单基因检测带来的样本耗竭和时间延误,可以快速地为后续评估提供依据。因此,建议传统检测为阴性的样本使用NGS复检。当患者出现疾病进展时,可再次进行全面的基因检测,有助于发现潜在的耐药机制和新的标靶,为下一步治疗方案的选择提供依据。二、NGS在骨与软组织肿瘤治疗中的意义1.靶向治疗——推荐考虑接受特异性靶向治疗的骨与软组织肿瘤患者,通过NGS技术或平台验证靶向药物相关的基因或潜在基因恶性骨与软组织肿瘤化疗进展后治疗手段较局限,近年来靶向药物的疗效逐步在肉瘤的临床试验与实践中得到了验证,部分药物获批适应证,部分药物被指南推荐,部分药物仍在临床试验阶段。靶向治疗通常用于不可切除或晚期骨与软组织肿瘤的二线治疗,但特定的靶向药物可以考虑用于特定类型不可切除或晚期骨与软组织肿瘤的一线治疗。鉴于肉瘤病理的复杂性,临床在使用此类特异性的靶向药物之前有必要行NGS检测进行靶点基因验证,如NTRK抑制剂被批准应用于NTRK基因融合的肉瘤;EZH2抑制剂被批准应用于上皮样肉瘤,在其他INI1基因缺失的肉瘤临床试验中也取得一定疗效;CDK4/6抑制剂在去分化脂肪肉瘤临床试验中取得了一定疗效;ALK抑制剂可用于ALK融合阳性的炎性肌纤维母细胞瘤;PDGFR抑制剂对隆突性皮肤纤维肉瘤有效。对于无有效或者更好治疗手段的进展期肉瘤患者,可尝试通过NGS检测寻找潜在的药物靶点,在取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据对靶点阳性的患者进行治疗。2. 免疫治疗——推荐进展期骨与软组织肿瘤患者,分别采用IHC和NGS检测PD-L1(programmeddeath-ligand1,程序性死亡因子配体1)、MSI、TMB等免疫治疗相关分子标志物,根据结果辅助免疫治疗随着免疫检查点抑制剂在多种肿瘤中被证实有效,免疫治疗在软组织肉瘤中的应用也日益得到重视。一项关于晚期骨与软组织肉瘤的亚型扩展试验发现,帕博利珠单抗治疗未分化多形性肉瘤和去分化脂肪肉瘤的ORR(overallresponsesrate,总客观缓解率)分别达到23%和10%,提示帕博利珠单抗在未分化多形性肉瘤治疗方面具有一定临床疗效。纳武利尤单抗单用治疗转移性肉瘤的ORR仅为5%,但联用伊匹单抗后ORR增至16%,提示纳武利尤单抗联合伊匹单抗可能在某些肉瘤亚型治疗方面具有一定潜力。而寻找合适的分子标志物有助于指导分子亚型分类,筛选优势人群,从而使肉瘤免疫治疗更加精准。目前,临床常用的免疫检查点抑制剂生物标志物包括PD-L1高表达、错配修复基因缺陷(mismatchrepair-deficient,dMMR)/微卫星高度不稳定性(microsatelliteinstability-high,MSI-H)和高肿瘤突变负荷(tumormutationburden-high,TMB-H)。PD-L1仅在部分肿瘤适应证中作为使用特定药物的临床分子标志物。有研究发现,PD-L1的表达与PD-1单抗治疗软组织肉瘤的疗效之间也没有明确的关系。dMMR/MSI-H、TMB-H是获得FDA批准、不限组织学类型的免疫治疗生物标志物,具有此类改变的患者将有可能从免疫治疗中获益。骨与软组织肿瘤中位TMB偏低(<5mutations/mb),但仍有约5%肉瘤患者具有高TMB(TMB≥10mutations/mb),且分布于多个亚型中。MSI-H在肉瘤患者中的发生频率非常低(0.78%),对肉瘤免疫治疗的指导意义尚需大规模、前瞻性的研究证实。结合临床实际情况,对进展期骨与软组织肿瘤患者,可采用NGS大panel(>300基因)检测MSI、TMB等免疫治疗相关的分子标志物,部分患者可参考检测结果选择免疫治疗。难以获取即时标本的进展期患者,应慎重选择既往样本的检测结果作为参考。3.试验性治疗——推荐既往治疗失败且无有效替代方案的骨与软组织肿瘤患者进行NGS检测,以寻找匹配的临床试验机会目前,靶向或免疫治疗在骨与软组织肿瘤中的应用较为有限。除骨巨细胞瘤、胃肠道间质瘤和炎性肌纤维母细胞瘤等,其余多数肿瘤的靶向或免疫治疗仍处于临床试验阶段。对于无标准治疗的进展期肉瘤患者,可尝试通过NGS检测寻找潜在的药物靶点,靶点阳性但无相应药物适应证的患者可能获得参加临床试验的机会。目前,正在进行临床试验的药物包括MDM2抑制剂(milademetan)、CDK4/6抑制剂(palbociclib、abemaciclib)、mTOR抑制剂(sirolimus)、PARP抑制剂(olaparib、niraparib、talazoparib)、EZH2抑制剂(tazemetostat)等。随着新的临床试验不断开展,患者可能得到更多的治疗机会。总结与其他实体肿瘤相比,骨与软组织肿瘤的诊断和治疗更具挑战性,且药物开发进展缓慢,复发难治性骨与软组织肿瘤的药物选择更为有限,大多数尚处于临床试验阶段。NGS技术的规范应用将为骨与软组织肿瘤患者个体精准诊疗奠定基础。相信随着科学技术的进一步发展,相关管理监督机制的日臻完善,NGS的临床实践将会越来越规范化,也将在骨与软组织肿瘤临床诊疗中发挥更加重要的作用。主要内容摘自中国抗癌协会肉瘤专业委员会2021年版骨与软组织肿瘤二代测序中国专家共识
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科77人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科77人已读 - 典型病例 【典型病例】骶骨巨大神经鞘瘤外科手术1例
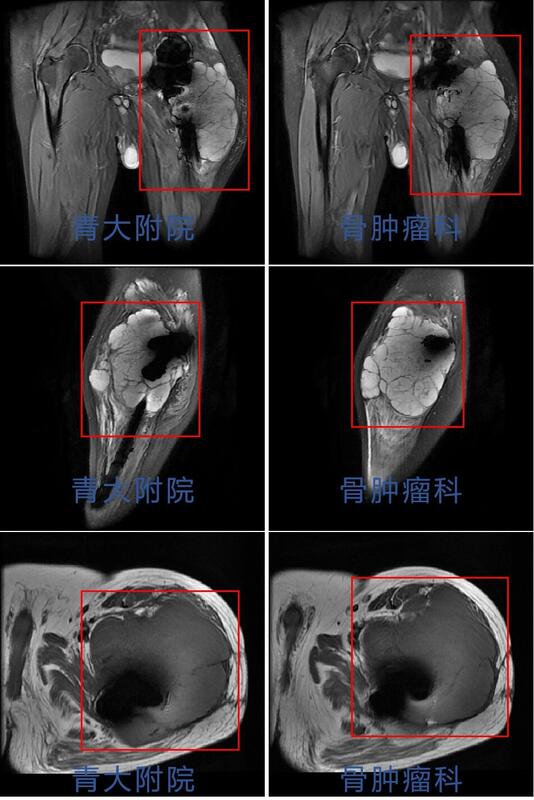
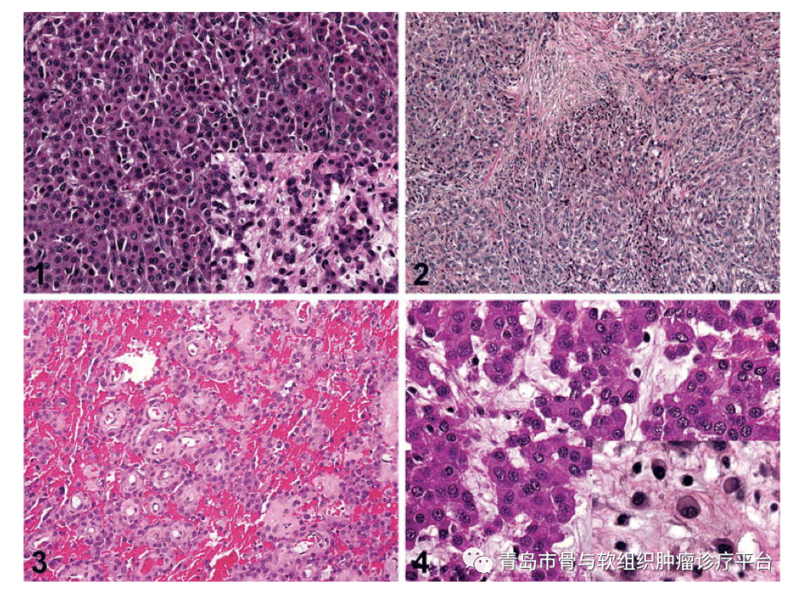
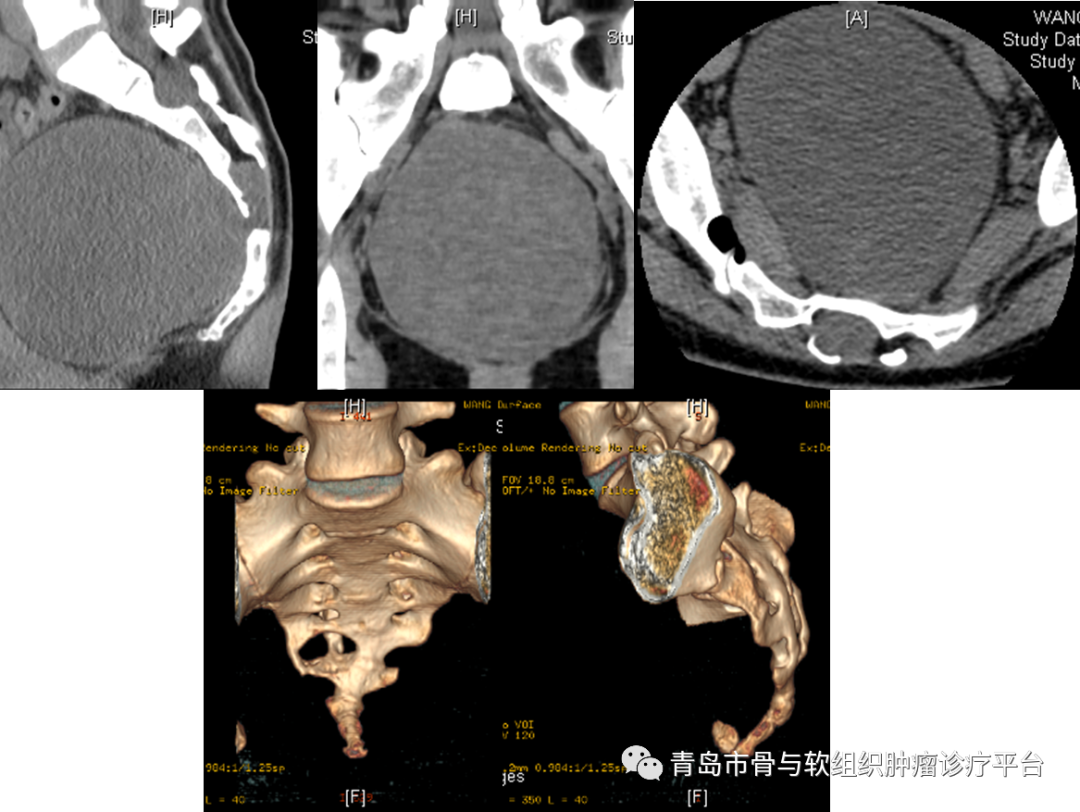
病例简介患者王某某,女性,27岁。主诉:发现骶尾部肿物4月余。现病史:发现骶尾部肿物4月余,无疼痛不适,大小便功能正常,会阴区无明显麻木不适。外院行骶尾部MR示:骶管内及骶椎前占位,脊索瘤?神经源性肿瘤?为求进一步治疗就诊于我院,门诊以“骶尾部肿物”收治入院,患者自患病以来,精神可,饮食睡眠可,大小便未见明显异常,体重未见明显变化。查体:双下肢活动及感觉可,双侧伸髋、屈髋、伸膝、屈膝活动可。骶尾部无明显压痛、叩击痛,会阴区无明显麻木不适。目前诊断:骶尾部占位性病变术前检查术前骶尾部T2相MRI平扫术前骶尾部MRI增强平扫术前骶尾部CT三维成像术前讨论1. 骶前巨大肿瘤,考虑为脊索瘤或神经鞘瘤可能大。切除过程中使用超声骨刀行骶骨截骨,有效降低术中出血风险。2. 术中需要充分保护双侧S3神经根,降低术后患者出现大小便功能异常的风险。术后关注患者大小便功能,早期康复锻炼。3. 骶前区有一层松散的组织,尽量使用钝性分离直肠,避免出现不必要的损伤。4.手术切除后存在较大空腔,感染风险较大。术前需要进行预防性使用抗生素,术前12h行清洁灌肠。术后关注引流情况。手术过程术后病理肉眼所见:灰白结节样物一枚,带部分骨组织,结节大小1110.79.5cm,距骨断端1.5cm,骨组织大小107.22cm,切面灰白灰黄质稍韧,部分呈胶冻样,包膜完整。病理诊断:(骶骨肿瘤)神经鞘瘤(大小1110.79.5cm),部分区域水肿、退变,局灶区域边界欠清,侵及骨组织,建议密切随访复查。免疫组化结果:S-100(+),SOX10(+),CK(-),Brachyury(-),H3K27Me3(+,表达未缺失),Ki-67(+,2%),Desmin(-),INI-1(+,表达未缺失),CD34(部分+),EMA(-)。病例总结涉及骶骨的肿瘤主要包括原发性和转移性肿瘤。转移性肿瘤较原发性肿瘤更常见。最常见的良性骶骨肿瘤是巨细胞瘤。最常见的原发性骶骨恶性肿瘤是脊索瘤,其次是软骨肉瘤。神经鞘瘤起源于神经,但其临床上与其他骶骨肿瘤类似,治疗方法也相同,被归类为骶骨肿瘤。骶骨是神经源性肿瘤的好发部位之一,绝大多数为良性周围神经鞘瘤。术前完善的影像学检查和实验室检查十分必要。被忽视的周围神经鞘瘤后期可能发展到非常巨大,导致盆腔器官功能障碍。大多数良性周围神经鞘瘤可以接受保留功能的保守手术切除治疗。需要密切关注肿瘤复发情况,必要时进行大剂量放疗控制肿瘤生长。对于恶性周围神经鞘瘤,多由神经纤维瘤病恶化而来。治疗方法包括放疗和整块手术切除。慢性神经压迫引起的慢性、钝性、下背部或尾部疼痛是骶骨肿瘤最常见的症状之一。肿瘤压迫可能导致肠道或泌尿系统习惯改变。骶骨下段肿瘤体积足够大时,直肠指诊可以触及其前部。对于较大的骶骨肿瘤,如脊索瘤和软骨肉瘤,臀部可能出现巨大肿块。高度恶性肿瘤的患者剧烈疼痛可能持续数周,行走困难,出现强迫体位等。骶骨肿瘤外科手术前需要完善影像学检查:包括平片、CT、MRI、血管造影。必要时PET-CT检查。术前需要明确切除范围,精准切除,尽可能多保留骶神经,以降低术后出现大小便功能异常的风险。Todd等研究证实,双侧S3神经保留的患者中,正常的肠和膀胱功能分别保持在100%和69%。骶骨手术术后出现的并发症包括:术中失血、感染、伤口问题(包括切口感染、皮肤或肌肉坏死、伤口愈合不良等)、直肠损伤、神经损伤(肿瘤较大时需关注坐骨神经)、脑脊液漏等。因此术前需要进行根据肿瘤范围大小,考虑术前12-24h行动脉栓塞或球囊植入,降低出血风险。术中可行控制性降压和控制性低温,以减少术中出血。术前24h预防性使用抗生素,术前12h行清洁灌肠,降低术后感染风险。近年来,青大附院骨肿瘤团队目前已常规开展各类骶骨肿瘤切除手术,大多数患者围手术期出血少,术后预后良好,目前也已经成为我科特色诊疗技术之一。
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科299人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科299人已读 - 典型病例 【典型病例】可延长肿瘤型膝关节假体治疗儿童股骨远段骨肉瘤
病例简介患者:陈某,男,3岁。主诉:发现左股骨肿瘤4月余。现病史:患者于4月余前因步行跛脚发现左股骨肿瘤,活动及行走受限,伴疼痛,活动后疼痛加剧。行穿刺活检提示骨肉瘤,PET-CT提示左侧股骨下端溶骨性骨质破坏,代谢增高,SUVmax约9.0,考虑骨原发恶性肿瘤,骨肉瘤可能性大,余处未见明显肿瘤。后于我院行2周期顺铂、吡柔比星、甲氨蝶呤化疗,现为行手术治疗,门诊以“左股骨骨肉瘤”收治入院。目前诊断:左股骨骨肉瘤术前讨论:患者术前化疗效果良好,肿瘤大小及水肿范围较化疗前改善,具备保肢指征。患儿年龄小,仍处于生长发育期,骨骺线未闭合,传统的保肢关节置换手术必然带来肢体不等长及步态异常,需使用可延长的肿瘤型假体,同时尽量保留胫骨侧骨骺。手术方案:根据肿瘤截骨范围,设计3D打印的股骨远段假体,使用可延长设计,同时保留胫骨侧骨骺,最大程度保护患者的患肢生长潜能,同时股骨和胫骨髓针生物喷涂设计。术前检查MRI提示左侧股骨下段干骺端和部分相邻骨骺可见混杂长T1、长T2异常信号影,范围约48mm×84mm×24mm。病变范围较之前MR缩小。三维CT提示:左侧股骨下段干骺端和部分相邻骨骺溶骨性骨质破坏,伴斑片斑点状骨质硬化,范围约36mm×79mm×18mm,破坏区内骨硬化较之前CT明显增多,周围软组织肿块较前明显缩小,近乎消失。假体设计股骨侧假体可延长设计,同时股骨和胫骨髓针生物喷涂设计肿瘤切除术后照片病例总结膝关节周围,包括股骨下端和胫骨上端,是骨肉瘤的好发部位。近年来新辅助化疗的应用,提高了骨肉瘤患者的5年生存率,保肢治疗成为外科治疗的主流,但由于儿童青少年正处于生长发育期,骨骼未成熟,股骨下端和/或胫骨上端恶性肿瘤切除时连同骨骺一起切除,由此造成的肢体不等长及肢体功能障碍等问题一直困扰着患者及家属。儿童及青少年正处于生长发育阶段,膝关节周围骨骺的生长占下肢身高发育长度的70%,在生长发育高峰(男性14~16岁,女性12~14岁)前,切除股骨下端或胫骨上端骺板会使患者每年丧失约10~16mm的生长长度。因此,对于少年儿童骨肿瘤患者切除膝关节后,随着生存期逐渐延长必然会引起严重的肢体不等长。对于肿瘤距骺板尚有一段安全距离的病例,也最好选择保留骨骺的自体、异体骨移植或骨延长等方法进行生物学重建。但对于无法安全保留骺板的病例,就必须进行复杂而多样的保肢重建治疗。对于骨骼尚未发育成熟的儿童膝关节骨肉瘤患者,关节重建不仅仅是肿瘤切除假体植入,更重要的是在于使患肢具有与健侧肢体以同样速度延长的能力。可延长式假体是专为儿童骨肿瘤患者设计的重建假体,通过机械作用延长假体,代替患侧骨骺生长,且对侧未受累关节面使用细柄生物固定假体(对骨骺生长影响很小),这样可以解决部分肢体不等长的问题。近年来,青大附院骨肿瘤科已完成大量3D打印适配性假体置换手术,涵盖了肩肘关节、髋膝关节等,利用个性化3D打印假体,术中精准化截骨,在保证肿瘤切除边界的前提下尽可能保留患肢功能,极大改善了患者的生存质量,延长了患者的生存期。同时针对儿童青少年患者,利用可延长假体和保留对侧骨骺的假体技术,解决儿童骨肿瘤的保肢难题,目前已成为我科的特色医疗技术之一。
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科120人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科120人已读 - 典型病例 【典型病例】带髓针绞锁螺钉的肿瘤型髋关节假体治疗股骨近端恶性肿瘤
病例简介患者:陈某,男,28岁。主诉:左大腿痛半年,加重40余天。现病史:患者半年前活动后感左大腿痛,持续性发作,后症状有所缓解,主要位于大腿内侧,40余天前摔倒后上述症状加重,出现左侧髋部痛,活动后加重,休息后减轻,伴膝关节活动受限,不伴下肢麻木及感觉异常,现为进一步诊治于我院就诊,左侧股骨占位穿刺活检:考虑中间性或低度恶性肿瘤。门诊以“左股骨肿瘤”收入院。目前诊断:左股骨近段肿瘤。术前讨论:患者股骨近段肿瘤明显破坏骨质,穿刺提示中间性或低度恶性肿瘤,考虑骨促结缔组织增生性纤维瘤可能性大,病理较为罕见,WHO分类中ICD编码为1(属于中间性或低度恶性肿瘤),多发于年轻人,可缓慢进展并具有侵袭性,刮除或局部手术切除有复发可能。拟行股骨瘤段切除假体重建,考虑患者年轻且体重偏大,假体髓针予以绞锁螺钉配合重建,增加假体承重抗扭转性。术前检查MRI:左侧股骨转子间至股骨中上段见膨胀性病变,呈稍短T1长T2信号影,部分骨皮质中断,周围见软组织信号影。病灶大小约95×46×48mm,与正常骨髓分界尚清,病灶周围软组织肿胀。CT:左侧股骨转子间至股骨中上段见膨胀性骨质破坏,骨皮质不连续,可见骨膜反应,与周围软组织分界不清,病灶大小约95.1×45.8×47.5mm,与正常骨髓分界欠清。左侧股骨占位穿刺活检:梭形细胞软组织肿瘤,肿瘤细胞弥漫分布,疏密不均,部分似有纤维间质,细胞形态尚温和,核分裂像少见。 免疫组化示肿瘤细胞:SATB2(-),β-Catenin部分核(+),CyclinD1部分(+),WT-1(-),TLE1部分弱(+),SS18-SSX(-),S-100(-),MyoD1(-),Myogenin(-),SMA(-),MUC-4(-),STAT6(-),H3.3G34W(-),H3K27Me3部分(+),ALK(5A4)(-)。 结合形态学及免疫组化结果,考虑中间性或低度恶性肿瘤,不能除外骨促结缔组织增生性纤维瘤。假体设计肿瘤切除肿瘤破坏股骨近段骨质,部分区域突破骨皮质,术中顺利完整切除股骨近段肿瘤。同时利用LARS韧带重建髋关节囊及周围肌群。术后照片病例总结股骨上、中段是骨原发恶性肿瘤的好发部位,约16%的尤文肉瘤、13%的软骨肉瘤和10%的成骨肉瘤发生于该部位。既往治疗股骨中、上段原发恶性和转移性肿瘤以截肢术为主。随着外科技术、重建材料及辅助性放化疗的进展,80%~90%的患者可选择保肢手术,在广泛切除肿瘤的同时获得有功能的肢体。目前,股骨肿瘤切除、人工假体置换术已成为股骨近段恶性肿瘤主要治疗方式之一。同时利用LARS韧带将髋臼周围软组织(如关节囊、髂腰肌等)在股骨颈周围拉紧缝合,加强髋关节的稳定性,防止术后脱位。同时髋外展功能重建,将臀中、小肌腱缝于股骨上段假体的粗隆部环状结构上,既有效重建了髋外展功能,也有助于防止假体脱位。近年来,青大附院骨肿瘤科已完成大量肢体恶性骨肿瘤切除+肿瘤型关节假体重建手术,其中包含各类3D打印假体置换手术,涵盖了肩肘关节、髋膝关节等,利用组配式假体或个性化3D打印假体,术中精准化截骨,在保证肿瘤切除边界的前提下尽可能保留患肢功能,极大改善了患者的生存质量,延长了患者的生存期,目前已成为我科的特色医疗技术之一。
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科83人已读
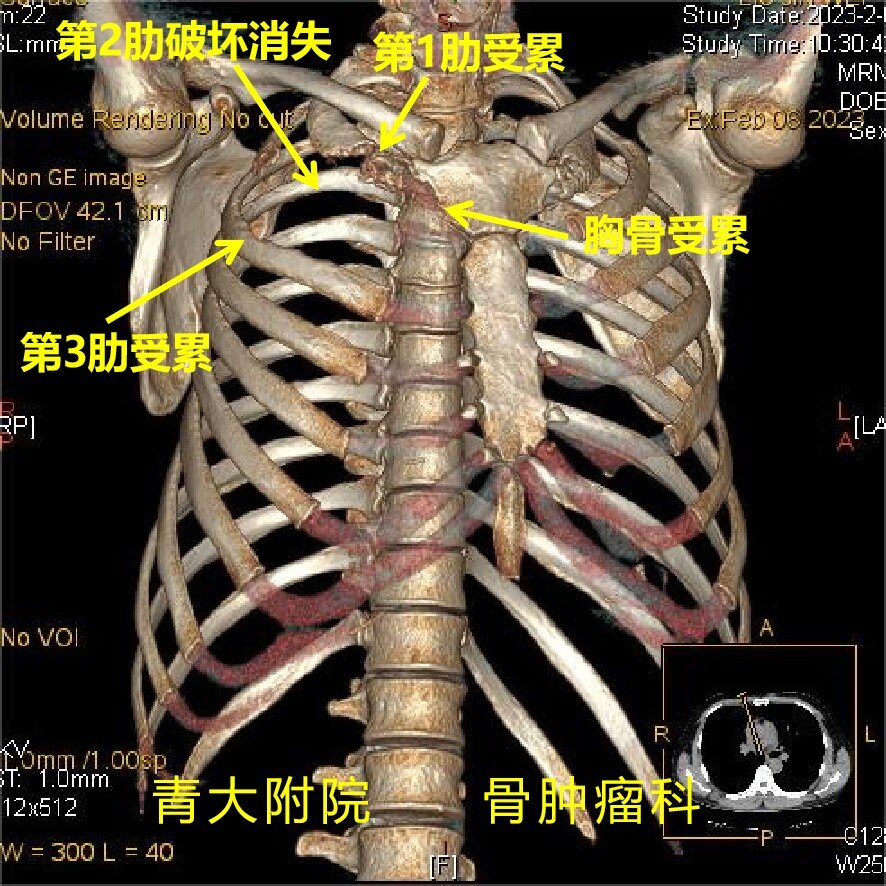
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科83人已读 - 典型病例 【团队合作】累及第1-3肋的胸壁肿瘤整块切除+胸壁重建
病例简介患者:刘某,男,45岁。主诉:右侧肩部不适6月,加重伴胸痛2月。现病史:患者6月前无明显诱因出现右侧肩部不适,伴疼痛,不伴肩关节活动受限,不伴上肢麻木,2月前上述症状加重,伴右侧胸前疼痛,不伴憋气及呼吸困难,后于我院就诊,行影像学检查发现右侧胸壁肿瘤,后行穿刺,病理结果示“梭形细胞恶性肿瘤,形态倾向肉瘤”。后于肿瘤科行术前辅助放疗和安罗替尼治疗,现为进一步诊治收入我科。目前诊断:右侧胸壁肿瘤术前讨论:患者右侧胸壁恶性肿瘤,累及第1-3肋,一方面:由于第1肋位置隐匿,前上方锁骨覆盖,显露困难,周围毗邻锁骨下血管及臂丛神经,肿瘤的切除难度风险较高,且肿瘤累及部分胸骨,术中需一并切除;另一方面:肿瘤突入胸腔,势必与胸膜及肺组织黏连难以分离,术中可能切除部分肺,需与胸外科共同完成手术,同时肿瘤切除后胸壁缺损巨大,需要牢靠的重建胸壁。拟行胸壁肿瘤整块切除+LARS韧带胸壁重建。术前检查胸部增强CT:右上前胸壁见团块状软组织密度影,密度较均匀,不均匀强化,边界较清,大小约89mm×58mm×60mm,边界较清,累及右侧第1-3前肋,可见骨质破坏,第二肋前段消失。体积较前部分减小。胸部MR:右侧前胸壁可见团块状混杂T1混杂T2信号影,大小约85mm×56mm×65mm,右侧第2前肋骨质明显破坏,第3前肋局部骨质破坏。术前设计肿瘤切除手术在胸外科、麻醉科、手术室等兄弟科室的保驾护航下顺利完成。术中由骨肿瘤科岳斌主任、胸外科徐林浩主任完成右侧胸壁(第1-3肋+部分胸骨)及部分累及的肺组织一期完整切除,同时利用LARS人工韧带重建胸壁缺损,未出现并发症!术后病理:(右胸壁)恶性肿瘤,意见为恶性间皮瘤(局限性,肉瘤样,大小874cm),肿瘤侵犯肋骨,部分区域与肺膜粘连,但未侵至肺实质未累及骨断端及肺断端。免疫组化结果:CK(-),WT-1(灶+),Calretinin(+),D2-40(+),Brg1(+,未缺失),CD34(-),STAT6(-),MUC-4(-),SATB2(弱+),S-100(-),Desmin(-),GATA3(-)。病例总结胸壁肿瘤可为良性或恶性,可原发于胸壁,也可源于原发性肺肿瘤或转移病灶的直接扩张,原发性胸膜恶性肿瘤也可侵犯胸壁。胸壁肿瘤切除术是对外科医生具有挑战的手术,尤其颈胸交界处的胸壁肿瘤,周围重要的血管神经众多,深面毗邻胸腔内重要脏器,可能导致严重的术后肺功能不全、血管神经损伤等。约55%的胸壁肿瘤为恶性,包括软骨肉瘤、恶性纤维瘤、恶性间皮瘤等。胸壁原发恶性肿瘤通常需行局部扩大切除术,肿瘤的整块切除可提高患者无进展生存率和总生存率。本例患者中肿瘤位于胸前壁,肿瘤体积较大,侵犯三根肋骨及部分胸骨。我们选择使用LARS人工韧带重建胸壁缺损。LARS(LigamentAdvancedReinforcementSystem)是一种人工合成的韧带增强及重建材料,其设计依据“仿生学原理”,内部结构与人体正常的韧带纤维结构相似,关节内的纵形纤维有弹性但不会被拉长,有强大的抗疲劳能力并允许人体细胞长入,从而达到修复重建的目的。本例手术中,我们将LARS韧带分别缝合固定到第1-3肋和胸骨残端,同时将胸壁肌肉缝合固定到Lars韧带,实现了良好的软组织覆盖,弹性并牢固的重建患者胸壁。近年来,青大附院骨肿瘤科骨肿瘤MDT模式不断推广与成熟,除了与影像科、病理科、肿瘤内科、放疗科、介入科等专业定期开展疑难病例讨论,也与胸外科、血管外科、胃肠外科、泌尿外科等兄弟科室建立联合手术模式,为胶东半岛骨与软组织肿瘤疑难疾病的诊疗提供新的平台和希望。改善了患者的生存质量,延长了患者的生存期,目前已成为我科的特色医疗技术之一。
 郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科124人已读
郑炳鑫 主治医师 青岛大学附属医院 骨肿瘤科124人已读





