李晓峰医生的科普号
- 精选 早期肺腺癌诊疗共识
【摘要】 随着胸部计算机断层扫描(computed tomography, CT)检查,尤其是低剂量薄层CT筛查项目在中国的广泛开展,越来越多的无症状肺部磨玻璃结节(ground-glass nodules, GGNs)被发现。虽然国内及国际上已发布了一系列针对肺部GGNs的指南,但是这些指南的撰写者多来自呼吸、肿瘤及影像专业,可能缺乏对现代微创胸外科的充分认识,造成外科手术在肺部GGNs诊治中的作用不明确,甚至被低估;而且,肺部肿瘤相关的各学科对于早 期肺癌,尤其是浸润前病变的处理也缺乏统一规范。因此,基于国内外现有文献及上海市肺科医院多年积累的经 验,上海市肺科医院撰写了此诊疗共识。本共识推荐对于疑似肺腺癌的GGNs进行多学科评估,依据诊断,选择合 理的处置方式。对于疑似原位腺癌,推荐进行胸部薄层CT随访,或在特定情况下进行不超过肺段切除的限制性肺切除;对于疑似微浸润腺癌,推荐进行限制性肺切除或肺叶切除;对于疑似浸润性腺癌,建议依据病灶是否含有 磨玻璃成分、位置、大小、个数及患者躯体情况选择合理的手术方式;而肺多发结节的处理原则推荐为主病灶优先,兼顾次要病灶,综合选择治疗方案。 【关键词】 肺磨玻璃结节;原位腺癌;微浸润腺癌;浸润性腺癌;外科 1 引言 近年来,随着胸部计算机断层扫描(computed tomography, CT)检查,尤其是低剂量薄层CT筛查项目在中国的广泛开展,越来越多的无症状肺部磨玻璃结 节(ground glass nodules, GGNs)被发现。其发病特点包括:以东亚裔人群最为常见,非吸烟为主的人群,女性患者,低龄化表现。 目前国内及国际上,发布了一系列针对肺部GGNs 的指南,但由于这些指南的撰写者多来自呼吸、肿瘤及影像专业,缺乏对现代微创胸外科的充分认识,因此造成现有指南对外科手术在肺部GGNs诊治中的作用不明确,甚至被低估;而且,肺部肿瘤相关的各学科对于早 期肺癌,尤其是浸润前病变的处理也缺乏统一规范。 2011年,肺腺癌新分类[1]将肺腺癌分为:浸润前病变、微浸润腺癌(minimally invasive adenocarcinoma, MIA)以及浸润性腺癌。浸润前病变分为不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)和原位腺癌 (adenocarcinoma in situ, AIS)。 本共识推荐对疑似肺腺癌的G GNs进行多学科评 估,依据诊断,选择合理的处置方式。现对于疑似AIS、 MIA、浸润性腺癌及多原发肺癌的处置原则分叙如下。 2 原位腺癌 AIS典型的影像学表现为直径大于5 mm且小于30 mm 的纯磨玻璃结节(pure ground-glass nodules, pGGN)。 pGGN,是指CT肺窗上的局灶性磨玻璃样阴影,且结节内不含能够遮挡血管或支气管结构的实性成分[2]。AIS 需要与AAH和MIA进行鉴别。小于5 mm的pGGN通常为 AAH[3],若pGGN最大径为2 mm-5 mm,其为AAH的可能 性约为97%[4];CT值小于-520 HU亦提示AAH的可能[5]。 若pGGN≥6.5 mm、边界完整[5],或CT上出现血管形态改变[6],或出现空泡征(vacuole),则AAH的可能较小。 AIS还需与MIA鉴别,若GGN出现分叶征,胸膜牵拉[7], 支气管充气征[5],通常提示MIA。GGN实性部分平均CT 值在鉴别MIA与浸润前病变(A AH/AIS)亦有重要意义,浸润前病变实性成分平均CT值为-318.1 HU,而MIA 为-194.7 HU[8]。 对首次发现的疑似AIS的GGN应进行定期随访[9]。推荐在结节首次发现后的3个月进行首次的薄层CT平扫检 查[2,10];若患者首次CT检查层厚大于3 mm,建议在1个月后复查薄层CT平扫以获得结节的基线资料[10],然后3个月后再次复查薄层CT平扫观察结节的变化情况。 随访过程中,若结节明显缩小,则考虑良性病变可能。若患者年龄小于40岁,无吸烟史及二手烟暴露史,无肺癌家族史,无肺部其他需长期随访的疾病(慢性阻塞 性肺病、肺纤维化、支气管扩张等),则无需常规随访胸部CT;其他患者推荐进行每年1次的薄层CT随访[11,12]。 若结节持续稳定存在,可视病灶形态及大小等因素继续随访。对于直径小于8 mm,CT值较低,边界模糊 的pGGN可每半年或1年随访一次;对于直径大于等于 8 mm,边界清楚的pGGN,或含有实性成分的部分实性结节(part-solid nodules),可适当缩短随访时间间隔至6个月;对于持续稳定存在的外周优势部位的疑似AIS病变,也可考虑微创外科手术切除。其依据如下:①部分 pGGN仍具有生长和恶变的可能[13,14];②亚肺叶切除即可将病灶完整切除,且不影响患者预后[15,16];③术前无需进行正电子发射型断层显像(positron emission tomography, PET-CT)、头颅磁共振、支气管镜等,术前检查简单[17,18];④术中无需进行纵隔淋巴结清扫/采样,手术创伤小[15,19];⑤手术可在一定程度上降低患者焦虑水平,改善生活质量[20]。外科手术治疗AIS也存在一定的缺点:①若患者手术后再次出现其他部位的肺部结节,可能需要再次手术,则再次手术的难度和风险有可能增加;②AIS进展到危及生命,可能需要多年,过早的手术介入,会导致过早的手术损伤,术后可能出现的长期疼痛或其他并发症,可能影响患者的生活质量,早期手术与随访择期手术相比并不能显著改善患者总体生存,但却可能使患者过早的承受手术的风险及术后疼痛;③术前的AIS的诊断依赖影像学判断,缺乏病理支持,对术前判断的AIS进行手术,术后可能证实为AAH或良性病变。所以,对于稳定存在的AIS应当进行胸部薄层CT随访,仅当同时满足以下4个条件时,可考虑对患者进行外科手术治疗:①对于结节诊断AIS的准确性较高(MDT讨论或结节直径≥8mm且边界清楚的pGGN);②结节位于外周或优势段,行楔形切除、亚肺段或肺段切除可完整切除病灶;③随访过程中,患者存在明显的焦虑症状,影响生活质量;④患者无影响其生命的其他系统的严重基础疾病,预期寿命超过10年,且不伴有其他恶性肿瘤。 若结节随访过程中出现体积增大,或实性成分增多,考虑疾病进展为MIA或浸润性腺癌时,应考虑及时外科介入。AIS的处理流程如图1所示。 【肺科共识——原位腺癌】 术前随访 可疑AIS患者,术前至少随访1次,且距首次发现间隔3个月以上。 术前检查 术前推荐薄层胸部CT平扫,无需行头颅磁共振、全身骨扫描、气管镜、胸部CT增强、PET/CT或经皮肺穿刺检查。 手术指征 1.长期随访,结节持续存在; 2.对于结节诊断AIS的准确性较高(MDT讨论或结节直径 ≥8 mm且边界清楚的pGGN); 3.结节位于外周或优势段,行楔形切除、亚肺段或肺段 切除可完整切除病灶; 4.随访过程中,患者存在明显的焦虑症状,影响生活质量; 5.随访中,结节明显增大或密度变实; 6.患者不伴有影响其生命的其他系统的严重基础疾病, 或其他恶性肿瘤,患者的预期寿命超过10年。 手术原则与手术切除范围 1.如病灶位于周边“优势部位”:行肺楔形切除; 2.如病灶位置较深,但仍位于某一个肺段内:行亚肺段或肺段切除; 3.病灶处于多个肺段之间或支气管根部,切除需要联合肺段切除或肺叶切除者,不推荐或慎重选择手术; 4.手术切缘应符合基本肿瘤学原则; 5.术中冰冻病理结果决定是否需要扩大切除及淋巴结清 扫。 淋巴结清扫范围 术中无需淋巴结清扫或采样。 术后辅助治疗 术后不需要放疗、化疗或靶向治疗。 预后 完全切除后肿瘤学预后良好,5年生存率可达100%。 术后随访 如无明显残余病灶,AIS术后可每年复查一次胸部CT平 扫,不必复查头颅磁共振、全身骨扫描、气管镜或血肿瘤标志物。 3 微浸润腺癌 MIA是一类早期肺腺癌(≤3 cm),主要以贴壁方 式生长,且病灶中任一浸润病变的最大直径≤5 mm,不伴有浸润胸膜、血管、淋巴管或肿瘤性坏死[1]。其在影 像学上多数表现为pGGN,也有部分表现为部分实性结节,极少数表现为实性结节。在Lee等[21]的研究中,三类影像表现的比例分别为53.8%、42.3%和3.8%。在pGGN中,结节的直径及特殊影像征象的有无决定结节的浸润 性。持续存在的,直径≥10 mm的pGGN是MIA的一个CT 特征[22],其CT值约为(-536.2±113.1)HU[8]。分叶征、 胸膜牵拉[7]和支气管充气征[5]的出现可作为MIA与AAH/ AIS鉴别的要点。而对于部分实性结节,根据其内实性成 分的比例来区分浸润前病变(AIS/MIA)和浸润性腺癌 至关重要。MIA的实性成分最大径一般小于5 mm[23-26], 实性面积占比总面积(consolidationtotumor ratio, C/T) -472 HU则提示为浸润性肺癌[40]。同时,患者 年龄(55岁-74岁)、吸烟史(>30年包、或戒烟年限
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科3128人已读 - 精选 肺部磨玻璃结节丨处理原则和共识及手术技巧
随着肺癌CT筛查的普及,肺部磨玻璃结节(ground glass nodule, GGN)的检出率也逐渐增高,这一现象得到了胸外科医师的广泛关注。 肺部GGN是指CT可见边界清楚或不清楚的肺内密度增高影,其病变密度不足以掩盖其中走行的血管和支气管影。 根据影像表现肺部磨玻璃影内部成分的均匀程度不同分为无实性成分的纯GGN和包含实性成分的部分实性GGN(混杂性GGN)。 GGN可能是恶性肿瘤、良性肿瘤、炎症、肺间质性疾病或肺内淋巴结等。GGN的病理基础是肺泡隔增厚或部分肺泡腔充满液体、细胞或组织碎片。 1.GGN的影像学分级 随着肺癌筛查的应用,GGN检出增多,而GGN的影像学表现多样,因而对GGN的正确分类和描述成为肺癌筛查成功实施的重要因素。 美国放射学会根据GGN的影像表现提出了Lung-RADS分级系统: 1级:没有结节或有钙化结节; 2级:实性或亚实性结节
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2180人已读 - 周二晚8点 刘杰话肺癌
直播时间:2022年11月01日20:00主讲人:刘杰主任医师山东省公共卫生临床中心肿瘤中心
 刘杰 主任医师 山东省公共卫生临床中心 肿瘤中心2812人已读
刘杰 主任医师 山东省公共卫生临床中心 肿瘤中心2812人已读 - 医学科普 肺楔形切除、肺段切除及肺叶切除区别
肺叶是由几个肺段组成,肺叶大于肺叶 肺楔形切除 肺段切除 肺叶切除 选择何种手术方式,还要具体情况具体分析,综合考虑。
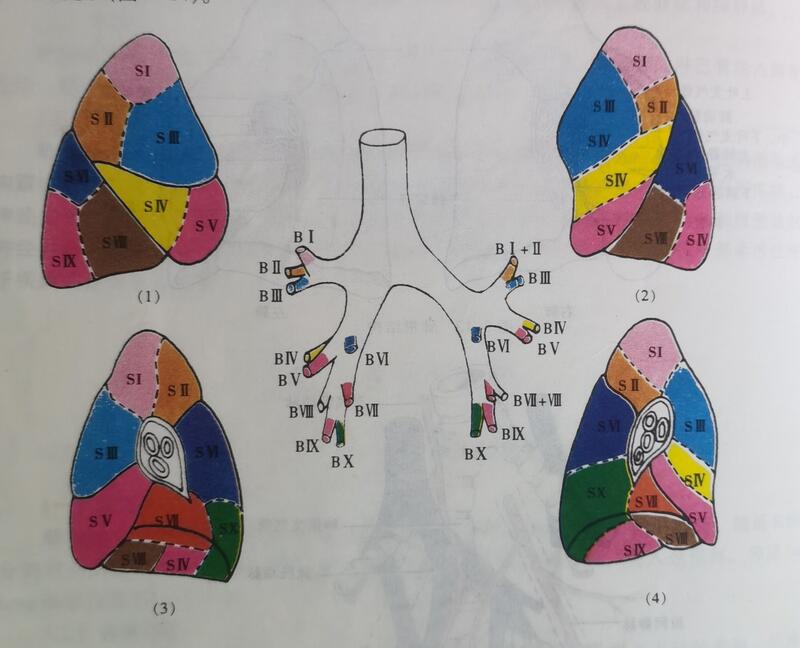 李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1.2万人已读
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1.2万人已读 - 医学科普 肺大疱?肺囊肿?注意鉴别囊腔型腺癌!
囊腔样腺癌,多超过原位癌和微浸润的的范畴,多数为浸润性腺癌。特点: 1.周边有边界清楚的磨玻璃影。 2.腔内有分隔与血管。即使周边结节影不明显,中央有分隔和血管这样的囊腔也需要密切观察,以防漏诊肺癌。 3.早期薄壁光滑型囊腔型腺癌同肺大泡等良性疾病不易区分,更容易漏诊。 下图示均为囊腔型腺癌 常见分型
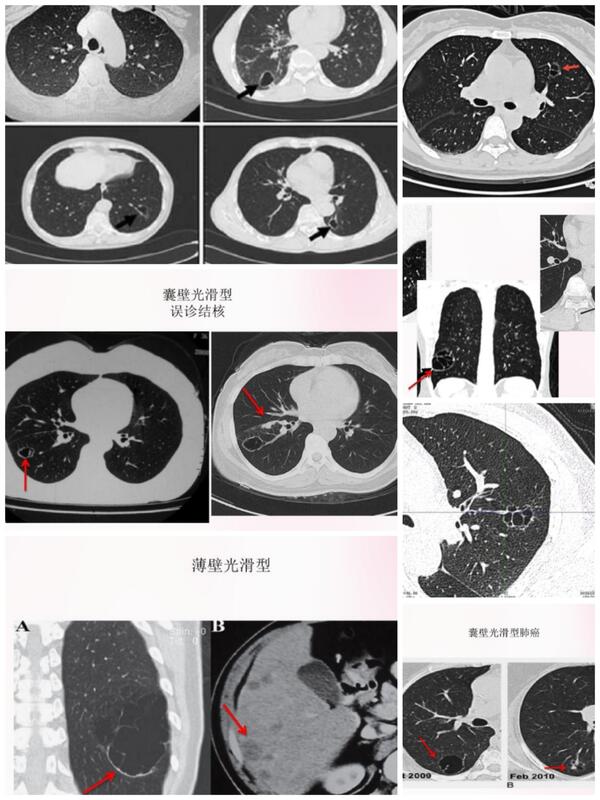 李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1187人已读
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1187人已读 - 医学科普 肺小结节手术方式的选择及相关临床试验
研究对象主要为外周型腺癌,有磨玻璃成分。试验结果可供参考,还要综合考虑慎重选择术式。 JCOG 0201(2002-2004)。非侵袭性腺癌的预测指标(特异性98.7%)。肿瘤直径≤2cm C/T值≤0.25。后续验证:非侵袭性肺腺癌患者五年生存率97.1%。C/T值0.5的周围型非小细胞肺癌,肺段切除有望取代肺叶切除。 3.(JCOG1211)研究:外周型非小细胞肺癌,根据胸部切片CT表现主病变最大直径≤3cm符合cT1N0临床分期(CTR≤50%),治疗采用肺节段切除的多中心研究非随机验证研究;主要终点5年无复发生存率;共纳入396例。这是日本癌症研究组织进行的一项小组间研究。本组结论是肺段切除是安全有效的。
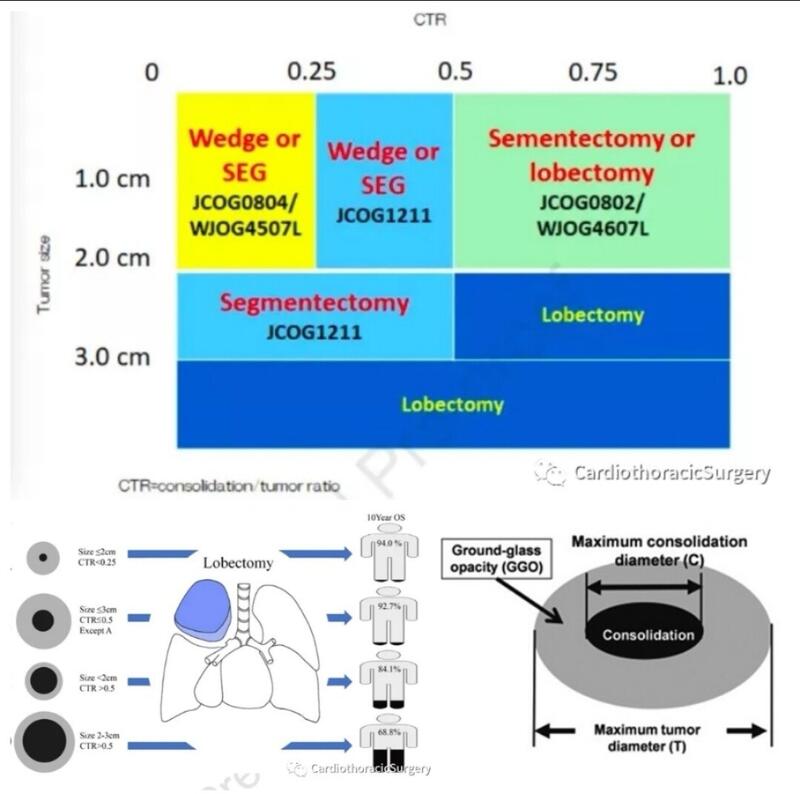 李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1596人已读
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1596人已读 - 医学科普 2021年 V1版《NCCN非小细胞肺癌临床诊治指南》更新解读
美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)根据新的临床证据,更新发布的《NCCN 非小细胞肺癌临床诊治指南》已成为全球临床医师遵循和认可的临床诊治参考。2020 年 11 月 25 日,最新的 2021 年 V1 版《NCCN 非小细胞肺癌临床诊治指南》(下文简称为《指南》)发布。相比 2020 年第 8 版《指南》有了众多更新,集中在靶向和免疫治疗进展。本文将对该版《指南》更新内容进行下列解读。 肺癌是世界范围内造成死亡最多的恶性肿瘤之一,2020 年美国新诊断肺癌 228 820 例,85% 为非小细胞肺癌(non-small cell lung cancer, NSCLC);死亡病例 135 720 例[1-2]。本文对 2021 年 V1 版《NCCN非小细胞肺癌临床诊治指南》[3](下文简称《指南》)更新内容进行下列解读。 1 评估 1.1 肺部磨玻璃结节随访 对于≥ 6 mm 的单发纯磨玻璃结节(pure ground-glass nodule,pGGN),上一版《指南》建议于第 6个月及第 12 个月进行一次 CT 随访,如果无增大或形态变化,则可每 2 年随访 1 次直至第 5 年;新版《指南》删去了可能引起混淆的“形态变化”的描述,推荐只要病灶直径不增大即可继续随访。 1.2 治疗前评估 1.2.1 非手术治疗前对病理诊断的要求 新版《指南》删去了“患者在进行任何非手术治疗之前都需要肺癌组织学诊断”的表述,因此对于采用非手术治疗的 NSCLC 患者,组织学评估不再是治疗前的必需流程;新版《指南》强调如果考虑在没有组织类型确认的情况下进行经验性治疗,则必须于治疗前进行包括放射介入科、胸外科、介入呼吸科等多学科团队(multi-disciplinary team,MDT)评估以探讨获取组织活检的可行性,如果讨论后仍认为活检风险或难度过高则可开始经验性非手术治疗。上述更新是基于 IJsseldijk 等[4]发表的 Meta 分析证实接受立体定向放疗(stereotactic body radiotherapy, SBRT)的患者中,病理活检证实的 NSCLC 患者与临床诊断患者相比,3 年总体存活率(overall survival, OS)、2 年和 5 年的肿瘤特异性存活率(cancer-specific survival)更低;但两类患者 5 年的 OS 相同[4]。这一研究强调了非手术治疗前获取病理评估的重要性,但也说明如果活检风险过高,直接放疗也是可接受的治疗方案。 1.2.2 手术前病理诊断的要求 新版《指南》新增了批注,强调在进行肺叶切除、双肺叶切除或全肺切除术之前,患者需要组织学确认的 NSCLC 诊断;而如果术前或术中组织诊断可能有风险或是结果不可靠,推荐进行多学科评估以确定最安全有效的活检方法;或就活检风险或困难太大难以达成共识,患者方可接受无组织学确认下的解剖性亚肺叶切除。这项更新强调了在亚肺叶切除或是更大范围切除术术前进行组织学评估的必要性。 1.2.3 对于 M1a 期、ⅣA 期局部治疗前排除远处转移的要求 伴有胸膜或心包侵犯所致积液的 M1a 期、ⅣA 期的晚期患者,治疗前评估至关重要。新版《指南》增加了 PET-CT 扫描(如果既往未行)、头颅磁共振成像(MRI)增强扫描和基因检测作为推荐的治疗前评估手段,以进一步排除其它远处转移。 1.2.4 对于吸烟者的手术治疗的要求 新版《指南》明确了不应单纯根据患者吸烟状态而拒行手术治疗,手术治疗是早期肺癌患者的主要治疗方案,而非上版《指南》所表述的“手术治疗提供了延长患者生存机会”。 1.2.5 对于ⅣA 期、M1b 期(包含部分具有有限数量和体积转移灶的 M1c 分期患者,适合根治性的局部治疗)患者体能状况评分(performance status,PS)的要求 由 PS 0~1、PS 2~4 两类变更为 PS 0~2、PS 3~4 两类,PS 0~2 的患者如为有限转移可考虑局部根治性疗法。 2 治疗 2.1 放疗 2.1.1 关于 SBRT 治疗早期肺癌 当前《指南》仍然支持手术切除作为可切除的早期 NSCLC 患者最成熟的治疗方法。 对不能耐受手术,且纵隔淋巴结阴性、外周 T1分期的早期肺癌患者的治疗,新版《指南》依次推荐:(1)SBRT 首选(而非前版《指南》中“包括 SBRT 等的根治性放疗”),新版《指南》相比前版明确了 SBRT 的最大容许剂量 5 疗程 50 Gy 方案并未带来高级别毒性反应;(2)如果无法接受 SBRT或根治剂量放疗,新版《指南》认为影像引导下热消融治疗(image-guided thermal ablation therapy, IGTA)为“疗效待明确的治疗方案”(而非如前版《指南》将其推荐为可选治疗方案);(3)适度低分割或剂量强化的传统分割 3D-CRT 方案是较不理想的选择,如果无法进行 SBRT,可以考虑采用。依据为 RTOG 系列前瞻性研究最新的长期随访结果:SBRT 提供了较高的 5 年局部控制率(93%)[5],主要的失败原因为区域淋巴结转移(20%)和远处转移(30%~40%)[6-8]。 2.1.2 关于局部进展期肺癌的放疗 新版《指南》特别推荐使用 PET/CT 进行局部进展 NSCLC 的放疗靶区体积规划。证据来源:Lancet Oncology 发表的一项研究证据[9],对比了 18F-FDG PET 及 CT制定计划靶区体积后选择性淋巴结区域照射(ENI)(常规计划组)和单独应用 18F-FDG PET 进行靶区体积规划,两组患者均接受了剂量递增放疗,结果发现单独应用 18F-FDG PET 进行靶区体积规划可改善局部控制率,并且不会增加同期化疗的毒性。老版《指南》建议在局部进展性 NSCLC 中优先使用累及野照射(IFIV)选择性淋巴结照射,新版《指南》新增引用了下列证据来源:Yuan 等[10]2007年发表的随机对照研究证实在 NSCLC 患者中 IFI优于 ENI,获得了更好的总体反应和局部控制,并且降低了孤立性淋巴结复发的概率。 2.1.3 关于晚期/转移性 NSCLC 的姑息性放疗 晚期/转移性 NSCLC 的姑息性治疗通常以局部放疗缓解疼痛等症状为主,然而对于姑息性放疗的剂量存在争议。本次更新中,《指南》根据最新研究证据增加了对于这类患者的推荐,12~16 Gy 的单次立体定向放疗相比标准的 10 次 30 Gy 放疗可以更好地控制疼痛反应和局部非脊柱骨转移,该疗法更适用于预期生存更长的患者[11]。 2.1.4 放疗的基本原则 新版《指南》增加了一条提醒,即在剂量集中放疗(SABR 或根治加速分割放疗)前或后使用强效血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制剂可能会累及近端支气管、肺门血管或食管,并可能导致严重毒性。研究发现,使用强效 VEGF 抑制剂贝伐单抗(Bevacizumab)或 VEGF 受体(VEGFR)抑制剂舒尼替尼(Sunitini)抑制 VEGF/ VEGFR 信号通路可能是血管损伤、内皮功能障碍和动脉粥样硬化形成、心力衰竭等事件的重要原因[12];而放疗也可能引起血管毒性,对心脏等大血管产生广泛的有害影响[12]。因此,特别对于转移性患者的治疗策略上,药物治疗和放射治疗的谨慎协调非常重要,包括强效 VEGF 抑制剂药物的选择和治疗顺序以及放射治疗的放疗剂量和分割次数。 2.1.5 影像引导下热消融治疗(IGTA)的临床应用 最后,新版《指南》新增加了一页对 IGTA 的推荐。这项更新对于 IGTA 疗法的总体原则、治疗前评估、适应证(ⅠA 期,病灶直径
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科4903人已读 - 医学科普 恶性肺结节的影像特点
下面分别讲述目前总结到的,也许还有疏漏,或一时没有想到的,不过,没有关系,以后仍可补充归纳: 浅分叶征:病灶表面凹凸不平,略不平则是浅分叶,因为肺小结多整体并不大,所以往往是浅分叶而已。形状像土豆。 蜂窝征:病灶多为实性密度或偏实性密度,但其内部有很多小空泡样,以致整体看就像蜂窝。这种病灶初期认识不够,会以为是炎症,其实现在看来,基本都是恶性的,大概是从磨玻璃病灶逐渐变实增密到实性的过程之中,有些区域还不密时,看上去像蜂窝 蝴蝶征:混合磨玻璃结节容易有这种表现,中间有收缩纠集,两边像蝴蝶的翅膀伸展开,其实是病灶有收缩力的外在表现,说明质地硬,中间密度高的部分更是密实,边缘含磨玻璃成份的相对不太密些,所以有这样的影像表现。 花朵征:病灶有浅分叶的前提下,又有血管进入,其实是浅分叶与血管征的综合,看着就像一朵花,血管就是花的枝。若是病灶缺乏分叶征,是圆形的,则像棒棒糖。 空泡征:磨玻璃病灶伴有中间小空泡或空腔时,基本上都是恶性的,好像印象中基本上没有碰到良性的。如果空泡边上的成份密度较淡,则可能是不典型增生或原位腺癌,或密度较高,则会是微浸润或浸润性腺癌。 乱石征:这个名称也是我自己想想的,病灶偏实性,就像多个小石头堆在一起,乱石堆砌的感觉。这时如果病灶的轮廓又很清晰,周围肺组织也无渗出的改变,那么极可能是恶性的。些征用在密度低的混合磨玻璃结节上也适用,其实性部分密度杂乱时也类似道理。 细毛刺征:病灶边缘不够光滑,有细毛刺,有点像杨梅或板栗表面的样子,毛刺突向正常肺组织中去,说明病灶有侵袭性,向周围浸润性生长,是恶性的征象。 囊腔征:此征与空泡征的区别时,空腔部分体积较大,大于有形部分,以致容易误诊肺大泡。它虽然看着像大泡,但它的壁明显不正常,比肺大泡的厚,有磨玻璃成份,且往往不同方向厚薄不均。记住,这不是肺大泡,是囊腔型肺癌。 毛刺征:为什么与细毛刺分开讲,因为像上图这种病灶,其毛刺较细毛刺为长,看着像尖刀刺向周边肺组织。同样代表着病灶有侵袭性,外侵性,基本有这种表现的多为浸润性癌。 胸膜凹陷征:这是老牌的肺癌恶性征象了,在磨玻璃为表现的早期肺癌中也适用。因病灶靠近胸膜,又有收缩力,导致邻近胸膜受到牵拉,以致拉向病灶侧。进胸后会发现表面胸膜皱缩纠集。 胸膜间隙征:这个名称也是我叫叫的,正规来说,应该没有这种叫法。要表达的意思是,病灶与胸膜挨的非常近,但却有极小的间隙存在,说明:1、病灶非炎症性,炎症的话,有渗出或水肿,往往离这么近的话,间隙消失了;2、说明病灶收缩力弱,一般是磨玻璃结节或实性的话,像周围型鳞癌或小细胞癌等收缩力弱的肿瘤。 血管破坏征:有时候,病灶比较小,又不适合穿刺的地方,实性,良恶性特征了不太显著,需要我们增强或重建以观察血管与病灶的关系,如果紧挨病灶的血管走行异常,被牵拉向病灶侧、被侵犯,或者血管与病灶间间隙消失,则要怀疑恶性,有血管破坏。 血管征:也叫血管集束征,直白说,就是有血管进入病灶里面去。若是单一血管进入,有时候像枝头上挂着个果实的样子。多根血管均改变自然走行,趋向病灶,说明病灶对血供需求比较旺盛,也是恶性的征象之一。 叶间胸膜凹陷征:胸膜凹陷不单只是肋胸膜,之所以单独列开来讲,是因为提醒大家,叶间胸膜也是胸膜,邻近叶间裂部位的病灶,如果对叶间裂处有牵拉,也是胸膜凹陷征 月牙铲征:这种征象也是混合磨玻璃结节中较为常见,病灶一侧是往外突的,但某一侧则明显凹向病灶内部,形成这个方向的深凹陷。以前我不知道这叫啥征,只知道有这样影像表现的基本上都是恶性的,后来才知道它有专门的名称,叫“月牙铲征”,挺好听,也有诗意的名称。 好了,目前想到的恶性影像征就总结到这儿,当然不可能一个病灶中这些特征都占齐,只要有其中的一项或二项,我们就要高度怀疑其为恶性。但愿通过我们的分享,让更多同道,也更多肺结节患者对恶性结节有更深刻的认识,尽量避免漏诊。只有不断的努力才能不断进步!只有不断的无私分享才能与大家共同进步!肺结节相对来说,是近十来年以来较新的疾病,明显改变了肺癌的疾病组成,早期肺癌的发现改写了肺癌治疗的效果,但此领域仍是比较混乱,没有形成非常统一的规范与意见,医生对肺结节的认识水平也参差不齐,只有大家共同努力,才能更好的服务于肺结节病人,期望既要尽量少误诊漏诊,也要防止过度干预、过度手术,权衡手术干预的最佳时机以及最佳的手术方式。尤其在目前多原发肺癌比例很高,检查发现的又多是早期肺癌的情况下,改变传统的“肺癌治疗的标准术式是肺叶切除加淋巴结清扫”这一理念,更加细化采用不同术式的肺结节标准,使得维护肺功能与肿瘤得到根治做到最佳平衡才是我们应该追求的。
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2479人已读 - 医学科普 磨玻璃肺结节随访观察,会不会变成肺癌?
先问大家一个问题:从磨玻璃结节,到7厘米的晚期肺癌,需要长几年?不着急回答,我们先看一个晚期病例,比较遗憾: 一位70多岁老爷子,咳嗽、咳血半个月,CT发现右肺7.0cm大肿块,病理是浸润性肺腺癌,低分化,已经无法手术。 而且肿瘤已经进入加速生长期,仅仅40天后复查,肿块以肉眼可见的速度进一步增大,很麻烦了…… 老人这个肺癌发展到7厘米,长了多少年呢? 我们查询老人既往的检查资料,他7年前曾经做过一次肺部CT,当时发现他有一个混合磨玻璃结节,6.3mm,建议定期复查: 很遗憾,这7年来,老人没有回来哪怕复查一次,这个肺结节利用这段无监督的时间偷偷长大了,变成了7.0cm的晚期肺癌…… 这个病例提醒大家,磨玻璃结节(包括混磨)定期复查很有必要! 磨玻璃结节的科学处置 很多朋友问:干嘛要复查?直接切了不更好?复查长大了怎么办? 答案很简单,肺结节太多了,良性远远多于恶性!就算是磨玻璃结节,大多数也是惰性病灶,可以几十年不变化,没有必要过度医疗,花钱、伤肺、甚至发生一些并发症。 所以对于比较小的磨玻璃肺结节,首次发现时通常选择先观察。一般首次复查建议间隔3个月,避免漏掉少数生长快速的结节,无变化的话,以后延长复查间隔。 于是很多人就担忧另一个问题:万一这个结节是肺癌,随访观察会不会耽误治疗?癌细胞会不会在观察期扩散,从而失去手术机会呢?毕竟地球上没有后悔药,有也是假药! 豪大夫今天整理了几个病例,给大家演示一下磨玻璃肺结节的随访结果,包括混合磨玻璃结节,让大家安心。 第一种结局最美丽,结节复查消失 对于首次发现的磨玻璃结节,如果没有确凿的恶性征象,通常是先随访观察,某些良性结节会吸收(这是最好的结果),这种情况不少见,多为炎症性结节,可以通过抗炎治疗、增强免疫力等方法促进吸收,甚至有些结节不采取任何措施也能吸收消散。 所以,首次查出的磨玻璃结节,先等等,别着急手术,有些良性结节会吸收,这是第一种结局。 第二种结局:长期不变,结节保持稳定 这种情况是最常见的,也不着急手术,定期复查就好: 一位50岁男子,体检发现4个磨玻璃肺结节,最大的这个5mm,定期复查,已经7年了没有任何变化,自己也从刚开始的惶恐不安逐渐变得安心、理性了。 磨玻璃肺结节定期复查,只要没有体积增大和密度增加,就可以继续安心观察。随着医学不断进步,也许以后会有无创伤的治疗方法出现。 长期稳定,可能伴随终生,这是磨玻璃结节的第二个结局,也是最常见的。 这种长期稳定的肺结节,很多人有焦虑心理,要慢慢克服。 即使是多发磨玻璃小结节也不必焦虑。在三项专门针对多灶性磨玻璃结节的研究中,60-95%的纯磨玻璃结节保持稳定,少数减少或消失,仅少数增加或变成部分实性(提示切除)。 第三种结局:复查进展,需要积极治疗 某些磨玻璃结节会进展,变成危及生命的毒瘤,通常表现为密度增加和/或体积增大(混合磨玻璃结节内部实性成分增加,也提示进展),就需要胸外科医生给它执行处罚措施,清理出身体: 一位中年女士,体检发现右肺纯磨玻璃结节1.1cm,定期复查,3年后好像增大了一点,直径大约1.2cm,边缘出现少量细索条影,她不想再观察了,做了胸腔镜微创手术,病理是原位腺癌。 与肺癌相关的磨玻璃结节,通常包括:不典型腺瘤样增生(AAH)、原位腺癌(AIS)、微浸润性腺癌(MIA)、贴壁生长型腺癌(LPA)。其中前两种属于浸润前病变(AAH、AIS),大多为惰性病灶,可以长期随访,不会转移扩散。 再举个例子: 一位中年女士,体检发现3mm微结节,8个月后增大为9mm的磨玻璃结节,手术病理是微浸润腺癌(MIA)。 磨玻璃结节随访增大、或者密度增加,需要手术治疗,可以治愈!这是第三种结局。 第四种结局,置之不理,少部分进展为晚期肺癌 如果查出肺结节,不遵从医生指导定期复查,只凭保持心情愉悦,或者某些偏方,就有可能出现第四种结局,如同本文第一个病人,7年后进展为晚期肺腺癌了: 这种是最遗憾的,原本通过科学的随访观察手段可以阻止,可以治愈。 最后补充一句:肺结节的复查尽量去同一家医院,使用同一台CT,方便医生对比;另外,对于存在肺结节的人群,不推荐低剂量CT复查,因为低剂量扫描降低了图像清晰度,不利于细节观察。 好,今天的内容就是这些。
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2936人已读 - 典型病例 带了两年多的引流管终于被拔掉,患者重获新生!
56岁男性患者,2018年出现支气管胸膜瘘,左全肺毁损,右肺部分疝入左侧胸腔,间断咯血,消耗明显,曾先后多家医院胸腔闭式引流、瘘封堵等治疗,效果差,一直带胸腔闭式引流管2年余…… 2020年8月行胸腔镜辅助左侧胸膜全肺切除术。手术难度如预想一样,全胸腔黏连致密、解剖结构不易辩识、甚至分不清上叶下叶还是疝入的对侧的肺,肺动静脉萎缩与周围组织分不清、支气管动脉扩张粗大……。克服困难顺利完成手术。 术后复查CT 术后近半年,一般情况好,恢复正常生活,血化验较前明显改善,基本恢复正常,引流管终于拔掉了,不再咯血了,贫血消失,营养状态恢复正常…
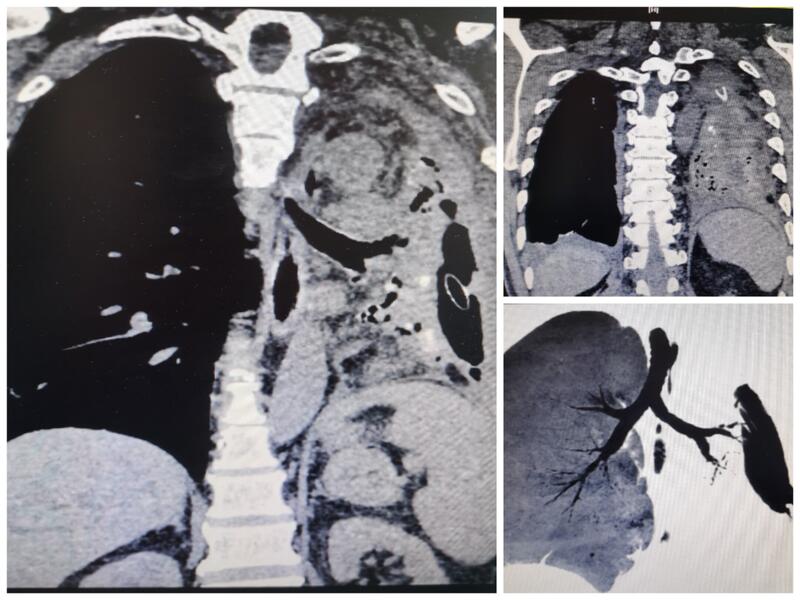 李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1131人已读
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1131人已读





