山东胸科医院胸外科科普号
- 引用 早期肺腺癌诊疗共识
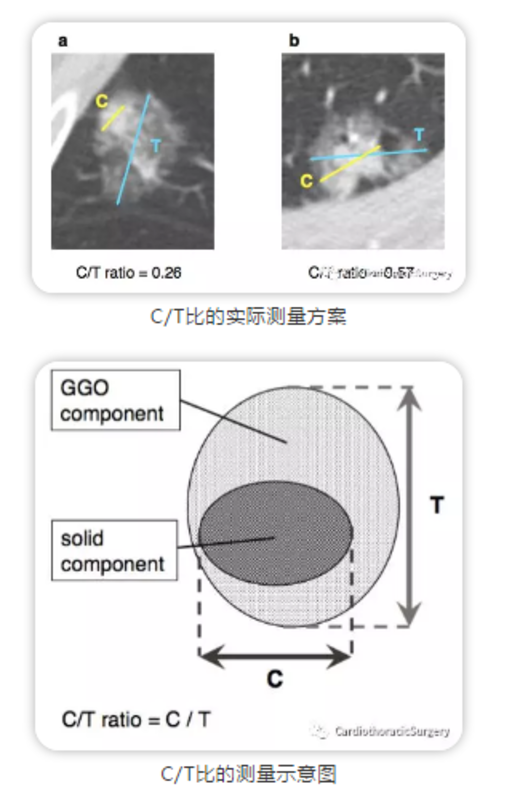
【摘要】 随着胸部计算机断层扫描(computed tomography, CT)检查,尤其是低剂量薄层CT筛查项目在中国的广泛开展,越来越多的无症状肺部磨玻璃结节(ground-glass nodules, GGNs)被发现。虽然国内及国际上已发布了一系列针对肺部GGNs的指南,但是这些指南的撰写者多来自呼吸、肿瘤及影像专业,可能缺乏对现代微创胸外科的充分认识,造成外科手术在肺部GGNs诊治中的作用不明确,甚至被低估;而且,肺部肿瘤相关的各学科对于早 期肺癌,尤其是浸润前病变的处理也缺乏统一规范。因此,基于国内外现有文献及上海市肺科医院多年积累的经 验,上海市肺科医院撰写了此诊疗共识。本共识推荐对于疑似肺腺癌的GGNs进行多学科评估,依据诊断,选择合 理的处置方式。对于疑似原位腺癌,推荐进行胸部薄层CT随访,或在特定情况下进行不超过肺段切除的限制性肺切除;对于疑似微浸润腺癌,推荐进行限制性肺切除或肺叶切除;对于疑似浸润性腺癌,建议依据病灶是否含有 磨玻璃成分、位置、大小、个数及患者躯体情况选择合理的手术方式;而肺多发结节的处理原则推荐为主病灶优先,兼顾次要病灶,综合选择治疗方案。 【关键词】 肺磨玻璃结节;原位腺癌;微浸润腺癌;浸润性腺癌;外科 1 引言 近年来,随着胸部计算机断层扫描(computed tomography, CT)检查,尤其是低剂量薄层CT筛查项目在中国的广泛开展,越来越多的无症状肺部磨玻璃结 节(ground glass nodules, GGNs)被发现。其发病特点包括:以东亚裔人群最为常见,非吸烟为主的人群,女性患者,低龄化表现。 目前国内及国际上,发布了一系列针对肺部GGNs 的指南,但由于这些指南的撰写者多来自呼吸、肿瘤及影像专业,缺乏对现代微创胸外科的充分认识,因此造成现有指南对外科手术在肺部GGNs诊治中的作用不明确,甚至被低估;而且,肺部肿瘤相关的各学科对于早 期肺癌,尤其是浸润前病变的处理也缺乏统一规范。 2011年,肺腺癌新分类[1]将肺腺癌分为:浸润前病变、微浸润腺癌(minimally invasive adenocarcinoma, MIA)以及浸润性腺癌。浸润前病变分为不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)和原位腺癌 (adenocarcinoma in situ, AIS)。 本共识推荐对疑似肺腺癌的G GNs进行多学科评 估,依据诊断,选择合理的处置方式。现对于疑似AIS、 MIA、浸润性腺癌及多原发肺癌的处置原则分叙如下。 2 原位腺癌 AIS典型的影像学表现为直径大于5 mm且小于30 mm 的纯磨玻璃结节(pure ground-glass nodules, pGGN)。 pGGN,是指CT肺窗上的局灶性磨玻璃样阴影,且结节内不含能够遮挡血管或支气管结构的实性成分[2]。AIS 需要与AAH和MIA进行鉴别。小于5 mm的pGGN通常为 AAH[3],若pGGN最大径为2 mm-5 mm,其为AAH的可能 性约为97%[4];CT值小于-520 HU亦提示AAH的可能[5]。 若pGGN≥6.5 mm、边界完整[5],或CT上出现血管形态改变[6],或出现空泡征(vacuole),则AAH的可能较小。 AIS还需与MIA鉴别,若GGN出现分叶征,胸膜牵拉[7], 支气管充气征[5],通常提示MIA。GGN实性部分平均CT 值在鉴别MIA与浸润前病变(A AH/AIS)亦有重要意义,浸润前病变实性成分平均CT值为-318.1 HU,而MIA 为-194.7 HU[8]。 对首次发现的疑似AIS的GGN应进行定期随访[9]。推荐在结节首次发现后的3个月进行首次的薄层CT平扫检 查[2,10];若患者首次CT检查层厚大于3 mm,建议在1个月后复查薄层CT平扫以获得结节的基线资料[10],然后3个月后再次复查薄层CT平扫观察结节的变化情况。 随访过程中,若结节明显缩小,则考虑良性病变可能。若患者年龄小于40岁,无吸烟史及二手烟暴露史,无肺癌家族史,无肺部其他需长期随访的疾病(慢性阻塞 性肺病、肺纤维化、支气管扩张等),则无需常规随访胸部CT;其他患者推荐进行每年1次的薄层CT随访[11,12]。 若结节持续稳定存在,可视病灶形态及大小等因素继续随访。对于直径小于8 mm,CT值较低,边界模糊 的pGGN可每半年或1年随访一次;对于直径大于等于 8 mm,边界清楚的pGGN,或含有实性成分的部分实性结节(part-solid nodules),可适当缩短随访时间间隔至6个月;对于持续稳定存在的外周优势部位的疑似AIS病变,也可考虑微创外科手术切除。其依据如下:①部分 pGGN仍具有生长和恶变的可能[13,14];②亚肺叶切除即可将病灶完整切除,且不影响患者预后[15,16];③术前无需进行正电子发射型断层显像(positron emission tomography, PET-CT)、头颅磁共振、支气管镜等,术前检查简单[17,18];④术中无需进行纵隔淋巴结清扫/采样,手术创伤小[15,19];⑤手术可在一定程度上降低患者焦虑水平,改善生活质量[20]。外科手术治疗AIS也存在一定的缺点:①若患者手术后再次出现其他部位的肺部结节,可能需要再次手术,则再次手术的难度和风险有可能增加;②AIS进展到危及生命,可能需要多年,过早的手术介入,会导致过早的手术损伤,术后可能出现的长期疼痛或其他并发症,可能影响患者的生活质量,早期手术与随访择期手术相比并不能显著改善患者总体生存,但却可能使患者过早的承受手术的风险及术后疼痛;③术前的AIS的诊断依赖影像学判断,缺乏病理支持,对术前判断的AIS进行手术,术后可能证实为AAH或良性病变。所以,对于稳定存在的AIS应当进行胸部薄层CT随访,仅当同时满足以下4个条件时,可考虑对患者进行外科手术治疗:①对于结节诊断AIS的准确性较高(MDT讨论或结节直径≥8mm且边界清楚的pGGN);②结节位于外周或优势段,行楔形切除、亚肺段或肺段切除可完整切除病灶;③随访过程中,患者存在明显的焦虑症状,影响生活质量;④患者无影响其生命的其他系统的严重基础疾病,预期寿命超过10年,且不伴有其他恶性肿瘤。 若结节随访过程中出现体积增大,或实性成分增多,考虑疾病进展为MIA或浸润性腺癌时,应考虑及时外科介入。AIS的处理流程如图1所示。 【肺科共识——原位腺癌】 术前随访 可疑AIS患者,术前至少随访1次,且距首次发现间隔3个月以上。 术前检查 术前推荐薄层胸部CT平扫,无需行头颅磁共振、全身骨扫描、气管镜、胸部CT增强、PET/CT或经皮肺穿刺检查。 手术指征 1.长期随访,结节持续存在; 2.对于结节诊断AIS的准确性较高(MDT讨论或结节直径 ≥8 mm且边界清楚的pGGN); 3.结节位于外周或优势段,行楔形切除、亚肺段或肺段 切除可完整切除病灶; 4.随访过程中,患者存在明显的焦虑症状,影响生活质量; 5.随访中,结节明显增大或密度变实; 6.患者不伴有影响其生命的其他系统的严重基础疾病, 或其他恶性肿瘤,患者的预期寿命超过10年。 手术原则与手术切除范围 1.如病灶位于周边“优势部位”:行肺楔形切除; 2.如病灶位置较深,但仍位于某一个肺段内:行亚肺段或肺段切除; 3.病灶处于多个肺段之间或支气管根部,切除需要联合肺段切除或肺叶切除者,不推荐或慎重选择手术; 4.手术切缘应符合基本肿瘤学原则; 5.术中冰冻病理结果决定是否需要扩大切除及淋巴结清 扫。 淋巴结清扫范围 术中无需淋巴结清扫或采样。 术后辅助治疗 术后不需要放疗、化疗或靶向治疗。 预后 完全切除后肿瘤学预后良好,5年生存率可达100%。 术后随访 如无明显残余病灶,AIS术后可每年复查一次胸部CT平 扫,不必复查头颅磁共振、全身骨扫描、气管镜或血肿瘤标志物。 3 微浸润腺癌 MIA是一类早期肺腺癌(≤3 cm),主要以贴壁方 式生长,且病灶中任一浸润病变的最大直径≤5 mm,不伴有浸润胸膜、血管、淋巴管或肿瘤性坏死[1]。其在影 像学上多数表现为pGGN,也有部分表现为部分实性结节,极少数表现为实性结节。在Lee等[21]的研究中,三类影像表现的比例分别为53.8%、42.3%和3.8%。在pGGN中,结节的直径及特殊影像征象的有无决定结节的浸润 性。持续存在的,直径≥10 mm的pGGN是MIA的一个CT 特征[22],其CT值约为(-536.2±113.1)HU[8]。分叶征、 胸膜牵拉[7]和支气管充气征[5]的出现可作为MIA与AAH/ AIS鉴别的要点。而对于部分实性结节,根据其内实性成 分的比例来区分浸润前病变(AIS/MIA)和浸润性腺癌 至关重要。MIA的实性成分最大径一般小于5 mm[23-26], 实性面积占比总面积(consolidationtotumor ratio, C/T) -472 HU则提示为浸润性肺癌[40]。同时,患者 年龄(55岁-74岁)、吸烟史(>30年包、或戒烟年限
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科3128人已读 - 引用 怀疑是肺癌,如何选医院和科室?如何正确就医?
如果怀疑自己某些情况好像是肺癌,所有人都会焦虑不已,甚至乱了方寸。但焦虑归焦虑,我们总要捋清楚下一步的行动思路——例如去哪家医院?带什么材料?看哪个科室?找哪位医生?甚至要不要多问几个医生?这些问题咱们心里都要有个数。今天这篇文章,我们就把这几个关键点一一搞清楚。 一、记录自己目前状态 如果怀疑自己是肺癌,一般有三种情况,①有主观症状,②体检影像资料显示异常,③以上两种情况都有。 如果是有主观症状,此时我们要梳理下自己的情况,包括: 1) 症状的描述,记录自己出现了哪些症状。常见的包括体重减轻、咳嗽、疼痛、呼吸困难、发热等,但我们要做的不只是反应症状,还要反应细节。 例如疼痛,我们需要告诉医生,疼痛区域在哪里以及怎样的疼痛,如,胸口锐利的疼痛?隐痛?咳嗽时才疼痛?深呼吸时疼痛加重等等;如果是咳嗽,是干咳还是有痰?痰中是否有血丝? 2) 症状出现和持续的时间。例如间歇咳嗽两周不见好,胸闷气短1个月有余等。 3) 用药史。是否服用过相关药物或进行对应治疗,因为一些药物可能会暂时缓解症状,反而影响真实病情的发现。 以上信息最好拿本子提前记录下来,并在门诊时带上,以便在医生询问时能确说出不遗漏。 如果做过影像学检查,例如拍过胸片、肺部CT、磁共振等,首次就医时需要带上片子及报告。如果是近段时间做过肺部相关检查,例如肺功能的检测、支气管镜甚至肺穿刺等,也都要带好报告。 二、医院及科室的选择 首先,如果是紧急状况,例如有咳血、呼吸困难、剧烈胸闷等其它威胁生命的情况,应立刻打急救电话,就近就诊。如果是非紧急情况,本人状况也比较平稳,则可以分以下两种选择: ① 对于肺癌高危人群,如果出现了异常症状,建议去二、三级医院的门诊直接就诊。 ② 如果本人并不抽烟,且远离二手烟、煤烟、油烟、氡气、石棉等危险因素,则可以先去看社区医院,如果医生也高度怀疑肺癌,则可以再去上级医院,或直接去二、三级医院就诊。 对于科室的选择,一般二、三级医院肺癌相关的科室包括胸外科(手术)、呼吸内科(化疗及靶向治疗)、肿瘤内科(手术及靶向治疗)及放射治疗科(放疗)。当然在排除怀疑之前,我们并不用选择治疗,大家只需根据当地医院的情况,选择门诊挂号即可。医生会根据患者描述及临床处理经验,来建议接下来的操作。 三、医生的选择 现在不少医院都有医生墙,面对这么多张陌生的面孔和花花绿绿的头衔,选择医生也成了问题,到底是选择普通医生,当天就能开单子做检查?还是一定要大主任,虽然等的时间长却选择的人多呢? 其实选医生没那么复杂,我们只要把握一个大原则——此次的就医目的,例如首次去门诊,就是想确诊或排除肺癌,那这时除了基础问诊之外,让医生开单子做各种检查就是此行目的。 而到底是普通医生开的单子,或是主任医生开的单子,其实本质上都一样。也就是说,既然都是一纸检查单,开单子做检查以及检查的结果才是重点。这时候,我们完全可以把挑选医生的时间省出来,先去排队做检查(级别越高的医院,检查需要预约等待的时间越久)。 那接下来,患者拿到了检查报告,我们的就医目的就变了——此时我们①要确认诊断信息②要开始寻求治疗方案,相应选择医生的标准也发生了变化。 我们的建议是,此时您可以选择一位既有临床经验——接触的病例数量较多,同时又与时俱进——知识更新速度快的医生。那如何知道你选中的医生是不是符合这些条件呢?给大家几个参考标准: ① 年龄。我们就医时常会倾向于高年资主任,意思是既要有足够的临床经验,也要追得上当下最新的知识更新,一般来说,参考年龄大概在35-55岁之间。 ② 职称。与年龄一样,我们也要综合考虑,并不是头衔越大越好,因为头衔越大意味着职责越多,而分给每一位患者的时间相对较少。一般来说各省市三甲医院的副主任、主任级以上医生都比较优秀。另外有一些医生会在**学会/协会任职,说明该医生在该领域很专业,经常参加学术会议,知识更新很快,掌握信息也很前沿。 ③ 医生排名。一般在医院/科室的医生墙(前后排名)以及互联网(患者评价)上都能看到医生打分,大家可以根据这些信息判断该医生是否适合自己,例如问诊是否细心、是否愿意与患者沟通、是否站在患者角度考虑问题等。 除以上之外,大家还可能说这位医生是博士,或者在国外待过,这些因素也可以成为加分项,但言而总之,一定要确认我们的就医目的,带着目的去就医,往往事半功倍。 最后还有一种情况要说明,那就是有些朋友对自己第一次选择的医生不太满意,原因可能包括: ① 沟通不畅,医生个人风格不适合自己 ② 医生给出的治疗方案较多,不知如何选择 ③ 诊断不明,患者本身的情况比较复杂 遇到以上情况,也建议大家可以再找一位/几位医生,对诊断结果和治疗方案兼听则明是其一;在之后的真正治疗中,医患顺利配合,患者和家属疑问能够得到及时解答,心情舒畅也非常重要。 总而言之,如果大家发现了身体有异常状况,一定要选择正规的医院进行就诊,而对医生的选择要根据自己的就医目的和就医需求,理性选择。 本信息版权归肿瘤知道所有,创作过程获得中国初级卫生保健基金会肺常好关爱项目支持。未经授权,不得转载。
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1841人已读 - 引用 肺结节?肺癌?
如今,随着大家体检意识的不断增强,加之胸部低剂量螺旋CT检查项目的广泛开展,在每年一度的体检中,都会出现一大批肺结节患者。 但查出来后,接下来该怎么办? 肺结节 = 肺癌吗? 中国作为肺癌的“第一大国”,发病率与死亡率双率第一,也难怪大家都谈之色变! 而肺结节之所以会引起大众的足够重视,是因为有相当一部分的肺结节其实是“癌前病变”,如果不及时处理,真的会发展为“肺癌”! 一份调查报告中也提到:10个肺结节患者中约有1个会变成肺癌! 以至于一些人断章取义,一旦发现肺里有结节,就觉得自己要得肺癌了! 因此,很有必要在此给大家科普下:肺结节≠ 早期肺癌! 查出肺结节先弄清楚三件事 肺结节病因复杂,影像学表现多样,临床表现缺乏特异性,因此医生诊断有一定难度,常借助低剂量螺旋CT。 1、结节的分类 根据结节的大小,临床上把肺实质内≤3cm的病灶称为结节,>3cm的病灶称为肿块,而<1cm的结节称为小结节,<5mm的结节称为微小结节。 根据结节的性质,肺结节又可以分为良性结节和恶性结节,良性结节有可能是感染肺炎、肺结核等痊愈后留下的疤痕,也有可能是良性肿瘤;恶性结节则包括肺癌、转移癌等。 2、结节的危险性 体检时发现肺结节并不代表有肺癌。而且专家表示,初次CT检查发现的肺结节,约有80%是良性的,不必过于担忧。 但即便现在是良性结节,日后也有恶性病变的可能,所以也不能掉以轻心,要做好定期复查随访,有需要时也得采取一定的干预手段。 3、结节不能“一刀切” 很多人会想,既然结节有癌变风险,立马切除就好。其实不然,治疗结节,因根据个人情况(年龄、身体因素),判断结节是否有发展为恶性肿瘤的可能,不能盲目选择“一刀切”。 一方面,切除结节也可能存在损伤正常组织的风险;另一方面,几乎所有的结节都存在复发的可能,所以医生常建议低危结节应以观察为主。 但如果检查结果显示“低回声结节”、“占位病变”时,建议咨询专业医生,进行复查。 如果有15%以上会发展为恶性肿瘤的可能,则不反对手术;如果发展为肿瘤的可能性在25%以上,则建议手术。 肺结节的危险度判别 发现肺结节,一般有三种可能,一、已发展为肺癌;二、不是肺癌,但有癌变的可能;三、与癌症无关。那么,那如何判断肺部结节是否有癌变可能? 根据密度判断 根据病灶密度不同,肺结节还可分为实性肺结节和亚实性肺结节,后者包括纯磨玻璃样结节和部分实性结节。 实性肺结节是一个高密度的影子,在CT下呈现白色的。实性结节,表面光滑小而圆的。 纯磨玻璃结节指CT显示的肺内密度稍增高影,通过病灶仍然能看到肺纹理影,就像透过磨玻璃观察到相对模糊的影像一样。 部分实性结节其恶性概率相对较高,易形成肺腺癌,通常由小结节引起。 根据大小判断 对于肺部结节,一般来说,结节越大,危险性越高。体检第一次发现肺结节时可参考下文,但每个人病情有差异,具体遵医嘱。 当直径<5mm,且没有肿瘤病史、家族病史的,恶性的可能性较小,每6-12个月做CT复查一次就可以; 当直径为5-10mm时,恶性可能性为6-28%,每3个月复查一次; 直径>10mm的肺结节应每1~2个月复查一次。如果随访发现病灶无变化,则常延长至3个月、6个月、1年进行复查;当肺结节2年无变化时,则可大致认为是良性结节;有变化时,则根据变化情况做出判断并决定下一步处理意见。 要特别注意的是:>2cm的肺部结节恶性率可高达20%,>3cm的病灶通常很可能是恶性病变。 非专业人士判断 对于非专业人士的我们可以从以下几个简单的信息点区分肺结节的良恶性。 看“光”不“光 良性结节外周通常都很光滑,就像玻璃球那样;恶性结节周围没有那么光滑。 看“圆”不“圆” 良性结节基本都是圆形或椭圆形,恶性结节圆形的很少,而且长成哑铃型或葫芦形的。 看“长”不“长” 良性结节经过几个月甚至几年的观察、复查,大小变化不大;恶性结节有可能会慢慢长大。 看“硬”不“硬” 如果是完全钙化的结节基本都是良性的结节,钙化就像骨质那样非常硬。恶性结节不会是完全钙化的因此质地没有那么硬。 肺结节癌变的高危人群 有几类人在体检发现肺部小阴影或小结节时,千万不要掉以轻心,应当积极咨询医生,配合检查,推荐低剂量CT筛查肺结节。 (1)长期吸烟,烟龄超过20年,每天抽烟超过20支以上者,或有长期被动吸烟的人群; (2)年龄在40岁以上,伴随有胸痛、咳嗽、不明原因的痰中带血丝、消瘦、体重下降等症状; (3)有肿瘤家族史,特别是肺癌家族史者; (4)有慢性阻塞性肺部疾病、弥漫性肺纤维化或者既往肺结核病史; (5)有工业粉尘、石棉及放射性物质接触
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科1706人已读 - 引用 肺部结节需要怎么治疗?
肺结节很常见,多数是良性的。但有小部分结节是肺癌早期,还有一些虽然不是肺癌,但有可能演化成癌,这些危险结节是我们做肺结节筛查的重点。哪些肺结节有可能是肺癌?国内外专家对肺结节做了大量分析,把以前可能是肺癌的结节列为高危结节,需要进一步明确诊断和及时处置:上面的两种类型就属于高危肺结节,但这里面不全是肺癌,需要通过多学科会诊、支气管镜、经皮肺穿刺,甚至手术病理明确。一般高危肺结节不建议长期随访观察,以免耽误治疗。除了上面划掉的这个范围,还有少部分肺结节,没有达到上面这个指标,但依然有早期肺癌的可能,通常就需要你定期随访观察,尤其是肺癌高危人群中查出的肺结节哪些群体是肺癌的高危人群?国内的胸部专家,针对我国国情制定了适合我国的肺癌高危人群,如下图:相对来说,这个群体的人患肺癌的风险要高一些,应当更加重视胸部健康体检,发现中、低危肺结节应密切监控,从而阻止晚期肺癌的发生。但我们也知道,肺结节很常见,甚至能达到正常人群的20%,即使是肺癌高危人群,也不能发现肺结节就手术,那样一定会造成过度医疗,因为高危人群中也有很多良性肺结节。所以我们再反过来,锁定一些良性的肺结节特征,这些良性的不必手术(下图来自山东肿瘤医院黄教授的总结):1.不吸烟,没有高危因素的女性患者,发现肺内小于5毫米的实性结节,不必担心,几乎都是良性!2.年龄在30岁以下,体检发现的光滑实性小结节(小于3厘米),几乎都是良性。低风险的的肺结节随访观察,达到什么指标需要手术治疗?在复查过程中,结节增大或者密度增高,危险等级就要上调,可以考虑手术切除。开篇所提到的高危肺结节,短期复查不消失、不缩小,也应当考虑手术切除。像这个磨玻璃小结节,本来风险很低,但随访过程中逐渐增大,最终手术切除病理是原位腺癌。
白雪鹏 主治医师 山东省公共卫生临床中心 胸外科3270人已读 - 引用 体检发现肺部结节怎么办?
首先自己要做的是戒烟和避免吸二手烟;最好到设有肺部结节多学科联合门诊的医院就诊,如果没有多学科联合门诊可以找呼吸内科或胸外科等有肺癌诊治经验的医生就诊。近期张先生进行每年一次的体检,和以往不同,今年肺部检查由往年的普通胸片改为肺部CT平扫,结果发现了有肺部小结节。体检时张先生没有任何不舒服,也没有咳嗽等呼吸道症状。这样的体检结果让张先生非常着急,急急忙忙的带着体检报告来到医院,询问这个结节到底有没有问题,发现肺部结节下一步怎么办?下面我们把肺结节相关知识做一简单介绍。1 什么是肺部结节?肺部结节是指胸片或CT等影像学检查发现直径小≤3cm的圆形以及类圆形实性或亚实性肺部阴影,可为孤立性或多发性。肺部结节有良、恶性之分,良性的结节有炎性结节、良性肿瘤如错构瘤等。早期肺癌也可表现为肺部小结节,如果小结节边缘比较毛糙及有分叶,结节内部有囊泡,并且牵拉周边支气管或胸膜,结节周围有血管生长进入结节内,随访过程结节缓慢生长等等,这些特征都提示早期肺癌的可能性大,要高度重视。2 肺部结节有什么表现?肺结节一般没有症状,多数都因为体检时影像学检查发现。普通胸片很少能发现直径小于1cm的结节,同时国内外研究均表明普通胸片检查并不能早期发现肺癌,每年进行常规普通胸片检查不能提高肺癌患者生存期。因此目前国内外许多指南均推荐,如有发生肺癌高危因素人群,建议每年进行低剂量胸部CT扫描进行筛查。3 如何确定肺部结节的良恶性?早期小结节良恶性鉴别比较困难,定期低剂量胸部CT随访是关键。如果发现小结节尽可能到呼吸内科、胸外科等相应科室就诊。目前首都医科大学附属北京世纪坛医院等北京许多三甲医院都有肺结节多学科诊疗门诊,此门诊由呼吸内科、胸外科、肿瘤科、影像科包括核医学科,放疗科等高年资专家组成,到多学科联合门诊就诊可能会得到更专业的判断。良恶性判断需要结合病人的临床信息、肺部结节影像学表现、肿瘤标记物及功能显像,甚至非手术或手术活检等等。临床信息有患者年龄、吸烟史、职业史、家族遗传史及慢性病史等。影像学表现如上述结节边缘比较毛糙及有分叶等等。目前尚无特异性肿瘤标记物应用于早期肺癌临床筛查,如果动态观察神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)及鳞状细胞癌抗原(SCC)等呈进行性增高,或者增高数倍以上,需要警惕肺癌可能。对于直径大于8mm以上不能定性的实性结节可以采用计算机断层显像--计算机断层扫描,即PET-CT来区分良恶性。病理是最终确定良恶性的金标准,取得病理途径有气管镜或超声气管镜、CT引导下穿刺活检,疑难的病例甚至胸腔镜下活检。4 肺部结节需要治疗吗?通过上述检查或者随访,多数患者的肺部结节都会明确原因。针对肺部结节治疗是对因治疗。病人自己首先要做的是戒烟和避免吸二手烟。如果是感染导致的炎性结节,包括细菌、结核、真菌,就用针对性的药物治疗。特殊的良性结节有些时候鉴别困难,通常可能会采取手术治疗。如果高度怀疑或确诊恶性肿瘤,能够耐受手术建议尽早进行手术。随着科学技术发展,早期肺癌可以采取胸腔镜下微创手术。胸腔镜微创手术术后恢复快,后遗症少。如果肺结节直接小于等于8mm,良恶性又不能马上判断的,可以在3、6、12和24月进行CT随访。总之,发现肺结节后病人不需要紧张,首先自己要做的是戒烟和避免吸二手烟;最好到设有肺部结节多学科联合门诊的三甲医院就诊,如果没有多学科联合门诊可以找呼吸内科或胸外科等有肺癌诊治经验的医生就诊。医生一般会根据实际情况给出诊疗建议,如是否还需要进一步检查,是否需要手术,如果不手术下一步如何随访以及是否需要药物治疗等等。
白雪鹏 主治医师 山东省公共卫生临床中心 胸外科4342人已读 - 引用 肺癌和肺结节是不是一回事?2
肺结节是指肺内直径≤3cm的类圆形或不规则型病灶,并不等于肺癌。根据密度,影像学肺结节分为实性和非实性两大类,非实性结节又进一步细分为纯磨玻璃结节和混合磨玻璃结节。其中,纯磨玻璃结节如果到复查时间不消失甚至增大,结节大小超过8mm,其他影像学或数字肺检查有血管供应,就要考虑恶性的可能,如果结节表现为混合磨玻璃密度,则肺癌的可能性很大。而实性结节,良恶性均有可能。
金锋 主任医师 山东省公共卫生临床中心 胸外科2176人已读 - 引用 肺癌和肺结节是不是一回事?1
肺结节是指肺内直径≤3cm的类圆形或不规则型病灶,并不等于肺癌。根据密度,影像学肺结节分为实性和非实性两大类,非实性结节又进一步细分为纯磨玻璃结节和混合磨玻璃结节。其中,纯磨玻璃结节如果到复查时间不消失,是肺癌的可能性很大,因为增长速度慢,所以随访可能2-3年不变化。如果结节表现为混合磨玻璃密度,则肺癌的可能性很大。而实性结节,良恶性均有可能。
金锋 主任医师 山东省公共卫生临床中心 胸外科1877人已读 - 引用 多原发肺癌的诊治
概述:多原发肺癌的诊治 引言 — 肺癌患者的肺部可能同时存在1个以上原发病灶[即同时性多原发肺癌(multiple primary lung cancer, MPLC)],也可能在第一个病灶经治疗后又发生一个(异时性)原发性肺癌。这在临床中成为更常见的问题,并且这些肿瘤如何分类也是一个挑战。 MPLC患者在临床中面临多个重要的诊断和治疗问题,这些问题与单发原发肿瘤不同。本文将总结同时性和异时性MPLC的问题。 诊断标准 同时性MPLC — 同时存在1个以上肺部结节的患者必须符合严格的诊断标准,才能被归类为同时性MPLC。 ●两个肺部病灶必须都是恶性的且必须独立存在。第二个病灶不能被推定为代表第二原发性肺癌。必须排除良性结节、感染性过程及来自肺外部位的转移灶。 ●第二个恶性病灶不能是第一个肺部病灶的转移灶。作此区分的公认标准包括: 组织学类型不同,或者起源于另一原位癌。 组织学类型相同,但解剖学上存在差别,没有累及纵隔(N2、N3阴性),且无全身转移。 组织学类型相同,但综合性组织学评估明显不同: -确定主要分型 -以10%为增量估计得到的每种组织学亚型的相对百分比 -细胞学特征,包括分级、坏死和炎症 生物标志物的模式不同。 异时性MPLC — 有接受肺癌治疗既往史的患者发生第二处肺癌的风险增加。这一类患者中的诊断问题及后续治疗与同时性MPLC不同。 ●鉴别诊断包括良性结节、感染性过程或来自肺外原发肿瘤的转移灶。 ●如果肿瘤组织学类型不同,或者组织学类型虽然相同但是前后两个癌症出现的时间间隔为4年或以上且没有全身转移证据时,可考虑是异时性肿瘤。如果两个原发性肿瘤出现的时间间隔较短,预后可能不佳,但是在没有出现其他全身性转移性疾病的情况下,治疗选择一般是相似的。 TNM分期系统意义 — 在第8版美国癌症联合会(American Joint Committeeon Cancer, AJCC)TNM(tumor node metastasis)分期系统的定义中,将患者分类为MPLC有重要意义。 ●同一肺叶中组织学类型相同的病灶被认为“分开的肿瘤结节”,归类为单个T3期肿瘤,而不认为是MPLC。 ●同侧肺内不同肺叶中组织学类型相同的第二处病灶被认为是T4期病变。因此,过去在第6版分期系统中考虑为Ⅳ期疾病或MPLC的一些情况,现在归类为T4期肿瘤。 本专题中提出的临床指导均采用第8版分期系统;然而,也应意识到引用的研究可能使用的是既往版本分期系统,这也是现有数据的一个局限。 组织学 — 在美国过去的数十年中,各种组织学类型的肺癌患病率发生了重大变化,腺癌的发病率和比例不断增加,而鳞状细胞癌的发生率不断下降。一项研究分析了在非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中进行的协作小组试验,发现大部分患者为腺癌(58%),其次是鳞状细胞癌(20%)和大细胞癌(8%)。小细胞肺癌(small cell lung cancer, SCLC)的发生率也在下降。因此,在美国最可能出现的临床场景是,某肺癌患者有两个病灶,这两个病灶都是腺癌。这就是为何单纯证实组织学类型相同并不足以将病灶归为转移灶的原因。 先进的分子检测技术,如DNA指纹,或许能够判定两个病灶是独立原发灶抑或同一肺癌,但是这些技术还不能在临床中常规使用,在确定关联性方面仅有提示作用而不能确定。检测以下基因的重排已成为对组织学类型为腺癌NSCLC患者的标准处理:表皮生长因子受体(epidermal growth factor receptor, EFGR)基因(EGFR)、渐变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因(ALK)及ROS1。已有人将突变检测用于调查患者是存在异时性还是同时性多原发灶。这项小型病例系列研究共纳入来自20例患者(6例患者为同时性肿瘤,14例为异时性肿瘤)的42处肿瘤,在4个比较组(18%)中,根据基因组分析结果的分类与临床病理学诊断相矛盾。这项小型研究展示了基因组分析有区分克隆性肿瘤与独立原发灶的潜力。 过去称为细支气管肺泡癌(bronchioloalveolar carcinoma, BAC)的特殊临床疾病,现在被认为是一系列病变,可从原位腺癌(adenocarcinoma in situ, AIS)到微浸润腺癌(minimally invasive adenocarcinoma, MIA)再到浸润腺癌,生长模式从沿肺泡贴壁样生长为主到黏液样生长,在一些(非所有)病例系列研究中这使肺腺癌的比例不断增加。 这一病变系列常表现为多病灶肿瘤,考虑到其局部进展而非远处转移的倾向,通常属于独立的原发肿瘤而非转移性病变。多病灶疾病在CT上有特征性表现:病灶处于不同的进展期,CT表现可以为纯毛玻璃样变到部分实质性结节样变到全实质性结节样变;不同肿瘤的进展速度也不尽相同,从在数年间进展的惰性肿瘤到在数月间迅速进展的侵袭性肿瘤。由于不是所有病灶都适合切除,所以处理这种情况时需要特殊考虑。 流行病学和危险因素 — 在多数病例中肺癌与吸烟有因果关系,也与很多其他环境危险因素有关。此外,一些证据表明在吸烟相关肺癌和非吸烟相关肺癌患者中,遗传因素均在肺癌的发生中起作用。烟草和其他致癌物质可产生“区域癌化”,在这一区域良性的相邻组织中可出现多中心癌。 一篇文献综述估计,接受NSCLC完全切除的患者发生第二处肺癌的风险为每患者年1%-2%。同样,已被成功治疗的SCLC患者发生第二原发肺癌的风险是每患者年6%。另一项关于SCLC患者的研究发现,这些患者发生第二处癌症的整体风险是一般人群的3.5倍。有胸部放疗史的SCLC患者出现第二处肺癌的风险是一般人群的13倍,没有放疗史的风险是一般人群的7倍。 继续吸烟的患者发生第二处肺癌的风险比不吸烟患者高。一项Ⅲ期化学预防试验前瞻性地探讨了发生第二原发肺癌的风险及其与吸烟的关系,该试验中,已行切除术的Ⅰ期NSCLC患者被随机分配至硒治疗组或安慰剂组。硒治疗组和安慰剂组第二原发肺癌的发生率分别为1.62例每100人年和1.30例每100人年(P=0.29)。总(体)生存(overall survival, OS)因吸烟状况不同而存在显著不同。未戒烟患者、曾吸烟患者和从未吸烟患者出现第二原发肺癌或复发的风险分别为30%、24%和20%。 同时性MPLC 诊断和分期评估 — 诊断同时性MPLC要求取各病灶组织以明确各肺肿瘤的特征。这是因为一般将同侧肺中结节视为转移瘤。多发腺癌甚至更为复杂,因为据报道多发腺癌在同时性MPLC中的占比高达50%或更多。组织学检查中的信息为明确一些患者是否具有MPLC的特征提供了依据。 患者表现为1处以上原发肺癌时,分期非常复杂,对于预计要行潜在治愈性切除术的患者尤需谨慎。应进行头部MRI扫描和FDG-PET检查来评估胸外转移情况。 对于周围型Ⅰ期NSCLC患者,当前纵隔分期指南并不推荐使用有创方式来明确纵隔淋巴结的状态,除非FDG-PET发现纵隔淋巴结的FDG摄取增加,或者CT扫描发现纵隔淋巴结增大。这样做的原因是,在这一临床情况下隐匿性纵隔淋巴结受累的验前概率较低。 然而,目前尚无充足数据来确定同时性MPLC患者纵隔受累的概率;因此,对于考虑确定性切除术的患者,有创纵隔分期的方式不能不用。而且,当纵隔淋巴结存在病理学受累时,同时性病灶更可能是肺内转移而非第二原发灶[5]。因此,有创纵隔分期不仅可提供手术切除肿瘤可能性的额外信息,还有助于明确患者是存在2个同时性原发灶还是出现了肺内转移。 对于组织类型不同的MPLC,治疗方案应基于这一原则:能使肿瘤获得最佳远期结局,其中每个肿瘤在接受评估和治疗时并不考虑其他肿瘤。然而,2个肿瘤在组织学上相似时,采取这种方式要依据两病灶确实是不同的这一事实。 组织学类型相同且有N2淋巴结受累的多发瘤患者,通常被视为Ⅳ期疾病进行治疗,因为所有的病灶很可能(但不一定)由单个恶性过程引起。 治疗 手术 — 对于同时性或者异时性MPLC患者,如果切除1个以上病灶后仍有足够的肺储备,外科手术是标准治疗方法。然而,如果肺储备有限,则患者可能需要接受1个或者2个病灶的局限性切除(如,肺段切除或者楔形切除),或者接受确定性非手术局部治疗。 确诊同时性原发性肺癌后,应评估两个病灶均手术切除的可能性。患者应尽量选择两个肿瘤都完全解剖性切除的手术方式,两个病灶均切除的患者中很大一部分将可能有超过60个月的平均远期生存期。 目前还没有随机试验确认这种治疗方式的有效性,大部分数据都是回顾性的、来自单个中心,并且同时存在患者选择偏倚和发表偏倚。而且,这些分析都是在广泛采用FDG-PET分期方式之前进行的。试验中也根据共存疾病、肺功能和肿瘤解剖位置非常谨慎地选择两个病灶均进行切除的患者。根据目前分期系统的定义,病灶的解剖位置非常重要。位于同侧的组织学类型相同的两个独立结节现在被认为是T4期病灶,不再考虑是转移灶。 在某些情况下,2个同时性肿瘤可能组织学上相似,可能无法明确它们是否为2个原发性肿瘤。这种情况下,由于存在两个原发性病灶是“最佳情景(best case scenario)”,所以当作这种病况来治疗此类患者可能较为恰当,而不应该将其归为Ⅳ期疾病。 非手术局部治疗 — 对于经恰当心肺诊断性检查后发现不适合外科手术切除1个或以上病灶的患者,其他治疗方案可能实现对局部疾病的长时间或确定性控制。这些方法的相关数据来源于医学上不能外科治疗的早期NSCLC患者。 潜在选择包括: ●首选:立体定向体部放射治疗(stereotactic body radiation therapy, SBRT),也称为立体定向消融放疗(stereotactic ablative radiotherapy, SABR)。 ●常规放疗。 ●影像学引导下的经皮肿瘤消融术。 对于Ⅰ期NSCLC,前瞻性试验和人群对比分析已发现,与常规放疗或射频消融术相比,SBRT治疗的局部肿瘤控制率和总生存率更高,且在匹配患者队列中SBRT与手术的治疗结果相似。 对于存在同时性病灶的患者,非手术局部治疗(尤其是SBRT)可能有一定作用,既可以2个病灶都治疗,也可在2个原发病灶都需要手术切除但认为患者不能耐受这种手术时与手术治疗联合。现有数据表明,在MPLC患者中,尤其是手术并发症发生风险高的患者中,SBRT具有良好安全性和潜在治愈作用。 已报道了7项关于SBRT治疗MPLC的回顾性研究,共304例患者(研究中10例到101例患者不等),这些患者或接受SBRT治疗所有病灶,或者接受SBRT和手术联合治疗不同病灶。大部分患者从医学角度来说不能手术。中位总生存期为20-46个月,2年局部肿瘤控制率为81%-99%。高分级毒性罕见。同时性MPLC患者的总生存率和无进展生存率均低于异时性MPLC患者。 对于特殊病例多灶性同时性MPLC,尤其是之前被称作BAC的一系列腺癌,即使采用实质保留技术切除所有病灶也可能不可行。 对于根据组织学分级或放射学特征(如,生长情况、病灶大小、实质成分、PET的FDG吸收情况)确定为最高风险的病灶,如可能应给予确定性局部治疗;对于出现症状的风险较低病灶(如,生长缓慢的亚实性小结节)可暂时观察,直至它们表现出更具侵袭性的放像学特征。 因为将来其他病灶可能会以更具侵袭性的方式生长并且需要治疗,所以优先选择保留实质的治疗方法,应更强调考虑非手术局部治疗,甚至将其作为一线治疗方式。其他病灶在出现有症状进展的可能时(如,亚实性结节加速生长或实性成分不断增加,或者FDG摄取不断增加,即使结节仍较小),应考虑确定性局部治疗。不能采用确定性局部治疗的多病灶进展可能需要全身性治疗,像治疗转移性疾病那样。 异时性MPLC — 很多NSCLC或SCLC治疗成功的患者将发生第二原发肺癌。经过适当筛选的异时性NSCLC患者,外科切除第二原发肿瘤可使患者长期存活。根据回顾性研究,原发与新发肺癌之间的时间间隔中位数为48个月,且大约2/3的肿瘤组织学类型相同。 治疗第二原发性肺癌的最大挑战之一是评估是否可外科手术切除。大约2/3的异时性肺癌患者可手术切除,接受切除术的患者中大约1/3为局限性切除术。然而,对于所有病例均应尝试局限性切除术(至少尝试解剖性肺段切除术)。肺段切除术与肺叶切除术的无复发生存期结局相似,对于3cm以下的肿瘤尤其如此。另外,肺段切除术在开胸或胸腔镜下均可安全进行,对肺功能的影响显著更少。 异时性MPLC患者也可从使用非手术治疗方式中获益,尤其是那些外科切除术后肺储备减少、不适合再次切除的患者。 NSCLC切除术后的辅助化疗 — 目前还没有可指导在MPLC患者中应用辅助化疗的随机试验。 对于已接受潜在治愈性切除术的单个Ⅱ期或Ⅲ期NSCLC患者,基于顺铂的辅助化疗是标准治疗方案。这种方案的依据是Ⅲ期临床试验结果,试验显示术后给予化疗与单纯观察相比,前者患者的总生存改善。关于Ⅰ期NSCLC患者的数据是不确定的,但提示ⅠA期疾病患者接受辅助化疗实际上结局会更差,而ⅠB期疾病和肿瘤大于4cm的患者接受术后化疗可能获益。 对同时性MPLC患者而言,肿瘤的最高分期似乎是预后的最佳预测指标;如果患者已接受Ⅱ期或Ⅲ期疾病切除,则推荐辅助化疗。有2个同时性或者异时性Ⅰ期NSCLC的患者能否从辅助化疗中获益还不确定。有Ⅰ期NSCLC的MPLC患者比单个Ⅰ期NSCLC患者的预后差,基于顺铂的辅助化疗可带来的绝对获益尚不清楚。这种情况下,临床医生在决定是否采用辅助化疗时,应考虑肿瘤大小以及患者的共存疾病、体能状态和倾向。 预后 — 仍然认为分期是切除MPLC后患者总生存的最重要预测指标。然而,肿瘤大于2cm和每年吸烟包数与结局更差之间有统计学意义。更高并发症发生率见于第一秒用力呼气量较低的患者和同侧手术的患者中。 异时性原发性肺癌患者的预后好于同时性肺癌患者,数个仅调查这组患者的回顾性研究显示,手术切除之后,自第二原发肿瘤诊断起的5年总生存率为27%-51%。另一项包括161例患者的回顾性研究显示,从第2次手术切除起的5年总生存率为61%。 由于很多研究的样本量较小以及定义和随访各不相同,同时性和异时性MPLC患者之间的预后差异难以明确。一项meta分析纳入了22项包括近1800例患者的相关研究,调查同时性和异时性MPLC患者之间的总生存差异。11项研究分析了同时性及异时性MPLP患者诊断首个异时性肿瘤后的总生存期(n=580),发现同时性MPLC患者的总生存期更短。有趣的是,9项研究调查了自诊断第二异时性肿瘤之时起的总生存(n=1009),对这些研究进行分析并未显示有总生存上的差异。总体上,在这项meta分析中,组织学和位置(单侧或双侧)对生存情况均无影响。然而,这项meta分析未能评价初始分期或淋巴结受累的影响。单一机构研究显示,N1或N2淋巴结受累与无淋巴结受累病变(N0)相比,与死亡率增加有关。 随访监测 — 对于接受单一NSCLC病灶完全切除的患者,美国国立综合癌症网络(National Comprehensive Cancer network, NCCN)指南推荐在术后最初2年内每6-12个月进行1次对比增强CT或CT平扫,同时询问病史并做体格检查。NCCN推荐在2年后每年1次询问病史和体格检查,1次低剂量CT平扫。对于继续吸烟的患者,推荐戒烟、接受戒烟咨询和药物治疗。 到目前为止,临床试验还没有确立任何药物能在肺癌预防中发挥作用。 总结与推荐 ●多原发肺癌(MPLC)是一种相对不常见疾病,但看似越来越多。这可能是由于当代所用筛查策略和患者生存改善,发生新发原发性肺癌的机会随之增加。 ●腺癌发病率的持续增加引起出现两个病灶组织学类型相同的临床情况。多灶性腺癌是一种单独的临床疾病,需要特殊考虑。 ●治疗需要多学科小组的细心协调和仔细评估,包括对影像学检查、病理学的仔细评估以及由胸外科医生进行手术切除评估。所有MPLC患者的治疗均应考虑以治愈为目的,因为特定的患者群体将长期生存。 ●分期是MPLC切除后总生存(OS)的最重要预测指标。 ●如果可行,外科切除目前是标准治疗方案。首选按照标准原则进行手术切除,即进行解剖性肺叶切除术或者肺段切除术。 ●经恰当心肺功能测试后显示手术风险高的患者,或可能需要治疗其他病灶的患者,可考虑对1个或潜在多个病灶进行确定性非手术局部治疗,特别是立体定向体部放射治疗(SBRT)。 ●对于已行切除同时性原发灶的患者,应根据分期最高的病灶决定是否进行基于铂类的辅助化疗。对于同时性或者异时性Ⅱ期或Ⅲ期非小细胞肺癌(NSCLC)患者,根据在单个病灶切除术后患者中已观察到的生存获益,均应考虑进行基于顺铂的的辅助化疗。
 李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2388人已读
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2388人已读 - 引用 肺叶或肺段等肺切除手术后会有什么影响?
很多人从心底并不恐惧手术,也并不认为手术是一件很危险的事。 相反,他们对手术完的生活质量,十分在意。 从逻辑上,这是可以说得通的, 因为术业有专攻,手术风险如何,患者本身无法调控,专业的事情就交给专业的人办。 对于他们而言,他们关心的是, 肺部手术对身体会有什么影响? 具体而言, 术后会不会痛呀? 术后对肺功能会有多大影响?能保证怎样的生活质量呀? 手术完了以后,我之前那些症状能消失么? …… 既然大家这么关心,那么今天我们就来聊一聊这个话题: “肺部手术对身体会有什么影响?” 2 “肺部手术指什么?” ? 人体有5个肺叶,其中左肺2叶、右肺3叶。 我们常说的肺部手术,根据切除范围,可以分为, 亚肺叶切除、肺叶切除、全肺切除。 其中,亚肺叶切除,指的是切除范围不足肺叶,包括楔形切除和肺段切除; 肺叶切除指的是切除一个肺叶; 全肺切除指的是切除一侧肺,在左肺是2叶,而在右肺是3叶。 针对恶性肿瘤的常规肺部手术,指的是肺叶切除术。 3 “肺部术后身体恢复分几个阶段?” ? 尽管手术以后,每个病人的恢复程度千差万别, 但郑医生总结起来,应该可以分为以下3个阶段: 阶段一. 出血应激期 这个阶段,指的是手术以后24小时, 这个时间段内,手术创面结痂不牢,尽管手术顺利, 但仍有可能因出血而需二次手术干预。 这里必须强调的是,这里的出血,指的是 “采用传统内科手段无法止住的活动性出血,可能会影响患者生命” 因此,患者术后创面渗血不在考虑范围之内。 ? 阶段二. 快速康复期 这个阶段指的是术后过了24小时,出血风险基本消失以后到出院前的这个阶段。 在这个阶段,我们面对的是最大威胁来自肺炎, 因此我们强调早期有效的咳嗽排痰。 在这个阶段,我们追求的是快速康复, 因此我们鼓励患者早期下地,迅速拔管。 这个阶段长短是因院而异的, 以郑医生所在的肺肿瘤外科而言,大部分肺部手术患者均在术后第四天顺利出院, 那么对于大部分患者而言,这个阶段指的就是 “术后第一天到第四天”这个阶段。 ? 阶段三. 缓慢复原期 缓慢复原期,指的是患者出院以后,身体慢慢适应手术改变, 修复手术创伤,重塑身体机能。 一般而言,这个阶段要维持到术后半年。 大部分患者关注的恢复问题,集中在这个缓慢复原阶段。 ? 4 “我的身体到底能恢复成什么样呢?” 在这个许多病人最关心的问题逐一回答如下: Q1. 我之前的不适症状会消失么? 一般而言,因不适求诊的患者,其症状往往包括: 刺激性咳嗽、痰中带血、胸痛、胸闷。 在刺激性咳嗽方面,这个症状来自中央型肺部肿瘤对支气管的刺激 在痰中带血方面,这个症状来自中央型肺部肿瘤破溃出血导致 在胸痛方面,这个症状一般来自肺部肿瘤侵犯胸壁神经所致 因此,以上3种症状在切除肿瘤以后均会消失。 在胸闷方面,这个症状一般来自巨大肺部肿瘤,占据巨大空间而压迫有效的呼吸面积导致。 这个症状,将在切除肿瘤以后,残余肺组织有效复张以后,不同程度的消失。 ? Q2. 手术完了,我怎么反而咳起来了? 现在,由于低剂量螺旋CT的普及,发现了很多往常不能发现的早期肺癌。 在这部分患者中,往往没有主观症状,但却在手术完了以后咳起来了。 为什么? 因为肺部手术围绕动脉、静脉、支气管三大管道系统进行, 切肺就是切这三大管道。 在微创手术时代,胸腔镜是主流手术方式, 有限的操作空间带来了手术器械的高速发展, 产生了——一次性切割闭合器。 ? 如上图所示,就是一个最常用的术后一次性切割器, 在这个切割器头里,中间是刀片,两边是呈现订书机一样的装置 切到哪里,两侧的钉子就把切断的组织钉紧而防止出血。 ? 如上图所示,支气管残端就是这样被钉子钉上的。 而在手术以后的短期之内,钉子这个异物将会持续的刺激支气管,而诱发刺激性咳嗽。 随着时间的推移,钉子诱发的炎症反应将钉子包裹住,这个刺激性咳嗽才会停止。 一般情况下,这个期限是术后3~6个月。 Q3. 出院了,伤口表面的感觉异常,木木的,感觉肉都不是自己的。 ? 如上图所示,为人体的肋间神经分布图,可见肋间神经是从脊神经发出来的,是负责单侧胸廓的感觉神经(不越过胸骨中线)。 肺部手术,不论在开放还是腔镜,都会对肋间神经造成不同程度的损伤。 因此,导致受损肋间神经远端的部分神经功能障碍, 即表现为皮肤麻木感、甚至“肉都不是自己的”错觉。 但是,这种感觉一定不会越过中线, 简单来说,左胸的手术,一定不会有右胸的感觉异常。 因此,我们可以此为评估标准来为自己的不适症状定性, 如果没越过中线,那么就是正常反应; 如果越过中线,那么单纯用手术创伤来解释就不行了,可能合并有其他问题。 正常情况下,在还没有离断的情况下,肋间神经可以实现一定程度的自我恢复, 一般3-6月以后,相关症状会有一定程度的缓解,然后趋于稳定。 Q4. 出院了,伤口还是会痛。 ? 做了这么大的手术,会痛一段时间也不奇怪。 一般情况下,手术后1月伤口的疼痛会在很大程度上缓解; 1月后,伤口疼痛可以表现为一种间断的隐痛,基本不影响生活; 半年后,伤口的疼痛感基本可以消失。 Q5. 肺叶切了,肺功能还能恢复正常么? ? 肺是负责通气换气的,切了一个肺叶,必定会在短期内造成肺功能的下降。 表现为很容易胸闷、气促,活动耐量下降。 但是在出院后的一段时间内,肺功能可以逐渐恢复。 肺功能的恢复,取决于残余肺组织的代偿情况。 简单来说,这种代偿有两种途径: 同侧肺叶的代偿性膨胀, 对侧肺叶的代偿性膨胀并引发纵隔移位。 这里为了突出这个恢复的过程,郑医生选取一个术后初始肺部情况不佳的患者为例子进行讲解。 在术后一月内,肺功能的恢复是基于同侧不同肺叶的代偿来实现的。 但在一个月以后直至半年这个时间内,对侧的肺组织开始代偿,协助纵隔移位。 在术后半年的片子中,可以明显看到心脏偏左了,此时肺基本已经把整个胸腔都胀满了。 因此,手术完了以后,肺功能的恢复至少需要半年的时间。 但是,这仅仅是一个宏观的改变,即肺可以吹的起来,反应的是通气功能。 而在换气功能方面,则需要有效的保证肺泡-毛细血管上皮的通透性,减少炎症、减少痰液积聚。 因为少部分的痰液未咳尽,虽然不影响通气,却会对肺泡的通透性造成很大的影响,即影响换气。 恢复成什么样子,除了自身的基础体质,最重要的就是在手术的快速康复期乃至缓慢复原期的早期阶段,能够保持一个积极有效的咳嗽。 一方面促进肺复张,一方面排出积聚痰液。 在正常情况下,一个成年人,接受肺叶切除半年以上,基本能恢复其术前80%以上的活动耐量。 4 身体恢复需要注意什么问题? ? 为了促进这段时期的恢复,郑医生有一些小建议: 一、正常饮食,规律休息 其实出院以后,排便正常以后,就基本可以恢复一个正常的饮食了。 这个并不是说,你原来怎么吃就怎么吃,原来什么生活习惯就什么生活习惯。 郑医生强调的正常饮食,指的是一种营养均衡的健康的膳食习惯。 在忌口方面,除了的“鹿茸、老山参”不推荐之外,也没有特别强调。 为什么不能吃鹿茸、老山参? 因为它们太补了,促进血管再生,不利于肿瘤恢复。 (该观点来自医学前辈代代传承,并未考据) 此外,强调一个规律的睡眠休息,力求以一种健康的生活习惯促进身体机能的正常恢复。 ? 二、适量运动,循序渐进 不可冒进!不可冒进!不可冒进! 重要的事情说三遍! 身体的恢复一定是一个循序渐进的过程, 在运动方面尤其如此,切不可冒进,否则过犹不及,反受其害。 ? 三、正规治疗、定期复查 在肿瘤患者中,手术以后,除了面对一个身体的恢复,还就是一个后续的治疗问题。 很多病友跟我反应,曾经有某个朋友化疗,生不如死。 确实,在早些时候,在那个医疗水平相对不发达的年代,肿瘤的治疗就是化到死,化疗到身体不堪重负而停止运转。 但是,在目前医疗水平大踏步前进的阶段, 在目前药物治疗发展到第三、四代的阶段, 在目前各方面毒副作用处理手段十分完备的阶段, 我们有太多的好药、新药可供选择, 后续的治疗,即便是化疗,也根本没有想象的那么痛苦,对身体也不会造成那么大的负担。 因此, 大数据时代到来,医疗已经进入到一个难以想象的飞速发展的年代, 现在肿瘤治疗理念的更新迭代速度之快, 夸张点说,专业人士“一月不看书,不识身边物”。 所以,广大非专业人士切莫基于老旧的观念认识耽误最佳的治疗时间, 规范的治疗是获取良好生活质量、长久生存时间的根本。 最后,祝广大病友都能获得良好的术后康复~
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科2.2万人已读 - 引用 2018中国专家肺结节共识
肺结节的患病率如何 肺结节的发病率35.5%,其中诊断为肺癌的肺结节分别占0.54%; 年吸烟量超过30包的人群肺结节的发病率为25.9%,其中诊断为肺癌的占 1.1%; 孤立性肺结节在30岁以下人群中的恶性率为1%~5%,70岁人群肺结节恶性率可达80%以上; 单纯性磨玻璃样肺结节(pGGN)的恶性比例可达59%~73%,伴有实性成分的GGN(mGGN)恶性比例可高达80%以上; 肺结节的分类 大小:微小结节<5毫米;小结节5-10毫米;肺结节10-30毫米;肺肿块>30毫米。 密度:纯磨玻璃结节、混合磨玻璃结节、实性结节 高危人群的定义 年龄≥40岁且具有以下任一危险因素者:1) 吸烟≥20 包/年(或400 支/年),或曾经吸烟≥20 包/年(或400 支/年),戒烟时间<15 年;2) 有环境或高危职业暴露史(如石棉、铍、铀、氡等接触者);3) 合并慢阻肺、弥漫性肺纤维化或既往有肺结核病史者;4) 既往罹患恶性肿瘤或有肺癌家族史者。 影像学部分有关问题 不推荐X线胸片用于常规肺部结节的评估 推荐肺部结节患者行胸部CT薄层扫描 PET-CT对于大于8毫米的实性结节无法确定良恶性时可以考虑,对纯磨玻璃结节或实性成分小于8毫米的混合磨玻璃结节无明显优势 影像学良恶性诊断要点 以下特征倾向恶性: 结节较大 圆形或类圆形,或不规则形 分叶、毛刺、胸膜凹陷、血管集束征 瘤肺边界清楚但不光滑或者毛糙甚至有毛刺 密度不均匀,实性成分超过50% 支气管被包埋伴局部管壁增厚、管腔不规则 CT增强示强化>15HU 随访中出现恶性特征、病灶增大、实性成分增多、血管生成 以下特征倾向良性: 结节较小 无分叶,周围纤维条索、胸膜增厚 边缘模糊或边缘清楚光整 小于5毫米密度均匀的纯磨玻璃结节常提示不典型增生 随访中短期内外部特征变化明显、密度变淡、迅速变大,实性结节2年以上仍稳定 临床处理策略 孤立性实性结节: 8-30毫米:视恶性概率高低选择每半年随访、增强CT或PET-CT、非手术活检或手术切除活检,手术与否还要综合考虑手术风险大小 小于8毫米:分为小于4毫米、4-6毫米及6-8毫米视恶性可能性大小,选择3-6个月、6-12个月或12-24个月随访复查,稳定后仍年度随访复查。 孤立性纯磨玻璃结节: 小于等于5毫米:6个月复查,此后年度复查 大于5毫米:3个月复查,此后年度复查 孤立性混合磨玻璃结节: 小于等于8毫米:3、6、12、24个月复查 大于8毫米:3个月复查,若持续存在建议进一步PET、非手术或手术活检切除等 非孤立性多发性肺结节: 全面综合评估、密切随访、早期处理(个人以为相对孤立性结节,多发结节的处理在同等恶性概率下更要慎重) 小结 肺结节可按数量(孤立性、多发性)、直径(微小结节、小结节、肺结节)、密度(pGGN、mGGN)进行分类; 薄层、低剂量CT扫描是检测和诊断肺结节的首选方法,强调关注结节外部结构和内部特征,功能显像为区分良恶性提供更多依据; 连续CT扫描密切随访观察、非手术活检和外科手术是肺结节的基本处理策略,直径≤8 mm的肺结节筛查肺癌高危因素,以随访为主;8~30 mm的肺结节评估恶性肿瘤概率,因地制宜; 亚实性肺结节(pGGN、mGGN)的恶性概率高,应密切随访,早期处理。
李晓峰 副主任医师 山东省公共卫生临床中心 胸外科5572人已读



