杨军医生的科普号
- 精选 “淋巴结活检”有讲究
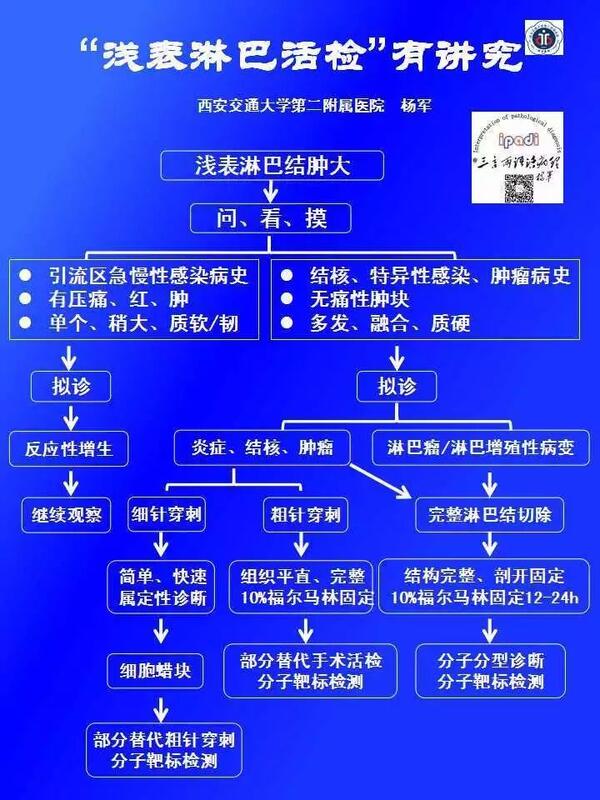
“淋巴结活检”有讲究! 杨军 西安交通大学第二附属医院病理科 浅表淋巴结肿大是临床最为常见的患者或家属可自我触及的疾病体征,其发病年龄涵盖所有年龄阶段,相当数量患者以此为主述就诊。 但是,由于淋巴结病变的多样性和复杂性,加之宣传不当和患者、家属的过度关注,使得淋巴结活检存在明显的过度检查和不当检查的问题。经常会有大量患者因颈部浅表淋巴结肿大就诊的接受了不必要的淋巴结活检。 而与此同时,由于临床专科医生专业知识的局限性导致的淋巴结活检取材、固定不当使得这一问题犹显复杂。 因此,本文仅就浅表肿大淋巴结活检相关专业和科普知识以及临床问题进行讨论,并且提供相关的处理原则,以供参考。 1、浅表淋巴结肿大急不得 发现浅表淋巴结肿大(皮下结节)及时就诊无可厚非。但是,由于浅表淋巴结肿大病因繁杂,涉及从急、慢性非特异性或特异性炎症、反应性增生到淋巴瘤、淋巴组织增殖性病变及转移癌等各种类型病变。 尽管,淋巴瘤和其它恶性肿瘤、转移癌的发病率的上升。但是,不同类型恶性肿瘤各有其特点,且绝大多数浅表淋巴结肿大仍以非特异性急/慢性炎症、反应性增生和特异性感染为主。 大多浅表淋巴结肿大大多自行恢复正常,不需要特殊处理: 其中,以头颈部器官的非特异性感染(如感冒、上呼吸道感染等)引起的引流淋巴结反应性增生最为常见。而且,这种淋巴结的反应性增生多出现于发育期的少年儿童,并常常会持续时间较长(数周甚至数月之久),这也是儿童期免疫系统发育成熟的表现。因而,大多浅表淋巴结肿大大多会多一段时间自行恢复正常,并不需要特殊处理。 要知道,淋巴结就是人体免疫系统的安全检查站,不必要的淋巴结活检会对机体造成不可挽回的损失。 所以,浅表淋巴结肿大,毋需过份着急,让子弹先飞一会儿。 2、症状、体征很重要 正常淋巴结具有特有的皮质(淋巴滤泡、滤泡间区)和髓质结构,而判断、鉴别正常组织结构的改建方式和程度是淋巴结活检病理学诊断的主要依据。 虽然引起浅表淋巴结肿大的病因很多,但不同疾病引起的浅表淋巴结肿大的机制和病理形态学改变各不相同。例如: (1)急性炎症以急性炎细胞浸润、坏死、增生为主,大多可依临床病史、症状、体征和实验室检查明确诊断,并不需活检,即便活检,选择简单易行的细针穿刺方式就可诊断。 (2)淋巴结引流区组织器官的急性、慢性炎症也常常会引起引流淋巴结的肿大,质韧如鼻尖,大多需要数周数月时间方可恢复,且以少年儿童为主,并有感染病史,活检价值不大。 (3)结核等特异性病原体感染引起皮下质韧无痛性淋巴结肿大或融合,且以年轻患者为主,细针穿刺虽可诊断,粗针穿刺活检能够确诊。 (4)淋巴结转移癌患者以年长者为主,多有恶性肿瘤病史,查体可见淋巴结肿大、融合,硬如额头。细针穿刺活检大多可以定性,如果与细胞蜡块技术相结合能对一些病例进行分型诊断和分子靶标检测,而粗针穿刺可替代完整淋巴结手术活检等创伤性检查,实现转移癌的分子分型诊断和分子靶标检测。 (5)淋巴瘤和淋巴增殖性病变多引起多个、多部位单个或融合性淋巴结肿大,此类患者尽可能采用完整淋巴结手术活检,细针穿刺和粗针穿刺活检常常难以确诊,而且穿刺引起的继发性改变甚至会对后续诊断造成不良影响。 3、浅表淋巴结活检有讲究 活检组织病理学检查是诊断浅表淋巴结肿大的重要方法,甚至被认为是诊断的金标准。常用的具体方法包括细针穿刺活检、粗针穿刺活检、完整淋巴结切除活检三种。不同方法各具优缺点、适应症及取材固定方法。而临床实践中因为活检方法选择不当造成的样本不能诊断、漏、误诊时有发生,轻则患者遭受不必要的痛苦和经济损失,还难以明确诊断,还需再次活检;重则增加患者及家属的不信任感甚至医疗纠纷。 那么,浅表淋巴结活检方法到底应该怎么选?这还真有讲究 : 首先,接诊医师应注重问诊、查体,收集详细病史、临床体征、非创伤性检查和实验室检测结果,并结合年龄、性别做出初步诊断和必要的鉴别诊断。这个时候,患者及家属的耐心、包容、信任将十分重要,甚至会直接影响整个的就诊过程,往往由于患者及家属的不信任,或者类似于“如果不是这个病怎么办”?“耽误了怎么办”?等过度怀疑的问题常常会让很多接诊医生给出一个炎症?结核?肿瘤?淋巴瘤?式的包含所有可能性的、貌似无比正确的宏观诊断。不可讳言,这名患者很可能会遇到多度检查的风险。 其次,要根据初步诊断结合不同活检取材方法的优缺点、适应症及检查目的合理选择,具体来说: (1)细针穿刺活检 细针穿刺活检属于细胞病理学诊断取材方法,具有操作简单、快捷、痛苦小、费用低的特点。大多1小时内就可获得病理诊断报告。但是,由于该取材方法难以获得完整的组织结构,且只能进行一次性制片、染色,难以进行相关分子靶标的检测。因此,诊断难度大、难以明确分型,主要用于拟诊肿瘤(主要是转移癌)和急、慢性炎症性病变的定性和鉴别诊断。近年来,由于细胞蜡块制备技术的普及和完善,将细针穿刺活检方法获取样本制备成细胞蜡块已能实现对多种实体肿瘤的明确分型诊断和个体化治疗相关分子靶标的检测,并在某种程度上达到粗针穿刺活检的效果。尽管如此,该方法不适于淋巴瘤和淋巴组织增值性病变的诊断。 (2)粗针穿刺活检 粗针穿刺活检属于微创检查,虽然费用较高、操作较复杂,却能获得组织样本从而能对大多数疾病的做出明确诊断,还能进行各类分子靶标的检测。因而,在很大程度上替代了传统手术切除活检取材方法。但是,由于该方法存在样本太少或缺乏有诊断价值成分而不能诊断的风险。该方法可适用除淋巴瘤和淋巴增殖性病变之外的几乎所有浅表淋巴结病变的活检诊断。 (3)浅表淋巴结手术切除活检 正常形态结构是否存在是诊断淋巴结病变的形态学基础。其中,淋巴瘤和淋巴增殖性病变的病理诊断对于淋巴结的完整性具有近乎苛刻的要求。所以,尽管细针穿刺活检和粗针穿刺活检技术的广泛应用,浅表淋巴结手术切除活检的应用大幅下降。但是,对拟诊淋巴瘤和淋巴增殖性性病变的患者,浅表淋巴结手术切除活检仍是最受推荐的首选活检取材方法,在患者难以耐受手术的情况下方可选择粗针穿刺活检方式取材。 由于淋巴结结构是否完整是诊断淋巴瘤及淋巴增殖性病变的形态学基础。尽管病变淋巴结脆性增加,易于破损。但是,在手术活检取材过程中,仍需尽可能保持淋巴结结构的完整性。 此外,当有多个淋巴结肿大时,应优先选择颈部淋巴结,腋窝淋巴结次之(因常见脂肪组织浸润),尽可能避免选择腹股沟淋巴结,因为此处淋巴结受易受会阴、肛门及下肢慢性炎症出现慢性炎症和明显纤维化改变而对诊断造成严重影响,影响易干扰正确诊断。如果仅有腹股沟淋巴结肿大,则应检查有无盆腔淋巴结肿大和相关病史,以确认是否活检的必要性。如有必要取材,应尽可能选择最大的淋巴结活检。 虽然,浅表较小的淋巴结易于活检,但往往可能只显示非特异性的增生,而较大、较深部位的淋巴结才具有诊断性特征。 (4)淋巴结活检样本不适于快速冷冻切片病理检查 所有淋巴结病变,尤其是拟诊淋巴瘤和淋巴增殖性病变的肿大淋巴结不适于快速冷冻切片病理诊断。这不仅在于淋巴瘤的诊断本身就需综合组织形态学、细胞遗传学、基因遗传学结果的分子诊断,更由于冷冻过程对于组织样本的造成的生物物理性破坏会直接影响IHC、FISH、RT-PCR等后续检查结果的可靠性,故应尽量避免图一时快捷或迫于患者及家属的压力而采用不必要的快速冷冻检病理诊断。而对于需经开胸或开腹等手术切取的深部等淋巴结,采用冷冻切片检查的目的则仅限于确定样本是否具有代表性,而并非用于获得具体的病理诊断。 4、活检样本固定要规范 无论那种活检方法取材,对于活检样本的规范化固定是进行病理学诊断和分子靶标检测的基础。 (1)细针穿刺活检样本的涂片和固定 及时均匀涂片和湿固定是诊断的前提,切忌用力挤压、反复涂抹和研磨。常用固定液为10%福尔马林或95%酒精(可含少许冰醋酸)。近年来,直接将细针穿刺样本制备成细胞蜡块,让这一技术焕发了新的生机,尤其是对转移癌的诊断具有重要的意义。 (2)粗针穿刺活检样本的处理和固定 保持粗针穿刺活检样本的完整性尤其重要。具体操作中,应先将粗针穿刺组织条从空心针中缓慢推出至非脂溶性且透水性良好的载体(推荐原生棉擦镜纸等)上,进行适当包裹后放入底部平整的标本瓶内加足量(完全淹没样本,4~10倍体积)的10%的中性福尔马林固定液中固定4~6h以上再进行处理,包埋时每个蜡块内只包埋一条组织。操作全程均应尽可能保持组织条的完整性,切勿弯曲反折。 (3)完整淋巴结手术切除活检样本的处理和固定 完整淋巴结手术切除活检是淋巴瘤及淋巴增殖性病变诊断的首选取材方式。除淋巴结结构的完整性之外,淋巴结的良好固定也是淋巴瘤诊断和分子分型的基础。由于淋巴结具有较厚的纤维包膜,因此,应先沿最大面将淋巴结剖开,再浸入足量的10%中性福尔马林固定液中充分固定(12~24h)。 总之,虽然都表现为浅表淋巴结肿大,但不同疾病引起的淋巴结重大的病变性质差异甚大。因此,首先应通过详细地询问病史、查体并结合辅助检查和实验室检测结果决定是否需要进行淋巴结活检,对于确需进行淋巴结活检者应结合淋巴结肿大的病因、年龄、质地、拟诊病变类型采用适宜的活检取材方式。同时,对于任何一种活检取材样本的规范化处理和固定也应该受到足够的重视。可以说,淋巴结活检病理诊断最大的挑战并非来自于待诊淋巴结病变的复杂性,而更多是来自不适宜的取&材方式、人为组织结构破坏和不规范的固定方法和组织处理流程。 文 l 病理科 杨军 编辑 l 赵文颉 http://blog.sciencenet.cn/home.php?mod=space&uid=288672&do=blog&quickforward=1&id=1093152&from=timeline http://mp.weixin.qq.com/s/arlOrKOxqcs5L1e9f29pEg
 杨军 主任医师 西安交大二附院 病理科1.1万人已读
杨军 主任医师 西安交大二附院 病理科1.1万人已读 - 精选 HPV感染
人乳头瘤病毒是一类高度异质的双链小分子DNA病毒,具有严格的种属和组织特异性,主要感染人类和多种高等脊柱动物皮肤和黏膜组织,引起相应部位上皮组织的增生性病变,可分为引起良性增生病变的低危型以及与人类多种组织恶性肿瘤密切相关的高危型,根据核酸序列同源性,目前已发现100多种型别,有30多种可从受感染生殖道组织分离不同型别的HPV引起不同的疾病。1、HPV分型与疾病HPV 1、2、3、4、7、10、26~29在正常或免疫缺损个体中引起良性疣;HPV 5、8、9、12、14、15、17、19~25、36、46~50在免疫缺损个体中引起扁平状损伤;HPV 6、11、34、41~44、51~55引起生殖道或呼吸道黏膜非恶性湿疣,HPV6和11是90%以上生殖器疣和喉乳头瘤的致病因子,HPV 11主要寄生于肛门黏膜,6型主要寄生于阴道、阴茎上皮,16、18主要寄生于宫颈。根据与宫颈癌相关程度,将与宫颈癌相关程度较为清楚的HPV型归为高危型HPV和疑似高危型HPV,与尖锐湿疣等良性疾病相关的HPV被归入低危型HPV,一般认为低危型HPV的感染不会诱导宫颈癌的发生:高危型HPV有15种(16、18、31、33、35、39、45、51、52、56、58、59、68、73、82);低危型有12种(6、11、40、42、43、44、54、61、70、72、81、candHPV 89),3种中国人群常见疑似高危型HPV病毒类型(26、53、66),HPV16、18与宫颈癌的发生高度相关。育龄妇女HPV感染率11.6%,而且以高危型HPV感染为主,排序在前面5位的HPV型别依次是58,52,16,18,33。2、HPV感染的相关因素流行病学调查显示性行为为主要途径,直接皮肤接触是传播的最有效途径,不通过血液或体液传播,会阴部的接触是获得HPV的主要条件,而性交不是必要的,性伴数多而不固定是宫颈HPV感染的高危因素,累计性伴数达6个或以上的女性宫颈HPV感染率是只有1个性伴者的4倍,性接触的频率也是宫颈HPV感染的危险因素。年龄是宫颈HPV感染的相关因素,高峰年龄是18~25岁,随年龄增加,机体对HPV抵抗力增强,宫颈HPV感染逐渐下降,首次性交年龄越小,宫颈HPV感染率越高。避孕措施对宫颈HPV感染是否有保护作用存在争议。有人认为吸烟减少宫颈黏膜LANGER-HANS细胞,降低机体免疫力,诱导宫颈CIN形成,是宫颈HPV感染的高危因素;免疫力对宫颈HPV感染起重要作用。经济收入低,受教育水平低可能通过高危性行为和卫生保健等因素增加HPV感染;HIV感染者宫颈HPV感染率高除与机体免疫状态有关外,还与更多的引起HPV感染的危险行为有关;沙眼衣原体和单纯疱疹病毒血清抗体阳性者的宫颈HPV感染率是阴性者的2倍。细菌性阴道病和宫颈HPV感染也有相关性。总之,性伴数是宫颈HPV感染的高危因素,首次性交年龄、种族、免疫状态、其他性病及社会经济地位均与宫颈HPV感染相关。吸烟、妊娠、口服避孕药及阴茎套的应用等因素与宫颈HPV感染关系尚不肯定。3、HPV感染的特点HPV在年轻的性活跃人群中感染很普遍,可以同时感染多个型别HPV,既往感染过一种型别HPV的个人仍可能再次获得同种型别的感染,但一种型别HPV的存在,可抑制另一种型别HPV的复制,因此通常一种型别与疾病有关,两型或以上宫颈HPV感染率为2%~27%,有报道较多为10%~20%。低危型与低度宫颈上皮内瘤变有关,高危型与高度宫颈上皮内瘤变有关,绝大多数的感染是一过性的,病毒感染的早期可能存在免疫逃逸,故没有炎症反应,多数无临床症状,90%以上特定型别HPV的清除在1~2年以内,宫颈HPV感染平均持续时间是8个月,24个月后只有9%的妇女仍持续感染,说明宫颈HPV感染多为暂时性,其中绝大部分可以清除感染而无可见的临床病变,持续HPV感染对于宫颈癌进展具有非常重要的意义。生殖器HPV感染的潜伏期变化极大,一般生殖器疣在感染3~6个月后显现,也有研究表明潜伏期为数个月甚至几十年。从HPV感染到释放病毒约有3周,造成损伤的个体在大多数情况下可以产生有效的细胞免疫反应,HPV由被感染的复层鳞状上皮的表层脱屑角化细胞释放,HPV颗粒突破下生殖道表皮,进入表皮细胞的基底层,随着基底层干细胞的子细胞分裂以及在垂直方向上的成熟化,病毒在基底层以上鳞状细胞中复制,成熟的病毒在表面细胞分离时释放到环境中,HPV感染至出现损伤之间可能数周到数月。新发感染大多1~2年内会发生自愈,仅有少数的HPV感染会保持潜伏性,几年或几十年后会再激活。年轻人HPV感染多为自限性,多无症状,而持续性宫颈HPV感染多见于年龄较大者。从HPV感染到宫颈上皮内瘤变再到宫颈癌的演变过程,从正常宫颈细胞向宫颈上皮内瘤变及宫颈癌的转化是多因素参与、渐进发展的过程,高危型人乳头瘤病毒持续感染是宫颈细胞恶性转化中的必要因素从HPV感染到宫颈浸润癌大约为20年左右,说明除了HPV感染,宫颈癌的发病过程中还有许多未知因素。4、致病机理HPV具有嗜上皮性,因机械原因如上皮薄,生物性原因如宫颈上皮储备细胞对HPV敏感等,生殖道致瘤性HPV往往感染宫颈的移行带上皮,感染上皮细胞后,呈游离状态存在于染色体外,不引起病变,良性病变或癌前病变,癌前病变则与病毒DNA整合入宿主染色体密切相关。HPV的DNA链在E1或E2的开放读码框断裂,使HPV-DNA能够整合入染色体脆弱区,E6、E7有促进和维持整合状态的功能。然而,病毒整合并非恶变绝对必要,一些癌被发现只含游离状态的HPV-DNA或含有游离和整合状态的混合,HPV的E6蛋白可通过作用于P53改变细胞生长,高危型HPV的E6蛋白与P53结合导致P53失活,并促进其在细胞内的降解,P53的降解失活阻碍细胞对DNA损伤的反应,由此导致遗传性状改变的积累,进而产生恶变的基因型。E7蛋白则含有与PRB的结合部位,PRB是抑癌基因,E7与RB亲和力高,高危型HPV的E7蛋白与PRB结合后导致PRB蛋白功能失活降解,改变细胞生长周期的调控机制,使细胞永生化和对恶性变的防疫进一步受到影响,最终导致癌变。5、HPV感染的防治HPV感染的防治,尚无治疗方法,可针对上述高危因素进行预防,对本地区有高危型HPV感染人群应定期随访,及早预防是有必要的,对有高危型HPV阳性且细胞学阴性,30岁以上女性,适宜1年间隔的反复筛查,对于30岁以下的青少年进行高危型HPV筛查不太需要,因为较年轻的女性会拥有多次重复周期的HPV感染,这类感染往往仅与微小的细胞学变化有关,这个年龄层的女性往往会自我清除病毒感染并恢复细胞学变化至正常,检测一过性感染的HPV没有意义,会给女性带来不必要的焦虑;30岁以上女性,HPV16,18,33,31型感染,即使细胞学检查未见上皮内病变和恶性细胞,仍建议阴道镜检查。
杨军 主任医师 西安交大二附院 病理科2.3万人已读 - 精选 魏则西的去世,希望由此可以有些改变
魏则西——一群不幸且值得同情的恶性肿瘤患者的中的一位,对于生的奢求是导致其上当受骗的重要原因;而不良医者和野蛮商人食腐类动物的嗜血本性则是加剧悲剧进展的罪恶推手,而尸位素餐的监管部门才是真正的幕后元凶。无疑又是一个典型的虐心事件,希望由此可以有些改变……1. 作为商人,能赚钱的行业其实很多,又何苦抓着一群将死之人非得敲骨吸髓才肯罢休。还是积点阴德吧,别以为有俩糟钱、移得了民、获得了绿卡就可万事大吉,可是空气是公平的、水是公平的、食物链是公平的。大家不过在易子而食、析骸而爨罢了。最终也将毁掉他们自己。世事无常,保不齐那天也会患得此病成了他人刀俎间之鱼肉。2. 作为医者,健康所系、生命相托,在基本伦理道德基线上规范医疗行为,告知患者真相、制定适宜治疗方案,毕竟此类疾病,治疗大多是安慰而已,适可而止,这是底线和根本。别再为了几多名利做个替别人数票子的帮凶。3. 生物免疫治疗技术仍旧是最终治疗癌症的希望之一。但在目前仍是一项发展中的技术,可作为一项辅助治疗方法,既不如事件中那么不堪,也不是一些人吹嘘的那么神奇,合适的病人合适的时机使用还是有些作用的。但寄希望于起死回生,那就是个人认知的问题了。4. 尸位素餐的监管部门才是最应受到谴责的罪人。他们的不作为、乱作为毁掉的不仅仅是患者的生命,也是一个产业、一个行业、甚至一个国家的命运。正所谓一方水土养一方强盗。所以,作为恶性肿瘤患者,活在当下认识到生的无奈、死的必然很是重要。因此,还是早点理智地、坦然地规划一个与家庭经济能力相适应的计划,安然渡过癌后余生吧。这种病很多情况下花十万和花百万的结果没有本质不同…
杨军 主任医师 西安交大二附院 病理科1279人已读 - 精选 宫颈癌筛查与病理诊断那些事
本文系杨军医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载
杨军 主任医师 西安交大二附院 病理科2561人已读 - 精选 免疫组织化学检测结果判读标准
一种免疫组织化学检测结果判读标准和方法杨军 康安静 苏宝山 陈晓黎摘要:免疫组织化学(Immunohistochemistry,IHC)是病理学诊断、鉴别诊断及特异性分子靶标筛选、鉴定的最重要技术手段之一,也是肿瘤个体化治疗相关靶标检测的基础性平台技术。但自IHC应用以来,尽管,已有多种IHC判读标准和方法,但由于分级标准差异大和主观性强以及对IHC结果准确性和精细化要求的提升,现有IHC结果判读标准已不能满足临床工作的需要。为此,该文拟在现有基础上,提出一种新的IHC结果判读标准和方法,以期为实现IHC的标准化提供参考。关键词:免疫组织化学;免疫细胞化学;免疫表型;判读方法中图分类号:R392-3;R392.31;R-331 免疫组织化学(Immunohistochemistry,IHC)又称免疫细胞化学,是生命科学、尤其是现代病理学诊断、鉴别诊断、肿瘤特异性分子靶标筛选、鉴定的最重要技术手段之一,也是肿瘤个体化治疗相关靶标检测的基础性平台技术。然而,自IHC应用以来,关于IHC检测结果判读标准和方法的问题一直困扰着从事和应用该技术的相关人员。尽管,目前已有多种IHC判读标准和方法在临床上广为使用[1,2,3]。但由于操作繁琐、分级标准差异大和判读的主观性强等因素,以及对IHC结果准确性和精细化要求的提升,现有IHC结果判读标准和方法已不能满足临床工作的需要。为此,该文拟在现有的基础上,提出一种新的IHC结果判读标准和方法,以期为实现IHC的标准化提供参考。表1:免疫组织化学检测结果判读标准和方法表达模式判读标准判读方法胞核型l 0级:无阳性细胞:0%l Ⅰ级:阳性细胞数:1-10%l Ⅱ级:阳性细胞数:11-20%l Ⅲ级:阳性细胞数:21-30%l Ⅳ级:阳性细胞数:31-40%l Ⅴ级:阳性细胞数:41-50%l Ⅵ级:阳性细胞数:51-60%l Ⅶ级:阳性细胞数:61-70%l Ⅷ级:阳性细胞数:71-80%l Ⅸ级:阳性细胞数:81-90%l Ⅹ级:阳性细胞数:91-100%在低倍镜下(4X或10x)浏览整张切片,观察目标细胞中(如肿瘤实质细胞)细胞核着色情况和胞核阳性细胞的分布状态,选择高表达区域,转换物镜到较高放大倍数(20x或40X)估算核阳性细胞在整张切片中同类型细胞中的百分比作为整张切片的判读结果,既可以计数资料方式以百分比报告,也可按照0~10级的等级资料分级报告。胞膜型l 0(阴性):无着色l 1+(弱阳性):任何比例的细胞呈现微弱、不完整膜着色l 2+ (阳性):>10%的细胞呈现弱至中等强度、完整但不均匀膜棕黄着色的细胞呈现弱至中等强度、完整但不均匀膜棕黄着色l 3+(强阳性):>30%的细胞呈现强、完整膜棕褐着色在低倍镜镜下(4X或10x)浏览整张切片,确定要观察的目标细胞(如肿瘤实质细胞)的细胞膜着色和网格状分布情况,对于在低倍镜镜下(4X或10x)不能明确阳性细胞的情况下,转换较高放大倍数(20x、40X)进行观察,按照目标细胞膜彼此间连接形成的网格状结构的完整性、着色强度、均匀程度及其在同类型细胞所占的比例,进行分级。胞质型l 0(阴性):无着色l 1+(弱阳性):≤10%的细胞呈现不同程度的细胞质着色l 2+(阳性):10-30%的细胞呈现强的棕褐着色细胞质着色,或≤70%的细胞呈现弱或中等强度的细胞质着色l 3+(强阳性):>30%的细胞呈现强的棕褐着色细胞质着色或>70%的中等强度细胞质着色在低倍镜下(4X或10x)浏览整张切片,观察目的细胞(如肿瘤实质细胞)中细胞质阳性细胞的分布情况,选择高表达区域,转换物镜到较高放大倍数(20x或40X)确定细胞着色强度和阳性细胞数(或面积)占视野下(或整张切片内)同类型细胞的百分比,最后按照阳性细胞百分数所在区间进行分级。质/核型l 同胞质型按照胞质型标准判读,必要时,同时标注核阳性细胞比例。也可按表达模式的优势原则参照胞核型或胞质型分子标准判读。质/膜型l 同胞质型按照胞质型标准判读,必要时,同时标注膜阳性细胞比例。也可按表达模式的优势原则参照胞质型或胞膜型分子标准判读。文献:杨军,康安静,苏宝山,等.免疫组织化学检测结果判读进展.中华临床医师杂志(电子版)2014;8(20):3699-3703http://www.cnki.net/kcms/detail/detail.aspx?QueryID=6&CurRec=1&DbCode=CJFQ&dbname=CJFD2014&filename=ZLYD201420025&uid=WEEvREcwSlJHSldTTGJhYlN2ekdRQUZWNXRHbFBkQnBUaDhoOFlCNUtEZ29RMGZDRFFPck1FcGJXa3FKajdQYnVPMD0=$9A4hF_YAuvQ5obgVAqNKPCYcEjKensW4IQMovwHtwkF4VYPoHbKxJw!!&v=MDU1MzdZUUxCSGs1emhSbDRqZDVTWDNtckdOSEZyQ1VSTCtmYitacEZ5N25VNzdOUHlIU2FyRzRIOVhPcjQ5SFk=
杨军 主任医师 西安交大二附院 病理科6097人已读 - 精选 饮酒为何发酒疯——酒的传说
话说轩辕皇帝时期,天下太平,风调雨顺,五谷丰登。正所谓“饭饱思淫欲”,大家已普遍不能满足吃饭时只喝白水的地步了!得弄点饮料喝一喝!!。于是,轩辕皇帝下令,让杜康研发一种饮料,以半年为期。转眼一月已经过去了,杜康还是毫无思路。当时正值盛夏,一天阵雨过后,杜康躺在麦垛子下发愁,无意间麦垛上的积水滴到了杜康嘴里,酸酸涩涩,杜康顿时性起,这不就是饮料吗?他爬起身来收集一碗积水便去见轩辕皇帝,轩辕帝品了一口大怒:“大胆杜康,竟敢用馊水欺骗于我,如不能如期做好饮料,提头来见。”杜康一筹莫展。他想,把麦子用水泡的时间长一些,兴许味道就会好一些吧!于是,杜康模拟麦垛的情形,将麦子放入大缸内加水密封后,放在太阳下暴晒。一月煎熬之后,开缸品尝,可还是酸酸涩涩。杜康顿觉后项发凉,人头不保。午后,无奈的他坐在村口大树下发呆。不知过了多久,杜康昏昏沉沉睡了过去。睡梦间,来了一位白髯老者说道:“你应在今天落日酉时之前找到三人,每人取鲜血一滴,共收集三滴血加入缸中,密封七七四十九日之后,方可开缸,切记,切记。”杜康一下惊醒,原来是有人仙人指路啊!杜康赶紧爬起,守在村口大树下,不一会儿,远远的走来一文弱书生。杜康赶紧上前说明缘由。书生一听,为天下人做饮料,好啊,便伸出手指,杜康赶紧用针刺破挤出了鲜血一滴。又过了一会儿,忽听一阵马蹄声,由远而近,杜康起身姚望,只见,远远的尘土飞扬,转眼间一名骠骑将军飞奔而来至。杜康站在路中,张开双臂大叫:“将军留步!”骑马将军勒马大怒:“你想找死不成?”杜康赶紧说明情况,想取将军鲜血一滴。将军听后大笑:“我当嘛事!一碗够否?”“够了,只要一滴便够了”说话间,将军右手拎刀照着自己左手一划,鲜血顿时泉涌而出,眨眼间就有半碗。杜康连连叫道:“够了!够了!多谢谢!多谢谢!”可那将军早已经绝尘而去。还差一人!,杜康在路口继续等待。可是,两个时辰过去了,还没有人来。杜康急得绕着大树转圈,眼看日渐西山,酉时已到,他突然发现树后躺着一个蓬头垢面的疯子,杜康心想:“疯子的血也是血呀!在不采血就来不及了。”预示,也顾不了那么多了,杜康抓起疯子手来,用针刺破,挤出一滴鲜血,飞奔而去。终于,在酉时之前将鲜血加到缸里,并用厚厚的黄泥密封起来。杜康掐指一算,七七四十九日之后刚好是半年期满之时,这才松了口气。可是随着日期临近,杜康的心又悬了起来,终于等到了七七四十九天,杜康一大早就拿着工具来到缸前,等他颤颤巍巍打开封盖,一股前所未闻的奇香飘起,顿觉眼前一亮,品一小口,沁人心脾,微辣而甘,飘飘欲仙。杜康赶紧盛一满碗,飞奔入朝,所过之处奇香弥散。轩辕皇帝品了一口,大叫:“好喝!好喝!”随分于群臣,片刻间,朝堂上香气四溢,大家飘飘欲仙,啧啧声不断。半晌过后,轩辕皇帝才想起来问杜康:“这是什么东东?”“您下令让我研制的饮料啊!”“怎么做的?”杜康便把制作过程仔细讲述了一遍。轩辕皇帝又问:“叫什么名字?那这字怎么写啊?”杜康一时无语,便答道:“还是请大王赐名吧”轩辕黄帝转头问仓颉:“你说呢?”仓颉沉思良久回道:“此物用五谷加水,并在日落酉时滴加人鲜血三滴,后经七七四十九天封藏洞藏而成。就叫“九”吧。这个字应该三滴水旁加个‘酉’字,三滴血代表‘酉’既表示时辰,形状又似做酒用的大缸,写作‘酒’如何?。”轩辕皇帝一听,连称:“如此甚好!甚好!”遂对杜康大加封赏,并命其将方法传授于神州各地百姓分享!一时间,神州大地,处处飘香。此后,百姓们便都喝上了这种饮料,并成为逢年过节、婚丧嫁娶时必不可少的饮料。不料,好景不长,大家就发现了问题。很多人饮酒后行为判若两人:有的温文尔雅,有的豪情万丈、侃侃而谈,有的昏昏欲睡、飘飘若仙,有的又哭又闹、撒泼打滚、寻衅滋事、殴打路人、破坏公物、扰乱社会秩序…。一时间,神州各地各处急报学雪片般报至轩辕皇帝。轩辕皇帝很是震惊,急传杜康一问缘由。杜康也是苦思不得其解。皇帝命他三天内查明原因,拿出对策。杜康回家,组织人马,制酒经过逐步分析,突然想起做酒时加的三滴鲜血,顿时恍然大悟。赶紧向轩辕皇帝汇报。原来,喝酒过程中,一开始饮酒者温文尔雅,敬酒夹菜,谦让有加,这是书生的一滴血在起作用;等酒过三巡,饮酒者开始划拳碰杯,侃侃而谈,天南海北无所不说,这是武士的那一滴血在发挥左右。再继续喝,有的便开始又哭又闹,撒泼打滚,殴打路人,破坏公物,扰乱社会秩序,这是疯子的那滴血开始发挥作用了。轩辕皇帝长舒一口气:“原来如此,有什么办法吗?”杜康答道:“只要控制饮酒量,让书生和武士的血发挥作用就行了,不要喝到疯子的血发挥作用就万事大吉了。”轩辕皇帝说:“如此甚好,昭告天下,饮酒适量,切勿贪杯。”
杨军 主任医师 西安交大二附院 病理科2012人已读 - 精选 肿瘤的分型、分级和分期
由于诸多因素的影响,全球恶性肿瘤发病率呈现持续升高态势,据推测到2020年前,全球恶性肿瘤发病率将增加50%,不仅如此,恶性肿瘤的死亡人数也在全球迅猛上升[1],而在我国等发展中国家,这一趋势将更为明显,并具有显著的年轻化趋势。因此,加强恶性肿瘤的防治研究,准确、客观评价肿瘤生物学行为和预后、制定治疗方案显得更为迫切。肿瘤的分型(classification)、分级(grading)和分期(staging)是目前评价肿瘤生物学行为和诊断的最重要的三项指标,其中分级和分期主要用于恶性肿瘤生物学行为和预后的评估。近数十年来,得益于生命科学和医学技术的突破性进展,肿瘤个体化治疗相关靶标的检测及包括靶向治疗在内的个体化治疗药物的临床应用,不仅在很大程度上提高了早期肿瘤的检出率,也明显改善了许多肿瘤的预后。传统肿瘤分型、分级和分期的临床价值和意义也随之产生不同程度的变化。本文拟深入分析肿瘤的分型、分级和分期的生物学依据及临床价值,以期为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测。一、恶性肿瘤的病理分类(分型)尽管,关于肿瘤起源的干细胞理论和去分化理论的争论仍在持续,但是,机体各器官和组织、细胞均可发生肿瘤的事实却不可否认。肿瘤细胞与其来源组织的相似或接近于正常组织的程度是肿瘤病理学分类(分型)的重要诊断依据,例如,角化型鳞癌出现不成程度的角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。因此,肿瘤的病理学分型是最能反映肿瘤来源组织细胞的生物学行为和形态学特征的重要参数。不同组织类型的肿瘤具有不同的生物学行为和侵袭转移能力,例如,来源于消化道的粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好。而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强的侵袭转移能力、恶性程度更高。目前,WHO肿瘤分型标准是公认的肿瘤分型方案,通常按照优势成份分型原则进行恶性肿瘤的分型,即以肿瘤主要组织学类型(>50%的组织结构)进行分型诊断。然而,异质性(heterogeneity)是恶性肿瘤的重要组织结构特点之一,许多恶性肿瘤(如结直肠癌和胃癌等)均存在不同程度的多方向分化或不同组织学类型并存的现象,肿瘤的异质性也决定了恶性肿瘤复杂的临床生物学行为和预后。显然,按照优势成份分型原则进行的WHO肿瘤分型方法无疑会在某种程度上忽视恶性肿瘤高度异质性的组织学特征,也掩盖了次要组织性类型对肿瘤生物学行为和预后的影响;同时,病理组织学诊断也易受恶性肿瘤千差万别的显微镜下形态学表现以及病理医师主观因素判断的影响,不可避免存在一定的分型不一致性。此外,即使相同分型、分级和分期的肿瘤,由于其分子表型的差异,显示出完全不同的治疗反应和预后。可见,按照优势原则进行的恶性肿瘤分型方案在反映肿瘤组织学特征、生物学行为和预后方面均存在一定的局限性,并不能满足肿瘤个体化治疗中对于肿瘤诊断精细化的要求。因此,在传统肿瘤病理学分型的基础上,大力推进以肿瘤分子表型检测为核心肿瘤的分子分型诊断迫在眉睫[2-8]。二、肿瘤的分级分化(cell differentiation)是指从胚胎时的幼稚细胞逐步向成熟的正常细胞发育的过程。肿瘤细胞分化是指肿瘤细胞逐渐演化成熟的过程。异型性(atypia)[9]是恶性肿瘤的重要组织学特征,其实质是肿瘤分化程度的形态学表现,反映的是肿瘤组织在组织结构和细胞形态上与其来源的正常组织细胞间不同程度的形态差异。这种肿瘤组织异型性的大小可用肿瘤的分级(grading,G)来表示。目前,简明三级方案最为常用:Ⅰ级(G1),即分化良好者(称为“高分化”),肿瘤细胞接近相应的正常发源组织,恶性程度低;Ⅲ级(G3),分化较低的细胞(称为“低分化”),肿瘤细胞与相应的正常发源组织区别大、分化差,为高度恶性;Ⅱ级(G2),组织异型性介于Ⅰ级和Ⅲ级之间者,恶性程度居中。简明三级分级方案经多用于分化性恶性肿瘤,如腺癌、鳞癌等的异型性分级。此外,还有学者将部分未显示分化倾向的恶性肿瘤称为未分化肿瘤,属于IV级(G4),为高度恶性。在实际操作中,肿瘤的分级主要是根据显微镜下HE染色切片中肿瘤组织结构和细胞异型性的大小、核分裂像或增殖指数的多少、坏死范围、侵袭状况等[9-12]参数确定的。并以分化最好的区域来确定肿瘤的组织学来源(分型),而以分化最差的区域来确定肿瘤的级别,可见,恶性肿瘤的分级反映的是肿瘤的内部特征,对于客观评估肿瘤的分化程度和生物学行为、预测预后具有很大参考价值。一般说来,肿瘤分级越高,预后越差,但并非完全一致[13]。然而,由于肿瘤组织结构的复杂性和异质性特征,不同类型肿瘤(例如腺癌、鳞癌、肾细胞癌、乳腺癌等等)均有其不同的结构特征和分级标准,且缺乏定量指标,此外,由于受取材充分程度和对诊断标准、异型性判读的主观性差异的影响,均并不同程度地影响到肿瘤分级的客观性、精确性和可重复性。因此,精简分级参数、减少分级的级别、简化分级标准,增强可量化参数和临床可操作性及可重复性,是肿瘤分级的必然趋势。在过去的几十年来,得益于不同领域的专家学者的卓越贡献,在此取得显著进展。例如,在上皮内瘤变分级中将3级简化为高低两个级别的分级理念无疑为肿瘤组织学分级提供了值得借鉴的成功经验。而核分裂、增殖指数(如Ki-67)等[14]的检测为恶性肿瘤的诊断和分级提供了可靠的可量化参数,其中Ki67作为评价肿瘤细胞增殖活性的可量化参数,在肿瘤分级中的价值也日益被接受并广泛应用。此外,Gleason等按腺体结构异型性提出的前列腺癌Gleason评分系统[15,16]对于前列腺癌的分级也提供了一种较为合理的可量化分级方案,并被广泛使用。作者也结合胃癌和结直肠癌WHO分型原则及其分化程度、生物学行为、侵袭转移能力,提出了一种新的胃癌和结直肠癌组织学分级-评分方案[17,18]。免疫学评分进行的肿瘤分类也为量化分型与分级提供了新的方法[19] 。三、肿瘤的分期肿瘤的分期(staging)是根据原发肿瘤的大小、浸润的深度、范围以及是否累及邻近器官、有无局部和远处淋巴结的转移、有无血源性或其他远处转移等参数来确定的,其的实质是反映肿瘤的侵袭转移程度,是评价恶性肿瘤侵袭转移范围、病程进展程度、转归和预后的重要指标。精确的肿瘤分期不仅是准确预测恶性肿瘤生物学行为及预后的可靠指标,也能为临床医师提供准确的患者分层管理依据,还是选择辅助治疗方案、提高治疗效果的基本前提。在众多肿瘤分期方案1929年的Dukes分期中,由美国癌症联合会(The International American Joint Committee on Cancer (AJCC))提出的TNM分期系统(TNM staging system)是目前被广泛接受和公认的能够反映恶性肿瘤进展、判断预后的最可靠的独立指标。 2010年,第七版 TNM staging (AJCC-7) [20]也已出版。而肉眼及显微镜下对原发肿瘤的大小及浸润范围(T),局部淋巴结(N)受累情况及远隔脏器、组织中肿瘤转移情况(M)的判读是进行肿瘤TNM分期的三项直接可评价参数。其中,淋巴结检测对于恶性肿瘤分期的精确性具有直接的影响[21-23],获得足够淋巴结是保证分期精确的前提。所以,在AJCC第七版TNM分期中对于不同肿瘤推荐了进行可靠分期所需的最少淋巴结数量[24],例如,对于结直肠癌推荐至少10-14 淋巴结才能进行可靠的淋巴结分期. 虽然,不同肿瘤TNM分期中T、N、M判读界值不尽相同,但,一般而言,数字越大,病情越晚,预后越差。众所周知,恶性肿瘤的生物学行为和侵袭转移能力取决于其特定的组织学类型(或免疫表型)和分化程度,也就是说肿瘤的组织学类型(或免疫表型)和分化程度是真正影响TNM分期的决定性因素。因此,深入探讨恶性肿瘤的组织学分型(或免疫表型)和分级、全面检测肿瘤侵袭转移范围才是精确进行TNM分期的根本。与肿瘤组织学分型与分级是肿瘤内在的特征参数不同,肿瘤的分期是描述肿瘤特征的外部参数,不仅取决于肿瘤的组织学类型和分级,还明显受到肿瘤所引发的临床症状出现的早晚、患者的临床耐受性、患者经济状况、医疗保障水平和患者就诊时间等主观和社会因素的影响。可见,患者就诊时间在相当大程度上也决定了肿瘤的TNM分期。四、肿瘤分型、分级和分期之间的关系既往认为,TNM分期是反映恶性肿瘤进展、判断预后的独立指标,亦是决定手术切除范围、手术方式和合理辅助治疗方案的主要依据,而肿瘤的组织学类型和分级的临床价值并不明确[13,25]。然而,实际情况并非如此,恶性肿瘤组织学类型和分级对其侵袭转移能力和肿瘤预后的影响正被逐步认识:如前所述,肿瘤的分型和分级是肿瘤的内在本质特征:肿瘤的分型依赖于肿瘤组织细胞与正常组织细胞的形态相似性,肿瘤的分级取决于肿瘤来源组织的分化程度,均是反映肿瘤来源组织细胞的分化程度、结构特征和生物学行为等内在特征重要参数。肿瘤的分期以原发肿瘤的大小及浸润范围、局部淋巴结及远隔脏器、组织受累范围为判读依据,是反映肿瘤侵袭转移能力的临床可观察参数。肿瘤的TNM分期不仅取决于特定的肿瘤组织学类型(或分子表型)和分化程度,同时受到患者就诊时间的显著影响。简而言之,肿瘤的分型描述的是肿瘤的来源,肿瘤的分级描述的是肿瘤的分化程度,而肿瘤的分型和分级决定了不同类型肿瘤特有的生物学行为和侵袭转移能力,进而决定了肿瘤的TNM分期。TNM分期反映的是恶性肿瘤的进展程度、预示的患者到达预期生命终点的时间点。因此,加强恶性肿瘤组织学分型、分级和免疫表型的研究是准确判断肿瘤进展程度、预后、制定临床治疗方案的之关键。然而,随着分子生物学技术的发展,基因测序、荧光原位杂交、免疫组化、Real-time PCR等技术的广泛应用和后基因组学时代(post-genenomic era)的来临,对于肿瘤的认识已经深入到分子水平。基因突变、缺失或过表达以及染色体不稳定性 (chromosomal instahility,CIN)、微卫星不稳定(microsatellite instability,MSI)等遗传学机制和CpG 岛甲基化(The CpG Island Methylator phenotype,CIMP)、蛋白磷酸化等表遗传学机制得以阐明[25-33],一系列肿瘤个性化治疗相关分子靶标被先后发现,大量特异性肿瘤靶向治疗药物也陆续上市,不仅为恶性肿瘤的预后预测和指导治疗提供了新的指标、也在一定程度上为恶性肿瘤的治疗提供新的方案[34],还在不同层面上改变着传统肿瘤病理分型、分级、分期的临床意义和患者的预后。例如,高度恶性的低分化或未分化结直肠癌由于出现MSI-H而显示良好的临床经过,表皮生长因子受体(EGFR)高表达及KRAS、BRAF等基因突变的结直肠癌患者由于采用靶向治疗药物和新辅助治疗方案,预后也较前明显改善。Her-2基因的检测和赫赛丁的使用完全改变了Her-2阳性乳腺癌患者的预后。可见,肿瘤个体化治疗时代业已来临[35,36],传统肿瘤分型、分级和分期已经不能满足肿瘤个体化治疗的需要,因此,在传此基础上,提升肿瘤分子分型诊断水平,为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测,无疑将是恶性肿瘤分型、分级和分期的发展方向和目标[37,38]。总之,肿瘤的分型、分级和分期是评价肿瘤生物学行为和侵袭转移能力及临床进展程度的重要参数,其中肿瘤的分型和分级是反应肿瘤来源及其生物学行为和侵袭转移能力的内在参数,肿瘤的分期是反映肿瘤侵袭转移能力和临床进展程度的可检测指标,不仅取决于肿瘤的组织学类型和分级,同时明显受制于患者临床症状和就诊时间。在传统肿瘤分型、分级和分期的基础上,积极开展以肿瘤特异性分子靶标的检测为核心的分子分型诊断是精确、客观预测肿瘤预后、指导治疗方案的制定和疗效监测的前提和基础,对于肿瘤个体化治疗的实施具有重要意义。参考文献[1] Siegel R, Ward E, Brawley O, et al. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths [J]. CA Cancer J Clin, 2011,61(4):212–236.[2] 来茂德. 肿瘤的分子分型(类)和诊治[J].浙江大学学报(医学版), 2006,35(4):349-353.[3] Ola Marzouk, John Schofield. Review of Histopathological and Molecular Prognostic Features in Colorectal Cancer [J]. Cancers (Basel), 2011,3(2): 2767–2810.[4] 陈海泉. 分子分型时代的肺癌治疗个体化趋势[J]. 中国癌症杂志,2012,22(12):956-960.[5] 张英军, 吴君心, 侯如蓉. 乳腺癌的分子分型[J]. 实用癌症杂志, 2012,27(1):98-100.[6] Goyal R, Gersbach E, Yang XJ, et al. Differential diagnosis of renal tumors with clear cytoplasm: clinical relevance of renal tumorsubclassification in the era of targeted therapies and personalized medicine [J]. Arch Pathol Lab Med, 2013,137(4):467-480.[7] Wittekind C. New developments in the classification of malign tumors [J]. Dtsch Med Wochenschr, 2013,138(20):1054-1058.[8] Shinuk Kim, Mark Kon, Charles DeLisi. Pathway-based classification of cancer subtypes [J]. Biol Direct, 2012,7: 21.[9] Nakashima Y, Yao T, Hirahashi M, et al. Nuclear atypia grading score is a useful prognostic factor in papillary gastric adenocarcinoma [J]. Histopatho logy, 2011,59(5):841-849.[10] Kadota K, Suzuki K, Kachala SS, et al. A grading system combining architectural features and mitotic count predicts recurrence in stage I lung adenocarcinoma [J]. Mod Pathol, 2012,25(8):1117-1127.[11] Espinosa AM, Alfaro A, Roman-Basaure E, et al. Mitosis is a source of potential markers for screening and survival and therapeutic targets in cervical cancer [J]. PLoS One, 2013,8(2):e55975.[12] Giordano TJ. The argument for mitotic rate-based grading for the prognostication of adrenocortical carcinoma [J]. Am J Surg Pathol, 2011,35(4):471-473.[13] Volante M, Daniele L, Asioli S, et al. Tumor staging but not grading is associated with adverse clinical outcome in neuroendocrine tumors of the appendix: a retrospective clinical pathologic analysis of 138 cases [J]. Am J Surg Pathol, 2013,37(4):606-612.[14] Tomasino RM, Morello V, Gullo A, et al. Assessment of "grading" with Ki-67 and c-kit immunohistochemical expressions may be a helpful tool in management of patients with flat epithelial atypia (FEA) and columnar cell lesions (CCLs) on core breast biopsy [J]. J Cell Physiol, 2009,221(2):34334-9.[15] Gleason DF. Histologic grading of prostate cancer: a perspective[J]. Hum Pathol, 1992,23(3):273-279.[16] Epstein JI, Allsbrook WC Jr, Amin MB, et al. Update on the Gleason grading system for prostate cancer: results of an international consensus conference of urologic pathologists[J]. Adv Anat Pathol, 2006,13(1):57-59.[17] 杨 军, 刘妮, 康安静, 等.一种新型胃癌组织学分型、分级-评分系统[J]. 临床与实验病理学杂志, 2013,29( 2):159-162.[18] 杨军,郭睿,康安静,等.一种新的结直肠癌组织学分型、分级-评分方案[J].南方医科大学学报,2014,34(2):169-173.[19] Jérme Galon, Franck Pagès, Francesco M Marincola, et al. Cancer classification using the Immunoscore: a worldwide task force [J]. J Transl Med, 2012,10: 205.[20] Edge SB. American Joint Committee on Cancer: AJCC cancer staging manual. 7th edition. New York: Springer, 2010.[21] Pheby DF, Levine DF, Pitcher RW, et al. Lymph node harvests directly influence the staging of colorectal cancer: evidence from a regional audit [J]. J Clin Pathol, 2004,57 (1) :43–47[22] Hyslop T,Weinberg DS,Schulz S,Barkun A, et al. Analytic Lymph Node Number Establishes Staging Accuracy by Occult Tumor Burden in Colorectal Cancer [J]. J Surg Oncol, 2012,106(1): 24-30.[23] Sobin LH, Gospodrowicz MK, Wittekind C. TNM classification of malignant tumors (UICC International Union Colorectal carcinoma: Pathologic aspects Against Cancer). 7th ed. New York. Wiley-Blacvkwell, 2009.[24] Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM [J]. Ann Surg Oncol, 2010,17(6):1471-1474.[25] Lao VV, Grady WM. Epigenetics and colorectal cancer [J]. Nat Rev Gastroenterol Hepatol, 2011,8(12):686-700.[26] Suehiro Y, Hinoda Y. Genetic and epigenetic changes in colorectal cancer and genetic testing for personalized medicine [J]. Rinsho Byori, 2012,60(10):976-981.[27] Hile SE, Shabashev S, Eckert KA. Tumor-specific microsatellite instability: do distinct mechanisms underlie the MSI-L and EMAST phenotypes? [J]. Mutat Res, 2013,743-744:67-77.[28] Bhattacharjee P, Banerjee M, Giri AK. Role of genomic instability in arsenic-induced carcinogenicity . A review. [J]. Environ Int, 2013,53:29-40.[29] Hughes LA, Khalid-de Bakker CA, Smits KM, et al. The CpG island methylator phenotype in colorectal cancer: progress and problems [J]. Biochim Biophys Acta, 2012,1825(1):77-85.[30] Bae JM, Kim JH, Kang GH. Epigenetic alterations in colorectal cancer: the CpG island methylator phenotype [J]. Histol Histopathol, 2013,28(5):585-595.[31] Migliore L, Migheli F, Spisni R, et al. Genetics, cytogenetics, and epigenetics of colorectal cancer [J]. J Biomed Biotechnol, 2011,2011:792362.[32] Sinicrope FA, Sargent DJ. Molecular pathways: microsatellite instability in colorectal cancer: prognostic, predictive, and therapeutic implications [J]. Clin Cancer Res, 2012,18(6): 1506–1512.[33] Alex Duval, Ada Collura, Kevin Berthenet, et al. Microsatellite Instability in Colorectal Cancer: Time to Stop Hiding! [J]. Oncotarget, 2011,2(11): 826-827.[34] Legolvan MP, Taliano RJ, Resnick MB. Application of molecular techniques in the diagnosis, prognosis and management of patients with colorectal cancer: a practical approach [J]. Hum Pathol, 2012,43(8):1157-68.[35] Alex Mejia, Stephanie Schulz, Terry Hyslop, et al. Molecular staging individualizing cancer management [J]. J Surg Oncol, 2012,105(5): 468–474.[36] Perea J, Lomas M, Hidalgo M. Molecular basis of colorrectal cancer: towards an individualized management? [J]. Rev Esp Enferm Dig, 2011,103(1):29-35.[37] Gurzu S, Szentirmay Z, Jung I. Molecular classification of colorectal cancer: a dream that can become a reality [J]. Rom J Morphol Embryol, 2013,54(2):241-245.[38] Alex Mejia, Stephanie Schulz, Terry Hyslop, et al. Molecular staging individualizing cancer management [J]. J Surg Oncol, 2012 ,105(5): 468–474.
杨军 主任医师 西安交大二附院 病理科6.4万人已读 - 精选 双排病理取材刀,零售
双排病理取材刀
杨军 主任医师 西安交大二附院 病理科1739人已读 - 精选 HT-1组织芯片制备系统
HT-1组织芯片制备系统
杨军 主任医师 西安交大二附院 病理科1254人已读 - 精选 HT-1组织芯片制备系统1
本项目组研制的HT-1型组织芯片仪采用独特的阵列孔受体蜡块一次成型技术,从根本上完美解决了现有组织芯片仪采用单针打孔的致命技术缺陷,通过使用不同规格和排列组合的阵列孔受体蜡块成型器,使得阵列孔受体蜡块的制备过程一蹴而就。即使是未接受特殊培训的技术人员也能仅通过一次操作在数秒之内快速制备高质量阵列孔受体蜡块(阵列孔数目从数十个到数百,直径0.5~2.5 mm),并能完全杜绝受体蜡块在阵列孔制备过程中的碎裂现象,显著提高受体蜡块的质量和制备效率。这也是该组织芯片仪优于其他组织芯片仪的特征之一。 TMAs蜡块的包埋是组织芯片制备中的另一关键性环节。由于缺乏相应的解决方案和方法,对于大多数研究者而言,唯一可做的便是小心翼翼地完成TMAs蜡块的包埋。由于组织样本与石蜡的物理差异,在包埋过程中,组织样本常常出现漂移、倒伏、移位等现象,很难保证按照阵列孔排列的圆柱形组织样本准确定位并处于同一水平面;同时,组织样本与受体蜡块阵列孔间残留气泡形成的腔隙致使组织样本不能与受体蜡块完全融合,最终导致组织样本在切片过程中丢失。上述现象随着组织芯片容量的增加而频繁发生,严重制约组织芯片的质量和制备效率。尽管系列切片辅助设备(Instrumedics Inc, NJ, USA)已被应用,但并不足以弥补上述仪器设计之不足,收效甚微。而HT-1型组织芯片仪采用了独特的负压包埋技术,通过调节、控制包埋温度和压力,既可将阵列组织样本原位固定于同一平面,减少组织样本的漂浮、倒伏和移位,又可完全抽除组织样本与受体蜡块阵列孔间腔隙内的空气并用熔化的石蜡填充,获得高质量TMAs蜡块。使用普通切片机和常规病理切片技术,勿需特殊辅助器具即可制备高质量的组织芯片,脱片率低于1.0%±1.1%,达到国内外商品化组织阵列仪性能。通过本研究单位以及兰州、杭州、上海等多家单位使用证实,HT-1型组织芯片仪制备组织芯片性能可靠、是一款结构简单、使用方便、易于操作的高性价比组织芯片仪。 总之,由于采用独特的阵列孔受体蜡块一次成型技术和负压包埋技术,HT-1组织芯片仪在最大程度上降低了组织芯片制备的技术难度、劳动强度、设备成本和开展组织芯片研究的门槛,显著提高了组织芯片的质量和制备效率,是一款结构简单、使用方便、易于操作的高性价比组织芯片仪,可广泛应用于所有商业研究机构和不同规模的研究机构。使用该仪器,研究者可完全按照自己的设计随心所欲地在自己的实验室构建自己的组织芯片,这将更有利于推动组织芯片技术的发展和应用。
杨军 主任医师 西安交大二附院 病理科2670人已读





