李进医生的科普号
- 精选 疗效经济双保险,高博阿特蒙推出“高诊无忧”肿瘤患者福利项目
日前,高博医疗集团与镁信健康联手设计并推出“高诊无忧”患者福利项目,这是一项面向肿瘤患者的爱心援助计划,旨在为晚期肿瘤患者提供个性化诊疗方案,并通过保险机制切实减轻患者的经济负担。该项目于2021年3月1日正式在上海阿特蒙医院落地实行。 组合创新药+爱心援助计划肿瘤治疗进入免疫靶向时代后已经取得了巨大的进步,越来越多的癌症患者从PD-1/PD-L1单抗、抗血管靶向药物中获益。但一部分肿瘤患者对免疫治疗不敏感;其疗效不确定,而且费用昂贵。尤其对于中国未批准的适应证,大多数癌症患者仍需要自费使用这些靶向或免疫治疗药物。高博集团特别设立了这项慈善福利计划。凡是符合条件并加入该项目的患者将获得由高博为患者赠送的一份医疗保险。符合条件进入该项目的患者若在两个治疗周期内发生疾病进展,将由保险公司赔付投保期间患者承担的指定药品的相关费用。为确保诊治策略的准确性,疗效的确认将委托第三方机构进行评估。 上海阿特蒙医院首席科学家李进教授在签约仪式上指出:为患者赠送保险的举措解除了患者及其家庭在经济上的后顾之忧,可谓之疗效与经济双保险。有一些医药公司本身就有患者援助药品计划,但前提条件是治疗有效。高博集团推出的这个无效退款理赔保险计划为患者获得制药公司的赠药提供了机会,让一些想尝试国际前沿治疗药物的癌症患者不会因为价格高、疗效不明显而 “人财两空”,能够“高诊无忧”去追求更好的治疗方式。 顶尖专家团队+个性化诊疗方案上海阿特蒙医院特聘教授韩宝惠教授在介绍该举措时谈到:高博医疗集团之所以敢于设计并推出“高诊无忧”患者福利项目,是源于上海阿特蒙医院拥有强大的专家团队、丰富的诊疗与用药经验,并真正以患者利益为出发点:最大限度地满足患者需求至上的初衷。上海阿特蒙医院建立“医保+商保”双保险模式,这是进入肿瘤治疗新时代之后,对如何保障患者利益最大化的一种有益探索。 为确保免疫靶向治疗的疗效,高博医学阿特蒙肿瘤中心特设立了专家委员会,患者将获得由高博医学阿特蒙肿瘤中心专家委员会专家组制定的个性化诊疗策略与用药方案。该委员会由秦叔逵教授担任主任委员,专家组成员包括于金明院士、马军教授、李进教授、韩宝惠教授、宋纯教授、周彩存教授、郭晔教授、尹路教授、殷咏梅教授等国内知名专家。高博阿特蒙肿瘤中心还拥有强大的国外专家资源库,包括美国加州大学旧金山分校Alan Venook教授、美国纪念斯隆凯瑟琳癌症中心Charles M. Rudin教授、美国丹娜法伯癌症研究所Jochen H. Lorch教授、美国芝加哥大学 Daniel Catenacci教授等国际一流专家。根据患者需要,专委会可以随时发起国、内外顶级专家团队的MDT会诊,以便为患者提供全方位的诊断建议,制定严密的个性化治疗方案。 报名方式:关注上海阿特蒙医院公众号——点击菜单栏【高诊无忧】——选择【报名&查询】 即可申请报名,也可拨打400-021-5115客服热线了解详情。 关于阿特蒙高博医疗集团上海阿特蒙医院是上海自贸区首家中德合作的国际化高品质综合医院。医院定位国际研究型医院,汇集一批国内外临床专家团队和科研人才,提倡整合诊疗和团队医疗的新模式,将“患者需求至上”作为建院的根本。上海阿特蒙医院以肿瘤科、腔镜技术为重点科室,定位中、高端患者人群,提供与国际接轨的高品质医疗服务。 就诊地址:中国(上海)自由贸易试验区台北东路 170 号 门诊时间:8:00- 17:00(周一至周五) 预约电话:400-021-5115 交通信息: 公交:6号线保税区南站1号口,181路、815路、71路,外高桥保税区站下车步行约1.5公里 自驾:杨高北路/外高桥出口进入五洲大道行驶至台北东路。 停车:可从台北东路出入口进入B1车库,再乘电梯至一楼大堂。
 李进 主任医师 上海市东方医院 肿瘤科2310人已读
李进 主任医师 上海市东方医院 肿瘤科2310人已读 - 精选 针对KRAS 突变肿瘤的重磅出击 !
由勃林格殷格翰公司开发的全球第一款全KRAS抑制剂,正式在中国开始临床研究,该临床研究总负责人李进教授在启动会上正式宣布了这一消息。众所周知, 四大蛋白RAS、P53、MYC以及β-连环蛋白在癌细胞的生命过程中发挥了关键性作用,任何上述促癌靶点的药物转化都将会给肿瘤治疗带来巨大的突破。 其中RAS驱动型癌症在所有癌症中的占比约为15%。 过去近40年, 针对RAS研究一直在进行,但尚未能开发出有效药物,其主要原因之一是由于RAS 分子的特殊构象,研究者未能设计出高亲和力和高选择性的小分子能够识别,并像钥匙匹配锁孔一样“打开”并关闭RAS 蛋白;其二, 在RAF-MEK-ERK 丝裂原激活蛋白激酶(MAPK)串联通路上,MEK 抑制剂效果受限于ERK-介导的反馈抑制缓解所造成的耐药,从而导致代偿性ERK再激活。 但科学探索的魅力就在于为了人类的健康事业,虽然屡败屡战, 但仍然勇于突破研究瓶颈。近年来,“难以进行药物转化”的RAS 被屡屡挑战,涌现出若干颇具潜力的候选药物。KRAS 在RAS家族中是最普遍的突变,实体瘤中非常常见。其中的一种形式为KRASG12C驱动因子突变,发生在大约15%的非小细胞肺癌,3-5%的结直肠癌中,针对此靶点的首批化合物已进入临床试验并且取得了令人印象深刻的结果。 目前, 除了KRAS(G12C),KRAS家族还包括 KRAS(Gd12D),KRAS(G12V)等共计达30多个等位基因。勃林格殷格翰研究团队勇于进一步突破,从针对所有KRAS类型所诱发癌症的治疗入手。范德堡大学的Stephen W. Fesik等找到了针对SOS1蛋白的一个候选药物,此蛋白负责打开KRAS功能,并且将“音量”维持在高音量状态。“如果KRAS是癌症跳动的心脏,SOS1则是它的起搏器,”McConnell说:“没有SOS1,KRAS将无法跳动。”通过联用SOS1抑制剂与RAS信号通路其他关键蛋白的抑制剂比如MEK 抑制剂,我们能够将KRAS的音量调低,并且将其维持在低音量状态。尽管还需要开展大量的工作,但SOS1有望对所有KRAS癌症一网打尽,而不仅仅是KRAS(G12C)突变型癌症的一把钥匙。 这款SOS1::KRAS小分子抑制剂BI 1701963的首个全球I期研究已经于2019年11月在欧洲开展,紧随其后中国也于2020年12月开始招募携带KRAS突变且接受过至少一线化疗后病情进展的晚期肠癌患者进性不同剂量BI 1701963 (SOS1::KRAS小分子抑制剂)联合伊立替康的研究以探索其安全性、耐受性、药代动力学以及初步抗肿瘤活性进行探索。目前,该研究正在进行单药部分BI 1701963(SOS1::KRAS小分子抑制剂)。
李进 主任医师 上海市东方医院 肿瘤科3002人已读 - 精选 抗肿瘤免疫治疗的新型助燃剂—TLR8
一、TLR8简介 免疫系统是人体防卫外来病原的重要机制,由大量不同类型的细胞和蛋白质组成,具有辨识敌我的能力,会对入侵体内的「敌人」,如细菌、病毒、霉菌等致病的微生物发动攻击并予以消灭。免疫系统衰弱时,外界病原体便有机可乘;与之相对,如果免疫系统过于活跃或活跃得不合时宜,人体则可能发生一些自身免疫性疾病,如红斑狼疮、银屑病、类风湿性关节炎等。控制人体免疫系统的开关是一系列重要的免疫调节受体,其中Toll样受体家族(Toll-likereceptors,TLRs)在先天性免疫和适应性免疫中都占据了重要地位。 Toll样受体(Toll-like receptors,TLRs)是一类模式识别受体,不但表达于免疫细胞上,还在各种肿瘤细胞中表达,参与肿瘤免疫监视,对肿瘤的生长发挥不同的作用。人体中的TLRs共有十种(TLR1-TLR10),它们各司其职。TLR1,TLR2,TLR4,TLR5和TLR6都是位于细胞表面的受体; TLR3、TLR7、TLR 8、TLR9位于内涵体内。 TLR8是先天性免疫通路中一类重要的受体蛋白,相较于其他它TLRs成员,TLR8在不同亚型的免疫细胞中的表达更广泛。调节性T 细胞(Treg)具有强有力的免疫应答抑制能力,是有效的癌症免疫治疗的主要障碍。TLR8 信号通路被证明是逆转Treg 细胞抑制功能导致强烈肿瘤抑制所必要且充分的条件,TLR8也是Toll样受体家族中唯一能够逆转Treg细胞引起的免疫抑制的蛋白,激活TLR8还可以增强抗体依赖性细胞介导的细胞毒性(ADCC)。二、TLR8与抗肿瘤治疗 肿瘤免疫治疗是近年来肿瘤药物研发的重要领域,已批准上市的肿瘤免疫治疗药物如抗PD-1/PD-L1单抗等药物均为基于获得性免疫开发的药物,对肿瘤免疫产生良好应答的只是少数病人,大多数肿瘤病人对肿瘤免疫治疗耐药。其中的主要原因是这些耐药肿瘤病人的免疫系统不能被激活(“冷肿瘤”)。先天性免疫是人体识别和防御外来和内在病原的第一道防线,在激活具有免疫抑制的肿瘤,使无免疫应答的“冷”肿瘤(“cold” tumor)转变为有免疫应答的“热”肿瘤(“hot” tumor)过程中发挥关键作用。因此,激活先天免疫为肿瘤免疫治疗提供了新方向。 TLR8激动剂可以导致各种不同的促炎细胞因子的释放,如IL-6、IL-12、TNF-α和IFN-γ,启动细胞内信号传导途径,激活先天性免疫,具有连接固有免疫和适应性免疫的桥梁作用。根据TLR8的抗癌机理,TLR8 激动剂不仅单药有效,而且还可以和其他包括免疫检查点抑制剂(PD-1, PD-L1 抗体)、化疗药等多种药物联合用药以进一步扩大适应症并增强疗效。 目前国内外暂无TLR8 选择性激动剂被获批上市,处于临床阶段的TLR8激动剂有:Motolimod/VTX-2337、GS9688、DN1508052-01。TLR8激动剂临床研究DN1508052-01正在东方医院开展中,试验总牵头人:李进。
李进 主任医师 上海市东方医院 肿瘤科4320人已读 - 学术前沿 恶性肿瘤的细胞治疗
由东方临床肿瘤研究中心(ECCO)发起的一项针对CAR-NK细胞治疗局部晚期或转移性实体瘤的临床试验在上海同济大学附属东方医院及上海阿特蒙医院正式启动,并成功入组首例受试者。该项目研究用CAR-NK细胞由英百瑞(杭州)生物医药有限公司(以下简称英百瑞)自主研发生产。上海市东方医院肿瘤医学部主任李进教授担任该项目组长单位的主要研究者(PI)。 该项目是一项单臂、开放标签、多中心的研究者发起的临床试验(IIT),旨在评价国内首个非病毒修饰、非基因编辑方法的通用型CAR-NK细胞药物——IBR854细胞注射液在局部晚期或转移性实体瘤患者中的安全性、耐受性及初步有效性。 研究背景 目前,临床上针对实体瘤常用的治疗方法包括手术、放疗、化疗等,但这些治疗手段并不适合大部分的晚期或转移性实体瘤患者。此外,由于肿瘤是一种多因素参与、多步骤发展的全身性、系统性疾病,仅靠针对肿瘤组织的传统治疗手段,并不能取得很好的愈后,常常会发生药物耐药、肿瘤转移及复发。因此,对于晚期或转移性实体瘤而言,亟需探索新的治疗方式。 近年来,过继性细胞免疫治疗(adoptive cellular immunotherapy)成为了国内外研究的热点,已经在肿瘤临床试验和应用中取得较好的效果。NK细胞属于人体抵抗癌细胞的第一道防线,与其他过继细胞(T细胞、DC细胞等)治疗相比,NK细胞治疗具有诸多优点: 1) 无需抗原提前致敏就有较强的杀伤肿瘤细胞的活性; 2) 对肿瘤细胞的杀伤直接、灵敏、反应速度快; 3) 更为安全,不会引起移植物抗宿主病(GvHD)、细胞因子风暴(CRS),无神级毒性。 NK细胞能够释放穿孔素和颗粒酶,穿孔素在肿瘤细胞表面穿孔,使颗粒酶B进入靶细胞诱导肿瘤细胞凋亡,同时分泌大量的细胞因子,如IFN-γ、TNF-α、GM-CSF、IL-3、M-CSF等。NK细胞还可以通过进一步激活其他种类免疫细胞攻击靶细胞,并可表达可以诱导细胞凋亡的蛋白(FasL)和肿瘤坏死因子相关凋亡诱导配体(Trail),使靶细胞进入程序性凋亡状态。此外,NK细胞表面CD16低亲和力分子可与靶细胞表面IgG抗体复合物介导抗体依赖的细胞介导的细胞毒性(ADCC)作用。而加上修饰分子可以进一步提高NK细胞对肿瘤细胞的特异性靶向杀伤活力。
 李进 主任医师 上海市东方医院 肿瘤科879人已读
李进 主任医师 上海市东方医院 肿瘤科879人已读 - 学术前沿 【2021 CSCO】李进教授:前景可期,斯鲁利单抗有望成为MSI-H/dMMR晚期实体瘤患者治疗新
“聚焦创新研究,引领原创未来”——第二十四届全国临床肿瘤学大会暨2021年中国临床肿瘤学会(CSCO)学术年会于9月25~29日线上盛大召开。免疫治疗的发展实现了多个瘤种领域的革命性进展,显著延长了患者的生存期,改善了患者的生活质量。已有研究显示,传统化疗治疗疗效有限的高微卫星不稳定(MSI-H)/错配修复基因缺陷(dMMR)实体瘤患者对免疫治疗反应较好,有望通过这一治疗方式改善患者的预后。本次年会上,一项探索HLX10(斯鲁利单抗,PD-1抑制剂)治疗经治不可切除或转移性MSI-H/dMMR实体瘤患者疗效和安全性的单臂、多中心II期临床研究重磅发布,38.2%的客观缓解率(ORR)和良好的安全性为这部分患者的治疗带来了希望的曙光。 精准检测,生物标志物助力筛选免疫治疗优势人群Q1:以PD-1单抗为代表的免疫检查点抑制剂改变了多个瘤种的治疗格局,通过探究生物标志物来鉴别免疫治疗的获益人群成为了研究的热点。请您谈一谈基于生物标志物的免疫治疗现状和进展。 李进教授:以PD-1单抗为代表的免疫检查点抑制剂显著延长了诸如肺癌、肝细胞癌、食管癌和恶性黑色素瘤患者的生存期,改善了患者的生活质量。如何通过有效的生物标志物发现免疫治疗的获益优势人群,特别是对于免疫治疗不敏感的胃癌、结直肠癌、胰腺癌等,筛选出可能从免疫治疗获益的患者人群是我们探索的重要方向。 当前,我们已积累了较多的循证医学证据,发现了PD-L1表达水平、肿瘤突变负荷(TMB)、MSI/MMR状态和EB病毒感染等对免疫治疗疗效的预测价值。其中,PD-L1表达水平(CPS评分)是临床上运用较早的免疫治疗生物标志物,已有CheckMate-649等研究证实了免疫治疗可为PD-L1 CPS≥5的胃癌患者带来生存获益。在我看来,MSI/MMR状态是最能指导免疫治疗在结直肠癌领域应用的生物标志物。既往研究显示,MSI-H/dMMR结直肠癌患者能从PD-1单抗免疫治疗显著获益,如在晚期结直肠癌中占比约为5%的患者,多表现为MSI-H/dMMR,因此可从以PD-1单抗为代表的免疫治疗获益。 事实上,MSI-H/dMMR在多种实体瘤中都存在。临床常用免疫组化(IHC)、二代测序(NGS)和聚合酶链式反应(PCR)三种方法检测MSI/MMR状态。其中,免疫组化最为简便,通过检测肿瘤组织中4个常见错配修复基因(MLH1、MSH2、MSH6和PMS2)的表达情况,明确是否存在错配修复功能缺陷。若结果显示任一蛋白表达缺失,则判读为dMMR,提示接受免疫治疗疗效较好。NGS相对较为复杂,价格较为昂贵。PCR是MSI/MMR状态检测的金标准。该方法通过比对正常细胞DNA和肿瘤细胞DNA各个微卫星位点的PCR长度,来确定位点是否稳定。通常检测至少5个以上的位点,1个位点不稳定称为低度微卫星不稳定(MSI-L),2个及2个以上位点不稳定称为MSI-H,5个位点均稳定即为微卫星稳定(MSS)。当对IHC或NGS检测结果存在疑虑时,可通过PCR明确检测结果。 此外,TMB也是目前研究较多的免疫治疗的生物标志物,其原理和MMR相似。当肿瘤细胞存在dMMR时,标志着肿瘤细胞失去了对DNA复制错误的修复能力,此时肿瘤细胞积累了大量突变,TMB升高,增加了肿瘤细胞的免疫原性,因此接受免疫治疗疗效更好。 有效安全,斯鲁利单抗有望成为MSI-H/dMMR晚期实体瘤患者的治疗新标准Q2:今年CSCO年会上,斯鲁利单抗治疗经治不可切除或转移性MSI-H/dMMR实体瘤患者疗效和安全性的单臂、多中心II期临床研究重磅发布,请您解读研究结果。 李进教授:这项由秦叔逵教授和我共同牵头的单臂、多中心II期临床研究旨在探索斯鲁利单抗(重组抗PD-1人源化单克隆抗体注射液)治疗经治不可切除或转移性MSI-H/dMMR实体瘤患者的疗效和安全性,入组了原发诊断为结直肠癌、胃癌、子宫内膜癌、乳腺癌等的患者。 患者接受3 mg/kg,每2周1次的斯鲁利单抗治疗,直至临床不再获益或出现不可耐受的毒性,研究的主要终点为经独立影像评估委员会评估的ORR(IRRC,RECIST v1.1),次要终点包括研究者评估的ORR(INV RECIST v1.1)、ORR(IRRC & INV iRECIST),疾病控制率 DCR(IRRC & INV RECIST v1.1 & iRECIST),无进展生存期(PFS)(IRRC & INV RECIST V1.1 & iRECIST),总生存期(OS),6个月及12个月OS率,缓解持续时间(DoR)、6个月及12个月PFS率,药代动力学(PK),生物标志物,安全性,免疫原性和生活质量。 截至2021年1月9日,研究共纳入108例MSI-H/dMMR实体瘤患者并接受了至少1次的斯鲁利单抗治疗。主要疗效分析人群的结果显示,IRRC评估的ORR为38.2%(95% CI 26.71%-50.82%),2.9%(2例)患者实现了完全缓解(CR)。IRRC评估的12个月DoR率为95.7%(95% CI 72.9%-99.4%),12个月PFS率为61.9%(95% CI 49.0%-72.5%)。12个月OS率为81.2%(95% CI 67.8%-89.4%)。主要疗效分析人群中,≥3级治疗相关不良事件(TEAE)的发生率为41.2%。安全性与其他PD-1单抗相似。 该研究质量由秦叔逵教授和我严格把控,仔细复核,研究证实了斯鲁利单抗治疗MSI-H实体瘤患者可靠的疗效和可控的安全性,与其他PD-1单抗的国际研究结果相似。对于中国MSI-H/dMMR晚期实体瘤患者,斯鲁利单抗有望成为临床治疗新标准。 前景无限,免疫联合策略探索是大势所趋Q3:请您展望未来斯鲁利单抗的前行探索之路。 李进教授:我们知道,免疫治疗启动时机越早,即当患者体质状况越好、体内T细胞尚未耗竭时,开展免疫治疗的疗效越好。因此,未来可探索斯鲁利单抗一线治疗MSI-H/dMMR晚期实体瘤患者的有效性和安全性。同时如何进一步提高免疫治疗MSI-H/dMMR实体瘤患者的有效性也是研究者努力的目标。当前,已有免疫联合抗血管靶向治疗(如贝伐珠单抗)、联合小分子靶向药物、联合化疗的研究开展得如火如荼,为免疫联合治疗策略提供了诸多循证医学证据;亦有相关研究在MSS实体瘤患者中的临床探索。 在此,我呼吁所有的临床医生、科学工作者和生物制药公司,携手同行,以患者为中心,临床价值为导向,通过开展科学严谨的临床研究,真正意义上指导临床实践,为患者服务。期待斯鲁利单抗能尽快在我国获批上市,为广大的肿瘤患者提供可及的免疫治疗产品,切切实实帮助我国肿瘤患者实现更长久和更优质的生存。
李进 主任医师 上海市东方医院 肿瘤科1.7万人已读 - 学术前沿 李进教授专访:中国新药创制,一定要注意这几点!
2021 年 9 月 25 日至 29 日,中国临床肿瘤学会(CSCO)和北京市希思科临床肿瘤学研究基金会联合主办的「第二十四届全国临床肿瘤学大会暨 2021 年 CSCO 学术年会」以线上线下相结合的方式召开。 Q1:您如何看待 CDE 近期发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》?该原则将对国内创新药研发产生什么深远影响?关于近期 CDE 即将要出台的指导原则,在一个多月前公布了征求意见稿之后,在全社会引起了强烈反响。当时,我在苏州的一个大会上做了相应的报告,在这个报告里就这个问题谈了一些我个人对指导原则的一些看法。总体来说,大家对指导原则都持正面的观点,认为国家应该出台类似指导原则、法规等,以推动中国临床研究的进步。 这也就是为什么 CDE 或者是国家药监局要强调以临床价值为核心,以患者利益为导向的指导意见。我们在过去的临床研究过程中,虽然强调 GCP 的基本原则是保护受试者权益,但事实上在中国的临床研究的起步阶段,我们并没有真正的 100% 的贯彻这样一个理念。 今天当中国进入到一个中高级发展阶段,在这个阶段我们可能要在理念上,在临床研究的方法学上以及临床研究的引领等等方面都要比以往有所进步。 过去我们都是在仿制的过程当中,可能不涉及到很多的核心,只要拿国外的产品先跟我们所做的仿制品,比较它的有效性和安全性基本上相一致,我们就可以让这个产品上市。 可是当我们进入到从「中国制造」到「中国创造」这样一个我们称之为一个大踏步的进步阶段时,我们就要考虑到在临床研究过程当中,我们怎么能够让临床研究的速度更快,让我们临床研究的质量更高,让我们的患者获益更多。 因为在当我们中国的临床研究进入到蓬勃发展阶段的时候,很多的仿制产品,很多的类似物就会挤占我们临床研究的资源,而不少的病人在这种情况下,他们所接受的治疗并不是最佳方案。我们要跟安慰剂做对照,出于上市的考虑,企业可能会选择一种疗效相对来讲比较差的一个产品来做对照。不会选最强的,因为选最强的往往可能失败,影响上市,这就造成了我们产品总是跟比较差的去做比较,其实这就损害了我们患者的利益。 而作为临床研究来讲,首先我们要让最好的产品能够迅速的上市,这样才能够帮助我们的患者。我们希望临床试验的资源要集中到那些疗效比较好的,能够帮助病人的那些产品上去。 用什么办法去确定产品最优,CDE 也没有办法确定,这个时候我们就用一种法规来限制,就是以临床价值为导向,用目前最好的治疗方法来做你的对照,如果你能够超过他,说明你是最优。 如果有两个企业,你敢用最好的治疗方法来做对照的时候,把病人利益放在首位的时候,如果做出有效,你一定是超过现在的治疗方法。实际上我们是用一种理念来引导,让最好的药物能够尽快的上市,这样就不会让「劣币」来驱逐「良币」。 我们强调以临床价值为导向,以病人利益为核心,实际上就是为了推动中国的新药创制。用一种理念作为 CDE 的抓手,让那些不敢用最佳治疗方法来做对照的产品知难而退,把有效的资源,包括资金、研究者、医生、病人资源等,全部集中到最好的产品的研发上去,这样才能够真正把中国从原来的「制造大国」变成「创造大国」。我们的药物研发领域一样,希望有引领作用的新药,高效低毒且又便宜的药物尽快上市,来帮助我们中国乃至于全球的肿瘤患者。 CDE 推出的指导原则具有非常重大的指导意义。因为现状是我们不满意的,很多仿制品其实每个都讲是 me too,甚至讲 me better,其但实际上也是 me too,但是这种 me too 太多了以后,挤占了我们有限的资源,而且他想用比较差的临床治疗方法来做对照,让他变得有效。从伦理上考虑,我们肿瘤病人在临床上一旦参加了临床实验后,就意味着他必须要用治疗一直做下去。 可是这个时候我们是选一个好的方法,还是选一个比较差的方法,其实病人是没有选择权的,这个跟买产品不一样,你有选择的权利。可是病人不一样,病人一旦参加临床试验之后,没有选择权。如果你给他一个比较差的药物,可能活的时间就是比较短,从伦理角度看,这是不符合的。 所以说 CDE 提出的这种观点也是基于一种人文关怀,也体现了我们党和国家建设健康中国 2030 这种理念,要让中国的肿瘤患者能够享受到最好的治疗,而不是因为我们想做临床研究,让它暴露在一个没有什么效果的治疗当中去。这也是我们认为最先进的一种治疗的理念。 Q2:今年 7 月《中国抗肿瘤药物研发现状与挑战》发布,针对目前国内热门靶点、适应症扎堆布局的现象,您认为中国新药创制之路该往哪走?关于我们抗肿瘤药物临床研究专委会出台的 2020 年的《中国抗肿瘤药物研发现状与挑战》报告。其实这个报告我们计划于今年的第一季度出台,但是因为新冠疫情,出台的时间推迟了。 经过几个月的时间,紧张的工作,当然还得到了我们礼来公司医学部的大力的配合,我们把 2020 年的所有在中国开展的临床试验,抗肿瘤药物临床试验尽量全部收集起来,但是收集的数据可能会有错漏,因为毕竟这是我们第一次做,但是总体来讲我想可能 99% 都是正确的。 我们希望通过这样的总结能够告诉大家,或者给我们的研发人员、申办方等,了解我们中国到底有哪些临床研究正在开展。正在开展的这些靶点,拿这些靶点跟自己的产品线去做一个比较,在我们国内处于什么样的一个水平。如果你是处在第一梯队的,我觉得你就应该拼命往前赶,加快速度。 我们初始计划设置三个不同的等级。一是推荐,就是靶点目前只有 1、2 个,我们推荐加快研发。第二是警示,如果我们超过 5 个同样的产品,我们讲的同靶点的产品,同机制的产品,可能就面临着比较强的竞争。 但是 CLDN18.2 还不太一样,因为 CLDN18.2 分三种,一种是单抗,一种是 ADC,还有一种是 CAR-T。如果认为你的产品跟他们的产品都不一样,效果特别好,毒性特别低,我觉得你完全可以去做。因为有些专家提出,不需要提出警告,让企业自己考虑可能的结果。最终,我们就把这一条去掉了,只提供这个示例以供参考。 我们从研究这个角度来讲,可能还没那么高的水平,评价哪个产品好哪个产品不好,所以我们只是把这些靶点相关的项目具体做了哪些研究总结好以供参考。 《中国抗肿瘤药物研发现状与挑战》出台以后很多企业还是蛮欢迎的,可以整体了解中国到底在做哪些研究。包括国外企业在中国开展的研究,合计约有 800 多个临床研究正在开展中。希望通过公布这些数据,能够真正整合并节约资源,做真正的创新。 没有列出来的靶点,可能是比较新的靶点或是单独的产品,如果你的产品在这些信息里都没有,可能说明你的靶点是很新的。这个时候假如你的产品在临床前研究过程当中,科学性、先进性、可行性都很好,高效低毒,特别是在临床前动物实验过程当中发现它的疗效特别好,毒性特别低,我觉得就可以去花大力气去开发,可以推动中国的新药创制。同时把这些信息公布出来以后,让那些还在做仿制的,或者是自以为创新的,让他知难而退,特别是那些还没有申报 CDE 的。 我们作为一个民间学会,假如经过我们几个月的努力,能够对中国新药创制有这么一点帮助的话,我觉得也是一点贡献。我们这个项目主要是在马军教授、秦叔逵教授的指导之下完成的,所以也是特别感谢他们两位对我们这个项目的大力的支持。 Q3:中国创新药临床研究与国际相比,还存在什么问题?如果是说拿中国的临床研究跟西方发达国家来比较,我觉得我们还是有一定差距的。 特别是美国,它在新药创制方面比较领先,目前几乎 80% 的新靶点都在美国首先上临床,而中国这几年也有不小的进步。特别是在两三年前,党和国家也采取了一系列推动中国新药创制的举措,对中国的新药创制起到了很大的推动作用,包括资本、学术、研究者和申办方等都在努力。这两年有很多比较新的靶点,甚至在国际上没有的 first in class,都已经在中国开始做临床研究。 当然大部分研究还是中外合作的,尽管我们所处地域不同,观念不同,管理方式不同,分属于不同国家,但我觉得对病人来说都是一样的。我们研制抗肿瘤药物的目标就是在全球范围内帮助到我们肿瘤患者。中国作为拥有 14 亿人口的人口大国,中国的肿瘤患者约有 400 多万,更应该加强这方面的研究。 我们中国的科学家,中国的民族制药企业,中国的医生有责任在新药创制方面为世界做更多贡献。 最近几年除了中国传统的老牌企业,诸如百济神州、再鼎医药、天境生物、苏州信达等企业,在新药创新研发方面都做得比较出色。如果一些企业仍躺在过去的功劳簿上,我觉得他们应该引起警觉。 还有一点是企业的产品线不在多,而在于精。只有拥有核心竞争力,产品是全世界最具创新性,疗效最优的,就能成功。我希望这一类的产品能够使这一类的中国民族制药企业能够跻身世界 Top10。 我们中国的企业家们要努力,同时我作为一个 PI 参与过很多临床研究,我也希望用我微薄的力量能够助力企业,把他们的创新药物推向临床,最终帮助我们的患者。我也希望他们的创新产品能够到我们中心来开展临床研究,我们一定尽全力来推动,用最好的质量,最快的速度把产品推向临床。 Q4:贵院研究中心推出了「全智能化的临床试验平台」,能否介绍一下该平台的运转特点和优势?我们中心开展 I 期临床试验距今已有十几年的历史,在做临床试验的过程当中,我总觉得我们花费的精力人力耗费太多,效率比较低,究其原因是我们中国的数据平台不对外开放,医院里面是一个独立的数据管理中心,数据不能向外推送。当然,我觉得也是可以理解的,一是涉及到患者的隐私,二是涉及到网络的安全。但是在这种情况下,我们如何能够用最新的技术完成突破,让我们提高效率,在国外有过类似的尝试,但是都没有打通全流程,完全成功。 所以我联合了多个 IT 行业的公司,从源头的医生写病史开始,模块化相关信息。我们的医生写的病史都是模块化的。比如不良反应,之前如果病人出现肝肾功异常的不良反应,就需要我们医生去判断,其属于 1 级 2 级 3 级 4 级毒性。如果不太熟悉毒性分级,就非常耗时。CRC 需要将收集的数据双人录入系统,这个过程也非常耗时,也会出现错误。 现在我们做了一个人工智能系统参与到病人筛选、病人入院管理,不良反应的判读,数据的传输及数据审核等过程中。在东方医院已经将前面 4 站全部打通了(核查之前全部流程),因为在东方医院有一个自动核查环节这一部分走不通,是因为我们的数据不能直接外传,所以暂时没办法做数据实时核查。 第一,我们医生评判不良反应过去要花 3~4 个小时,现在就 10 分钟。用人工自动判读,收集信息后,人工自动会判定患者的不良反应级别,医生只需要确认就可以。 而我们过去需要两位 CRC 来录入数据,现在数据可直接传输到数据库中,节省了录入环节的时间。这个过程我们称之为全流程的人工智能的方式,把整个临床实验的流程打通,大概能够节省 1/3 的人力。 我们效率提高的同时,我们的准确度也有效的提高了。数据都是自动传输的,不需要人工去录入,所以这个数据非常准确,且可以溯源。希望未来我们能够通过这种人工智能的方式,高效、精准的助力我们中国的新药创制。
李进 主任医师 上海市东方医院 肿瘤科624人已读 - 学术前沿 李进教授谈首个胃癌一线免疫疗法:体现以“临床价值”为导向的未来趋势
近日,基于重要研究CheckMate-649带来的总生存期(OS)与无进展生存期(PFS)的双重获益成果,中国国家药品监督管理局(NMPA)批准纳武利尤单抗(O 药;欧狄沃)联合含氟尿嘧啶类和铂类药物化疗一线治疗晚期或转移性胃癌、胃食管连接部癌或食管腺癌患者。 这是中国首个免疫肿瘤药物获批胃癌一线治疗适应症,打破了胃癌一线治疗长达10 年停滞不前的僵局,万千中国晚期胃癌患者有望以创新免疫疗法为生命争取更多时光。 OS/PFS 全人群获益,铸就胃癌一线里程碑CheckMate-649 研究是迄今开展的规模最大的消化道免疫治疗前瞻性研究,旨在评估与单独化疗相比,以纳武利尤单抗为基础的免疫疗法用于一线治疗晚期或转移性胃癌、胃食管连接部癌或食管腺癌患者的疗效。考虑到胃癌高度异质性的因素,CheckMate-649 研究的入组患者涵盖了东西方多个国家的不同人种,囊括上消化道各种不同疾病部位和病理类型的肿瘤,最终样本量达到破纪录的2000例以上,其中免疫联合化疗和单纯化疗组共1581例。 全球数据方面,在主要分析人群(CPS≥5 患者)中,纳武利尤单抗联合化疗组的OS、PFS均显著优于单独化疗,达到研究的两项主要终点,这也是目前唯一在胃癌一线患者中,免疫联合化疗对比化疗取得OS与PFS双重显著获益的临床研究。不仅如此,在 CPS≥1 和所有随机人群中,纳武利尤单抗联合化疗均显著改善了患者OS,并观察到了PFS改善的趋势。 全球人群结果完整数据链接 研究还纳入了 208 例中国大陆胃癌及胃食管连接部患者,随机分配至纳武利尤单抗联合化疗组或单独化疗组,其数量占比在所有国家中居首位。中国亚组数据显示,纳武利尤单抗联合化疗的获益结论与全球整体人群一致,在所有人群中观察到有临床意义的OS、PFS获益,且有获益幅度更大的趋势;尤其是在主要分析人群中,中位OS获益可达近6个月(15.5 vs 9.6个月),中位PFS近两倍于单独化疗(8.5 vs 4.3个月)。 中国亚组分析完整数据链接 免疫+化疗获批胃癌一线:填补临床空白,对患者意义重大李进教授介绍道:长期以来,化疗是晚期或转移性胃癌患者的主要疗法,但效果有限;至于靶向治疗,由于胃癌的异质性较强,迄今并未找到主要的驱动基因;即使是其中最成熟的靶点HER2,也并非关键位点的突变,背后的驱动因素仍不清楚,因此疗效也无法和其他主要癌症的靶向治疗相比,且覆盖的人群极为有限。在胃癌一线治疗中,自2010年起已有近10年再无显著进展。加之胃癌患者基础身体情况往往较差,李进教授认为,目前在所有的常见癌症中,晚期胃癌患者的中位生存期或许可以排入倒数几名。 此次基于 CheckMate-649研究纳武利尤单抗联合化疗获批胃癌一线治疗适应症,“意义重大”,李进教授表示,“这是近10年来晚期胃癌一线治疗领域取得的首个重大突破,而且获益人群广泛”。虽然 CheckMate-649的主要研究人群设置为 PD-L1 CPS≥5的患者,但实际上无论在全球人群还是中国人群,纳武利尤单抗联合化疗都实现了全人群的OS和PFS获益。“在全球的所有随机人群中,纳武利尤单抗联合化疗较化疗延长OS 2.2 个月;中国的所有随机人 群中,OS更是延长了4个月,同时PFS延长2.7个月这是非常有临床意义的结果,表明化疗基础上联用纳武利尤单抗具有协同增敏作用;此外,该方案整体安全性可靠,且全人群应用一线免疫+化疗,对比 PD-L1 高表达人群用药也并无额外的安全性风险,因此该方案在中国和美国均获批胃癌一线全人群适应症有其合理性。”李进教授分析道。 基于CheckMate-649研究全人群的显著获益,纳武利尤单抗联合化疗此次在中国获批一线全人群适应症,无论PD-L1 CPS表达,也无论HER2状态,这与 FDA的获批一致。实际上,在FDA和NMPA获批之前,美国的NCCN指南和中国CSCO指南均已先行一步,将该方案写入胃癌的一线治疗推荐,限定为HER2阴性、PD-L1 CPS≥5的人群。 “随着FDA和NMPA的相继获批,指南很可能会做出进一步调整,因为获批适应症是指南制定的首要依据。”李进教授认为,“在过去很长一段时间里,胃癌一线治疗的主要手段仅有化疗,只有HER2阳性患者可以加用曲妥珠单抗;而纳武利尤单抗一线全人群适应症的获批,意味着未来所有晚期胃癌患者都可以在最关键的一线治疗中用到疗效显著优于单纯化疗的创新疗法,将对胃癌一线治疗的格局产生重大影响。” 同时,李进教授认为,CheckMate-649研究的成功也验证了“免疫治疗越早用越好”的观点:将免疫治疗提前至一线时,患者的体力状况往往较好,此时免疫治疗的反应就更好;而且免疫治疗有“拖尾效应”,起效后随着时间的延长,疗效的优势也就更为明显。未来,免疫治疗应该继续向更前线推,值得在辅助治疗中进一步探索,因为辅助治疗阶段患者的体力状态更好,如果结果阳性,则意义更为重大,相当于给更多患者带来了临床治愈的机会。 快速获批背后的未来趋势:以患者利益为核心,以临床价值为导向自2020年9月ESMO大会上以LBA(late breaking abstract)形式首次公布了CheckMate-649的首轮研究结果后,美国FDA就迅速于2021年4月16日批准了纳武利单抗联合化疗的胃癌一线治疗适应症,无论PD-L1表达和 HER2 状态。而紧随其后,在2021年8月25日,这一适应症又在NMPA获批,距离 CheckMate-649 结果首次公布不足1年,距离该适应症全球首度获批仅时隔4个半月;且早在今年4月,新版CSCO胃癌指南就将这一疗法纳入指南并作为最高级别推荐(Ⅰ级推荐,1A 类证据)。这一系列的“速度”背后反映出 了中国肿瘤医学界的怎样的发展趋势? “批准速度快,首先说明在国家深化医药改革的背景下,药物审评的效率大大提高,这是第一。”李进教授坦言,“第二,主管部门能以患者为中心,充分了解患者的需求,迅速批准能填补重大临床空白的适应症,以使患者尽快用到更好的方案,体现了对患者的人文关怀;第三,纳武利尤单抗作为一种进口药物,新适应症能如此快地在中国获批,也体现了‘科学无国界’的理念——不论是美国 FDA 还是中国 CDE,对于患者的关怀都是一致的。”李进教授盛赞中国国家药品监督管理局药品审评中心(CDE)“以患者利益为核心,以临床价值为导向”的政策和理念。 最后,谈及临床价值,李进教授提到,今年7月,CDE 颁布了《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》,并认为这一新政策将对中国未来的癌症创新治疗研究起到极大的推动作用。何谓临床价值? 李进教授用“有效、安全、方便、可及”四个词语进行了概括。“新政策大大提高了对未来临床研究开展和新药、新适应症获批的要求;但也只有在这样的高标准之下,我们才能不断探索出比现有最好的疗法更好的新方案。未来,我相信这一定会成为我们中国医药创新发展的源泉。”李进教授总结道。
李进 主任医师 上海市东方医院 肿瘤科1169人已读 - 学术前沿 李进教授:HER2阳性实体瘤新希望 ADC药物MRG002 Ⅰ期研究公布
2021年9月25-29日,第二十四届全国临床肿瘤学大会暨2021年CSCO学术年会如约而至,推动我国肿瘤领域不断发展。HER2靶点在实体瘤的开发非常成熟,其精准治疗也随临床研究的进展而革故鼎新。大会首日,同济大学附属东方医院(上海市东方医院)李进教授牵头的MRG002 Ⅰ期研究引爆抗HER2诊疗热点,从HER2阳性胃癌到乳腺癌,新型ADC药物MRG002初步显示了的疗效和安全性,为患者燃起新的希望。 2021年9月25日,CSCO学术年会首日主会场中,CSCO大会主席同济大学附属东方医院(上海市东方医院)李进教授发布了题为《评价注射用重组人源化抗HER2单抗-MMAE偶联物(MRG002)在HER2阳性晚期实体瘤患者中的安全性、耐受性的剂量递增及扩展入组的临床研究》的重要报告,为我国抗HER2 ADC药物的发展画出了浓墨重彩的一笔。 李进教授首先代表临床试验团队对大会将本研究选入主旨会场报告表示感谢,随后回顾了近年来 ADC药物蓬勃发展,正逐渐成为治疗HER2阳性实体瘤的新选择的研究背景。ADC药物被誉为“魔法子弹”,不断在实体瘤中开疆拓土。 MRG002作为我国自主研发的新兴ADC药物,李进教授表示“其设计非常巧妙”,从结构和机制上看,其由糖修饰曲妥珠单抗通过可酶切vc链接子与MMAE(甲基澳瑞他汀E)偶联而成,其化疗部分MMAE是目前广泛应用于ADC的微管蛋白抑制剂,可抑制微管聚合,干扰有丝分裂导致细胞死亡,“是足够强大的细胞毒药物”。李进教授重点言明 “MRG002链接子与其他ADC不同,为可裂解的vc链接子,更容易产生旁观者效应”,该链接子在血液中足够稳定,被内化进入溶酶体后会迅速裂解,快速释放MMAE分子,进而形成旁观者效应,使抗肿瘤效果更显著的体现,是当前肿瘤领域极具前景的ADC药物。 在安全性结果中,李进教授指出常见不良事件为细胞毒药物相关的白细胞降低和肝功能影响,总体安全可耐受。基于疗效与安全性,在本阶段初步得出推荐剂量为2.6mg/kg(RP2D)。 Ⅰb期剂量扩展阶段入组的51例患者以2.6mg/kg MRG002开展研究,涵盖乳腺癌、胃癌,既往中位系统治疗5线,99%患者既往接受了抗her2治疗。在43例可评估患者中,22例PR、18例SD、3例PD,ORR为51%,DCR为93%;在既往T-DM1治疗失败的6例患者中观察到2例PR;另有8例患者仍在用药中,李进教授对后续观察结果寄予厚望。 李进教授进一步分析了整个Ⅰ期研究中MRG002对HER2阳性乳腺癌和胃癌的效果。在可评估的5例既往接受2线治疗且曲妥珠耐药胃癌患者中,ORR为60%,DCR为80%。在可评估的47例RP2D以上剂量的HER2阳性乳腺癌的ORR达到53%,其中23例肝转移患者的ORR为61%,5例肝+脑转移患者ORR为60%,22例HER2和HR双阳性患者的ORR为68%。 Ⅰb期研究的安全性方面,其常见不良反应为中性粒细胞计数降低(46%)、LDH升高(43%)、多为1~2级;常见(发生率≥10%)的3级不良反应仅为中性粒细胞计数降低(17%),无危及生命不良事件。基于此,李进教授评定:“MRG002的安全性非常良好,不良反应可控且在短期内可恢复正常。” 该研究前期结果已在今年ESMO会议公布,本次报告进一步显示了MRG002在经治的HER2阳性晚期实体瘤患者人群中的抗肿瘤活性以及可控的安全性和耐受性,得到了广泛的认可。李进教授总结指出,MRG002在HER2阳性胃癌及乳腺癌方面已初步显示了后线治疗的疗效,为临床治疗提供了新的方向,但仍需要在后续的Ⅱ期、Ⅲ期研究中进一步探索有效性和安全性。 李进教授讲解完毕后,在北京大学肿瘤医院郭军教授的主持下,北京大学国际医院梁军教授与李进教授就ADC药物的安全性及耐药性进行了讨论。李进教授指出,由于ADC药物靶向化疗的特点,其较之单纯化疗安全性更佳;然而在耐药方面,当前已上市的ADC药物在一线、二线用药过程中已发现耐药的存在,对于MRG002而言,现阶段研究尚停留在中位5线的治疗线序,暂未观察到耐药存在,期待后续的线序前移研究中,能够就此开展相关探索。 本环节最后,李进教授呼吁全国的肿瘤专家携手共进,加快后续试验入组进程,尤其是胃癌、乳腺癌领域的探索,助力MRG002早日上市,为患者带来更多选择、更多获益。
 李进 主任医师 上海市东方医院 肿瘤科1616人已读
李进 主任医师 上海市东方医院 肿瘤科1616人已读 - 学术前沿 李进教授:dMMR/MSI-H晚期结直肠癌患者福音—KEYNOTE-177研究详谈_化疗
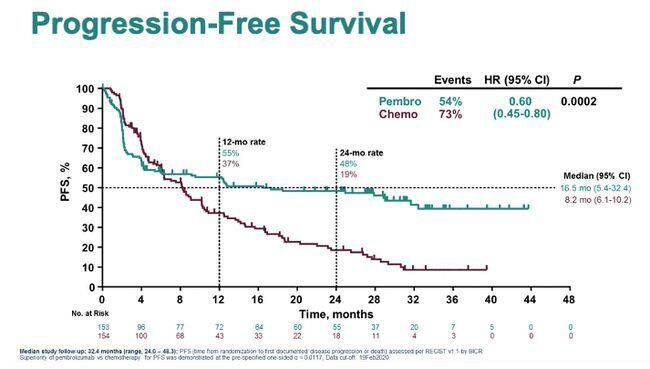
每年的4月15日~21日为全国肿瘤防治宣传周,今年宣传周主题是“健康中国健康家——关爱生命,科学防癌”,强调了家庭在防癌抗癌中的重要作用。 近年来肿瘤免疫疗法已成为肿瘤治疗领域的焦点,KEYNOTE-177是一项旨在评估帕博利珠单抗单药对比标准化疗一线治疗MSI-H型mCRC的III期临床研究。【ONCO前沿】特邀同济大学附属东方医院的李进教授就KEYNOTE-177研究相关热点问题进行了详尽的阐释。 问题一:去年 6 月 ASCO 大会上口头报道了 KEYNOTE-177 研究,今年年初的 ASCO GI 上 报告了 KEYNOTE-177 研究的最终无疾病进展生存(PFS)分析和 PFS2 分析结果。帕博利珠单抗完胜化疗,并且 PFS 翻倍(16.5 vs. 8.2),OS 结果还未成熟。您可以简单聊下 KEYNOTE-177 研究吗?李进教授::KEYNOTE-177研究是一项旨在评估帕博利珠单抗单药对比标准化疗一线治疗微卫星不稳定(MSI-H)型晚期结直肠癌(mCRC)的III期临床研究。林奇综合征(Lynch,又称为遗传性非息肉性大肠癌,hereditary non-polyposis colorectal cancer,HNPCC)是最常见的遗传性结直肠癌综合征,往往表现为错配修复功能缺陷(dMMR)或MSI-H表型。也有部分患者由于肿瘤错配修复基因的缺失导致肿瘤发生发展,约占14%。此类患者的预后往往比非错配修复基因缺失(pMMR)的患者略好些。 而在晚期肠癌患者中,错配修复基因缺失(dMMR)的患者仅占5%左右。这部分患者有两大特点:其一,复发风险非高危,往往不进行术后辅助化疗;其二,对免疫治疗特别敏感,可从免疫治疗中获益。 基于此KEYNOTE-177研究开展,研究入组307 例患者。研究结果显示中位研究随访时间32.4个月,帕博利珠单抗组ORR为43.8%,化疗组为33.1%;帕博利珠单抗组中位 PFS 为 16.5 个月,是化疗组(8.2 个月)的两倍。与化疗组相比,帕博利珠单抗组的 PFS2(从随机分组进展到后线治疗出现进展或任何原因死亡的时间)未达到,对照组为 23.5 个月。 这个结果非常令人振奋。相信未来PD-1、PD-L1、免疫联合化疗或者其他靶向药物治疗能够为肿瘤患者带来更多获益,也希望这样的研究将来能更多的开展。 问题二:您如何看待 MSI-H/dMMR 的检测现状?前景如何?李进教授:对于II期患者,术后需要做错配修复基因检测来确定其是否需要进行化疗。而对于晚期患者——如KEYNOTE-177这样的研究已经表明错配修复基因缺失(dMMR/MSI-H)的患者,可以从免疫治疗中获益。因此虽然目前错配修复基因的检测在临床上还不是必须的,但未来需要对患者加强这方面的检测。错配修复基因的检测不复杂,主要是检测其4个错配修复(MMR)基因(MLH1,MSH2,MSH6,PMS2) 。一旦确定患者是错配修复基因缺失的(dMMR/MSI-H),其可以很大程度上从免疫治疗中获益。 正如自从发现曲妥珠单抗一线治疗对HER2高表达胃癌的患者有效,胃癌患者的HER2检测已经成为术后常规,我们也希望未来对于结直肠癌患者的错配修复基因的检测可以变成常规检测。这样II期、III期患者术后是否需要化疗、化疗的用量、复发后的用药等问题我们就可以通过大数据检测来指导临床用药。 问题三:据悉,帕博利珠单抗在去年11月向CDE递交上市申请并拟纳入优先审评,用于结 直肠癌一线治疗,有望今年3季度正式获批。您认为KEYNOTE-177对临床有何意义呢?李进教授:我觉得这是个好消息,对药企、对医生、对患者都是好消息。对我们医生来讲,又多了一个抗击肿瘤的武器;对于患者来讲,他们又有了一线生的希望,特别对错配修复基因缺失(dMMR/MSI-H)的晚期结直肠癌患者是一个福音。 盼望国家有关部门能够尽早组织专家进行评审。一旦通过评审,此可谓晚期肠癌治疗的里程碑式事件。 免疫治疗的毒副反应相对于化疗来讲比较低。我们也希望通过这个研究能够引伸出更多的研究。能为患者提供更好的治疗,包括让更多患者实现生存的延长、生活质量的提高。当然未来错配修复基因不缺失的患者,也是我们研究的重点。期待通过大家的共同努力,为患者带来更多希望。 问题四:2017 年 5 月帕博利珠单抗获批后线治疗 MSI-H/dMMR 泛实体瘤及结直肠癌患者,您如何看待 MSI-H 患者的免疫治疗前景?李进教授:帕博利珠单抗此前获得FDA批准成为全球首个基于生物标志物的“泛癌种”疗法。通过基因检测或者免疫组化的方式都可以检测出错配修复基因缺失的患者,他们对免疫治疗非常敏感,可以从以帕博利珠单抗为代表的PD-1抑制剂中获益。 希望未来通过病理学专家和临床肿瘤学专家的共同努力,为患者提供最好的治疗,让他们得到救治,实现活得长活得好的长远目标。
 李进 主任医师 上海市东方医院 肿瘤科6186人已读
李进 主任医师 上海市东方医院 肿瘤科6186人已读 - 就诊指南 抗癌治疗中“打铁还需自身硬”的免疫疗法
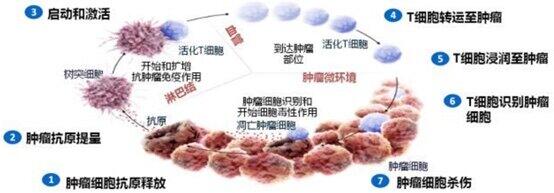
癌症早已成为我们生活中的常见的慢性病,对于癌症的治疗措施,您是否还停留在手术、放疗、化疗呢?传统治疗手段经典,但也存在一定弊端。如手术治疗对于中晚期肿瘤通常不彻底,无法根除肿瘤;放疗和化疗虽然可以有效的控制很多肿瘤,但是它们对机体的正常细胞也有较大伤害。随着医学的发展和技术革新,近些年来非常火热的免疫治疗,已成为癌症精准医疗中的一大热点,并已逐步发展成为继手术、化疗和放疗后的第四种肿瘤治疗模式。今天就让我们一起来了解一下什么是免疫疗法,及其给癌症治疗带来了怎样翻天覆地的变化。 什么是肿瘤免疫治疗?正常情况下,我们的免疫系统是可以识别并清除肿瘤细胞的。但为了生存下来,肿瘤细胞能够采取不同策略,逃避免疫细胞的围剿和追杀,从而在抗肿瘤免疫应答的各阶段得以幸存。肿瘤细胞的这种特征称为“免疫逃逸”。肿瘤-免疫循环分为七个环节:肿瘤抗原释放→肿瘤抗原呈递→启动和激活效应性T细胞→T细胞向肿瘤组织迁移→肿瘤组织T细胞浸润→T细胞识别肿瘤细胞→清除肿瘤细胞。上述七个环节中,任一环节出现问题都可能会导致肿瘤细胞免疫逃逸。 肿瘤免疫治疗就是通过重新启动并维持免疫系统对肿瘤细胞的识别和杀伤,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤细胞的一种治疗方法。免疫治疗包括单克隆抗体类免疫检查点抑制剂、治疗性抗体、癌症疫苗、细胞治疗和小分子抑制剂等。免疫治疗不仅效果好,而且还避免了对机体的损伤,因此近年来备受关注。 肿瘤免疫疗法中的“在战斗机”免疫疗法的出现掀起了癌症治疗的变革,其中最具代表性的是PD-1/PD-L1抑制剂,在多种癌症中都取得了令人瞩目的疗效。PD-1/PD-L1通路是最重要的免疫检查点之一,肿瘤细胞通过过度表达PD-L1等分子,与T细胞表面的PD-1结合,从而使得T细胞失活,导致T细胞无法发现及杀灭肿瘤细胞,帮助肿瘤逃脱免疫系统的追杀,典型的“助纣为虐”。PD-1/PD-L1抗体,通过阻断这种“罪恶的连接”,促进病人自身的免疫系统杀伤肿瘤。从2018年国内首个PD-1抑制剂获批至今(2014年世界首个PD-1抑制剂获批),国内已有九种PD-1/PD-L1抑制剂获批上市,包括4种进口药,5种国产药(信迪利单抗、替雷利珠单抗、特瑞普利单抗、卡瑞利珠单抗、派安普利单抗;前4种已进入医保)。 国内获批的九种PD-1/PD-L1抑制剂的部分适应症 PD-1/PD-L1抑制剂是怎样工作的呢?免疫细胞的细胞表面上表达一种PD-1蛋白激酶,可帮助免疫细胞识别致病因子,包括肿瘤细胞。但是肿瘤细胞在演变的过程中,会狡猾的依据免疫细胞的蛋白激酶进展出一种PD-L1配体,可去识别并结合免疫细胞的 PD-1,一旦PD-L1与PD-1结合,肿瘤细胞就像披上了羊皮的大灰狼,在我们身体里大摇大摆的扩增,而免疫细胞就像失明了的猎人,再也无法看穿肿瘤细胞的真面目。 PD-1和PD-L1抑制剂就是去阻断PD-1和PD-L1融合,撕下肿瘤细胞披着的羊皮,让猎人(免疫细胞)恢复“火眼金睛”,从而消灭肿瘤细胞这些“大灰狼”! PD-1/PD-L1抑制剂的副作用?从PD-1/PD-L1抑制剂的作用机制上就可以知道,PD-1/PD-L1抑制剂的副作用小,是远小于化疗的。最常见的副作用是“流感”样的表现:发热、乏力、头晕、全身肌肉酸痛、嗜睡等,上述症状大约出现在1/3的病人中,对症处理后,可逐步缓解。 然而,并不是说PD-1抑制剂就毫无风险。大约5%-10%的患者,会出现严重的免疫相关的炎症反应:免疫性肺炎、免疫性肠炎、免疫性肝炎、甚至免疫性心肌炎,此外部分患者会出现垂体炎和甲状腺减退症。上述免疫性炎症,如果发现不及时,处理不到位,偶尔也会发生危及生命的严重不良反应。因此,选择PD-1抑制剂治疗时,也要时刻牢记风险,不可麻痹大意,最好在有经验的临床医生的指导和监督下完成。 PD-1/PD-L1抑制剂给癌症治疗带来什么变化?(以下结果均来自消化道肿瘤相关的3期随机临床试验)(一)显著延长了患者的生存期,提高了缓解率 与安慰剂相比,纳武单抗作为三线或后线疗法将难治性的不可切除的晚期或复发性胃癌或胃食管交界癌患者的12个月总生存率提高了两倍多(26.2% vs 10.9%),而且将中位总生存期延长了1.3倍 [1]。 与化疗(紫杉醇或多西他赛)相比,纳武单抗作为二线或后线疗法显著延长了不可切除的晚期或复发性食管鳞癌的总生存期(10.9 vs 8.4 个月;死亡风险比 0.77,p=0.019)[2]。 纳武单抗联合化疗相比单纯化疗作为一线疗法明显延长了既往未治疗过的、不能切除的、非HER2阳性的PD-L1 CPS≥5分的胃癌、食管癌或胃食管癌患者的总生存期(14.4 vs 11.1个月,p
 李进 主任医师 上海市东方医院 肿瘤科1609人已读
李进 主任医师 上海市东方医院 肿瘤科1609人已读





