李玲玉医生的科普号
- 医学科普 病理报告提示神经内分泌肿瘤,该怎么办?
1.神经内分泌肿瘤属于恶性肿瘤范畴很多患者看到活检病理或者术后病理提示“神经内分泌肿瘤”,不是“癌”,就认为是良性肿瘤,实则不然。2017年版神经内分泌肿瘤WHO分类中将其编码为3/恶性肿瘤。因此,即使病理报告提示为G1级的神经内分泌肿瘤,它仍为恶性,同样存在复发转移的风险。而其具体的复发转移风险,与肿瘤的部位、起源、大小、分级、有无脉管神经侵犯等因素密切相关,需有经验的医生通过结合患者病史、影像学评估及病理报告综合评估,并给予患者个体化的诊疗意见。2.神经内分泌肿瘤的病理误诊率高尽管神经内分泌肿瘤的WHO分类已明确了该类肿瘤的病理诊断框架,但我国该类疾病的病理误诊率仍较高,据不完全统计,神经内分泌肿瘤特别是罕见部位神经内分泌肿瘤的病理误诊率达到50%以上。例如:发生在鼻的小圆细胞肿瘤,表达神经内分泌肿瘤标记syn,很多病理医生直接下“鼻神经内分泌肿瘤”的诊断,但事实上,该部位的神经内分泌肿瘤还需与嗅母细胞瘤、异位垂体腺瘤等相鉴别。病理的误诊将直接导致后续临床诊疗的偏离,因此,当患者拿到病理报告提示“神经内分泌肿瘤”时,建议就诊有经验的神经内分泌肿瘤专病医生,必要时请病理联合会诊,尽可能降低病理误诊率。完善明确的病理诊断是该类患者后续诊疗的基石。3.不同部位、不同时期病理诊断不同神经内分泌肿瘤是时空异质性极强的恶性肿瘤(时空异质性强是指:同一患者不同时间、不同部位的肿瘤生物学行为不同,病理报告上体现为疾病分级、ki67指数、SSTR2等表达的不同),所以神经内分泌肿瘤患者就诊时,建议携带全部病理结果,以便专病医生对患者的病情进行全面评估。
李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科399人已读 - 医学科普 带你了解嗜铬细胞瘤/副神经节瘤
嗜铬细胞瘤/副神经节瘤是恶性肿瘤?嗜铬细胞瘤和副神经节瘤(PPGLs)是一类起源于神经外胚层嗜铬母细胞的神经型神经内分泌肿瘤,临床上习惯将定位于肾上腺髓质的PPGLs称为嗜铬细胞瘤,而将肾上腺外的PPGLs统称为副神经节瘤。既往研究认为由于目前尚无组织学、分子学证据区分PPGLs的良恶性,仅当PPGLs出现远处转移时才被诊断为“恶性PPGL”。然而,近年来随着临床对该类疾病生物学行为认识的深入,病理学家认为所有PPGLs均具有恶性潜能,因此,2017年WHO的国际癌症编码将PPGLs统一界定为恶性,并建议将已经发生转移的PPGLs命名为“转移性PPGLs”。临床怀疑嗜铬细胞瘤/副神经节瘤需完善哪些检查?临床上当患者高度怀疑PPGLs时,建议在手术切除前,按照神经内分泌肿瘤的诊疗思路,给予完善全身常规影像学评估(增强CT或MRI)以及功能影像学(如18F-FDG-PET/CT、68Ga-SSA-PET/CT、18F-DOPA-PET/CT、123I-MIBG扫描等),以充分评估肿瘤负荷及全身转移情况。此外,交感神经起源的PPGLs多伴有儿茶酚胺等激素的分泌,临床上多表现为阵发性高血压、心悸、多汗等症状。因此,PPGLs治疗前均需完善血液/尿液儿茶酚胺及其代谢产物的检测。基因检测对于PPGLs患者至关重要,超过40%的PPGLs患者携带遗传相关基因突变,包括RET(MEN2A、MEN2B综合征)、SDHx、VHL、NF1等多种基因的胚系突变。因此,PPGLs患者,尤其是年轻发病并伴有其他类型神经内分泌肿瘤的患者,均需进行胚系基因检测及家系筛查。嗜铬细胞瘤/副神经节瘤的治疗手段有哪些?1.手术治疗在治疗上,对于非转移性的PPGLs,手术切除仍是首选治疗方案。由于该类肿瘤易分泌儿茶酚胺,术中出现高血压危象的风险极高,因此无论术前检测儿茶酚胺的分泌情况如何,均应给予α受体阻滞剂(必要时加用β受体阻滞剂)进行围手术期处理。2.放疗临床上对于颅底或颈部无激素分泌的PPGLs,由于部分手术难度较大,可考虑行局部放疗,然而放疗的整体缩瘤率较低,大部分患者仅可达到肿瘤的局部控制。此外,对于术后切缘不净或局部残留的PPGLs,放疗可延长局部复发的时间,但整体放疗在PPGLs中的应用仍缺乏有利的循证医学证据。3.药物治疗对于晚期的转移性PPGLs,临床上专病医生会通过全身肿瘤学评估以及功能影像学评估的结果,选用个体化的全身治疗方案:1)生长抑素类似物(SSA):对于生长抑素受体表达阳性且增殖指数较低的患者,可选用善龙、兰瑞肽等SSA类药物。2)靶向治疗:目前有小样本研究显示PPGLs患者可从舒尼替尼治疗中获益,但抗血管生成的TKI类药物易出现高血压等不良反应,对于伴有激素分泌的PPGLs应慎用。3)化疗:对于无法切除、快速进展且高肿瘤负荷的PPGLs,以替莫唑胺或CVD(环磷酰胺、达卡巴嗪、长春新碱)为基础的化疗也应被考虑。4.放射性核素治疗对于MIBG摄取阳性的晚期、疾病进展且无局部治疗指征的患者可尝试131I-MIBG的核素治疗;此外,针对生长抑素受体(SSTR2)阳性表达的转移性PPGLs患者也可采用肽受体介导的放射性核素治疗(PRRT),具体核素包括90Y-Dotatoc以及177Lu-DOTATATE。
李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科568人已读 - 医学科普 垂体瘤也是一种神经内分泌肿瘤
垂体腺瘤起源于垂体前叶的腺垂体细胞,腺垂体细胞由多种分泌不同激素的神经内分泌细胞组成,主要包括生长激素(GH),促甲状腺激素(TSH),促肾上腺激素(ACTH),促性腺激素(LH/FSH),催乳素(PRL)及促黑素(MSH)等。虽然垂体腺瘤多为良性,但仍有少部分具有侵袭性甚至发生远处转移,因此,鉴于垂体瘤起源于垂体神经内分泌细胞并存在恶性潜能,在2022年的“WHO中枢神经系统肿瘤分类概述”中,将“垂体腺瘤”正式更名为“垂体神经内分泌肿瘤(pitNET)”。因此,通俗意义上讲,垂体腺瘤是一种原发于垂体部位的神经内分泌肿瘤。目前在临床诊治过程中,我们将pitNET根据是否分泌激素分为功能性pitNET及无功能性pitNET。针对功能性pitNET,我们在关注肿瘤控制的同时往往更需控制激素相关症状、评估靶器官功能;而针对无功能性pitNET,由于缺乏激素分泌,患者多由于局部压迫症状被发现,因此诊疗过程中常常需重点评估肿瘤对局部视交叉、海绵窦、蝶窦等部位的侵犯,为进一步的外科手术治疗完善评估。对于术后病理提示有高危复发风险并在常规影像学上提示存在可疑远处转移时,需通过18F-FDG-PET/CT或68Ga-SSA-PET/CT完善全身评估。此外,pitNET中有约5-7%的患者存在遗传相关疾病的致病基因,包括AIP、MEN1、NF1等胚系基因突变,因此,对于青年发病,或合并全身其他部位神经内分泌肿瘤患者,建议行神经内分泌肿瘤相关的胚系基因检测。由于该类疾病为常染色体显性遗传,患者的子女将有50%携带致病基因的风险,因此,一旦确诊遗传相关疾病,均建议对患者的直系亲属行遗传相关疾病的家系筛查。
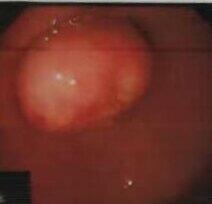
李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科299人已读 - 医学科普 发现直肠神经内分泌肿瘤该怎么办?
直肠神经内分泌肿瘤(NET)早期往往无症状,偶伴有腹泻、腹痛等非特异性症状,通常在体检肠镜时发现,目前仍不少患者被当作“直肠息肉”行简单的内镜下钳除,误诊误治率仍居高不下。因此,当患者行常规内镜下检查,发现直肠粘膜下隆起时应予以高度重视(如下图)。有经验的专病医生会通过粘膜下隆起的大小、隆起的形状、表面情况、浸润深度等肠镜或超声内镜下表现,初步判断病灶的恶性程度及转移风险,并进一步通过增强CT或者MRI,以及68Ga-SSA-PET/CT等完善全面评估后,制定个体化的诊疗策略。1.超声内镜检查通常情况下直肠NET的肿瘤直径小于1.0cm,无局部淋巴结转移及远处转移的情况下是可行内镜下粘膜剥离术(ESD)切除的。然而,普通肠镜很难正确判断NET的真正大小、肠壁起源、浸润深度及区域淋巴结转移情况,因此,术前需通过超声内镜检查明确判断。2.增强CT或MRI增强CT或MRI的应用可用于判断直肠NET局部肠壁侵犯的范围,局部及腹盆腔淋巴结转移的情况。对于直肠NET直径大于1.0cm的患者(转移概率约20-30%),还应关注肝脏等直肠NET常见转移部位的转移情况。这里需要强调,由于神经内分泌肿瘤血供的特殊性,若患者无造影剂过敏的禁忌症,均应行增强CT或MRI完善肿瘤学评估。3.PET-CT检查直肠NET患者90%以上存在生长抑素受体(SSTR2)的表达,通过68Ga-SSA-PET/CT(或者18F-NOTA-PET/CT)等功能影像学检查可进一步评估肿瘤负荷、转移情况,为后期用药选择提供依据。4.术后病理报告直肠NET可在术后多年出现复发或转移,因此,此类患者需长期随访。直肠NET患者行ESD或外科手术切除后,术后病理结果需进一步咨询神经内分泌肿瘤专病医生,根据病理报告中肿瘤的分级、大小、切缘情况等,制定后续诊疗及随访周期。
 李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科562人已读
李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科562人已读 - 医学科普 神经内分泌肿瘤患者需要做哪些影像学检查,为何要做PET-CT?
神经内分泌肿瘤作为一种实体肿瘤,在通过穿刺或者手术病理证实后,往往还需要明确肿瘤在患者体内的分布情况,是否存在转移,具体转移部位,原发及转移肿瘤负荷等。因此,此类肿瘤患者需要通过行胸、腹、盆增强CT明确肿瘤的具体定位,观察肿瘤的血供特点;对于存在肝脏转移的患者,需要加做肝脏普美显核磁,提高肝转移肿瘤的检出率,进一步指导临床诊疗。不仅如此,由于神经内分泌肿瘤的异质性极强,同时对于遗传相关神经内分泌肿瘤(MEN1、MEN2、VHL等)可能同时在不同脏器出现不同类型的神经内分泌肿瘤,应用核医学功能影像可进一步描绘患者疾病图谱,指导临床诊疗。神经内分泌肿瘤常用的3种PET-CT包括:传统的18F-FDG-PET/CT,68Ga-SRS-PET/CT以及18F-DOPA-PET/CT。18F-FDG-PET/CT是用18F同位素标记的葡萄糖作为示踪剂的PET/CT,可以充分体现肿瘤对于葡萄糖摄取的情况,一般FDG摄取越多,说明肿瘤的糖代谢越活跃,恶性程度也越高,患者预后相对越差。68Ga-SRS-PET/CT是由68镓同位素标记的生长抑素作为示踪剂的PET/CT,该示踪剂通过与神经内分泌肿瘤细胞表面表达的生长抑素受体结合显像。由于神经内分泌肿瘤中约80%以上存在生长抑素受体表达,因此临床上多将68Ga-SRS-PET/CT作为神经内分泌肿瘤相对特异性的显像手段,为此类患者之后的生长抑素类似物(奥曲肽、兰瑞肽等)治疗、PRRT核素治疗等提供依据。由于我国68Ga-SRS-PET/CT尚未普及,部分医院应用18F标记的奥曲肽PET/CT(18F-NOTA-OC-PET/CT)代替68镓扫PET/CT,也可实现对于生长抑素受体的充分显像。18F-DOPA-PET/CT是18F同位素标记L-多巴类似物的PET/CT显像。18F-DOPA的摄取可反应肿瘤细胞代谢儿茶酚胺的能力,由于神经内分泌肿瘤氨基酸转运系统及多巴胺代谢通路关键酶的活性较高,此类肿瘤(特别是嗜铬细胞瘤/副神经节瘤、甲状腺髓样癌、胃肠道NET等)多可通过18F-DOPA-PET/CT显像,指导临床进一步诊治。因此,实际临床工作中,医生常常通过多种PET/CT检查的综合应用,充分评估肿瘤的负荷、恶性程度、生物学行为,为患者的个体化诊治提供依据。由于PET/CT检查费用较高,且为自费项目,特写此篇科普告知广大神经内分泌肿瘤患者,该类检查的意义。PET/CT多作为患者首次诊疗评估,不作为复查常用检查,治疗常规复查及随访多应用普通影像学(CT及MRI)实现。
李玲玉 副主任医师 吉林大学第一医院 肿瘤中心肿瘤科301人已读





