闫丽隽医生的科普号
- 精选 宫颈癌诊治
?《中国癌症杂志》2021年第31卷第6期 474 欢迎关注本刊公众号 CHINAONCOLOGY 2021 Vol.31 No.6 ·指南与共识· 子宫颈癌诊断与治疗指南(2021年版) 中国抗癌协会妇科肿瘤专业委员会 [关键词] 子宫颈癌;诊断;治疗;指南 DOI: 10.19401/j.cnki.1007-3639.2021.06.06 中图分类号:R737.33?文献标志码:A?文章编号:1007-3639(2021)06-0474-16 ?子宫颈癌发病率居女性生殖系统恶性肿 瘤第2位,根据世界卫生组织(World Health Organization,WHO)的数据,全球每年有新增 病例53万,约25万女性因子宫颈癌死亡,其中发 展中国家女性因子宫颈癌死亡人数占全球女性因 子宫颈癌死亡人数的80%。在西方发达国家,由 于人乳头瘤病毒(human papilloma virus,HPV) 疫苗的使用和子宫颈癌筛查的普及,子宫颈癌发 病率缓慢下降;在中国,每年新增子宫颈癌病例 约14万,死亡病例约3.7万。 本指南适用于子宫颈鳞癌、腺癌、腺鳞癌及 子宫颈小细胞神经内分泌肿瘤(neuroendocrine carcinoma of the cervix,NECC)。其他特殊 病理学类型,如透明细胞癌、肉瘤等发病率低, 国际、国内尚未就诊断与治疗方法达成共识,因 此,本指南不包括这些少见病理学类型的诊治, 部分诊治可参照本指南。在临床实践中,根据医 院的设备、技术条件以及患者的病情,国际上推 荐采用最适合的符合指南的方法诊治患者。对于 病情复杂的子宫颈癌,临床医师应灵活应用指 南,不适用于本指南的情况下建议参考高级别循 证医学证据及研究结果,并鼓励参加临床试验。 1 分期 1.1 分期规则 子宫颈癌分期规则采用国际上统一使用 的国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2018年分期 (表1)、TNM分期作为参考(表2)[1]。FIGO 2018年子宫颈癌分期与2009年分期相比,主要有 以下不同: 1 因存在取材和病理“伪影”误差,微小浸 润癌的分期不再考虑病变宽度。 2 IB期根据子宫颈病变的最大直径细分为 IB1、IB2和IB3期。 3 由于淋巴结受累其预后更差,所有伴淋 巴结转移的病例归为IIIC期,若仅有盆腔淋巴结 阳性,则为IIIC1期;若腹主动脉旁淋巴结也受 累,则为IIIC2期,分期规则还指出,添加符号标 明影像学评估为“r”,已获得病理学确诊的为 “p”。因此,FIGO 2018年子宫颈癌分期规则为 临床结合影像学及病理学诊断结果的分期。 分期需注意以下4点: 1 需2名及以上高年资医师共同查体明确 临床分期,有条件时最好在麻醉状态下行盆腔 检查。 2 分期有分歧时以分期较早的为准。 3 允许影像学和病理学检查结果用于分期。 4 微小浸润癌诊断必须根据子宫颈锥切标本 由有经验的病理科医师作出诊断。 1.2 分期前检查 子宫颈癌治疗前分期很重要,应全面检查评 估患者的病情及身体状态,避免遗漏转移病灶, 以下检查应作为常规检查: 1 子宫颈活检。镜下浸润必要时行子宫颈锥 切及子宫颈管搔刮术以明确组织病理学诊断及病 变范围。 2 妇科检查仍然是临床分期的主要依据。 3 分期为IIB期以上或有相关的临床症状或 必要时,需行肾图、膀胱镜、肠镜检查。 4 血清鳞状上皮细胞癌抗原(squamous cell 《中国癌症杂志》2021年第31卷第6期 carcinoma antigen,SCCA)(对子宫颈鳞癌)、 糖类抗原125(carbohydrate antigen 125,CA125) (对子宫颈腺癌)检查。 5 胸CT、盆腔及上下腹(含腹主动脉旁) 平扫+增强MRI或CT,无条件者可行上下腹超 声检查和胸部CT,建议IB1期以上有条件者行 PET/CT检查。 6 子宫颈HPV定性或定量检测。 7 肿瘤相关基因检测可选择。 1.3 临床分期 遵照FIGO 2018年分期原则,子宫颈癌FIGO 临床分期见表1,TNM分期采用美国癌症联合会 (American Joint Committee on Cancer,AJCC) 第9版,具体见表2。 1.4 影像分期 FIGO 2018年分期把影像学检查结果纳入分 期,盆腔和(或)腹主动脉旁淋巴结受累,无论 肿瘤的大小与范围(采用r标记),IIIC1r表示只 有盆腔淋巴结转移,IIIC2r表示腹主动脉旁淋巴 结转移。对于IB3、IIA2~IVA期的子宫颈癌患 者,可采用影像学评估分期,根据影像学评估淋 475 巴结是否阳性决定下一步治疗方案。影像学提示 盆腔淋巴结阳性,腹主动脉旁淋巴结阴性,可选 择下列一种治疗方式:1 盆腔全量同步放化疗+ 后装腔内放射治疗±腹主动脉旁淋巴结放疗;2 腹主动脉旁淋巴结切除,建议术后影像学检查确 定淋巴结已充分切除,照射范围需根据临床和影 像学结果决定;3 病理学检查结果证实腹主动脉 旁淋巴结阳性,选择延伸野全量放化疗+后装腔 内放射治疗。影像学分期提示盆腔淋巴结阳性, 腹主动脉旁淋巴结阳性,直接选择延伸野全量放 化疗+后装腔内放射治疗。影像学分期盆腔及腹 主动脉旁淋巴结均阴性,可选择盆腔全量同步放 化疗+后装腔内放射治疗。 1.5 手术分期 对于IB3、IIA2~IVA期的子宫颈癌患者也 可以采用手术病理学分期,不论肿瘤的大小与范 围(采用p标记),IIIC1p表示只有盆腔淋巴结转 移,IIIC2p表示腹主动脉旁淋巴结转移。采用腹 主动脉旁淋巴结切除±盆腔淋巴结切除的手术分 期(2B级证据),淋巴结切除上界至肠系膜下动 脉水平,建议分期术后行影像学检查明确的淋巴 ??分期 I IA IAl IA2 IB IB1 IB2 IB3 II IIA IIA1 IIA2 IIB III IIIA IIIB IIIC IIIC1 IIIC2 IV IV1 IV2 表 1 子宫颈癌的临床分期(FIGO 2018年分期) 描述 癌症仅局限于子宫颈(扩散至子宫体者不予考虑) 显微镜下诊断的浸润癌,最大浸润深度≤5.0 mma 间质浸润深度≤3.0 mm 间质浸润深度>3.0 mm而≤5.0 mm 最大浸润深度>5.0 mm的浸润癌(大于IA期的范围);病变局限在子宫颈,病变大小为肿瘤最大直径b 间质浸润深度>5.0 mm而最大径线≤2.0 cm的浸润癌 最大径线>2.0 cm而≤4.0 cm的浸润癌 最大径线>4.0 cm的浸润癌 子宫颈癌侵犯至子宫外,但未扩散到阴道下1/3或骨盆壁 累及阴道上2/3,无子宫旁浸润 浸润癌最大径线≤4.0 cm 浸润癌最大径线>4.0 cm 子宫旁浸润,但未达骨盆壁 癌症累及阴道下1/3和(或)扩散到骨盆壁和(或)导致肾积水或无功能肾和(或)累及盆腔和(或)腹主动脉旁淋巴结 癌症累及阴道下1/3,未扩散到骨盆壁 扩散到骨盆壁和(或)肾积水或无功能肾(明确排除其他原因所致) 盆腔和(或)腹主动脉旁淋巴结受累(包括微小转移)c,不论肿瘤的大小与范围(采用r与p标注)d 只有盆腔淋巴结转移 腹主动脉旁淋巴结转移癌症已扩散超出真骨盆或已累及膀胱或直肠黏膜(活检证实)。出现泡状水肿不足以诊断为IV期 扩散至邻近的器官 转移至远处器官 ??a:所有的分期,都可以利用影像学和病理学检查结果来辅助临床所见而判定肿瘤的大小与浸润深度。病理学检查结果优于影像学与临床 判别。b: 脉管受累不改变分期。不再考虑病灶的横向范围;c:孤立的肿瘤细胞不改变分期,但需要记录下来d: r与p的加入是为了标注诊 断IIIC期的依据来源。例如:假如影像提示盆腔淋巴结转移,则分期为IIIC1r期,当病理学检查确诊后,就成为IIIC1p期。影像学的检查手 段、病理学诊断技术都应该记录下来。 476 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?原发肿瘤(T) 淋巴结转移(N) 远处转移(M) 表 2 AJCC(第9版)TNM分期 描述 原发肿瘤不能评估 原位癌 肿瘤局限于子宫颈 镜下可见浸润性癌,浸润深度≤5.0 mm 浸润深度≤3.0 mm 浸润深度>3.0 mm,但≤5.0 mm 临床可见的局限于子宫颈的肿瘤;或镜下可见超出T1a的范围(淋巴脉管侵犯不改变 分期,水平浸润宽度不再纳入分期) 肿瘤间质浸润>5.0 mm和肿瘤最大径≤2.0 cm 肿瘤最大径>2.0 cm,但≤4.0 cm 肿瘤最大径>4.0 cm 肿瘤侵犯超出子宫颈,但未达到盆壁或者阴道下1/3 肿瘤侵犯阴道上2/3,无子宫旁浸润 肿瘤最大径≤4.0 cm 肿瘤最大径>4.0 cm 有子宫旁浸润,但未达盆壁 肿瘤侵犯至盆壁,和(或)阴道下1/3,和(或)引起肾积水或无功能肾 肿瘤侵犯阴道下1/3,但未达到盆壁 肿瘤侵犯盆壁,和(或)引起肾积水或无功能肾 活检证实侵犯膀胱或直肠黏膜或肿瘤扩散至临近器官 (大疱性水肿病例不列为IVA期) 区域淋巴结中的孤立肿瘤细胞≤0.2 mm或单个淋巴结横截面中的单个肿瘤细胞 或肿瘤细胞簇≤200个 仅盆腔淋巴结转移 盆腔区域淋巴结转移(>0.2 mm,但最大径≤2.0 mm) 盆腔区域淋巴结转移(最大径>2.0 mm) 腹主动脉旁淋巴结转移,含或者不含盆腔淋巴结转移 腹主动脉旁区域淋巴结转移(>0.2 mm,但最大径≤2.0 mm),含或者不含 盆腔淋巴结转移 腹主动脉旁区域淋巴结转移(最大径>2.0 mm),含或者不含盆腔淋巴结转移 远处转移(包括腹股沟淋巴结转移、腹腔内病灶、肺、肝或骨转移;不包括 ?盆腔或主动脉旁淋巴结或阴道转移) 显微镜下证实远处转移(包括腹股沟淋巴结转移、腹腔内病灶、肺、肝或骨转移; ?不包括盆腔或主动脉旁淋巴结或阴道转移) ?TX Tis T1 T1a T1a1 T1a2 T1b T1b1 T1b2 T2 T2a T2a1 T2a2 T2b T3 T3a T3b T4 TX, T0, TX, T0, 任何T N0(i+) T1-T3 N1 N1mi N1a T1-T3 N2 N2mi N2a 任何N M1 cM1 pM1 ?结充分切除,具体照射范围需根据临床和影像学 表现决定:1 手术分期病理学检查提示淋巴结阴 性,采用盆腔全量放化疗+后装腔内放射治疗。 2 手术分期病理学检查提示盆腔淋巴结阳性,腹 主动脉旁淋巴结阴性(IIIC1p期),选择盆腔全 量放疗+后装腔内放射治疗+含铂药物同步化疗。 3 手术分期病理学检查提示腹主动脉旁淋巴结阳 性(IIIC2p期),需行全身检查排除远处转移, 若无远处转移选择延伸野全量放疗+后装腔内放 射治疗+含铂药物同步化疗;若存在远处转移, 选择系统性全身治疗及个体化治疗。 对于IB3、IIA2~IVA期的子宫颈癌患者影 像学分期提示盆腔淋巴结阳性,腹主动脉旁淋巴 结阴性,也可再次选择腹主动脉旁淋巴结切除手 术病理学分期,如果手术分期病理学检查提示腹 主动脉旁淋巴结阴性,采用盆腔全量放疗+后装 腔内放射治疗+铂类药物同步化疗;如果腹主动 脉旁淋巴结阳性,选择延伸野全量放疗+后装腔 内放射治疗+铂类药物同步化疗[2]。 《中国癌症杂志》2021年第31卷第6期 2 子宫颈癌病理类型 子宫颈癌的病理类型遵照妇科肿瘤WHO分类 (2020版)原则[3],具体见表3。 3 治疗 3.1 基本原则 子宫颈癌治疗方法主要有手术治疗和放疗, 化疗广泛应用于与手术、放疗配合的综合治疗和 晚期复发性子宫颈癌的治疗。目前靶向治疗、免 疫治疗及其联合治疗可用于复发或转移子宫颈 癌的全身系统性治疗。子宫颈癌综合治疗不是几 种方法的盲目叠加,而应有计划地分步骤实施, 治疗中根据手术结果和放疗后肿瘤消退情况予以 调整,原则上早期子宫颈癌以手术治疗为主,中 晚期子宫颈癌以放疗为主,化疗为辅。放疗适用 于各期子宫颈癌,外照射可采用前后对穿野、盆 腔四野、三维适形、调强放疗。适形放疗和调强 477 放疗已应用于临床,由于子宫颈癌后装腔内放疗 的剂量学特点,具有不可替代性。手术治疗适用 于分期为IA期、IB1、IB2、IIA1的患者, IB3期及IIA2期首选推荐同步放化疗,在放疗 资源缺乏地区可选择手术。对于未绝经的患者, 特别是年龄小于40岁的患者,放疗容易引起盆 腔纤维化和阴道萎缩狭窄,早于IIB期、无手术 禁忌证者可选择手术治疗。手术入路推荐开腹手 术或经阴道手术,对于IA1期无脉管侵犯患者 可选腔镜微创手术。目前化疗广泛适用于子宫 颈癌治疗,采用以铂类药物为基础的单药或联 合化疗,化疗中可联合贝伐珠单抗治疗。而对 于二线治疗,可以选用靶向治疗或免疫治疗, 例如,程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)阳性或微卫星高度不稳 定(microsatellite instability-high,MSI-H)/错配 ?表 3 子宫颈恶性肿瘤主要病理类型及分类原则(2020 WHO)[3] 病理类型及分类 鳞状上皮肿瘤(squamous epithelial tumours) 低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion) 宫颈上皮内瘤变,1级(cervical intraepithelial neoplasia, grade 1) 高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion) 宫颈上皮内瘤变,2级(cervical intraepithelial neoplasia, grade 2) 宫颈上皮内瘤变,3级(cervical intraepithelial neoplasia, grade 3) 鳞状细胞癌,HPV相关(squamous cell carcinoma, HPV-associated) 鳞状细胞癌,非HPV相关(squamous cell carcinoma, HPV-independent) 鳞状细胞癌,非特异性(squamous cell carcinoma, NOS) 腺体肿瘤及前驱病变(glandular tumours and precursors) 原位腺癌,非特异性(adenocarcinoma in situ, NOS) 原位腺癌,HPV相关(adenocarcinoma in situ, HPV-associated) 原位腺癌,非HPV相关(adenocarcinoma in situ, HPV-independent) 腺癌,非特异性(adenocarcinoma, NOS) 腺癌,HPV相关(adenocarcinoma, HPV-associated) 腺癌,非HPV相关,胃型(adenocarcinoma, HPV-independent, gastric type) 腺癌,非HPV相关,透明细胞型(adenocarcinoma, HPV-independent, clear cell type) 腺癌,非HPV相关,中肾管型(adenocarcinoma, HPV-independent, mesonephric type) 腺癌,非HPV相关,非特异性(adenocarcinoma, HPV-independent, NOS) 内膜样腺癌,非特异性(endometrioid adenocarcinoma, NOS) 癌肉瘤,非特异性(carcinosarcoma, NOS) 腺鳞癌(adenosquamous carcinoma) 黏液表皮样癌(mucoepidermoid carcinoma) 腺样基底细胞癌(adenoid basal carcinoma) 未分化癌,非特异性(carcinoma, undifferentiated, NOS) 混合性上皮-间叶肿瘤(mixed epithelial and mesenchymal tumours) 腺肉瘤(adenosarcoma) ??NOS: Non otherwise-specified 478 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?修复缺陷(deficient mismatch repair,dMMR)的 患者可选择程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂(如派姆单抗)[4-6]。 NTRK基因融合阳性的患者可以选用拉罗曲替尼 或恩曲替尼。治疗方式的选择取决于本地区现有 的设备、妇科肿瘤医师的技术水平以及患者的一 般状况、年龄、愿望、肿瘤分期和肿瘤标志物检 测结果,治疗前应进行充分的医患沟通。 3.2 子宫颈癌的手术治疗 3.2.1 手术分型 子宫颈癌手术治疗方式包括保留生育功能 手术、不保留生育功能手术、盆腔廓清术和腹主 动脉±盆腔淋巴结切除分期手术。保留生育功能 手术包括子宫颈锥切术和经腹或经阴道根治性子 宫颈切除术。不保留生育功能手术采用Querleu- Morrow(QM)分型,包括筋膜外子宫切除术 (A型)、改良根治性子宫切除术(B型)、根 治性子宫切除术(C型)和超根治性子宫切除术 (D型)[7]。C型手术又分为保留膀胱神经(C1 型)和不保留膀胱神经(C2型)。根治性子宫 切除手术方式推荐开放性手术[8-9]。放疗后盆腔 中心性复发或病灶持续存在可选择盆腔廓清术, 包括前盆腔廓清术、后盆腔廓清术和全盆腔廓清 术。关于盆腔淋巴结的处理,可选择双侧盆腔淋 巴结切除或前哨淋巴结显影。QM分型见表4, Piver分型见表5。 表 4 Querleu-Morrow (QM)分型 ?QM分型 A型 B型 C型 C1型 C2型 D型 Piver分型 I型 II型 III型 IV型 V型 术式 ?有限的根治性子宫切除术,在输尿管和子宫颈之间切断侧方子宫旁组织,腹侧和背侧子宫旁组织贴近子宫切除,约切除 5 mm,切除阴道<10 mm。适用于:1 病灶<20 mm、盆腔淋巴结阴性、无深肌层侵犯、无脉管受侵的低危的IB1期子 宫颈癌;2 个别放化疗结束后的晚期子宫颈癌,改良式根治性子宫切除术,在输尿管隧道处切断侧方子宫旁组织,不 切除 下腹下神经,在子宫直肠反折腹膜处切除背侧子宫旁组织,切除部分腹侧子宫旁组织。在子宫颈或肿瘤下方10 mm处切除 阴道,也称 B1型手术;B2型手术是B1+子宫颈旁淋巴结切除 经典的根治性子宫切除术,于髂内血管内侧切除侧方子宫旁组织;近直肠水平切断骶韧带、近膀胱水平切断膀胱子宫颈 韧带、膀胱阴道韧带,完全游离输尿管,根据阴道受侵的范围调整阴道切除的长度。适用于深肌层受侵的IB1期、 IB2~II A 期或偏早的II B期子宫颈癌 保留神经的根治性子宫切除术,分离出背侧的自主神经后切除背侧子宫旁组织;暴露下腹下神经丛,在切除侧方子宫旁 ?组织时仅切除盆丛的子宫支;膀胱阴道韧带内的盆丛的膀胱支予以保留,故只切除腹侧子宫旁组织的内侧,暴露输尿管 ?下方的下腹神经,保留膀胱支 不保留自主神经的根治性子宫切除术,在直肠侧方切断下腹下神经丛、骶内脏神经;分离出尿管后,近膀胱壁处切除腹 ?侧子宫旁组织(膀胱阴道韧带),不保留下腹神经丛里的膀胱支;切除侧方子宫旁组织时沿着髂内血管的内侧至盆壁。 ?在骶骨水平切除背侧子宫旁组织。该型仅适用于因解剖原因不能保留盆腔自主神经者 侧盆扩大切除术,D1型近盆壁切除所有的子宫旁组织,包括下腹、闭孔血管。可适用于IIB 期子宫颈癌;D2型即盆腔脏器 廓清术(LEER术),范围包括D1+临近的筋膜/肌肉组织。适用于侧方复发的肿瘤 ??子宫动脉 子宫颈筋膜外侧 与输尿管交汇处结扎 髂内动脉起始部结扎 必要时于盆壁结扎髂 ?内动脉 结扎髂内动脉 表 5 Piver 分型 手术范围 主韧带 宫骶韧带 子宫颈筋膜外侧 子宫颈筋膜外侧 从中间切断 靠近子宫切断 全部切除 近骶骨处切断 全部切除 近骶骨处切断 全部切除 近骶骨处切断 阴道 子宫颈筋膜外侧 切除上1/3 切除上1/2 切除3/4 切除3/4 淋巴结 适应证 ??不切除 IA1期 选择性切除 IA2期 肿大的淋巴结 常规行盆腔 IB1期 淋巴结清扫术 常规行盆腔 淋巴结清扫术 常规行盆腔 淋巴结清扫术 中央型复发 中央型复发累及远 ?端输尿管或膀胱 ? 《中国癌症杂志》2021年第31卷第6期 3.2.2 前哨淋巴结显影 在早期病例中应用,可以避免系统的盆腔 淋巴结切除。肿瘤直径<2.0 cm时检测率和显影 效果最好[10-11]。前哨淋巴结显影推荐用于经选 择的I期子宫颈癌患者手术。具体操作为在子 宫颈3和9点或3、6、9、12点位置注射染料或放 射性胶体99mTc(图1)。注射染料采用直观观 察有色染料,注射99mTc采用γ探测器,吲哚菁绿 (indocyanine green,ICG)采用荧光摄像。病 理科医师对前哨淋巴结(sentinel lymph nodes, SLN)进行超分期可提高微小转移的检出率。 ICG能识别出比蓝色染料更多的SLN[12]。 图 1 子宫颈染料及标记注射点示意图 3.2.3 各期子宫颈癌手术治疗 详见3.5各期子宫颈癌的治疗选择建议。 3.3 子宫颈癌放疗 各期子宫颈癌都适合放疗,包括各种病理学 类型,患有内科疾病不能耐受手术的CIN III可以 选择单纯腔内放疗。但对于年轻的早期子宫颈癌 患者,考虑到对卵巢功能的保护,主要采用手术 治疗或卵巢移位以后的盆腔放疗。 3.3.1 一般性原则 子宫颈癌放疗包括远距离体外照射(体外 照射)和近距离放疗,两者针对的靶区不同,外 照射主要针对子宫颈癌原发灶和盆腔蔓延及淋巴 转移区域,近距离放疗主要照射子宫颈癌的原 发病灶区域。应有足够的剂量以保证疗效,与 此同时也需要最大限度地保护邻近正常组织, 提高患者生存质量。需要根据患者一般状况、 肿瘤范围以及治疗单位放疗设备条件、患者意 愿来选择放疗方式。体外放疗可选择前后二野 传统照射技术,或精确放疗技术如三维适形放 疗(three-dimensional conformal radiotherapy, 3D-CRT)、适型调强放疗(intensity-modulated radiotherapy,IMRT)、容积调强放疗 479 (volumetric modulated arc therapy,VMAT)、 螺旋断层放疗(TOMO)等。腔内照射可选择二 维、三维或四维技术。外照射不能取代后装治疗 在子宫颈癌根治性放疗中的作用。 子宫颈癌的放疗剂量根据分期不同而有所 差别。A点总剂量为盆腔体外照射联合后装治疗 换算后的总的生物等效剂量,对于早期(IA 期及病灶小于1.0 cm的IB1期)子宫颈局部肿 瘤小的患者,也可以单独接受后装腔内治疗, 特别是对外照射放疗(external beam radiation therapy,EBRT)有相对禁忌证者。A点常给予 60~65 Gy的等效剂量。EBRT与腔内近距离放疗 (intracavitary radiotherapy,ICRT)联合方案也 是这类患者的一种选择。局部肿瘤大或晚期患者 A点总剂量≥85 Gy[常规2 Gy分次放射的生物等 效剂量(equivalent dose in 2 Gy/f,EQD2)]。 治疗剂量应根据治疗过程中的患者症状、盆腔检 查及影像学检查等获得的肿瘤变化及时调整,采 用个体化放疗方案。根治性放疗应尽量在8周内 完成。无化疗禁忌患者,放疗过程中需要接受铂 类药物为基础的同步化疗。 3.3.2 体外照射 体外照射主要针对子宫颈癌原发灶和盆腔蔓 延及淋巴转移区域,要求在5~6周内完成,尽量 避免放疗时间延长。强调不能以任何体外照射方 式替代后装放疗。 3.3.2.1 体外照射靶区设定 子宫颈癌放疗靶区的设定应根据妇科检查 情况和影像学检查(如CT、MRI、PET/CT)确 认,应包括子宫、子宫颈、子宫旁和上1/3阴道 (或距阴道受侵最低点下2.0 cm,IIIA期患者包 括全部阴道)以及盆腔淋巴引流区,如闭孔、髂 内、髂外、髂总、骶前;如果腹股沟区淋巴结、 腹主动脉旁淋巴结转移,该区域也应包括在照射 野内。 3.3.2.2 照射野设定 采用X线模拟定位机或CT、MRI模拟定位机 定位。 (1) 盆腔等中心照射:包括下腹及盆腔, 设前后野等中心垂直照射。上界在L4~L5间 ?? 480 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?隙,下界在闭孔下缘或肿瘤下界以下至少 2.0 cm,侧界在真骨盆最宽处向外1.5~2.0 cm, 同时,应用铅块[有条件者用多叶光栅技 术(multi-leave collimators,MLC)]遮挡 正常器官。每次盆腔中平面处方剂量为1.8~ 2.0 Gy,每周4~5次。盆腔等中心照射可分两阶 段完成,第1阶段为全盆腔等中心照射,DT量为 20~30 Gy,2~3周完成;第2阶段建议行影像学复 查,可根据情况重新定位,中间遮挡照射,全盆 腔中间遮挡4.0 cm×(8.0~12.0)cm,以降低危及 器官膀胱和直肠的受量,给后装治疗提供剂量空 间,DT量为20~25 Gy(EQD2),2~3周完成。 (2) 四野箱式照射:即盆腔前后两野照射加 两个侧野照射,主要适用于特别肥胖的患者拟 增加子宫旁或淋巴引流区的剂量。上界在L4~L5 间隙,下界在闭孔下缘或肿瘤下界以下至少 2.0 cm,侧界在真骨盆最宽处向外1.5~2.0 cm。两 侧野前缘达耻骨联合(包括髂外淋巴引流区), 后缘在S2~S3骶椎交界水平(包括骶前淋巴引流 区),如子宫颈原发灶大,宫骶韧带受累,后缘 可达S3~S4骶椎水平,应用铅块或MLC技术遮挡 正常器官。每天四野同时照射,一般给予B点DT 量为45~50 Gy(EQD2),4~5周完成。 (3) 腹主动脉旁野(延伸野)照射:髂总或主 动脉旁淋巴结转移时需行延伸野照射,照射野的 宽度一般为6.0~8.0 cm,长度依据淋巴结转移的 范围予以个体化设计。建议DT量为40~45 Gy, 4~5周,每天1次,1.8~2.0 Gy,照射时要注意保 护肾脏和脊髓。对腹主动脉旁淋巴引流区的照 射,建议采用适形或调强精确放疗技术。 3.3.2.3 射线选择 根据采用的放疗技术、照射野数以及医疗 机构的设备、防护条件而选择射线。射线能量越 高,其穿透能力越强,需要的防护条件越高,前 后二野照射可选择 10~15 MV X射线,多野照射 可选择6~10 MV X射线。 3.3.2.4 精确放疗 精确放疗技术实施均基于靶区的精确定位, 包括靶区准确定义、针对治疗中靶区变化和器官 移动的应对、摆位及质量控制,其中合理的靶区 勾画是治疗成败的关键,也直接影响放疗并发症 的发生与否[13-15]。建议行MRI或PET/CT检查以 保证照射靶区覆盖受侵子宫旁及转移淋巴结组 织,同时最大限度地保护直肠、小肠、膀胱等危 及器官。子宫颈癌的靶区包括大体肿瘤区(gross tumor volume,GTV)、临床靶区(clinical target volume,CTV)和计划靶区(planning target volume,PTV)。 (1) GTV:指临床可见的肿瘤灶靶区,一般诊 断手段,如妇科检查、CT、MRI、PET/CT,能 够确定具有一定形状和大小的病变范围,包括原 发病灶、转移淋巴结和其他转移病灶。理论上, 子宫颈癌行广泛性子宫切除术+淋巴结切除术后 没有GTV。未行手术切除者,GTV应包括子宫颈 和受累的阴道、子宫体、子宫旁、转移淋巴结及 其他转移病灶。 (2) CTV:包括肿瘤临床靶区和亚临床靶区。 CTV主要包括盆腔原发肿瘤区和淋巴引流区,亚 临床灶靶区为肿瘤可能侵犯的范围。 盆腔原发肿瘤区对于未行子宫切除者包括 肿瘤、全子宫(子宫颈+子宫体)、部分阴道、 子宫旁或阴道旁软组织;对于已行子宫切除 者包括残存肿瘤、阴道残端、上段阴道(3.0~ 4.0 cm)、阴道旁或瘤床软组织。淋巴引流 区[16]包括闭孔、髂内、髂外、髂总±腹主动脉 旁淋巴结引流区。对于影像学诊断子宫颈间质 受侵的患者,应包括骶前淋巴引流区;如果髂总 淋巴结、腹主动脉旁淋巴结有转移则需行腹主动 脉旁淋巴引流区照射,其靶区上界要求达肾血管 水平;如果转移淋巴结超过肾血管水平,则根据 受侵淋巴结范围决定上界;肿瘤侵及阴道下1/3 时,靶区需包括全阴道及双腹股沟淋巴引流区。 需要特别指出的是,应建立考虑膀胱体积变化 的内靶区(internal target volume,ITV),若在 制订计划时发现直肠过度扩张,应考虑再次行 CT、MRI模拟定位。 (3) PTV:确定PTV的目的是确保临床靶区得 到规定的治疗剂量。PTV应包括CTV、照射中患 者器官运动和由于日常摆位、治疗中靶位置和靶 体积变化等因素引起的扩大照射范围。子宫颈癌 《中国癌症杂志》2021年第31卷第6期 体外照射由CTV外放一定距离形成PTV,目前没 有统一标准。 (4) 处方剂量:外照射处方剂量约45~ 50 Gy,对于转移淋巴结可采用同步加量照射 或后程加量,根据转移淋巴结大小,增加剂量 10~15 Gy,总剂量可达55~65 Gy。加量照射时需 要注意保护临近正常组织。 3.3.3 近距离放射治疗 近距离放射治疗主要照射子宫颈癌的原发区 域,在子宫颈癌治疗中占有重要地位。根据情况 选择传统二维后装或图像引导的三维后装治疗。 3.3.3.1 剂量率 根据后装治疗时放射源对A点剂量的贡献速 率分为低剂量率(low dose rate,LDR)、中剂量 率(middle dose rate,MDR)和高剂量率(high dose rate,HDR)。目前,国内多使用HDR后装 治疗机。A点剂量以传统剂量分割及LDR近距离 治疗为依据。对于近距离放疗,设定为一个4~ 7 Gy/h的LDR。应用HDR近距离放疗应当依据线 性二次方程定义HDR的A点剂量,即转化成生物 等效LDR的A点剂量。如30 Gy的HDR的A点剂 量被分割为5次照射,等同于采用LDR的A点的 40 Gy剂量(剂量率换算参考第4版《肿瘤放射治 疗学》)。 3.3.3.2 腔内放疗剂量 应与体外照射剂量统筹考虑,一般给予A 点剂量20~42 Gy,体外联合腔内放疗总剂量 (EQD2)大于75 Gy,每次5~7 Gy,每周1次, 腔内后装治疗当天不进行体外照射。体外照射 联合腔内治疗A点的EQD2因期别而异,IA2 期应达到75~80 Gy(EQD2),IB1、IB2和 IIA1期达到80~85 Gy,IB3、IIA2和IIB~IVA 期≥85 Gy(EQD2),采用不同剂量率后装 机治疗时,应进行生物剂量转换(腔内剂量以 体外常规分割等效生物剂量换算),同时注意 对膀胱及直肠剂量的监测,避免膀胱及直肠 的过高受量。正常组织的限定剂量为:直肠 2 cc≤65~75 Gy;乙状结肠2 cc≤70~75 Gy;膀胱 2 cc≤80~90 Gy。 3.3.3.3 后装治疗时机 通常在外照射开始后,子宫颈口便于暴露时 481 进行,在子宫颈条件允许原则下应尽早进行,最 好与体外照射同步进行,以缩短总放疗时间。最 常用的传统二维后装治疗采用剂量参数系统包括 A、B点及膀胱和直肠点的剂量。 3.3.3.4 三维后装治疗 子宫颈癌近距离治疗中采用图像引导的三维 治疗计划有明显优势,可以提高局控率、肿瘤特 异性生存率和总生存率。采用CT或MRI进行定 位,扫描范围从髂前上嵴(或子宫底上3.0 cm) 至坐骨结节下缘,层厚3 mm。对于无法行MRI定 位的单位,可进行CT扫描定位,但需要参照定 位前MRI扫描图像。 靶区、危及器官(organ at risk,OAR) 勾画,参考ICRU89号文件:以MRI-T2加权像 上的高信号及灰色信号加上妇科查体病灶确 定为GTV。CTV分3类:肿瘤高危临床靶区 (CTV-THR),包括整个子宫颈和后装治疗时 残留的可见肿瘤及查体和MRI确定的残留病 变组织。肿瘤中危临床靶区(CTV-TIR),包 括GTV-Tinit的范围映射在近距离治疗时影像上 的区域,及CTV-THR基础上外扩的总和。肿 瘤低危临床靶区(CTV-TLR)代表来自原发肿 瘤潜在的连续或非连续的具有临床下病灶扩 散的危险区域。建议以D90、D100评估CTV-THR 和CTV-TIR的剂量,以V150、V200评估高剂量 体积;以D1cc、D2cc评估OAR的耐受剂量。 A点剂量仍需报告,作为评价靶区剂量的参 考。以CTV-THR确定处方剂量,剂量至少达到 80 Gy,对于肿瘤体积大或退缩不佳病灶,应 该≥87 Gy。OAR限定剂量为:直肠2 cc≤65~ 75 Gy;乙状结肠2 cc≤70~75 Gy;膀胱 2 cc≤80~90 Gy。当腔内近距离治疗无法满足上 述剂量要求时,可考虑联合组织间插植放疗。 3.3.3.5 特殊情况后装治疗 对于子宫切除术后患者(尤其是阴道切缘 阳性或肿瘤近切缘者),可采用阴道施源器后装 治疗作为体外放疗的补充。以阴道黏膜表面或阴 道黏膜下5 mm处为参照点,高剂量率192Ir剂量为 20~24 Gy(EQD2)。对于子宫颈外生型大肿瘤, 特别是出血较多者,体外放疗前可先给予后装治 疗消瘤止血,肿瘤表面出血多采用阴道施源器, ? 482 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?以阴道黏膜表面为参考点,一般给予10~12 Gy。 3.3.4 OAR的耐受剂量 子宫颈癌放疗邻近器官的耐受剂量:子宫颈 癌放疗的OAR包括膀胱、直肠、结肠、骨髓、皮 肤、小肠、输尿管等,一般用TD5/5表示最小放射 耐受量,表示在治疗后5年内,预计严重并发症 发生率不超过5%。 3.3.5 根治性放射治疗时间控制 子宫颈癌放射治疗包含体外照射和腔内照 射,总时间应控制在7~8周内。 3.3.6 各期子宫颈癌的放疗 3.3.6.1 IA1期子宫颈癌的放疗 IA1期子宫颈癌的放疗以后装腔内治疗为 主,如果子宫颈锥切标本无淋巴脉管间隙浸润 (lymphovascular space invasion,LVSI),可单独 行后装治疗,子宫颈锥切标本有LVSI,后装治疗 ±盆腔外照射,参考点A点的EQD2为60~65 Gy。 3.3.6.2 IA2、IB1、IB2、IIA1期子宫颈癌 的放疗 采用盆腔外照射+后装治疗,盆腔外照射 45~50 Gy,后装治疗+外照射给予A点的EQD2为 75~85 Gy(EQD2)。 3.3.6.3 IB3、IIA2、IIB~IVA期子宫颈癌的放疗 放疗前必须进行盆腔淋巴结状况的评估, 建议用影像学评估或手术评估确定放射野,盆腔 45~50 Gy的体外放射剂量,局部病灶可以在图像 引导下加量10~15 Gy。如腹主动脉旁淋巴引流区 需加量,应在影像引导下予以45~50 Gy照射, 局部病灶可缩野加量10~15 Gy。对于子宫颈局 部病灶,后装治疗+外照射给予A点总剂量85 Gy 以上。放疗中应该有2~3次临床和影像学疗效评 估,必要时重新定位,以确定个体化治疗剂量。 3.3.6.4 IVB期子宫颈癌的放疗 IVB期子宫颈癌的放疗为姑息性治疗,剂量 基本同IVA期子宫颈癌治疗剂量,但由于有直肠 或膀胱侵犯,应尽量采用个体化放疗。 3.3.6.5 其他部位寡转移病灶 对于腹股沟、颈部淋巴结、肺、肝等寡转移 病灶,可以考虑根治性放疗。 采用SBRT给予1~5分次的较高剂量照射;照 射野内复发病灶的再程放疗可以考虑采用SBRT 技术[17]。 3.3.7 术后放疗 子宫颈癌术后放疗包括子宫颈癌根治术后放 疗及单纯性全子宫切除术后意外发现的子宫颈癌 的放疗。由于术后粘连,肠管的活动度变差,容 易导致肠道局部受量过大,推荐调强放疗等立体 照射技术,盆腔剂量45~50 Gy[15],建议在术后 8周内完成。放射野可根据术后病理学检查结果 来确定。有髂总或腹主动脉旁淋巴结转移者,腹 主动脉旁淋巴引流区也应给予(50±5)Gy的照 射剂量,阴道切缘阳性或近切缘者,应增加后装 近距离治疗,推荐柱状施源器阴道黏膜下0.5 cm 5.5 Gy×2次,或阴道黏膜面6.0 Gy×3次。详见 3.6.1 子宫颈癌根治术后辅助放疗。 3.4 子宫颈癌的化疗 子宫颈癌化疗以顺铂为基础的联合化疗或单 用顺铂化疗为主。目前主要适用于同步放化疗、 新辅助化疗和姑息化疗。同期放化疗一般采用顺 铂单药,不能耐受顺铂者可采用卡铂或可选择 的含铂联合化疗。新辅助化疗主要用于IB3或 IIA2期,即肿瘤直径≥4.0 cm的局部晚期子宫颈 癌术前化疗,一般2~3个疗程。新辅助化疗可以 提高局部控制率和手术切净率,但不能改善子宫 颈癌的预后,且术后病理学高危因素易被掩盖, 原则上不推荐使用。晚期及复发性子宫颈癌初 始化疗首选含铂类药物联合化疗+贝伐珠单抗的 联合方案,如顺铂/卡铂+紫杉醇/紫杉醇脂质体+ 贝伐珠单抗,也可选择顺铂+紫杉醇/紫杉醇脂质 体、拓扑替康+紫杉醇/紫杉醇脂质体等联合化疗 方案。接受化疗或化疗后出现疾病进展时,对于 PD-L1阳性或MSI-H/dMMR患者首选派姆单抗。 派姆单抗也可用于无法切除或转移性的高肿瘤突 变负荷(tumor mutation burden-high,TMB-H) 肿瘤,而拉罗曲替尼、恩曲替尼用于NTRK基因 阳性肿瘤(表6)。 3.5 各期子宫颈癌的治疗选择建议 3.5.1 IA1期子宫颈癌治疗 ?应根据患者是否有生育要求选择治疗方法。 有生育要求者:可采用子宫颈锥切术,子 宫颈锥切标本无脉管浸润,切缘至少达3 mm阴 性距离为适应证,如果切缘阴性(边缘没有浸润 《中国癌症杂志》2021年第31卷第6期 483 ?同步放疗 表 6 鳞状细胞癌、腺癌或腺鳞癌化疗方案 复发或转移性疾病 一线单药化疗 首选方案 顺铂 其他推荐方案 卡铂/紫杉醇 (紫杉醇脂质体) 卡铂/ (紫杉醇脂质体) ?一线联合化疗 二线化疗 首选方案 派姆单抗 (PD-L1阳性或MSI-H/dMMR) 其他推荐方案 贝伐珠单抗 白蛋白结合型紫杉醇 紫杉醇脂质体 多西他赛 5-氟尿嘧啶 吉西他滨 异环磷酰胺 伊立替康 丝裂毒素 培美曲塞 拓扑替康 长春瑞滨 ?首选方案 首选方案 顺铂 顺铂/紫杉醇/贝伐珠单抗 卡铂/紫杉醇(紫杉醇脂质体)?/贝伐珠单抗 卡铂 其他推荐方案 (患者不能耐受顺铂) 顺铂/紫杉醇(紫杉醇脂质体) 顺铂/紫杉醇 卡铂/紫杉醇(紫杉醇脂质体) (个体化选择) (对于之前接受过顺铂治疗的 患者) 拓扑替康/紫杉醇/贝伐珠单抗 性癌或高度鳞状上皮内病变)可选择观察,如果 切缘阳性,则推荐再次锥切或行子宫颈切除术。 有脉管浸润时,首选子宫颈根治性切除术+盆腔 淋巴结切除术(或SLN显影),手术先行盆腔淋 巴结切除,送快速冷冻切片病理学检查或快速石 蜡切片病理学检查。有转移者,应改行改良根治 性子宫切除术(B型);无转移者,行根治性子 宫颈切除术。次选子宫颈锥切+盆腔淋巴结切除 (或SLN显影),锥切切缘至少有3 mm的阴性距 离,如果切缘阳性,推荐再次锥切或行子宫颈切 除术。对于NECC、胃型腺癌或恶性腺瘤患者, 不支持其保留生育能力。 无生育要求者:IA1期无LVSI,行子宫颈锥 切术,确认锥切切缘阴性。不能手术者可选择观 察,可行手术者选择筋膜外子宫切除术(A型)。 如切缘阳性可考虑重复锥切活检以更好地评估浸润 深度以排除IA2/IB1期病变;或选择筋膜外或改 良根治性性子宫切除术(B型)+盆腔淋巴结切除术 (切缘为癌时淋巴结清扫为2B类证据)(或SLN显 影)。如果患者伴有淋巴血管受侵,行改良根治性 子宫切除术(B型)+盆腔淋巴结切除术(或SLN显 影)。对于不能手术的患者或拒绝手术的患者可选 择近距离治疗±外照射。根据正常组织的耐受性、 放疗分割方法和靶区大小调整方案。A点剂量一般 为60~70 Gy(EQD2)。 3.5.2 IA2期子宫颈癌治疗 IA2期子宫颈癌治疗仍可根据是否有生育要 求选择。 有生育要求者:行根治性子宫颈切除术+盆 腔淋巴结切除术,术中先行盆腔淋巴结切除, 送冷冻切片或快速石蜡切片检查,有淋巴结转移 者,改行根治性子宫切除术(C型)±腹主动脉 旁淋巴结取样(髂总淋巴结阳性或疑有腹主动脉 旁淋巴结转移者);淋巴结无转移者,行根治性 子宫颈切除术(子宫颈病变距切缘大于8 mm)。 无生育要求者:行改良根治性子宫切除术 (B型)+盆腔淋巴结切除术,年龄小于45岁者可 切除输卵管、保留双侧卵巢。 有手术禁忌、无生育要求者可选择根治性放 疗。近距离放疗±盆腔外照射,A点的EQD2一 般为70~80 Gy(EQD2)。 3.5.3 IB1、IB2及IIA1期子宫颈癌治疗 有生育要求者:IB1期可行根治性子宫颈 切除术(C型)。IB2期肿瘤直径为2.0~4.0 cm 者,推荐行经腹根治性子宫颈切除术(C型)。 术中先行盆腔淋巴结切除,送术中快速冷冻切片 病理学检查,如无转移,根治性子宫颈切除术 (C型)+盆腔淋巴结切除术±腹主动脉旁淋巴 结切除(可考虑行SLN显影:阳性和可疑均送术 中快速冷冻切片病理学检查);如有转移,应考 虑放弃手术改行根治性放疗或行根治性子宫切除 术(C型)+盆腔淋巴结切除术±腹主动脉旁淋 巴结切除。NECC和胃型腺癌被认为不适用此种 手术。 ? 484 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?无生育要求者可选择:1 根治性子宫切除 术(C型)+盆腔淋巴结切除(1类证据)±主动 脉旁淋巴结切除(2B类证据),可考虑行SLN 显影。绝经前如双侧卵巢正常,45岁前,可保留 双侧卵巢。根治性子宫切除术的标准术式是开腹 (1类证据)。2 有手术禁忌证或拒绝手术者, 可行盆腔外照射+阴道近距离放疗±含铂药物的 同期化疗。 3.5.4 IB3和IIA2期 (1) 盆腔外照射+含顺铂方案的同步化疗+近距 离治疗(传统方法为75~80 Gy至总A点)[A点 的EQD2≥85 Gy(EQD2),B点为40~50 Gy] (EQD2,首选)。对于阴道侵犯明显的患者, 必要时可加用阴道塞进行后装腔内放疗,黏膜 下0.5 cm处给予20~30 Gy(EQD2)。同时治疗 根据正常组织耐受性、分割和靶体积大小进行 调整[18-22]。 (2) 根治性子宫切除术(C型)+盆腔淋巴结 切除±主动脉旁淋巴结取样(肿瘤较大、怀疑或 已知有盆腔淋巴结疾病的患者)。首先进行盆腔 淋巴结切除术,如果淋巴结阴性,进行根治性子 宫切除术。如果淋巴结阳性,选择放化疗。不推 荐术前以铂类药物为基础的新辅助化疗,根治性 术后应根据病理学高危/中危因素选择放疗或同 步放化疗。 根治性子宫切除术后如有病理学高危因素 (淋巴结转移,子宫旁或手术切缘受累),首选 同步放化疗,时间在手术后6周内完成。目前有 研究结果显示,同步放化疗前化疗(紫杉醇+顺 铂),放疗后2个周期化疗与同步放化疗效果相 当[23-24],可用于放疗资源紧张的地区。 (3) 盆腔外照射+含顺铂方案的同步化疗+近 距离治疗+选择性子宫切除术(根治性放疗后子 宫颈病灶残存)。 初次放化疗后是否推荐辅助子宫切除术存在争 议,目前为3类证据推荐[25-26]。放疗后辅助子宫切除 术能改善盆腔控制,但不能改善总生存率[27-29]。对 于因疾病范围或子宫解剖学关系不能充分覆盖近距 离放疗的患者,可以考虑采用此方法。 3.5.5 IIB~IVA期子宫颈癌治疗 采用铂类药物为基础的同步放化疗,可选 择周化疗或3周化疗。常规放疗剂量:肿瘤直径 ≥4.0 cm,A点应达到85 Gy(EQD2)及以上, IIIB期患者B点应达到45~50 Gy(EQD2)。对于 盆壁受侵明显的患者,必要时可高适形缩野局部 盆腔加量10~15 Gy。对于阴道侵犯明显的患者, 建议采用三维后装放疗。放疗范围包括已知及可 疑肿瘤侵犯的部位。放疗中应该有2~3次临床和 影像学检查疗效评估,必要时重新定位,以确定 个体化治疗剂量。治疗结束后评估,进入随访; 若局部病灶持续存在或局部复发,考虑全身治疗 (化疗、靶向治疗、免疫治疗)、姑息性支持治 疗、子宫切除术或盆腔廓清术。推荐手术在放疗 后3个月左右评估,充分知情后决定。 免疫治疗可用于晚期或复发的子宫颈癌。免 疫治疗患者检出相关的分子标志物才能取得较高 的缓解率(包括PD-L1+、MSI-H、TMB-H等)。 其他药物靶向治疗和生物制剂仍然需要更多的临 床研究数据支持,鼓励参加相关的临床试验。 3.5.6 IVB期子宫颈癌 (1) 寡转移病灶,若适合局部治疗,可考虑局 部切除±个体化放疗,或局部消融治疗±个体化 放疗,或个体化放疗±全身系统性治疗,也可考 虑综合治疗。在进行盆腔局部放疗的同时,应加 强以铂类药物为基础的联合化疗,并针对转移灶 进行个体化治疗,加强对症治疗、营养治疗、止 痛治疗,以控制病情进展,改善生存质量。 (2) 全身广泛转移者,应进行全身系统性治疗 及最佳支持治疗,参加临床试验。 靶向治疗药物在IVB期患者中得到广泛应用, 以贝伐珠单抗为代表。贝伐珠单抗可应用于复发 晚期的子宫颈癌[30],通常与铂类药物/紫杉醇或 铂类药物/拓扑替康等联合使用,应用前仔细评估 患者胃肠道/泌尿生殖系统毒性的风险[31-33]。 3.6 子宫颈癌根治术后辅助治疗 3.6.1 子宫颈癌根治术后辅助放疗 (1) 术后病理学检查结果显示存在高危因素: 子宫颈癌根治术后存在淋巴结阳性、切缘阳性或 子宫旁阳性任一个高危因素均需补充放疗。术后 补充盆腔放疗+铂类同步化疗(1类证据)±阴道 近距离放疗,无髂总或腹主动脉旁淋巴结转移, 仅行盆腔照射;髂总、腹主动脉旁淋巴结转移, 《中国癌症杂志》2021年第31卷第6期 照射需包括腹主动脉旁淋巴引流区,如果盆腔淋 巴结多枚阳性,腹主动脉旁淋巴结清扫阴性,可 不延伸放射野,如未做腹主动脉旁淋巴结清扫, 可选择延伸放射野;如有腹主动脉旁淋巴结转移 者,还需进一步明确有无其他部位的远处转移。 (2) 术后病理学检查结果显示存在中危因素: 病理学类型和肿瘤浸润范围是重要因素,鳞状细 胞癌,需按Sedlis标准[34]来决定是否进行辅助 治疗,IB~IIA期子宫颈癌患者行根治性子宫切 除术后补充放疗或放化疗者,腺癌预后更差。因 此,腺癌或腺鳞癌患者术后是否补充治疗应参照 “四因素模式”[35-36],如肿瘤≥3.0 cm、浸润 子宫颈外1/3、间质脉管间隙见癌栓、腺癌/腺鳞 癌,术后病理学因素中,有以上4个中危因素中 的2个以上,应当辅助治疗。任何病理学类型, 病灶近切缘应当考虑辅助放疗[37]。 (3) 术后放化疗应遵循的原则: 1 术后存在高危因素者,补充治疗可选择同 步放化疗。 2 子宫颈癌术后放疗野设计应覆盖瘤床和 引流淋巴结区域在内的盆腹腔,通常剂量为45~ 50 Gy。 3 适型调强放疗(intensity-modulated radiotherapy,IMRT)是一种先进和精细的放射 治疗技术,有条件应用者可减少放疗的毒性及不 良反应。 4 对于切缘阳性或肿瘤靠近切缘者、肿瘤直 径大于4.0 cm或深间质浸润、子宫旁或阴道受累 者可采用阴道残端近距离放疗。 5 对于广泛的LVSI,需加铂类药物为主的 化疗加阴道残端近距离放疗。 3.6.2 意外发现子宫颈癌的术后治疗 因良性疾病进行单纯子宫切除术后病理学检 查意外发现子宫颈癌(仅包括鳞癌、腺癌、腺鳞 癌和NECC),由于手术范围不足,绝大多数患 者术后需接受进一步的治疗。 对这一类患者首先需明确病理学诊断,对 于病理学诊断不清者,尤其是无法判断IA1或 IA2期、是否有LVSI、切缘情况不明等,需明 确病理学诊断后制定治疗措施。其次,需进行全 面检查评估,包括手术范围、查体、血生化检 485 查和影像学检查。影像学检查包括盆腹腔CT、 肺CT及盆腔MRI,有条件者可行PET/CT检查, MRI对软组织有较高的识别度,可判断盆腔有无 病灶残留,CT和PET/CT有助于发现淋巴结问题 和是否有远处转移。根据病理学、影像学检查结 果,结合当地技术条件及患者具体情况选择以下 治疗方案: (1) 术后病理学诊断结果为IA1期,无 LVSI,术后可密切随访。 (2) 术后病理学诊断结果为IA1期且 LVSI(+)、IA2、IB1期及以上者,根据不同的 情况,可选择不同的后续处理方式,手术切缘的 情况与后续治疗方案的选择密切相关。 (3) 切缘和影像学检查均呈阴性,选择:1 盆腔放疗+阴道残端近距离放疗±含铂药物的同 步化疗;2 若子宫标本的病理学检查无Sedlis标 准中术后补充放疗的指征,可行根治性子宫旁切 除术+阴道上段切除+盆腔淋巴结切除±腹主动 脉旁淋巴结切除。再次术后病理学检查阴性,建 议随访;再次术后病理学检查结果提示淋巴结阳 性、手术切缘阳性或子宫旁阳性,则需辅助盆腔 放疗±阴道残段近距离放疗+同期化疗。 (4) 若病理学检查结果显示切缘阳性,或影像 学检查提示有明显肿瘤残留或盆腔淋巴结肿大,或 者子宫标本病理学检查有Sedlis标准中术后放疗的 指征,应行盆腔放疗+同步含铂化疗+阴道残端近距 离放疗。 (5) 意外发现子宫颈癌的患者在术后选择二次 手术治疗,需考虑手术后病理学检查结果、患者 对再次手术的耐受能力和当地医疗水平,作出综 合判断。虽然手术+术后放疗对意外发现的子宫 颈癌是可行的,但预后比直接广泛子宫切除差, 由于瘢痕、粘连形成和解剖学改变,手术难度增 加。第二次手术的优势在于适于部分早期年轻患 者,有望通过再次手术治愈,手术后无需辅助放 疗,可保留卵巢功能和阴道功能,避免放疗的不 良反应,有助于提高患者的生活质量。对评估术 后放疗概率大的病例,不推荐手术和放疗方式的 叠加,建议选择盆腔放疗+同期化疗。 3.7 复发性子宫颈癌的治疗 对复发性子宫颈癌进行治疗之前,尽量行复 ? 486 发病灶活检以明确复发或PET/CT证实复发。 3.7.1 局部复发的治疗 局限于子宫颈或阴道的子宫颈癌局部复发, 可针对复发部位进行以临床治愈为目标的治疗。 3.7.1.1 既往无放疗史或复发灶位于既往放疗野外 (1) 可手术切除病灶,手术后再行个体化的外 照射治疗±含铂药物化疗方案±近距离放疗。 (2) 不能耐受手术者或不接受手术者,外照射 放疗±同步化疗和(或)近距离放疗。 (3) 对于初始治疗后短期复发的患者,以全 身系统性治疗为主,按照复发性子宫颈癌系统 治疗选用化疗,鼓励参加临床试验和做相关基因 检测。 (4) 治疗后再复发者,选择化疗、靶向治疗、 支持治疗、免疫治疗,鼓励患者参加临床试验和 做相关基因检测。 3.7.1.2 既往有放疗史或复发病灶位于既往放疗 野内 (1) 中心性复发可选择手术治疗,手术应以临 床治愈为目的。最可能从手术中获益的患者:盆 腔中央复发,无侧盆壁固定或相关肾积水;无病 间期较长;复发肿瘤直径小于3.0 cm。 1 盆腔廓清术(前盆腔、后盆腔、全盆腔) ±术中放疗(无术中放疗条件者可考虑放射性 粒子植入放疗(3类证据),应同时进行盆底重 建,术后制订有关社会心理学及性心理学的康复 计划。 2 复发病灶直径<2.0 cm并经仔细评估的病 例,可行子宫切除术或近距离放疗。 (2) 不适合手术切除的患者,可予全身系统性 治疗、免疫治疗或插植放疗等。 (3) 非中心性复发治疗:1 针对肿瘤局部放 射治疗±化疗;2 切除肿瘤±术中放射性粒子植 入放疗(3类证据);3 以铂类药物为基础的联 合化疗,联合贝伐珠单抗;4 PD-1/PD-L1单抗 (单用或联合化疗);5 支持治疗;6 鼓励患 者参加临床试验。 (4) 治疗后再复发者可采用全身系统性治疗、 支持治疗、免疫治疗和参加临床试验。 3.7.2 远处转移复发的治疗 (1) 复发灶为多病灶或无法切除者,选择化 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) 疗、免疫治疗(PD-1/PD-L1单抗,单用或联合化 疗)、放射治疗。 (2) 病灶可切除者选择: 1 病灶切除±放疗。 2 化疗:一线化疗推荐以铂类药物为基础的 联合治疗,首选顺铂+紫杉醇加用血管生成抑制 剂贝伐珠单抗;一线治疗后疾病进展及不适合联 合化疗的患者,采用单药治疗,如卡铂、白蛋白 结合型紫杉醇、培布珠单抗。 3 PD-1/PD-L1单抗治疗。 4 参加临床试验。 3.8 妊娠期子宫颈癌的处理 3.8.1 诊断方法同非妊娠期子宫颈癌 3.8.2 评估 (1) 肿瘤评估:组织病理学类型、FIGO分 期、影像学检查(超声或MRI)诊断有无淋巴结 转移和肿瘤标志物(SCCA)。 (2) 胎次、妊娠阶段、胎儿的发育情况。 (3) 总体治疗原则:治疗方案应与产科医师、 患者及亲属充分沟通,综合考虑子宫颈癌的恶性 程度、孕周及胎儿发育情况,严密监测患者病情 发展及产科情况。应充分了解患者及其家属对妊 娠的期望等,在决定治疗方案前,患者及其家属 享有充分的知情权,结合肿瘤评估结果,选择是 否保留胎儿和恰当的治疗方式,获得患者及其家 属的知情同意。对各妊娠时期的子宫颈癌尚没有 成熟的方案,国际妇科肿瘤协会(International Gynecologic Cancer Society,IGCS)和欧洲妇 科肿瘤协会(European Society of Gynaecological Oncology,ESGO)2014年专家共识认为,在不 保留胎儿和生育功能时,处理同非妊娠期子宫 颈癌。 ???按照不同分期和孕期的治疗建议: 1 妊娠早期(孕20周以内),除子宫颈癌 IA1期外,不建议患者继续妊娠。 2 IA1期患者应严密监测,每8周行1次阴 道镜检查,必要时子宫颈活检,直至妊娠结束开 始治疗。无LVSI可行子宫颈锥切并行子宫颈环扎 术(低级别证据)。 3 妊娠中期(孕20~孕28周)要求继续妊 娠、IIB期以内者,可继续妊娠。IIB期以上 ? 《中国癌症杂志》2021年第31卷第6期 者,不建议继续妊娠。IB2期及IB3期继续妊 娠患者考虑行新辅助化疗,新辅助化疗可以维持 至孕34~35周。对于妊娠中期的处理目前争议较 大,应充分评估风险和尊重患者选择权。 4 妊娠晚期(孕28周以上)诊断子宫颈癌, 无论患者期别,患者要求继续妊娠者在孕34周、 胎儿肺成熟后采用剖宫产结束妊娠为宜,再根据 分期制订相应的治疗方案:IA、IB1期患者可 在剖宫产同时行根治性子宫切除术+淋巴结切除 术,避免放疗引起的纤维化,并保留卵巢功能; 根治性手术后如果需要行放疗的患者,可在切口 愈合后进行;IIB期以上的子宫颈癌患者,结束 妊娠后按分期选择同期放化疗。 3.9 NECC的治疗 该类肿瘤侵袭性强、易发生早期转移、预后 较差,对化疗相对敏感,这些对患者的诊治具有 重要意义。相对于子宫颈鳞癌、腺癌、腺鳞癌患 者,NECC有如下几个特点: 1 有别于其他常见类型子宫颈癌,NECC的 病理学诊断主要基于形态学改变,而无论免疫组 织化学结果如何。 2 初治评估及治疗过程使用:胸部/腹部/盆 腔的CT+脑部MRI,或颈部/胸部/腹部/盆腔/腹股 沟PET/CT+脑部MRI,以排除脑转移。 3 不推荐NECC患者保留生育功能。 4 IB3/IIA2期不推荐直接手术治疗。 5 NECC对化疗相对敏感,局部晚期患者可 行新辅助化疗。 6 无论首选手术还是首选放疗,治疗后所有 患者均推荐补充全身系统性治疗,化疗和同步放 化疗推荐首选使用顺铂+依托泊苷,若患者不能 耐受顺铂,可采用卡铂+依托泊苷。 7 放宽手术后补充放疗的指征。 8 对于新辅助治疗、术后辅助治疗,以及 出现疾病复发或转移的病例,一线推荐首选顺 铂+依托泊苷或卡铂+依托泊苷,二线推荐方案 与鳞状细胞癌/腺癌/腺鳞癌的一、二线推荐治疗 一致。 4 随访 4.1 随访间隔 治疗结束2年,每3~6个月随访1次,治疗结 487 束3~5年,每6~12个月随访1次。根据患者疾病复 发风险进行年度复查。 4.2 随访内容 随访内容包括:全身体格检查、妇科检查、 鳞癌抗原、细胞角蛋白等肿瘤标志物检测和子宫 颈或阴道残端细胞学、人乳头瘤病毒检查。必要 时行阴道镜检查及活体组织病理学检查、胸片、 胸部CT、盆腔MRI、超声、全身浅表淋巴结超声 检查。根据症状、体征怀疑复发时可进行相关实 验室、影像学检查,如血常规、血尿素氮、肌酐 等。根据检查结果,必要时行阴道镜检查及活体 组织病理学检查、胸片、胸部CT、盆腔MRI、超 声、全身浅表淋巴结超声检查。 [参 考 文 献] [1] OLAWAIYE A B, BAKER T P, WASHINGTON M K, et al. The new (version 9) American Joint Committee on Cancer tumor, node, metastasis staging for cervical cancer[J]. CA Cancer J Clin, 2021. Epub ahead of print. [2] DELARA R, YANG J, BUCKNER-PETTY S, et al. Surgical or imaging lymph node assessment in locally advanced cervical cancer: a systematic review and meta-analysis[J]. J Gynecol Oncol, 2020, 31(6): e79. [3] WHO Classification of tumours Editorial Board. Female Genital Tumours. WHO Classification of Tumours, 5th edition, vol. 4 [M]. Lyon: IARC Press, 2020: 8. [4] MINION L E, TEWARI K S. Cervical cancer-state of the science: from angiogenesis blockade to checkpoint inhibition [J]. Gynecol Oncol, 2018, 148(3): 609-621. [5] CHUNG H C, SCHELLENS J H M, DELORD J P, et al. Pembrolizumab treatment of advanced cervical cancer: updated results from the phase 2 KEYNOTE-158 study[J]. J Clin Oncol, 2018, 36(15_suppl): 5522. [6] MARABELLE A, LE D T, ASCIERTO P A, et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 study[J]. J Clin Oncol, 2020, 38(1): 1-10. [7] CIBULA D, ABU-RUSTUM N R, BENEDETTI-PANICI P, et al. New classification system of radical hysterectomy: emphasis on a three-dimensional anatomic template for parametrial resection[J]. Gynecol Oncol, 2011, 122(2): 264-268. [8] RAMIREZ P T, FRUMOVITZ M, PAREJA R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer[J]. N Engl J Med, 2018, 379(20): 1895-1904. [9] UPPAL S, GEHRIG P A, PENG K, et al. Recurrence rates in patients with cervical cancer treated with abdominal versus minimally invasive radical hysterectomy: a multi-institutional ? 488 中国抗癌协会妇科肿瘤专业委员会 子宫颈癌诊断与治疗指南(2021年版) ?retrospective review study[J]. J Clin Oncol, 2020, 38(10): 1030-1040. [10] WUYB,LIZM,WUHY,etal.Sentinellymphnodebiopsyin cervical cancer: a meta-analysis[J]. Mol Clin Oncol, 2013, 1(6): 1025-1030. [11] KADKHODAYAN S, HASANZADEH M, TREGLIA G, et al. Sentinel node biopsy for lymph nodal staging of uterine cervix cancer: a systematic review and meta-analysis of the pertinent literature[J]. Eur J Surg Oncol, 2015, 41(1): 1-20. [12] FRUMOVITZ M, PLANTE M, LEE P S, et al. The FILM trial: a randomized phase III multicenter study assessing near infrared fluorescence in the identification of sentinel lymph nodes (SLN) [J]. Gynecol Oncol, 2018, 149: 7. [13] LIM K, SMALL W Jr, PORTELANCE L, et al. Consensus guidelines for delineation of clinical target volume for intensity- modulated pelvic radiotherapy for the definitive treatment of cervix cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 348-355. [14] SMALL W Jr, BOSCH W R, HARKENRIDER M M, et al. NRG oncology/RTOG consensus guidelines for delineation of clinical target volume for intensity modulated pelvic radiation therapy in postoperative treatment of endometrial and cervical cancer: an update[J]. Int J Radiat Oncol Biol Phys, 2021, 109(2): 413- 424. [15] KLOPP A H, YEUNG A R, DESHMUKH S, et al. Patient- reported toxicity during pelvic intensity-modulated radiation therapy: NRG oncology-RTOG 1203[J]. J Clin Oncol, 2018, 36(24): 2538-2544. [22] MORRIS M, EIFEL P J, LU J, et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer[J]. N Engl J Med, 1999, 340(15): 1137-1143. [23] HUANG H, FENG Y L, WAN T, et al. Effectiveness of sequential chemoradiation vs concurrent chemoradiation or radiation alone in adjuvant treatment after hysterectomy for cervical cancer: the STARS phase 3 randomized clinical trial [J]. JAMA Oncol, 2021, 7(3): 361-369. [24] TRIFILETTI D M, SWISHER-MCCLURE S, SHOWALTER T N, et al. Postoperative chemoradiation therapy in high- risk cervical cancer: re-evaluating the findings of gynecologic oncology group study 109 in a large, population-based cohort [J]. Int J Radiat Oncol Biol Phys, 2015, 93(5): 1032-1044. [25] KEYS H M, BUNDY B N, STEHMAN F B, et al. Radiation therapy with and without extrafascial hysterectomy for bulky stage IB cervical carcinoma: a randomized trial of the Gynecologic Oncology Group[J]. Gynecol Oncol, 2003, 89(3): 343-353. [26] KOKKA F, BRYANT A, BROCKBANK E, et al. Hysterectomy with radiotherapy or chemotherapy or both for women with locally advanced cervical cancer[J]. Cochrane Database Syst Rev, 2015(4): CD010260. [27] COLOMBO P E, BERTRAND M M, GUTOWSKI M, et al. Total laparoscopic radical hysterectomy for locally advanced cervical carcinoma (stages IIB, IIA and bulky stages IB) after concurrent chemoradiation therapy: Surgical morbidity and oncological results[J]. Gynecol Oncol, 2009, 114(3): 404- [16] TAYLOR A, ROCKALL A G, REZNEK R H, et al. Mapping 409. pelvic lymph nodes: guidelines for delineation in intensity- modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 63(5): 1604-1612. [17] HIGGINSON D S, MORRIS D E, JONES E L, et al. Stereotactic body radiotherapy (SBRT): technological innovation and application in gynecologic oncology[J]. Gynecol Oncol, 2011, 120(3): 404-412. [18] LANDONI F, MANEO A, COLOMBO A, et al. Randomised study of radical surgery versus radiotherapy for stage Ib-IIa cervical cancer[J]. Lancet, 1997, 350(9077): 535-540. [19] WHITNEY C W, SAUSE W, BUNDY B N, et al. Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative para-aortic lymph nodes: a Gynecologic Oncology Group and Southwest Oncology Group study[J]. J Clin Oncol, 1999, 17(5): 1339-1348. [20] ROSE P G, BUNDY B N, WATKINS E B, et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer[J]. N Engl J Med, 1999, 340(15): 1144-1153. [21] KEYS H M, BUNDY B N, STEHMAN F B, et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma[J]. N Engl J Med, 1999, 340(15): 1154-1161. [28] TOUBOUL C, UZAN C, MAUGUEN A, et al. Prognostic factors and morbidities after completion surgery in patients undergoing initial chemoradiation therapy for locally advanced cervical cancer[J]. Oncologist, 2010, 15(4): 405-415. [29] HUGUET F, COJOCARIU O M, LEVY P, et al. Preoperative concurrent radiation therapy and chemotherapy for bulky stage IB2, IIA, and IIB carcinoma of the uterine cervix with proximal parametrial invasion[J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1508-1515. [30] LEATH C A, STRAUGHN J M. Chemotherapy for advanced and recurrent cervical carcinoma: results from cooperative group trials[J]. Gynecol Oncol, 2013, 129(1): 251-257. [31] MCLACHLAN J, BOUSSIOS S, OKINES A, et al. The impact of systemic therapy beyond first-line treatment for advanced cervical cancer[J]. Clin Oncol (R Coll Radiol), 2017, 29(3): 153-160. [32] MARTH C, LANDONI F, MAHNER S, et al. Cervical cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl 4): iv262. [33] CIBULA D, P?TTER R, PLANCHAMP F, et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer [J]. Int J Gynecol Cancer, 2018, 28(4): 641-655. 《中国癌症杂志》2021年第31卷第6期 489 ?[34] SEDLIS A, BUNDY B N, ROTMAN M Z, et al. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: a Gynecologic Oncology Group study[J]. Gynecol Oncol, 1999, 73(2): 177-183. [35] NOH J M, PARK W, KIM Y S, et al. Comparison of clinical outcomes of adenocarcinoma and adenosquamous carcinoma in uterine cervical cancer patients receiving surgical resection followed by radiotherapy: a multicenter retrospective study (KROG 13-10)[J]. Gynecol Oncol, 2014, 132(3): 618-623. [36] RYU S Y, KIM M H, NAM B H, et al. Intermediate-risk grouping of cervical cancer patients treated with radical hysterectomy: a Korean Gynecologic Oncology Group study [J]. Br J Cancer, 2014, 110(2): 278-285. [37] DIAZ E S, AOYAMA C, BAQUING M A, et al. Predictors of residual carcinoma or carcinoma-in-situ at hysterectomy following cervical conization with positive margins[J]. Gynecol Oncol, 2014, 132(1): 76-80. (收稿日期:2021-04-28 修回日期:2021-04-30) 子宫颈癌诊断与治疗指南(2021年版) 编写专家 主 编: 玛依努尔 新疆维吾尔自治区人民医院 周 琦 重庆大学附属肿瘤医院 副主编: 盛修贵 中国医学科学院肿瘤医院深圳医院 学术秘书: 邹冬玲 重庆大学附属肿瘤医院 李雨聪 重庆大学附属肿瘤医院 龙行涛 重庆大学附属肿瘤医院 主要编写人员(按姓氏笔画排序): 王 莉 河南省肿瘤医院 王纯雁 中国医科大学肿瘤医院/辽宁省肿瘤 医院 古扎丽努尔 新疆医科大学附属肿瘤医院 ·阿不力孜 龙行涛 重庆大学附属肿瘤医院 田小飞 陕西省肿瘤医院 刘乃富 山东省肿瘤医院 刘开江 上海交通大学医学院附属仁济医院 孙蓬明 福建省妇幼保健院 ·尼牙孜 李雨聪 重庆大学附属肿瘤医院 李隆玉 江西省妇幼保健院 邹冬玲 重庆大学附属肿瘤医院 张国楠 四川省肿瘤医院(电子科技大学医学院 附属肿瘤医院) 陈 刚 华中科技大学同济医学院附属 同济医院 周 琦 重庆大学附属肿瘤医院 柯桂好 复旦大学附属肿瘤医院 夏百荣 中国科学技术大学附属第一医院 郭红燕 北京大学第三医院 黄 奕 湖北省肿瘤医院 黄曼妮 中国医学科学院肿瘤医院 盛修贵 中国医学科学院肿瘤医院深圳医院 康 山 河北医科大学附属第四医院 蔡红兵 武汉大学中南医院
闫丽隽 主任医师 山西省肿瘤医院 妇科1048人已读 - 精选 2019ASCCP基本风险的宫颈癌筛查结果异常的管理共识解读
● 446 ● 中国妇产科临床杂志 2020 年 7 月 第 21 卷 第 4 期 Chin J Clin Obstet Gynecol July 2020,Vol.21,No.4 ·共识解读· 2019 ASCCP 基于风险的子宫颈癌筛查结果异常的管理共识解读 李明珠??赵昀??李静然??赵超??魏丽惠 ?2019 美国阴道镜和宫颈病理学会(ASCCP)基于风险 的宫颈癌筛查结果异常和癌前病变管理指南是 ASCCP 发起 的宫颈癌筛查异常后处理的第四次共识指南,第一次共识 会议于 2001 年召开 [1],随后分别于 2006 年 [2] 和 2012 年 [3] 进行了更新。2012 年 ASCCP 共识中已首次提出同等风 险,同等管理的原则,即对 5 年内发生宫颈高级别及以上 病变(CIN3+)的风险进行分层管理,这在概念上是一大 突破,但这一评估依赖于复杂的计算,而且没有充分纳入 既往筛查史。2015 年 ASCCP 发布了一版过渡指南 [4],主 要针对 HPV 初筛提出了管理建议。2019 年 ASCCP 宫颈癌 筛查结果异常和癌前病变的管理共识(以下简称为 2019 版 指南)[5],在既往指南的基础上再次更新,与之前版本的关 键区别在于其基于风险值的量化和细化,加入“阈值”概 念,同等风险,同等管理更加精细化。例如,从 HPV 阳 性的 ASC-US、LSIL 建议进行阴道镜检查,变为 2019 版 “基于风险”的推荐:既往筛查和此次筛查结果,当前发生 CIN3+ 的风险在 4.0% 以上者,建议进行阴道镜检查。提出 这一改变的依据是基于此次筛查结果和既往筛查史 ( 包括 未知史 ) 组合风险评估表 [6]。这个评估表来自于凯撒机构 (KPNC)的一项前瞻性纵向队列研究,该研究对 150 多万 名女性进行了历经 10 年以上的随访,详细描述了各种风险 指标的处理,对此版指南中评估不同风险管理具有决策性 的意义。风险升高的患者,建议进行更频繁的监测、阴道 镜检查和治疗;而对风险较低的患者可以推迟阴道镜检查, 进行更长时间的随访监测,当风险足够低时,再回到常规 筛查。 2019 版指南具体在以下几个方面进行了更新: 一、关于宫颈癌筛查方法 基于 HPV 的检测是风险评估的基础。2019 版指南使 用基于 HPV 的检测,指的是 HPV 初筛或 HPV 检测与宫颈 细胞学的联合筛查。HPV 感染的特征,包括 HPV 类型和 感染持续时间,共同决定了 CIN 3+ 的罹患风险。与 HPV 检测相比,细胞学较低的敏感性和阴性预测值影响其作为 长期风险预测的效果 [7]。单独 HPV 检测或与细胞学的联合 筛查,可延长随访间隔和推迟低风险人群的阴道镜检查。 应采用美国食品和药物管理局(FDA)批准的用于筛查的 方法,需注意的是所有 HPV 检测仅指高危 HPV 类型的检 doi:10.13390/j.issn.1672-1861.2020.04.035 作者单位:100044 北京大学人民医院妇产科 通信作者:魏丽惠 Email:weilhpku@163.com 测。未经 FDA 批准的 HPV mRNA 和 HPV DNA 检测仅可 用于与细胞学联合进行筛查,除非有充分、严格的数据支 持其不同方式的使用 [8]。 只有在无法进行 HPV 检测或无法进行联合筛查的情 况下,才采用单一细胞学检查作为检测手段。如果应用 HPV 检测或联合筛查间隔每年一次,那么单一细胞学检查 则需要每 6 个月一次;如应用 HPV 检测或联合筛查间隔每 3 年一次,单一细胞学筛查则需要每年一次。 二、个性化、基于风险的管理依据当前筛查结果和既 往筛查史结合 2001 版共识首次确定了阴道镜的转诊阈值,即低级别 鳞状上皮内病变(LSIL)和 HPV 阳性的 ASC-US 患者,这 一建议一直延续到 2006 版和 2012 版。2019ASCCP 工作 组回顾多项数据发现,直接转诊阴道镜患者当前发生 CIN 3+ 的风险为 3%~7%[9]。该风险应由当前筛查结果和既往 病史(包括未知病史)以及既往宫颈病变治疗情况综合评 估。即使相同的当前筛查结果,根据既往筛查史评估后会 有不同的管理建议。总体评估原则:根据当前筛查和既往 筛查结果,如当前 CIN3+ 风险 ≥ 4%,应立即进行阴道镜 检查或治疗;如当前 CIN3 风险 < 4%,则评估其 5 年内发 生 CIN3+ 风险,以确定患者是否应在 1 年、3 年或 5 年后 进行随访。 2019 版指南根据不同风险阈值提出以下处理组合分别 为:观察随防、阴道镜检查和治疗,分别代表了不同 CIN3 风险的阈值层面,见图 1。每个风险层的最低阈值,称为 临床操作阈值(clinical action threshold, CAT),决定了下一 步管理建议的级别,具体可通过智能应用程序或通过网址 当前CIN3+风险 25%~59% 推荐快速治疗 ??≥4% 当前CIN3+风险 4%~24% 阴道镜或快速治疗 ?可以接受 ?当前CIN3+ 风险 5年内CIN3+风险 ≥ 0.55% 推荐阴道镜 检查 ??5年内CIN3+风险 0.15%~0.54% 1年复查 ??<4% ?图 1 风险阈值及处理推荐图示 当前CIN3+风险 60%~100% ?5年内CIN3+风险 <0.15% 3年复查 ?5年复查 ? 中国妇产科临床杂志 2020 年 7 月 第 21 卷 第 4 期 Chin J Clin Obstet Gynecol July 2020,Vol.21,No.4 ● 447 ● ?http://cervixca.nlm.nih.gor/Risk Tables/ 查 询 表 格 来 确 定 其 处 于何种风险级别。 三、HPV 阳性的分流问题 所有初筛为 HPV 阳性者,无论 HPV 基因型如何,均 建议用同一次实验室样本进行细胞学的分流检测。这一项 建议对其同等风险,同等管理的指导意义更加明确(如 HPV16 阳性细胞学阳性进行阴道镜检查,但如 HPV16 阳 性细胞学 HSIL 直接快速治疗)。这一推荐与 2015 宫颈癌 筛查异常的临时指南中关于 HPV16/18 可直接转诊阴道镜, 非 HPV16/18 需要细胞学分流的建议不同,2019 版指南指 出 HPV 阳性,无论 HPV 分型如何都要进行细胞学检查。 但 HPV16/18 阳性发生 CIN3 和隐匿性癌的风险较高,因 此即使细胞学检查结果为阴性,也有必要进行阴道镜检查。 另外如 HPV16/18 阳性,但实验室无法提供对同一样本细 胞学的分流检测的条件,患者也可直接转诊阴道镜 [4]。 四、阴道镜检查实践 依据 ASCCP 阴道镜标准 [10]:阴道镜检查中最大限 度地检出 CIN2+ 至关重要,如果没有发现 CIN2+,管理力 度也会降低,仍建议对不同部位醋白区域进行 2~4 块活检。 对于风险较低的人群:细胞学 HSIL 以下、无 HPV16/18 和阴道镜印象完全正常(无任何化生或其他可见异常的醋 白,且有完整可见的鳞柱交界),这种情况发生隐匿 CIN 2+ (1%~7%)和 CIN3( < 1%)的风险较低。不建议进行无 目标性(随机)活检,随访即可。为了确保 CIN2+ 不被遗 漏,ASCCP 阴道镜标准强调了活检的必要性,即阴道镜下 任何程度的化生或其他异常的醋白上皮均应进行活检。 ??五、关于快速治疗的处理推荐 在 2012 版指南中,快速治疗(无需阴道镜活检直接 进行治疗)是宫颈高级别病变患者的一种选择 [3],2019 版再此基础上进行了更明确的定义。KPNC 的数据显示, HPV 阳性,细胞学 HSIL 时,当前 CIN3 和 CIN2 的风险 分 别 为 49% 和 77%[6]; 细 胞 学 HSIL,HPV16 时,CIN3 和 CIN2 的当前风险分别为 60% 和 77%[11]。故对于 25 岁及以 上的非妊娠患者,当 CIN3+ 即刻风险 ≥ 60% 时(如细胞学 HSIL,HPV16+),优先推荐快速治疗。对于 CIN3+ 当前风 险在 25%~60% 之间的患者,可以先进行阴道镜检查或直 接快速治疗。但是在选择快速治疗时,医患应充分沟通共 同决策,特别是对于担心治疗会对今后妊娠结局有潜在影 响的患者。 ??六、高级别鳞状上皮内病变组织病理学报告的推荐 基于 2014 年下生殖道肛门 - 生殖器鳞状上皮内病变术 语(LAST)/ 世界卫生组织(WHO)对宫颈高级别病变进 行二级分类报告结果:即高级别鳞状上皮内病变(HSIL) 和 LSIL,2019 版建议组织病理学报告应包括 CIN2 或 CIN3 限定性词语,因这两种类型的进展风险及治疗方式的选择 有所不同,应采用 HSIL(CIN2)、HSIL(CIN3)的方式报告。 对于一些 CIN 2,保守治疗是可接受的 [12],故 2019 版指南 HSIL 治疗的管理也将 CIN2 和 CIN3 的管理方案根据不同风 险进行推荐,并继续推荐 p16 免疫组织化学在 HSIL(CIN 2 或 CIN 3)组织形态学的应用。但应避免 p16 应用不当, 造成宫颈组织学过度诊断的风险,例如组织形态为 CIN1, 即使 p16 阳性也不应升级为 HSIL(CIN2)。 七、高级别病变的治疗管理和随访 1. 治疗后随访间隔问题 2019 版与 2012 版不同之处在于锥切后首次随访间隔 不再是 12 个月,而是治疗后 6 个月进行基于 HPV 检测的 复查。根据 KPNC 数据,HSIL 治疗后联合检测 /HPV 检 测连续 1、2、3 次阴性后 5 年发生 CIN 3+ 的风险分别为 1.7%/2.0%、0.68%/0.91% 和 0.35%/0.44%[6]。 因 此, 建 议 首次治疗后 6 个月随访如阴性,则每年联合检测或 HPV 检测,直到连续三次阴性。2012 年指南建议 5 年的筛查 间隔,但没有具体说明何时应该停止筛查。KPNC 数据显 示,HSIL 治疗后 5 年 CIN 3+ 的风险仍然高于 0.15% 的阈 值,人群长期研究显示,HSIL 治疗后宫颈癌风险持续增加 2 倍,风险至少持续 25 年,尤其是 50 岁以上人群 [13]。因 此,2019 版指南推荐 3 次阴性随访后,进入每 3 年间隔的 基于 HPV 的检测,至少 25 年。只要患者的预期寿命和接 受筛查的能力没有因健康问题受到严重影响,那么 25 年后 继续间隔 3 年的持续监测也是可以接受的。 2. HSIL(CIN2 和 CIN3)在不同人群的管理 在 2012 年的指南中,21 岁至 24 岁的患者被认为是 一个特殊人群。在目前的指南中,共识是将这一组统称为 “25 岁以下的患者”。以 25 岁为界的原因为 25 岁以下人群 HPV 感染和 CIN2 的自然逆转率很高 [14],肿瘤发病率明显 低于 25 岁以上人群。 系统回顾 CIN2 进行保守治疗后,50% 逆转,32% 持 续,18% 进展为 CIN3,多数消退发生在起初的 12 个月 内,进展率随时间延长而增加,在 30 岁以下消退率较高 (60%)[12]。故 2019 版推荐,对于 <25 岁或≥25 岁有生 育愿望的女性,可采取观察方案,但适用于鳞柱交界完全 可见,宫颈管取样无 CIN2+ 或未定级的 CIN。对于 <25 岁女性,可采用阴道镜和细胞学随访, ≥ 25 岁观察方案 为阴道镜和 HPV 检测为主,首次 6 个月和 12 个月复查。 在观察期间,如果 2 次连续细胞学<ASC-H,病理结果 <CIN2,对于≥25 岁进行基于 HPV 检测为主,<25 岁 细胞学为主,共一年,如果结果仍为阴性,进行基于 HPV 检测每年一次共 3 年,如阴性进入每 3 年一次随访至少 25 年,但如果 CIN2 持续 2 年,建议治疗。CIN3 推荐进行 治疗。另外,如果鳞柱交界不可见,或病变上界不可见或 ECC 为 CIN2 不建议观察,因 CIN2 可能升级,建议进行 宫颈锥切术。 3. 关于 HSIL 的治疗选择问题 HSIL 首选切除性治疗,包括环形电切术(LEEP 或 LLETZ)、冷刀锥化、激光锥活检。消融治疗不建议使用 的情况:1 病变向颈管内延伸;2 当病变覆盖超过 75% 的子宫颈外表面,病变范围超出正在使用的冷冻头治疗范 围时;3 鳞柱交界不完全可见,或病变上边界不完全可 见;4 颈管 CIN2+ 或不能分级的 CIN;5 有 CIN2 的治疗 ? ?● 448 ● 中国妇产科临床杂志 2020 年 7 月 第 21 卷 第 4 期 Chin J Clin Obstet Gynecol July 2020,Vol.21,No.4 ?史;6 活检检查不充分;7 可疑宫颈癌。子宫切除术作为 HSIL(CIN2 或 CIN3)的治疗首要选择是不可取的。除了 特定的临床试验外,对于 HSIL(CIN2 或 CIN3),采用外 用制剂或治疗性疫苗等试剂治疗也是不可取的 [5]。 5. 原位腺癌(AIS)的处理 活检确诊的 AIS 患者,建议进行诊断性切除手术,以 除外浸润性腺癌,即使最终计划进行子宫切除术也应如此。 当 AIS 锥切切缘阴性,可进行单纯子宫切除,当切缘阳 性时,需要二次切除以保证切缘阴性,即使计划切除全子 宫。如果无法保证阴性切缘,保留生育的处理也是不推荐 的。为达到理想的标本长度,在实施 LEEP 后进行“牛仔 帽”式颈管切除使标本破坏是不可取的。切除标本深度至 少 10 mm,对于无未来生育要求者,可将切除标本深度增 加至 18~20 mm。 保留生育功能管理:联合检测及宫颈管取样推荐每 6 个月至少 3 年,之后每年一次,至少 2 年,或直到子宫切 除术。如果连续 5 年都是阴性,可在第 6 年延长至筛查间 隔每三年一次。锥切切缘和宫颈管内取样均可预测子宫切 除标本的残留病变和浸润性癌的风险,HPV 检测阳性是 AIS 复发较有力的预测因素 [13, 15]。 6. 65 岁以上既往筛查异常人群的管理 65 岁以上人群如接受 HPV 检测、联合检测或细胞学 检查,依据 25~65 岁患者方案管理执行。大约 20% 的宫颈 癌发生于 65 岁以上患者 [16]。为了降低 65 岁以上患者的癌 症风险,管理指南建议对结果异常的 65 岁及不符合退出 标准的患者进行持续检测。由于多项指南推荐对于 65 岁 以上接受过充分筛查的患者停止常规筛查,因此关于老年 患者特定筛查试验结果预后价值的数据是有限的。但既往 CIN 3+ 的 65 岁以上患者再发宫颈癌或阴道癌的风险更高, 故对这一类 65 岁以上人群仍需继续监测 [13]。 2019 版指南是基于多项大样本的临床研究结果,在既 往指南基础上进行了更新和完善,也体现出同等风险、同 等管理的精细化,但在学习指南的同时,应了解这是基于 美国筛查策略的变更,没有任何一个指南是放之四海而皆 准的,正如指南中所讲,2019 版指南是推荐在美国本土应 用的宫颈癌筛查和病变管理的指导方针,但是其精细化管 理理念对于我国也有很多学习和借鉴的地方。 参考文献 [1] Wright TJ, Cox JT, Massad LS, et al. 2001 Consensus guide- lines for the management of women with cervical cytological abnormalities[J]. J Low Genit Tract Dis, 2002, 6(2):127-143. DOI: 10.1097/00128360-200204000-00012 [2] Wright TJ, Massad LS, Dunton CJ, et al. 2006 consensus guide- lines for the management of women with abnormal cervical can- cer screening tests[J]. Am J Obstet Gynecol, 2007, 197(4):346- 355. DOI: 10.1016/j.ajog.2007.07.047. [3] Massad LS, Einstein MH, Huh WK, et al. 2012 updated consen- sus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors[J]. Obstet Gynecol, 2013, 121(4):829-846. DOI: 10.1097/AOG.0b013e3182883a34. [4] Huh WK, Ault KA, Chelmow D, et al. Use of primary high- risk human papillomavirus testing for cervical cancer screening: interim clinical guidance[J]. Gynecol Oncol, 2015, 136(2):178- 182. DOI: 10.1016/j.ygyno.2014.12.022. [5] Perkins RB, Guido RS, Castle PE, et al. 2019 ASCCP risk-based management consensus guidelines for abnormal cervical cancer screening tests and cancer precursors[J]. J Low Genit Tract Dis, 2020, 24(2):102-131. DOI: 10.1097/LGT.0000000000000525. [6] Egemen D, Cheung LC, Chen X, et al. Risk estimates sup- porting the 2019 ASCCP risk-based management consensus guidelines[J]. J Low Genit Tract Dis, 2020, 24(2):132-143. DOI 10.1097/LGT.0000000000000529. [7] Schiffman M, Kinney WK, Cheung LC, et al. Relative per- formance of HPV and cytology components of cotesting in cervical screening[J]. J Natl Cancer Inst, 2018, 110(5):501-508. DOI:10.1093/jnci/djx225. [8] Clarke MA, Darragh TM, Nelson E, et al. Reporting and assess- ing the quality of diagnostic accuracy studies for cervical cancer screening and management[J]. J Low Genit Tract Dis, 2020, 24(2):157-166. DOI: 10.1097/LGT.0000000000000527. [9] Wright TC, Stoler MH, Behrens CM, et al. Primary cervical can- cer screening with human papillomavirus: end of study results from the ATHENA study using HPV as the first-line screening test[J]. Gynecol Oncol, 2015, 136(2):189-197. DOI: 10.1016/ j.ygyno.2014.11.076. [10] Wentzensen N, Massad LS, Mayeaux EJ, et al. Evidence-based consensus recommendations for colposcopy practice for cervical cancer prevention in the United States[J]. J Low Genit Tract Dis, 2017, 21(4):216-222. DOI: 10.1097/LGT.0000000000000322. [11] Demarco M, Egemen D, Raine-Bennett TR, et al. A study of partial human papillomavirus genotyping in support of the 2019 ASCCP risk-based management consensus guidelines[J]. J Low Genit Tract Dis, 2020, 24(2):144-147. DOI: 10.1097/ LGT.0000000000000530. [12] Tainio K, Athanasiou A, Tikkinen K, et al. Clinical course of untreated cervical intraepithelial neoplasia grade 2 under ac- tive surveillance: systematic review and meta-analysis[J]. BMJ, 2018, 360:k499. DOI: 10.1136/bmj.k499. [13] Strander B, Andersson-Ellstr?m A, Milsom I, et al. Long term risk of invasive cancer after treatment for cervical intraepithelial neoplasia grade 3: population based cohort study[J]. BMJ, 2007, 335(7629):1077. DOI: 10.1136/bmj.39363.471806. [14] Silver MI, Gage JC, Schiffman M, et al. Clinical outcomes after conservative management of cervical intraepithelial neoplasia grade 2 (CIN2) in women ages 21-39 years[J]. Cancer Prev Res (Phila), 2018, 11(3):165-170. DOI: 10.1158/1940-6207. [15] Costa S, Venturoli S, Origoni M, et al. Performance of HPV DNA testing in the follow-up after treatment of high-grade cervical lesions, adenocarcinoma in situ (AIS) and microinva- sive carcinoma[J]. Ecancermedicalscience, 2015, 9:528. DOI: 10.3332/ecancer.2015.528. [16] Feldman S, Cook E, Davis M, et al. Cervical cancer incidence among elderly women in Massachusetts compared with younger women[J]. J Low Genit Tract Dis, 2018, 22(4):314-317. DOI 10.1097/LGT.0000000000000435. (收稿日期 : 2020-05-12) ??
闫丽隽 主任医师 山西省肿瘤医院 妇科1967人已读 - 精选 学术看点|关铮教授:宫颈锥切术——小手术大学问
妇产科在线 妇产科在线 2018-06-20 宫颈锥切术是切除部分子宫颈的一种手术,即由外向内呈圆锥的形状切下一部分宫颈组织,包括宫颈环形电切术 一、何时切? 宫颈锥切术的指征为宫颈鳞状上皮内高度瘤样病变(HSIL)或CIN2-3级。禁忌症包括:1.可疑浸润癌或腺上皮不典型增生;2.病变累及宫颈管范围超过1cm,或看不见病变边缘或上限;3.宫颈感染或盆腔炎性疾病;4.妊娠或产后12周内;5.异常出血。 HSIL和LSIL是2014年WHO的新分类,免疫组化P16是HSIL和LSIL划分的重要标志,具体划分如下表: 二、如何切? (一)宫颈锥切术分型 在传统的手术学图谱中,宫颈锥切术的切除范围包括整个鳞柱交界,锥高在2.5cm以上,所以过去手术范围较大。目前,宫颈锥切术分为三型,要求切除完整的转化区和鳞柱交界部以上的部分宫颈管。 因此,可根据宫颈移行区的位置来决定宫颈锥切的发小,且切除范围一定要包括宫颈移行区。 (二)宫颈锥切术分类 根据手术器械类型,宫颈锥切术包括宫颈冷刀锥切(CKC)、宫颈电刀锥切(EKC)、宫颈环形电切(LEEP)、宫颈射频刀锥切、宫颈冷冻治疗等。但射频治疗和冷冻治疗破坏宫颈组织,无法进行病理检查。 1.宫颈冷刀锥切是宫颈锥切术的标准术式。其主要优势为:(1)可一次性切除足够大的、完整的宫颈用于组织病理检查,且锥切标本边缘的切净率较高;(2)切除标本边缘不影响组织病理学诊断;(3)可用于腺上皮异常者的诊断。但该手术方式出血不易控制,易引起并发症。该手术方式主要适用于以下情况 :(1)宫颈细胞学HSIL,阴道镜检查阴性或不满意;(2)阴道镜检未看到病变的边界或未见鳞柱交界的上界;(3)主要病灶位于宫颈管内或HSIL延伸入宫颈管内;(4)TCT诊断较阴道镜下宫颈活检的病理结果重(相差2级);(5)宫颈管搔刮术(ECC)的病理结果为异常或不能确定;(6)TCT示腺上皮异常或可疑宫颈腺癌或原位癌;(7)宫颈活检病理提示可疑微小浸润癌;(8)TCT、阴道镜怀疑宫颈浸润癌,但活检病理未能证实;(9)外宫颈病变范围广,累及宫颈四象限,甚至延伸至阴道穹窿。需要注意的是以上宫颈冷刀锥切术的适应症均不适宜行LEEP治疗。 2.宫颈电刀锥切就是应用电刀取代冷刀,该手术可获取足够大的宫颈椎体用于病理检查,且术中出血少,止血效果好,但电刀可致切缘电凝处组织变性,影响病理医生对靠近切缘处病变的判断。该缺点随着P16染色的出现被弥补,如果P16染色弥漫强阳性,代表切缘阳性,即切缘未切净;如果P16染色阴性,说明是电凝导致了组织变性。 3.宫颈电热圈环切术(LEEP)是通过环形金属丝(圈电极)传到高频交流电,利用高频电流所特有的干燥脱水效应、电弧切割效应来对电极接触的组织进行快速切开。常用的切除模式为移行带环切术和子宫颈环锥切。LEEP用于CIN1和ASC-US诊断时,活检的宫颈深度和颈管的深度约4mm,既可达到诊断和治疗作用,又避免切除过多组织,比宫颈钳活检术优越。 4.锐扶刀的形状与LEEP有相似之处,锐扶刀宫颈锥切是一种射频消融技术,最大的优点是止血效果好,切缘没有热损伤,不影响病理诊断。 (三)术后处理 宫颈锥切术后处理是临床医生需要重点关注的内容之一,包括术后并发症的处理、术后随访和术后妊娠的相关问题。 1.宫颈锥切术后并发症 宫颈锥切术后并发症包括出血、感染、宫颈管口粘连、创面子宫内膜异位症等。出血是最常见的术后并发症,有术后早期和晚期出血。术后早期出血是指宫颈锥切术后即刻出血和术后1-2天内创面出血,多因手术止血不彻底导致,可根据术者经验术中采用“8”字或锁边缝合创面防治出血。然而,术者在止血时一方面要考虑如何妥善止血,另一方面还要考虑如何防止术后宫颈管粘连,可采用宫颈管处放置导尿管、碘伏纱条等措施。此外,强调月经干净以后行宫颈锥切手术,其主要原因包括两方面:①区别阴道出血是月经血还是手术创面出血;②降低宫颈创面子宫内膜异位症发生风险。 2.宫颈锥切术后随访 由于宫颈锥切术后患者比普通人群患宫颈癌风险高2-5倍以上,因此术后要定期随访。术后1-2个月随访主要观察创面愈合进程,术后6个月行TCT及HPV检测,随访阳性者则需要阴道镜再次评估。 三、切缘阳性怎么办? 1.切缘未净的定义 鳞状上皮内病变:紧邻切缘指病变距离切缘3mm。 腺上皮病变:因其具有病变的跳跃性,要求病变距离切缘>7mm才安全。 宫颈管内切缘阳性:出现残留复发的风险高。 2.切缘阳性的处理原则 符合以下条件者,可进行随访:①无腺上皮异常证据;②无宫颈管切缘阳性;③无浸润性病变的证据;④患者年龄小于50岁。 当出现内切缘阳性,腺体受累或多象限受累,患者年龄≥50岁,阴道镜检查困难,随访条件差等情况时,需要行再次宫颈锥切术或子宫切除术。其中,单纯全子宫切除的指征主要包括:无生育要求;充分的宫颈切除后切缘仍为阳性;锥切治疗后存在高级别细胞学异常;患者不愿意接受保守治疗;因某些原因无法进行充分的TCT,如宫颈管狭窄;患者存在其他切除子宫的指征;已排除浸润性疾病。 3.宫颈锥切术后复发 关于宫颈锥切术后复发的问题有个概念需要理解,即病变残留和病变复发。病变残留指术后6个月内发现宫颈病变,病变复发指术后6个月以上发现宫颈病变(第一次TCT复查阴性后又出现CIN者)。 宫颈锥切术后复发与手术方式、手术切缘状况、腺体受累、HPV持续感染等因素相关。①研究显示,CKC与LEEP相比,术后1年宫颈病变复发率低,HPV清除率高。②宫颈锥切术后切缘阳性复发率高,宫颈管搔刮术(ECC)可预测病灶残留,对判断宫颈管内病变和复发有很重要的意义。③研究发现,腺体受累者复发率是无受累的4.51倍,此时宫颈锥切的深度可影响病灶残留和复发率。④锥切术后HPV逐渐被清除,多数在6个月内转阴(术后6个月复查较为合理),但仍有20%的术后患者HPV持续感染。根据相关资料,LEEP术后3个月、6个月、9个月和12个月的HPV持续阳性率分别为44.6%、10.6%、2.1%和2.1%。数据调查发现HPV阳性者复发率明显高于阴性者(9.2%:1.9%)。 四、宫颈锥切术与妊娠 1.宫颈锥切术对妊娠的影响 宫颈锥切术后由于宫颈长度缩短、宫颈壁变薄,约20%术后妊娠患者存在不良结局,晚期流产的比例是非锥切者的7倍,而锥切类型、锥切大小、宫颈长度是宫颈锥切术后早产的三个高危因素。 一组关于宫颈切除深度对妊娠结局的影响数据资料如下: 宫颈切除深度>10mm时,将增加早产的风险; 宫颈切除深度>12mm时,早产风险增加3倍; 宫颈切除深度10-14mm时,早产绝对风险为8%; 宫颈切除深度>20mm时,早产风险将上升至18%。 由上可知,宫颈锥切的锥高越高,早产风险将越大。 2.宫颈机能不全 (1)定义:早孕期无宫缩时出现宫颈扩张,而无法维持继续妊娠 (2)诊断:①病史:多次孕中期妊娠自然流产史或早产史;②查体:8号宫颈扩张棒无阻力通过;孕期无痛性宫颈扩张,羊膜囊突出;③子宫输卵管造影:子宫峡部漏斗区呈管状扩张;④超声:非孕期宫颈管宽径>6mm,宫颈管长度
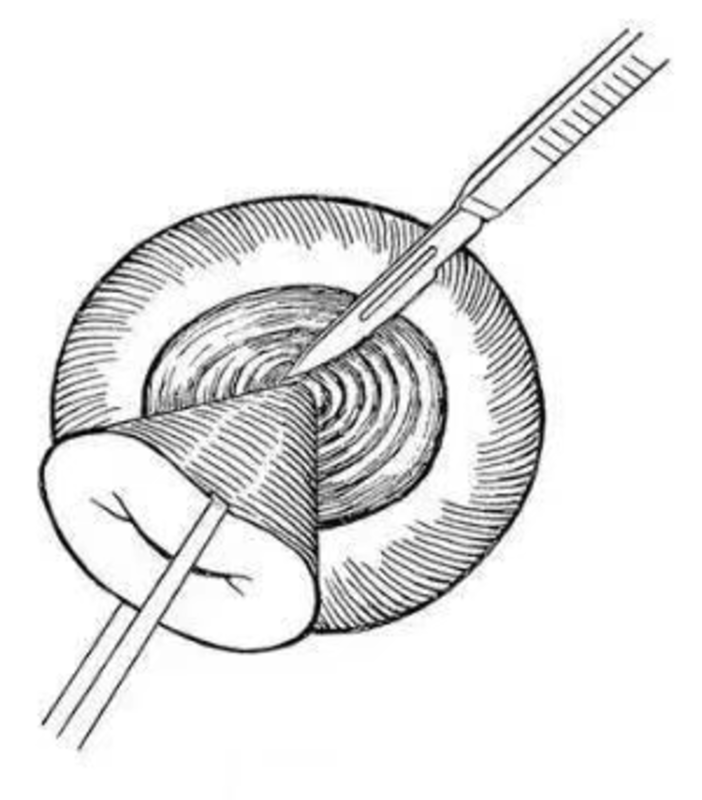 闫丽隽 主任医师 山西省肿瘤医院 妇科4443人已读
闫丽隽 主任医师 山西省肿瘤医院 妇科4443人已读 - 就诊指南 需氧菌性阴道炎诊治
中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 · 11 · ·专家共识· 需氧菌性阴道炎诊治专家共识(2021 版) 中华医学会妇产科学分会感染性疾病协作组 通信作者:薛凤霞,天津医科大学总医院妇产科暨天津市女性生殖健康与优生重点实 验室 300052,Email:xuefengxia@tmu.edu.cn 【摘要】 需氧菌性阴道炎(AV)是以阴道内乳杆菌减少或缺失、需氧菌增多为主要特点的常见阴 道感染性疾病。AV 患者阴道病原体复杂,包括革兰阳性和革兰阴性需氧菌,临床表现主要为黄色阴 道分泌物、分泌物异味、阴道黏膜红肿等,并常合并其他阴道炎症。AV 采用湿片镜检评分≥3 分结合 临床表现进行诊断。AV 的治疗根据患者的临床特点及镜检结果进行分类管理,包括抗菌药物治疗、 针对阴道黏膜炎症反应的治疗及恢复阴道微生态。针对需氧菌感染,根据镜检背景菌群为革兰阴性 杆菌或革兰阳性球菌,个体化选择对应的抗菌药物。AV 患者的性伴无需常规筛查及治疗。本共识也 对妊娠合并 AV 的管理进行了阐述。 需氧菌性阴道炎(aerobic vaginitis,AV)是以阴 AV 虽然是 Donders 于 2002 年新提出的阴道感 道内乳杆菌减少或缺失,需氧菌增多引起的阴道炎 染[3],但追溯历史,在该病的认识过程中,曾在 ?症。AV 患者阴道菌群多样性增加,病原体相对复 杂 ,以 B 族 链 球 菌 、大 肠 埃 希 菌 、金 黄 色 葡 萄 球 菌 、 粪肠球菌、咽峡炎链球菌、肺炎克雷伯菌等多种需 氧菌和兼性厌氧菌增多常见[1‐2]。AV 除了具有病 原体复杂的特点外,还易合并其他阴道感染。 AV 不仅可导致患者外阴阴道不适,还与盆腔 炎症性疾病、不孕症以及流产、早产、胎膜早破、绒 毛膜羊膜炎、新生儿感染、产褥感染等不良妊娠结 局有关。AV 也会增加性传播病原体(如 HPV、 HIV、阴道毛滴虫、沙眼衣原体等)的感染风险。 自 2002 年比利时学者 Donders 提出 AV 的概 念[3]至今不足20年的时间,国内临床医师对AV的 认识不足,诊治水平参差不齐,但 AV 又是临床常见 的阴道感染性疾病,为了提高临床医师对 AV 的认 识,规范 AV 的诊治流程,解决 AV 诊治中遇到的问 题,促进 AV 相关的科学研究,由中华医学会妇产科 学分会感染性疾病协作组结合近年来国内外 AV 的 研 究 进 展 、国 际 相 关 指 南 [ 4 ] 并 基 于 国 内 情 况 ,形 成 本专家共识供临床参考。 一、历史沿革与流行病学 1956 年 被 命 名 为“ 渗 出 性 阴 道 炎(exudative v a g i n i t i s ) ”[ 5 ] ,于 1 9 6 5 年 被 称 为“ 脱 屑 性 阴 道 炎 (desquamative inflammatory vaginitis,DIV)”[6],直至 2002 年,Donders 等[3]首次提出 AV 的概念及诊断标 准,并认为既往所认知的 DIV 是 AV 的重度形式。 AV 是常见的阴道感染性疾病之一,不同国家、 地区的发病率因就诊人群、种族、诊断方法的不同 而有差异。国外相关研究报道,AV 的发病率为 4.9%~11.8%[7‐11]。国内AV在阴道炎症中的所占比 例波动于 9.4%~23.7%[12‐13]。AV 的发病原因尚未完 全明确,但可能与反复阴道灌洗、长期使用广谱抗 菌药物、多个性伴等因素有关[14]。 二、临床特点 10%~20% 的 AV 患者无症状。有症状者主要 表现为黄色阴道分泌物、分泌物异味、外阴烧灼感 或刺痛、性交痛等,查体可见阴道黏膜红肿、溃疡或 一定程度的阴道黏膜萎缩等表现。有症状者症状 持续时间长、间歇性加重,且治疗后易复发。 三、诊断 1. 诊断标准: ?DOI:10.3760/cma.j.cn112141-20201009-00763 收稿日期 2020-10-09 本文编辑 沈平虎 引用本文:中华医学会妇产科学分会感染性疾病协作组 . 需氧菌性阴道炎诊治专家共识(2021 版)[J]. 中 华妇产科杂志, 2021, 56(1): 11-14. DOI: 10.3760/cma.j.cn112141-20201009-00763. · 12 · (1)有临床症状和(或)体征; ( 2 )A V 评 分 ≥ 3 分 。 对于单纯性 AV 患者,目前国内外较广泛采用 的是 Donders 提出的阴道分泌物生理盐水湿片诊断 标 准 ( 见 表 1 )[ 3 ,1 5 ] ,通 过 相 差 显 微 镜 评 价 乳 杆 菌 分 级、白细胞数量、含中毒颗粒的白细胞所占比例、背 景菌落及基底旁上皮细胞比例,对这 5 个项目分别 评分,每项 0~2 分,总分 10 分;累计评分≥3 分诊断 为 AV,3~4 分为轻度、5~6 分为中度、7~10 分为重 度。此诊断标准的优点为可以反映 AV 菌群情况、 炎症反应和阴道黏膜萎缩三方面的特征;缺点是对 检验人员及设备要求较高,生理盐水湿片不易保 存、无法重复阅片,并且未结合患者的临床症状和 体征。在做出 AV 诊断时,除 AV 评分≥3 分,还应结 合患者的临床症状和体征做出诊断。 2. 其他诊断方法:(1)Tempera 等[16]于 2004 年 提出的临床特征和湿片特点相结合的方法,评价内 容包括:1检查见阴道异常黄色分泌物;2阴道 pH 值 升 高( p H > 5 . 0 );3 分 泌 物 有 异 味( 但 K O H 试 验 阴 性);4阴道分泌物 400 倍镜检见大量白细胞;5根 据 Donders 标准[3]确定乳杆菌分级为IIa、IIb 或 III级。该方法的优点是结合了患者的临床表现;缺 点是缺乏量化标准,为描述性评价,未包含显示阴 道黏膜萎缩的指标;目前临床应用较少。 (2)分子诊断[17]:应用实时荧光定量 PCR 技术 对阴道内乳杆菌属和需氧菌(包括肠杆菌属、链球 菌属、葡萄球菌属)的载量进行检测,当乳杆菌载量 减少、需氧菌载量增加 10 倍以上诊断 AV。该方法 目前尚处于研究阶段。 (3)功能学检测[15]:当 pH 值升高、H2O2 减少、白 细胞酯酶阳性、β‐葡萄糖醛酸酶或凝固酶阳性可对 AV 的诊断有一定的辅助作用,尚不能作为诊断 AV 的单独标准。功能学检测须联合形态学检测。当 功能学与形态学结果不一致时,以形态学检测结果 为准。 (4)细菌培养法:AV 患者阴道微生态失调、病 原菌相对复杂,可能存在传统培养法难以培养出的 致病菌种,因此不推荐细菌培养用于诊断 AV,但可 通过药敏试验指导治疗和随访[18]。 3. 诊断注意事项:AV 患者易合并其他阴道炎 症,诊断 AV 时应注意排除其他常见阴道炎症的混 合感染。此外,AV 患者阴道分泌物多呈黄色脓性, 与子宫颈炎、盆腔炎症性疾病患者的体征相似,诊 断 AV 时还应注意排除子宫颈及上生殖道感染引起 的分泌物异常。 四、治疗 AV 常易合并阴道混合感染,治疗前应进行充 分评估是否存在其他阴道炎症,如细菌性阴道病 (bacterial vaginosis) 、 阴 道 毛 滴 虫 病 (trichomoniasis)、外 阴 阴 道 假 丝 酵 母 菌 病 (vulvovaginal candidiasis)等。有条件时还需要同 时检查沙眼衣原体和淋病奈瑟菌等。对于单纯性 AV 的治疗,建议根据患者的临床特点及镜检结果 进行分类管理[18‐19]。 1. 针对需氧菌感染的治疗:选择经验性抗菌药 物,可根据镜检特点,针对背景菌群为革兰阴性杆 菌、革兰阳性球菌或两者同时增多者予以对应的抗 菌药物治疗。对于疗效不佳或反复发作者,也可根 据阴道细菌培养及药敏结果调整用药。国内外的 治疗经验包括: (1)克林霉素:克林霉素的抗菌谱可覆盖革兰 阳性球菌。采用 2% 克林霉素软膏 5 g,阴道用药, 1 次 / d ,共 7 ~ 2 1 d [ 4 ] 。 对 于 重 度 A V ( D I V ) ,可 采 用 2% 克林霉素 5 g、阴道用药、1 次/d 治疗,症状缓解 后,可每周用药 1~2 次进行维持治疗,连用 2~6 个 月,可减少疾病反复发作[20]。应当注意的是,克林 霉素乳膏(使用 5 d 内)或克林霉素阴道栓剂(使用 72 h 内)其中的油性基质可能减弱乳胶避孕套的防 护作用,建议患者在治疗期间避免性生活。 (2)头孢呋辛:头孢呋辛属于第 2 代头孢菌素, 对革兰阳性球菌的作用与第 1 代相似,抗革兰阴性 杆菌的活性较第1代强。可采用头孢呋辛酯 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 ?表 1 AV 湿片法评分标准(相差显微镜,×400)[3,15] AV 评分 0 1 2 菌为主;IIb 级:混合菌群,但乳杆菌比例明显减少,少于其他细菌;III级:乳杆菌严重减少或缺失,其他细菌过度增殖。HPF 表示高倍视野 (high power field),×400 放大倍数;PBC 表示基底旁上皮细胞(parabasal epitheliocytes) LBG I或IIa 级 IIb 级 III级 注:AV 表示需氧菌性阴道炎。LBG 表示乳杆菌分级(lactobacillary grade),I级:多量多形乳杆菌,无其他细菌;IIa 级:混合菌群,但以乳杆 ?白细胞数量 ≤10 个/HPF >10 个/HPF 且 1 个上皮细胞周围≤10 个 含中毒颗粒的白细胞所占比例 无或散在 ≤50% 的白细胞 背景菌落 不明显或溶胞性 肠杆菌类的小杆菌 PBC 所占比例 无或<1% 1%~10% >10% ?1 个上皮细胞周围>10 个 >50% 的白细胞 球菌样或呈链状 ? 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 · 13 · ?250 mg,口服,2 次/d,共 7 d[21‐22]。 (3)喹诺酮类:第 3 代喹诺酮类药物的抗菌谱 覆盖一些革兰阳性和阴性菌,可选用左氧氟沙星 200 mg,口服,2 次/d,共 7 d[22]。第 4 代喹诺酮类药 物除了具有抗革兰阴性菌活性,且抗革兰阳性菌活 性更强,可采用莫西沙星 400 mg,口服,1 次/d,共 6 d[23]。 (4)卡那霉素:卡那霉素具有较强的抗革兰阴 性需氧杆菌活性,对葡萄球菌属(甲氧西林敏感株) 也有一定的抗菌作用,对乳杆菌无明显影响。可采 用卡那霉素阴道栓剂 100 mg,阴道用药,1 次/d,共 6 d[16]。 2. 针对阴道黏膜萎缩的治疗:对于表现有阴道 黏膜萎缩的 AV 患者,可阴道局部应用雌激素(如 0 . 1 % 戊 酸 雌 二 醇 ) ,每 周 2 次 [ 1 8 ,2 0 ] 。 也 有 使 用 氯 喹 那多‐普罗雌烯阴道片获得与克林霉素相当的疗 效,氯喹那多是 1 种广谱抗菌剂,普罗雌烯可作用 于下生殖道黏膜,起局部的雌激素样作用,具体方 案为 1 片/d,睡前阴道用药,共 12 d[24]。应用雌激素 类药物时,应当注意激素使用禁忌证,如乳腺癌、既 往血栓栓塞史等。 3. 针对外阴阴道黏膜局部炎症反应的治疗:对 于外阴阴道黏膜炎症反应,可局部应用皮质类固醇 激素治疗,具体方案为:氢化可的松 300~500 mg,睡 前 阴 道 用 药 ,1 次 / d ,7 ~ 2 1 d [ 4 ,2 0 ] ,症 状 改 善 者 可 选 择 维持治疗方案,即应用氢化可的松 300~500 mg 睡 前阴道用药,每周 1 或 2 次,连用 2~6 个月[20];或丙 酸氯倍他索,睡前阴道用药,1 次/d,连用 1 周[20]。 维持治疗中,对于有真菌感染风险者,可考虑加用 氟康唑 150 mg,口服,1 次/周,预防阴道真菌感染[20]。 4. 微生态制剂:随机对照临床试验显示,微生 态制剂可延长 AV 的复发间隔[25]。对于 AV 患者, 可考虑外源性补充乳杆菌制剂辅助恢复正常的阴 道微生态。 5. 中医药治疗:传统中药不同于西药类抗菌药 物,药效相对温和,耐药相对少见,其对于 AV 具有 一定的疗效[26‐27],为 AV 治疗提供了新的方向。 五、性伴的管理 AV 患者的男性性伴无需常规筛查及治疗[4]。 六、随访 AV 患者若症状持续或反复发作需要随访复 查[4]。有条件者,AV 治疗后可复查阴道微生态检 测,评估阴道菌群恢复情况及疗效。 七、妊娠合并AV的管理 妊娠期 AV 的发生率因研究地区、就诊人群、孕 周不同、有无症状而异,波动于 4%~9%,总体低于 非妊娠期人群[18]。妊娠状态与AV存在相互影响, 一方面,妊娠期雌、孕激素水平升高,阴道局部免疫 调节失衡,以及子宫颈黏液和阴道分泌物增多,增 加了妊娠妇女生殖道感染的风险;另一方面,AV 的 常见致病菌多为阴道定植菌,当阴道菌群紊乱,这 些定植菌可转变为 AV 致病菌上行感染而引起不良 妊娠结局[28]。 1. 妊娠期 AV 筛查及治疗原则:对于妊娠期是 否进行 AV 筛查和治疗尚缺乏循证医学证据支持, 参 照 《 细 菌 性 阴 道 病 诊 治 指 南 ( 2 0 2 1 修 订 版 ) 》[ 2 9 ] , 本共识建议:有症状者需进行 AV 筛查;无症状但既 往有感染相关流产或早产病史的高风险妊娠妇女 需进行 AV 筛查。鉴于现有研究提示妊娠期 AV 可 导致不良妊娠结局[30‐31],因此妊娠期 AV 应在权衡 治疗获益与潜在风险的情况下进行治疗。 2. 用药方案:推荐应用针对需氧菌的、妊娠期 安全的药物治疗,可采用的治疗方案:头孢呋辛 250 mg,口服,2 次/d,共 7 d。微生态制剂的应用可 以改善阴道微生态,但关于围产结局的大样本量的 资料尚无报道。 3. 随访:妊娠合并 AV 者治疗后可复查阴道微 生态检测,评估阴道菌群恢复情况。 执笔专家:薛凤霞(天津医科大学总医院)、刘朝晖(首都医科大学 附属北京妇产医院)、樊尚荣(北京大学深圳医院)、张岱(北京大学 第一医院)、廖秦平(北京清华长庚医院) 本共识由中华医学会妇产科学分会感染性疾病协作组成员共同讨 论制定,协作组专家成员(按姓氏拼音排序):安瑞芳(西安交通大 学第一附属医院)、崔满华(吉林大学第二医院)、狄文(上海交通大 学医学院附属仁济医院)、丁岩(新疆医科大学第一附属医院)、 樊 尚 荣( 北 京 大 学 深 圳 医 院 )、耿 力( 北 京 大 学 第 三 医 院 )、郝 敏( 山 西医科大学第二医院)、洪颖(南京大学医学院附属鼓楼医院)、 胡 丽 娜( 重 庆 医 科 大 学 附 属 第 二 医 院 )、李 萍( 南 京 医 科 大 学 附 属 妇 产医院)、李淑霞(天津市中心妇产科医院)、梁旭东(北京大学人民 医院)、廖秦平(北京清华长庚医院)、刘朝晖(首都医科大学附属北 京妇产医院)、刘宏图(中国疾病预防控制中心病毒病预防控制 所)、刘宏伟(四川大学华西第二医院)、刘建华(上海交通大学医学 院附属第九人民医院)、刘晓巍(首都医科大学附属北京妇产医 院)、罗新(暨南大学附属第一医院)、宋静慧(内蒙古医科大学附属 医 院 )、宋 磊( 解 放 军 总 医 院 )、隋 龙( 复 旦 大 学 附 属 妇 产 科 医 院 )、 王 惠 兰( 河 北 医 科 大 学 第 二 医 院 )、熊 正 爱( 重 庆 医 科 大 学 附 属 第 二 医 院 )、薛 凤 霞( 天 津 医 科 大 学 总 医 院 )、薛 敏( 中 南 大 学 湘 雅 三 医 院 )、杨 慧 霞( 北 京 大 学 第 一 医 院 )、杨 兴 升( 山 东 大 学 齐 鲁 医 院 )、 杨 毅( 北 京 协 和 医 院 )、张 岱( 北 京 大 学 第 一 医 院 )、张 帝 开( 深 圳 大 学第三附属医院)、张淑兰(中国医科大学附属盛京医院)、郑波(北 京大学第一医院)、郑建华(哈尔滨医科大学附属第一医院)、 · 14 · 周 坚 红(浙江大学医学院附属妇产科医院) 利益冲突 所有作者均声明不存在利益冲突 参考文献 [1] Wang C, Fan A, Li H, et al. Vaginal bacterial profiles of aerobic vaginitis: a case‐control study[J]. Diagn Microbiol Infect Dis, 2020, 96(4): 114981. DOI: 10.1016/j. diagmicrobio.2019.114981. [2] Tao Z, Zhang L, Zhang Q, etal. The pathogenesis of Streptococcus anginosus in aerobic vaginitis[J]. Infect Drug Resist, 2019, 12: 3745‐3754. DOI: 10.2147/IDR. S227883. [3] Donders GG, Vereecken A, Bosmans E, et al. Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis[J]. BJOG, 2002, 109(1):34‐43. DOI: 10.1111/j.1471‐0528.2002.00432.x. [4] Sherrard J, Wilson J, Donders G, etal. 2018 European (IUSTI/WHO) International Union against sexually transmitted infections (IUSTI) World Health Organisation (WHO) guideline on the management of vaginal discharge [J]. Int J STD AIDS, 2018, 29(13): 1258‐1272. DOI: 10.1177/0956462418785451. [5] Scheffey LC, Rakoff AE, Lang WR. An unusual case of exudative vaginitis (hydrorrhea vaginalis) treated with local hydrocortisone[J]. Am J Obstet Gynecol, 1956, 72(1): 208‐211. DOI: 10.1016/s0002‐9378(16)37537‐8. [6] Gray LA, Barnes ML. Vaginitis in women, diagnosis and treatment[J]. Am J Obstet Gynecol, 1965, 92: 125‐136. DOI: 10.1016/0002‐9378(65)90113‐4. [7] Vieira‐Baptista P, Lima‐Silva J, Pinto C, etal. Bacterial vaginosis, aerobic vaginitis, vaginal inflammation and major Pap smear abnormalities[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(4): 657‐664. DOI: 10.1007/ s10096‐016‐2584‐1. [8] Donders GG, Gonzaga A, Marconi C, etal. Increased vaginal pH in Ugandan women: what does it indicate?[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(8): 1297‐1303. DOI: 10.1007/s10096‐016‐2664‐2. [9] Dermendjiev T, Pehlivanov B, Hadjieva K, etal. Epidemiological, clinical and microbiological findings in women with aerobic vaginitis[J]. Akush Ginekol (Sofiia), 2015, 54(9):4‐8. [10] Marconi C, Donders GG, Martin LF, etal. Chlamydial infection in a high risk population: association with vaginal flora patterns[J]. Arch Gynecol Obstet, 2012, 285(4):1013‐1018. DOI: 10.1007/s00404‐011‐2085‐5. [11] Bologno R, Díaz YM, Giraudo MC, et al. Importance of studying the balance of vaginal content (BAVACO) in the preventive control of sex workers[J]. Rev Argent Microbiol, 2011, 43(4): 246‐250. DOI: 10.1590/ S0325‐75412011000400002. [12] 田泉, 薛艳, 李娜, 等 . 4019 例妇科门诊不同症状患者阴道 微生态状况分析[J]. 中国微生态学杂志, 2013, 25(12): 1432‐1435. [13] Fan A, Yue Y, Geng N, et al. Aerobic vaginitis and mixed infections: comparison of clinical and laboratory findings [J]. Arch Gynecol Obstet, 2013, 287(2): 329‐335. DOI: 10.1007/s00404‐012‐2571‐4. [14] Geng N, Wu W, Fan A, et al. Analysis of the risk factors for aerobic vaginitis: a case‐control study[J]. Gynecol Obstet Invest, 2016,81(2):148-154. DOI: 10.1159/000431286. [15] 中华医学会妇产科学分会感染性疾病协作组 . 阴道微生态 评价的临床应用专家共识[J]. 中华妇产科杂志, 2016, 51(10):721‐723. DOI: 10.3760/cma.j.issn.0529‐567x.2016. 10.001. [16] Tempera G, Abbadessa G, Bonfiglio G, etal. Topical kanamycin: an effective therapeutic option in aerobic vaginitis[J]. J Chemother, 2006, 18(4): 409‐414. DOI: 10.1179/joc.2006.18.4.409. [17] Rumyantseva TA, Bellen G, Savochkina YA, et al. Diagnosis of aerobic vaginitis by quantitative real‐time PCR[J]. Arch Gynecol Obstet, 2016, 294(1): 109‐114. DOI: 10.1007/ s00404‐015‐4007‐4. [18] Donders G, Bellen G, Grinceviciene S, etal. Aerobic vaginitis: no longer a stranger[J]. Res Microbiol, 2017, 168(9‐10):845‐858. DOI: 10.1016/j.resmic.2017.04.004. [19] Donders GG, Ruban K, Bellen G. Selecting anti‐microbial treatment of aerobic vaginitis[J]. Curr Infect Dis Rep, 2015, 17(5):477. DOI: 10.1007/s11908‐015‐0477‐6. [20] Paavonen J, Brunham RC. Bacterial vaginosis and desquamative inflammatory vaginitis[J]. N Engl J Med, 2018, 379(23):2246‐2254. DOI: 10.1056/NEJMra1808418. [21] 冯岩岩, 张蕾, 朱云珊, 等 . 头孢呋辛酯和克林霉素磷酸酯 阴道乳膏治疗单纯需氧菌性阴道炎效果评价[J]. 中国实用 妇科与产科杂志, 2018, 34(9):1055‐1057. DOI: 10.19538/ j.fk2018090126. [22] 尹璐瑶, 祝洪澜, 彭二玄, 等 . 需氧菌性阴道炎临床微生态研 究及治疗效果的探讨[J]. 中国妇产科临床杂志, 2014, 15(5): 417‐421. DOI: 10.13390/j.issn.1672‐1861.2014.05.010. [23] Wang C, Han C, Geng N, et al. Efficacy of oral moxifloxacin for aerobic vaginitis[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(1):95‐101. DOI: 10.1007/s10096‐015‐2513‐8. [24] 张岱, 林怀宪, 廖秦平, 等 . 治疗需氧菌阴道炎的随机对照 研究[J]. 中国妇产科临床杂志, 2017, 18(1):33‐35. DOI: 10.13390/j.issn.1672‐1861.2017.01.011. [25] Heczko PB, Tomusiak A, Adamski P, et al. Supplementation of standard antibiotic therapy with oral probiotics for bacterial vaginosis and aerobic vaginitis: a randomised, double‐blind, placebo‐controlled trial[J]. BMC Womens Health, 2015, 15: 115. DOI: 10.1186/s12905‐015‐0246‐6. [26] 王慧慧, 夏军, 董梦婷, 等 . 红核妇洁洗液治疗需氧菌性阴 道炎的疗效研究[J]. 中国实用妇科与产科杂志, 2020, 36(5):474‐477. DOI: 10.19538/j.fk2020050121. [27] 刘朝晖, 董悦 . 需氧菌阴道炎菌群及治疗效果的临床研究 [J]. 现代妇产科进展, 2009, 18(11):832‐835. [28] Han C, Wu W, Fan A, et al. Diagnostic and therapeutic advancements for aerobic vaginitis[J]. Arch Gynecol Obstet, 2015, 291(2):251‐257. DOI: 10.1007/s00404‐014‐3525‐9. [29] 中华医学会妇产科学分会感染性疾病协作组 . 细菌性阴道 病诊治指南(2021 修订版)[J]. 中华妇产科杂志, 2021, 56(1): 3‐6. DOI: 10.3760/cma.j.cn112141‐20200717‐00583. [30] Han C, Li H, Han L, etal. Aerobic vaginitis in late pregnancy and outcomes of pregnancy[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(2):233‐239. DOI: 10.1007/ s10096‐018‐3416‐2. [31] Donders GG, Van Calsteren K, Bellen G, et al. Predictive value for preterm birth of abnormal vaginal flora, bacterial vaginosis and aerobic vaginitis during the first trimester of pregnancy[J]. BJOG, 2009, 116(10): 1315‐1324. DOI: 10.1111/j.1471‐0528.2009.02237.x. 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 ??
闫丽隽 主任医师 山西省肿瘤医院 妇科4019人已读 - 就诊指南 混合性阴道炎诊治
中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 · 15 · ·专家共识· 混合性阴道炎诊治专家共识(2021 版) 中华医学会妇产科学分会感染性疾病协作组 通信作者:刘朝晖,首都医科大学附属北京妇产医院妇科 100026,Email: 23662161@qq.com 【摘要】 混合性阴道炎是由两种或两种以上的致病微生物导致的阴道炎症,在临床上比较常见, 其较单一阴道炎症诊治困难,且常伴随着复杂阴道微生态环境的存在。本专家共识针对 4 种常见的 阴道炎症(细菌性阴道病、阴道毛滴虫病、外阴阴道假丝酵母菌病和需氧菌性阴道炎)而制定。混合性 阴道炎有症状不典型、病程较长和易复发等特点。诊断时多采用阴道微生态检测方法,诊断要点: (1)同时存在至少两种病原体或同时满足两种或以上阴道炎症的诊断标准;(2)同时存在两种或以上 阴道炎症相应的症状和体征,需要同时药物治疗。治疗目标为采用综合性用药方案,杀灭病原体,保 护阴道有益菌群并增强其功能。治疗原则为针对不同病原,选择规范的抗菌药物,尽量减少不必要的 抗菌药物的使用;建议除了对于各种感染的治疗外,强调对于阴道微生态失调的纠正。 ?混合性阴道炎(mixed vaginitis)是由两种或两 种以上的致病微生物导致的阴道炎症[1‐3]。 混合性阴道炎较单一阴道炎症诊治困难。混 合性阴道炎常伴随着复杂阴道微生态环境的存在, 若混合感染未得到及时、正确的诊治,易导致感染 反复发作和治疗失败,以及长期的阴道微生态失 调,进而带来很高的卫生经济学负担。 混合性阴道炎缺乏高质量的流行病学数据、临 床表现多样且不典型、实验室检查手段参差不齐, 提高对混合性阴道炎的重视,及时、正确治疗,纠正 微 生 态 失 调 ,对 维 护 女 性 生 殖 健 康 十 分 必 要 [ 2 ,4 ‐ 5 ] , 因此制订本专家共识非常必要且具有重要意义。 一、流行病学 1. 混合性阴道炎的发病率:根据病原体的不 同 ,阴 道 感 染 性 疾 病 可 分 为 1 0 余 种 [ 1 ] 。 其 中 ,细 菌 性 阴 道 病(bacterial vaginosis,BV)、阴 道 毛 滴 虫 病 (trichomoniasis)、外阴阴道假丝酵母菌病 (vulvovaginal candidiasis,VVC)和需氧菌性阴道炎 (aerobic vaginitis,AV)较为常见[1‐2]。 本专家共识主要针对上述 4 种常见的阴道炎 症的混合感染。 混合性阴道炎在临床上比较常见[6‐7],但缺乏 高质量的流行病学数据。10 年来我国各地区混合 性阴道炎的发病率总体波动在7.33%~56.80%[8‐19]。 既往的研究报道混合性阴道炎中 VVC+BV 的发病 率最高(20.95%~74.89%),而加入 AV 诊断后的研 究均提示 AV 相关的混合感染发病率最高,AV+BV 的发病率为 37.14%~55.34%[11,14,19],AV+VVC 的发 病率为 50.91%[18],AV+阴道毛滴虫病的发病率为 29.71%[10]。国外研究报道 BV+阴道毛滴虫病最常 见(37.8%),其 次 为 BV+VVC(14.9%)及 BV+VVC+ 阴道毛滴虫病(4.1%)[20]。 文献报道的混合性阴道炎的发病率和类型不 一,可能与下列因素有关:(1)观察的病原体种类不 尽相同;(2)不同地区、种族人群中病原体的暴露率 不同;(3)不同研究单位的实验技术、设备、研究人 员的水平存在一定的差异;(4)混合感染的诊断目 前缺乏统一明确的标准,一些阴道炎症不符合现有 的任何诊断标准而无法归类;(5)部分临床医师缺 乏对混合性阴道炎的认识,仅凭临床经验决定行某 种病原体的检查,常遗漏混合性阴道炎的病原体[4]。 2. AV 的诊治需要得到进一步重视:AV 相关的 混合感染数量、比率远高于单纯 AV 感染[21‐23]。国 内的流行病学数据显示,AV 在混合性阴道炎的发 ?DOI:10.3760/cma.j.cn112141-20200603-00472 收稿日期 2020-06-03 本文编辑 沈平虎 引用本文:中华医学会妇产科学分会感染性疾病协作组 . 混合性阴道炎诊治专家共识(2021 版)[J]. 中华 妇产科杂志, 2021, 56(1): 15-18. DOI: 10.3760/cma.j.cn112141-20200603-00472. · 16 · 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 生中起到了不可忽视的作用。这可能与 AV 患者阴 诊:(1)悬滴法:在阴道分泌物中找到阴道毛滴虫; 道pH值升高,阴道酸性环境破坏以及AV相关的阴 (2)核酸扩增试验:是诊断阴道毛滴虫病的“金标 ?道 黏 膜 炎 症 较 重 , 有 利 于 其 他 病 原 体 繁 殖 有 关 。 3. 外阴、子宫颈的感染:在关注各种阴道炎症 混合感染的同时,子宫颈、阴道同时存在感染的问 题也需要被关注。如外阴单纯疱疹病毒2型 (HSV‐2)、子宫颈沙眼衣原体(chlamydia trachomatis, CT)、淋病奈瑟菌(neisseria gonorrhoeae,NG)、支原 体(mycoplasma)及 HPV 等病原体的感染都可能与 阴道炎症同时存在,且往往子宫颈感染症状隐匿, 大大增加了诊断的复杂性,临床医师在正确诊断、 规范治疗混合性阴道炎的同时对外阴、子宫颈的上 述病原体的联合感染也应加以考虑。 二、临床特点 1. 混合性阴道炎的症状不典型:混合性阴道炎 的患者,临床主要表现为分泌物异常和(或)外阴瘙 痒。病原体不同,分泌物的颜色、性状、气味也不同。 阴道炎患者中,单一感染与混合感染均会出现 瘙痒、黏膜充血、分泌物异常、白带增多[19],而混合 感染者比单一感染者更多表现出阴道灼痛症状增 加、清洁度更差、阴道 pH 值偏高、乳杆菌减少。 2. 混合性阴道炎的病程较长:单一感染的阴道 炎患者 1 个月的转阴率远大于混合性阴道炎者,混 合性阴道炎的转阴时间集中在 2 个月或 3 个月[5]。 3. 混合性阴道炎易于复发:混合感染的复发率 远大于阴道单一感染。单纯 BV、单纯 VVC 治疗后 的复发率均<10%,而BV+VVC混合感染的复发率 在 4 0 % 以 上 [ 5 ,2 4 ]。 三、诊断 阴道微生态检测已经成为诊断各种阴道炎症 的最常用方法。2016 年,中华医学会妇产科学分 会感染性疾病协作组推出的《阴道微生态评价的临 床应用专家共识》[25]应当作为混合性阴道炎诊断的 规范性标准。 采用形态学检测(阴道分泌物涂片革兰染色油 镜镜检或病原体培养)及功能学检测(阴道微生物 的代谢产物及酶的活性)相结合,有助于同时诊断 多种阴道炎症。也可应用各种阴道炎症的诊治规 范[25‐29]逐一诊断。 1. 阴道毛滴虫病:可有阴道分泌物增多伴异 味,分泌物黄绿色,伴有外阴瘙痒、灼热感等刺激症 状,并可出现性交困难、排尿困难、尿频、下腹痛等。 查体可见外阴阴道红斑、水肿、有泡沫的黄灰或绿 色的阴道分泌物、pH 值增高。任何 1 项阳性即可确 准 ” , 诊 断 的 敏 感 性 和 特 异 性 均 超 过 9 5 % ;( 3 ) 阴 道 毛滴虫培养:也是诊断阴道毛滴虫病的“金标准”, 其敏感性为 75%~96%,特异性高达 100%。 2. VVC:(1)悬滴法:10%KOH 镜检,菌丝阳性 率 70%~80%。(2)涂片法:革兰染色法镜检,菌丝阳 性率 70%~80%。(3)培养法:复发性 VVC 或有症状 但多次镜检阴性者,应采用培养法诊断,同时进行 药物敏感试验。 3. BV:(1)Amsel 标准:下列 4 项临床特征中至 少 3 项阳性可诊断为 BV:线索细胞阳性,胺试验阳 性,阴道 pH 值>4.5,阴道分泌物呈均质、稀薄、灰白 色;其中线索细胞阳性必备。(2)阴道分泌物涂片革 兰染色 Nugent 评分≥7 分诊断为 BV。 4. AV:有黄色阴道分泌物、分泌物异味、外阴 烧灼感或刺痛、性交痛等,查体可见阴道黏膜红肿、 溃疡或一定程度的阴道黏膜萎缩等;AV 评分≥3 分。 5. 混合性阴道炎诊断要点[3]:(1)同时存在至 少两种病原体或同时满足两种或以上阴道炎症的 诊断标准;(2)同时存在两种或以上阴道炎症相应 的症状和体征,需要同时药物治疗。 四、治疗 混合性阴道炎由于病原体的混合存在,在治疗 上存在以下特点[1,30‐31]: (1)及时、准确的诊断是治疗的基础; (2)缺乏统一的治疗规范,治疗需个体化; (3)症状缓解后易反复发作; (4)比单一阴道炎症的治疗时间长; (5)药物治疗的同时需要管理性伴、强调随访, 建立整体治疗方案。 1. 混合性阴道炎的治疗目标:混合性阴道炎的 治疗目标为采用综合性用药方案,杀灭病原体,保 护阴道有益菌群并增强其功能[1]。 2. 混合性阴道炎的治疗原则:混合性阴道炎的 治疗原则为针对不同病原体,选择规范的抗菌药 物,尽量减少不必要的抗菌药物的使用,以减少药 物毒副作用、同时防止耐药率升高[2]。对于混合感 染的治疗目前国内外均无统一的治疗及随访方案, 原则上参照每种单纯性阴道炎的治疗及随访,根据 不同病原体的组合而选用不同抗菌药物的联合应 用[31‐32],建议根据患者情况个体化选择治疗药物。 应当了解混合性阴道炎的多种病原体之间的相关 性,避免治疗中出现病原体之间“此消彼长”。 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 · 17 · ?(1)包含 VVC 的混合性阴道炎的治疗方案建 议包含抗真菌药物[27]。 (2)包含 AV 的混合性阴道炎,针对 AV 可能的 病因可以采用下列药物进行局部和(或)全身治疗: 抗菌药物(针对感染),类固醇激素(针对免疫炎症 反应),乳杆菌(恢复阴道微生态环境),雌激素(针 对阴道黏膜萎缩)[33]。 (3)包含 BV 的混合性阴道炎,需注意是否合并 性传播感染,因为 BV 是性传播疾病的关键危险因 素之一,BV 的治疗是性传播疾病一级预防的重要 措施。因此即使症状不明显,仍建议针对 BV 选择 抗厌氧菌的药物进行治疗,并恢复育龄期妇女阴道 微生物群以降低其他生殖道病原体的易感性[28,34]。 (4)包含阴道毛滴虫病的混合性阴道炎属于性 传播感染,主要采用硝基咪唑类药物治疗,并需要 治疗性伴[26]。 (5)建议除了对于各种感染的治疗外,强调对 于微生态失调的纠正。 3. 混合性阴道炎的治疗顺序:由于混合性阴道 炎的症状存在不典型性,对于症状体征不明显的患 者宜根据引起症状的主要病原体的种类依次治疗。 如 VVC 或阴道毛滴虫病的相关症状明显者,可先 进行抗真菌或抗滴虫治疗,改善症状。对于这类患 者,需要特别关注阴道微生态的恢复情况,应加强 随访,随访时重点了解症状和体征有无纠正、实验 室检查的变化,再治疗其他病原体[5]。混合性阴道 炎的治疗顺序选择问题仍需更多大样本量的临床 试验、更高质量的循证医学证据。 4. 常见混合感染的治疗方案: (1)BV+VVC 或阴道毛滴虫病+VVC[1]:口服硝 基咪唑类+局部抗真菌药物;局部联合给药(硝基咪 唑类+抗真菌药物如克霉唑等);口服联合给药(硝 基咪唑类+抗真菌药物如氟康唑等)。 (2)BV+阴道毛滴虫病[1]:可选择硝基咪唑类药 物口服,疗程 1 周,或者单次口服+阴道给药。 国 外 的 局 部 联 合 治 疗 方 案 :B V :甲 硝 唑 ( 2 5 0 ~ 750 mg)、替硝唑、克林霉素;阴道毛滴虫病:甲硝唑 (500~750 mg)、替硝唑;VVC:克霉唑、咪康唑(100~ 200 mg)、制霉菌素或氟康唑。 (3)AV 相关的混合感染[1]:AV+BV 或 AV+阴道毛 滴虫病:口服硝基咪唑类+抗需氧菌药物等;AV+VVC: 口服或局部抗真菌药物+口服抗需氧菌药物等。 混合性阴道炎的治疗方案并不局限于以上方 案,医师可以个体化选择其他治疗方法。根据选择 的治疗方案决定治疗的疗程。 5. 针对混合性阴道炎易复发的处理:混合性阴 道炎易于复发,增加了治疗难度[5]。对存在多次复 发的包含 BV 的混合性阴道炎患者,建议 BV 治疗的 疗程延长[35]。对包含VVC复发或再发的混合性阴 道炎患者,推荐克霉唑阴道片强化后半年内定期巩 固的治疗方案[27],能显著降低 VVC 的复发率[36]。 混合性阴道炎疗效不理想、易复发的另一原因 是治疗中忽视了阴道微生态平衡的调整[1,31],因此 需要注意阴道微生态的改善。 6. 混合性阴道炎的阴道微生态治疗:混合感染 往往意味着阴道内微生态环境更加复杂,应强调对 于微生态失调的纠正。 约 30% 的阴道炎患者甚至在完整综合的评估 后依然无法明确诊断[37],对于这些阴道炎患者的治 疗需要更加重视阴道微生态环境的恢复。中医药 及微生态制剂在治疗混合性阴道炎、恢复阴道微生 态环境中有一定的作用。 采用乳杆菌等微生态制剂,与抗菌药物联合应 用,及时补充阴道乳杆菌,恢复阴道微生态平衡;这 种联合治疗对巩固疗效及预防复发有重要作用[1]。 7. 混合性阴道炎的疗效评价:除了症状、阳性 体征和病原体均消失,阴道微生态的评估也是关键 指标;如不能进行阴道微生态评价,需阴道清洁度 和阴道 pH 值达到正常。 执笔专家:刘朝晖(首都医科大学附属北京妇产医院)、薛凤霞(天 津医科大学总医院)、廖秦平(北京清华长庚医院) 本共识由中华医学会妇产科学分会感染性疾病协作组成员共同讨 论制定,协作组专家成员(按姓氏拼音排序):安瑞芳(西安交通大 学第一附属医院)、崔满华(吉林大学第二医院)、狄文(上海交通大 学医学院附属仁济医院)、丁岩(新疆医科大学第一附属医院)、 樊 尚 荣( 北 京 大 学 深 圳 医 院 )、耿 力( 北 京 大 学 第 三 医 院 )、郝 敏( 山 西医科大学第二医院)、洪颖(南京大学医学院附属鼓楼医院)、 胡 丽 娜( 重 庆 医 科 大 学 附 属 第 二 医 院 )、李 萍( 南 京 医 科 大 学 附 属 妇 产医院)、李淑霞(天津市中心妇产科医院)、梁旭东(北京大学人民 医院)、廖秦平(北京清华长庚医院)、刘朝晖(首都医科大学附属北 京妇产医院)、刘宏图(中国疾病预防控制中心病毒病预防控制 所)、刘宏伟(四川大学华西第二医院)、刘建华(上海交通大学医学 院附属第九人民医院)、刘晓巍(首都医科大学附属北京妇产医 院)、罗新(暨南大学附属第一医院)、宋静慧(内蒙古医科大学附属 医 院 )、宋 磊( 解 放 军 总 医 院 )、隋 龙( 复 旦 大 学 附 属 妇 产 科 医 院 )、 王 惠 兰( 河 北 医 科 大 学 第 二 医 院 )、熊 正 爱( 重 庆 医 科 大 学 附 属 第 二 医 院 )、薛 凤 霞( 天 津 医 科 大 学 总 医 院 )、薛 敏( 中 南 大 学 湘 雅 三 医 院 )、杨 慧 霞( 北 京 大 学 第 一 医 院 )、杨 兴 升( 山 东 大 学 齐 鲁 医 院 )、 杨 毅( 北 京 协 和 医 院 )、张 岱( 北 京 大 学 第 一 医 院 )、张 帝 开( 深 圳 大 学第三附属医院)、张淑兰(中国医科大学附属盛京医院)、郑波(北 京大学第一医院)、郑建华(哈尔滨医科大学附属第一医院)、 · 18 · 周 坚 红(浙江大学医学院附属妇产科医院) 利益冲突 所有作者均声明不存在利益冲突 参考文献 [1] 曹泽毅 . 中华妇产科学[M]. 3 版 . 北京:人民卫生出版社, 2014:1208‐1210. [2] 张帝开, 秦君璞 . 混合性阴道炎的诊治辨析[J]. 中国实用妇 科与产科杂志, 2017, 33(8):804‐806. DOI: 10.19538/j. fk2017080109. [3] Sobel JD, Subramanian C, Foxman B, etal. Mixed vaginitis‐more than coinfection and with therapeutic implications[J]. Curr Infect Dis Rep, 2013, 15(2):104‐108. DOI: 10.1007/s11908‐013‐0325‐5. [4] 岳莹利, 范爱萍, 张慧英 . 阴道混合感染研究进展[J]. 中国 实用妇科与产科杂志, 2012, 28(4):312‐314. [5] 陈素文, 申南 . 女性生殖道混合感染的临床诊断及治疗[J]. 中国妇幼保健, 2006, 21(10):1380‐1383. [6] Maladkar M, Tekchandani C, Dave U. Clindamycin, clotrimazole and tinidazole in mixed vaginosis: a“real world”clinical experience[J]. J Gynecol Obstet, 2015, 3(3): 49‐54. DOI: 10.11648/j.jgo.20150303.12. [7] 李永勇 . 女性生殖道感染的临床检验分析[J]. 中国地方病 防治杂志, 2017, 32(3):360. [8] 郭元元, 杨双双 . 1830 例女性阴道炎患者阴道微生态调查 [J]. 中国微生态学杂志, 2019, 31(3):339‐343. DOI: 10.13381/j.cnki.cjm.201903020. [9] 任传伟, 赵时梅 . 细菌性阴道炎合并妇科感染性疾病的临 床特点[J]. 中国病原生物学杂志, 2018, 13(4):421‐423. DOI: 10.13350/j.cjpb.180422. [10] 黄文军 . 青海高原地区 7325 例藏族妇女阴道分泌物五联 检测[J]. 中国微生态学杂志, 2018, 30(9):1079‐1081. DOI: 10.13381/j.cnki.cjm.201809021. [11] 段文冰, 刘芸, 鞠瑛, 等 . 阴道混合感染患者阴道微生态分 析[J]. 中国医药, 2018, 13(2):257‐261. DOI: 10.3760/cma. j.issn.1673‐4777.2018.02.024. [12] Wang H, Huang Z, Wu Z, et al. An epidemiological study on vaginitis in 6, 150 women of reproductive age in Shanghai[J]. New Microbiol, 2017, 40(2):113‐118. [13] 宋琦, 王晓莉, 熊万春 . 15860 例阴道分泌物检查结果及影 响因素分析[J]. 中国医学创新, 2017, 14(8):71‐74. DOI: 10.3969/j.issn.1674‐4985.2017.08.018. [14] 庞卓超, 叶翠芬, 聂润球, 等 . 428 例育龄期妇女阴道感染情 况调查[J]. 中国妇幼保健, 2017, 32(15):3623‐3626. DOI: 10.7620/zgfybj.j.issn.1001‐4411.2017.15.77. [15] 李金凤 . 2178 例女性阴道分泌物检测结果的临床分析[J]. 国际检验医学杂志, 2017, 38(14):1993‐1995. DOI: 10.3969/j.issn.1673‐4130.2017.14.050. [16] 曹敬荣, 王培昌, 闵嵘, 等 . 不同年龄段妇女阴道微生态状况 分析[J]. 中华实验和临床感染病杂志:电子版, 2016, 10(3): 311‐314. DOI: 10.3877/cma.j.issn.1674‐1358.2016.03.012. [17] 鲁燕飞, 叶菊花, 陈锐, 等 . 阴道分泌物的检测与感染结果 分析[J]. 中华医院感染学杂志, 2016, 26(12):2834‐2836. DOI: 10.11816/cn.ni.2016‐153449. [18] 田泉, 薛艳, 李娜, 等 . 4019 例妇科门诊不同症状患者阴道 微生态状况分析[J]. 中国微生态学杂志, 2013, 25(12): 1432‐1435. [19] 林怀宪, 薛辰, 王颖, 等 . 女性阴道混合感染 246 例临床分析 [J]. 中国妇产科临床杂志, 2010, 11(3):173‐175. DOI: 10.3969/j.issn.1672‐1861.2010.03.004. [20] Ozyurt E, Toykuliyeva MB, Danilyans IL, et al. Efficacy of 7‐day treatment with metronidazole+miconazole (Neo‐Penotran): a triple‐active pessary for the treatment of single and mixed vaginal infections[J]. Int J Gynaecol Obstet, 2001, 74(1):35‐43. DOI: 10.1016/s0020‐7292(01) 00388‐5. [21] Fan A, Yue Y, Geng N, et al. Aerobic vaginitis and mixed infections: comparison of clinical and laboratory findings [J]. Arch Gynecol Obstet, 2013, 287(2): 329‐335. DOI: 10.1007/s00404‐012‐2571‐4. [22] 田泉, 薛艳, 李娜, 等 . 需氧菌性阴道炎的临床及微生态特 征分析[J]. 实用妇产科杂志, 2014, 30(7):508‐511. [23] Wang ZL, Fu LY, Xiong ZA, et al. Diagnosis and microecological characteristics of aerobic vaginitis in outpatients based on preformed enzymes[J]. Taiwan J Obstet Gynecol, 2016, 55(1): 40‐44. DOI: 10.1016/j.tjog.2015.06.012. [24] 宋和存, 李慧, 赵杨, 等 . 细菌性阴道病和念珠菌性阴道炎的 临床分析[J]. 中国现代医学杂志, 2006, 16(8):1126‐1129. [25] 中华医学会妇产科学分会感染性疾病协作组 . 阴道微生态 评价的临床应用专家共识[J]. 中华妇产科杂志, 2016, 51(10):721‐723. DOI: 10.3760/cma.j.issn.0529‐567x.2016. 10.001. [26] 中华医学会妇产科学分会感染性疾病协作组 . 阴道毛滴虫 病诊治指南(2021 修订版)[J]. 中华妇产科杂志, 2021, 56(1): 7‐10. DOI: 10.3760/cma.j.cn112141‐20200717‐00582. [27] 中华医学会妇产科分会感染协作组 . 外阴阴道假丝酵母菌 病(VVC)诊治规范修订稿[J]. 中国实用妇科与产科杂志, 2012, 28(6):401‐402. [28] 中华医学会妇产科学分会感染性疾病协作组 . 细菌性阴道 病诊治指南(2021 修订版)[J]. 中华妇产科杂志, 2021, 56(1): 3‐6. DOI: 10.3760/cma.j.cn112141‐20200717‐00583. [29] Tempera G, Bonfiglio G, Cammarata E, etal. Microbiological/clinical characteristics and validation of topical therapy with kanamycin in aerobic vaginitis: a pilot study[J]. Int J Antimicrob Agents, 2004, 24(1):85‐88. DOI: 10.1016/j.ijantimicag.2003.12.013. [30] Workowski KA, Bolan GA, Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2015[J]. MMWR Recomm Rep, 2015, 64(RR‐03):1‐137. [31] 王敏, 王欣彦 . 常见阴道感染的抗生素应用[J]. 中国实用妇 科与产科杂志, 2012, 28(7):493‐496. [32] 张慧英, 薛凤霞 . 阴道炎性疾病治疗中的过度与不足[J]. 中 国实用妇科与产科杂志, 2011, 27(7):506‐509. [33] 李婷, 牛小溪, 刘朝晖 . 需氧菌性阴道炎临床治疗的研究进 展[J]. 中华妇产科杂志, 2016, 51(10):791‐794. DOI: 10.3760/cma.j.issn.0529‐567x.2016.10.019 [34] 张瑞, 桑佳特, 吴文湘, 等 . 无症状性 BV 的自然转归及其高 危因素分析[J]. 现代妇产科进展, 2015, 24(12):881‐884. [35] van Schalkwyk J, Yudin MH, Infectious Disease Committee. Vulvovaginitis: screening for and management of trichomoniasis, vulvovaginal candidiasis, and bacterial vaginosis[J]. J Obstet Gynaecol Can, 2015, 37(3):266‐274. DOI: 10.1016/S1701‐2163(15)30316‐9. [36] 向明, 王蕾, 林育华 . 制霉菌素栓剂与凯妮汀阴道给药治疗 复发性外阴阴道念珠菌病临床疗效和安全性分析[J]. 中外 医疗, 2014, 33(11):117‐118. [37] Anderson MR, Klink K, Cohrssen A. Evaluation of vaginal complaints[J]. JAMA, 2004, 291(11): 1368‐1379. DOI: 10.1001/jama.291.11.1368. 中华妇产科杂志 2021 年 1 月第 56 卷第 1 期 Chin J Obstet Gynecol, January 2021, Vol. 56, No. 1 ??
闫丽隽 主任医师 山西省肿瘤医院 妇科1366人已读 - 就诊指南 孕产妇如何补钙
实用妇产科杂志 2021 年 5 月第 37 卷第 5 期 Journal of Practical Obstetrics and Gynecology 2021 May Vol. 37,No. 5 文章编号: 1003-6946( 2021) 05-0345-03 中国孕产妇钙剂补充专家共识( 2021) 中华医学会围产医学分会,中国营养学会妇幼营养分会 ·345· ?中图分类号: R153. 1 文献标志码: B 钙是自然界中分布最广泛的元素之一,按元素在 人 体 的 构 成 比 ,钙 的 排 位 仅 次 于 氧 、碳 、氢 和 氮 ,列 第 五位,是人体含量最多的矿物元素[1]。钙是胎儿生长 发育所必须的营养物质,缺乏易导致胎儿发育不 良[2]。与普通人群相比,孕妇对钙的需求量是增加 的。孕期钙缺乏也会给母体带来多种危害,如近期的 腓肠肌痉挛和远期的骨质疏松等[3]。为指导孕妇的 钙营养保健及产科钙剂的规范应用,国际妇产科联盟 ( the International Federation of Gynecology and Obstet- rics,FIGO) 于 2015 年发布了关于青少年、孕前及孕期 女性的营养建议[4],世界卫生组织( World Health Or- ganization,WHO) 也分别于 2018 年和 2020 年对孕期 及孕前的钙剂补充给出了指导意见[5,6]。尽管中国营 养学会已于 2013 年修订了中国居民膳食钙参考摄入 量,但针对有特殊需求的人群,特别是有医学状况的 人群,尚缺乏有针对性的钙剂补充共识。此外,中国 居民,特别是汉族居民不饮奶的习惯致膳食钙摄入偏 低也提示对钙需要量较高的人群,如孕妇、乳母、儿童 青少年和老年合理钙补充是非常必要的。由于涉及 的人群众多,工作量太大,现就孕产妇人群,包括有不 同医学状况人群钙剂的规范补充,中华医学会围产医 学分会联合中国营养学会妇幼营养分会组织专家团 队 ,通 过 梳 理 文 献 ,评 估 证 据 强 度 ,形 成 此 共 识 ,以 期 为指导围产专业人员特别是基层妇幼保健相关专业 人员的钙营养临床实践提供有价值的能应用的专业 指导。 1 孕期钙的营养及生理需求 孕妇与一般人群相比存在独特的钙生理特点。 钙在母体和胎儿之间通过胎盘主动转运,这是胎儿骨 骼矿化必不可少的活动[7]。当孕期妇女钙缺乏时,母 体会动用自身骨骼中的钙维持血钙浓度并满足胎儿 骨骼生长发育的需要[8]。孕期缺钙,由于血清钙的降 低使神经兴奋性增高而出现腓肠肌痉挛; 孕妇骨骼中 的钙被动流失导致骨质疏松,也与孕妇腰腿疼痛和腓 肠肌痉挛有关; 尤其到了妊娠后期,胎儿生长速度加 快,骨骼矿化达高峰,更易造成孕妇钙营养不良[3]。 因此,对孕期钙的补充需要较孕前加强。 2方法 在共识形成过程中,召集了围产医学、妇产科学、临 床营养、妇幼营养等多学科专家代表,通过对收集的证 据进行评估,研讨主要框架,撰写初稿、审查及修订,最 终形成终稿。撰写初稿时,尽可能参考了 WHO 与 FI- GO 的推荐意见及充分结合中国营养学会营养素推荐 摄入量标准,同时又检索了国内外专业数据库中截至 2020 年 8 月相关证据。英文文献检索词包括 calcium、 pregnancy、preeclampsia 等,中文文献检索词包括钙、妊 娠、子痫前期等。参照 2013 年美国心脏协会( American Heart Association,AHA) 的证据等级( 见表 1) 和推荐意 见类别( 见表 2) ,对研究证据和推荐意见进行分类[9]。 表1 证据等级 表2 推荐意见 3 中国孕产妇的钙摄入营养状况 我国孕妇传统膳食中缺少富含钙食品( 奶类及其 制品) ,孕妇膳食钙摄入量仅达到推荐摄入量( recom- mended nutrient intake,RNI) 的 30% ~ 40%[3]。中国居 民营养与健康状况监测报告 2010 ~ 2013 年显示,中国 孕妇膳食钙的摄入量为 296. 1 mg/d,大城市、中小城 市、普通农村和贫困农村分别为 563.0 mg/d、 322. 5 mg/d、297. 7 mg/d 和 223. 3 mg/d; 孕妇乳类摄 入量中位数为 120. 1 g / d,其中城市为 192. 0 g / d,农村 为 64. 1 g / d,大城市孕妇乳类摄入量是普通农村孕妇 的 3. 2 倍,是贫困农村孕妇的 5. 3 倍[10]。中国城市孕 妇膳食钙和乳类摄入量均大于农村孕妇。 ?证据等级 表述 ?A 级 来自多个随机临床试验或荟萃分析的数据 ?B 级 单个随机对照研究,或非随机研究 ?C 级 专家共识或个案报道 ??推荐意见分类 表述 ?I类 有充足的证据证明和( 或) 普遍同意该建议或治 疗是有用或有效的 ?II类 对某一推荐意见或治疗的有效性有相互矛盾的证 据和( 或) 意见分歧的情况 ?IIa 类 证据偏向治疗 ?IIb 类 证据偏向不治疗 ?III类 有证据和( 或) 普遍同意该手段或治疗无效或在 某些情况下可能有害 ?通讯作者: 刘兴会,E-mail: xinghuiliu@ 163.com; 汪之顼,E-mail: zhixu.wang@ 126.com; 苏宜香,E-mail: suyx@ mail.sysu.edu.cn; 漆洪波,E-mail: qi- hongbo728@ 163.com 实用妇产科杂志 2021 年 5 月第 37 卷第 5 期 Journal of Practical Obstetrics and Gynecology 2021 May Vol. 37,No. 5 ·346· 4 围产期孕妇钙剂补充的推荐建议 4. 1 普通孕妇钙剂补充的推荐建议 已经有随机对 照研究显示了孕产期钙补充有助于产后的骨骼恢复 以及减少其后代龋齿的数量。国内外营养学会及健 康组织对孕产期钙补充的推荐量有所不同。中国营 养学会《中国居民膳食营养素参考摄入量( 2013 版) 》推 荐,孕妇每日钙膳食 RNI 为: 孕早期( 妊娠未达 14 周) 800 mg,孕中晚期( 第 14 周以后) 及哺乳期 1000 mg 以 满足孕期钙的需要[1,2]。尽可能从富含钙的食物中获 取充足的钙; 当饮食中钙摄入不足时,可给予钙剂补 充[11]。 美国医学研究院( the Institute of Medicine,IOM ) 2011 年推荐: 孕妇每日钙膳食 RNI: 14 ~ 18 岁 1300 mg, 19 ~ 30 岁 1000 mg,31 ~ 50 岁 1000 mg[7]。2015 年FIGO 建议妊娠前、妊娠期和哺乳期的每日钙膳食 RNI 均为 1000~1300 mg[4]。 对于普通孕妇,推荐从孕中期开始每天补充钙剂 至少 600 mg 直至分娩,有利于产后骨密度增加与骨 骼恢复( I类推荐,B 级证据) 。 维生素 D 与钙的吸收密切相关,但尚无明确证据 证明维生素 D 补充剂可以提高孕期质量或降低孕期 不良事件包括子痫前期的发生,故本共识暂不讨论孕 期维生素 D 的相关问题。 4. 2 不同风险下孕妇钙剂补充的推荐建议 4. 2. 1 低钙摄入地区普通孕妇的钙剂补充的推荐建 议 如前所述,中国孕妇的膳食钙摄入量具有明显的 地区性差异[10],因此低钙摄入地区包括中国部分城市 及所有郊县农村地区孕妇尤其是无饮奶习惯的孕妇 需要补充钙剂。WHO 的妊娠期间补钙预防子痫及其 并发症( 2018) 的推荐意见中指出,在膳食钙摄入量低 的人群中,建议孕妇每天补充钙( 1500 ~ 2000 mg 口服 元素钙) [5]。 4. 2. 2 妊娠期高血压疾病高危孕妇钙剂补充的推荐 建议 多项研究观察了补充钙剂与妊娠期高血压疾 病风险之间的关系,并得出相对一致的研究结果,补 充钙剂可临床获益。有 Meta 分析结果说明高剂量补 充钙剂( ≥1000 mg/d) 可能降低子痫前期风险,特别 是对于低钙饮食的女性[12]( A 级证据) 。我国 2019 年 由北京协和医院牵头发表的 1 项对 99535 例孕妇的横 断面调查研究显示,孕期每日补充钙剂 600 mg 可能是 妊娠期高血压疾病的潜在保护因子[13]( B 级证据) 。 WHO的妊娠期间补钙预防子痫及其并发症 ( 2018) 推荐意见中指出,在膳食钙摄入量低的人群 中,建议孕妇在孕期每天补充钙( 1500 ~ 2000 mg 口服 元素钙),以降低子痫前期的风险[5]。2019年欧洲心 脏病学会( European Society of Cardiology,ESC) 对围产 期高血压的管理意见中指出,对低钙饮食的孕妇,补 充高剂量钙剂( ≥1000 mg/d) 可降低子痫前期风 险[14]。而基于 2019 年发表于 Lancet 的研究,WHO 的 妊娠期间补钙预防子痫及其并发症( 2020) 推荐意见 中更新: 妊娠前( 备孕期) 补充钙以降低子痫前期风险 的证据仍不确定,在补钙依从性高于 80%人群中可能 有临床获益,仍需开展更多研究进行证实[6]。中华医 学会妇产科学分会妊娠期高血压疾病学组的《妊娠期 高血压疾病诊治指南( 2020) 》建议对于钙摄入低的人 群(<600mg/d),推荐口服钙补充量至少为 1000 mg/d,以预防子痫前期[15]。 结合以上证据,并与中华医学会妇产科学分会产 科学组制定《孕前和孕期保健指南( 2018) 》[16]推荐一 致: 对所有孕妇,推荐从妊娠前或孕前期开始每日补 充钙剂至少 600 mg 直至分娩,有利于产后骨密度增加 与骨骼恢复( I类推荐,B 级证据) ,同时可能是避免 妊娠期高血压疾病的潜在保护因子( IIa 类推荐,B 级 证据) ; 对于妊娠期高血压疾病高危风险孕妇( 如低钙 摄入地区包括中国部分城市及所有郊县农村地区孕 妇、高龄妊娠≥40 岁等) ,结合上述 Meta 分析证据并 以不超过中国营养学会制定的可耐受最高摄入量( tol- erable upper intake levels,UL) 为原则,推荐从孕中期开 始每日补充钙剂 1000 ~ 1500 mg 直至分娩,以达到预防 子痫前期或妊娠期高血压疾病的获益(I类推荐,A 级证 据) 。 4. 2. 3 双胎妊娠孕妇钙剂补充的推荐建议 在双胎 妊娠中,胎儿对钙的需求量增加,并且增加了子痫前 期的基线风险[17]。有研究显示,双胎妊娠女性的骨代 谢变化与单胎妊娠不同,双胎妊娠女性通过早期和大 幅度增加骨转换标志物以满足妊娠期间胎儿对钙的 高需求[18]。2009 年美国妇产科医师协会( American College of Obstetricians and Gynecologists,ACOG) 在改 善双胎妊娠结局的最佳营养综述中指出,双胎妊娠增 加了早产、低出生体质量和胎儿生长受限的风险,对 于双胎妊娠,ACOG 建议钙每日膳食 RNI 为 2000 ~ 2500 mg[17]。 结合上述证据并以不超过中国营养学会制定的 UL 为原则,考虑到双胎妊娠增加了早产、低出生体质 量和胎儿生长受限的风险,对于所有双胎妊娠的孕 妇,谨慎推荐孕期每日应补充钙剂 1000 ~ 1500 mg ( IIa 类推荐,C 级证据) 。 5总结 专家组总结评估了国内外关于孕妇钙剂的研究的 证据及获益,结合国内外产科及营养组织的推荐,并以 每日钙摄入总量( 膳食钙+钙剂) 不超过中国营养学会 制订的 UL 为原则,对中国围产期妇女钙剂补充和处方 形成如下核心推荐意见( 见表 3) ,以供产科医生参考。 ? 实用妇产科杂志 2021 年 5 月第 37 卷第 5 期 Journal of Practical Obstetrics and Gynecology 2021 May Vol. 37,No. 5 ·347· ?表 3 核心推荐意见 北京: 科学出版社,2014: 166,169-171,173,176. [2] 谢 幸,孔北华,段 涛 主编.妇产科学[M].9 版.北京: 人民卫 生出版社,2018: 43,57,70,83,86,95-96. [3] 董彩霞,荫士安.中国孕妇营养与健康状况十年回顾[J].中华预 防医学杂志,2018,52( 1) : 94-100. [4] Hanson MA,Bardsley A,De-Regil LM,et al.The International Federa- tion of Gynecology and Obstetrics ( FIGO ) recommendations on ado- lescent,preconception,and maternal nutrition: “Think Nutrition First”[J].Int J Gynaecol Obstet,2015,131( 4) : S213-S253. [5] WHO.WHO recommendation: Calcium supplementation during preg- nancy for the prevention of pre-eclampsia and its complications[M]. Geneva: World Health Organization,2018: 2-12. [6] WHO.WHO recommendation on Calcium supplementation before preg- nancy for the prevention of pre-eclampsia and its complications[M]. Geneva: World Health Organization,2020: 2-14. [7] Institute of Medicine.Dietary reference intakes for calcium and vitamin D[M]. Washington,DC: The National Academies Press,2011: 55 - 57,349. [8] 中国营养学会膳食指南修订专家委员会妇幼人群膳食指南修订 专家工作组.孕期妇女膳食指南[J].临床儿科杂志,2016,34 ( 11) : 877-880. [9] Jauch EC,Saver JL,Adams HP Jr,et al.Guidelines for the early man- agement of patients with acute ischemic stroke: a guideline for health- care professionals from the American Heart Association/American Stroke Association [J].Stroke,2013,44( 3) : 870-947. [10]王 杰.中国居民营养与健康状况监测[2010-2013]之十中国孕 妇乳母营养与健康状况[M].北京: 人民卫生出版社,2020: 34, 38,93. [11]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗 指南( 2017) [J].中华骨质疏松和骨矿盐疾病杂志,2017,10( 5) : 413-443. [12] Hofmeyr GJ,Lawrie TA,Atallah N,et al.Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems[J/ CD].Cochrane Database Syst Rev,2018,10( 10) : CD001059. [13]Zhuang C,Gao J,Liu J,et al.Risk factors and potential protective fac- tors of pregnancy-induced hypertension in China: a cross-sectional study[J].J Clin Hypertens( Greenwich) ,2019,21( 5) : 618-623. [14] Cífková R,Johnson MR,Kahan T,et al.Peripartum management of hy- pertension.A position paper of the ESC Council on Hypertension and the European Society of Hypertension [J / OL]. Eur Heart J Cardiovasc Pharmacother,[2019-12].https: / /doi.org/10.1093/ehjcvp/pvz082. [15]中华医学会妇产科学分会妊娠期高血压疾病学组.妊娠期高血压 疾病诊治指南( 2020) [J].中华妇产科杂志,2020,55( 4) : 227- 238. [16] 中华医学会妇产科学分会产科学组.孕前和孕期保健指南( 2018) [J].中华妇产科杂志,2018,53( 1) : 7-13. [17]Goodnight W,Newman R,Society of Maternal-Fetal Medicine.Optimal nutrition for improved twin pregnancy outcome[J]. Obstet Gynecol, 2009,114( 5) : 1121-1134. [18]Nakayama S,Yasui T,Suto M,et al.Differences in bone metabolism between singleton pregnancy and twin pregnancy[J].Bone,2011,49 ( 3) : 513-519. ( 收稿日期: 2021-03-29) ?序号 推荐意见 ?对于所有孕妇,均应建议首选摄入富含钙的食物, 以保证钙摄入量; 对于所有孕妇,每日钙的推荐摄 意见 1 入量为: 孕早期( 妊娠未达 14 周) 800 mg,孕中晚期 ( 第 14 周后) 1000 mg 及哺乳期 1000 mg,以满足孕 期钙的需要 ?意见 2 对于普通孕妇,推荐从孕中期开始每天补充钙剂至 少 600 mg 直至分娩,有利于产后骨密度增加与骨骼 恢复(I类推荐,B 级证据) ,同时可能是避免妊娠期 高血压疾病的潜在保护因子(IIa 类推荐,B 级证据) ?对于部分特殊孕妇( 如: 不饮奶的孕妇、低钙摄入地 区包括中国部分城市和所有郊县农村地区孕妇) , 意见 3 推荐孕期每日补充钙剂 1000 ~ 1500 mg 直至分娩, 以达到预防子痫前期或妊娠期高血压疾病的获益 ( I类推荐,A 级证据) ?意见 4 对于妊娠期高血压疾病高危风险孕妇,推荐从孕中 期开始每日补充钙剂 1000 ~ 1500 mg 直至分娩,以 达到预防子痫前期或妊娠期高血压疾病的获益( I 类推荐,A 级证据) ?意见 5 考虑到双胎妊娠时胎儿对钙的需求量增加,并且增 加了子痫前期的基线风险,对于所有双胎妊娠的孕 妇,谨慎推荐孕期每日应补充钙剂 1000 ~ 1500 mg ( IIa 类推荐,C 级证据) ?执笔专家: 刘兴会( 四川大学华西第二医院) ,苏宜香( 中 山大学公共卫生学院) ,汪之顼( 南京医科大学公共卫生学 院) ,漆洪波( 重庆医科大学附属第一医院) ,李涛( 四川大学华 西第二医院) 参与制订及讨论的专家: ( 按姓氏汉语拼音排序) : 陈敦金 ( 广州医科大学附属第三医院) ,程蔚蔚( 上海交通大学医学院 附属国际和平妇幼保健院) ,崔世红( 郑州大学第三附属医 院) ,段涛( 上海市第一妇婴保健院) ,冯玲( 华中科技大学同济 医学院附属同济医院) ,贺晶( 浙江大学医学院附属妇产科医 院) ,胡文胜( 杭州市妇产科医院) ,胡娅莉( 南京大学医学院附 属鼓楼医院) ,李光辉( 首都医科大学附属北京妇产医院) ,李 虹( 河北医科大学第二医院) ,李涛( 四川大学华西第二医院) , 李笑天( 复旦大学附属妇产科医院) ,李雪兰( 西安交通大学第 一附属医院) ,林建华( 上海交通大学医学院附属仁济医院) , 蔺莉( 北京大学国际医院) ,刘彩霞( 中国医科大学附属盛京医 院) ,刘俊涛( 中国医学科学院北京协和医院) ,刘兴会( 四川大 学华西第二医院) ,漆洪波( 重庆医科大学附属第一医院) ,苏 宜香( 中山大学公共卫生学院) ,孙静霞( 哈尔滨医科大学附属 第一医院) ,孙瑜( 北京大学第一医院) ,王少为( 北京医院) ,王 谢桐( 山东省立医院) ,王子莲( 中山大学附属第一医院) ,汪之 顼( 南京医科大学公共卫生学院) ,徐先明( 上海市第一人民医 院) ,颜建英( 福建省妇幼保健院) ,杨慧霞( 北京大学第一医 院) ,于康( 中国医学科学院北京协和医院) ,张卫社( 中南大学 湘雅医院) ,张为远( 首都医科大学附属北京妇产医院) ,张雪 芹( 厦门大学附属妇女儿童医院) ,赵扬玉( 北京大学第三医 院) ,邹丽( 华中科技大学同济医学院附属协和医院) 参考文献 [1] 中国营养学会.中国居民膳食营养素参考摄入量( 2013 版) [M].
闫丽隽 主任医师 山西省肿瘤医院 妇科304人已读 - 就诊指南 妊娠期如何运动
中华围产医学杂志 2021 年9 月第 24 卷第 9 期 Chin J Perinat Med, Sept. 2021, Vol. 24, No. 9 · 641 · 标 准·指 南·方 案 妊娠期运动专家共识(草案) 中国妇幼保健协会妊娠合并糖尿病专业委员会 中华医学会妇产科学分会产科学组 通信作者:杨慧霞,北京大学第一医院妇产科 100034,Email:yanghuixia@bjmu.edu.cn, 电话:010-83573246 【摘要】 运动作为健康生活方式的重要组成部分,在生命的各个阶段都具有维持和提高机体健 康水平的重要作用。妊娠期女性在围产期也建议保持适当的运动。目前,我国仍缺乏妊娠期运动方 面的专家共识。中国妇幼保健协会妊娠合并糖尿病专业委员会和中华医学会妇产科学分会产科学组 联合组织全国专家进行多次讨论和修改,同时查阅大量高级别证据的相关文献,并结合我国国情,在 广泛征求意见的基础上撰写本专家共识,以期为指导临床实践和妊娠期合理运动提供参考。 【关键词】 妊娠;运动;共识 基金项目:国家重点研发计划(2016YFC1000303) DOI:10.3760/cma.j.issn113903-20210713-00630 Expert consensus on exercise during pregnancy (draft) Professional Committee of Gestational Diabetes Mellitus, Chinese Maternal and Child Health Association; Obstetrics Subgroup, Society of Obstetrics and Gynecology, Chinese Medical Association Corresponding author: Yang Huixia, Department of Obstetrics and Gynecology, Peking University First Hospital, Beijing 100034, China, Email: yanghuixia@bjmu.edu.cn, Tel: 0086-10-83573246 【Abstract】 As an important part of a healthy lifestyle, physical activity plays an important role in maintaining and improving health in all stages of life. Pregnant women are also advised to maintain appropriate exercise throughout the perinatal period. At present, there is no expert consensus for physical activity throughout pregnancy in China. To provide a reference for guiding clinical practice and standardizing physical activity during pregnancy, the Professional Committee of Gestational Diabetes Mellitus, Chinese Maternal and Child Health Association, and the Obstetrics Subgroup, Society of Obstetrics and Gynecology, Chinese Medical Association organized a panel of experts to develop recommendations for physical activity during pregnancy by reviewing and evaluating relevant guidelines and high-quality evidence based on the present conditions in China. 【Key words】 Pregnancy; Exercise; Consensus Fund program: National Key Technologies R&D programme of China (2016YFC1000303) ??DOI:10.3760/cma.j.issn113903-20210713-00630 运动作为健康生活方式的重要组成部分,在生 命的各个阶段都发挥着维持和提高机体心肺功能, 并降低肥胖、糖尿病、高血压等慢性疾病风险的重 要作用。妊娠期女性也建议保持适当的运动。 目前,我国仍缺乏妊娠期运动相应的专家共 识。中国妇幼保健协会妊娠合并糖尿病专业委员 会和中华医学会妇产科学分会产科学组联合组织 全国专家进行多次讨论和修改,参考美国妇产科医 师 学 会(American College of Obstetricians and Gynecologists, ACOG)[1]、加 拿 大 妇 产 科 医 师 协 会 (Society of Obstetricians and Gynaecologists of Canada, SOGC)与 加 拿 大 运 动 生 理 学 学 会 (Canadian Society for Exercise Physiology, CSEP)[2]、 英国皇家妇产科医师学会(Royal College of Obstetricians and Gynaecologists, RCOG)[3-4] 等 相 关 指南,同时查阅大量高级别证据的相关文献,并结 合我国国情,在广泛征求意见的基础上撰写本专家 共识,以期为指导临床实践和妊娠期合理运动提供 参考。 本共识中的推荐等级的界定方法采用评估、制订 ? · 642 · 中华围产医学杂志 2021 年9 月第 24 卷第 9 期 Chin J Perinat Med, Sept. 2021, Vol. 24, No. 9 ?和 评 价(grades of recommendation,assessment, development,and evaluation, GRADE)方法进行推 荐强度分级。对于有良好和一致的科学证据支持 (有随机对照研究支持)的证据推荐等级为 A 级;对 于有限的或不一致的文献支持(缺乏随机对照研 究)的证据推荐等级为 B 级;主要根据专家共识的 证据推荐等级为 C 级。 一、妊娠期运动的益处 【推荐 1】 妊娠期运动风险低,且对母儿有 益 。( 推 荐 等 级 A ) 妊娠使女性机体发生解剖学和生理学的变化, 如腰椎前凸、关节负担加重、血容量增加、外周循环 阻力降低、肺储备能力下降等。妊娠期运动可通过 加强机体肌肉力量缓解疼痛、减轻关节水肿,增强 孕妇产程和分娩的体力,进而促进分娩、减少剖宫 产。同时,妊娠期运动还可改善孕妇情绪、减少抑 郁。更加重要的是,妊娠期适当运动不增加早产的 发生,并可以控制孕妇妊娠期体重过度增长,减少 胰岛素抵抗,以及预防妊娠期糖尿病(gestational diabetes mellitus, GDM)、子痫前期等妊娠并发症,从 而改善母儿预后,保障母婴安全和健康[5-10]。 二、妊娠期运动的适应人群及禁忌证 【推荐 2】 所有无妊娠期运动禁忌证的孕妇 均建议妊娠期进行规律运动。(推荐等级 A) 所有无妊娠期运动禁忌证的孕妇均建议在妊 娠期进行规律的运动[1-4,11-14]。专业人员(如妇产科 医生)在给予孕妇妊娠期运动建议之前应对孕妇的 身体状况进行充分评估。 妊娠期运动禁忌证包括严重心脏或呼吸系统 疾 病 ,重 度 子 痫 前 期 / 子 痫 ,未 控 制 的 高 血 压 、甲 状 腺疾病、1 型糖尿病,宫颈机能不全,持续阴道出 血,先兆早产,前置胎盘,胎膜早破,重度贫血,胎儿 生长受限,多胎妊娠(三胎及以上)等。有妊娠期运 动禁忌证的孕妇除日常活动外,不建议进行规律运 动。当孕妇存在轻中度心脏或呼吸系统疾病、复发 性流产史、早产史、严重肥胖、营养不良或极低体重 (体重指数<12 kg/m2)、双胎妊娠,以及癫痫且症状 控制不佳时,应在接受详细的专业评估,综合考虑 运动利弊后,由医生决定能否进行妊娠期运动,并 给予运动形式、频率、强度等建议。此外,当孕妇运 动时出现以下情况,应停止运动:阴道出血、规律并 有痛觉的宫缩、胎膜早破、呼吸困难、头晕、头痛、胸 痛、肌肉无力影响平衡等[1-4,11-14]。 三、妊娠期运动频率和持续时间 【推荐 3】 无运动禁忌证的孕妇,妊娠期应 每周进行5 d、每次持续30 min的中等强度运动。 (推荐等级 B) ACOG 建议无运动禁忌证的孕妇,每天或一周 至少 4 d 进行 20~30 min 的中等强度运动[1]。SOGC 与 CSEP 建议无运动禁忌证的孕妇,每周进行至少 150 min 中等强度运动,且一周至少 3 d [2]。美国健 康与人类服务部与 RCOG 同样建议健康孕产妇妊 娠期和产后每周进行至少 150 min 中等强度运动[4]。 丹麦和挪威关于妊娠期运动指南建议无运动禁忌 证的孕妇每天进行 30 min 中等强度运动,日本则建 议健康孕妇每周进行 2~3 次、每次 60 min 的中等强 度运动[4]。 研究证实,即使孕妇既往无运动习惯,母胎也 可耐受妊娠期 30 min 的中等强度运动[15]。研究证 实,每周进行 3 d 或以上,共计持续 150 min 的中等 强度运动,可显著降低 GDM、子痫前期及妊娠期高 血压疾病的发生风险[8]。且随着妊娠期运动频次、 持续时间及运动强度的相对增加,妊娠期获益增 加[5,8,16]。因此,本共识建议无运动禁忌证的孕妇,每 周进行 5 d、每次持续 30 min 的中等强度运动。 四、妊娠期运动形式/类型 【推荐 4】 妊娠期的运动形式包括有氧运动 及抗阻力运动。应避免有身体接触、有摔倒及受伤 风险的运动,以及在高海拔地区运动。(推荐等 级 C) 有氧运动及抗阻力运动均是妊娠期可接受的 运动形式。推荐的运动形式包括步行、游泳、固定 式自行车运动等[1-4,11-14]。同时,妊娠期应避免需要 有身体接触、快速移动等增加摔倒风险的运动,以 及容易引起静脉回流减少和低血压的仰卧位运 动[1-4,11-14]。尽管研究认为母体发热、进行热水浴或 桑拿等情况可能会增加胎儿神经管缺陷的风险,但 研究发现,运动尚不足以将母体核心体温提高到引 起并发症的程度[1]。但是妊娠期间,尤其是妊娠早 期,仍应避免引起母体体温过高的运动,如高温瑜 伽或普拉提[1]。此外,本共识建议孕妇每周至少进 行 3~5 d 的盆底肌肉训练,如凯格尔运动,以减少尿 失禁的风险[2,12]。 相较有氧运动,有关妊娠期抗阻力运动的研究 ?? 中华围产医学杂志 2021 年9 月第 24 卷第 9 期 Chin J Perinat Med, Sept. 2021, Vol. 24, No. 9 相对较少。但现有研究指出,妊娠期进行有氧运动 表 1 与抗阻力运动的结合运动较单独进行有氧运动更 评分 能改善妊娠结局[2]。 67 对于妊娠期运动地区海拔的限定,SOGC 与 8 · 643 · Borg 感知运动强度度量表[1] ?????自觉劳累分级 ?????非常非常轻松 ?????非常轻松 ?????比较轻松 ?????有点困难 ??????困难 ?????非常困难 ?????非 常非常困 难 ??CSEP 认为对于长期生活在低海拔地区的孕妇,其 在海拔 1 500~2 800 m 进行运动都是安全的[2], ACOG 则认为孕妇在海拔<1 800 m 地区运动是安 全的[1]。 五、妊娠期运动强度 【推荐 5】 孕期运动以中等强度为宜,即运动 时心率达到心率储备(heart rate reserve, HRR)的 60%~80%,或感知运动强度评分应为 13~14 分。 妊娠前无运动习惯的孕妇,妊娠期运动应从低强度 开 始 , 循 序 渐 进 。( 推 荐 等 级 C ) 多数学术组织建议妊娠期运动应达到中等强 度运动水平。而对于中等强度运动的量化,主要通 过以下 2 项指标:心率和自觉劳累分级(ratings of perceived exertion, RPE)。SOGC 与 CSEP 推荐当孕 妇运动时心率达到 HRR 的 40%~59% 则提示运动 强度达到中等强度水平;当心率达到 HRR 的 60%~ 80% 提示运动强度达到高强度水平。应避免孕期 剧烈的运动(心率>90% HRR)[2]。英国的指南认为 孕妇运动时的心率可达到 HRR 的 60%~90%,而对 于孕前久坐不动的孕妇在妊娠期运动的最高心率 以 HRR 的 60%~70% 为宜[3-4]。ACOG 认为,在监测 孕期运动强度时,使用基于 Borg 感知运动强度度量 表(表1)的RPE比心率参数更有效[1]。Borg量表有 从 6~20 分共 15 个等级评分,代表对劳累程度感受 的不同等级,其中 6 分代表“非常非常轻松”,20 分 代表“非常非常困难”。对于中等强度的运动,孕妇 的 RPE 评分应为 13~14 分,即其对自我运动强度的 感受为有点困难[1,11]。这一量化方式也是目前使用 最广泛的。此外,使用“谈话测试”是另一种衡量运 动程度的方法,即孕妇的主观感觉运动“有点困 难”,但仍可以在运动的时候与人交谈,则运动强度 对于其来说即不会过于轻松或过度剧烈[1-2,11-12]。 此外,对于妊娠前无规律运动的孕妇,建议妊 娠期从低强度运动开始,并逐渐加强运动强度。 六、安全注意事项 【推荐 6】 运动过程中应保持充足的水分供 给,穿宽松的衣服,避免在高温和高湿度环境中运 动 。( 推 荐 等 级 C ) 9 10 11 12 13 14 15 16 17 18 19 20 ?需要注意的是,如果孕妇在平躺运动时感到头 晕、恶心或不适,应调整运动体位,避免采用仰卧 位。在运动期间,孕妇应该保持充足的水分供给, 穿宽松的衣服,并避免在高温和高湿度环境中运 动。此外,在任何运动过程中应包含热身和舒缓放 松环节。最后,当孕妇在运动过程中出现任何不 适,都应停止活动并就医[1-4]。 七、特殊人群的相应注意事项 【推荐 7】 对于妊娠期运动强度明显超过指 南推荐的孕妇,应在专业人员的指导和监护下进行 运动;GDM 孕妇若使用胰岛素治疗,需警惕运动引 起的低血糖,尤其是孕早期;孕前肥胖孕妇应尽早 开始运动,并应从低强度、短持续时间开始,循序渐 进 。( 推 荐 等 级 C ) ACOG 建议对于孕前即有规律运动习惯的健 康且没有妊娠合并症的孕妇,在妊娠期亦可继续孕 前的运动,如慢跑和有氧运动,并不会产生不良妊 娠结局。但对于曾经进行竞技体育运动的孕妇或 者妊娠期运动强度明显超过指南推荐的孕妇,应在 专业人员的指导和监护下进行运动[1]。 GDM 孕妇若未使用胰岛素治疗,对于妊娠期 运动无额外注意事项。根据美国运动医学学会和 澳大利亚运动科学学会建议,GDM 孕妇妊娠期运 动间隔不应超过 2 d,因为运动对于胰岛素敏感性 的改善和葡萄糖被动摄取作用通常最多仅能维持 48 h[17]。但若 GDM 孕妇使用胰岛素治疗,需警惕运 动引起低血糖,尤其是孕早期[17-18]。 ? · 644 · 中华围产医学杂志 2021 年9 月第 24 卷第 9 期 Chin J Perinat Med, Sept. 2021, Vol. 24, No. 9 ?孕前肥胖孕妇的妊娠期运动应从低强度、短持 续时间开始,然后逐渐加强。相比孕中期开始对孕 前肥胖孕妇进行运动干预,孕早期甚至孕前即开始 运动干预,可能使其获益更大[9,19]。 八、产后运动 【推荐 8】 产后应尽早恢复运动锻炼并保持 规律的运动习惯。(推荐等级 B) 产后是建立和巩固健康生活方式的好时机。 产后恢复运动锻炼或培养新的运动习惯对维持终 身健康生活习惯很重要。有研究表明,产后保持规 律运动有助于产妇产后体重回降,并减少产后抑郁 的发生[20]。无医疗或手术并发症的女性应在分娩 后尽快恢复规律的运动锻炼。盆底运动可在产后 尽早进行。研究证实,规律的有氧运动可改善哺乳 霞(北京大学第一医院)、杨秋红(济南市妇幼保健院)、张眉花(太 原市妇幼保健院)、张小松(北京大学第一医院) 参 考 文 献 [1] ACOG Committee Opinion No. 650: Physical activity and exercise during pregnancy and the postpartum period[J]. Obstet Gynecol, 2015,126(6):e135-142. DOI: 10.1097/AOG.0000000000001214. [2] Mottola MF, Davenport MH, Ruchat SM, et al. 2019 Canadian guideline for physical activity throughout pregnancy[J]. Br J Sports Med, 2018, 52(21): 1339-1346. DOI: 10.1136/bjsports- 2018-100056. [3] Royal College of Obstetricians and Gynaecologists. Exercise in pregnancy(Statement No. 4)[EB/OL].(2015-02-04)[2021-06-01]. https://www. rcog. org. uk/en/guidelines-research-services/ guidelines/exercise-in-pregnancy-statement-no.4/. [4] Evenson KR, Barakat R, Brown WJ, et al. Guidelines for physical activity during pregnancy: comparisons from around the world[J]. Am J Lifestyle Med, 2014,8(2):102-121. DOI: 10.1177/ 1559827613498204. [5] Davenport MH, McCurdy AP, Mottola MF, et al. Impact of prenatal exercise on both prenatal and postnatal anxiety and depressive symptoms: a systematic review and meta-analysis[J]. Br J Sports Med, 2018, 52(21): 1376-1385. DOI: 10.1136/ bjsports-2018-099697. [6] Davenport MH, Kathol AJ, Mottola MF, et al. Prenatal exercise is not associated with fetal mortality: a systematic review and meta-analysis[J]. Br J Sports Med, 2019, 53(2): 108-115. DOI: 10.1136/bjsports-2018-099773. [7] Davenport MH, Ruchat SM, Sobierajski F, et al. Impact of prenatal exercise on maternal harms, labour and delivery outcomes: a systematic review and meta-analysis[J]. Br J Sports Med, 2019,53(2):99-107. DOI: 10.1136/bjsports-2018-099821. [8] Davenport MH, Ruchat SM, Poitras VJ, et al. Prenatal exercise for the prevention of gestational diabetes mellitus and hypertensive disorders of pregnancy: a systematic review and meta-analysis[J]. Br J Sports Med, 2018,52(21):1367-1375. DOI: 10.1136/bjsports-2018-099355. [9] Wang C, Wei Y, Zhang X, et al. A randomized clinical trial of exercise during pregnancy to prevent gestational diabetes mellitus and improve pregnancy outcome in overweight and obese pregnant women[J]. Am J Obstet Gynecol, 2017, 216(4): 340-351. DOI: 10.1016/j.ajog.2017.01.037. [10] Davenport MH, Meah VL, Ruchat SM, et al. Impact of prenatal exercise on neonatal and childhood outcomes: a systematic review and meta-analysis[J]. Br J Sports Med, 2018, 52(21): 1386-1396. DOI: 10.1136/bjsports-2018-099836. [11] Perales M, Artal R, Lucia A. Exercise during pregnancy[J]. JAMA, 2017,317(11):1113-1114. DOI: 10.1001/jama.2017.0593. [12] Nascimento SL, Surita FG, Cecatti JG. Physical exercise during pregnancy: a systematic review[J]. Curr Opin Obstet Gynecol, 2012,24(6):387-394. DOI: 10.1097/GCO.0b013e328359f131. [13] Albright E. Exercise during pregnancy[J]. Curr Sports Med Rep, 2016,15(4):226-227. DOI: 10.1249/JSR.0000000000000277. ?期妇女的心血管健康,并不影响泌乳量、乳汁成分 [1] 及婴儿生长 。 本共识总结了现有关于妊娠期运动推荐的基 本建议(表 1),旨在提高妊娠期女性生活质量、减 少妊娠并发症及改善生命健康。希望该共识有助 于医务工作者指导围产期女性运动实践,最终使母 儿两代实现健康获益。 执 笔 专 家 王 晨( 北 京 大 学 第 一 医 院 )、马 京 梅( 北 京 大 学 第 一 医 院)、杨慧霞(北京大学第一医院) 参与讨论专家(按姓氏拼音排序) 曹永平(北京大学第一医院)、 陈 丹 青( 浙 江 大 学 医 学 院 附 属 妇 产 科 医 院 )、郭 建 军( 首 都 体 育 学 院 )、隽 娟( 北 京 大 学 第 一 医 院 )、李 笑 天( 复 旦 大 学 附 属 妇 产 科 医 院)、刘斌(中山大学附属第一医院)、刘军(北京大学第一医院)、刘 兴会(四川大学华西第二医院)、马京梅(北京大学第一医院)、米阳 (西北妇女儿童医院)、单瑞芹(济南市妇幼保健院)、宋耕(北京大 学第一医院)、苏日娜(北京大学第一医院)、王晨(北京大学第一医 院 )、王 子 莲( 中 山 大 学 附 属 第 一 医 院 )、魏 玉 梅( 北 京 大 学 第 一 医 院)、颜建英(福建省妇幼保健院)、杨昕(北京大学第一医院)、杨慧 ?推荐等级 表 1 本共识推荐条款总结 推荐内容 A 妊娠期运动风险低,且对母儿有益 所有无妊娠期运动禁忌证的孕妇均建议妊娠期进行规律运动 B 无运动禁忌证的孕妇,每周进行 5 d、每次持续 30 min 的中等强度运动 产后应尽早恢复运动锻炼并保持规律的运动习惯 C 专业人员如妇产科医生,在给予孕妇妊娠期运动建议之前应对其身体状况进行充分的评估 孕期运动以中等强度为宜,即孕妇运动时心率达到心率储备的 60%~80%,或感知运动强度评分为 13~14 分 妊娠期应避免有身体接触、摔倒受伤风险及高海拔地区运动 妊娠前无规律运动的孕妇,妊娠期运动应由低强度开始,循序渐进 孕期运动强度明显超过指南推荐的孕妇,应在专业人员的指导和监护下进行运动 使用胰岛素治疗的妊娠期糖尿病孕妇,需警惕运动引起低血糖的发生,尤其是在孕早期 孕前肥胖孕妇应尽早开始运动,并应从低强度、短持续时间开始,循序渐进 运动过程中应保持充足的水分供给,穿宽松的衣服,并避免在高温和高湿度环境中运动 ?? 中华围产医学杂志 2021 年9 月第 24 卷第 9 期 Chin J Perinat Med, Sept. 2021, Vol. 24, No. 9 · 645 · ?[14] Gregg VH, Ferguson JE. Exercise in pregnancy[J]. Clin Sports Med, 2017,36(4):741-752. DOI: 10.1016/j.csm.2017.05.005. [15] Skow RJ, Davenport MH, Mottola MF, et al. Effects of prenatal exercise on fetal heart rate, umbilical and uterine blood flow: a systematic review and meta-analysis[J]. Br J Sports Med, 2019, 53(2):124-133. DOI: 10.1136/bjsports-2018-099822. [16] Davenport MH, Sobierajski F, Mottola MF, et al. Glucose responses to acute and chronic exercise during pregnancy: a systematic review and meta-analysis[J]. Br J Sports Med, 2018, 52(21):1357-1366. DOI: 10.1136/bjsports-2018-099829. [17] Savvaki D, Taousani E, Goulis DG, et al. Guidelines for exercise during normal pregnancy and gestational diabetes: a review of international recommendations[J]. Hormones (Athens), 2018, 17(4):521-529. DOI: 10.1007/s42000-018-0085-6. [18] Colberg SR, Castorino K, Jovanovi? L. Prescribing physical activity to prevent and manage gestational diabetes[J]. World J Diabetes, 2013,4(6):256-262. DOI: 10.4239/wjd.v4.i6.256. [19] Ma R, Schmidt MI, Tam WH, et al. Clinical management of pregnancy in the obese mother: before conception, during pregnancy, and post partum[J]. Lancet Diabetes Endocrinol, 2016,4(12):1037-1049. DOI: 10.1016/S2213-8587(16)30278-9. [20] Harrison CL, Brown WJ, Hayman M, et al. The role of physical activity in preconception, pregnancy and postpartum health[J]. Semin Reprod Med, 2016, 34(2): e28-37. DOI: 10.1055/ s-0036-1583530. (收稿日期:2021-07-13) (本文编辑:夏乐) ·外 刊 精 选· ?美国妇产科医师学会更新指南“多胎妊娠的管理”介绍 全球范围内多胎妊娠的发生率急剧上升。多胎妊娠与 高龄孕妇以及辅助生育技术等密切相关,导致相关围产期 并发症,如早产、胎儿异常、子痫前期、妊娠期糖尿病等发生 率明显升高。多胎妊娠早产儿发生相关并发症和死亡的风 险也明显高于足月新生儿。2021 年 6 月,美国妇产科医师 学 会(American College of Obstetricians and Gynecologists, ACOG)发表了第 231 号实践公告“多胎妊娠”,以替代 2016 年发布的第 169 号实践公告。现将该实践公告的推荐 条款和结论介绍如下。 一、A 级证据推荐及结论 1. 预防性使用宫缩抑制剂,包括长期使用 β2 受体兴奋 剂等不能改善多胎妊娠的预后,因此不推荐。 2. 孕酮不会降低未进行选择性减胎术的双胎或三胎妊 娠女性的自发性早产发生率,因此不推荐。 3. 建议对单绒毛膜双胎妊娠女性从约孕 16 周起每 2 周 进行 1 次超声评估,以监测双胎输血综合征。 二、B 级证据推荐及结论 1. 三胎妊娠孕妇中,行减胎术减至双胎者妊娠丢失、产 前并发症、早产、低出生体重儿、剖宫产和新生儿死亡的发 生率低于不行减胎术而继续妊娠的孕妇。减至双胎者上述 并发症的发生率与自然受孕的双胎孕妇相似。 2. 多胎妊娠应尽量在早孕期确定绒毛膜性。超声鉴定 的最佳时机为早孕期或者中孕早期。 3. 尚未证明常规预防性的干预措施,如宫颈环扎术、住 院监测、卧床休息、宫缩抑制剂和宫颈托等可以减少新生儿 相关并发症发生风险或死亡率。因此不推荐仅以多胎妊娠 这一指征进行上述干预。 4. 在没有禁忌证的情况下,在孕 24~34 周、且在 7 d 内 有分娩风险的患者,无论胎儿数量如何,都应接受 1 个疗程 的产前糖皮质激素治疗。 5. 无论胎儿数量如何,预计在孕 32 周前分娩者应使用 硫酸镁,以降低存活胎儿脑性瘫痪的风险和严重程度。 6. 有 1 次子宫下段横切口剖宫产史的女性再次妊娠时 为双胎妊娠的,如无其他禁忌证,可尝试阴道试产。 三、C 级证据推荐及结论 1. 任何年龄段的多胎妊娠患者都应常规筛查胎儿染色 体异常。 2. 对于无并发症的双绒毛膜双胎妊娠孕妇,可考虑从 孕 36 周起,每周进行 1 次产前胎儿监测。 3. 对于双绒毛膜双胎妊娠合并母体或胎儿并发症(如 胎儿生长受限)者,产前胎儿监测应个体化,并根据母胎情 况决定终止妊娠的时间和方式。 4. 对于无并发症的单绒毛膜单羊膜囊双胎,可考虑在 孕 32~34 周终止妊娠。 5. 单羊膜囊双胎妊娠应选择剖宫产终止妊娠,以避免 一胎儿娩出后,未娩出胎儿出现脐带相关的急性并发症。 6. 双羊膜囊双胎妊娠孕妇如孕周≥32 周,且先露胎儿为 头位,可考虑阴道试产,但需要由经验丰富的产科医师 操作。 7. 多胎妊娠孕妇行椎管内镇痛,便于进行内倒转或外 倒转术和臀位牵引术,有助于阴道分娩。 [1] 参考文献 Multifetal Gestations: Twin, triplet, and higher-order multifetal pregnancies: ACOG Practice Bulletin, Number 231[J]. Obstet Gynecol, 2021, 137(6): e145-162. DOI: 10.1097/AOG. 0000000000004397. (山东省临沂市中心医院妇产科 李飞、北京大学 第三医院妇产科 魏瑗 供稿) (收稿日期:2021-07-27) (本文编辑:李晔 张馨月) ?
闫丽隽 主任医师 山西省肿瘤医院 妇科355人已读 - 就诊指南 绝经后卵巢肿物诊治
中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 ·1021· 专家共识 DOI:10.19538/j.fk2021100110 绝经后卵巢肿物诊治的中国专家共识(2021 年版) 中国医师协会微无创医学专业委员会妇科肿瘤学组 中国优生科学协会生殖道疾病诊治分会 关键词:绝经后;卵巢肿物;诊断;治疗;专家共识 Keywords:postmenopausal;ovarian neoplasms;diagnosis;treatment;specialist consensus 中图分类号:R711.75 文献标志码:A ?1 背景 大约 7% 的女性在不同年龄段发现卵巢肿物,绝经后 卵巢肿物并非少见。美国女性绝经后 15 年内发生卵巢肿 物的概率为 18%;欧洲的一项大型筛查结果显示,自然绝经 后卵巢肿物的发生率为 21.2%[1]。由于目前缺少大规模的 调查数据,我国绝经后卵巢肿物的发生率尚不清楚,现有 数据表明,发生率在 5%~17%[2]。 随着全民健康意识的提高和超声技术的广泛应用,常 规体检所发现的绝经后卵巢肿物越来越多。医患由此要 面 临 两 个 问 题 :( 1 ) 是 否 需 要 干 预 和 处 理 。( 2 ) 如 何 鉴 别 和 排除恶性肿瘤可能。为规范绝经后卵巢肿物的精确评估 及合理干预,中国医师协会微无创医学专业委员会妇科肿 瘤学组与中国优生科学协会生殖道疾病诊治分会组织本 领域有关专家,通过检索文献,专题讨论后制定本共识,以 供参考。 本共识推荐级别及其代表意义见表 1。 表 1 本共识推荐级别及其代表意义 前的阶段,即出现卵巢功能衰退征兆至最后 1 次月经的阶 段。(4)绝经后期,绝经后 1 年直到生命终止的整个时期。 本共识仅针对绝经后期发现的卵巢肿物。 2 绝经后卵巢肿物的诊断 2.1 病史采集和体格检查 推荐及共识:详细询问病史, 注意有无卵巢恶性肿瘤的高危因素以及卵巢癌、乳腺癌或 结直肠癌家族史,过去 1 年内是否出现肠道易激症状。全 面的体格检查包括腹部检查以及妇科检查。若家族存有 明确致病性或可能致病的肿瘤易感基因突变,推荐遗传风 险 评 估( 2 A 类 推 荐 )。 解读:绝经后卵巢肿物首诊表现不尽相同,应详细询 问病史,包括既往诊疗病史及家族遗传史和临床症状。卵 巢肿物较小时,多无症状,常在妇科检查或常规查体时偶 然发现;较大的肿物可以表现为腹胀感,当肿物增大充满 盆腹腔时,则表现为压迫症状。少数绝经后卵巢肿物可因 扭转、破裂或出血等急腹症而就诊[3]。如短期内增长迅速 或压迫症状加重,要警惕恶性肿瘤的可能。 通过一般体检时的妇科检查发现卵巢肿物的敏感度 不高,这与医生的临床经验、检查手法、患者腹壁肥厚程 度、肿物大小、位置等诸多因素有关。卵巢肿物较小时,一 般不易获得阳性体征;大的肿物在妇科检查时,则可扪及 子宫一侧或双侧肿块,病例记录需描述肿物的位置、大小、 质 地 、边 界 、活 动 度 、有 无 触 痛 、直 肠 子 宫 陷 凹 是 否 有 结 节 或包块、是否合并腹水等[2]。恶性肿瘤常见的妇科检查特 征是不规则、固定、结节状肿物,可伴腹水。绝经后女性阴 道穹隆浅平,一般双合诊不易查及小的肿物或后穹隆转移 结节,强调运用三合诊检查。 遗传易感性是卵巢癌发病的危险因素之一,若家族存 有明确致病性或可能致病的肿瘤易感突变基因患者,需由 具有遗传知识背景的妇产科医师进行遗传风险评估。评 估内容包括完整的家族史、既往史、详细的体格检查以及 易感基因检测,若为遗传性肿瘤的高危患者,推荐转诊至 肿瘤遗传学专科门诊或遗传学专家,进行家族史采集、风 险评估和咨询,指导基因检测、肿瘤筛查以及是否采取降 ?推荐级别 1 类 2A 类 2B 类 3 类 代表意义 基于高级别临床研究证据,专家意见高度一致 基于低级别临床研究证据,专家意见高度一致;或基 于高级别证据,专家意见基本一致 基于低级别临床研究证据,专家意见基本一致 不论基于何种级别临床证据,专家意见明显分歧 ?根据 WHO 提出的绝经有关术语,将绝经分为:(1)绝 经前期,包括青春期发育到绝经,即绝经前的整个生育期。 (2)围绝经期,指 40 岁开始出现内分泌、生物学变化即伴随 临床表现及卵巢功能衰退的征兆,一直持续到最后 1 次 月经后 12 个月内。(3)绝经过渡期,从月经改变至最终月经 基金项目:国家自然科学基金(81972437) 通讯作者:张师前,山东大学齐鲁医院,山东 济南 250012, 电子信箱:r370112@126.com;薛凤霞,天津医科大学总医院妇产科 天津市女性生殖健康与优生重点实验室,天津 300052,电子信箱: xuefengxia@tmu.edu.cn ? ·1022· 风险的干预措施[4-5]。 2.2 临床表现及初步检查 推荐及共识:绝经后卵巢肿物 的临床表现不尽相同,出现急腹症时,要考虑卵巢肿物扭 转、破裂或出血可能。首选检查手段包括经阴道超声检查 和血清 CA125 测定。肿瘤体积较大、超出经阴道超声检查 范围时,需联合经腹超声检查(1 类推荐)。 解读:绝经后卵巢肿物可无特殊临床表现,或为偶然 发 现 。 往 往 因 以 下 几 种 情 况 被 发 现 :( 1 ) 因 急 性 下 腹 痛 考 虑 卵 巢 肿 物 扭 转 、 破 裂 或 出 血 。( 2 ) 绝 经 后 因 其 他 妇 科 疾 病,在例行妇科检查或健康查体时发现。(3)因其他内外科 疾病,影像学检查时意外发现。(4)因妇科或其他外科疾病 手术治疗时意外发现[2]。也可表现为绝经后腹胀、食欲下 降、腹痛、尿频尿急等相关症状[2]。 经阴道超声是首选影像学检查手段,超声检查鉴别良 恶性卵巢肿物的准确性与医生的专业技术水平有关,有经 验的超声专家或可将诊断范围缩小至组织学亚型[6]。超声 报告需记录肿物的形态以及超声特征,包括肿瘤的大小、 部位、形态、性质以及大致来源,通过测定血流阻力指数 (RI)和搏动指数(PI)评估恶性肿瘤的风险[6-7]。 2.3 血清学标志物检测 推荐及共识:CA125 可作为绝经 后卵巢肿物的初选血清肿瘤标志物,若与人附睾蛋白 4(hu? man epididymis protein 4,HE4)联合检测,特异度升高;其他 肿瘤标志物如 CA19-9、甲胎蛋白(AFP)、癌胚抗原(CEA)、 CA724、乳酸脱氢酶(LDH)、β-hCG 等可以协助诊断卵巢恶 性肿瘤,但不推荐多种肿瘤标志物串联检测用于最初评估 ( 2 A 类 推 荐 )。 解读:CA125 是初步评估绝经后卵巢肿物性质的血清 肿瘤标志物,虽在恶性肿瘤早期缺乏敏感性和特异性,但 可用以分流可疑恶性卵巢肿物,是初步判定卵巢肿物性质 的首选生物学标志物。影响绝经后卵巢肿物患者 CA125 水平的因素包括炎症、肌瘤以及子宫内膜异位症等[6]。 单一 CA125 检测对诊断卵巢良恶性肿瘤的敏感度和 特异度均较低,推荐与 HE4 联合检测或联合影像学检查[8]。 HE4 诊断卵巢癌的敏感度及特异度较 CA125 高,可提高约 10% 的卵巢癌检出率,两者联合检测较单一检测的特异度、 敏感度均明显升高[6,9-10]。 CA19-9 主要见于黏液性卵巢癌,联合其他标志物可用 于卵巢恶性肿瘤的筛查与鉴别[7]。CEA 和 CA19-9 与 CA125 结合,主要用于鉴别胃肠道或胰腺转移性肿瘤与原 发性卵巢恶性肿瘤[6]。其他肿瘤标志物如 AFP、CA724、 LDH、β-hCG、抑制素 B 等可协助判断卵巢恶性肿瘤的组织 学来源,但目前尚无足够证据表明,多种肿瘤标志物串联 检测评估绝经后卵巢肿物的优势,上述肿瘤标志物单独或 联合 CA125 检测时,并未提高检测的敏感度,因而不推荐 常规进行联合检测[2,8,11-12]。 性激素测定在卵巢肿物的诊断中也有重要价值。卵 巢支持细胞间质细胞瘤主要表现为雄激素分泌异常,当睾 中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 酮 水 平 升 高 ( > 3 . 4 7 n m o l / L ) 时 ,需 考 虑 分 泌 雄 激 素 的 卵 巢 肿瘤[7]。临床表现可疑卵巢支持细胞间质细胞瘤时,性激 素检测可作为临床诊断的佐证。部分卵巢颗粒细胞瘤、卵 泡膜细胞瘤表现为雌激素升高。 2.4 影像学检查 推荐及共识:不推荐 CT、MRI 和 PET- CT 作为绝经后卵巢肿物的初始检查手段。当高度可疑卵 巢恶性肿瘤或存在广泛腹腔转移时,推荐 CT、MRI 等影像 学检查。既往有恶性肿瘤病史者,PET-CT 可评估附件区 肿物是否为转移性肿瘤(2A 类推荐)。 解读:CT 评估卵巢肿物内部特征的作用有限,特异度 低,不推荐作为常规的初始检查手段。当临床特征、超声 检查以及肿瘤标志物提示有恶性肿瘤可能,或超声无法初 步判定肿物性质时,CT 可协助确定腹盆腔是否存在转移。 此外,CT 诊断非妇科来源的附件区肿物的敏感度高,能够 协助排除结直肠、胰腺、胃等原发腹腔肿瘤有无卵巢和 (或)大网膜转移,CT 扫描还可协助可疑原发输卵管-卵巢 癌 的 分 期 ,指 导 初 始 治 疗 方 案 [ 2 ,1 3 ] 。 标 准 化 C T 腹 膜 癌 指 数 (CT-PCI)是评估肿瘤扩散和腹膜受累的手段,但预测值较 低[14]。CT 检测肿瘤累及范围的特异度高,但敏感度较 低[15]。CT 优先用于排除多器官实质远处转移、继发性恶性 肿瘤的诊断[6]。 MRI 诊断卵巢肿物有较高的敏感度和特异度,能协助 确定附件区肿物的来源和性质;增强扫描特异度较高,若 肿物内实性成分有强化或腹水及腹膜有强化,则高度可疑 为恶性肿瘤[16]。单独应用MRI或与CT联合能够相对准确 预测是否存在腹膜转移[17-20]。不推荐 MRI 用于绝经后卵巢 肿物的初始检查[2]。 PET-CT 对绝经后无症状卵巢肿物的敏感度和特异度 不高,鉴别交界性肿瘤与良性肿瘤的诊断价值较低,不推 荐用于绝经后女性卵巢肿物的初始检查,也不推荐作为可 疑卵巢癌患者的诊断和初始分期[6,21]。有恶性肿瘤病史 者,PET-CT 可评估附件区肿物是否为转移性肿瘤[22]。 2.5 恶性肿瘤风险的评估 2.5.1 恶性肿瘤风险指数(RMI)和卵巢恶性肿瘤风险模型 (ROMA) 推荐及共识:RMI 评分系统可以协助判断卵巢 恶性肿瘤的风险,绝经后 RMI≥200 者需进一步行腹盆腔 CT 评估。ROMA 风险分层有利于卵巢肿物分层管理(2A 类推 荐)。 解读:单一方法评估绝经后卵巢肿瘤性质的特异度均 不理想,联合检测可以提高诊断的敏感度和特异度[7]。 RMI 是目前应用最广且最被大家所接受的评分系统[2]。结 合卵巢肿物的 3 项指标,即血清 CA125 水平、绝经状态 (menopausal status,M)和超声形态(ultrasound,U)进行计 算:RMI=U×M×血清 CA125 实测值。异常超声形态包括双 侧病变、多房囊肿、实性成分、转移病灶和腹水征。若超声 检查未发现上述异常,U=0;若为单个异常,U=1;若发现 2 个 及 以 上 的 异 常 表 现 ,U = 3 。 患 者 处 于 绝 经 前 ,M = 1 ;处 于 ? 中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 ·1023· 绝经后,M=3。绝经后 RMI≥200 者需行腹盆腔 CT 进一步评 估[2]。基于 RMI 的卵巢肿物良恶性鉴别流程见图 1。 图 1 基于 RMI 的卵巢肿物良恶性鉴别流程 ?ROMA 则是将 CA125、HE4 水平以及绝经状态相结合, 用于预测卵巢上皮性癌的发病风险[23]。ROMA 预测卵巢癌 具有较高的敏感度,可用于绝经后卵巢肿物的风险分层。 如排除交界性卵巢肿瘤和非上皮性恶性肿瘤,RMI 和 RO? MA预测绝经后女性附件肿物特异度相似[24-25]。 2.5.2 国际卵巢肿瘤分析组织(IOTA)、妇科影像报告和数 据 系 统 ( G I - R A D S ) 、卵 巢 附 件 报 告 与 数 据 系 统 ( O - R A D S ) 推荐及共识:(1)超声诊断模型可以鉴别卵巢肿物的性质 ( 2 A 类 推 荐 ) 。( 2 ) 超 声 诊 断 模 型 ( I O T A 简 易 标 准 或 A D N E X 模型)优于CA125、HE4水平以及ROMA,在鉴别良恶性肿 瘤方面具有优势(2B 类推荐)。(3)推荐使用 IOTA 简易标准 和 ADNEX 模型,两者优于包括 RMI 在内的其他评分系统 (2A 类推荐)。 解读:IOTA 基于逻辑回归分析,规范了卵巢肿瘤标准 化的超声术语,建立了判断卵巢肿瘤性质的不同预测模 型,通过对卵巢肿瘤的超声特征分析,提高卵巢肿瘤良恶 性的预测能力,达到同质化的诊断目的[6],根据是否存在 5 个良性和 5 个恶性超声特征评估恶性肿瘤风险,适宜于 80% 以上的附件区肿块,在欧美国家已广泛应用于临 床 [ 2 6 ]。 见 表 2 。 ?模型或评分系统类别 RMI 评分系统 IOTA 简易标准 ADNEX 风险模型 表 2 绝经后卵巢肿物术前诊断的主要模型与评分系统总结[27] 预测变量 CA125、绝经状态、超声形态(双侧病变、多房囊肿、实性成分、转移病灶和腹水) 良性特征:单房肿物,实性成分最大径线<7mm,伴声影,囊壁光滑的多房肿物, 最大径<10cm,无血流信号;恶性特征:不规则实性肿瘤,腹水,乳头状结构 ≥4 个,不规则多房实性肿瘤,最大径≥10cm,丰富血流信号 年龄(岁)、病变最大直径(mm)、实性成分最大直径(mm)、肿瘤内是否超过 10 个 囊腔、囊壁乳头数量、肿瘤是否有声影、是否合并腹水 评价 无风险估计,基于临床 风险估计,基于二元超声特征 风险估计,4 种恶性肿瘤亚型的 估计,基于临床和超声,避免 主观预测因素 ?IOTA 还建立了 ADNEX 模型,将非良性肿瘤划分为交 界性肿瘤、I期和II~IV期原发性癌和继发转移性肿瘤[28]。 预测指标包括年龄、病变最大直径、实性成分最大直径、肿 瘤内是否超过 10 个囊腔、囊壁乳头数量、超声下肿瘤是否 有声影、是否合并腹水等。ADNEX 模型对卵巢肿瘤鉴别价 值高于 RMI[6]。基于 IOTA 简易标准的卵巢肿物良恶性鉴 别流程见图 2。 GI-RADS 系统将恶性肿瘤风险量化为 5 类:GI-RADS 1,确定良性(估计恶性肿瘤概率 0);GI-RADS 2,良性可能 性大(估计恶性肿瘤概率<1%);GI-RADS 3,可能良性(估 计恶性肿瘤概率 1%~4%);GI-RADS 4,可疑恶性(估计恶 性肿瘤概率 5%~20%);GI-RADS 5,恶性可能性大(估计 恶性肿瘤概率>20%)。GI-RADS 系统联合 CA125 检测进 一步提高附件区高风险恶性肿瘤的鉴别水平[29-31]。 O-RADS 系统是对附件区病变描述的标准化术语,是 惟一包含所有风险类别及管理方案的分类系统[32-33]。O- RADS 系统共分 6 类:O-RADS 0,不完整的评估;O-RADS 1, 生 理 性 ;O - R A D S 2 ,几 乎 可 以 肯 定 良 性( < 1 % 的 恶 性 肿 瘤 风险);O-RADS 3,具有低度恶性风险的病变(1%~< 10%);O-RADS 4,具有中等恶性风险的病变(10%~< 50%);O-RADS 5,具有高度恶性风险的病变(≥50%)。回 顾性研究证实,O-RADS 系统与 GI-RADS 系统和 IOTA 简 易标准相比,具有较高的敏感度和相似的可靠性,特异度 无显著降低[34]。 ·1024· 中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 ?3 绝经后卵巢肿物处理 腔镜下全面分期手术[38-39]。术中严格遵循无瘤原则。 3.2.2 子宫是否需要切除 推荐及共识:绝经后卵巢良性 肿物的基本术式是双侧输卵管卵巢切除术,但临床决策需 高度个体化,若患者有切除子宫的指征及需求,也可行全 子宫加双侧输卵管卵巢切除术(2B 类推荐)。 解读:绝经后卵巢良性肿物若不存在子宫切除的手术 指征,可仅行双侧输卵管卵巢切除术,但临床决策需高度 个体化[2,39-40]。若有切除子宫需求、患者体能状况能够耐受 附加性手术,也可一并进行全子宫切除术。高龄、存在严 重内科合并症者,手术目的在于去除病灶、改善症状(扭 转、破裂、感染),也可仅行患侧附件切除术。对于有遗传 性肿瘤高危因素的绝经后卵巢良性肿物患者,建议行 BRCA1/BRCA2 基因检测及 Lynch 综合征筛查,有异常者建 议行全子宫加双侧附件切除术,同时对附件周围腹膜活 检、腹盆腔全面探查、腹腔冲洗液细胞学检查和可疑及腹 膜粘连部位活检[2]。 3.2.3 开腹手术 推荐及共识:绝经后卵巢肿物 RMI≥200, CT 检查、临床评估可疑恶性,或腹腔镜术中明确为恶性,推 荐开腹全面分期手术(2A 类推荐)。 解读:经综合评估而不排除卵巢恶性肿瘤(RMI≥200), 患者的体能状态可耐受手术时,推荐行开腹探查术,取腹 水或腹腔冲洗液细胞学检查,快速病理为恶性肿瘤则行全 面分期手术或肿瘤细胞减灭术。也可选择腹腔镜探查术, 活检确定肿瘤性质,腹腔镜评分评估手术切除至 R0 的概 率,指导进一步诊治。依据影像学及肿瘤标志物,交界性 肿瘤很难与良性和恶性肿瘤区分,大约 20% 的交界性卵巢 肿瘤超声检查表现为单纯肿物。鉴于冰冻切片在诊断交 界性肿瘤中的局限性,术前、术中应充分沟通,将冰冻病理 作为手术决策需十分谨慎,最终确诊需根据术后常规病理 检查。 3.1 保守观察 推荐及共识:CA125 正常、最大直径<5cm 的无症状单侧单房卵巢肿物,患者具有随访意向和随访条 件时,可以 CA125 及超声联合随访,推荐间隔时间 4~6 个 月。随访期间注意症状、卵巢肿物体积变化和(或)内部回 声改变以及 CA125 水平变化(2A 类推荐)。 解读:意外发现的绝经后卵巢肿物,重点在于鉴别卵 巢肿物的性质。经过综合评估恶性可能性较低者(RMI< 200),特别是不存在乳腺癌-卵巢癌家族史者,可选择随访 观察;最大直径<5cm的单侧单房肿物,不存在实性或乳头 状成分者,恶性肿瘤的风险<1%,半数以上可在3个月内 自行消失,借助血清CA125及超声检查定期随访,推荐随 访间隔为 4~6 个月,并根据临床表现及体征做出调 整[2,35-36]。当患者存在严重的内外科合并症,多学科评估具 有高风险围术期并发症时,更适于定期随访[2]。 3.2 手术治疗 3.2.1 腹腔镜手术 推荐及共识:无手术禁忌证、体能状 态可耐受手术、RMI<200 的患者可以选择腹腔镜手术,术 者应具有丰富的腹腔镜手术经验,具备初步判定大体标本 良恶性的能力,并严格遵循无瘤原则(2B 类推荐)。 解读:评估后 RMI<200 或最大直径<5cm 的单侧单房 肿物,患者体能状态能够耐受手术,缺乏随访条件或对于 绝经后卵巢肿物存有疑虑,可选择腹腔镜探查术,目的是 去除病灶、排除可疑的卵巢恶性肿瘤,并对粘连及可疑病 灶部位多点活检,为临床-病理分期提供依据[7]。但需充分 沟通手术探查和保守观察的利弊,必要时可转诊至妇科肿 瘤专科医师[2,4]。良性肿物推荐双侧输卵管卵巢切除术。 对于 BRCA1/BRCA2 基因突变携带者或存在卵巢癌高危因 素者,应进行冰冻病理全面规范的检查。手术者应具有初 步判定大体标本良恶性的能力[37]。术中快速病理检查提 示为卵巢恶性肿瘤,则依据术者的技能选择中转开腹或腹 图 2 基于 IOTA 简易标准的卵巢肿物良恶性鉴别流程 中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 声明:本共识旨在为绝经后卵巢肿物的诊断与治疗提 出指导性意见,但并非惟一的实践指南,不排除其他共识、 意见与建议的合理性。专家团队及成员声明,本共识制定 与任何商业团体无利益冲突。 执 笔 作 者( 排 名 不 分 先 后 ):王 稳( 徐 州 医 科 大 学 附 属 滕 州 市 中 心 人 民 医 院 );王 颖 梅( 天 津 医 科 大 学 总 医 院 ); 王 玉 东( 上 海 交 通 大 学 附 属 国 际 和 平 妇 幼 保 健 院 );王 建 六 (北京大学人民医院);王建东(首都医科大学附属北京妇产 医 院 );马 晓 欣( 中 国 医 科 大 学 附 属 盛 京 医 院 );向 阳( 中 国 医 学 科 学 院 北 京 协 和 医 院 );程 文 俊( 江 苏 省 人 民 医 院 ); 张 燕( 武 汉 大 学 人 民 医 院 );张 国 楠( 四 川 省 肿 瘤 医 院 ); 张师前(山东大学齐鲁医院);薛凤霞(天津医科大学总医院); 刘招舰(山东大学高等医学研究院) 参与讨论专家(按姓氏笔画排序):马晓欣(中国医科 大学附属盛京医院);王小元(山东省千佛山医院);王丹波 (辽宁省肿瘤医院);王平(四川大学华西第二医院);王玉东 (上海国际和平妇幼保健院);王建六(北京大学人民医院); 王 悦( 河 南 省 人 民 医 院 );王 颖 梅( 天 津 医 科 大 学 总 医 院 ); 王稳(徐州医科大学附属滕州市中心人民医院);孙力(中国 医学科学院肿瘤医院);刘开江(上海交通大学附属仁济 医 院 );吕 卫 国( 浙 江 大 学 医 学 院 附 属 妇 产 科 医 院 );许 天 敏 ( 吉 林 大 学 第 二 医 院 );刘 木 彪( 广 东 省 人 民 医 院 );刘 军 秀 (中山大学附属第一医院);向阳(中国医学科学院北京协和 医院);任彤(中国医学科学院北京协和医院);朱琳(山东大学 第二医院);朱颖军(天津市中心妇产科医院);孙蓬明 ( 福 建 省 妇 幼 保 健 院 );李 卫 平( 中 国 人 民 解 放 军 总 医 院 ); 李长忠(山东省立医院);李宁(中国医学科学院肿瘤医院); 张玉泉(南通大学附属医院);杨红(空军军医大学西京 医 院 );张 师 前( 山 东 大 学 齐 鲁 医 院 );张 岩( 北 京 大 学 第 一 医 院 );张 英 丽( 浙 江 省 肿 瘤 医 院 );张 国 楠( 四 川 省 肿 瘤 医 院 );汪 洪 波( 华 中 科 技 大 学 同 济 医 学 院 附 属 协 和 医 院 ); 张 瑜( 中 南 大 学 湘 雅 医 院 );张 颐( 中 国 医 科 大 学 附 属 第 一 医 院 );张 燕( 武 汉 大 学 人 民 医 院 );邹 冬 玲( 重 庆 市 肿 瘤 医 院 );陈 刚( 华 中 科 技 大 学 同 济 医 学 院 附 属 同 济 医 院 ); 范 江 涛( 广 西 医 科 大 学 第 一 附 属 医 院 );陈 亮( 山 东 省 肿 瘤 医院);罗喜平(广东省妇幼保健院);陈琼华(厦门大学附属 第 一 医 院 );林 蓓( 中 国 医 科 大 学 附 属 盛 京 医 院 );赵 卫 东 ( 安 徽 省 立 医 院 );胡 丽 娜( 重 庆 医 科 大 学 第 二 附 属 医 院 ); 胡 元 晶( 天 津 市 中 心 妇 产 科 医 院 );赵 淑 萍( 青 岛 大 学 妇 女 儿 童 医 院 );郝 敏( 山 西 医 科 大 学 第 二 附 属 医 院 );贾 雪 梅 ( 南 京 市 妇 幼 保 健 院 );郭 瑞 霞( 郑 州 大 学 第 一 附 属 医 院 ); 黄 向 华( 河 北 医 科 大 学 第 二 附 属 医 院 );郭 红 燕( 北 京 大 学 第三医院);程文俊(江苏省妇幼保健院);熊光武(重庆医科 大学附属第三医院);薛凤霞(天津医科大学总医院) ·1025· ?参 考 文 献 [1] Farghaly SA. Current diagnosis and management of ovarian cysts[J].Clin Exp Obstet Gynecol,2014,41(6):609-612. [2] Ovarian Cysts in Postmenopausal Women(Green-top Guideline No. 34)[EB / OL].(2016-07-19)[2021-08-10]. https://www. rcog.org.uk/en/guidelines-research-services/guidelines/gtg34/. [3] 李会阳,王颖梅,薛凤霞 . 绝经后卵巢囊肿的处理[J]. 中国实 用妇科与产科杂志,2018,34(4):458-461. [4] Daly MB,Pilarski R,Yurgelun MB,et al.NCCN Guidelines In? sights:Genetic/Familial High-Risk Assessment:Breast,Ovari? an,and Pancreatic,Version 1.2020[J]. J Natl Compr Canc Netw,2020,18(4):380-391. [5] 中国抗癌协会肿瘤内分泌专业委员会,中国优生科学协会女 性生殖道疾病诊治分会,中国优生科学协会肿瘤生殖学分 会 . 遗传性妇科肿瘤高风险人群管理专家共识(2020)[J]. 中 国实用妇科与产科杂志,2020,36(9):825-834. [6] Timmerman D,Planchamp F,Bourne T,et al.ESGO/ISUOG/IO? TA/ESGE Consensus Statement on pre-operative diagnosis of ovarian tumors[J].Int J Gynecol Cancer,2021,31(7):961-982. [7] 张燕,毛林 . 绝经后卵巢包块诊断策略[J]. 中国实用妇科与 产科杂志,2020,36(12):1148-1152. [8] Myers ER,Bastian LA,Havrilesky LJ,et al.Management of ad? nexal mass[J].Evid Rep Technol Assess(Full Rep),2006, (130):1-145. [9] Urban N,Thorpe J,Karlan BY,et al.Interpretation of single and [10] [11] [12] [13] [14] [15] serial measures of HE4 and CA125 in asymptomatic women at high risk for ovarian cancer[J].Cancer Epidemiol Biomarkers Prev,2012,21(11):2087-2094. Moore RG,McMeekin DS,Brown AK,et al.A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass[J].Gynecol On? col,2009,112(1):40-46. Azeez HAA,Labib HA,Sharaf SM,et al.HE4 and mesothelin: novel biomarkers of ovarian carcinoma in patients with pelvic masses[J].Asian Pac J Cancer Prev,2010,11(1):111-116. Nolen B,Velikokhatnaya L,Marrangoni A,et al. Serum bio? marker panels for the discrimination of benign from malignant cases in patients with an adnexal mass[J].Gynecol Oncol, 2010,117(3):440-445. Solnik MJ,Alexander C.Ovarian incidentaloma[J].Best Pract Res Clin Endocrinol Metab,2012,26(1):105-116. Avesani G,Arshad M,Lu H,et al.Radiological assessment of Peritoneal Cancer Index on preoperative CT in ovarian cancer is related to surgical outcome and survival[J].Radiol Med, 2020,125(8):770-776. Nasser S,Lazaridis A,Evangelou M,et al. Correlation of pre- operative CT findings with surgical &histological tumor dissemination patterns at cytoreduction for primary advanced and relapsed epithelial ovarian cancer:A retrospective evalua? ·1026· 中国实用妇科与产科杂志 2021 年 10 月 第 37 卷 第 10 期 ovarian cancer before surgery using the ADNEX model to dif? ferentiate between benign,borderline,early and advanced stageinvasive,andsecondarymetastatictumours:prospective multicentre diagnostic study[J].BMJ,2014,349:g5920. [29] Behnamfar F,Adibi A,Khadra H,et al.Diagnostic accuracy of gynecology imaging reporting and data system in evaluation of adnexal lesions[J].J Res Med Sci,2019,24:57. [30] Migda M,Bartosz M,Migda MS,et al.Diagnostic value of the gynecology imaging reporting and data system (GI-RADS) with the ovarian malignancy marker CA-125 in preoperative adnexal tumor assessmen[t J].J Ovarian Res,2018,11(1):92. [31] Basha MAA,Refaat R,Ibrahim SA,et al.Gynecology Imaging Reporting and Data System (GI-RADS):diagnostic perfor? mance and inter-reviewer agreement[J].Eur Radiol,2019,29 (11):5981-5990. [32] Andreotti RF,Timmerman D,Benacerraf BR,et al. Ovarian- Adnexal Reporting Lexicon for Ultrasound:A White Paper of the ACR Ovarian-Adnexal Reporting and Data System Com? mittee[J].J Am Coll Radiol,2018,15(10):1415-1429. [33] Andreotti RF,Timmerman D,Strachowski LM,et al.O-RADS USRiskStratificationandManagementSystem:AConsensus Guideline from the ACR Ovarian-Adnexal Reporting and Data System Committee[J].Radiology,2020,294(1):168-185. [34] Basha MAA,Metwally MI,Gamil SA,et al.Comparison of O- RADS,GI-RADS,and IOTA simple rules regarding malignan? cy rate,validity,and reliability for diagnosis of adnexal mass? es[J].Eur Radiol,2021,31(2):674-684. [35] Greenlee RT,Kessel B,Williams CR,et al.Prevalence,inci? dence,and natural history of simple ovarian cysts among wom? en aged >55 years old in a large cancer screening trial[J]. Am J Obstet Gynecol,2010,202(4):373. [36] Baheti AD,Lewis CE,Hippe DS,et al.Adnexal lesions detected on CT in postmenopausal females with non-ovarian malignan? cy:do simple cysts need follow-up?[J].Abdom Radiol(NY), 2019,44(2):661-668. [37] van de Vrie R,Rutten MJ,Asseler JD,et al.Laparoscopy for di? agnosing resectability of disease in women with advanced ovari? an cancer[J]. Cochrane Database Syst Rev,2019,3(3): CD009786. [38] National Collaborating Centre for Cancer(UK). Ovarian Can? cer:The Recognition and Initial Management of Ovarian Can? cer[M].Cardif(f UK):National Collaborating Centre for Cancer (UK),2011:PMID:22479719. [39] Kehila M,Kebaili S,Hidar S,et al.Ovarian tumors in postmeno? pausal women:report of 100 cases and review of the litera? ture[J].Pan Afr Med J,2014,19:235. [40] 王稳,崔秀娟,张师前 . 绝经后卵巢良性肿瘤诊治的相关问 题[J]. 中国妇产科临床杂志,2019,20(6):564-566. (2021-08-12 收稿) ?[16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] tion[J].Gynecol Oncol,2016,143(2):264-269. Anthoulakis C,Nikoloudis N. Pelvic MRI as the "gold stan? dard" in the subsequent evaluation of ultrasound-indetermi? nate adnexal lesions:a systematic review[J].Gynecol Oncol, 2014,132(3):661-668. Dohan A,Hoeffel C,Soyer P,et al.Evaluation of the peritoneal carcinomatosis index with CT and MRI[J].Br J Surg,2017,104 (9):1244-1249. Low RN,Barone RM,Lucero J.Comparison of MRI and CT for predicting the Peritoneal Cancer Index(PCI)preoperatively in patients being considered for cytoreductive surgical proce? dures[J].Ann Surg Oncol,2015,22(5):1708-1715. Torkzad MR,Casta N,Bergman A,et al. Comparison between MRI and CT in prediction of peritoneal carcinomatosis index (PCI)in patients undergoing cytoreductive surgery in relation to the experience of the radiologis[t J].J Surg Oncol,2015,111 (6):746-751. Gadelhak B,Tawfik AM,Saleh GA,et al. Extended abdomino? pelvic MRI versus CT at the time of adnexal mass characteriza? tion for assessing radiologic peritoneal cancer index(PCI)pri? or to cytoreductive surgery[J]. Abdom Radiol(NY),2019,44 (6):2254-2261. Fenchel S,Grab D,Nuessle K,et al. Asymptomatic adnexal masses:correlation of FDG PET and histopathologic find? ings[J].Radiology,2002,223(3):780-788. Wahl RL,Javadi MS,Eslamy H,et al.The Roles of Fluorodeox? yglucose-PET/Computed Tomography in Ovarian Cancer:Diag? nosis,Assessing Response,and Detecting Recurrence[J]. PET Clin,2010,5(4):447-461. Moore RG,Brown AK,Miller MC,et al. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass[J].Gynecol Oncol,2008,108 (2):402-408. Westwood M,Ramaekers B,Lang S,et al.Risk scores to guide referral decisions for people with suspected ovarian cancer in secondary care:a systematic review and cost-effectiveness analysis[J].Health Technol Assess,2018,22(44):1-264. Chacón E,Dasí J,Caballero C,et al.Risk of Ovarian Malignan? cy Algorithm versus Risk Malignancy Index-I for Preoperative Assessment of Adnexal Masses:A Systematic Review and Me? ta-Analysis[J].Gynecol Obstet Invest,2019,84(6):591-598. Timmerman D.The use of mathematical models to evaluate pel? vic masses:can they beat an expert operator?[J].Best Pract Res Clin Obstet Gynaecol,2004,18(1):91-104. Calster BV,Valentin L,Froyman W,et al.Validation of models to diagnose ovarian cancer in patients managed surgically or conservatively:multicentre cohort study[J].BMJ,2020,370: m2614. Calster BV,Hoorde KV,Valentin L,et al.Evaluating the risk of
闫丽隽 主任医师 山西省肿瘤医院 妇科555人已读 - 就诊指南 接种HPV疫苗专家共识
华南预防医学2021年9月第47卷第9期 South China J Prev Med,September 2021,Vol.47,No.9 · 1155 · ·共识标准指南· ?青春前期女性接种人乳头瘤病毒疫苗专家共识 李小毛,李依芬,万璟,杨越波,张宇 中山大学附属第三医院,广东 广州 510630 【摘要】 人乳头瘤病毒(HPV)疫苗接种是子宫颈癌防控的重要措施之一。通过综合考虑HPV疫苗接种的有 效性、安全性、成本效益等多方面因素,专家强烈推荐青春前期(9~14 岁)女性作为重点目标人群应优先接种 HPV 疫苗,提高重点目标人群 HPV 疫苗免疫覆盖率,以达到子宫颈癌一级预防策略的最佳效果。 【关键词】 青春前期; 人乳头瘤病毒; 疫苗; 子宫颈癌 中图分类号:R186 文献标识码:A 文章编号:1671 - 5039(2021)09 - 1155 - 08 Expert consensus on human papillomavirus vaccination for prepubertal girls LI Xiao?mao,LI Yi?fen,WAN Jing,YANG Yue?bo,ZHANG Yu The Third Affiliated Hospital of Sun Yat?sen University,Guangzhou 510630,China 【Abstract】 Human papillomavirus(HPV)vaccination is one of the essential measures for cervical cancer preven‐ tion and control. By comprehensively analyzing the effectiveness,safety,cost‐effectiveness and other factors of HPV vacci‐ nation,experts strongly recommend prepubertal girls(9~14 years old)as the primary target population,and HPV vac‐ cines should be given priority to them . Improving the vaccination coverage among target populations can achieve the best effect of the primary prevention strategy of cervical cancer. 【Keywords】 Prepuberty; Human papillomavirus; Vaccines; Cervical cancer ?世界卫生组织(WHO)界定的青春期年龄范围 是 10~19 岁,青春期的发动一般始于 8~10 岁,通 常将生理及心理出现明显变化的 9~14 岁这个年龄 段定义为青春前期(prepuberty)。人乳头瘤病毒 (human papillomavirus,HPV)疫 苗 接 种 是 预 防 HPV 感染及相关疾病最有效的措施,是 WHO 提出加速 实现消除子宫颈癌全球战略的主要策略之一[1]。HPV 疫苗在国际上获批的适用年龄段通常为 9~45 岁。 本文通过综合分析考量 HPV 疫苗接种的有效 性、安全性、免疫程序、成本效益等多方面因素,提 出子宫颈癌防控中 HPV 疫苗接种的重点目标人群 是青春前期女性,通过创造条件逐步纳入免疫规 划,优先保障和大幅提高青春前期女性的 HPV 疫苗 接种率,可更好地利用有限的社会资源,达到子宫 颈癌一级预防策略的最佳效果。 1 HPV 感染及子宫颈癌发病呈现年轻化趋势 1 项汇总中国 170 万女性 HPV 感染的流行病学 DOI:10.12183/j.scjpm.2021.1155 通信作者:李小毛,E‐mail:lixmao@mail.sysu.edu.cn 研究显示,女性总体 HPV 感染率为 15.54%,前 5 位 HPV 感染型别分别为 HPV16/52/58/18/33[2]。另 1 项 纳入中国 37 个城市既往无子宫颈病变及治疗史的 15~60 岁女性的大型研究结果显示,高危型 HPV 感 染的总阳性率为 21.07%,以 HPV16/52/58 型别多 见,其中 15~19 岁有核心性性行为女性的高危型 HPV 感染率高达 30.55%,是 HPV 感染的第 1 个高峰 年龄段[3]。 全球大部分地区青少年初次核心性性行为年 龄为 15~19 岁[4]。2015 年我国原国家卫生计生委 家庭司发布的《中国家庭发展报告 2015》中提到我 国青少年初次核心性性行为的平均年龄为 15.9 岁, 15~17 岁青少年性行为的发生率为 4.1%[5]。中国 1 项纳入 7 个城市 78 400 名大学生的横断面调查研究 显示,在 10 164 名有过性行为的大学生中初次性行 为的平均年龄为 20.14 岁,其中 15~19 岁占比达到 37.31%[6]。 15~16、<15 岁有初次核心性性行为女性的 ? · 1156 · 华南预防医学2021年9月第47卷第9期 South China J Prev Med, September 2021,Vol.47,No.9 ?HPV 感染风险分别是>21 岁开始初次性行为者的 2.55、3.22 倍[7]。青春期人群生理和心理发育均处于 快速成熟的萌动阶段,青春后期的生活环境和学习 压力发生较大变化,导致其在朦胧之中容易萌动不 理智的性冲动。初次核心性性行为年龄提早,生殖 健康知识不足,往往缺乏安全保护措施,过早和过 频的性生活不利于尚未完全发育成熟的生殖道黏 膜的损伤修复,加之性伴侣多等因素,增加了 HPV 暴露的机会,是年轻女性易感染 HPV 的原因。 子宫颈癌发病年龄和高发年龄段均呈年轻化 趋势。英国 20~29 岁女性子宫颈癌发病率在 2000 —2009 年上升了 10.3%[8]。我国子宫颈癌高发年龄 段 1990 年为 70~79 岁,2019 年降至为 50~59 岁年 龄组[9]。2000—2014 年诊断为子宫颈癌患者的平均 年龄由 53.48 岁下降为 50.32 岁[10]。湖北省 1975— 2009 年的 6 063 例子宫颈癌病例分析结果显示<35 岁女性占比从 2.8%增长至 15.7%[11]。 发生初次核心性性行为之前的低年龄段女性 是 HPV 疫苗接种的重点目标人群,在 HPV 暴露之前 完成 HPV 疫苗全程接种对预防 HPV 感染及子宫颈 癌的保护效果最佳[12-13]。根据广东省现有相关数据 建立的静态比例预测模型显示,若从 2021 年起持续 每年对全省 13 岁年龄段女性进行双价 HPV 疫苗接 种,且接种率达到 80%~90%,预计 50 年后全省子 宫颈癌发病率可降至 4/10 万以下。另一项预测模 型提示,我国若从2021年开始对9~14岁女性进行 双价 HPV 疫苗接种,条件具备后及时替换选择更优 的 HPV 疫苗,同时实施定期子宫颈癌筛查等多方位 综合方案,子宫颈癌发病率有望在 2050 年前降低 至 4/10 万以下,实现消除子宫颈癌目标[14]。 专家意见:青春前期女性是子宫颈癌一级预防 策略实施的重点目标人群。 2 青春前期女性接种 HPV 疫苗的免疫原性与安全 性良好 我国目前获批上市了 4 种 HPV 疫苗:AS04 佐剂 双价 HPV 疫苗、四价 HPV 疫苗、九价 HPV 疫苗、国 产双价 HPV 疫苗(大肠杆菌)。中国厦门万泰研发的 双价 HPV 疫苗(大肠杆菌)于 2019 年 12 月获批上市, 我国成为第 3 个具有 HPV 疫苗自主供给能力的国家。 2.1 青春前期女性接种 2 剂次 HPV 疫苗免疫原 性 全球及国内多项研究表明:青春前期女性接种 2 剂次 HPV 疫苗,其免疫原性无论是抗体阳转率还 是抗体几何平均滴度(geometric mean titer,GMT)/抗 体 几 何 平 均 浓 度(geometric mean concentration, GMC)都不低于较大年龄组。 我国境内的桥接试验结果显示,接种 2 剂次国 产双价 HPV 疫苗(大肠杆菌)的 9~14 岁女性, HPV16/18 抗体阳转率均达 100%,且抗体 GMC 不低 于 15~17、18~26 岁年龄组[15]。 9~45 岁人群在接种 3 剂次 AS04 佐剂双价 HPV 疫苗的 1 个月后,各年龄组受种者 HPV16/18 抗体的 阳转率为 97.5%~100.0%,其中 9~17 岁年龄组女 性接种后的抗体 GMT 是 18~25 岁女性的 2~3 倍[16]。1 项全球多中心研究结果显示,9~14 岁女性 接种 2 剂次 AS04 佐剂双价 HPV 疫苗后 1~54 个月 的 HPV 16/18 抗体水平与 15~25 岁女性接种 3 剂次 者相当[17]。 9~45 岁人群全程接种 3 剂次四价 HPV 疫苗 的 1 个月后,HPV 6/11/16/18 的抗体阳转率为 96% ~100%[18]。9~13 岁女性按照 0、6 个月的免疫程序 接种 2 剂次四价 HPV 疫苗后的抗体阳转率和抗体 GMT 与同年龄段及 16~26 岁女性接种 3 剂次人群 无显著性差异[19]。 在欧洲多国开展的研究结果显示,9~15 岁女性 接种 2 剂次九价 HPV 疫苗后的抗体阳转率和抗体 GMT 与 16~26 岁的女性接种 3 剂次无显著性差异[20]。 2.2 HPV 疫苗保护效果 HPV 疫苗接种率高的国 家 ,子 宫 颈 上 皮 内 瘤 变(cervical intraepithelial neo‐ plasia,CIN)2~3级和子宫颈癌发病率都呈现明显 下降趋势,真实世界研究数据证实了 HPV 疫苗预防 子宫颈癌的良好保护效果。 1 项对 2014—2018 年全球 HPV 疫苗真实世界 保护效果的 Meta 分析显示,接种 AS04 佐剂双价 HPV 疫苗或四价 HPV 疫苗 5~8 年后,13~19 岁女 性 HPV16/18 型感染率显著降低 83%,HPV31/33/45 型感染率也降低 54%;接种 5~9 年后,15~19、20~ 24 岁年龄组女性 CIN2+发病率分别下降 51%、 31%[21]。瑞典 1 项纳入近 170 万 10~30 岁女性的真 实世界研究发现,子宫颈癌累积发病率在 23 岁后迅 速升高,而17岁前开始接种至少1剂四价HPV疫苗的女 性患子宫颈癌风险比从未接种疫苗女性降低88%[22]。 接种 HPV 疫苗还能降低生殖器疣发病率。挪 威和丹麦在 2009 年启动针对 12 岁女孩的四价 HPV 疫苗接种免疫规划项目,2015 年生殖器疣发病率在 该人群中分别下降了 4.8%和 18.0%[23]。有文献报 道 15~19 岁女性在接种 AS04 佐剂双价 HPV 疫苗或 四价 HPV 疫苗后生殖器疣发病率下降了 67%[21]。 2.3 HPV 疫苗免疫持久性 HPV 疫苗接种后抗体 华南预防医学2021年9月第47卷第9期 South China J Prev Med,September 2021,Vol.47,No.9 · 1157 · ?滴度持久性是青春前期接种人群更为关注的问题 之一。目前的研究数据表明,青春前期女性接种 2 剂次 HPV 疫苗的免疫持久性与接种 3 剂次的同龄或 大年龄组差异无显著性,完成 HPV 疫苗全程接种的 人群不需要加强免疫。 9~14 岁女性接种 2 剂次 AS04 佐剂双价 HPV 疫苗产生的抗体 GMC 在 5 年内不低于接种 3 剂次的 15~25 岁女性[24]。通过数学模型发现,接种 AS04 佐剂双价 HPV 疫苗产生的抗体滴度至少在 20 年内、 甚至 50 年都能保持高于自然感染产生的抗体 水平[25-26]。 1 项对接种 3 剂次四价 HPV 疫苗的 9~15 岁女 性随访 10 年的研究结果显示,89%~96%的受种者 仍保持疫苗相关型别抗体阳性,对 HPV 6/11/16/18 感染及相关疾病保护效力为 100%[27]。9~15 岁女 性接种2剂次四价HPV疫苗产生的抗体GMT在6年 后仍不低于接种 3 剂次四价 HPV 疫苗的同龄者[28]。 1 项对 9~15 岁女孩接种 3 剂次九价 HPV 疫苗 随访 8 年的研究结果显示,疫苗相关型别抗体阳性 率达 90%以上,对 CIN2+和生殖器疣的保护效果达 100%[29]。9~14岁女性接种2剂次9价HPV疫苗后 产生的抗体 GMT 在 2~2.5 年内接近、甚至高于接种 3 剂次 15~25 岁女性所产生的抗体滴度[30]。 疫苗诱导相关抗体水平多数会随接种时间推 移而降低,当人体与相关病原体再次接触时,因为 存在免疫记忆,受种者仍能产生免疫应答。 2.4 HPV 疫苗的安全性和耐受性 HPV 疫苗安全 性是青春前期女性接种工作中所关注的重要问题 之一,也是公众疫苗犹豫的主要原因之一。HPV 疫 苗在临床试验中出现的疫苗不良反应(adverse reac‐ tion,AR),包括局部 AR 和全身 AR,与其他疫苗一 样,一般无需特殊处理。局部 AR 主要有接种部位 疼痛、肿胀、红斑、瘙痒和硬结,通常发生于接种后 15 d 内,多为轻、中度,大多可自然缓解;全身 AR 主 要有发热、头痛、眩晕、疲劳、肌肉痛、关节痛和胃肠 道症状等,症状多数轻微[31-34]。HPV 疫苗全球上市 后收集到的数据显示,局部和全身 AR 与临床试验 结果基本一致。 美国疾病预防控制中心收集 2006—2017 年 HPV 疫苗接种报告显示,美国共接种 AS04 佐剂双 价 HPV 疫苗超过 72 万剂次、四价 HPV 疫苗超过 8 000 万剂次、九价 HPV 疫苗超过 2 800 万剂次,其 中疫苗不良事件(adverse events,AE)发生率:AS04 佐剂双价 HPV 疫苗<3/万剂次、四价 HPV 疫苗<5/ 万剂次、九价 HPV 疫苗<3/万剂次;疫苗严重不良 事件(serious adverse events,SAE)发生率:AS04 佐剂 双价 HPV 疫苗<0.12/万剂次、四价 HPV 疫苗<0.35/ 万剂次、九价 HPV 疫苗<0.09/万剂次[35]。在 AS04 佐剂双价、四价及九价 HPV 疫苗全球上市后的长期 监测中均证实了 HPV 疫苗的安全性和耐受性良 好[36-38]。国产双价 HPV 疫苗(大肠杆菌)上市时间 较短,临床试验中未见有报告 SAE[39]。 相关研究结果显示青春前期女性接种 HPV 疫 苗的安全性和耐受性良好[16-18,40-41]。全球疫苗安全 咨询委员会(The Global Advisory Committee on Vac‐ cine Safety,GACVS)多次对 HPV 疫苗安全性进行审 核评估,2017 年发表新一轮的评估意见结论为 HPV 疫苗具有非常好的安全性[42]。 随着全球大规模适龄人群接种 HPV 疫苗,十几 年来曾监测到一些罕见情况,如格林巴利综合征、 复杂性区域疼痛综合征、体位性心动过速综合征 等,各国报道发生率不同,但基本不超过 3 例/100 万 剂次,且无明确证据证明其与接种 HPV 疫苗有直接 相关性[35-36,43-45]。目前文献报道结果显示 HPV 疫苗 对女性生育力尚未见有不良影响,接种 HPV 疫苗并 未增加不良妊娠结局和后代出生缺陷的风 险[35,39,46-47]。 专家意见:青春前期女性接种 HPV 疫苗对预防 HPV 感染及相关疾病的获益更大,且安全性良好。青 春前期女性免疫程序推荐 2 剂次 HPV 疫苗接种方案。 3 青春前期女性接种 HPV 疫苗成本效益高 在推动 HPV 疫苗应用尤其是纳入国家免疫规 划时,除了考虑疫苗的安全性和有效性外,卫生经 济学疾病负担与成本效益也是重要的考量指标。 接种 HPV 疫苗结合子宫颈癌筛查是目前子宫颈癌 防控的最佳策略,其中在 HPV 暴露之前和无 HPV 感 染史的女性当中接种疫苗更具有卫生经济学价值, 但对于选择哪种 HPV 疫苗更具有成本效益的问题 还存在争议[48]。 多项研究表明低年龄段女性 2 剂次 HPV 疫苗接 种方案的成本效益优于适龄人群 3 剂次接种方案。 欧洲医学协会提出采用 2 剂次接种 HPV 疫苗的主要 依据是免疫桥接试验和非劣效性值[49]。马来西亚 1 项数学模型显示,在 13 岁女性中接种 2 剂次或 3 剂 次 HPV 疫苗,均可有效预防子宫颈癌,接种 2 剂次免 疫方案在 95 年间可节约近 3 672 万林吉特(ringgit), 在保证免疫效果的同时明显降低了成本[50]。新加 坡、孟加拉国及印度的研究显示,对 10~13 岁女孩 接种 2 剂次 AS04 佐剂双价 HPV 疫苗具有非常好的 · 1158 · 华南预防医学2021年9月第47卷第9期 South China J Prev Med, September 2021,Vol.47,No.9 ?成本效益[51-53]。意大利 1 项研究表明 2 剂次九价 HPV 疫苗和 2 剂次四价 HPV 疫苗均可使子宫颈癌 前病变、子宫颈癌及生殖器疣的发病率降低,2 剂次 九价 HPV 疫苗接种方案较四价 HPV 疫苗接种方案 成本效益更高[54]。青春前期女性 HPV 疫苗 2 剂次接 种方案是子宫颈癌防控策略调整中推荐的免疫程序。 我国 1 项基于模型的成本效益分析研究表明, 9~14岁女性接种2剂次国产双价HPV疫苗(大肠 杆菌)结合每 5 年 1 次的子宫颈癌筛查是目前最具 成本效益的子宫颈癌防控策略,如果疫苗价格足够 低、疫苗的保护效力足够长,接种成本效益将大大 提高[55]。假定广东省通过带量采购方式降低国产 双价 HPV 疫苗(大肠杆菌)目前价格 10%以上,且 13 岁女孩采用 2 剂次方案全程接种率达到 90%,测算数 据显示每挽救 1 例子宫颈癌所致伤残调整寿命年的增 量成本/人均生产总值比值明显小于 1,表明 HPV 疫苗 接种在子宫颈癌防控中能获得良好的成本效益。 专家意见:青春前期女性实施 2 剂次免疫程序 是最具成本效益的子宫颈癌防控策略。建议加快 国内 HPV 疫苗研发与上市,降低价格,提高 HPV 疫 苗的可及性。 4 提高青春前期女性 HPV 疫苗接种率是消除子宫 颈癌的重要策略之一 发生初次核心性性行为之前的青春前期女性 是 HPV 疫苗的优先接种人群,保护该人群免受 HPV 感染是减少子宫颈癌新发病例数的关键举措。 WHO 在 2017 年 HPV 疫苗立场文件中建议,HPV 疫 苗的首要接种对象为未发生初次核心性性行为的 9 ~14岁女性[12]。2020年11月WHO提出加速消除 子宫颈癌全球战略的 3 大主要策略之一:90%的 15 岁以下女性完成 HPV 疫苗全程接种[1]。 多个学术机构的推荐意见与 WHO 立场文件基 本一致:HPV 疫苗对未发生初次核心性性行为的 9~ 15 岁女性群体性预防接种获益最大,疫苗资源供应 充足时可继续扩展推荐年龄至 16~26 岁的女性。26 岁以上成年女性群体接种的成本效益相对较低,高年 龄段女性一般只推荐个体化的自费接种策略[12-13,56]。 大多数国家和地区在执行 HPV 疫苗免疫规划 时都是优先将青春前期女性作为重点目标人群。 截至 2020 年 10 月,已有 110 个国家和地区将 HPV 疫苗纳入或部分纳入国家免疫规划[57]。将 HPV 疫 苗纳入免疫规划的国家和地区,青春前期女性全程 接种率平均为 53%,其中 22 个国家全程接种率超过 75%,有 6 个国家 HPV 疫苗接种率>90%[58]。 目前我国 9~45 岁适龄人群女性的 HPV 疫苗接 种率总体偏低,其中 9~14 岁女性作为 HPV 疫苗重 点目标人群在已接种人群中的占比不足 5%[59]。造 成青春前期女性 HPV 疫苗接种率低的主要原因,一 方面是我国现在上市的 HPV 疫苗产能明显不足,疫 苗销售价格过高;另一方面是处于中小学生阶段的 青春前期女性无经济来源,子宫颈癌防控与 HPV 疫 苗知识受学校和监护人影响较大,而监护人对 HPV 感染和子宫颈癌的危害性认识不足、对 HPV 疫苗安 全性有所顾虑、对 HPV 疫苗知识缺乏全面了解,或 因某些原因而处于观望等待状态。大部分家长至今 没有主动让孩子接种 HPV 疫苗,若将 HPV 疫苗纳入 免疫规划,监护人对疫苗接受度可增加至 61.3%[60]。 因此,结合我国国情,需加快 HPV 疫苗研发与 上市,降低疫苗价格,保障疫苗供应,提高 HPV 疫苗 可及性,在此基础上建议由政府主导、相关职能部 门协同参与,创造条件逐步将 HPV 疫苗纳入基本公 共卫生服务免疫规划项目范围,开展 HPV 疫苗免费 接种工作,推动“青春前期女性+2 剂次免疫程序”的 HPV 疫苗接种方案,对初中在校女学生(12~14 岁 女性)有序开展 HPV 疫苗 2 剂次接种工作,优先保障 和大幅提高青春前期女性的 HPV 疫苗接种率,90% 的 15 岁以下女性完成 HPV 疫苗全程接种,有望早日 实现消除子宫颈癌战略目标。 专家意见:青春前期女性全程接种 HPV 疫苗是 子宫颈癌防控的重要措施之一,建议创造条件逐步 将 HPV 疫苗纳入免疫规划,以提高青春前期女性 HPV 疫苗接种率。 5 青春前期女性接种HPV疫苗的注意事项 HPV 疫苗接种的整体收益远大于风险,在初次 核心性性行为发生之前完成 HPV 疫苗全程接种获 益最大。社会各界应重视对青春前期女性及其监 护人的 HPV 感染相关疾病及 HPV 疫苗知识的科普 宣教,有关部门在严格遵循知情、同意、自愿的前提 下推动疫苗接种工作。在接种 HPV 疫苗前必须对 青春前期女性及其监护人进行全面、科学、客观、公 正的疫苗接种推荐,不仅要充分沟通子宫颈癌及 HPV 感染相关疾病危害,还要客观公正告知 HPV 疫 苗预防疾病的有效性和安全性无法达到 100%, HPV 疫苗没有覆盖所有 HPV 型别,接种后仍不能忽 略其他子宫颈癌防控措施。 一些特殊人群,如人类免疫缺陷病毒感染、免 疫功能低下或患有系统性红斑狼疮的青春前期女 华南预防医学2021年9月第47卷第9期 South China J Prev Med,September 2021,Vol.47,No.9 · 1159 · ?性接种 HPV 疫苗安全性良好,其接种后能产生免疫 原性,但免疫应答率较正常人群低[61-63]。肾功能衰 竭接受血液透析的青春前期女性在病情允许时可 接种 HPV 疫苗,但全身脏器功能差、预期寿命有限 者不推荐接种[64]。目前尚无证据证明意外暴露于 HPV 疫苗会增加自发性流产和其他不良妊娠结局 的风险[35,39,46-47]。 曾对 HPV 疫苗任何成分过敏或既往接种疫苗 有严重过敏反应者,不可接种 HPV 疫苗[12-13]。另 外,需要注意青春前期人群接种 HPV 疫苗后可能出 现心因性症状,这种现象多是对疫苗副作用的焦虑 或注射部位疼痛引起的一种特殊心理反应,可发生 在疫苗接种过程中或接种后,因此青春前期女性在 集体场所接种疫苗更需要加强心理疏导,配备充足 的医疗救护条件,避免群体性癔症事件的发生。 HPV 疫苗接种是子宫颈癌防控的重要措施之 一。HPV 暴露前的青春前期(9~14 岁)女性作为重 点目标人群优先接种 HPV 疫苗,并建议选择 2 剂次 免疫程序,是最具成本效益的子宫颈癌防控策略。 建议政府创造条件逐步将 HPV 疫苗纳入免疫规划, 卫生健康部门和教育部门等职能部门相互协调并 组织实施,医务人员、预防接种工作人员以及相关 领域专家从不同角度共同努力推动项目进展并落 实具体工作,广泛开展 HPV 疫苗接种相关健康知识 宣教,应对公众疫苗犹豫,优先保障重点目标人群 和大幅提高青春前期女性 HPV 疫苗接种率,以加速 实现消除子宫颈癌战略目标。 讨论与制定共识的专家(按姓氏笔画排序):丁杰(中山大学附 属第三医院),万璟(中山大学附属第三医院),马卫东(贵州中医药 大学第二附属医院),王三锋(广东省妇幼保健院),王小韵(浙江大 学医学院附属第二医院),王泽华(华中科技大学同济医学院附属协 和医院),王焕(中山大学附属第三医院),邓柳枝(中山大学附属第 三医院),邓高丕(广州中医药大学第一附属医院),卢美松(哈尔滨 医科大学附属第一医院),史文静(广州医科大学附属第二医院),生 秀杰(广州医科大学附属第三医院),冯亚玲(南京医科大学附属无 锡妇幼保健院),冯忻(广州医科大学附属肿瘤医院),乔友林(中国 医学科学院/北京协和医学院群医学及公共卫生学院),向阳(北京协 和医院),刘阳(深圳市龙岗区人民医院),刘国成(广东省妇幼保健 院),刘娟(广州医科大学附属第三医院),刘继红(中山大学肿瘤防 治中心),刘萍(广州市番禺妇幼保健院),刘楠(南方医科大学南方 医院),刘穗玲(中山大学附属第三医院),许晓君(广东省疾病预防 控制中心),李小毛(中山大学附属第三医院),李东林(珠海市妇幼 保健院),李田(中山大学附属第七医院),李俊东(中山大学肿瘤防 治中心),杨萍(石河子大学医学院第一附属医院),杨越波(中山大 学附属第三医院),肖立(深圳市妇幼保健院),肖兰(安徽医科大学 第一附属医院),肖国宏(广州医科大学附属第二医院),肖静(广东 省中医院),吴素慧(山西白求恩医院),邱琇(广州市妇女儿童医疗 中心),何善阳(广东省人民医院),况燕(广西医科大学第一附属医 院),张丙忠(中山大学孙逸仙纪念医院),张宇(中山大学附属第三 医院),张金玲(暨南大学第二临床医学院),张春焕(广州市疾病预 防控制中心),张秋实(广东省第二人民医院),张帝开(深圳大学第 三附属医院),陆安伟(南方医科大学深圳医院),陈建国(广东省人 民医院),陈瑶(湖南省郴州市第一人民医院),易丹妮(广州市妇女 儿童医疗中心),罗颂平(广州中医药大学第一附属医院),周水生 (中山大学附属第三医院),周袆(中山大学附属第一医院),周晖(中 山大学孙逸仙纪念医院),郑慧贞(广东省疾病预防控制中心),赵淑 萍( 青 岛 大 学 附 属 妇 女 儿 童 医 院 ),聂 惠 龙( 中 山 大 学 附 属 第 五 医 院),郭晓玲(佛山市妇幼保健院),郭遂群(南方医科大学第三附属 医院),唐虹(广东省中医院),黄芳(深圳市疾病预防控制中心),黄 神姣(广州市妇女儿童医疗中心),曹泽毅(中国医科大学航空总医 院),曹晓晓(广州市红十字会医院),盛修贵(中国医学科学院肿瘤 医院深圳医院),隋龙(复旦大学附属妇产科医院),舒珊荣(暨南大 学附属第一医院),曾玉霞(湖南省郴州市第四人民医院) 学术秘书(按姓氏笔画排序):王佳,叶敏娟,叶辉霞,成娟,苏淑 军,李依芬,杨晓辉,张慧玲,唐欣然,梁常艳,蒋慧云,曾峥(中山大 学附属第三医院) 利益冲突:所有作者均声明不存在利益冲突 参考文献 [1] GultekinM,RamirezPT,BroutetN,etal.WorldHealthOrgani‐ zation call for action to eliminate cervical cancer globally[J]. Int J Gynecol Cancer,2020,30(4):426-427. [2] Zhu B,Liu Y,Zuo T,et al. The prevalence,trends,and geo‐ graphical distribution of human papillomavirus infection in Chi‐ na:The pooled analysis of 1.7 million women[J].Cancer Med, 2019,8(11):5373-5385. [3] Wang R,Guo X,Wisman GBA,et al. Nationwide prevalence of human papillomavirus infection and viral genotype distribution in 37 cities in China[J]. BMC Infect Dis,2015,15(1):257. [4] Secor ‐ Turner M,Kugler K,Bearinger LH,et al. A global per‐ spective of adolescent sexual and reproductive health:context matters[J]. Adolescent Medicine(Elk Grove Village,Ill.), 2009,20(3):1005. [5] 国家卫生计生委家庭司 . 中国家庭发展报告 2015[M]. 北京: 中国人口出版社,2015:83-84. [6] Shu C,Fu A,Lu J,et al. Association between age at first sexual intercourse and knowledge,attitudes and practices regarding re‐ productive health and unplanned pregnancy:A cross ‐ sectional study[J]. Public Health,2016,135:104-113. [7] Vinodhini K,Shanmughapriya S,Das BC,et al. Prevalence and risk factors of HPV infection among women from various provinc‐ es of the world[J]. Arch Gynecol Obstet,2012,285(3):771-777. [8] Patel A,Galaal K,Burnley C,et al. Cervical cancer incidence in young women:a historical and geographic controlled UK region‐ al population study[J]. Br J Cancer,2012,106(11):1753-1759. [9] 孟令昊,胥秋艳,李科,等 . 1990—2019 年中国女性宫颈癌疾病 · 1160 · 华南预防医学2021年9月第47卷第9期 South China J Prev Med, September 2021,Vol.47,No.9 ?负担变化的分析[J]. 中国循证医学杂志,2021,21(6):648-653. [10] Li X,Zheng R,Li X,et al. Trends of incidence rate and age at diagnosis for cervical cancer in China,from 2000 to 2014[J]. Chin J Cancer Res,2017,29(6):477-486. [11] Cai HB,Liu XM,Huang Y,et al. Trends in cervical cancer in young women in Hubei,China[J]. Int J Gynecol Cancer,2010, 20(7):1240-1243. [12] WHO. Human papillomavirus vaccines:WHO position paper,May 2017-Recommendation[s J].Vaccine,2017,35(43):5753-5755. [13] No authors listed.Human papillomavirus vaccination:ACOG com‐ mittee opinion summary,Number 809[J]. Obstet Gynecol,2020, 136(2):435-436. [14] Xia C,Xu X,Zhao X,et al. Effectiveness and cost‐effectiveness of eliminating cervical cancer through a tailored optimal pathway: A modeling study[J]. BMC Med,2021,19(1):62. [15] Hu Y,Guo M,Li C,et al. Immunogenicity noninferiority study of 2 doses and 3 doses of an Escherichia coli‐produced HPV biva‐ lent vaccine in girls vs.3 doses in young women[J]. Sci China Life Sci,2020,63(4):582-591. [16] Zhu F,Li J,Hu Y,et al. Immunogenicity and safety of the HPV- 16/18 AS04-adjuvanted vaccine in healthy Chinese girls and women aged 9 to 45 years[J]. Hum Vaccin Immunother,2014, 10(7):1795-1806. [17] Puthanakit T,Huang LM,Chiu CH,et al. Randomized open tri‐ al comparing 2-dose regimens of the human papillomavirus 16/18 AS04-adjuvanted vaccine in girls aged 9-14 years versus a 3- dose regimen in women aged 15-25 years[J]. J Infect Dis,2016, 214(4):525-536. [18] Li R,Li Y,Radley D,et al. Safety and immunogenicity of a vac‐ cine targeting human papillomavirus types 6,11,16 and 18:A randomized,double‐blind,placebo‐controlled trial in Chinese males and females[J]. Vaccine,2012,30(28):4284-4291. [19] Dobson SR,Mcneil S,Dionne M,et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: Arandomizedclinicaltria[l J].JAMA,2013,309(17):1793-1802. [20] IversenO,MirandaMJ,UliedA,etal.Immunogenicityofthe9- valent HPV vaccine using 2-Dose regimens in girls and boys vs a 3-dose regimen in women[J]. JAMA,2016,316(22):412-413. [21] Mélanie D,élodie B,Norma P,et al. Population ‐ level impact and herd effects following the introduction of human papillomavi‐ rusvaccinationprogrammes:Updatedsystematicreviewandmeta ‐analysis[J]. Lancet,2019,394(10197):497-509. [22] Lei J,Ploner A,Elfstr?m KM,et al. HPV vaccination and the risk of invasive cervical cance[r J]. N Engl J Med,2021,76(1):1340-1348. [23] Madleen O,Susanne KK,Christian D,et al. The impact of HPV multi‐cohort vaccination:Real‐world evidence of faster control of HPV‐related morbidity[J]. Vaccine,2020,38(6):1345-1351. [24] Folschweiller N,Behre U,Dionne M,et al. Long‐term cross‐re‐ activity against nonvaccine human papillomavirus types 31 and 45 after 2- or 3-dose schedules of the AS04-adjuvanted human HPV-16/18 vaccine[J]. J Infect Dis,2019,219(11):1799-1803. [25] Aregay M,Shkedy Z,Molenberghs G,et al. Model ‐ based esti‐ mates of long‐term persistence of induced HPV antibodies:A flexible subject‐specific approach[J]. J Biopharm Stat,2013, 23(6):1228-1248. [26] David MP,Van Herck K,Hardt K,et al. Long ‐ term persistence of anti ‐ HPV-16 and -18 antibodies induced by vaccination with the AS04-adjuvanted cervical cancer vaccine:modeling of sustained antibodyresponse[s J].GynecolOncol,2009,115(3Suppl):S1-S6. [27] Ferris DG,Samakoses R,Block SL,et al. 4-Valent human pap‐ illomavirus(4vHPV)vaccine in preadolescents and adolescents after 10 years[J]. Pediatrics,2017,140(6):e20163947. [28] Toh ZQ. Evaluation of long‐term immunological responses follow‐ ing reduced ‐ dose quadrivalent human papillomavirus vaccine schedulesinFij[i D].Australia:UniversityofMelbourne,2017. [29] Olsson SE,Restrepo JA,Reina JC,et al. Long‐term immunogenic‐ ity,effectiveness,and safety of nine ‐ valent human papillomavirus vaccine in girls and boys 9 to 15 years of age:Interim analysis after 8 years of follow‐up[J]. Papillomavirus Res,2020,10:100203. [30] Bornstein J,Roux S,Kjeld PL,et al. Three‐year follow‐up of 2- dose versus 3-dose HPV vaccine[J]. Pediatrics,2021,147(1): e20194035. [31] EinsteinMH,LevinMJ,ChatterjeeA,etal.Comparativehumor‐ al and cellular immunogenicity and safety of human papillomavi‐ rus(HPV)-16/18 AS04-adjuvanted vaccine and HPV-6/11/16/ 18 vaccine in healthy women aged 18-45 years:Follow ‐ up through month 48 in a phase III randomized study[J]. Hum Vac‐ cin Immunother,2014,10(12):3455-3465. [32] Reiter PL,Brewer NT,Gottlieb SL,et al. How much will it hurt? HPV vaccine side effects and influence on completion of the three‐dose regimen[J]. Vaccine,2009,27(49):6840-6844. [33] JouraEA,GiulianoAR,IversenOE,etal.A9-valentHPVvac‐ cine against infection and intraepithelial neoplasia in women[J]. N Engl J Med,2015,372(8):711-723. [34] 陈桂珍 . 由大肠杆菌制备的人乳头瘤病毒(16 型和 18 型)二价 疫苗的免疫原性和安全性:II期临床试验[J]. 微生物学免疫 学进展,2016,44(5):85. [35] CDC. HPV vaccine safety[EB/OL].(2021-07-23)[2021-09- 09]. https://www. cdc. gov/vaccinesafety/vaccines/hpv/hpv ‐ safety ‐ faqs.html,2020. [36] Tiffany AS,Paige L,Jorge A,et al. Safety of bivalent human papillomavirus vaccine in the US vaccine adverse event reporting system(VAERS),2009-2017[J]. Br J Clin Pharmacol,2018, 84(12):2928-2932. [37] Jorge EA,Theresa H,Maria C,et al. Post‐licensure safety moni‐ toring of quadrivalent human papillomavirus vaccine in the Vac‐ 华南预防医学2021年9月第47卷第9期 South China J Prev Med,September 2021,Vol.47,No.9 · 1161 · ?cine Adverse Event Reporting System (VAERS) , 2009- 2015[J]. Vaccine,2018,36(13):1781-1788. [38] Phillips A,Patel C,Pillsbury A,et al. Safety of human papillomavi‐ rus vaccines:An updated review[J]. Drug Saf,2018,41(4):329-346. [39] 乔友林,吴婷,李荣成,等 . 双价人乳头瘤病毒疫苗(大肠杆菌) 的有效性研究:一项随机对照临床试验的中期分析[J]. 中国 妇产科临床杂志,2020,21(6):581-584. [40] Edson DM,Stan LB,Daron F,et al. Safety profile of the 9-va‐ lent HPV vaccine:A combined analysis of 7 phase III clinical tri‐ als[J]. Pediatrics,2016,138(2):1-17. [41] Vesikari T,Brodszki N,van Damme P,et al. A randomized, double‐blind,phase iii study of the immunogenicity and safety of a 9-valent human papillomavirus l1 virus‐like particle vaccine (V503)versus Gardasil? in 9-15-year‐old girls[J]. Pediatr In‐ fect Dis J,2015,34(9):992-998. [42] No authors listed.Meeting of the global advisory committee on vac‐ cine safety,7-8 June 2017[J]. Wkly Epidemiol Rec,2017, 92(28):393-402. [43] Ojha RP,Jackson BE,Tota JE,et al. Guillain‐Barre syndrome following quadrivalent human papillomavirus vaccination among vaccine‐eligible individuals in the United States[J]. Hum Vaccin Immunother,2014,10(1):232-237. [44] Miranda S,Chaignot C,Collin C,et al. Human papillomavirus vaccination and risk of autoimmune diseases:A large cohort study of over 2million young girls in France[J]. Vaccine,2017, 35(36):4761-4768. [45] Vielot NA,Becker‐Dreps S. Hazard of complex regional pain syn‐ drome following human papillomavirus vaccination among adoles‐ cent girls in the United States:A case‐cohort analysis of insurance claims data[J]. Expert Opin Drug Saf,2020,19(1):107-112. [46] 汪安石,黄演林,刘畅,等 .(围)妊娠期 HPV 疫苗接种对后代 出生缺陷发生风险的影响[J]. 中国产前诊断杂志(电子版), 2020,12(3):34-39. [47] 赖婷,王艳萍,李小洪,等 . 预防性接种人乳头瘤病毒疫苗对妊 娠结局的影响[J]. 中华妇幼临床医学杂志(电子版),2018, 14(6):621-628. [48] 郭建铭,郑斌,李娜,等 . 人乳头瘤病毒疫苗预防中国女性宫颈 癌药物经济学研究的系统评价[J]. 中国现代应用药学,2021, 38(4):445-452. [49] European Medicines Agency. Assessment report cervarix[EB/ OL].(2013-01-01)[2021-09-09]. https://www. ema. europa. eu/ en/medicines/human/EPAR/cervarix,2013. [50] Aljunid S,Maimaiti N,Nur AM,et al. Cost ‐ effectiveness of HPV vaccination regime:Comparing twice versus thrice vaccina‐ tions dose regime among adolescent girls in Malaysia[J]. BMC Public Health,2016,16:71. [51] Prinja S,Bahuguna P,Faujdar DS,et al. Cost ‐ effectiveness of human papillomavirus vaccination for adolescent girls in Punjab state: Implications for India's universal immunization pro‐ gram[J]. Cancer,2017,123(17):3253-3260. [52] PhuaLC,ChoiH,WuJ,etal.Cost‐effectivenessanalysisofthe nonavalent human papillomavirus vaccine for the prevention of cer‐ vical cancer in Singapore[J]. Vaccine,2021,39(16):2255-2263. [53] Mahumud RA,Gow J,Alam K,et al. Cost ‐ effectiveness of the introduction of two ‐ dose bi ‐ valent(Cervarix)and quadrivalent (Gardasil) HPV vaccination for adolescent girls in Bangla‐ desh[J]. Vaccine,2020,38(2):165-172. [54] MenniniFS,BonanniP,BianicF,etal.Cost‐effectivenessanal‐ ysis of the nine ‐ valent HPV vaccine in Italy[J]. Cost Eff Resour Alloc,2017,15:11. [55] Zou Z,Fairley CK,Ong JJ,et al. Domestic HPV vaccine price and economic returns for cervical cancer prevention in China:A cost‐effectiveness analysis[J]. Lancet Glob Health,2020,8(10): e1335-e1344. [56] 徐小倩,由婷婷,胡尚英,等 . 全球人乳头瘤病毒疫苗接种指南 制定现状的系统综述[J]. 中华医学杂志,2021,101(24): 1890-1898. [57] WHO.Vaccine in national immunization program update[R]. Ge‐ neva:WHO:2020. [58] BruniL,SauraA,MontoliuA,etal.HPVvaccinationintroduction worldwide and WHO and UNICEF estimates of national HPV immu‐ nization coverage 2010-2019[J]. Prev Med,2020,144:106399. [59] 冯雪娇,侯海龙,喻琼,等 . 我国宫颈癌疫苗市场分析及对策研 究[J]. 中国生物工程杂志,2020,40(11):96-101. [60] 史金晶,张肖肖,郑徽,等 . 中国大陆青少年家长人乳头瘤病毒 疫苗认知度和接受度 Meta 分析[J]. 中国疫苗和免疫,2019, 25(4):464-470. [61] Mcclymont E,Lee M,Raboud J,et al. The efficacy of the quadri‐ valent human papillomavirus vaccine in girls and women living with human immunodeficiency virus[J]. Clin Infect Dis,2019, 68(5):788-794. [62] Macintyre CR,Shaw PJ,Mackie FE,et al. Long term follow up of persistence of immunity following quadrivalent Human Papillo‐ mavirus(HPV)vaccine in immunocompromised children[J]. Vaccine,2019,37(37):5630-5636. [63] Ingrid HRG,Natalia FP,Aline L,et al. Safety and immunoge‐ nicity of the quadrivalent human papillomavirus vaccine in pa‐ tients with childhood systemic lupus erythematosus:A real‐world interventional multi ‐ centre study[J]. Lupus,2020,29(8) : 096120332092840. [64] Praditpornsilpa K,Kingwatanakul P,Deekajorndej T,et al. Immu‐ nogenicity and safety of quadrivalent human papillomavirus types 6/ 11/16/18 recombinant vaccine in chronic kidney disease stage IV,V and VD[J]. Nephrol Dial Transplant,2017,3(2 1):132-136. (收稿日期:2021-03-28) (本文编辑:万东华,江金女)
闫丽隽 主任医师 山西省肿瘤医院 妇科948人已读 - 就诊指南 子宫内膜癌指南
?《中国癌症杂志》2021年第31卷第6期 CHINAONCOLOGY 2021 Vol.31 No.6 欢迎关注本刊公众号 501 ·指南与共识· 子宫内膜癌诊断与治疗指南(2021年版) 中国抗癌协会妇科肿瘤专业委员会 [关键词] 子宫内膜癌;诊断;治疗;指南 DOI: 10.19401/j.cnki.1007-3639.2021.06.08 中图分类号:R737.33?文献标志码:A?文章编号:1007-3639(2021)06-0501-12 ?子宫内膜癌在中国居女性生殖系统恶性肿 瘤的第二位,在发达国家居首位[1-2]。据2019年 国家癌症中心统计,中国子宫内膜癌发病率为 10.28/10万,死亡率为1.9/10万。相关危险因素包 括持续雌激素暴露[如卵巢排卵功能障碍,分泌 雌激素的卵巢肿瘤(无孕激素保护的雌激素替代 治疗,选择性雌激素受体调节剂治疗,如他莫昔 芬等)]、代谢异常(如肥胖、糖尿病)、初潮 早、未育、绝经延迟、携带子宫内膜癌遗传易感 基因,如林奇综合征(Lynch syndrome)以及高 龄等。近年来,由于高脂高热饮食和低运动量生 活方式的影响,子宫内膜癌在我国的发病率呈上 升趋势。 约有70%的子宫内膜癌诊断时肿瘤局限于子 宫体,属临床早期,预后较好。部分患者可能因 忽略早期不规则阴道流血和阴道排液等症状而失 去早期诊断和治疗的机会。 子宫内膜癌的预后与发病年龄、分期、肿瘤 的分化程度、病理学类型有关,高龄、分期晚、 低分化的患者预后更差[3-4]。临床上可将子宫内 膜癌分为I型和II型(Bokhman分型)[5],I 型为激素依赖型,病理类型以子宫内膜样癌为 主,预后较好;II型为非激素依赖型,主要包括 浆液性癌、透明细胞癌、癌肉瘤等,预后较差。 子宫内膜癌的主要治疗手段为手术和放化 疗。近年来,随着临床研究的开展,靶向治疗和 免疫治疗也在子宫内膜癌中显示出良好的疗效。 此外,基因检测的广泛应用,不仅为Lynch综合 征等遗传性子宫内膜癌的诊断提供依据,更为子 宫内膜癌的分子分型和靶向药物的选择提供指 引。临床医师需要综合分析患者的临床、病理 学、分子特征等因素,结合指南推荐,在规范诊 疗的基础上为患者制定个体化的治疗措施。本指 南的更新基于重要的临床研究结果,为临床诊治 提供参考。 1 遗传咨询与干预 子宫内膜癌绝大部分为散发性,但约有 5%的患者为遗传性子宫内膜癌。以错配修复 (mismatch repair,MMR)系统基因胚系突变 为特征的Lynch综合征是最常见的遗传性子宫 内膜癌,其他还包括以PTEN基因胚系突变为主 要特征的Cowden综合征等。遗传性子宫内膜癌 患者平均发病年龄较散发性患者小10~20岁。 Lynch综合征为常染色体显性遗传性疾病,患 者及其家族成员具有DNA MMR系统(MLH1、 MSH2、MSH6和PMS2)之一或EPCAM基因的 胚系突变。Lynch综合征也是最常见的遗传性 结直肠癌,患者80岁前患结直肠癌的风险为 8.7%~61.0%,女性患子宫内膜癌风险为21.0% ~57.0%,患卵巢癌风险为≤1.0%~38.0%。此 外,患者发生胃、小肠、肝、胆和泌尿系统恶性 肿瘤的风险也较普通人群增加[6-11]。 1.1 子宫内膜癌患者Lynch综合征的筛查 在条件允许时,建议对所有子宫内膜癌患者 行Lynch综合征筛查。在条件有限时,至少对以 下子宫内膜癌患者进行Lynch综合征筛查: (1) ≤60岁时诊断为子宫内膜癌。 (2) 任何年龄被诊断为子宫内膜癌,同时具有 502 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) ?以下一个或几个危险因素:患者本人同时或先后 患有Lynch综合征相关癌症;一位一级亲属在60 岁或更年轻时患Lynch综合征相关癌症;病理学 检查强烈提示Lynch综合征相关癌症。 针对子宫内膜癌组织进行Lynch综合征的 筛查,包括采用免疫组织化学检测肿瘤组织 MMR蛋白,或检测肿瘤组织微卫星不稳定性 (microsatellite instability,MSI)。如果一个或多 个MMR基因产物表达缺失或MSI高(MSI-high, MSI-H)时,均应高度怀疑Lynch综合征的可能 性,建议患者接受遗传咨询,必要时进行基因检 测以明确诊断。如免疫组织化学检查未见MMR蛋 白表达缺失,但根据患者家族史或其他情况高度 怀疑Lynch综合征时,也应建议患者进行遗传咨询 和进一步检查。肿瘤组织MMR免疫组织化学检查 和MSI检测对Lynch综合征筛查的敏感性均能达到 90%以上,但免疫组织化学检查更为简便,且成 本较低。 1.2 Lynch综合征患者的管理 对已确诊Lynch综合征的患者,应进行长期的 监测和健康管理,并采取预防措施,及早发现癌 前病变,降低Lynch综合征相关恶性肿瘤的发病风 险和死亡率。 首先应进行充分的健康教育,让患有Lynch 综合征的女性认识到罹患子宫内膜癌、结直肠 癌、卵巢癌和其他恶性肿瘤的风险[6]。对子宫 内膜癌的筛查,一般可以从35岁开始监测,亦可 根据患者特定基因突变类型和家族史,来确定开 始监测子宫内膜的年龄。建议每年进行子宫内膜 取样或经阴道超声检查监测子宫内膜情况[12]。 并建议定期进行肠镜检查,以降低患结直肠癌的 风险。 携带胚系MLH1、MSH2、MSH6基因突变的 女性,完成生育后,可考虑在40岁之前接受预防 性的子宫和双附件切除,以降低子宫内膜癌和卵 巢癌的发病风险[13]。这类患者术后可采用激素 替代治疗,直至自然绝经年龄。在未切除子宫和 双侧附件之前,Lynch综合征的女性患者可使用 口服避孕药,以降低子宫内膜癌和卵巢癌的发病 风险。口服阿司匹林有助于预防Lynch综合征结 直肠癌的发生。 2 诊断 2.1 症状与体征 2.1.1 不规则阴道流血、排液 约90%的子宫内膜癌患者有不规则阴道流血 症状,通常发生在绝经后。有的患者表现为阴道 异常排液,可为浆液性或血性分泌物。围绝经期 患者可以表现为月经量增多、月经期延长、月经 淋漓不尽、月经间期出血等。应注意一些子宫内 膜良性病变同样可以引起类似症状,如子宫内膜 息肉、子宫内膜增生等。 2.1.2 子宫增大及其他晚期表现 因大部分子宫内膜癌诊断时为早期,体检往 往没有子宫增大等阳性体征。若肿瘤侵犯子宫颈 内口,导致子宫腔积血或积脓,可引起下腹胀痛 及痉挛样疼痛。晚期患者因癌组织侵犯周围组织 或神经可引起下腹及腰骶部疼痛。 2.2 评估 初次评估包括现病史、既往史、家族史、体 格检查、影像学检查、子宫颈细胞学检查、子宫 内膜活检等。通过子宫内膜活体组织病理学检查 可以明确诊断,并进行初步的临床分期。 2.2.1 子宫内膜活检 结合患者临床表现和辅助检查,高度怀疑 子宫内膜病变时,应进行子宫内膜活检以明确 诊断。子宫内膜活检方式包括子宫内膜吸取活 检、诊断性刮宫或宫腔镜下诊断性刮宫等。子 宫内膜活体组织病理学检查是确诊子宫内膜癌 的“金标准”。病理学检查报告需要详细地描 述病理学类型及分化程度等特征,必要时需进 行免疫组织化学检查。 由于子宫内膜病变多灶性的特点,子宫内膜 活检可能存在约10%的假阴性。如果临床高度怀 疑子宫内膜癌,但子宫内膜活检未提示子宫内膜 癌时,应考虑再次行诊断性刮宫或宫腔镜检查, 以减少漏诊。由于子宫内膜病变病理学诊断存在 一定的不符合率,建议施治医院对外院诊断患者 的病理切片进行复核[14]。应注意子宫内膜活检 并不能判断子宫内膜癌浸润肌层深度,也难以诊 断子宫肌层来源的恶性肿瘤。 《中国癌症杂志》2021年第31卷第6期 2.2.2 影像学检查 术前的影像学检查可以了解子宫肌层浸润深 度和腹膜后淋巴结状况,帮助诊疗方案的制定。 1 超声检查是子宫内膜癌最常用的检查方法, 盆腔超声可以初步了解子宫体大小、子宫内膜厚 度、肌层浸润情况、附件有无占位等,经阴道彩 超检查的准确性更高。2 盆腹腔增强MRI或增强 CT。用于评估子宫肿瘤累及范围、盆腹腔淋巴结 及其他器官累及情况。首选增强MRI,其对评估 子宫内膜癌灶子宫肌层浸润深度和范围、子宫颈 间质受累情况具有较高的特异性[15-17]。3 胸部影 像学检查推荐胸部CT扫描[18]。4 对于有可疑远 处转移的患者,推荐全身PET/CT检查[19]。 2.2.3 肿瘤标志物检测 对于子宫内膜癌,尚无特异敏感的肿瘤标 志物可用于诊断与随访。对于有子宫外病变的 患者,糖类抗原125(carbohydrate antigen 125, CA125)有助于监测临床治疗效果。但炎症或者 放射损伤等因素也会引起CA125异常升高,而 有些患者(如阴道孤立转移)的CA125可能并不 升高。因此,在缺乏其他临床表现时,CA125 不能准确预测复发[20]。人附睾蛋白4(human epididymal protein 4,HE4)的检测对子宫内 膜癌患者的诊断和预后预测可能有一定的参考 价值[21-22]。 3 子宫内膜癌的分类 2020年世界卫生组织(World Health Organi- zation,WHO)对子宫内膜癌病理学类型进行了 修订,并整合了子宫内膜癌的分子分型。 3.1 子宫内膜癌主要病理学类型 (1) 子宫内膜样癌(endometrioid carcinoma) 非特指型(non otherwise-specified,NOS): POLE超突变型内膜样癌(POLE-ultramutated endometrioid carcinoma)、错配修复缺陷型内 膜样癌(mismatch repair-deficient endometrioid carcinoma)、p53突变型内膜样癌(p53-mutated endometrioid carcinoma)、无特异性分子谱的内 膜样癌(no-specific molecular profile endometrioid carcinoma)。 (2) 浆液性癌非特指型(serous carcinoma 503 NOS)。 (3) 透明细胞癌非特指型(clear cell carcinoma NOS)。 (4) 未分化癌非特指型(carcinoma,undiffer- entiated,NOS)。 (5) 混合细胞癌(mixed cell carcinoma)。 (6) 中肾腺癌(mesonephric adenocarcinoma)。 (7) 鳞状细胞癌非特指型(squamous cell carcinoma NOS)。 (8) 黏液性癌,肠型(mucinous carcinoma, intestinal type)。 (9) 癌肉瘤非特指型(carcinoma NOS)。 3.2 子宫内膜癌分子分型 2013年,癌症基因组图谱(The Cancer Genome Atlas,TCGA)根据全基因组测序基 因特征(有无POLE基因超突变、MMR缺失、 拷贝数变异等)将子宫内膜癌分为4种分子类 型[23]。此后基于TCGA分子分型,不同的组织 机构制定了对这4种分型的命名和诊断流程, 方法大同小异,对4种分子分型的命名整合如 下:1 POLE超突变型;2 MSI-H型(微卫星 不稳定型)或错配修复系统缺陷(mismatch repair-deficient,dMMR)型;3 微卫星稳定 (microsatellite stability,MSS)型或无特异性分 子谱(no-specific molecular profile,NSMP)型或 低拷贝型;4 p53突变型或高拷贝型。子宫内膜 癌分子分型有助于预测患者预后和指导治疗。其 中POLE超突变型预后极好,这类患者如果手术 分期为I~II期,术后可考虑随访,不做辅助治 疗。MSI-H型预后中等,对免疫检查点抑制剂的 治疗敏感,但目前的证据仅限于晚期和复发病 例。MSS型预后中等,对激素治疗较敏感,年轻 患者保育治疗效果较好。p53突变型预后最差, 对化疗可能敏感。 子宫内膜癌分子分型在不依赖肿瘤形态学 特征的前提下,通过分子特征进行分类,提升 了子宫内膜癌诊断的准确性和可重复性。结合 临床病理学特征和分子分型对子宫内膜癌进行 风险分层和指导临床诊疗是今后子宫内膜癌诊 疗的方向。 ? 504 4 手术病理分期 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) 表 1 子宫内膜癌2009年FIGO手术—病理学分期 ?子宫内膜癌多采用手术病理学分期[24]。目 前采用的子宫内膜癌的分期包括第8版美国癌症 联合会(American Joint Committee on Cancer, AJCC)的TNM分期(2017年版)和国际妇产科 联盟(International Federation of Gynecology and Obstetrics,FIGO)的FIGO分期(2009年版)。 具体见表1、2。 手术病理学分期需通过全面分期手术,对子 宫、输卵管、卵巢及淋巴结等进行病理学评估后 进行分期[25]。然而,并非所有子宫内膜癌患者 都适合用手术病理学分期,如部分年轻的希望保 留生育功能的患者、有严重的内科疾患或手术禁 忌证无法接受手术的患者、单纯放疗或需要术前 分期 I IA IB II III IIIA IIIB IIIC IIIC1 IIIC2 IV IVA IVB 描述 肿瘤局限于子宫体 肿瘤浸润深度<1/2肌层 肿瘤浸润深度≥1/2肌层 肿瘤侵犯子宫颈间质,但无子宫体外蔓延 肿瘤局部和(或)区域扩散 肿瘤累及子宫浆膜层和(或)附件 阴道和(或)子宫旁受累 盆腔淋巴结和(或)腹主动脉旁淋巴结转移 盆腔淋巴结转移 腹主动脉旁淋巴结转移,伴或不伴盆腔淋巴结转移 肿瘤侵及膀胱和(或)直肠黏膜,和(或)远处转移 肿瘤侵及膀胱和(或)直肠黏膜 远处转移,包括腹腔内和(或)腹股沟淋巴结转移 ??TNM分期 FIGO分期 原发肿瘤定义(T) TX T0 T1 表 2 子宫内膜癌TNM(2017年)和FIGO(2009年)手术分期系统 标准 原发肿瘤无法评估 无原发肿瘤证据 肿瘤局限于宫体,包括子宫颈腺体累及 肿瘤局限于子宫内膜或浸润子宫肌层小于1/2 肿瘤浸润子宫肌层大于等于1/2 肿瘤浸润子宫颈间质结缔组织,但未超出子宫。不包括子宫颈腺体累及 肿瘤累及浆膜、附件、阴道或宫旁 肿瘤累及浆膜和(或)附件(直接浸润或转移) 阴道累及(直接浸润或转移),或子宫旁累及 肿瘤浸润膀胱黏膜和(或)肠黏膜大泡性水肿不足以将肿瘤定义为T4 区域淋巴结无法评估 无区域淋巴结转移 区域淋巴结见孤立肿瘤细胞≤0.2 mm 盆腔区域淋巴结转移 盆腔区域淋巴结转移(转移灶直径>0.2~2.0 mm) 盆腔区域淋巴结转移(转移灶直径>2.0 mm) 腹主动脉旁淋巴结转移,伴或不伴盆腔淋巴结转移 腹主动脉旁区域淋巴结转移(转移灶直径>0.2~2.0 mm),伴或不伴盆腔淋巴结转移 腹主动脉旁区域淋巴结转移(转移灶直径>2.0 mm),伴或不伴盆腔淋巴结转移 无远处转移 ??远处转移(包括转移至腹股沟淋巴结、腹腔内病灶、肺、肝或骨) ??(不包括转移至盆腔或腹主动脉旁淋巴结、阴道、子宫浆膜面或附件) 尽管腹水或腹腔冲洗液细胞学检查结果不影响FIGO分期,但是细 胞学阳性是不良预后因素,因此仍应常规送检,并单独报告 ?T1a T1b T2 T3 T3a T3b T4 I IA 区域淋巴结定义(N) NX N0 N0 (i+) N1 N1mi N1a N2 N2mi N2a IIIC1 IIIC1 IIIC1 IIIC2 IIIC2 IIIC2 IB II III IIIA IIIB IVA 如仅通过前哨淋巴活检发现有转移,?N前加sn 远处转移定义(M) M0 M1 IVB ? 《中国癌症杂志》2021年第31卷第6期 放疗的患者。对这些患者仍采用1971年FIGO发 布的临床分期标准[26]。 5 治疗 5.1 基本原则 子宫内膜癌治疗以手术为主,放疗和化疗是 常用的辅助治疗方式。制定治疗方案应结合患者 的年龄、病理学类型和分子分型、临床(影像) 分期、体能状态等综合考虑决策。 手术可采用开腹、经阴道、腹腔镜或机器人 手术系统等方式。无论采取何种手术方式,均要 坚持无瘤原则,子宫切除后应完整取出,禁止采 用子宫粉碎术取标本。肿瘤局限于子宫者(临床 I/II期)应行全面分期手术,推荐术中取腹腔 冲洗液送细胞病理学检查,并作记录。术中全面 探查评估腹膜、膈肌以及腹腔器官,并对可疑处 取样活检。 对临床I/II期的子宫内膜癌,前哨淋巴结 定位切除是系统性淋巴结清扫的可选择替代方 案。但前哨淋巴结定位切除可能更适合于中低危 患者(不存在任何高危因素或仅存在以下一个高 危因素:深肌层浸润、G2或G3、Ia期非内膜样 癌无肌层浸润)。如果一侧盆腔未检出前哨淋巴 结,则该侧需行系统性淋巴结切除术。推荐对前 哨淋巴结进行病理超分期。 对年龄<45岁的低级别子宫内膜样癌、子宫 肌层浸润<1/2、术前检查和术中评估无卵巢累及 和子宫外转移证据的绝经前患者,可考虑保留 卵巢,但应切除双侧输卵管。对有胚系BRCA突 变、Lynch综合征或子宫内膜癌家族史的患者, 不建议保留卵巢。 对有子宫外转移的晚期患者,经多学科协作 团队(multi-disciplinary team,MDT)评估能完 全切除病灶,且手术风险和对术后生活质量的影 响可被接受者,可考虑行肿瘤细胞减灭术(包括 切除肿大淋巴结)。如果基于影像学检查和手术 探查发现有明显子宫外转移病灶,为了分期目的 进行淋巴结切除是不必要的。 5.2 子宫内膜癌初始治疗[27] 5.2.1 病灶局限于子宫体 按照手术分期原则进行全面分期手术。基本术 505 式为全子宫切除术+双附件切除术±盆腔和腹主动 脉旁淋巴结切除术,术中取腹腔冲洗液送细胞学检 查。可选择前哨淋巴结活检结合病理学超分期替 代淋巴结系统切除。对诊刮病理学检查结果为子 宫内膜浆液性癌、癌肉瘤及未分化癌的患者,应 切除大网膜或进行大网膜活检。对先前接受了不 完全分期手术的中高危或高危患者,应考虑进行 再分期手术。 对有手术禁忌证的患者,可选择盆腔外照射放 疗±阴道近距离放疗。少数患者可考虑内分泌治疗。 5.2.2 子宫颈疑有/已有肿瘤浸润 子宫颈活检、子宫颈管搔刮病理学检查结 果为阳性,或盆腔MRI检查显示子宫颈间质受累 者,可行全子宫切除或广泛全子宫切除为基础的 分期手术。目前无证据显示广泛全子宫切除术较 全子宫切除术能改善这些患者的预后。不适合手 术者可先行盆腔外照射放疗+阴道近距离放疗±系 统治疗,放疗后必要时可再考虑手术治疗。 5.2.3 病变超出子宫 临床体检和影像学检查发现有子宫外病灶的 患者,需充分评估是否适合行初始手术治疗。 (1) 病变已超出子宫,但仍局限于腹、盆腔内 者,可行肿瘤细胞减灭术,包括全子宫切除+双 附件切除术±淋巴结切除(切除肿大的淋巴结)± 腹盆腔内肿物切除±大网膜切除等,术后给予系 统治疗。也可考虑新辅助化疗后再手术。 (2) 出现远处转移者,则以系统治疗为主,根 据系统治疗的效果,再次评估是否可以手术治疗 (姑息性子宫+双附件切除)和(或)盆腔放疗。 (3) 局部扩散但不适合手术者,也可先行盆腔 外照射±阴道近距离放疗±系统治疗,然后再次评 估是否可以手术治疗。 5.3 术后辅助治疗[13] 子宫内膜癌患者术后应根据病理学危险因素 进行分级(表3),以决定是否需要辅助治疗及 其方法。 5.3.1 低危子宫内膜癌 对低危子宫内膜癌,包括I/II期POLE超突 变型和IA期dMMR/NSMP内膜样癌+低级别+无 或局灶淋巴脉管间隙浸润(lymphovascular space ? 506 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) ?表 3 预后危险因素定义和分组(引自ESGO/ESTRO/ESP 2020子宫内膜癌指南) ?危险分组 分子分型未知 * 低危 IA期内膜样癌+低级别 +LVSI无或局灶 中危 IB期内膜样癌+低级别*+LVSI无或局灶 IA期内膜样癌+高级别*+LVSI无或局灶 IA期非内膜样癌(浆液性癌、透明细胞癌、未分化癌、?癌肉瘤、混合细胞癌)不伴肌层浸润 高-中危 I期内膜样癌+弥漫LVSI,无论级别与浸润深度 IB期内膜样癌+高级别*,无论LVSI状态 II期 高危 III~IVA期,无残留病灶 I~IVA期,非内膜样癌(浆液性癌、透明细胞癌、未分化癌、?癌肉瘤、混合细胞癌)伴肌层浸润,无残留病灶 晚期转移 III~IVA期伴残留病灶 IVB期 分子分型已知△ I~II期,POLEmut内膜样癌,无残留病灶 IA期dMMR/NSMP内膜样癌+低级别*+LVSI无或局灶 IB期dMMR/NSMP内膜样癌+低级别*+LVSI无或局灶 IA期dMMR/NSMP内膜样癌+高级别*+LVSI无或局灶 IA期p53abn和(或)非内膜样癌(浆液性癌、透明细胞癌、未分化癌、?癌肉瘤、混合细胞癌)不伴肌层浸润 I期dMMR/NSMP内膜样癌+弥漫LVSI,无论级别或浸润深度 IB期dMMR/NSMP内膜样癌高级别*,无论LVSI状态 II期dMMR/NSMP内膜样癌 III~IVA期,dMMR/NSMP内膜样癌无残留病灶 I~IVA期,p53abn内膜样癌伴肌层浸润,无残留病灶 I~IVA期dMMR/NSMP非内膜样癌(浆液性癌、未分化癌、癌肉瘤),?伴肌层浸润,无残留病灶 III~IVA期伴残留病灶,任何分子分型 IVB期,任何分子分型 ??△:对III~IVA期POLEmut子宫内膜样癌和I~IVA期dMMR或NSMP透明细胞癌伴肌层浸润者,没有充分的数据将这些患者分配到分子分型 的预后危险组别中去。建议进行前瞻性登记;*:根据FIGO分级两分类,G1和G2定义为低级别,G3为高级别 invasion,LVSI)的患者,不推荐进行辅助治 疗。POLE超突变型的III/IVA期患者是否属于低 危子宫内膜癌,目前尚无定论,也缺乏不进行辅 助治疗的证据,推荐患者参加前瞻性临床试验。 5.3.2 中危子宫内膜癌 近距离腔内放疗可以减少中危子宫内膜癌 患者的复发风险,对中危患者也可不进行辅助治 疗,尤其是60岁以下的患者。已知分子分型后, p53abn内膜样癌局限于内膜层或不伴肌层浸润 者,通常不建议辅助治疗。 5.3.3 高-中危子宫内膜癌 淋巴结分期为pN0患者,近距离放疗可减少 高-中危子宫内膜癌的复发。弥漫LVSI和II期患 者可考虑辅助盆腔外照射,或考虑辅助化疗,特 别是高级别和(或)弥漫LVSI的情况。患者如果 能密切随访,也可以选择不进行辅助治疗。 未进行淋巴结分期手术(cN0/pNx)的高-中 危患者,推荐术后进行盆腔外照射,尤其是弥漫 LVSI和(或)II期患者。除放疗外也可考虑增加 辅助化疗,尤其是高级别和(或)弥漫LVSI时。 对高级别不伴LVSI的患者以及II期内膜样癌G1患 者可选择单纯阴道近距离放疗。 5.3.4 高危子宫内膜癌 推荐术后进行盆腔外照射联合化疗。单纯化 疗可作为替代方案。癌肉瘤的术后治疗参照高危 内膜癌治疗方案,而不是子宫肉瘤方案。 5.3.5 晚期子宫内膜癌有术后残留病灶的辅助治疗 接受手术治疗的III/IV期子宫内膜癌患者, 如果术后有残留的转移淋巴结病灶、术后切缘阳 性(包括阴道切缘阳性、盆侧壁受累)、或盆腔 内病灶残留者,应经MDT讨论,采用化疗±放疗 的个体化治疗方法。 5.4 已行不完全分期手术患者的处理[28] 5.4.1 观察 IA期+低级别+LVSI阴性+年龄<60岁, 或IA期+高级别+LVSI阴性+无肌层浸润+年 龄<60岁的患者,可考虑随访观察。 5.4.2 阴道近距离放疗 IA期+LVSI阴性+高级别+年龄<60岁, 或IB期+低级别+LVSI阴性+年龄<60岁,应 先行影像学检查,若影像学检查阴性,给予阴道 近距离放疗。 5.4.3 补充分期手术 IA期+任何级别+LVSI阳性,或IB期+ 低级别+LVSI阳性,或IB期+高级别±LVSI, 或II期患者,可直接补充行手术进行全面分期。 也可先行影像学检查,若影像学检查阴性,按照 I期或II期给予相应的辅助治疗。若影像学检查 《中国癌症杂志》2021年第31卷第6期 507 ?可疑或阳性,应进行再次手术分期或对可疑病灶 进行病理学检查确诊。 5.4.4 系统治疗±盆腔外照射±阴道近距离放疗 适用于初次手术已确定为IIIA期以上的患者。 6 要求保留生育功能患者的治疗及监测 6.1 保留生育功能患者需满足的条件 必须同时满足以下条件: (1) 诊断性刮宫病理学检查结果为分化好 (G1)的内膜样癌,建议经三级医院的病理学专 家评估确认。 (2) 增强MRI(首选)或者阴道超声检查发现 病变局限于子宫内膜。影像学检查无其他可疑转 移病灶。 (3) 没有内分泌药物治疗或妊娠的禁忌。 (4) 患者有强烈的保留生育愿望,对子宫内膜癌 保留生育功能治疗所存在的风险充分知情同意。 6.2 保留生育功能治疗的方法 (1) 治疗前需要由生殖医学专家进行生育力相 关评估,且确认未怀孕。 (2) 子宫内膜癌组织需行MMR蛋白或MSI检 测。以下情况应进行遗传咨询和进一步胚系基因 检测:存在MMR异常或MSI(排除MLH-1启动子 甲基化);MMR表达正常或MSS,或未行MMR 筛查,但有子宫内膜癌和(或)结直肠癌家族 史者。 (3) 采用以孕激素为基础的连续治疗:可口服 醋酸甲地孕酮、醋酸甲羟孕酮,或使用左炔诺孕 酮子宫内装置[29-31]。 (4) 进行体重管理和生活方式指导。 (5) 在治疗期间,每3~6个月进行子宫内膜病 理学检查评估,可采用诊断性刮宫或宫腔镜下子 宫内膜活检,推荐宫腔镜检查评估子宫内膜。 (6) 治疗6~12个月后,子宫内膜病理学检查 评估证实完全缓解者,鼓励妊娠。如暂时无生育 要求,应予以孕激素保护子宫内膜。 (7) 完全缓解患者也应严密随访,每6个月进 行1次子宫内膜活检。 (8) 建议患者完成生育后进行全子宫+双侧输 卵管切除±卵巢切除±分期手术。根据术后的危险 因素决定后续治疗[13,28,32]。 (9) 如果激素治疗期间病情进展,或治疗 6~12个月子宫内膜癌持续存在者,建议手术治疗 (全子宫+双侧输卵管切除±卵巢切除±淋巴结 切除)。根据患者年龄及基因检测结果,评估决 定是否保留卵巢和是否需要后续治疗。 7 子宫内膜癌的放疗 7.1 放疗原则 放疗主要用于子宫内膜癌的术后辅助治疗。 对于不适合手术的各期子宫内膜癌的患者,也可 选择放疗,包括体外照射和(或)近距离腔内照 射。放疗前必须进行影像学检查以评估局部照射 范围和排除远处转移。一般体外放疗包括盆腔区 域和(或)腹主动脉区域。单独近距离放疗可以 用于术前或术后的辅助放疗。 7.2 放疗范围及剂量 放疗技术推荐使用适形调强放疗(intensity- modulated radiotherapy,IMRT)。 (1) 盆腔放疗的靶区应包括肉眼可见的病灶 (如果存在)、髂总、髂外、髂内、闭孔、宫 旁、骶前淋巴结区域、阴道上部和阴道旁组织 (子宫颈受累的患者)。 (2) 如术后病理学或影像学检查结果显示腹主 动脉旁区域淋巴结阳性,应给予延伸野放疗。延 伸照射野应包括盆腔区、整个髂总和腹主动脉旁 淋巴结区。延伸野的上界取决于临床情况,但至 少应到达肾血管上方1~2 cm。 (3) 盆腔的照射区域,特别是在子宫切除术 后,应考虑肠管和膀胱充盈的影响。临床靶体 积(clinical target volume,CTV)包括器官运动 和变形范围的内靶区(internal target volume, ITV),应完全在照射野中覆盖。 (4) 亚临床病灶区域放疗剂量通常应用45~ 50 Gy。如术后病理学检查显示子宫切除术后阴 道切缘阳性或肿瘤近阴道切缘,可以考虑联合阴 道近距离放疗。黏膜表面4~6 Gy×2~3次为阴道 近距离放疗推量时的常用方案。 (5) 术后如果有肉眼残留的病灶,并且可以被 准确定位,在考虑周围正常组织可以耐受的前提 下,可以推量照射至60~70 Gy。 (6) 对于肿大淋巴结,在周围正常组织可以耐 508 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) ?受的前提下,可以推量照射至60~65 Gy。 (7) 近距离放疗应在阴道切缘愈合后尽早开 始,一般在6~8周最好,原则上不超过12周。近距 离放疗采用阴道表面或阴道黏膜下0.5 cm,剂量通 常视体外放疗剂量而定。子宫切除术后阴道近距 离放疗范围不应该超过阴道上2/3,对弥漫脉管瘤 栓或切缘阳性者,阴道放疗范围可延长。 (8) 对单独高剂量率(high dose rate,HDR) 阴道近距离放疗,放疗方案包括黏膜表面 6 Gy×5次、黏膜下0.5 cm 7 Gy×3次或5.5 Gy× 4次,虽然黏膜下0.5 cm 7 Gy×3次方案最常应 用,但在某些病例中,使用更小的分割可能会进 最佳证据,如果单独使用近距离放疗,剂量应 至少达到48 Gy;如果近距离照射与外照射联 合,剂量应增加至65 Gy。如果能利用MRI勾 画出残留肿瘤,则建议此处剂量(gross tumor volume,GTV)可增加至80 Gy及以上。 8 子宫内膜癌的系统治疗 8.1 系统治疗原则 基于目前的研究结果,大部分子宫内膜癌患 者不需要接受系统治疗。对于转移性/复发性子 宫内膜癌患者,或高危型患者术后的辅助治疗, 在能耐受的前提下,联合化疗方案是系统治疗的 首选。 一步减少毒性。 激素治疗主要用于广泛转移、雌激素 (9) 对无放疗史的复发性子宫内膜癌患者, 放疗野应根据复发病灶个体化设计。可以考虑 在总剂量等效于75~80 Gy的低剂量率(low dose rate,LDR)照射的方案中,插入1~2次的HDR 照射。 (10) 组织间插植近距离放疗是将多根针/导管 插入肿瘤病灶,可以使靶区的剂量最大化,而对 危及器官的剂量最小化。三维治疗计划允许在 CT和(或)MRI上通过剂量-体积直方图对目标 靶区和危及器官进行体积剂量描绘。剂量和分次 取决于先前的放疗剂量、靶区体积和危及器官剂 量,并将近距离放疗剂量统一换算成相当于2 Gy 时的等效生物剂量,即EQD2,便于与外照射剂 量叠加计算。 (11) 用于根治性治疗的近距离放疗剂量应基 于临床情况个体化。建议采用基于CT和(或) MRI的三维近距离放疗,照射范围包括子宫 体、子宫颈和阴道上部1~2 cm。基于现有的 受体(estrogen receptor,ER)/孕激素受体 (progesterone receptor,PR)阳性、分化好的子 宫内膜样癌患者。 目前,分子靶向药物用于子宫内膜癌治疗 的原则是:1 有阳性的生物标志物;2 用于 二线及以上的治疗。 8.2 化疗方案[28](表4) 转移性/复发性子宫内膜癌或高危型患者术 后辅助系统治疗方案引自美国国立综合癌症网 络(National Comprehensive Cancer Network , NCCN)子宫体肿瘤指南2021年第1版(2021. V1)。卡铂联合紫杉醇是治疗晚期、转移性或 复发性子宫内膜癌的首选化疗方案。其他常用方 案或药物包括:多西他赛联合卡铂、多柔比星联 合顺铂、卡铂联合紫杉醇方案加贝伐珠单抗、脂 质体多柔比星、白蛋白结合型紫杉醇、拓朴替康 等。对病理学类型为癌肉瘤的患者,紫杉醇联合 卡铂(TC方案)也是首选的化疗方案,其他可 表 4 转移性/复发性子宫内膜癌或高危型患者术后辅助系统治疗方案(引自NCCN子宫体肿瘤指南2021.V1) ?首选方案 卡铂+紫杉醇(对癌肉瘤为1类证据) 卡铂+紫杉醇+曲妥珠单抗(对III/IV期或复发的HER2阳性?的浆液性腺癌,曲妥珠单抗可用美国FDA批准的生物?类似物替代) 其他推荐的方案 卡铂+多西他赛(多西他赛可用于有紫杉醇使用禁忌的患者) 顺铂+多柔比星(第1天水化、利尿) 顺铂+多柔比星+紫杉醇(仅用于晚期和复发患者,因毒性较大,应用不广) 卡铂+紫杉醇+贝伐珠单抗(仅用于晚期和复发患者,贝伐珠单抗可用美国FDA 批准的生物类似物替代) 异环磷酰胺+紫杉醇(癌肉瘤) 顺铂+异环磷酰胺(癌肉瘤) ??? 《中国癌症杂志》2021年第31卷第6期 选择化疗方案包括紫杉醇联合异环磷酰胺或顺铂 联合异环磷酰胺。对于一线含铂药物治疗失败后 的患者,目前尚未有高级别的证据确定有效的二 线标准治疗方案。因此,对于这些患者应强烈鼓 励其参加临床试验。 509 8.3 激素治疗方案[28](表5) 高效孕酮如醋酸甲羟孕酮、甲地孕酮是子宫 内膜癌激素治疗的主要药物,其他药物包括雌激 素受体调节剂如他莫昔芬、芳香化酶抑制剂阿那 曲唑和来曲唑等。 ?首选方案 醋酸甲羟孕酮/他莫昔芬(交替) 醋酸甲地孕酮/他莫昔芬(交替) 孕激素类单药: ?醋酸甲羟孕酮 ?甲地孕酮 ?左炔诺孕酮宫内装置 ?(适用于部分保留生育功能的患者) 芳香化酶抑制剂 他莫昔芬 氟维司群 8.4 生物标志物导向的二线系统治疗[28] 曲妥珠单抗:对于III/IV期和复发的子宫内 膜浆液性癌,并且人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达 阳性的患者,可在卡铂联合紫杉醇方案的基础上 加入曲妥珠单抗。 帕博丽珠单抗:用于肿瘤突变负荷高 (tumor mutation burden-high,TMB-H)或 MSI-H/dMMR,前线治疗后进展,或没有满意 替代治疗方案、无法切除的转移性子宫内膜癌 患者。 纳武单抗:适用于dMMR的复发、转移或高 危型子宫内膜癌患者。 仑伐替尼+帕博丽珠单抗:用于晚期或复发 性子宫内膜癌,不存在MSI-H或dMMR,没有手 术或放疗治愈的可能性,并且在前次系统治疗后 进展的患者。 拉罗替尼或恩曲替尼:用于治疗NTRK基因 融合阳性的患者。 9 复发和转移子宫内膜癌的治疗 对复发患者,通常以系统治疗为主,需要综 合考虑复发的部位、病灶数量、既往是否接受过 放疗、相关分子指标等情况,由MDT会诊讨论制 定治疗方案。常用的治疗方法包括放疗、手术治 疗、化疗、分子靶向药物和激素治疗等。 表 5 子宫内膜癌激素治疗方案(引自NCCN 宫体肿瘤指南2021.V1) 其他推荐的方案 维罗莫司/来曲唑 (用于子宫内膜样癌患者) 9.1 局部复发的治疗 9.1.1 既往未接受过放疗或仅接受近距离放疗 (1) 外照射放疗通常是未接受过放疗患者局部 复发的首选治疗方法,必要时可联合阴道近距离 放疗和(或)系统治疗。 (2) 手术切除复发病灶,切除后可酌情考 虑给予术中放疗(intraoperative radiotherapy, IORT)[33-35],如盆侧壁病灶或包膜外受累的转 移淋巴结切除后,可给予针对瘤床的IORT。术 后治疗:1 病变局限在阴道或者阴道旁,术后给 予外照射,可联合阴道近距离放疗或系统治疗; 2 病变局限在盆腔或腹主动脉旁淋巴结,术后给 予外照射,并联合系统治疗;3 上腹部病灶术后 无肉眼可见的残留,给予系统治疗;4 上腹部病 灶术后有肉眼可见的残留者,应给予系统治疗。 必要时酌情给予局部放疗,上腹部的外照射放疗 应慎重选择。 对既往仅接受过阴道近距离放疗的患者,处 理同初治未接受过放疗的患者。 9.1.2 放疗野内的复发 对放疗野内孤立可切除的复发病灶,可选 择手术切除,联合系统治疗。再程放疗需十分谨 慎,应根据复发病灶范围、以前的放射野和距 离、以前放疗的时间进行个体化治疗。更多的再 程放疗是采用组织间插植近距离放疗或IORT, ???? 510 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) ?特别是对局限在阴道残端或盆侧壁的病灶。对 个别经过充分评估的病例,再程外照射放疗、立 体定向放疗、质子或重离子治疗也是一种可以考 虑的选择,特别是盆侧壁或淋巴结转移病灶。通 常都需要联合系统治疗。 9.2 远处转移 9.2.1 孤立病灶 对远处复发的孤立病灶可考虑手术切除和 (或)外照射,联合系统治疗。如果不适合采用 局部治疗,或多次复发,可参照广泛转移的治疗 方式(见9.2.2)。 9.2.2 广泛转移 对有广泛转移病灶的患者,无论是初治, 还是复发,都应以系统治疗、特别是化疗为主。 对于无症状的低级别肿瘤或ER/PR阳性的患者, 可考虑采用激素治疗[36-37];对有症状,或G2、 G3,或肿瘤较大的患者,建议化疗,并进行肿 瘤相关基因检测,以指导靶向药物治疗。必要 时也可考虑给予局部姑息放疗[38-40]。 10 子宫内膜癌患者治疗后的随访 10.1 随访周期 大多数复发出现在治疗后3年内。因此,在 治疗结束后的2~3年内,应每3~6个月复查1次, 之后每半年1次,5年后每年1次。 10.2 随访内容 1 询问症状:有无阴道出血、血尿、血便、 食欲减退、体重减轻、疼痛、咳嗽、呼吸困难、 下肢水肿或腹胀等。 2 体格检查:每次复查时应特别注意进行全 身浅表淋巴结检查和妇科检查。 3 对无症状患者,不推荐常规进行阴道细胞 学检查,特别是短期内接受过近距离阴道放疗后 的患者。 4 CA125、HE4检测。 5 影像学检查:可选择B超(腹部、盆 部)、增强CT(胸部、腹部、盆部)或MRI检 查,必要时行全身PET/CT检查。 10.3 健康教育 应向患者宣教健康生活方式,指导饮食营 养,鼓励适当的性生活(包括阴道扩张器、润滑 剂的使用),评估其他合并疾病如糖尿病、高血 压等情况,注意治疗的远期不良反应处理等。 [参 考 文 献] [1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. [2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017 [J]. CA Cancer J Clin, 2017, 67: 7-30. [3] DOLL K M, TSENG J, DENSLOW S A, et al. High-grade endometrial cancer: revisiting the impact of tumor size and location on outcomes[J]. Gynecol Oncol, 2014, 132(1): 44- 49. [4] BENEDETTI PANICI P, BASILE S, SALERNO M G, et al. Secondary analyses from a randomized clinical trial: age as the key prognostic factor in endometrial carcinoma[J]. Am J Obstet Gynecol, 2014, 210(4): 363.e1-363363.e10. [5] BOKHMAN J V. Two pathogenetic types of endometrial carcinoma [J]. Gynecol Oncol, 1983, 15(1): 10–17. [6] KWON J S, SCOTT J L, GILKS C B, et al. Testing women with endometrial cancer to detect Lynch syndrome[J]. J Clin Oncol, 2011, 29(16): 2247-2252. [7] MILLS A M, LIOU S, FORD J M, et al. Lynch syndrome screening should be considered for all patients with newly diagnosed endometrial cancer[J]. Am J Surg Pathol, 2014, 38(11): 1501-1509. [8] OBERMAIR A, YOULDEN D R, YOUNG J P, et al. Risk of endometrial cancer for women diagnosed with HNPCC-related colorectal carcinoma[J]. Int J Cancer, 2010, 127(11): 2678- 2684. [9] RESNICK K E, HAMPEL H, FISHEL R, et al. Current and emerging trends in Lynch syndrome identification in women with endometrial cancer[J]. Gynecol Oncol, 2009, 114(1): 128- 134. [10] RYAN N A J, GLAIRE M A, BLAKE D, et al. The proportion of endometrial cancers associated with Lynch syndrome: a systematic review of the literature and meta-analysis[J]. Genet Med, 2019, 21(10): 2167-2180. [11] WATKINS J C, YANG E J, MUTO M G, et al. Universal screening for mismatch-repair deficiency in endometrial cancers to identify patients with Lynch syndrome and Lynch- like syndrome[J]. Int J Gynecol Pathol, 2017, 36(2): 115- 127. [12] MANCHANDA R, SARIDOGAN E, ABDELRAHEIM A, et al. Annual outpatient hysteroscopy and endometrial sampling (OHES) in HNPCC/Lynch syndrome (LS)[J]. Arch Gynecol Obstet, 2012, 286(6): 1555-1562. [13] CONCIN N, MATIAS-GUIU X, VERGOTE I, et al. ESGO/ ESTRO/ESP guidelines for the management of patients with endometrial carcinoma[J]. Int J Gynecol Cancer, 2021, 31(1): 12-39. [14] KATZ V L, LENTZ G M, LOBO R A, et al. Diagnostic procedures. Imaging, endometrial sampling, endoscopy: 《中国癌症杂志》2021年第31卷第6期 511 ?indications and contraindications, complications[M]// Comprehensive Gynecology. St. Louis, Mosby, 2007. [15] VAN HEESWIJK M M, LAMBREGTS D M, PALM W M, et al. DWI for assessment of rectal cancer nodes after chemoradiotherapy: is the absence of nodes at DWI proof of a negative nodal status?[J]. AJR Am J Roentgenol, 2017, 208(3): W79-W84. [16] VAN DEN BOSCH T, COOSEMANS A, MORINA M, et al. Screening for uterine tumours[J]. Best Pract Res Clin Obstet Gynaecol, 2012, 26(2): 257-266. [17] ORTASHI O, JAIN S, EMANNUEL O, et al. Evaluation of the sensitivity, specificity, positive and negative predictive values of preoperative magnetic resonance imaging for staging endometrial cancer. A prospective study of 100 cases at the Dorset Cancer Centre[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 137(2): 232-235. [18] DEMIR S, PIJNENBORG J M A, BEKKERS R L M. The role of chest computed tomography in the work-up of patients with cervical or endometrial cancer[J]. J Cancer Ther, 2011, 2(4): 441-447. [19] FASMER K E, GULATI A, DYBVIK J A, et al. Preoperative 18F-FDG PET/CT tumor markers outperform MRI-based markers for the prediction of lymph node metastases in primary endometrial cancer[J]. Eur Radiol, 2020, 30(5): 2443-2453. [20] PATSNER B, ORR J W Jr, MANN W J Jr. Use of serum CA125 measurement in posttreatment surveillance of early-stage endometrial carcinoma[J]. Am J Obstet Gynecol, 1990, 162(2): 427-429. [21] BIGNOTTI E, RAGNOLI M, ZANOTTI L, et al. Diagnostic and prognostic impact of serum HE4 detection in endometrial carcinoma patients[J]. Br J Cancer, 2011, 104(9): 1418- 1425. [22] DEGEZ M, CAILLON H, CHAUVIR?-DROUARD A, et al. Endometrial cancer: a systematic review of HE4, REM and REM-B[J]. Clin Chim Acta, 2021, 515: 27-36. [23] Cancer Genome Atlas Research Network, KANDOTH C, SCHULTZ N, et al. Integrated genomic characterization of endometrial carcinoma[J]. Nature, 2013, 497(7447): 67-73. [24] PECORELLI S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium[J]. Int J Gynaecol Obstet, 2009, 105(2): 103-104. [25] WRIGHT J D, BARRENA MEDEL N I, SEHOULI J, et al. Contemporary management of endometrial cancer[J]. Lancet, 2012, 379(9823): 1352-1360. [26] HOMESLEY H D. Revised 1988 International Federation of Gynecology and Obstetrics staging systems for endometrial and vulvar cancer: an assessment[J]. Clin Obstet Gynecol, 1992, 35(1): 89-94. [27] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: antiemesis.v.1.2021[EB/OL] [2021-04-10]. https://www.nccn.org/guidelines/guidelines- detail?category=3&id=1415. [28] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology Uterine neoplasms version 1.2021[EB/OL][2021-04-10]. https://www.nccn.org/ guidelines/guidelines-detail?category=1&id=1473. [29] GUNDERSON C C, FADER A N, CARSON K A, et al. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: a systematic review[J]. Gynecol Oncol, 2012, 125(2): 477-482. [30] HUBBS J L, SAIG R M, ABAID L N, et al. Systemic and local hormone therapy for endometrial hyperplasia and early adenocarcinoma[J]. Obstet Gynecol, 2013, 121(6): 1172- 1180. [31] PARK J Y, KIM D Y, KIM J H, et al. Long-term oncologic outcomes after fertility-sparing management using oral progestin for young women with endometrial cancer (KGOG 2002) [J]. Eur J Cancer, 2013, 49(4): 868-874. [32] HAMILTON C A, POTHURI B, AREND R C, et al. Endometrial cancer: a society of gynecologic oncology evidence-based review and recommendations, part II[J]. Gynecol Oncol, 2021, 160(3): 827-834. [33] BARAKAT R R, GOLDMAN N A, PATEL D A, et al. Pelvic exenteration for recurrent endometrial cancer[J]. Gynecol Oncol, 1999, 75(1): 99-102. [34] FLEISCH M C, PANTKE P, BECKMANN M W, et al. Predictors for long-term survival after interdisciplinary salvage surgery for advanced or recurrent gynecologic cancers[J]. J Surg Oncol, 2007, 95(6): 476-484. [35] DOWDY S C, MARIANI A, CLIBY W A, et al. Radical pelvic resection and intraoperative radiation therapy for recurrent endometrial cancer: technique and analysis of outcomes[J]. Gynecol Oncol, 2006, 101(2): 280-286. [36] KAUPPILA A. Oestrogen and progestin receptors as prognostic indicators in endometrial cancer. A review of the literature[J]. Acta Oncol, 1989, 28(4): 561-566. [37] THIGPEN T, BRADY M F, HOMESLEY H D, et al. Tamoxifen in the treatment of advanced or recurrent endometrial carcinoma: a gynecologic oncology group study[J]. J Clin Oncol, 2001, 19(2): 364-367. [38] MILLER D, FILIACI V, FLEMING G, et al. Late-breaking abstract 1: randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: a Gynecologic Oncology Group study[J]. Gynecol Oncol, 2012, 125(3): 771. [39] PECTASIDES D, XIROS N, PAPAXOINIS G, et al. Carboplatin and paclitaxel in advanced or metastatic endometrial cancer [J]. Gynecol Oncol, 2008, 109(2): 250-254. [40] SOVAK M A, DUPONT J, HENSLEY M L, et al. Paclitaxel and carboplatin in the treatment of advanced or recurrent endometrial cancer: a large retrospective study[J]. Int J Gynecol Cancer, 2007, 17(1): 197-203. (收稿日期:2021-04-30 修回日期:2021-06-08) 512 中国抗癌协会妇科肿瘤专业委员会 子宫内膜癌诊断与治疗指南(2021年版) ?子宫内膜癌诊断与治疗指南(2021年版) 编写专家 主 编: 刘继红 中山大学肿瘤防治中心 副主编: 吴令英 中国医学科学院肿瘤医院 陈晓军 复旦大学附属妇产科医院 学术秘书: 李 宁 中国医学科学院肿瘤医院 李 虎 广州市番禺中心医院 主要编写人员(按姓氏笔画排序): 王 冬 重庆大学附属肿瘤医院 王建六 北京大学人民医院 石少权 珠海市妇幼保健院 生秀杰 广州医科大学附属第三医院 曲芃芃 天津市中心妇产科医院 李 宁 中国医学科学院肿瘤医院 李 虎 广州市番禺中心医院 李 政 云南省肿瘤医院 李 凌 江西省妇幼保健院 李从铸 汕头大学医学院附属肿瘤医院 李艳芳 中山大学肿瘤防治中心 杨宏英 云南省肿瘤医院 林 安 福建省肿瘤医院 周怀君 南京鼓楼医院 姜 洁 山东大学齐鲁医院 娄 阁 哈尔滨医科大学附属肿瘤医院 陶光实 中南大学湘雅二医院 黄 鹤 中山大学肿瘤防治中心 樊晓妹 河北医科大学第四医院
闫丽隽 主任医师 山西省肿瘤医院 妇科2947人已读





