陈兴海医生的科普号
- 精选 手术中的高德地图——应用肿瘤荧光显像技术进行肝母细胞瘤术中的精准导航
对于肝母细胞瘤的术中定位,传统上根据视觉、触觉及术中超声对其进行定位,对于外形规整、边界清晰的较大的单发肿瘤,定位上没有难度,但对于一些外形不规整边界不清晰,尤其是伴有多发转移灶的定位,传统方式就存在一定的局限性,容易造成肿瘤边界判断不清导致术后肿瘤残留,或者术中未能发现全部转移灶导致遗漏的可能。近年来,我科引入并常规开展了数十例吲哚菁绿荧光显像下肝母细胞瘤的术中导航,通过在手术前2-3天给予患者注射吲哚菁绿(ICG),正常肝组织可以很快吸收血中的ICG并排入胆道,但肿瘤组织摄取ICG后代谢缓慢,导致ICG滞留在肿瘤内,手术时在近红外光的照射下,由于ICG可以呈现出荧光,因此肿瘤就自行跃然肝上,无处遁形了。我们通过荧光显影,可以直观的看到肿瘤的形态及边界,再根据其边界,标记预切除线,沿预切除线劈开肝脏,同时在离断肝脏内部实质的过程中,也可以实时根据荧光的指引,分离肿物与正常肝脏组织,从而避免肿瘤组织的残留。该技术对于肝内微小病灶的定位尤其更具优势,例如术后复发的患者,复发灶往往较小且多发,加之前次手术后,残余肝脏组织增生及粘连较重,单凭视觉及触觉难以发现病灶,往往需要借助术中超声的帮助,超声扫查剩余肝脏组织来寻找病灶,该传统方式比较被动且存在遗漏可能,而此技术在荧光下可使病灶主动显影,明显降低了遗漏的风险。该患者为一例肝母细胞瘤术后复发的病例,残余肝脏组织增生且粘连较重,复发灶较小,在视觉及触觉上难以探及,而在荧光下,该处病灶自行显影,难题迎刃而解,加之超声进一步确认,以及荧光和超声对其他部位的双重扫查,从而避免病灶残留的可能。此例患者为肝硬化合并肝内多发小病灶,在肝硬化背景下,肝脏表面遍布多发肝硬化结节,难以判断何处为病灶,在荧光指引下,病灶自行显影,术后经病理证实,病灶为肝细胞肝癌。此外,由于ICG经肝脏代谢后排入胆道,术中在近红外光的照射下,胆道系统也呈现出荧光,胆囊、胆总管清晰可见,有利于术中胆管的辨识,因此该技术也同样可以减少术中胆道损伤的发生。同样,由于胆汁中存有ICG,胆汁也呈现为绿色,术后挤压胆囊,荧光下观察肝脏断面是否有绿色的胆汁流出,对于判断胆瘘也同样有帮助,自采用该技术以来,术后胆瘘的发生率显著减低。该技术实现了肝脏肿瘤的术中显像,犹如手术中的高德地图一般,为手术提供了精准的导航,为精确的打击标定了坐标,同时也减少了肿瘤的残留、复发以及胆瘘等并发症的发生,为患者提供了更加精准和优质的治疗。
 陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科88人已读
陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科88人已读 - 精选 肝母细胞瘤常见问题解答
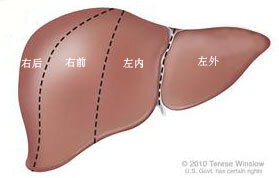
1、所有肝母细胞瘤都需要术前化疗吗? 肝母细胞瘤发现时肿瘤体积往往较为巨大,因此很多病人需要进行术前化疗,化疗后不但肿瘤体积会有所缩小,肿瘤的质地也会较为固缩,有利于术中操作,术中出血也会相应的减少。但对于一些肿瘤体积不是很大,靠近肝脏一侧或者肝脏周边甚至局部外生的肿瘤,也可以先手术切除,术后再行化疗,需要具体情况具体分析,制定个体化的治疗方案。2、化疗通路怎么选择?PICC还是输液港?由于化疗药物对血管的刺激和损伤较大,直接经外周静脉输注往往容易导致严重的静脉炎,因此化疗药物往往需要经过中心静脉的通路进行输注,以减少对外周静脉的刺激,常用的有PICC和输液港。PICC是经过外周静脉穿刺,将一根细长的导管置入中心静脉,好处是操作简便,不需要经过麻醉,损伤小,费用低,随时可以更换,缺点是留置时间较短,一般最长在半年左右,中间不使用时需要每周维护一次,对肢体活动有一定限制;输液港是在胸壁皮下埋置一个港座,这个港座连接一个导管,导管放置在中心静脉里,输液时用专用港针穿刺这个输液座,优点是可以长期携带,不影响活动,不使用时每月维护一次即可,缺点是取放均需要麻醉手术,费用较高。具体选择哪种化疗通路主要还是根据病情及家属自身的意愿决定,如果肿瘤位置局限,不存在多发的转移,预估只需要进行常规的化疗6-8次,可以考虑放置PICC;如果瘤体巨大侵犯周围组织或曾经破裂过,存在门静脉或肝静脉的瘤栓以及肝内或肝外的转移,预计需要长期多次反复的化疗,可以考虑放置输液港,尤其是在切除肿瘤的术中同时放置输液港,从而避免单独进行一次麻醉置港的手术。3、肝母细胞瘤化疗前需要取活检吗? 肝母细胞瘤根据影像学检查以及肿瘤标志物等检查,临床诊断往往较为明确,对于临床诊断明确的肝母细胞瘤,并不一定非要取活检,活检作为有创性的操作,手术活检或者穿刺活检首先往往需要麻醉,加之活检后肿瘤有出血或者破裂的风险,更为重要的是,对于肝母细胞瘤这种存在包膜的肿瘤,活检会破坏包膜的完整性,违反了无瘤原则,活检后肿瘤有局部转移及播散的风险,在临床诊断明确的前提下,根据肿瘤具体的情况,先行化疗或直接手术即可,常规进行活检没有必要。4、肝母细胞瘤甲胎蛋白一定升高吗,甲胎不高是不是就一定是良性的? 大部分肝母细胞瘤甲胎蛋白都是升高的,但有一些少见的情况,术后病理明确是肝母细胞瘤,但甲胎蛋白是正常的,甲胎蛋白作为肝母细胞瘤的肿瘤标记物,敏感性及特异性都很高,但并不绝对,有一些其他肝脏恶性肿瘤甲胎蛋白同样是正常的,而且肝母细胞瘤其中有一型甲胎蛋白不高反而恶性程度更高。5、肝母细胞瘤是恶性肿瘤,是不是不容易治好呢? 肝母细胞瘤的预后也要看具体情况,例如肿瘤的部位、大小、与周围血管的关系、是否存在瘤栓、是否存在其他器官的转移、初诊时甲胎蛋白的水平、肿瘤细胞的恶性程度以及对于化疗药物的敏感性等等。肝母细胞瘤的各种病理类型中,以单纯胎儿型预后最佳,术后甚至无需化疗,以小细胞未分化型预后最差。6、肝母细胞瘤怎么分期呢? 肝母细胞瘤的分期主要有两种,一种是基于影像学判断的术前分期,即PRETEXT/POST-TEXT分期。PRETEXT分期是指未经过任何治疗的情况下评价,POST-TEXT分期是指经过术前化疗后的情况,该种分期基于术前影像学的结果,将肝脏分为左外(Ⅱ、Ⅲ段)、左内(Ⅳ段)、右前(Ⅴ、Ⅷ段)及右后(Ⅵ、Ⅶ段)四个肝区。Ⅰ期:肿瘤局限在1个肝区,相邻的另外3个肝区无肿瘤侵犯;Ⅱ期:肿瘤累及1个或2个肝区,相邻的另外2个肝区无肿瘤侵犯;Ⅲ期:2个或3个肝区受累,另1个相邻的肝区未受累;Ⅳ期:肿瘤累及所有4个肝区。还有一种是基于手术情况和术后病理的COGEvans分期系统。Ⅰa期:肿瘤完全切除,组织病理学类型为单纯胎儿型;Ⅰb期:肿瘤完全切除,除单纯胎儿型以外其他组织病理学类型;Ⅱ期:肿瘤基本切除,有镜下残留;Ⅲ期:肿瘤有肉眼残留,或基本切除伴淋巴结阳性,或肿瘤破裂或腹膜内出血;Ⅳ期:诊断时发生远处转移,不论原发病灶是否完全切除。7、肝母细胞瘤的手术方式是怎样的? 手术方式可以比较简单的分为规则性切除和不规则性切除。规则性切除指的是按照以血管为基础的Couinaud分叶法,将肝脏分为二叶八段,将包含肿瘤在内的部分肝叶或肝段切除,如右半肝切除、右三叶切除等,优点是按照血管解剖切除,术中出血少,手术操作较为简单,残余肝脏的供血和回流受影响少,缺点是有一部分正常的肝组织可能会和肿瘤一并被切除掉。 由于肝母细胞瘤体积往往较为巨大,横跨多个肝叶,且肿瘤表面被覆包膜,因此,不规则性切除往往更为常用,术中沿肿瘤包膜,将肿瘤与正常肝组织分离,将肿瘤剥离切除,优点是正常肝组织丢失较少,缺点是剥离面较大,术中出血较多,手术难度较高,残余肝脏断面旁的肝组织供血和回流可能会有一些影响。其中最常见的就是肝中叶的巨大肿瘤,肿瘤两边都存在正常的肝组织,尤其是肿瘤体积巨大的情况下,两边存在的正常肝组织体积都不大,若行半肝或三叶的规则切除,势必会丢失一部分的正常肝组织,导致残留肝脏体积过小,术后存在肝脏功能衰竭的风险,这时候往往需要施行肝中叶的切除,将肝脏中间的肿瘤“挖出”,保留两侧的正常肝组织。 到底选择哪种术式,需要根据具体的情况具体分析,针对不同病人,制定个体化的手术方案。如果患侧丢失的正常肝组织较少,健侧的残肝体积完全可以满足机体的需要,血管也能得以保留,可以考虑行患侧的半肝或三叶的规则切除;如果单纯保留健侧,残余肝脏体积过小,则需要评估两侧的肿瘤与血管的关系,在保证两侧的供血血管和回流血管完好的情况下,可以考虑实施不规则的肝中叶切除。8、怎么判断术后剩余肝脏够不够用呢? 手术后剩余肝脏的体积判断对手术来讲尤为重要,残肝体积过小,术后会出现急性肝功能衰竭导致病人死亡的发生,因此需要术前进行精准的计算,从而避免悲剧的发生。术前通过CT或者现在市面上很多3D软件进行测量,计算出拟保留的残余肝脏体积,再根据患者的年龄、身高、体重,通过公式计算出该患者的标准肝体积,通常认为残余肝脏体积占标准肝体积的20%以上是安全的。同时还可以应用残余肝脏重量和体重的比值来进行评估,残余肝脏占体重的1%以上是安全的,最小不能小于0.8%。9、肝母细胞瘤术后出现胆瘘怎么办? 胆瘘在肝母术后并不少见,量少时表现为引流液的颜色呈金黄色伴油状,量大时呈棕黑色,一些胆瘘为肝脏的断面上存在的小胆管术中未确实结扎所致,但更常见的是肿瘤较为巨大,压迫Glisson系统,由于两者粘连紧密,在肿瘤剥离切除过程中,胆管受到损伤且术中未发现或发现后修补不当所致。术后短期内出现轻度胆瘘经充分引流并加强抗感染及营养支持下,很大一部分能自行愈合,但胆瘘如果长期不愈合或量较大时,需要再次手术。再次手术时要探明胆瘘的具体情况,若为胆管的断端,不涉及残余肝脏的胆汁引流,可缝合修补;若为仍承担引流作用的肝叶或肝段的主要胆管,则要看其具体情况,若为小的侧壁瘘,修补后不影响其通畅,可以小针细线修补,若已完全离断或修补困难,可行内引流术。我科在切除肝脏肿瘤时,常规保留胆囊,可将胆囊游离后上提至胆瘘处,行胆管-胆囊吻合,经胆囊将胆汁引流入肠道。若无法行胆管-胆囊吻合,可游离近端空肠,行胆管-空肠Roux-en-Y吻合,将胆汁内引流入肠道。 我科近年来引进了肝肿瘤吲哚菁绿术中导航技术,术前2-3天注射吲哚菁绿,该药物仅能被肝细胞特异性摄取并代谢,肿瘤内的肝细胞可以摄取但代谢缓慢,该药物就蓄积在肝肿瘤内部,在近红外光下肿瘤可显示荧光,实现肿瘤精准定位,同时该药物仅经胆汁代谢,因此胆管及胆汁也可显示荧光,这在术中对于胆管位置的判断和肿瘤切除后胆瘘的检查起到了重要的指引作用,应用此技术后,我科肝肿瘤术后的胆瘘发生率已显著下降。10、肝母细胞瘤术后腹腔积液怎么回事? 肝母细胞瘤体积往往较为巨大,将肿物切除后,原来肿瘤的地方就空出来了,容易在局部形成包裹性积液,有时术后3个月甚至半年还持续存在,但也不用特别担心,如果没有什么不适,等着它自己慢慢吸收就好了,如果积液内有继发感染或持续性增大,可以在B超引导下穿刺放入一根引流管,将积液引流出来,如果引流液呈黄色,引流量一直不减少,可能存在胆瘘的可能,经持续引流后,小的胆瘘有自行愈合的可能,若持续胆瘘,则需要再次手术解决胆瘘的问题。11、肝母细胞瘤术后引流管需要带多长时间?肝母细胞瘤术后引流量的多少还是和肿瘤本身的大小和部位有关系的,肿瘤体积大,剥离面自然就大,渗出量就多,肿瘤术前压迫肝门,术中切除肿瘤的同时,局部淋巴管损伤的严重,术后腹水量也大,总之术后需注意观察腹腔引流量的变化,如果引流量不大,颜色正常,可以尽早拔除,如果到出院时引流量还是比较大,也不用担心,可以带着引流管先行出院,于相关专业按时化疗,不要因为带着引流管就耽误化疗,等引流量少了再拔除就是了。
 陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科918人已读
陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科918人已读 - 精选 复杂肝母细胞瘤的手术策略
肝母细胞瘤是小儿最常见的肝脏原发性恶性肿瘤,好发于婴幼儿期,起源于胚胎早期的未成熟的肝母细胞,具有多潜能性特征。此病发病隐匿,早期往往没有明显的症状,容易被家长忽略,常为家长无意间发现上腹部肿块才就诊,发现时往往肿瘤已十分巨大。因此,家长平时要多注意对孩子进行观察,尤其腹部经常被衣服所覆盖,不易发觉,或者体检时可考虑行腹部超声检查,对腹腔内脏器常规探查,以利发现早期病变。大部分肝母细胞瘤发现时体积较为巨大,直接手术切除难度大,风险高,也容易产生并发症,治疗上往往先进行数次药物化疗,化疗后肿瘤体积缩小,质地有所固缩,更加利于术中的操作以及减少术中出血。肝母细胞瘤一般长在肝脏一侧,常规行患侧的规则半肝切除或三叶切除,这种规则的肝切除为常规手术,制定手术方案及术中操作难度不大。但对于一些位置较为特殊的情况,即便经过化疗,手术难度仍然很高,我科收治的大部分患儿均为此类情况,例如一些肿瘤长在第一或第二肝门上,压迫重要的血管、胆管,术中就需要在完整切除肿瘤的同时保留住这些重要的血管,尤其常见的是很大一部分肿瘤长在肝脏中间的情况,肿瘤两边都存在正常的肝组织,尤其是肿瘤体积巨大的情况下,两边存在的正常肝组织体积都不大,若行半肝的规则切除,势必会丢失一大部分的正常肝组织,导致残留肝脏体积过小,术后存在肝脏功能衰竭的风险,这时候往往需要施行肝中叶的切除,将肝脏中间的肿瘤“挖出”,保留两侧的正常肝组织。这种手术难度较大,风险较高,主要涉及以下几个问题。第一,手术方案的制定,对于一个肝中叶的肿瘤是否需要冒着风险行肝中叶切除,还是可以舍弃一边正常的肝组织行稳妥的半肝规则切除,主要取决于肿瘤具体的部位、大小、与周围血管的关系以及残余肝脏的体积,如果肿瘤一侧的正常肝组织较小,另一侧的残肝体积完全可以满足机体的需要,可以考虑行该侧的半肝切除;若肿瘤体积较大,单纯保留一侧则残余肝脏体积过小,这时需要评估两侧的肿瘤与血管的关系,在保证两侧的供血血管和回流血管完好的情况下,可以考虑实施肝中叶切除。第二,肝中叶切除与规则的半肝切除相比,肿瘤的剥离面较大,瘤床面积明显增大,这就造成了术中的操作风险及术后创面渗血及胆瘘的风险明显增加。第三,施行肝中叶切除的肿瘤,体积往往较为巨大,对于血管的处理难度明显增加,半肝切除对于血管往往以离断为主,将供血的门脉分支及回流的肝静脉离断即可;但肝中叶切除需要保留血管,由于肿瘤体积较大,明显挤压周围血管,操作中需要将血管自肿瘤表面剥离保留,操作难度大,血管损伤的风险也相应升高。第四,同剥离血管一样,胆管在Glisson系统中与门脉伴行,在剥离过程中也容易损伤导致胆瘘的发生。对于血管的处理,肝中叶切除同处理侵犯第一或第二肝门的肿瘤类似,由于肝母细胞瘤一般在肿瘤表面都存在包膜,肿瘤在包膜内呈膨胀性生长,对于周围的血管以压迫为主,很少包裹侵犯,因此,对于这样的血管往往能够完整的剥离保留,对于门脉系统,尽量将Glisson系统完整的与肿瘤剥离,剥离后往往可以见到Glisson鞘表面广泛的渗血,压迫或轻微的电凝后渗血比较容易控制。对于肝静脉,由于静脉壁菲薄,加之肿瘤的长期压迫,剥离过程中容易造成静脉的损伤,损伤后需要用小针细线精心修补,重建静脉的完整性。对于胆瘘的处理,一方面在剥离过程中精细操作,尽量避免损伤,切除后反复仔细检查,对于存在的胆瘘进行修补;另一方面,我科在切除肝肿瘤时常规保留胆囊,对于一些不易修补的胆瘘,可将胆囊上提,与胆瘘处直接吻合,对于多处胆瘘的情况,也可以同时做多处吻合以减少术后胆瘘的发生。
 陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科649人已读
陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科649人已读 - 采访纪实 神母细胞瘤北京青年报采访
 陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科128人已读
陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科128人已读 - 采访纪实 神母细胞瘤新京报采访
 陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科184人已读
陈兴海 副主任医师 首都儿科研究所附属儿童医院 普通外科184人已读