邱纯医生的科普号
- 精选 CT指导下肺部肿瘤消融治疗
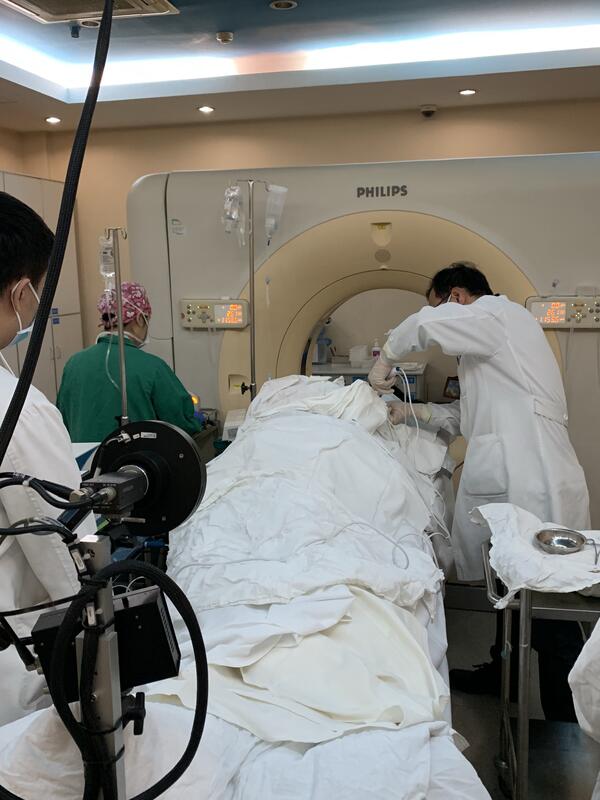
1、什么是肿瘤的局部消融治疗? 肿瘤消融治疗是继外科切除之后又一种具有肿瘤治愈潜力的介入性微创治疗技术。射频消融是其最杰出代表。该治疗是在影像技术(超声、CT、MRI 等)引导下,经皮肤穿刺,将电极针直接刺入肿瘤组织中。在高频交变电流作用下,肿瘤组织内离子或水分子、蛋白质分子等极性分子互相摩擦、碰撞,产生生物热效应,使肿瘤区域温度达到65℃ -95℃,造成肿瘤细胞凝固性坏死,进而达到彻底杀灭肿瘤的目标。目前热消融治疗已经用于肝脏、肺脏、肾脏、乳腺、甲状腺、淋巴结等实质性脏器良恶性肿瘤的有效治疗。 2、局部消融治疗术的优势: (1)有效性:大量研究资料表明,对于部位良好的小肿瘤,热消融治疗可以获得与外科切除类似的治疗效果,无论复发率、转移率以及5年生存率都与外科切除相近。 (2)安全性:与传统治疗相比,热消融治疗更为安全,损伤较轻微,术后严重并发症和死亡率均显著降低。 (3)美观性:热消融只需要在皮肤上留下1-2㎜的穿刺针眼,一段时间后针眼甚至完全消失,不留任何疤痕。相比外科切除“难看”的术后疤痕,热消融最大程度满足了患者对没血的追求,使生活更有质量。该治疗方法尤其适合甲状腺和乳腺肿瘤结节的治疗,既能获得传统外科切除的治疗效果,又可避免外科疤痕带来的美观上的影响,更符合年轻男女的审美要求。 (4)适应症的广泛性:热消融治疗不仅适合大部分需要传统外科切除的肿瘤,更是失去外科切除机会的肿瘤患者的不二之选,使更多被判“死刑”的肿瘤患者获得了意想不到的治疗机会,获得长期生存。 (5)治疗和恢复的快捷性:热消融治疗简单快捷,一般情况下完成全部治疗大都在一小时之内,局麻下小肿瘤消融甚至只需要20分钟左右,相比动辄几小时的传统外科切除具有显著优势。如果治疗顺利,患者当天或次日即可下地走路和恢复饮食,住院之间一般2-5天不等,同样由于传统外科。 (6)高度的可重复性:外科切除一般难以多次重复,再次手术的创伤显著重于第一次手术。由于固有的肿瘤局部微小创伤和对周围正常组织最大限度的保护,热消融治疗可以反复多次进行,且极少遗留远期并发症和后遗症,这对容易复发和转移的恶性肿瘤患者无疑是最大福音。 (7)几乎不受影响的生活质量:由于热消融治疗快捷迅速,对人体正常组织的损伤轻微,几乎没有远期后遗症和难看的手术疤痕,因而患者即使多次治疗也极少影响生活质量。 3、肺脏肿瘤局部消融的适应症和禁忌症 适应症: (1)早期非小细胞型肺癌不宜手术者,如高龄或心肺功能差不能耐受手术的周围型早期肺癌患者; (2)IIIb期(同一肺叶内出现卫星结节)或IV期(其它肺叶或另一肺出现结节)非小细胞型肺癌不宜手术者;或IIIa期或IV期肺癌标准治疗后残余孤立性结节者; (3)不愿意接受手术或是放化疗的周围型早期肺癌患者; (4)肺转移瘤:每侧肺的病灶数量≤3个,两侧肺病灶<6个或多个病灶直径总和
邱纯 副主任医师 海南省人民医院 肿瘤内科2127人已读 - 精选 肿瘤治疗利器---射频消融治疗
肿瘤治疗利器---射频消融治疗 1.概述 肿瘤射频消融术(Radiofrequency Ablation,RFA)是近几年发展的新技术,其机理是,在超声、CT或MRI等引导下,将针状或多针状电极直接刺入患者肿瘤部位,通过射频消融仪测控单元和计算机控制,将大功率射频能量通过消融电极传送到肿瘤组织内,利用肿瘤组织中的导电离子和极化分子按射频交变电流的方向作快速变化,使肿瘤组织本身产生摩擦热。当温度达到60℃以上时,肿瘤组织产生不可逆的凝固性坏死,坏死组织(灭活组织)在患者体内(原位)将部分被吸收(术后约一个月),坏死组织周围形成纤维化包膜,包膜内聚集了中性DNA,它能增强患者的免疫功能,提高疗效。同时,肿瘤周围组织凝固坏死形成一个反应带,切断肿瘤血供并防止肿瘤转移。其特点是微创、疗效确切、副作用小等。肿瘤射频消融术广泛运用于多种实体肿瘤的治疗中,如肝脏肿瘤,肺部肿瘤,纵隔淋巴结,肾脏、肾上腺肿瘤,前列腺肿瘤,良、恶性骨肿瘤等。 2.发展历史 RFA是一种热凝固疗法,利用热凝固疗法治疗肿瘤的历史最早可追溯到几千年前,古埃及人和古希腊人曾利用烧灼的方法治疗浅表溃疡和肿瘤。1891年,Arsonval发现射频电流(10kHz)能够穿过肝组织,引起肝组织局部温度升高而并不引起神经肌肉兴奋,可用于治疗肝脏疾病。之后RFA逐渐应用于心脏、前列腺及神经系统等。在治疗恶性肿瘤方面,Rossi等于1990年率先采用神经外科手术中的消融模式,将RFA应用于肝脏原发性和继发性恶性肿瘤的治疗,并取得成功。Anzai等1995年首次采用RFA治疗脑肿瘤,1O个月后随访经MRI证实,所有病灶达到局部控制。 3. 射频肿瘤消融仪 根据RFA的工作原理,射频电极周围组织的温度升高并非由电极自身温度升高和传导所致,而是组织中离子在电极的高频交替变化的电流作用下产生振荡运动,离子振荡摩擦生热,引起局部组织温度升高。最初的单电极式射频探针的射频电流从单电极向外传播时,随着传播距离的增大,能量迅速下降,其程度与传播距离的平方成反比,因此组织凝固坏死区直径最大只能够达到1.6cm。随后出现的双电极式射频探针消融的范围达到了4~5cm。多极式射频探针的问世,使得组织凝固坏死区达到3.5~7cm。为了让热传导能够使肿瘤凝固坏死达到足够的范围,RFA区域常需要包括肿瘤周边的部分正常组织。因此,根据组织坏死的最大范围,多数学者认为RFA治疗肿瘤的直径一般不超过6cm,在3cm以内效果最好。 装置构成主要包括功率为50~200W 的射频电流发生器、各种类型射频电极针以及计算机控制系统。目前国内应用的射频发生器主要是美国三家公司(RITA、RTC、RADIONICS)和国产(航天部)四种机型,RITA系统主机的能量设置为50~150W,发生器频率为460kHz;RTC公司与RATA系统相似,能量为100W;RADIONCS 的RF系统发生器频率为500kHz,能量为200W;国产的功率为200W。射频电极针主要有两种类型:一种类型为RITA、RTC和国产。针长12~25cm、直径2cm,未端可张开7~l2个小电极的鞘形多电极针;另一种类型为RADIONICS的针为中空可灌注循环冷却水的单针和三根平行呈三角形分布针的电极针。RITA是通过温度的变化控制射频发生器的工作,而RTC和RADIONICS则是通过电阻的变化来控制。 4. 临床应用 4.1 肝癌 肝癌是我国危害最大的恶性肿瘤之一,手术切除虽然是主要的治疗手段,但由于我国肝癌90%以上有HBV感染背景,多数合并肝硬化,患者就诊时多为晚期、肝功能差,仅有2O%~37%能获得手术根治,并且术后复发率较高。临床大量肝癌患者以往采用肝动脉插管栓塞(TACE)和酒精注射治疗,获得一定的疗效,但这两种方法均存在需反复多次治疗,大肝癌难以彻底灭活,且不适宜严重肝功能失代偿者,故临床需要更有效的局部治疗手段。大量的文献报道表明,RFA治疗原发性、转移性肝癌获得了令人鼓舞的疗效。研究显示:RFA治疗小肝癌(直径
 邱纯 副主任医师 海南省人民医院 肿瘤内科2958人已读
邱纯 副主任医师 海南省人民医院 肿瘤内科2958人已读 - 精选 肺癌患者使用PD-1需要注意的十大问题
1目前获批用于肺癌的免疫治疗药物有哪些? 现在已有四种免疫疗法药物被批准用于肺癌。Pembrolizumab(Keytruda) nivolumab(Opdivo) atezolizumab(TECENTRIQ) 被批准用于已经转移到肺以外的其他器官的肺癌患者。 Pembrolizumab也被批准与化疗联合用作转移性非小细胞肺癌的一线治疗药物。 durvalumab(IMFINZI)被批准用于III期无法手术,放化疗后病情没有进展的非小细胞肺癌患者,这些患者的目标是尽可能延缓癌症的进展。 2哪些肺癌患者适合使用PD-1? 国际上已经将免疫治疗纳入肺癌治疗的指南。最新NCCN(美国国立综合癌症网络)指南推荐符合下列情况的患者使用PD-1/PD-L1免疫检查点抑制剂: * 当PD-L1表达≥50%的EGFR/ALK/ROS1(原癌基因1酪氨酸激酶)基因突变阴性患者,一线可以直接选用 PD-1/PD-L1免疫检查点抑制剂,或在化疗、靶向治疗失败的二线及三线治疗上都可以使用 PD-1/PD-L1免疫检查点抑制剂。 * 对于ROS1重排阳性的患者,一线推荐靶向药物,疾病进展后可以进行PD-1/PD-L1免疫检查点抑制剂治疗。 此外,相关研究证实,KRAS基因突变型、EGFR基因正常型、吸烟者PD-1效果更好! 3PD-1治疗肺癌的临床效果究竟如何? 面对致死率第一的肺癌,免疫治疗无论在单药治疗、还是联合治疗亦或是新辅助治疗都未让我们失望过,不断带来惊艳的临床数据, 一线治疗:部分肺癌驱动基因阴性患者带来新的生存希望 * 临床研究证实,PD-L1阳性表达≥50%且EGFR(表皮生长因子受体)和ALK(间变性淋巴瘤激酶基因)突变阴性的患者,一线治疗使用PD-1/PD-L1免疫检查点抑制剂,比起传统化疗,一年总生存率从54%提高到70%。 * 中位无进展生存期由6个月上升到10.3个月,严重不良反应发生率从化疗的53%降至27%。 二线治疗:延长鳞癌和非鳞癌患者生存期,减少不良反应 * 临床上对鳞癌和非鳞癌二线治疗的效果和安全性都进行了研究。跟化疗相比,鳞癌患者使用PD-1/PD-L1免疫检查点抑制剂治疗,中位生存期由6个月提升到了9.2个月。 * 死亡风险降低了41%,严重不良反应发生率由55%降低到7%。 * 而对于非鳞癌的患者,相比化疗,死亡风险下降了27%。 * 严重不良反应发生率也从54%降至10%。 * 由此可见,PD-1/PD-L1免疫检查点抑制剂在多种分型肺癌的临床治疗中都有良好的生存改善和较好的耐受性,上述研究结果将对目前肺癌临床治疗格局产生深远的影响,也为饱受病情折磨的肿瘤患者带来新的生存希望。 4肺癌患者如何预测PD-1的疗效? PD-1/PD-L1免疫检查点抑制剂开启了肺癌治疗模式的新篇章,给肺癌患者提供了更多的治疗选择。那么,到底什么样的患者适合使用PD-1/PD-L1免疫检查点抑制剂呢? 事实上,为了更好的实现治疗效果,临床实际应用PD-1/PD-L1免疫检查点抑制剂前,一般会先检测患者的一些特定生物标记物,检测的结果可以一定程度上预测肿瘤免疫治疗的疗效,帮助医生选择最合理的治疗方案。目前临床上主要以肿瘤组织的PD-L1表达作为筛选患者的主要生物标记物。 值得注意的是,PD-L1表达的检测主要针对的非小细胞肺癌中的非鳞癌患者。 目前的临床研究结果显示,PD-1/PD-L1免疫检查点抑制剂对鳞癌的治疗同样有良好效果,但PD-L 1的表达与疗效无相关性,因此鳞状非小细胞肺癌患者无需进行检测。 此外,PD-L1虽然是目前主流的生物标记物,但多方面的因素导致单一的PD-L1表达水平作为疗效预测,仍然存在不确定性。因此,除PD-L1以外,PD-L2、TILs(肿瘤浸润淋巴细胞)、IFN-γ(γ-干扰素)、BIM(淋巴细胞瘤-2相互作用的细胞凋亡调节因子)、体细胞基因突变的负荷和MMR(DNA错配修复)基因缺失等也可能是PD-1/PD-L1免疫检查点抑制剂的潜在预测标志物,还在等待临床研究进一步的探索。 (1) PD-L1表达 PD-1与PD-L1如同一对“情侣”,其中PD-1位于免疫细胞的表面,而PD-L1则位于肿瘤细胞的表面。这对“情侣”一旦结合,负责杀伤肿瘤细胞的免疫细胞就会把肿瘤细胞当作“朋友”,从而不再对其进行攻击。 研究发现,当肿瘤细胞表面有PD-L1的表达,那么使用PD-1抑制剂或者PD-L1抑制剂抑制肿瘤的概率就会增加,所以,肿瘤组织中PD-L1的表达情况,就成为预测PD-1/PD-L1抑制剂有效率的一个指标。在非小细胞肺癌的临床实验中,人们发现,如果肿瘤组织中PD-L1的表达率超过50%,PD-1抑制剂可以作为首选治疗方法治疗肿瘤,而如果PD-L1的表达率>1%,免疫检查点抑制剂可以使一线化疗失败的肺癌患者获益。 (2) MSI(微卫星)检测 微卫星不稳定性是我们身体中基因的一种病态情况,与肿瘤的发生密切相关。 研究表明,如果肿瘤组织中微卫星处于高度不稳定的状态,即MSI-H,使用PD-1抑制剂的有效率高于微卫星不稳定性低的状态(MSI-L)和微卫星稳定的状态(MSS)。所以,MSI-H就成为了预测PD-1抑制剂的一个重要的生物标志物。 (3) 肿瘤基因突变负荷(TMB)检测 肿瘤突变负荷高,从免疫治疗中获益的概率就大。在CheckMate-032临床研究中,按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23%;而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月——22.0个月与3.4个月,相差6倍!所以,TMB也是预测PD-1抑制剂的一个重要的生物标志物指标。 (4) 肿瘤浸润淋巴细胞(TIL)检测 通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。 5肺癌患者应该接受多长时间的PD-1治疗? 许多患者认为PD-1是种神药,仿佛一针下去就可以药到病除。所以,大家在用药决策上,是能拖就拖。要么尝遍世间能用的其他药,要么问遍身边的所有医生,只有当药物无效、患者身体严重衰弱的时候,才匆匆忙忙选择PD-1 。 殊不知,为时已晚。 PD-1作为免疫疗法,调动的是人自身的免疫机能对抗癌细胞,这一般都需要2个月的时间才能生效(小概率可以是1.3-1.5个月)。而且在这生效时间之前,肿瘤有可能是会持续生长的!! 在对许多患者随访中发现,有相当一部分患者,拖到患者肝肾功能损伤、生活无法自理了,才开始考虑用药治疗,却已经错过了最佳治疗时机,医生在评估情况后,也只能遗憾地拒绝用药治疗。 同时,也有一部分患者,正因为没有留够充足的时间,在药物生效之前就已经坚持不住了,令人唏嘘。 所以,给大家两个建议: 1、 当断则断,尽快找到身边最有经验的医生,做出决策; 2、 不要等到化疗到身体很差的时候,才选择PD1。 6哪些肺癌患者不适合接受PD-1治疗? 1、 间质性肺炎:免疫性疾病,不用说啦,肯定不能用。用完大概率会害了病人,所以三思三思再三思! 2、 肝肾功能不全:这个应该很容易理解。不过如果肝癌或者肾癌的患者,这里功能不全的定义需要重新评估。这种评估需要专业的医生来判断! 3、 生活难以自理:这个,都已经到这个状况,病人应该已经很严重了。既受不了病情进展的两个月,也受不了药物联用的副作用。所以建议还是把重心放在提高生活质量上吧。 相信很多小细胞肺癌患者很想可不可以使用PD-1? 答案是可以。如果pd-1表达是阳性的话,可以尝试K药。如果PD-1表达是阴性的话,只可以用O药。综合来说,小细胞肺癌建议用O药。 当然,还有个豪华组合 O+Y,这个就不在这里多说了,费用高出20万。 7PD-1副作用大么?是否会引起免疫风暴? 在受控环境下的用药是安全的,常见副作用就是皮疹、发热等,对症治疗即可。 常见的流感样症状:对症处理即可,比如退烧、止痛、多休息等。 皮疹:可以用一点尿素软膏、氢化可的松软膏。 甲状腺问题:可以请内分泌科医生会诊。甲亢可以服用抗甲状腺药物,甲减可以补充优甲乐。 免疫性炎症,如肺炎、肝炎、肠炎等:需要酌情加上口服或静脉的糖皮质激素,如地塞米松、泼尼松、甲强龙等,对于病情较重的,还需要加上环磷酰胺、霉纷酸脂等免疫抑制剂。 发生细胞因子风暴的患者:需要及时使用IL-6抗体,托珠单抗。 所以,用药前的评估很重要,这是个技术活,要找有经验的医生来(我说的是有PD-1治疗经验的医生),很多人无所谓,以为买到药,就跟靶向药一样,一天吞一片就好了,根本不是这样子的!两个关键点: 1、 用药前的评估 2、 用药期间副作用的处理 这时候好医生的作用有多大,有碰到持续发烧、乏力又手足无措的病友最清楚了。 没有经过评估就自己买药来用,就是拿自己性命开玩笑。 8关于pd-1的价格 目前,Opdivo获批上市为国内肿瘤患者带来了福音,但价格也再次成为牵动国民神经的焦点话题。 根据FDA在2016年9月批准修改后的Opdivo给药方案,非小细胞肺癌患者按照“240mg/次,每2周1次”给药,直至疾病进展或出现不可耐受毒性。Opdivo 240mg规格在美国的定价大约是6500美元,治疗1年的成本大约为16.9万美元(约108万元)。 若Opdivo能把价格定在美国的1/10,即10万元/年,国家医保应该非常乐于覆盖,患者也会欣喜若狂,但可能性非常低。外界对Opdivo中国定价的猜想也多集中在40-60万元/年之间。国产信达制药提交的第一款国产PD-1抑制剂,价格或许每年10万元。加上百时美以及这次默沙东的PD-1抑制剂,2018年可能会有三款PD-1抑制剂在国内上市,价格将大幅度下降。希望造福更多的肿瘤患者。在国内上市后,全球肿瘤医生网医学部将为大家第一时间报道。 9如果PD-1起效,应该用多长时间? 目前国内外,标准的方案是:手术或同步放化疗后,巩固性、辅助性使用的病友,PD-1抑制剂建议用满1年;而晚期的、全身转移的病友,建议用满2年。然而,越来越多的证据支持,使用PD-1抑制剂满6个月,且肿瘤缩小达到完全缓解、部分缓解(肿瘤缩小超过30%以上)的病友,可以再巩固2-3次后,酌情停药或调整剂量和间隔。 10PD-1耐药后应该怎么办? PD-1抑制剂有效的病人,一般疗效持久;但是,目前已经观察到30%左右的患者,出现了疾病的耐药。克服耐药的关键,主要是两点: 首选,如果可能,可以通过对新增的或者不断增大的耐药部位,进行穿刺活检和深入的免疫分析,找到耐药的原因,根据原因治疗。比如,有的病人是由于TIM-3、LAG-3或IDO代偿性高表达;那么选择,PD-1抑制剂联合TIM-3抑制剂、LAG-3抗体、IDO抑制剂,就是最好的治疗方案。 其次,对于不能明确耐药原因的病友,可以结合具体病情,选择最佳的联合搭档,逆转耐药,延长生存期;或者,更换为放化疗、介入、射频、粒子植入等传统治疗。 最后,也是最重要的一点:越来越多的证据支持,PD-1抑制剂这类免疫治疗,应该在患者一般情况比较好,肿瘤负荷比较小的时候,尽早用。
邱纯 副主任医师 海南省人民医院 肿瘤内科4158人已读 - 精选 奥西替尼耐药后治疗策略
2017年5月,AZD9291(奥希替尼,商品名:泰瑞沙)在中国正式上市。一年多来,越来越多的晚期肺癌患者,接受了该药物的治疗。对于携带EGFR突变、接受第一代靶向药治疗后耐药,并且出现T790M突变的晚期肺癌患者,接受AZD9291治疗后,中位无疾病进展生存时间大约是10个月左右。 因此,越来越多的中国患者,已经开始出现针对AZD9291的耐药。 AZD9291,是目前上市的唯一一个靶向EGFR的第三代靶向药,截止目前第四代靶向药并未研发成功。因此,面对AZD9291耐药,下一步到底该怎么办? 01 耐药机制,逐渐清晰 2018年3月,上海肺科医院的周彩存教授在CCR杂志上发表了一篇重磅研究,周教授团队对93位接受AZD9291治疗的患者在治疗前后、疾病进展的时候,对组织标本和血液标本,分别作了416基因的测序分析。结果显示,导致AZD9291耐药的主要原因如下: ① EGFR基因再次突变 EGFR796、797突变占24.7%,EGFR 792突变占10.8%,EGFR 718、719突变占9.7%——EGFR基因,发生再次耐药突变,占所有患者的45%,接近半壁江山。 ② 其他基因突变 包括PIK3CA、BRAF、MET、RET、KRAS等,各种常见的、不常见的肺癌驱动基因,均有涉及,较为分散。 ③ 转化成了小细胞肺癌 2018年8月,哈佛大学的Geoffrey R. Oxnard教授对41位接受AZD9291耐药后的患者的组织标本和血液标本,进行了全面的基因分析。结果显示,耐药的病人可以分为两大类: 一类患者出现耐药的时候,T790M突变依然还在,这类患者一般接受AZD9291治疗疗效维持的时间较长,这类患者占32%(13位); 另一类患者出现耐药的时候,T790M突变已经消失,这类患者疗效维持时间较短,这类患者占68%(28位)。 发生耐药的原因,主要有如下的可能性: ① 耐药时依然携带T790M突变 9名患者出现了C797S突变,2名患者出现了PIK3CA突变。 ② 患者耐药后T790M突变丢失 6名患者发生了小细胞肺癌转化,4名患者MET基因扩增,2名患者发生了BRAF突变,2名患者发生了PIK3CA突变,1名患者KRAS突变,1名患者FGFR3基因融合,1名患者RET基因融合,1名患者BRAF基因融合。 类似的研究越来越多,从上述研究中我们可以得出结论:导致AZD9291耐药的原因很多,一部分是由于EGFR基因本身再次发生突变,一部分是由于其他驱动基因突变代偿了过来,一部分是由于发生了小细胞肺癌转化。 对于病友而言,如何才能知道自己为何耐药了呢?方法很简单:再次穿刺或者抽血,做基因检测! 02 找准原因,一击必杀 针对上面提及的这些耐药原因,到底应该如何克服呢。本文基于大量文献阅读和临床经验,给出如下建议: ① EGFR C797S 如果是反式突变(发生概率其实不高),可以考虑第一代靶向药联合第三代靶向药;如果是顺式突变,目前还是建议化疗。 ② MET扩增 建议AZD9291联合MET抑制剂(INC280、克唑替尼、Savolitinib等)。 ③ BRAF突变 建议AZD9291联合BRAF抑制剂(达拉菲尼+曲美替尼)。 ④ RET突变 建议AZD9291联合卡博替尼,当然更好的是AZD9291联合BLU-667。2018年9月发表在《cancer discovery》杂志上的研究显示:AZD9291耐药后出现RET融合突变,采用AZD9291联合BLU-667治疗,2名患者全部有效,肿瘤缩小80%。 ⑤ 小细胞肺癌转化 建议尝试EP方案化疗。 ⑥ 其他机制 有待进一步研究,暂时推荐化疗。
邱纯 副主任医师 海南省人民医院 肿瘤内科8733人已读 - 精选 结直肠癌分期及其对应治疗详解
一.结肠癌(一)分期癌症的治疗和预后和癌症在哪一期密切相关。结肠癌的分期基于原发肿瘤的侵润深度(用T来代表),是否有淋巴结转移(用N来代表)和远处转移(用M来代表)。结肠癌分为四期(I, II, III, IV),I期为早期癌,IV期为晚期扩散癌。原发肿瘤(T)Tis:原位癌;T1:肿瘤侵及粘膜下层;T2:肿瘤侵及肌层;T3:肿瘤穿透肌层侵及浆膜下层或大肠周围组织;T4:肿瘤侵犯到其他器官或造成肠穿孔。局部淋巴结(N)Nx:局部淋巴结转移未知;N0:无局部淋巴结转移;N1:有1~3个淋巴结转移;N2:有4个或以上淋巴结转移。远处转移(M)Mx:远处转移未知;M0:无远处转移;M1:有远处转移。最终分期I期: T1~2N0M0;IIA期: T3N0M0;IIB期: T4N0M0;IIIA期: T1~2N1M0;IIIB期: T3~4N1M0;IIIC期: 任何TN2M0;IV期: 任何T任何NM1。(二)治疗1. I期手术切除。2. II期手术切除。一般不主张术后化疗。但有以下情况可以考虑术后化疗:T4肿瘤,低分化肿瘤,手术切除标本中少于6个局部淋巴结(1)。具体化疗方案和以下介绍的用于III期结肠癌的化疗一样。3. III期手术切除。该期结肠癌需做术后化疗。FOLFOX(化疗方案简称)的效果最佳,不同FOLFOX 方案在药物剂量和用法上稍有不同,其疗效并无本质差别。因奥沙利铂(Oxaliplatin)有可能引起神经损害,已有神经损害的病人(如由糖尿病导致 的)应避免用含有奥沙利铂的FOLFOX化疗方案。卡培他滨(Capecitabine,希罗达Xeloda)是口服化疗药,其效果和静脉用氟尿嘧啶(5 -FU)加亚叶酸钙(Leucovorin,CF)相似。具体的化疗方案如下(2~6):FOLFOX4 (化疗方案简称)奥沙利铂(Oxaliplatin)85 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)200 mg/m2/天,在氟尿嘧啶(5-FU)前2小时静滴,第1~2天;氟尿嘧啶(5-FU)400 mg/m2/天,静脉注射,然后再用 600 mg/m2/天,22小时持续静滴,第1~2天;14天后重复治疗,共12个疗程。FOLFOX6 (化疗方案简称)奥沙利铂(Oxaliplatin)100 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)200 mg/m2/天,在氟尿嘧啶(5-FU)前2小时静滴,第1~2天;氟尿嘧啶(5-FU)400 mg/m2,静脉注射,第1天,然后再用 2400 mg/m2,46小时持续静滴,第1~2天;14天后重复治疗,共12个疗程。简化 FOLFOX6奥沙利铂(Oxaliplatin)85 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)400 mg/m2,在氟尿嘧啶(5-FU)前2小时静滴,第1天;氟尿嘧啶(5-FU)400 mg/m2,静脉注射,第1天,然后再用 2400 mg/m2,46小时持续静滴,第1~2天;14天后重复治疗,共12个疗程。氟尿嘧啶(5-FU)500 mg/m2,静脉注射,第1天;亚叶酸钙(Leucovorin,CF)500 mg/m2,静脉注射,第1天;每周重复治疗,治疗6周,休息2周(1个疗程),共4个疗程。氟尿嘧啶(5-FU)425 mg/m2/天,静脉注射,第1~5天;亚叶酸钙(Leucovorin,CF)20 mg/m2/天,静脉注射,第1~5天;28天后重复治疗,共6个疗程。卡培他滨(Capecitabine,希罗达Xeloda)1000 mg/m2,口服,1天2次,治疗2周,休息1周(1个疗程),共8个疗程。4. IV期此期结肠癌的主要治疗手段为化疗。以下为常用的化疗方案(7~9)。一般先用任何一种 FOLFOX加Avastin 化疗方案,等该化疗失效后再改用任何一种氟尿嘧啶(5-FU),亚叶酸钙(Leucovorin,CF),依立替康(Irinotecan,CPT- 11)加Avastin化疗方案。各种氟尿嘧啶 ,亚叶酸钙,依立替康化疗方案之间并无本质区别,只是在药物剂量和用法上稍有不同。卡培他滨(Capecitabine,希罗达Xeloda)是口服化疗 药,其效果和静脉用氟尿嘧啶加亚叶酸钙相似。(1)各种FOLFOX加Avastin化疗方案:FOLFOX4 + Avastin (化疗方案简称)奥沙利铂(Oxaliplatin)85 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)200 mg/m2/天,在氟尿嘧啶(5-FU)前2小时静滴,第1~2天;氟尿嘧啶(5-FU)400 mg/m2/天,静脉注射,然后再用 600 mg/m2/天,22小时持续静滴,第1~2天;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天;14天后重复治疗,共12个疗程。FOLFOX6 + Avastin (化疗方案简称)奥沙利铂(Oxaliplatin)100 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)200 mg/m2/天,在氟尿嘧啶(5-FU)前2小时静滴,第1~2天;氟尿嘧啶(5-FU)400 mg/m2,静脉注射,第1天,然后再用 2400 mg/m2,46小时持续静滴,第1~2天;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天;14天后重复治疗,共12个疗程。简化FOLFOX6 + Avastin奥沙利铂(Oxaliplatin)85 mg/m2,静滴,第1天;亚叶酸钙(Leucovorin,CF)400 mg/m2,在氟尿嘧啶(5-FU)前2小时静滴,第1天;氟尿嘧啶(5-FU)400 mg/m2,静脉注射,第1天,然后再用 2400 mg/m2,46小时持续静滴,第1~2天;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天;14天后重复治疗,共12个疗程。(2)各种氟尿嘧啶(5-FU),亚叶酸钙(Leucovorin,CF),依立替康(Irinotecan,CPT-11)加Avastin化疗方案:IFL + Avastin (化疗方案简称)亚叶酸钙(Leucovorin,CF)20 mg/m2,静脉注射,第1天,每周重复治疗,治疗4周,休息2周;氟尿嘧啶(5-FU)500 mg/m2,静脉注射,第1天,每周重复治疗,治疗4周,休息2周;依立替康(Irinotecan,CPT-11)125 mg/m2,静滴,第1天,每周重复治疗,治疗4周,休息2周;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天,每2周重复治疗;以上治疗可以一直重复,直到失效或因毒副作用而不能再耐受。FOLFIRI + Avastin (化疗方案简称)亚叶酸钙(Leucovorin,CF)200 mg/m2,在氟尿嘧啶(5-FU)前2小时静滴,第1天;氟尿嘧啶(5-FU)400 mg/m2,静脉注射,第1天,然后再用 2400 mg/m2,46小时持续静滴,第1~2天;依立替康(Irinotecan,CPT-11)180 mg/m2,静滴,第1天;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天;14天后重复治疗,共12个疗程。亚叶酸钙(Leucovorin,CF)200 mg/m2/天,在氟尿嘧啶(5-FU)前2小时静滴,第1~2天;氟尿嘧啶(5-FU)400 mg/m2/天,静脉注射,然后再用 600 mg/m2/天,22小时持续静滴,第1~2天;依立替康(Irinotecan,CPT-11)180 mg/m2,静滴,第1天;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天;14天后重复治疗,共12个疗程。(3)在2006年的美国癌症年会上,临床报告显示,如用口服卡培他滨取代FOLFOX + Avastin化疗方案中的静脉用氟尿嘧啶和亚叶酸钙,其疗效并无改变 (10)。具体的治疗方案为:奥沙利铂(Oxaliplatin)130 mg/m2,静滴,第1天;卡培他滨(Capecitabine,希罗达Xeloda)1000~850 mg/m2,口服,1天2次,治疗2周,休息1周;Bevacizumab (Avastin) 每公斤体重7.5毫克(7.5 mg/kg),静滴,第1天;21天后重复治疗,共8个疗程。(4)口服卡培他滨(Capecitabine,希罗达Xeloda),依立替康(Irinotecan,CPT-11)加Avastin化疗方案:XELIRI + Avastin (化疗方案简称)卡培他滨(Capecitabine,希罗达Xeloda)1000 mg/m2,口服,1天2次,治疗2周,休息1周,共8个疗程;依立替康(Irinotecan,CPT-11)250 mg/m2,静滴,第1天,21天后重复治疗,共8个疗程;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天,14天后重复治疗,共12个疗程。(5)如病人不能耐受奥沙利铂(Oxaliplatin)或依立替康(Irinotecan,CPT-11),可只用氟尿嘧啶(5-FU),亚叶酸钙(Leucovorin,CF)加Bevacizumab (Avastin)如下:亚叶酸钙(Leucovorin,CF)500 mg/m2,静脉注射,第1天,每周重复治疗,治疗6周,休息2周,共4个疗程;氟尿嘧啶(5-FU)500 mg/m2,静脉注射,第1天,每周重复治疗,治疗6周,休息2周,共4个疗程;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天,14天后重复治疗,共16个疗程。亚叶酸钙(Leucovorin,CF)20 mg/m2/天,静脉注射,第1~5天,每4周重复治疗,共6个疗程;氟尿嘧啶(5-FU)425 mg/m2/天,静脉注射,第1~5天,每4周重复治疗,共6个疗程;Bevacizumab (Avastin) 每公斤体重5毫克(5 mg/kg),静滴,第1天,14天后重复治疗,共12个疗程。卡培他滨(Capecitabine,希罗达Xeloda)可以单独用,从理论上讲也应该可以和Bevacizumab (Avastin)一起用,其具体效果尚在临床试验中。卡培他滨(Capecitabine,希罗达Xeloda)1000 mg/m2,口服,1天2次,治疗2周,休息1周,直到失效或因毒副作用而不能再耐受。(6)在2006年的美国消化道癌症年会上,临床研究显示,如将氟尿嘧啶,亚叶酸钙,依立替康,奥沙利铂四药合用(简称FLOFOXIRI化疗方案),其效果比氟尿嘧啶,亚叶酸钙,依立替康三药化疗方案FOLFIRI要好(11)。 因该化疗方案不含Bevacizumab (Avastin),对不能用Bevacizumab (Avastin)的病人,可考虑用该方案。具体的治疗方案为:FLOFOXIRI(化疗方案简称)亚叶酸钙(Leucovorin,CF)200 mg/m2,静滴,第1天;氟尿嘧啶(5-FU)3200 mg/m2,48小时持续静滴,第1~2天;依立替康(Irinotecan,CPT-11)165 mg/m2,静滴,第1天;奥沙利铂(Oxaliplatin)85 mg/m2,,静滴,第1天;14天后重复治疗,共12个疗程。(7)如病人用以上化疗失效后,可用艾比特恩(Erbitux,Cetuximab)或Panitumumab。艾比特恩和Panitumumab都是抗表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)的单克隆抗体,因此没有化疗药常有的毒副作用。艾比特恩可以和依立替康(Irinotecan,CPT-11)合用,也可以单独用。Panitumumab刚被批准单独用于治疗转移性大肠癌。具体的治疗方案如下(12~13):艾比特恩(Erbitux,Cetuximab)首次剂量400 mg/m2,静滴,一周后250 mg/m2,每周重复治疗,直到失效;依立替康(Irinotecan,CPT-11)125 mg/m2,静滴,7天后重复治疗;或180 mg/m2,静滴,14天后重复治疗;或350 mg/m2,静滴,21天后重复治疗,直到失效。艾比特恩(Erbitux,Cetuximab)首次剂量400 mg/m2,静滴,一周后250 mg/m2,每周重复治疗,直到失效。Panitumumab 6 mg/kg,静滴,14天后重复治疗。二.直肠癌(一)分期和结肠癌一样。(二)治疗1. I期手术切除。2. II期该期直肠癌需要手术,化疗和放疗。病人可以先做手术切除,再用化疗和放疗。最近的临床研究显示, 先做化疗和放疗再做手术切除效果更好(11)。术前化放疗尤其适用于直肠下端直肠癌,因外科医生无法切除肿瘤而同时保留肛门,术前化放疗可缩小肿瘤而使外 科医生在切除肿瘤的同时保留住肛门。(1)常用的术前化放疗方案有以下两种(14~15):放疗到总剂量50.4 Gy;同步化疗氟尿嘧啶(5-FU)1000 mg/m2/天,持续静滴,放疗第1和5周的头1~5天;化放疗后4到6周做手术切除;再用氟尿嘧啶(5-FU)500 mg/m2/天,持续静滴,第1~5天,28天后重复治疗,共4个疗程。放疗到总剂量45 Gy;同步化疗氟尿嘧啶(5-FU)225 mg/m2/天,持续静滴,直到放疗结束;化放疗后4到6周做手术切除。(2)常用的术后化放疗方案为(16):手术切除后4到6周开始以下化放疗;先单独用氟尿嘧啶(5-FU)500 mg/m2/天,静脉注射,第1~5,29~33天;第64天开始同步放化疗。放疗到总剂量45 Gy。同步化疗氟尿嘧啶(5-FU)225 mg/m2/天,持续静滴,直到放疗结束;最后再用氟尿嘧啶(5-FU)450 mg/m2/天,静脉注射,第134~138,169~173天;3. III期手术切除,然后再用化疗和放疗,具体治疗方案和以上介绍的用于II期直肠癌的一样。4. IV期此期直肠癌的主要治疗手段为化疗。具体的化疗方案和以上介绍的用于IV期结肠癌的一样。三.生存期癌症的治疗在不断的进步,病人的预后也在不断的改善,由于很多新的治疗尚无对长期生存期影响的具体数据,以下给出的结果是根据现有的统计资料,以供参考。(一)结肠癌(17)I期: 5年平均生存率为93%,绝大多数病人都会被治愈;IIA期: 5年平均生存率为85%,绝大多数病人都会被治愈;IIB期: 5年平均生存率为72%,大多数病人都会被治愈;IIIA期: 5年平均生存率为83%,大多数病人都会被治愈;IIIB期: 5年平均生存率为64%,大多数病人都会被治愈;IIIC期: 5年平均生存率为44%,有些病人会被治愈;IV期: 平均生存期为2年左右,5年平均生存率为8%。(二)直肠癌 (18)I期: 5年平均生存率为92%,绝大多数病人都会被治愈;II期: 5年平均生存率为73%,大多数病人都会被治愈;III期: 5年平均生存率为56%,很多病人都会被治愈;IV期: 5年平均生存率为8%。
赵曙 主任医师 哈尔滨医科大学附属肿瘤医院 肿瘤内科3.5万人已读 - 精选 基因检测 总结
目前,在很多的疾病治疗领域中,都在提倡精准治疗的理念,在肿瘤治疗的过程中更不例外。自然,作为肿瘤精准治疗的基础,基因检测现今也是关注度极高的话题。 在临床中就有很多病人都在问我:基因检测是什么?为什么要做基因检测?怎么做?类似的问题不胜枚举…………. 那么,究竟什么样的病人有必要做基因检测?都有一些什么途径来检查呢?我们今天就来简单了解一下关于基因检测的知识。 什么是基因检测? 首先,我们得要了解什么是基因?基因是遗传的基本单元,携带有遗传信息的DNA或RNA序列,通过复制,把遗传信息传递给下一代,指导蛋白质的合成来表达自己所携带的遗传信息,从而控制生物个体的性状表达。 为什么要做基因检测? 基因与肿瘤到底有什么关系?通常,在肿瘤的基因谱上,有原癌基因和抑癌基因之分。原癌基因是那些在人生长发育、细胞分裂中发挥重要功能的基因。如果原癌基因发生突变,则会导致活性增强,细胞分裂失控,导致肿瘤的产生。目前了解比较深入的原癌基因,比如EGFR和KRAS等。 曾有人形象地将它们比作开车时汽车的油门。抑癌基因是那些抑制细胞增殖的基因,这些基因的存在抑制了细胞的过度增殖,起到限制原癌基因活性的作用。这些基因发生了失活突变,相当于没有了功能,也会导致肿瘤的发生。同样是以开车打比方,其好比是汽车的刹车。 各种不同类型的肿瘤的发生,往往涉及到几个、甚至十几个原癌基因和抑癌基因,机理是非常复杂的,到目前为止,除少数几种基因我们了解比较透彻之外,绝大部分的基因功能我们仍知之甚少。 随著科技的进步,我们正慢慢地揭开某些致癌基因神秘的面纱。我们可以使用新一代的测序技术,更好地、全面、系统地检测更多的基因突变,并根据这些的因突变致病机制来寻找合适的针对性的靶向药物。对于适用的人群而言,使用靶向药物比化疗效果更好,副作用更小,可能获得更理想的疗效。 在肿瘤患者中,若基因检测结果中有相应敏感的基因突变,不同基因突变,适合用不同靶向药物。这就像一把钥匙(靶向药物)对应一把锁(基因突变),要首先知道是什么锁,才能选择合适的钥匙。而通过基因检测的方法,我们可以进一步明确突变类型,选用相应的靶向药,制定出个体化、最优化的治疗方案。 基因检测的方式和途径? 基因检测是通过被检测者外周静脉血或其他组织细胞等,利用生物基因技术,通过特定设备及分子生物技术检测方法、扩增受检者基因信息后,对被检测者细胞中的DNA分子信息作检测,分析它所含有的基因类型和基因缺陷及其表达功能是否正常的一种方法。肿瘤患者的基因检测的样本可以是多样的,可以是活检后取得的病变组织样本,也可以是血液、其他体液如胸腔、腹腔、心包腔积液、甚至是脑脊液等。常用方法包括组织/细胞活检及液体活检两种。 基因检测方法 基因检测都查什么? 一般来说,亚洲人群EGFR和ALK突变比例达到50%以上,这两个基因突变占了非小细胞肺癌基因突变的一半以上。对于非小细胞肺癌患者,EGFR突变是临床中最常见的突变,通常最需要检测的两个基因就是EGFR和ALK,而且这两类敏感突变患者,可从靶向治疗中显著获益,而且临床上也有效果很好的靶向药物可用。但其他的一些少见基因突变,比如ROS-1,C-MET,VEGF等等,在临床中也有很好的治疗指导价值。 如果单从理论上讲,基因检测越全面,检查的基因谱越多,能给临床医生提供更多的诊断和治疗的信息就越多。但目前来讲,基因检测价格比较昂贵,且大部分需要患者自费负担,所以,基因检测要从实用性、经济性等多方面全面考虑,慎重选择。 哪些患者有必要进行基因检测 一般来说小细胞肺癌的突变类型很不同,目前极少适用靶向药物,所以基因检测的意义不大。而非小细胞肺癌(腺癌、鳞癌、大细胞神经内分泌癌)的I期、II期、III期一般建议进行常见基因检测,例如EGFR及ALK等,以备将来万一肿瘤复发时指导治疗。当然,对于中晚期且有明显分子靶点的患者,可以根据患者自身情况及经济情况等选择靶向药物进行治疗。 那么在肺癌患者中哪些类型可以做基因检测呢?又有哪些有更适合做基因检测呢? 1.在目前的各个指南中,ASCO则推荐所有患者均可以进行检测,其中肺腺癌与大细胞肺癌做基因检测没有争议。 2.通常鳞癌患者虽然驱动基因突变的概率较低,但也建议进行检测。ESMO则推荐肺鳞癌患者检测,NCCN也认为肺鳞癌可以考虑做,尤其是不吸烟的肺鳞癌患者或者混合类型的肺鳞癌患者。 基因检测的机构和流程 可以做基因检测的机构有很多,但一定要选择正规的、有相关资质认证的机构和医院,建议选择排名靠前的公司检查,而且选择前要与医生沟通,选择检查什么合适的项目。至于是选择组织、还是细胞活检、液体活检,就要根据患者自身的病情以及经济情况决定了。 一般基因检测结果回报的时间均在7-10个工作日之间,根据检查机构的不同回报会有差别。检查结果会提示基因突变的点位、具体的意义以及靶向药物的选择,具体药物选择就由临床医生根据检查结果及患者实际情况做出选择。 基因检测一次就够了吗? 肿瘤存在异质性,在癌症治疗过程中,肿瘤极可能出现耐药或者复发。这时的肿瘤很可能已经和最初的肿瘤不一样,还有可能出现了新的突变,而之前的治疗方案可能不再适用。因此,获取新的肿瘤组织/血液标本,来了解“新肿瘤”特性,对新的用药方案具有重要的指导意义。多次活检、反复的基因检测就有相当的合理性。比如:EGFR突变患者使用第一代靶向药物通常1年左右会发生耐药,其中有50%-60%是由于EGFR基因出现了新的T790M突变引起的,这些患者适合用第三代的靶向药物,而如果没有这种突变,则选择别的治疗方式会更理想。
邱纯 副主任医师 海南省人民医院 肿瘤内科3090人已读 - 精选 非小细胞肺癌17类基因突变靶向药物 深度盘点
NSCLC靶向治疗的新起是肺癌治疗历史上里程碑式的跨越,从20世纪90年代第一代EGFR-TKI吉非替尼应用于临床,到现在涵盖EGFR、ALK等在内的多个基因靶点的靶向药物治疗,靶向治疗在近20年中取得了巨大的突破。 目前可检测与肿瘤靶向药物相关的23个基因的全部外显子,大多数驱动突变是互斥的,每个NSCLC患者体内只存在其中的一种,靶向药物抑制驱动能够诱导显著的肿瘤应答,相比传统细胞毒性药物,其应答率更高、患者疾病无进展生存(PFS)和总生存(OS)更长。 目前的靶向驱动突变包括常见的EGFR突变、KRAS突变、ALK易位,以及不常见的ROS1易位、RET易位、BRAF突变、HER2突变、NTRK易位、MET扩增或突变等。 * 在肺腺癌中驱动突变的比例约为:EGFR 15%,KRAS 25%,ALK 7%,HER2 2%,BRAF V600E 2%,ROS1 2%,RET 2%,NTRK1 0.5%,MET 3%,MAP2K1 0.5%,PIK3CA 1%,NRAS 0.5%。 * 在鳞状细胞癌中驱动突变的比例约为:EGFR 5%,DDR2 4%,FGFR1 17%,PIK3CA 14%,PTEN 18%,PDGFRA 9%,FGFR2 3%。 EGFR突变 EGFR基因常见的突变位点发生在18、19、20和21号外显子上,其中19号外显子的缺失突变约占45%,21号外显子的L858R点突变占40~45%,这两种突变被称为常见突变,其他的突变被称为罕见突变。 从20世纪90年代吉非替尼问世到今天,EGFR-TKI已走过了20多个春秋,第三代EGFR-TKI奥西替尼已获批用于临床。 EGFR突变 EGFR基因常见的突变位点发生在18、19、20和21号外显子上,其中19号外显子的缺失突变约占45%,21号外显子的L858R点突变占40~45%,这两种突变被称为常见突变,其他的突变被称为罕见突变。 从20世纪90年代吉非替尼问世到今天,EGFR-TKI已走过了20多个春秋,第三代EGFR-TKI奥西替尼已获批用于临床。 EGFR突变 EGFR基因常见的突变位点发生在18、19、20和21号外显子上,其中19号外显子的缺失突变约占45%,21号外显子的L858R点突变占40~45%,这两种突变被称为常见突变,其他的突变被称为罕见突变。 从20世纪90年代吉非替尼问世到今天,EGFR-TKI已走过了20多个春秋,第三代EGFR-TKI奥西替尼已获批用于临床。 第一代EGFR-TKI IPASSM+、NEJ002、IPASS、OPTIMAL等在内的多项临床研究显示吉非替尼在EGFR基因敏感型患者中相比传统化疗,能明显延长患者OS和PFS。 EURTAC、OPTIMAL、LUX-LUNG3等实验结果则证实了厄洛替尼在EGFR基因敏感型患者中,厄洛替尼组患者总生存期以及客观缓解率均在不同程度上高于传统铂类化疗组。并且厄洛替尼相比吉非替尼具有更高的血脑屏障渗透性,更适合用于治疗脑转移患者。 埃克替尼则在化学结构、分子作用机理、疗效等方面与吉非替尼、厄洛替尼相似,但具有更好的安全性。 第二代EGFR-TKI 阿法替尼与达克替尼均为人表皮生长因子受体(HER)的不可逆抑制剂,阿法替尼与吉非替尼相比,显示出更长的PFS与OS提高。达克替尼与吉非替尼相比PFS、ORR均有明显延长,且亚裔患者似乎从治疗中获益更多。 第三代EGFR-TKI 临床使用TKI药物治疗晚期NSCLC在治疗后的6~13个月后普遍会出现TKI耐药问题,继发性耐药的出现与酪氨酸激酶20外显子的T790M点突变有关,约有60%继发性耐药的患者会出现T790M点突变。 第三代EGFR-TKI奥西替尼被认为是解决T790M点突变的最佳解决方法。同时在一线治疗晚期NSCLC中,奥西替尼相比吉非替尼可以获得更长的PFS与OS。 ALK突变 在NSCLC患者中,EML4-ALK融合基因约占3%~5%。该基因型多出现于年轻、男性、不吸烟的NSCLC患者。EML4-ALK一般不与EGFR突变基因型同时存在,EML4-ALK基因成为NSCLC继EGFR之后分子靶向治疗的又一重要靶点。 克唑替尼主要通过与ALK结合并阻止ALK结合ATP阻断肿瘤细胞信号传导通路,无论之前是否接受过治疗,与化疗相比,都可以提高客观反应率和中位无进展时间。 色瑞替尼、阿来替尼、brigatinib、X-396、lorlatinib与克唑替尼结构的差异,使得它们具有更高的特异性(不能阻滞ROS1和PD1)、敏感度以及血脑屏障透过率。 实验证明,使用克唑替尼后耐药的患者中,至少39%的患者可以受益于新一代的ALK抑制剂,PFS可延长5.7个月及以上。 基于以上数据,FDA批准色瑞替尼和阿来替尼用于治疗使用克唑替尼后脑或脑膜转移的ALK靶点阳性的患者。目前NCCN指南推荐克唑替尼、色瑞替尼作为Ⅳ期ALK阳性NSCLC的一线治疗。 KRAS突变 KRAS基因在吸烟的非亚洲腺癌患者中,突变率高达25%。Kras基因突变很可能是NSCLC预后的负面因素。KRAS突变类型多变,它们可能参与不同的肿瘤细胞信号传导途径。目前治疗Kas突变的药物主要包括曲美替尼、司美替尼和Abemacinib。 ROS1易位突变 ROS1编码一种受体酪氨酸激酶(RTK),与细胞的生长、增殖、分化和生存有关。NSCLC患者中,1%~2%出现6号(6q22)染色体易位突变,其中,大部分是年轻的不吸烟腺癌患者。 克唑替尼(crizotinib)已被FDA批准治疗ROS1突变的NSCLC患者。随着研究的进展,包括卡博替尼(cabozantinib),entrectinib(RXDX-101)等更多针对ROS1靶点的靶向药物相继问世。目前NCCN指南推荐克唑替尼、色瑞替尼用于一线治疗ROS1重排阳性的患者。 MET突变 MET基因扩增被认为与EGFR-TKIs的使用以及获得性耐药有关。近期的试验证明,小分子抑制剂克唑替尼(crizotinib)和卡博替尼(cabozantinib)对MET突变阳性的患者有效,与化疗相比能提高患者的PFS,目前关于MET抑制剂以及EGFR-TKIs联用的试验正在进行中。一些疗效尚未确切的MET抑制剂,比如,INC280,MGCD265和volitinib正在进行临床试验。 HER2突变 HER2突变一般出现在不吸烟的女性腺癌患者中,出现率1%~2%。大多数为20外显子的插入突变。相关研究证明,曲妥珠单抗(trastuzumab)对HER2突变阳性的患者疾病控制率达到93%。此外,亦有实验证实HER2突变与其他靶点的抑制剂联用或许能收到更好的效果。 BRAF突变 NSCLC的BRAF突变率约为3%,其中50%为BRAF V600E突变,大部分是腺癌,多发生于吸烟肺癌患者。 治疗BRAF突变的药物中达拉菲尼+曲美替尼组合获用于BRAF V600E突变阳性的NSCLC,2018年的NCCN指南将其推荐作为BRAF突变的NSCLC的一线治疗,其他的BRAF靶向药物是否能用于NSCLC则需要进一步研究。 RET易位 RET基因可以与CCDC6,KIF5B,NCOA4和TRIM33等易位融合。这种现象可以在1%的腺癌患者中发生。但对于年轻的,不吸烟的患者来说,概率可以提升到7%-17%。 卡博替尼(cabozantinib)、凡德他尼(vandetanib)、舒尼替尼(sunitinib)和普纳替尼(ponatinib)等酪氨酸激酶抑制剂早已被批准应用于RET阳性的其他肿瘤。而对于非小细胞肺癌的临床试验也正在紧锣密鼓的进行当中。 NTRK1基因融合 NTRK1(神经营养酪氨酸激酶1型受体)基因能编码高亲和力的神经生长因子受体(TRKA),从而促进细胞分化。MRRIP-NTRK1及CD74-NTRK1融合都可以导致结构性的TRKA激酶活性的改变,从而发挥癌基因的作用。 据报道,约有3%的没有其他已知癌基因突变的NSCLC患者肿瘤中可以发现NTRK1基因融合现象。NTRK1抑制剂如克唑替尼、ARRY-470和来他替尼等正在临床试验阶段。 FGFR1扩增 FGFR1(成纤维生长因子受体1)是一种受体型酪氨酸激酶,它通过MAPK和PI3K通路介导肿瘤发生。13%-25%的肺鳞癌可以检测出该种突变,肺腺癌中罕见。 吸烟是FGFR1突变的危险因素,FGFR1突变对预后的影响仍不可知,因为各项报道的结论并不一致。目前使用FGFR抑制剂来治疗肺鳞癌的研究尚处于临床研究阶段。 DDR2基因突变 DDR2(盘状死亡受体2)是一种只能被胶原激活而非肽类生长因子激活的酪氨酸激酶受体,它能促进细胞迁移、增殖和存活,4%~5%的肺鳞状细胞癌中可以出现DDR2突变。 达沙替尼(dasatinib)是一种酪氨酸激酶抑制剂,曾经被用于慢性粒细胞性白血病。目前有病例报道DDR2第18号外显子突变S768R对达沙替尼有效。而瑞戈非尼、达沙替尼治疗DDR2突变的肺鳞癌的临床研究仍在进行中。 PI3KCA信号通路异常 PI3K信号通路是肿瘤存活和增殖的核心通路。PI3KCA和AKT1基因功能的放大、PTEN基因功能的丧失都会引起PI3K信号通路的改变。 据报道,PI3KCA扩增和突变分别占非小细胞肺癌的37%和9%。PI3KCA突变是是导致EGFR-TKI耐药的机制之一。目前治疗PI3KCA突变的药物主要包括依维莫司和替西罗莫司,二者已被批准用于其他癌种,在肺癌中的应用仍在研究当中。 KIT突变 KIT突变是ROS1重排NSCLC克唑替尼治疗后耐药的新机制,这个旁路激活是一个不依赖ROS1的耐药机制,但具有被KIT抑制剂ponatinib抑制的潜能,临床上用于KIT突变的药物主要包括: MEK1 体外实验表明MEK1第2号外显子突变可能导致EGFR-TKI类药物耐药。MEKI是BRAF下游增殖信号通路的丝氨酸苏氨酸激酶,约1%的NSCLC存在MEK1突变,这种突变在肺腺癌中较肺鳞癌多见,主要突变位点为K57N,Q56P和D67N。 在体外模型中,MEK1突变可以导致信号通路持续激活并对MEK抑制剂敏感。但MEK抑制剂在临床中应用的疗效目前还未知晓,一项MEK抑制剂MEK162的Ⅱ期临床试验已在RAF,RAS,VF1或MEK突变的实体瘤患者中展开。 NRAS 约1%的NSCLC患者存在NRAS体细胞突变,NRAS突变在腺癌及有吸烟史的肺癌患者中发生率较高,临床前模型中NRAS突变的NSCLC显示出对MEK抑制剂敏感。 目前可用于NRAS突变的靶向药物包括: PDGFRA 在肺鳞状细胞癌中发现有PDGFRA(血小板源性生长因子受体α)的扩增。通过shRNA敲除或小分子抑制PDGFRA可损害细胞存活和贴壁非依赖性的生长,表明PDGFRA可能是带有PDGFRA扩增的癌症的一种驱动癌基因。 多种PDGFR抑制剂在肺癌中的应用目前正在临床开发中,与FGFR1抑制剂相似,大量的药物都能抑制多种激酶。 PTEN 肿瘤抑制基因PTEN编码的脂质磷酸酯酶对PI3K-AKT信号起负调控作用,PTEN丧失可导致组成性PI3K-AKT信号。PTEN在大量癌症中可通过多种机制失活。相比于腺癌,PTEN丧失在鳞状细胞癌中更常见。临床试验正在评估PI3K抑制剂在PTEN缺失癌症中的效应。 依维莫司可以显著降低对厄洛替尼和放疗联合治疗耐药的肺腺癌细胞系PC9中p-P70S6K的表达,且与厄洛替尼和放射组合治疗相比,存活细胞数目也显著降低。此外,依维莫司治疗在第6周时显著抑制了肿瘤的增长。这些结果表明,厄洛替尼和放疗联合治疗产生耐药性后,依维莫司能够逆转这种耐药性。
邱纯 副主任医师 海南省人民医院 肿瘤内科7804人已读 - 精选 ALK基因突变治疗策略和方案的探讨
间变性淋巴瘤激酶(ALK)基因融合突变是非小细胞肺癌(NSCLC)常见的一种驱动基因,突变的形式有过量表达、形成融合基因,发生点突变等等。 ALK融合基因发现于2007年,全球非小细胞肺癌患者中突变频率为3.4%,东方人群4.1%,欧美人群2.5%,中国5.3%。有回顾性研究表明中国患者人群不吸烟患者ALK阳性的比例达到11.6%,EGFR/KRAS均野生的不吸烟患者ALK阳性比例高达42.8%。 ALK阳性虽然不如EGFR阳性患者数量大,但一方面其绝对数量在NSCLC中仅次于EGFR,另一方面其检测方法、病理学特征和ROS1、MET有一些相似之处,此外间变性大细胞淋巴瘤(ALCL)、炎性肌纤维母细胞瘤(IMT)等也存在不小比例的ALK阳性患者,对于我们国人来说值得高度关注。 对于NSCLC来说,年轻、女性、亚裔不吸烟的患者较易出现该基因突变,组织学亚型中,粘液型腺癌中出现的比例较大。肺鳞癌患者ALK融合基因突变概率很低,有报道说1400个肺鳞癌患者里ALK融合基因的发生率为1.3%,虽然绝对数量较小,但是还是有一定的比例,所以对于鳞癌患者也是可以做一下ALK检测的,实际了解到的肺鳞癌病友中也存在ALK阳性并受益于ALK抑制剂的。 图1、ALK阳性NSCLC的典型临床及病理特征 ALK激酶域共有10个外显子(EXON20-29),最常见的EML4融合发生在EXON20外显子上。 目前发现ALK有27种融合形式,主要的融合伴侣基因是EML4,其他的融合伴侣基因还有KIF5B、TFG、KLC1和PTN3等 因此检测时需确保这些融合位点都做了详细的覆盖,避免漏检。 图2、ALK常见融合伴侣基因及变体 ALK突变的非小细胞肺癌被认为是一种独立的分子亚型,与其他驱动基因互相排斥,也就是说,如果有ALK突变,那么其他驱动基因的突变可能性比较小,当然也有例外。 大约10-13%的ALK融合阳性患者同时携带EGFR、KRAS、BRAF或MET突变基因,近年来发现了EGFR和ALK双突变共存型的患者。 ALK基因的检测方法 ALK基因的检测方法有荧光原位杂交(FISH)、显色原位杂交(CISH)、免疫组化(IHC)、基于PCR的各种方法、NGS二代测序等。 * FISH被FDA批准认可,长期作为ALK检测的金标准,不过缺点就是无法区分ALK融合亚型、无法同时观察肿瘤组织的形态结构。 * CISH和FISH具有一致的检测敏感性、特异性,能观察到肿瘤组织的形态结构,其他缺点和FISH相似,无法区分ALK融合亚型。 * IHC主要通过免疫组化染色检测ALK蛋白表达,罗氏的Ventana IHC试剂盒检测获得CFDA批准作为伴随诊断ALK的标准,其一致率与FISH非常接近,所以看到检测报告Ventana IHC阳性,这就提示可以使用ALK抑制剂,缺点就是无法区分ALK融合亚型,另外蛋白存在降解的可能,切片存储3个月以上就不建议Ventana IHC 检测。 * RT-PCR方法简便可行,缺点是仅能检测少数融合亚型。 * NGS二代测序可以检测任何融合亚型,值得考虑,因为ALK的二次突变涉及多个突变点位发生继发性的耐药机制。 图3、ALK基因的检测方法的原理和优缺点 ALK突变的耐药机制 图4、多种ALK抑制剂耐药性机制 (ALK融合基因阳性NSCLC) 导致克唑替尼产生耐药的原因总体来说有以下几种: ALK激酶域继发性耐药突变 ALK融合基因拷贝数扩增 旁路和下游通路的激活 上皮间充质转化等 其中旁路和下游通路的激活,ALK通路和EGFR通路的活化突变有所相似。 激酶域的突变是公认的耐药机制。 前面谈到,融合基因的结合在20外显子,继发耐药突变则主要发生在21-25外显子上,正常情况下TKI药物与EML4-ALK受体凹槽中ATP(三磷酸腺苷)口袋区结合,竞争性抑制ATP结合,产生抗肿瘤作用。 值得注意的是,只有ALK融合基因突变使用ALK抑制剂才有效,包括最常见的EML4以及其他不常见的融合基因突变,ALK点位突变使用ALK抑制剂是无效的,所以我们不能看到检测报告里有ALK突变,就以为可以使用克唑替尼了。 激酶域突变会影响药物进入ALK活性位点的能力,使得药物失效耐药。 目前常见的耐药激酶域有:L1196M(守门员突变)、C1156Y、F1174L、L1153R、D1203N、S1206Y、G1260A、G1269A、1151Tins、G1202R等。它们很多时候都是同时存在的,即突变具有广谱性,使得ALK药物耐药机制异常复杂。 有一点需要注意,ALK阳性患者耐药后几乎没有组织学类型改变的情况出现,比如腺癌变小细胞,这一点和EGFR有明显区别,我们在EGFR突变中谈到,10%左右在治疗后发生组织学类型改变。 图5、ALK继发性耐药的机制 ALK突变的治疗策略 克唑替尼 是目前被批准用于一线治疗ALK阳性患者的小分子的TKI。 克唑替尼在 ALK 阳性 NSCLC 中的两项关键性研究分别为:全球多中心PROFILE1014 研究,亚太多中心 PROFILE 1029 研究。 图6、1014研究设计图 PROFILE 1014 试验入组标准是 ALK 阳性局部晚期 / 转移性的、无既往治疗的非鳞NSCLC患者。研究结果用大白话说:在ALK阳性的NSCLC患者中,一线克唑替尼治疗与培美曲塞为基础的化疗相比,得到了更长的无进展生存期,客观缓解率显著增加。PROFILE 1014研究确定了克唑替尼作为晚期ALK阳性NSCLC患者的一线首选治疗方案。 图7、1014研究无进展生存期PFS曲线 图8、1014研究客观缓解率ORR PROFILE 1014 研究证实一线克唑替尼治疗明显优于标准含铂化疗,中位PFS分别为10.9月和7.0月,ORR显著提高,分别为74%和45%。 针对ALK阳性亚裔人群的克唑替尼对比化疗一线治疗的PROFILE 1029研究也达到了主要研究终点,表明在亚裔人群一线克唑替尼治疗明显优于标准含铂化疗。用大白话说,1014确定了全球ALK阳性患者一线使用克唑替尼治疗,1029进一步确定了亚洲ALK阳性患者一线使用克唑替尼治疗的策略。 克唑替尼耐药后的治疗策略 克唑替尼治疗出现疾病进展,根据患者症状、转移部位、单发/多发病灶决定克唑替尼耐药后的治疗。克唑替尼治疗进展模式表现为三种主要进展模式:仅新发病灶,仅靶病灶进展,新发病灶和非靶病灶进展,约各占1/4,全面进展较少,仅5%。 局部进展或缓慢进展,如果一般情况良好,且无显著临床症状恶化,继续克唑替尼,并针对局部病灶进行治疗(如放疗、消融等)。 快速进展,化疗、ALK二代三代抑制剂、克唑替尼联合其他通路用药。 在这里主要说下克唑替尼耐药后化疗的策略,ALK二代三代抑制剂作为单独的部分介绍。回顾性研究表明培美曲塞/铂类化疗方案相比其他化疗方案在NSCLC非鳞癌ALK阳性患者中疗效更优,而对于鳞癌ALK阳性患者,耐药后的化疗方案一般考虑吉西他滨、多西他赛或者白蛋白紫杉醇等方案。 图9、克唑替尼耐药的原因及应对策略 ALK二代三代抑制剂简述 图10、ALK抑制剂 艾乐替尼(Alectinib,代号CH5424802) Alectini是罗氏公司研发的二代ALK抑制剂,能有效对抗不少ALK激酶区突变,且对脑病灶控制较好。基于J-ALEX试验结果,FDA于2015年12月11日批准Alectinib用于克唑替尼治疗后发生进展的ALK阳性NSCLC患者的治疗。 药物服用方式:一线300*2mg,bid(日本);二线600*2mg,bid(美国)。随餐口服。胃溶胶囊。 色瑞替尼(Ceritinib,LDK378) Ceritinib是瑞士诺华公司研发的二代ALK抑制剂。2014年4月29日FDA批准Ceritinib用于经克唑替尼治疗后病情恶化或不耐受的ALK阳性转移性NSCLC患者的治疗。 药物服用方式:750mg,qd(标准剂量),亚裔大多需要减量,600常见,最低剂量450。 空腹给药(饭前1小时或饭后2小时);随餐服用疗效没有显著性差异,胃肠道反应减少,但肝损和新血管毒性增加。胃溶胶囊。 Brigatinib(AP26113) AP26113是Ariad公司药物,一种新型的ALK和EGFR双重抑制剂,可强效抑制ALK的L1196M突变和EGFR的T790M突变,最常见的不良反应为腹泻。2016年ASCO会议上公布了ALTA研究结果(Brigatinib的II期研究),达到了设计目标。据悉将于今年上半年被FDA批准上市。 药物服用方式:90mg,qd起,有进展逐渐加量;T1151T、I1171N突变120mg起,G1202R突变180mg起;脑转移患者需要达到180mg,病友实践中有加量到240mg耐受的。 空腹给药(饭前1小时或饭后2小时);随餐服用疗效没有显著性差异。病友实践反馈AP耐药后有采用AP+184的方案,部分有效,但副作用巨大。胃溶胶囊。 Ensartinib(X-396) X-396是由美国Xcovery研发的第二代ALK抑制剂,浙江贝达药业获得Ensartinib项目在中国市场的所有权益。 2016年ASCO会议报道了Ensartinib II期临床部分数据,研究结果表明,未用克唑替尼的患者总有效率为88%,PFS最长已经超过32个月,进展的一名患者为Met扩增。克唑替尼耐药的患者总有效率为77%(10/13),PFS最长的为29个月。克唑替尼和色瑞替尼耐药的患者总有效率为29%。 药物服用方式:225mg,qd(II期临床剂量),空腹给药(饭前1小时或饭后2小时)。胃溶胶囊。 劳拉替尼(Lorlatinib,PF06463922) PF-3922是辉瑞公司研发的第三代ALK抑制剂,可抑制克唑替尼耐药的9种突变,具有较强的血脑屏障透过能力,入脑效果较强,特别适合对其他ALK耐药的晚期NSCLC患者。 2016年ASCO会议上公布了该药的I/II期临床研究数据,确定的给药方案为每日1次100mg,患者的总应答率为46%,3例实现完全应答,16例实现部分应答,中位PFS为11.4个月,另外还显示出缩小转移性的脑部肿瘤体积的效果。 病友反映AP耐药后3922不一定有效,主要优势在于脑部控制不错,但肺部控制不佳,尤其是胸水腹水的患者,主要可能是因为3922本身的两大棘手副作用,一是外周水肿,二是会增加积液,更多的积液导致治疗无效。可采用3922联合贝伐或V靶点药物来对抗,部分有效。 药物服用方式:临床剂量100mg,qd,病友实践20-100mg,qd,加减量以5mg为宜,最低20mg起;G1202R突变75mg起,超过50mg副作用较大;空腹给药(饭前1小时或饭后2小时)。肠溶胶囊。 塞卡替尼(AZD0530) AZD0530是阿斯利康公司研发的Src抑制剂,体外实验显示克、色瑞联合AZD0530有可能解决Src激活导致克耐药的问题。 药物服用方式:临床剂量为125mg,qd,最低联合剂量50mg;空腹给药(饭前1小时或饭后2小时)。胃溶胶囊。 图11、AKT-TKI活性比较 ALK-TKI联合其他通路抑制剂 ALK-TKI联合HSP90、EGFR、MEK、MTOR抑制剂。 ALK-TKI的轮回 Lorlatinib(PF06463922)被作为ALK靶点的最后一张王牌,因为克唑替尼耐药的所有位点该药似乎都能克服,直到出现了L1198F。 新英格兰医学杂志报道了一名患者治疗经过。该患者首先使用克唑替尼,耐药后检测发现了C1156Y,但是这个患者对二代ALK抑制剂没有应答,不得已使用Lorlatinib,但是后面新出现的L1198F导致对Lorlatinib耐药,看似山穷水尽,却不曾想L1198F突变导致了与克唑替尼结合更好,逆转了C1156Y的作用,患者对克唑替尼重新复敏。 患者同时存在C1156Y和L1198F突变,造成了这种三代耐药重回一代的逆转。也许其他的突变位点如L1196M等和L1198F就没有这种协同效果,或者还有可能Lorlatinib耐药的原因是其他的旁路激活,如KRAS或EGFR等,具体的还是可以根据基因检测结果来谨慎分析和对待。 ALK抑制剂的病友用药实践总结: 1、序贯策略:基本上ALK是采用1、2、3代药序贯使用,大致分为克唑替尼-AP26113-3922、克唑替尼-378-3922、克唑替尼-378-AP-3922的思路。对于4期病友,只要治疗方案正确合理,4-5年生存期的比例很高,希望很大,至于早期病友生存期更长,无愧于钻石突变的美名。 2、选择CH的病友不多,一方面是价格太贵,另一方面国内临床入组效果不太理想,一个病友6个月耐药,另一个10个月耐药,比日本临床数据差不少。 怪鱼博士认为,由于CH入脑能力强,初诊就脑转的病友可以把CH作为一线选择项。AP耐药后脑部进展或者脑部转移的病友用3922效果较好,但肺部同时进展的病友,3922不理想,主要体现在肺部控制不力,胸水腹水解决不了,水肿也很厉害。部分病友采用3922+贝伐有效,更多的因积液和肺部进展导致治疗无效而死亡。总之难度挺大。378耐药后有尝试AP结果有效的,但AP耐药后尝试378的基本无效,这和AP的多靶点抑制能力有关系。 3、怪鱼博士做了初步的调查,克唑替尼的PFS反馈有5年多了,有些病友脑转后局部放疗后继续使用克唑替尼仍然有效,增加了克唑替尼的有效期。378的反馈有30个月,AP的反馈有3年左右。396因为使用时间不长,目前看来有使用半年以上的病友。 ALK药物基本上都存在间质性肺炎的副作用,据统计发生3级以上间质性肺炎的比例为1.6%,如果发生药物带来的间质性肺炎,要考虑永久停药。 ALK抑制剂停药的最新文献述评 近期我们癌度公众号发表了一篇关于ALK停药的最新研究(点击阅读:),文章指出对于ALK过表达的细胞模型,采用药物抑制时,癌细胞对药物产生了依赖,治疗过程中突然停药,会让癌细胞一下子不适应,进而逐渐凋亡。当然,这个模型是体外和小鼠实验模型,并不是人体临床试验。 无独有偶,舒尼替尼(索坦)间断给药治疗肾癌的回顾性研究(回顾性是重新挖掘和分析过往的临床试验结果)和前瞻性研究(前瞻性重在挖掘新信息)得出了间歇式给药治疗是安全可靠且有效的,虽然样本量不大。 这些最新的研究启示我们新的可能,即ALK或者其他的靶点是否可以通过间歇式给药、剂量调整达到延缓耐药的目的,这也和我们的癌度船长的思路相近,即用进化的思维打抗癌的持久战(点击阅读:),用不同的手段牵制癌细胞,在恰当的时间使用恰当的武器或者组合,同时宣扬正能量和精神力量,鼓舞广大的病友和家属,达到与癌共舞、和谐共存、延长生存期、提高生活质量的目的。 总结: 1、如果一线用Crizotinib,耐药后二线该选用何药?目前可供选择的药物有Ceritinib、Alectinib、Brigatinib或者Ensartinib等药物,令人眼花缭乱。究竟应该如何合理制定一线二线乃至三线用药的全局策略,在针对ALK突变的分子机制、脑转移病灶疗效、毒副作用、治疗费用上,需要平衡药物的疗效、毒性和经济学来选择。序贯治疗可能是一个重要的策略,但还需更多的临床数据来佐证。 2、克唑替尼耐药的机制包括ALK激酶域继发性耐药突变、ALK融合基因拷贝数扩增、旁路和下游通路的激活、上皮间充质转化等,需要根据耐药机制制定对应的策略,包括序贯使用二代、三代ALK抑制剂,克唑替尼联合其他TKI,化疗等。 3、实践中,病友们在克唑替尼耐药后采用二代抑制剂时,绝大部分选择AP26113,原因众所周知,其yl药物质量相对可靠,价格相对较低能承受。ALK药物价格过于昂贵,制约了药物的应用。 4、针对ALK融合基因检测的方法前面已经列出来了,需要指出的是,上述方法都需要肿瘤组织标本。液态活检(包括外周血、积液)的准确率伴随技术的进步在提高,外周血中的ALK等位基因丰度变化趋势可以辅助评估治疗效果。 不过目前的抽血测ctDNA检测ALK突变可能会有阴性,PCR等检测方法也还没有相应的产品,目前只能尽量地取耐药后的新发组织样本,进行二代测序检测。ALK突变还比不上EGFR突变检测组织与血液的吻合度。所以ALK耐药检测最好使用组织和血液相互验证,提高检测的准确率,实现精准治疗。 5、只有ALK融合基因突变使用ALK抑制剂才有效,EML4-ALK和其他融合形式疗效没有差异,但ALK点位突变使用ALK抑制剂是无效的,所以我们不能看到检测报告里有ALK突变,就以为可以使用克唑替尼了。此外,ALK突变丰度可能和ALK抑制剂疗效正相关。 6、ALK继发性耐药机制有一半不在ALK通路上,肿瘤进化具有高度异质性,耐药机制复杂多变,进化和药物选择压力充满敌意,初诊时的基因突变检测和耐药后的活检应该成为标准治疗策略,以便更为有效的应对耐药,而不是选择盲试。
 邱纯 副主任医师 海南省人民医院 肿瘤内科9143人已读
邱纯 副主任医师 海南省人民医院 肿瘤内科9143人已读 - 精选 植入式静脉输液港临床应用专家共识及技术操作指南(2017
中心静脉作为一种安全的输液途径已经获得共识。 1982年,Niederhuber等首次报道将植入式静脉输液港(implantable venous accessport,IVAP,简称PORT)应用于临床。 由于具有血管并发症少、局部感染和导管移位发生率低且不需要换药等优点,PORT在乳腺癌临床领域得到广泛应用。 为规范PORT的临床应用,中华医学会外科学分会乳腺外科学组,组织国内部分专家讨论并制定本共识和操作指南,旨在为国内乳腺癌及其他专业医师提供参考借鉴。 第一部分 专家共识 PORT是一种可供反复穿刺的全植入式血管通道装置,可以长期或间歇性使用。理论上,全身各中心静脉都可以选择植入。本共识推荐优选经皮颈内静脉及锁骨下静脉穿刺置管,贵要静脉、股静脉等亦可选择。 1、适应证 PORT的适应证包括: (1)需输入化疗药物。 (2)需长期输入高渗透性或黏稠度较高的药物。 (3)需使用加压泵快速输液。 (4)需长期输液和保留静脉通路。 (5)每日需多次静脉采血检查。 2、禁忌证 PORT的禁忌证包括: (1)不能耐受手术。 (2)凝血机制障碍。 (3)对导管所含成分过敏。 (4)拟植入部位皮肤感染。 (5)植入部位具有放射治疗史,或局部组织影响PORT稳定性。(6)拟植入深静脉有静脉炎和静脉血栓形成史。 3、并发症及治疗 PORT的并发症按照发生时间分为术中并发症和术后并发症。 3.1 术中并发症 3.1.1 常见并发症 PORT植入过程中常见并发症包括:气胸[和(或)血胸]、空气栓塞、动脉损伤、心包填塞、心律失常、胸导管损伤、神经损伤、导管移位、导管无法植入等。 3.1.2 术中并发症防治 预防术中发生并发症是PORT操作的关键。其中,手术医师应经过培训,熟悉血管解剖并严格掌握适应证和操作规范。 推荐术前对穿刺静脉进行超声定位或术中使用超声引导下的静脉穿刺; 坚持通过细针试穿确定静脉的位置和插入最佳路径的原则; 沿导丝送入血管鞘管动作应轻柔; 注意左侧颈内静脉穿刺时鞘管深度一般不应该超过10 cm; 注意避免导管开口处于开放状态而导致空气栓塞。 沿鞘管送入导管过程中,病人配合屏气动作是有效增加中心静脉压力的方法,可以降低空气进入血管的发生率; 注意术中辨认穿刺回抽血液颜色及观察穿刺针溢出血液的流速; 必须在术中透视或术后通过X线胸片确认导管头端位于上腔静脉近右心房处,距离心包投影2 cm左右。 3.2 术后并发症 3.2.1 常见并发症 PORT植入后常见并发症包括:感染或非感染原因导致的皮肤、软组织损伤,静脉炎导管相关性感染,导管断裂或破裂、导管异位,导管相关性血栓、导管阻塞、药物外渗等。 3.2.2 术后并发症防治 3.2.2.1 局部皮肤损伤 囊袋表浅或注射座较大,穿刺部位液体外渗或综合因素导致囊袋感染,均可能导致局部皮肤、组织损伤。严重者可以发生PORT外露。 为避免此并发症发生,应注意以下问题: (1)术前仔细评估病人穿刺及注射座部位,避免在活动度较大的肌肉旁建立注射座。 (2)应根据病人皮下组织厚度选择PORT型号,防止注射座高出皮肤引起张力过高或受衣服摩擦而引起不适,尤其肥胖体形病人受同侧乳房的挤压导致注射座上移,更易导致摩擦,甚至导管脱落和断裂。 (3)肥胖病人手术预留皮下脂肪厚度应<2 cm。 (4)避免在经受放疗和乳房切除侧胸壁安放注射座。 (5)避免在锁骨下缘安放注射座,因为注射座与导管连接处邻近于锁骨下缘易与锁骨发生摩擦。 (6)避免在同一部位反复进行穿刺。 3.2.2.2 PORT感染 可能与多种因素相关,包括病人自身体质弱或免疫功能低下,以及导管腔外附壁血栓、导管内纤维蛋白凝集或血块形成引起栓塞。常见的导管培养细菌为皮肤菌群。近年来,革兰阴性杆菌及念珠菌引起的导管感染发生率也不断升高。临床表现包括局部感染和全身感染。局部感染主要发生在穿刺部位、隧道和囊袋,表现为局部红、肿、热、痛,甚至皮下积脓等;全身感染主要表现为发热、白细胞升高等。留置PORT病人出现注射座周围局部症状,以及原因不明的发热或败血症等全身症状,需警惕导管相关性感染的可能。对可疑导管相关感染应至少取2份血标本进行培养,包括外周血及PORT留置处。 确诊导管相关性感染需满足以下至少1项: (1)一次半定量或定量的血培养阳性,PORT留置处血标本和外周血标本培养出相同微生物(包括种属及抗生素敏感性)。 (2)RORT留置处血标本和外周血标本血培养菌落数≥5:1。 (3)有血培养阳性时间差。 (4)PORT留置处脓液培养菌与外周血培养菌一致。 若不能满足以上条件,在排除存在其他感染病灶的情况下,以下情况可作为临床诊断:导管培养阳性,临床表现为脓毒血症,且拔出导管48 h内症状好转;或导管培养阴性,有至少2次血培养阳性,且为皮肤共生菌。 处理原则:根据局部炎症反应程度酌情处理。轻度局部感染可使用碘酒、酒精消毒,更换敷料。怀疑为PORT引起的全身感染,需拔出导管并对其尖端作细菌培养,同时,应监测外周血与导管细菌培养结果,观察生命体征,考虑全身应用抗生素。警惕是否合并感染性心内膜炎。 3.2.2.3 导管相关性血栓 导管相关性血栓(catheter related thrombosis,CRT)是指导管外壁或导管内通路中血凝块形成,发生率为2%~26%。 避免CRT的发生,重在预防。 应选择合适的血管和适宜型号的导管,防止因导管管径过粗造成局部血流速度减慢,或作为异物刺激导致静脉炎;应注意置入导管的头端位置,推荐位于上腔静脉近右心房处,距离心包投影2 cm为宜,因此处血流流速快,可以对导管头端起到冲刷作用。 血栓形成与多种因素相关。 (1)血管内膜损伤:穿刺时损伤血管内膜,尤其是重复静脉穿刺时。 (2)血流量减少及流速减慢:留置导管后静脉血流减慢促进血栓形成。 (3)高凝状态:老年、肿瘤病人常见。 (4)长期卧床。 (5)某些抗肿瘤药物也会增加血栓风险。 (6)导管材质。 CRT表现为输液速度降低,导管回抽无血。 PORT植入侧肩部、颈部可出现疼痛,上肢可出现肿胀、疼痛、皮肤颜色改变和肢端麻木,部分病人可出现发热症状。 若出现不能解释的呼吸困难或心动过速,须警惕肺栓塞的可能。血管超声、静脉造影、肺CT血管造影等检查有助于诊断,其中,静脉造影是诊断的“金标准”。多普勒血管超声检查对临床怀疑CRT的诊断准确率为82%~95%,也是诊断CRT的首选方法之一。 已明确诊断为CRT的病人首选抗凝、溶栓治疗。对于有抗凝禁忌证的病人,须考虑拔除导管。不常规推荐PORT植入病人行预防性抗凝。 3.2.2.4 导管断裂或破裂 导管断裂或破裂往往是PORT临床应用过程的严重并发症,发生率为0.1%~2.1%。留置时间>40个月,存在移除难度的PORT,移除导管时导管破裂的可能性更大。 导管位置不佳常造成导管断裂,最常见于“夹闭综合征”(pinch-off syndrome),主要是由于导管经皮锁骨下静脉穿刺置管,进入第一肋骨和锁骨之间的狭小间隙时,受第一肋骨和锁骨挤压而产生狭窄或夹闭而影响输液,持续夹闭最终可致导管破损或断裂。夹闭综合征发生率约为1%,但其导致导管断裂的发生率约为40%。 其他危险因素还有:频繁大幅度活动手臂和肩部的过程中压力和角度改变、炎症或血肿、注射座与导管接口处的位置不当、快速输液的压力、不适当的导管护理。导管断裂部位包括:PORT-导管连接部、皮下隧道部位、导管插入静脉部位、静脉内部分。静脉内导管断裂病人的断裂导管会沿血流迁移至上腔静脉、右心房、右心室、下腔静脉,少数进入肺动脉。X线胸片或CT检查可以明确导管断裂部位。 血管外导管部分发生导管断裂的典型临床表现是输液后液体外渗,特别是断裂部位邻近浅表皮下区域的情况。表现为局部肿胀和波动感、皮肤红斑、局部疼痛和压痛,并出现淤斑或血肿。若未及时发现,还会导致蜂窝织炎和皮肤坏死等严重并发症。静脉内导管断裂病人,还可发生感染、肺脓肿、心律失常、上腔静脉压迫综合征、右心房穿孔,甚至猝死。大部分断裂的导管紧贴血管壁,从而使病人无任何临床不适表现,常通过X线或CT检查意外发现。 PORT置管病人出现回抽无血或输液阻力增加,须警惕导管断裂可能,必要时行影像学检查确认导管位置和连通情况。一旦发生导管断裂,不论有无临床症状,必须谨慎地完全移除PORT,并通过介入等手段取出断裂导管,以防发生进一步的严重并发症。 3.2.2.5 导管异位 又称导管移位,发生率在0.2%~1.7%之间。包括导管断裂导致导管末端移位以及导管末端进入非上腔静脉的其他血管,如颈内静脉或锁骨下静脉。 导管末端进入非上腔静脉的其他血管主要是由于导管过短,导管末端在锁骨下静脉或上腔静脉上1/3时,导管尖端移位风险增加。手臂和肩部运动,咳嗽或呕吐引起的胸内压的增加,充血性心力衰竭和强力的冲洗均可引起导管移位。移位导管可出现扭结、螺旋、环绕和卷曲。 大多数导管异位病人无症状,可表现为输注药物后注射座周围疼痛或药物推注不畅。其他常见症状如咳嗽、心悸,或注射座周围区域由于输液外渗引起肿胀。异位至颈内静脉的导管尖端可导致颈部、耳周或肩区疼痛或异常感觉。当冲洗导管时,病人可能会闻及怪声。异位导管必须采用介入技术处理,以避免血栓栓塞。通过X线胸片检查识别导管可以进行早期干预。 3.2.2.6 导管阻塞 导管阻塞是常见并发症。发生率约为0.8%~9.0%。常出现回抽无血或推注阻力大,不能输液。原因包括:注射座或蝶翼针移位;导管扭曲或打折;药物沉积于导管;纤维蛋白鞘形成;血栓形成。 病人多无不适主诉。一旦发现血液回抽困难,应行X线胸片检查或导管造影以明确导管情况。持续性导管阻塞多由于血块、CRT、肠外营养液中的沉淀物、药物、注射座释放的颗粒物质阻塞管腔所致。表现为血液回抽及液体输注均受阻。 在明确原因的情况下可采取以下措施: (1)明确专用蝶翼针是否插至注射座侧壁上,或插入过深或过浅,如回抽无血应旋转针头方向或重新插入。 (2)活动病人上肢或更换体位,因为导管末端有可能贴于血管壁。 (3)以3~5mL肝素盐水注入注射座内,保留1 h后用20 mL注射器回抽;若仍不成功,则使用纤维蛋白溶解药物(如尿激酶5000kU/L,3~5 mL封管,20 min抽回血)。 (4)药物沉积导致的导管阻塞,特别因输注两种不相容药物形成沉淀物导致导管阻塞时,可根据药物的酸碱度选择弱盐酸或碳酸氢钠中和;若为脂肪乳剂导致导管阻塞,可使用75%乙醇清除;如仍回抽无血,不应强行冲洗,若压力过大可能导致导管断裂。 以上方法仍不能奏效时,须取出PORT。 3.2.2.7 药物外渗 是指药物自PORT渗漏至周围组织,发生率为0.3%~4.7%。可能为导管原因或注射座原因。 导管原因包括: (1)纤维蛋白鞘形成包裹导管,输注液体时,液体经由鞘腔反流至静脉穿刺点处。 (2)导管破裂或断裂。 注射座原因包括: (1)专用蝶形针穿刺不到位。针头一侧贴着注射座的液态硅胶,另一侧贴在注射座边缘,导致专用针针头不能完全包裹在注射座硅胶里,而发生液体外渗。 (2)注射座穿刺隔受损,多发生在PORT使用较频繁的病人,专用针穿刺时间间隔较短。 (3)专用针两侧翼与注射座中间留有空隙,穿刺针松动,由于病人手臂、肩关节的活动及港座周围肌肉的收缩,使穿刺针在注射座穿刺隔中出现轻微摆动,从而导致针头松动。 输液时发现液体渗漏或囊袋肿胀,甚至在拔针后液体从针孔外渗,一般可明确诊断,必要时需行导管造影明确渗液点。 一旦发现药物外渗,应立即停止输液并回抽药物,尽量减少局部药物浓度,减轻药物对局部组织的刺激和侵蚀,为下一步治疗争取时间。 对于局部疼痛的病人可予局部封闭治疗,用生理盐水5 mL+地塞米松10mg+2%利多卡因10 mL在超出外渗部位0.5~1.0 cm处进行局部软组织注射,每日1次,连续3 d。还可局部外用糖皮质激素减轻炎症扩散,促进组织修复。也可应用50%硫酸镁或95%的酒精持续湿敷,配合理疗,减轻红肿等局部症状。后期如果局部组织完全坏死又难以自愈,一般须切除坏死组织,再行植皮整形手术。 4、日常维护 使用过程中加强护理和观察。 注射座穿刺应由接受过培训的护士实施,穿刺应使用专用针,且严格遵守无菌操作。 输注药物前注意观察回抽是否顺畅,输注是否有阻力,怀疑导管阻塞时须行相应检查。 非耐高压PORT要避免高压输注。 输液结束用20 mL生理盐水脉冲式冲洗PORT,因其产生的湍流可以将附于导管壁上的血液或药物冲刷干净。 规范冲洗、封管是预防导管阻塞的关键,使用100 kU/L肝素盐水3~5 mL封管可有效预防纤维蛋白鞘形成,当注射器内所剩液体为0.5~1.0 mL时,宜边推边撤离注射器,以达到正压封管目的。 每日使用PORT的病人,推荐每周更换穿刺针1次;精确浓度的肝素冲洗、封管可预防血栓形成。 对于高凝状态的病人,可考虑预防性抗凝;不使用时推荐每1个月冲洗、封管1次;平时注意保持注射座处皮肤清洁,可用肥皂水清洁皮肤后酒精消毒。 应告知病人避免肢体过度活动,因肌肉挤压血管可能导致机械性静脉炎发生;推荐定期行X线胸片检查,定位PORT位置并确认有无导管断裂。不再使用的PORT应及时取出。 第二部分 手术操作指南 实施PORT植入手术医师应有资质要求,操作医生须经过培训。 手术前应预评估穿刺部位情况,确认无手术禁忌证并签署知情同意书。 推荐经皮颈内静脉及锁骨下静脉穿刺置管,亦可选择贵要静脉、股静脉等。 推荐选择B超引导下穿刺或术前超声定位。 目前,临床常见装置有普通型、防反流型和耐高压型,可根据病人实际需要进行选择。 操作前应检查PORT、穿刺针、穿刺鞘等设备安全无误,导管和注射座用肝素盐水(250kU/100L)冲洗并排空空气。 1、 经皮颈内静脉穿刺置管 经皮颈内静脉穿刺依据操作者熟练程度可采取前、中、后入路(图1)。 1.1 中入路穿刺方法 1.1.1 体位及操作准备 平卧位,肩部垫高,头后仰使颈部充分伸展,面部略转向对侧。确定由胸锁乳突肌胸骨头、锁骨头及锁骨内1/3构成的三角,以三角顶点作为穿刺点。用标记笔标明穿刺点和注射座安放区域。消毒铺无菌巾。 1.1.2 试穿 1%利多卡因局部麻醉; 5 mL注射器试穿,进针方向与胸锁乳突肌锁骨头内侧缘平行,针尖指向同侧乳头; 针身与皮肤呈45~60?角,刺入皮肤后回抽并以负压前行; 一般刺入1.0~1.5 cm可见回血,辨识回抽为静脉血并确认穿刺方向及进针深度。 1.1.3 静脉穿刺 更换穿刺针,沿原路进针,见回血后推进0.1~0.2 cm; 置入导丝约10~15 cm,撤出穿刺针,术中X线透视显示引导丝进入上腔静脉。 注意不要过深,以防发生心律失常。 1.1.4 置入穿刺鞘 扩大穿刺点周围约0.5 cm长切口,以辅助手固定穿刺点皮肤,沿导丝置入插管鞘(包含穿刺鞘和内芯),注意向前旋转推送穿刺鞘和内芯防止穿刺鞘损伤血管。 1.1.5 置入导管 松开穿刺鞘和内芯之间的连接接口,撤出内芯,以拇指堵住穿刺鞘开口,嘱病人摒住呼吸;沿穿刺鞘送入导管至预定长度,回抽静脉血通畅,术中X线透视显示导管头端位于上腔静脉近右心房处,距离心包投影2 cm左右处;拔出穿刺鞘;撤出导丝。 1.1.6 确定囊袋 锁骨下方中外1/3处行局部麻醉,切开皮肤、皮下组织,距皮肤表面0.5~2.0cm间向下钝性分离脂肪纤维组织,形成囊袋。 注意:切口和囊袋大小依照PORT型号而定,囊袋不宜过浅,注射座植入后在切口下方1 cm为宜。 1.1.7 建立皮下隧道 自穿刺点平行向外延长1 cm切口至皮下,隧道针自囊袋至穿刺点切口最外侧点连通皮下隧道,将导管套入隧道针头并沿隧道将导管牵引至囊袋切口。 注意导管弧度,避免形成锐角或急弯影响导管通畅。 1.1.8 连接导管和注射座 导管锁套入导管,注意导管锁放射显影标记应在远离注射座的一端; 按照确定导管长度垂直导管90?修剪导管,保证断缘平滑,避免剪出斜面和毛刺; 用手将导管推送至略过导管接口的突起部位,再将导管锁推进至底端,此过程注意保持导管腔和注射座接口对接时成一条直线。 1.1.9 安放注射座 安放注射座于囊袋内,再次调整颈部及皮下隧道内导管的走行和弧度。无损伤针试穿注射座,回抽血液确认港路通畅,10 mL以上肝素盐水脉冲式冲洗,查看注射座与导管连接处有无渗漏。缝合固定注射座和周围组织。缝合囊袋切口及颈部切口,无菌敷料包扎。 如术中无X线透视设备,须在术后拍摄X线胸片了解导管头端位置。 1.2 前入路穿刺方法 于胸锁乳突肌前缘中点,甲状软骨上缘水平,触摸到颈总动脉搏动并推向内侧,离颈总动脉搏动外缘0.5 cm处进针,针身与皮面呈30~40?角,针尖指向胸锁乳突肌三角处,其余步骤同中入路穿刺。 1.3 后入路穿刺方法 在胸锁乳突肌的外缘中、下1/3交点处进针,针身保持水平位,针尖指向胸骨柄上窝。其余步骤同中入路穿刺。 2、 经皮锁骨下静脉穿刺置管 经皮锁骨下静脉穿刺置管可采用锁骨上或下入路(图2)。 2.1 锁骨上入路穿刺方法 在胸锁乳突肌锁骨头外侧缘,锁骨上方约1.0 cm处进针,针身与矢状面及锁骨各呈45?角,在冠状面呈水平或稍向前略偏15?角,针尖指向胸锁关节,一般进针1.5~2.0 cm即可进入锁骨下静脉。 2.2 锁骨下入路穿刺方法 锁骨中点下缘下方一横指偏外1 cm处为穿刺点,进针时针尖先抵向锁骨,然后回撤,再抬高针尾,紧贴近锁骨下缘负压进针。一般进针约4 cm左右可见回血,见到暗红色静脉血回流后,再轻轻推进0.1~0.2 cm,使针尖斜面向下。其余步骤同上述经皮颈内静脉穿刺置管。 3、 经皮贵要静脉穿刺置管 贵要静脉在锁骨下方汇入腋静脉,进入腋静脉处有较大角度,可能有分支与颈静脉相连,偶有导管反折进入颈静脉的情况,需要引起注意。 3.1 体位 病人平卧,手臂外展与躯干成90?角,测量导管尖端所在位置; 上臂港由于植入长度更长,植入前应测量拟定导管植入长度,导管植入长度(cm)=拟定穿刺点至同侧肩峰距离(cm)+肩峰至胸锁关节距离(cm)+胸锁关节至同侧胸骨旁第二、三肋间距离(cm)。 3.2 穿刺点位置 推荐选择超声血管定位。 由于囊袋多置于穿刺点下方,推荐在肘上两横指以上选择穿刺点,避免位置过低影响肘关节活动。 3.3 穿刺置管流程 测量上臂臂围基础值。消毒铺单,上臂扎止血带,局部浸润麻醉,穿刺针回抽血液,放低穿刺角度并松开止血带。自穿刺针处置入导丝。切开皮肤及皮下组织,沿导丝置入扩皮器,抽出导丝,置入导管。当导管进至肩部时,嘱病人头转向穿刺侧,下颌靠肩以防导管误入颈内静脉。置管成功后皮下做囊袋并连接导管。 4、注意事项 (1)避免同一部位反复穿刺。穿刺过程中,若需改变穿刺方向,须将针尖退至皮下,以免损伤血管。 (2)误穿动脉后局部应给予较长时间的压迫止血。 (3)PORT套件使用前需用肝素盐水预冲洗,排空空气;揉搓导管头端三向瓣膜开口处,以保证瓣膜功能开启;穿刺成功后应缓慢推注肝素盐水或生理盐水,以免血液在导管内凝固,阻塞管腔。 (4)缝合囊袋切口时应避免注射座位于切口正后方。 5、 日常维护 5.1 非手术期间 在非治疗期间应每4周进行1次维护。操作的医护人员应具有相应资质。 5.2 病人准备 应携带PORT病人维护手册。 5.3 操作流程 评估病人PORT处皮肤情况; 病人平卧位,暴露PORT处皮肤,头偏向对侧; 消毒铺无菌单。20 mL空注射器抽取生理盐水15 mL,连接蝶翼针预冲生理盐水并排气,非主力手拇指、食指及中指固定注射座,主力手持蝶翼针柄,针头从中点垂直刺入,有落空感停止,避免穿刺力度过大而致针尖弯曲,抽吸回血2~3 mL,证实蝶翼针位于注射座内,夹闭蝶翼针延长管处拇指夹,取下注射器,再将另一支注射器连接蝶翼针,脉冲式注入生理盐水20 mL。 再次更换注射器用5 mL肝素盐水封管,最后1 mL边推边夹闭蝶翼针延长管处拇指夹,用非主力手拇指、食指固定注射座皮肤,主力手稍用力将蝶翼针垂直拔出,小纱布按压穿刺点3~5 min; 撤去孔巾,手术敷贴遮盖;48~72 h后去除敷料。 PORT使用情况分别记录于病人维护手册及临床处置观察记录表,内容包括记录穿刺时间,有无回抽血,局部皮肤情况等,并签名。 6、 PORT的取出 6.1 适应证 (1)结束治疗或不适宜继续保留者。 (2)出现PORT周围感染,可考虑在感染控制后再行手术。 6.2 操作流程 术前查看局部皮肤情况有无感染,注射座和导管走行是否异常。 病人取平卧位,局部消毒铺无菌巾,1%利多卡因局部浸润麻醉,梭形切除原手术瘢痕,暴露PORT注射座、导管锁及部分导管; 切开包裹注射座的纤维包膜组织,向周围分离,使其完全暴露并游离注射座,将导管缓慢自静脉及皮下隧道中取出,最后一并移除整套PORT装置; 也可先切开导管锁及导管周围的纤维包膜组织,将导管自静脉及皮下隧道内取出,再游离并取出注射座。 PORT取出后,查看装置是否完整,皮下隧道开口处 “8”字缝合,静脉穿刺处压迫5 min;清除注射座周围的纤维包膜组织,严密止血,缝合皮下组织和皮肤,无菌敷料覆盖手术切口。 执笔: 刘运江,屈翔,葛智成,马力 参加编写及讨论者(依姓氏汉语拼音为序): 曹中伟,陈德滇,崔树德,段学宁,范志民,傅佩芬,葛智成,黄建,蒋宏传,金锋,姜军,康骅,凌瑞,刘克,刘锦平,刘倩,刘运江,刘荫华,刘真真,罗永辉,马力,马榕,毛大华,欧江华,屈翔,任国胜,宋爱琳,宋东,宋尔卫,唐利立,田兴松,王殊,王水,王翔,王川,王建东,吴炅,吴克瑾,辛灵,余之刚,张瑾,张建国,张景华,赵毅,赵作伟,朱炜,邹强 本文来源:中国实用外科杂志
邱纯 副主任医师 海南省人民医院 肿瘤内科1.5万人已读 - 精选 靶向治疗概述
什么是靶向治疗?科学家发现肿瘤细胞与正常细胞有一些“差异”,这些“差异”能够使肿瘤细胞存活并生长旺盛。这促使科学家们去研发针对这些“差异”的药物来杀灭肿瘤细胞,同时又不损伤正常的细胞,这样的疗法称为靶向治疗。靶向治疗是如何杀灭肿瘤的?大多数化疗药物多同时杀死肿瘤细胞和体内生长旺盛的正常细胞,这就会在治疗过程中给身体带来较大的伤害。因为靶向治疗药物主要针对与正常细胞有差异的肿瘤细胞,所以其对身体损伤比较小。肿瘤细胞在基因水平上与正常人体细胞有很多差异,这些差异使细胞比正常的的生长速度要快很多,并最终导致了肿瘤的发生。人类可以患有多种肿瘤,但同一种肿瘤的细胞也不是完全相同的。例如,结肠癌细胞和乳腺癌细胞通常生长和转移的比较快。同一结肠癌病人体内的癌细胞有不同的群体,各个群体之间的基因改变可能存在差异。靶向药物主要针对肿瘤细胞上不同于正常细胞的特异部位,这些特异部位称为靶点。肿瘤细胞上可以存在多个靶点,同时,也可以有多种药物作用于同一靶点。靶向药物主要通过以下方式杀灭肿瘤细胞:1、阻断或关闭肿瘤细胞赖以生存和繁殖的信号通路2、改变肿瘤细胞内的蛋白质,从而使肿瘤细胞死亡3、切断为肿瘤细胞提供养分的血管4、激活人体的免疫力杀灭肿瘤细胞5、将毒性物质特异性的转运到肿瘤细胞,同时避开正常的细胞一些靶向药物只能针对肿瘤细胞的一个靶点,一些靶向药物可以同时针对肿瘤细胞的多个不同的靶点。不同的靶向药物作用的精准度也是不同的,精准度高的靶向药物对正常细胞的影响较小,在实际应用过程中的副作用就会小一些。靶向治疗前您需要注意哪些问题呢?1、治疗期间您能饮酒吗?少量饮酒会使您放松和增强食欲。但需要注意的是酒精会与一些药物发生相互作用,可能减轻药效或加重药物的毒副作用。因此,治疗期间如果想饮酒或饮用含酒精的饮料,请咨询您的医生。2、靶向治疗期间能服用维生素、矿物质、植物提取物等保健品吗、这个问题没有确定的答案。一些植物提取物可能与靶向药产生相互作用,会导致药效下降或副作用增加。一些保健品是否能够增强靶向药的疗效还没有确切的答案,这方面的研究比较少。因此,如果您想在靶向治疗期间同时服用保健品,请咨询您的医生。3、您周围的人能接触靶向药吗?这方面没有成熟的规范可以遵循,但我们仍建议您尽量不要让您周围的人接触您正在服用的靶向药。当然,这并不意味着您接受靶向治疗期间不能与家人或朋友亲密接触。建议您最好不要让您的家人或朋友接触靶向药物或可能含有靶向药的体液,比如唾液、呕吐物、尿液等。4、靶向治疗会影响您的记忆力和思维能力吗?有研究显示化疗和放疗有时会影响您的记忆力、思维能力及专注力,有时这种影响会持续好几年。但靶向药是否也会有这些影响还不得而知。5、靶向治疗会影响夫妻生活吗?有些人在接受靶向治疗期间会发现自己对异性的渴望有轻度下降,而另一部分人则发现自己完全不想过夫妻生活。靶向药物可能通过以下几种方式影响您的性生活:(1)担心药物对自己外貌的影响,药物可能会使您长皮疹、体重增加或者脱发(2)恶心、腹泻以及皮肤敏感等副作用6、靶向治疗期间能怀孕吗?您可能会在靶向治疗期间怀孕,但医生多会建议您最好在治疗期间避免怀孕,这是因为一些靶向药会导致胎儿畸形。医生会建议生育期妇女在靶向治疗期间及靶向治疗结束后一段时间内采取避孕措施。建议您咨询医生应该采取哪种避孕措施。如果您在怀孕期间发现自己患了肿瘤,等婴儿出生后再接受治疗是一个可行的选择,但这需要咨询您的医生。对于需要尽早接受治疗的怀孕女性,建议您在怀孕12周以后开始接受治疗,因为这时胎儿对药物相对不敏感,产生畸形的概率较低。有时您可能需要结束妊娠,这需要咨询医生的意见。大多数靶向药物不会对育龄期妇女的生育力产生永久的破坏,但这方面的研究还不是特别充分。因此,如果您打算在不久的将来怀孕,请在接受治疗前咨询您的医生。靶向药物对男性生育能力的影响还知之甚少。因此,如果您有生育下一代的要求,请在接受治疗前咨询您的医生。靶向治疗的副作用虽然靶向药与传统化疗药的作用机制不一样,但它仍然会对人体产生一定的影响。不同的靶向药有不同的副作用。1、关于靶向药的副作用您该了解哪些方面?一种靶向药一般会有多种副作用,但一种靶向药的副作用不会全部发生在您的身上,有一些人仅会发生少数几种副作用,有一些人几乎不会发生明显的副作用。不同靶向药副作用的严重程度不同,不同的人服用靶向药后副作用的严重程度也各不相同。我们建议您接受治疗前咨询医生关于相关药物的常见副作用、副作用持续的时间、副作用的严重程度以及什么情况下需要到医院让医生处理一下您身体的不适。您的医生可能会在靶向治疗之前采取一些措施以减少副作用的发生。您在服药期间可能会出现一些罕见或严重的副反应,请及时向医生反应您身体的不适表现。治疗期间的副反应常常让您不愉快,并且一定程度上会影响您接受治疗的信心。2、靶向药的副作用会持续多长时间?通常来说,靶向治疗结束了,相关的副作用会逐渐减轻直至消失。停药后副作用持续的时间因人而异,这取决于多种因素,包括您的身体状况以及您服用的药物等。大多数靶向药物上市的时间不长,因此,很难确定每种靶向药副作用的持续时间。但可以确认的是部分副作用是终身的,比如一些靶向药物可以对心、肺、肾及生殖器官产生长期的破坏。3、靶向药的皮肤毒性许多靶向药会导致皮疹等皮肤损伤。这些皮肤问题多出现在服用靶向药几天甚至几周后。皮疹严重程度因人而异,也因药而异,若皮疹影响您的生活,请咨询您的医生。以前的观点认为皮疹的严重程度与靶向药的疗效相关,但目前认为皮疹与疗效是不相关的。您还可能会发生过敏反应,它通常发生在您服用靶向药几小时甚至几分钟以内,您可能会起荨麻疹或瘙痒难忍,同时可能伴有呼吸困难、头晕、喉咙发紧、胸闷或嘴唇、舌头肿胀。如果您在服用靶向药后发生过敏反应请立即到医院就诊。4、为什么靶向药会导致皮肤损伤?靶向药物的皮肤损伤与它们杀灭肿瘤的方式有关系。例如,有一些靶向药作用于表皮生长因子受体,而正常人体的皮肤中也有这个受体,因此这种靶向药在杀灭肿瘤细胞的同时也影响了正常皮肤细胞的生长,您就会长皮疹了。5、靶向药的皮肤损伤都有什么表现?(1)皮肤感觉异常:您可能会有让太阳暴晒的感觉,随后皮肤会发红,然后出现皮疹。即使这可能与正常人没有明显不同,但您常会感觉很困扰。这些反应通常在您服用靶向药后一周内发生。(2)对光线敏感:您的皮肤可能会对光线敏感,更容易被阳光晒伤。即使隔着玻璃,您也可能会被晒到皮肤起水泡。(3)皮疹:这是服用靶向药期间最常见的副作用,有的人可能会发生严重的皮疹,但多数情况下您的皮疹不会特别严重。皮疹多出现在您的头部、面部、颈部、胸部及背部。随着服药时间的延长,您的皮疹可能会减轻,但也有可能持续存在。皮疹多在停药一月后消失。(4)皮肤干燥:多种靶向药物均可导致皮肤干燥。几乎所有人在服药半年后均会发生皮肤干燥。严重的可能会发生皮肤皲裂。(5)皮肤瘙痒:皮疹和皮肤干燥可导致皮肤瘙痒。(6)手足综合征:确切机制不明。可能与手和足部的微小血管损伤有关,也可能与药物从血管渗漏至组织中有关。特征表现为麻木、感觉迟钝、感觉异常、麻刺感、无痛感或疼痛感,皮肤肿胀或红斑、脱屑、皲裂、硬结样水泡或严重的疼痛等。及早治疗有利于更好的控制症状,请及时咨询您的医生。(7)毛发生长异常:靶向药可能导致您脱发、头发变干、易碎,甚至弯曲。长时间服用可出现斑秃甚至全秃。胡须、眉毛和睫毛可能长的更快、更密,但也可能出现脱落。停用药物后,您的毛发多会恢复正常。(8)毛发或皮肤颜色异常:服用靶向药可能会出现毛发或皮肤变黄,个别人会出现肤色发暗。停用药物后这些改变多会恢复正常。6、皮肤损伤能够预防吗?您可以采取一些措施来预防或者减轻靶向药的皮肤损伤。您的医生可能会建议您在服用靶向药的同时采取一些预防措施,而不是等到皮肤损伤发生后再去治疗。在皮肤损伤发生前采取恰当的预防措施可将皮肤损伤的程度降到最低,以下的方法可能对您有所帮助:(1)使用不含酒精、香料以及染料的香皂、浴液以及洗发水。(2)避免淋浴,尝试使用含有燕麦的洗浴产品。(3)用温水或冷水洗澡,避免用偏烫的热水洗澡,避免蒸桑拿。(4)洗澡后使用柔和的润肤霜湿润皮肤。(5)穿宽松、柔软的衣服。(6)不要留长指甲。(7)使用洗衣液及柔软剂清洗衣物。(8)尽量避免阳光直射,如果您要外出,建议穿长袖衣服,戴帽子。如果外面光线较强,建议外出前一小时涂抹SPF30以上的防晒霜,靠近窗户的时候也需要注意防晒。(9)不要使用痤疮药,虽然靶向药的皮疹看起来和痤疮有点像,但痤疮药对皮疹是不管用的,相反有可能加重皮疹。(10)如果您的脚底疼,可以尝试使用凝胶鞋垫。(11)鞋子要合脚,可以适当宽松一点;穿厚的、软的袜子。(12)可以用一些刺激性小的化妆品,这样可以遮住皮疹,同时不会加重皮疹。7、发生了皮肤损伤后该怎么办?如果服用靶向药后出现皮肤损伤,请立即咨询您的医生。如果不去管它,皮疹可能会加重,甚至可能会发生感染,严重的可能会延迟靶向治疗,有时候您可能不得不停止靶向治疗。不要试图用非处方药治疗皮疹,也不要未经医生同意擅自停用靶向药。如果外用药不能有效控制皮疹的话,您的医生可能会建议您服用一些口服的药物。如有以下情况,请及时咨询您的医生:(1)皮肤烧灼感、发红或起皮疹。(2)皮肤变的干燥、脱皮或干裂。(3)皮肤瘙痒。(4)手指甲或脚趾甲周围皮肤疼痛或发红。(5)眼睛发干、发红或疼痛,或出现倒睫。(6)头皮疼痛。8、皮肤损伤能治好吗?如果您发生了皮肤损伤,您的医生可能需要经常观察您的皮肤变化以更好的制定治疗方案,并评估治疗效果。在症状得到控制前您可能需要多次就诊。轻度皮肤损伤:您可能不需要特殊治疗。比方说,如果您只是在局部皮肤发生皮疹,而且没有明显的不舒服,也没有感染的表现,可以自己涂抹一些不含酒精、香料及染料的润肤霜。这种情况,通常不需要调整靶向药的剂量。如果症状没有缓解,您需要咨询您的医生。中度皮肤损伤:您的皮疹范围比较大,或者伴有疼痛或瘙痒,但没有感染的表现。医生会建议您用一些外用药膏。这种情况,一般也不需要减少靶向药的剂量。但您需要更加密切的注意皮肤损伤的情况,如果有加重的趋势请及时咨询您的医生。重度皮肤损伤:皮疹影响全身多处皮肤,出现疼痛和瘙痒,并影响您的生活,比如让您失眠,甚至发生了皮肤的感染。医生可能会建议您服用口服的抗生素或激素。这种情况,医生多会建议您减少靶向药的剂量。如果皮肤损伤经过治疗后仍不能缓解,医生可能会建议您停止服用靶向药。9、靶向药还有哪些常见或严重的副作用?(1)高血压:一些靶向药,特别是那些作用于血管的靶向药,常有血压高的副作用。这通常不能预防,建议您定期监测血压,如果出现血压升高,建议咨询您的医生。如果血压升高比较明显,您的医生可能会建议您服用降压药。(2)出血或血栓:作用于血管的靶向药可能导致出血或血栓,这不是特别常见,但也没有有效的预防措施。严重的出血,像胃出血或肠道出血,可能会威胁您的生命。如果您出现吐血、吐出的东西为咖啡色或者大便带血、大便发黑发亮,请及时咨询您的医生。如果您的腿或胳膊出现肿胀、疼痛,请及时咨询您的医生。如果您出现胸痛、突然出现气短、视物模糊、癫痫或者说话不利索,请赶紧到急诊就诊。这种情况说明您的血管内很可能有了血栓。(3)伤口愈合缓慢:针对血管生成的靶向药会影响伤口和手术切口的愈合。有时会使旧的伤口或者切口裂开,新的伤口长不好。也可能会出现胃肠道穿孔。如果您在用药过程中出现腹痛或呕吐请及时咨询您的医生。因为会影响手术切口的愈合,医生通常在术前一段时间内会建议您停止使用针对血管的靶向药。如果您在应用这类靶向药期间需要做手术或一些有创性的检查,请务必告诉您的医生。10、心脏损伤:一些靶向药可能会造成心脏损伤,特别是当这些靶向药与一些化疗药同时使用时心脏损伤的发生机率会增加。医生通常会在您使用靶向药之前评估您的心脏功能。如果您出现胸痛、咳嗽增多、呼吸困难、短时间内体重下降、头晕、乏力或下肢水肿,请咨询您的医生。11、自身免疫反应:一些靶向药通过调节人体的免疫反应来发挥抗肿瘤的作用,如果您的免疫系统开始攻击您体内的正常细胞将对您的身体的某个器官造成损伤,比如肺、肠道、肝、皮肤、眼睛、神经以及内分泌等器官。这种情况不是很常见,但这种反应可能会比较严重,可能会有生命危险。12、水肿:一些靶向药会导致您面部肿胀,眼睛周围肿胀更为常见。手、脚和腿部肿胀也会发生。肿胀通常不需要特殊处理,如果肿胀比较严重,医生会建议您使用利尿药。13、靶向药的其它辅作用恶心、呕吐腹泻或便秘口腔溃疡气短或呼吸困难咳嗽乏力头痛脱发过敏反应容易感染您的医生在靶向治疗期间会密切观察您的反应,一般的副作用应该能及时发现并得到恰当的处理。如果您的身体在靶向治疗期间有什么变化,请一定及时告诉您的医生。本文系郭学光医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载。
1.1万人已读





