李耀锋医生的科普号
- 精选 胃食管结合部癌脾门清扫的标准化。
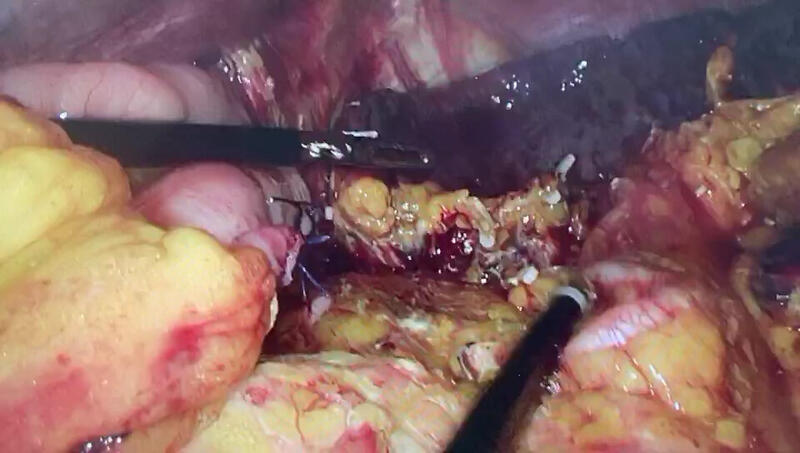 李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科621人已观看
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科621人已观看 - 精选 胃癌术后饮食指导
胃癌患者的饮食宜忌: 新鲜蔬菜,水果及含维生素A、B、E的食物,适当增加乳类、牛奶、蛋白质类事物的摄入,以利于保护胃黏膜。少吃或不吃腌菜,忌食烟熏和油炸食物。禁食霉变的食物,忌烟酒。 (1)蔗姜饮:甘蔗、生姜各适量。取甘蔗压汁半杯,生姜汁1匙和匀炖即成。每周2次,炖温后服用,具有和中健胃作用,适宜胃癌初期用。 (2)红糖煲豆腐:豆腐100克,红糖60克,清水1碗。红糖用清水冲开,加入豆腐,煮10分钟后即成。经常服食,具有和胃止血,吐血明显者可选用此食疗方治疗。 (3)陈皮红枣饮:桔子皮1块,红枣3枚。红枣去核与桔子皮共煎水即成。每日1次,此食疗方行气健脾,降逆止呕、适用于虚寒呕吐。 (4)莱菔粥:莱菔子30克,粳米适量。先将莱菔子炒熟后,与粳米共煮成粥。每日1次,早餐服食,此药方消积除胀,腹胀明显者可选用。 (5)陈皮瘦肉粥:陈皮9克,乌贼鱼骨12克,猪瘦肉50克,粳米适量。用陈皮、鱼骨与米煮粥,煮熟后去陈皮和乌贼骨,加入瘦肉片再煮,食盐少许调味食用。每日2次,早、晚餐服用,此食疗粥降逆止呕,健脾顺气,腹胀者可首选此膳。 (6)莴苣大枣饼:莴苣250克,大枣250克,面粉500克。将莴苣切碎,大枣煮熟去核,与面粉混和后做饼即成。当点心服用,健脾益胃,燥湿利水;大便稀薄或腹泻可选用。 (7)芡实六珍糕:芡实、山药、茯苓、莲肉、薏米仁、扁豆各30克,米粉500克。将上述全部加工成粉末与米粉合匀即成。每日2次或3次,每次6克,加糖调味,开水冲服,也可做糕点食用,此方健脾,止泻效果良好。 (8)桂圆花生汤:花生连红衣250克,大枣5枚,桂圆肉12克。大枣去核,与花生、桂圆一起加水煮熟即可。每日1次,养血补脾,贫血明显者可用此方。 (9)乌梅粥:乌梅20克,粳米100克,冰糖适量。先将乌梅煎取浓汁去渣,入粳米煮成粥,粥熟后加少许冰糖,再稍煮即可。每日1次,此方有收涩止血作用。 (10)麻仁粥:芝麻、桃仁各20克,粳米80克。用芝麻、桃仁和糯米共同煮粥即成。隔日1次,润肠通便,大便干燥秘结者可用此粥。 (11)芝麻粥:芝麻6克,粳米30克,蜂蜜适量。将芝麻炒香待米煮粥即将熟时加放,再加蜂蜜调匀即成。每日1次,此药膳补血润肠。 (12)鱼肚酥:鱼肚(大黄鱼、鲤鱼、黄唇鱼、鳗鱼的鳔均可作原料),芝麻油。鱼肚用芝麻油炸酥,压碎即成。每日3次,每次10克,用温开水送服。此药膳补肾益精,滋养筋脉,止血、散淤、消肿。 (13)健胃防癌茶:向日葵杆蕊或向日葵盘30克。用上述原料煎汤即成。煎汤代茶,长期饮用,有防癌,抗癌消炎之功效。胃癌术后吻合口有炎症者可选此膳。 胃癌一日食谱举例: 早餐:牛奶(鲜牛奶250克),煮鸡蛋(鸡蛋50克),蛋糕50克,大米粥(大米50克) 午餐:软米饭(大米75克),蒸肉饼(猪瘦肉50克),炒细软胡萝卜丝(胡萝卜200克) 加餐:煮果子水(水蜜桃150克),烤馒头干(面粉25克) 晚餐:汤面(肉末25克,碎油菜75克,挂面50克),花卷(面粉75克),清蒸鱼(鲤鱼100克)加餐:牛奶(鲜牛奶250克全日烹调用油10克胃癌手术后饮食 胃切除术后,使部分病人不能保持原有体重,由于创伤或不能正常进食,使体内蛋白质,脂肪等消耗,致使体重下降,还可发生一些维生素缺乏病及胃切除术后的并发症。 在胃切除术后,通常应禁食禁饮,24小时~48小时后一般情况良好,肠蠕动恢复,肛门排气,才可给予少量的温开水或葡萄糖饮料。如无不适,次日可给少量清淡流食,如米汤、菜汤、稀藕粉、淡果子水等,但不能吃蔗糖、牛奶及豆浆等,因为这些食物可产生腹胀。第四日可仍用流食,但在流食的基础上加用甜牛奶、甜豆浆等。第五日可用少渣半流食,例如可选择大米粥、碎肉蕃茄汁烩豆腐、馄饨、内末蕃茄汁或菜汁烩挂面、面包、蛋糕、牛奶、豆浆等。第九日可改用营养丰富、易于消化、无刺激性、质软一日五餐的胃病饮食。若进食后有恶心、腹胀等不适,则应减少或停止饮食。待症状消失之后,病情好转,再开始进食。 胃切除后的恢复饮食十分重要,既要弥补术前疾病的慢性消耗,又要填补手术创伤的损失。因此应在较长时间内采用胃病五次饭,保证有足够的营养、高蛋白、高维生素和维生素A、B、C含量充足的食物,以促进创伤的修复。如蛋类、乳类及其制品、瘦肉类、豆腐、豆浆等豆制品、鲜嫩的蔬菜及成熟的水果等。避免吃刺激性强和不易消化的食物,如辣椒、芹菜、酒、咖啡、浓茶和含粗纤维多的芹菜、韭菜等。 烹调方法更应注意,不要采用炸、煎、烟熏及生拌等方法,以免难于消化,采用蒸、煮、烩、炖等烹调方法。患者要待手术创伤及虚弱的身体完全康复后,再逐渐过度到正常普通饮食。由于胃切除后,容积明显减少,食物营养素的吸收受到了影响,所以每日膳食中注意适量增加维生素D含量多的食物,如动物的内脏及胡萝卜等,以防止手术后的骨软化病。另外,吃饭后不要急于下床活动,应卧床休息,不要吃高糖饮食,防止倾倒综合症。 胃切除术后,最常见的并发症是缺铁性贫血,维生素B族缺乏。有15%的患者有骨软化病,由于维生素D的缺乏,很容易使非常稀薄的骨质发生变化。在一些无明显维生素D缺乏的病人中,早期的骨组织变化可以得到纠正。这就使人们很难推断,在胃切除后所发生的骨质疏松和骨软化病是否与维生素D缺乏,钙吸收有关。但不论怎样,这些病人有明显的钙吸收障碍和维生素D的缺乏。胃切除术后的病人应注意膳食中补钙,维生素D的食物,这对骨骼钙化有利。动物性食品如蛋黄、肝脏,含视黄醇很高。一些植物性食品如黄、红色蔬菜、水果中含β-胡萝卜素,可在肝中转变为维生素A。含钙较高的食品有各种豆制品,乳制品和燕麦片、卷心菜、白菜、胡萝卜、芹菜、南瓜、萝卜、菠菜、葫芦、韭菜、蒲公英、冬瓜等。某些硬果和种子类食品含钙量也很高,如干杏仁、核桃、榛子、葵花子等。水果类有橙子等。 一些蔬菜和菠菜、苋菜、蕹菜等所含的草酸均影响钙的吸收,对含草酸高的蔬菜可先在沸水中焯一下,使部分草酸先溶于水、滤去水再炒食。注意在面粉、玉米粉、豆粉中加发酵剂,并延长发酵时间,可使植酸水解,游离钙增加,使钙容易吸收。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科3330人已读 - 精选 贲门失驰的腹腔镜helle手术治疗
贲门失弛缓症并无根治方法,治疗手段总结于表 3。治疗目的主要在于早期干预,阻止严重并发症的发生和保留食管的结构与功能。1. 药物治疗 口服钙拮抗剂和硝酸酯制剂可降低食管下括约肌的压力 47%-64%,对吞咽困难有一定治疗效果。但这些药物有一定的副作用(头疼、体位性低血压或水肿),且并不能阻断疾病的进程。所以不能作为长期治疗的手段,一般仅用于无法耐受外科和内镜治疗的患者。 5' 磷酸二酯酶抑制剂(如西地那非)也可用于治疗贲门失弛缓,降低食管 - 胃结合部的压力,减弱终末食管的收缩。西地那非可用于钙拮抗剂和硝酸酯制剂不耐受或无效的患者,但其长期疗效还不确定。 2. 肉毒杆菌毒素注射 食管下括约肌肉毒杆菌毒素注射可阻断神经末梢的乙酰胆碱释放,从而治疗贲门失弛缓。但是大多数患者在 12 个月内复发或需要再次治疗,且再次治疗后会使得未来的 Heller 肌切开术变得非常困难。因此,该治疗并不作为一线治疗手段。 3. 气囊扩张该方法即在透视下置入圆柱形球囊,穿过食管下括约肌,再使用手持压力计注气,强行扩张食管。其有效率约 62%-90%。若患者扩张后复发或效果不佳,再次扩张一般不会有效,但不会影响后续的肌切开术治疗。另外,气囊扩张发生穿孔的风险约为 0-16%,因此需要经验丰富的内镜医师操作。 4. 肌切开术 Heller 肌切开术是治疗贲门失弛缓的外科标准术式,即分离食管下括约肌的环形肌纤维。腹腔镜 Heller 肌切开术的有效率约为 88%-95%,优于气囊扩张。 5. 经口内镜下肌切开术(POEM)POEM 是治疗贲门失弛缓的最新手段。方法是在中段食管做一粘膜小切口,用前视镜、透明帽和粘膜下切开刀打通通往贲门的粘膜下隧道。POEM 的直接成功率大于 90%,但其长期效果还有待研究。 预后和随访 贲门失迟缓的预后与其分型相关:(1)Ⅱ型患者最能从肌切开术或气囊扩张治疗中获益(成功率 96%)。(2)Ⅰ型患者治疗效果稍差,成功率为 81%。(3)Ⅲ型患者预后最差(成功率 66%),可能因为肌肉痉挛较难通过从针对食管下括约肌的治疗中获益。 最优的随访策略是阶段性评估患者的症状缓解、营养状态和食管吞钡的排空时间。如果条件允许和患者能耐受,食管测压也是较好的随访手段。尽管我们不能单单因为一个异常的吞钡检查结果或测压结果而进行治疗干预,但通过这些随访结果,我们可以加强随访,从而阻止疾病进展。 贲门失弛缓患者的鳞癌发生风险明显高于普通人群,但是并没有充足依据来支持常规的内镜筛查。 贲门失弛缓并不能治愈,超过 20% 的治疗后患者会在 5 年内出现症状,需要再次治疗。对于严重食管扩张的患者以及治疗无效的患者,食管切除是最终手段。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科1334人已读 - 精选 造口疝 Lap-re-do 我的手术图片欣赏李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科5278人已读
- 精选 应该重视造瘘口疝的治疗,提高病人生活质量
手术最主要的部分是建立造口,即使造口仅有轻度功能不良,对病人的日常生活也将带来极大不便。造口旁疝形成的诱发因素与病人有关因素:如肥胖、老年、营养不良、恶性疾病、阻塞性肺部疾病、尿路阻塞疾病、应用过激素等。与手术有关因素:与造口位置的选择及造口技术有关。多数学者认为经腹直肌旁造口及经腹切口处造口最易发生造口旁疝,而经腹直肌造口可减少造口旁疝的发生。此外造口开口过大,造口位于剖腹切口处,都易诱发疝的发生。手术后因素:造口旁处感染,伴有其他腹部并发症、手术后腹胀或有腹水、放射线治疗、体重增加、早期或过早劳动等。在造口手术中,永久性结肠造口最常见,占0%~58%,其次为永久性回肠造口,占0%~28%,尿路造口最少见,仅5%~8%。Goligher等认为结肠造口者年老、肌肉虚弱易发生疝。Winkler认为在做腹壁通道时,结肠造口处开口过大,易并发结肠造口旁疝。袢状造口不太并发疝形成,较末端造口少见。疝形成与术后时间有关,如术后1年内疝发生率为36%~48%,而20年后则为36%~100%,由于袢状造口多为暂时性,且多在1年内关闭故形成疝机会少。造口位置不当易发生疝,Goligher认为造口若经剖腹手术切口拖出时易形成造口旁疝,多数学者认为造口若经腹直肌拖出,则疝形成机会较经腹直肌外侧拖出少见。Glier等报告50例结肠造口,术后平均随访4年,疝形成经腹直肌为10%,而在腹直肌外侧者为72%(28/40)。Eldrup也注意到疝的发生经腹直肌为1%,而在腹直肌外为19%。有关腹膜外结肠造口是否可减少造口旁疝,文献上有争论,但Harshaw等报告17例腹膜外结肠造口无1例发生造口旁疝,而经腹膜造口发生造口旁疝为11%(9/82)。Marks及Ritcher也有类似报告,3%(1/37):12%(22/190)。理论上认为急症手术是疝形成的危险因素,但这种假说难以证实,因这组病人死亡率高,生存者造口常已关闭。Stothert等也指出急症造口发生疝的比例高,其原因是伴有结肠梗阻,与造口的开口过大有关。虽然有很多的技术因素易形成造口旁疝,但是病人情况及术后因素也不能忽视。许多专家指出肥胖、老年、衰弱、恶性疾病、肺部疾病及应用激素有关,其中肥胖是造口旁疝最常见原因。本文作者在临床上注意到,肥胖及造口位置过低,也是造成造口旁疝的主要因素。也有学者认为术后腹部并发症特别是伤口感染及尿潴留,术后放疗、造口旁感染、腹胀或腹水都与疝形成有关。多数报告认为造口旁疝形成与随访时间有关,随访时间愈长则发生率愈高,此外造口类型不同,发生率也不同。临床上仅大的、有症状的或需手术的才引起注意,而小的,无症状者则不被人们注意。Grier等及Balslev对末端结肠造口病人做体检,随访时间大于5年,则造口旁疝发生率为58%及56%,Willian等对末端回肠造口随访,28%有疝。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科1669人已读 - 精选 造瘘口疝的治疗
造口旁疝分4型: 1、真型造口旁疝,最多见,占90%。有一腹膜囊自扩大筋膜缺损凸出,腹膜囊可在皮下或在组织间。 2、造口间疝:多合并脱垂。由于腹腔内肠袢随造口肠袢向皮下突出,筋膜有缺损并扩大。 3、皮下脱垂(假性疝):其筋膜环完整,由于造口处肠袢向外突出所致。病人站立时,皮下冗长肠袢凸出,类似疝。若需治疗,仅行局部修补,不必经剖腹治疗。 4、假性疝:极少见,由于腹壁薄弱或腹直肌外侧神经损伤所致。特点是在造口侧方有不变形弥漫突出,无卧隐立现的表现。 目前所见的造口旁疝90%是真型造口旁疝,筋膜缺损常较小,但也可以很大。小肠及大网膜常位于疝囊,但任何其他内器官都可进入。造口旁疝多见于造口处的肠系膜侧或外侧,脱垂多由于肠袢过长及缺乏固定,而疝是筋膜环过大,长期可反复脱垂可使造口处加宽而形成疝,而患者可以同时发生脱垂。临床表现 多数无明显临床症状,或仅有造口旁不明显肿胀和偶尔有漏出物,少数巨大造口旁疝可有临床症状。疝囊内容物的反复突出和回缩,交替牵拉腹壁皮肤,破坏了造口器材装置的密闭性,引起漏出和造口周围皮炎,尤其是回肠造口和尿路造口更为明显。 若造口旁疝膨隆巨大,可影响穿衣及正常生活。造口旁疝的存在可致肠功能不全,并增加护理困难,患者难以正常生活,沉重的心理负担会成为主要的症状。腹部疼痛及不适是另一个常见症状,常由于疝囊扩张牵拉腹壁和造口皮肤所致。由于造口旁疝的颈部一般比较宽大,肠绞窄的发生率较低。 造口旁疝都有明显卧隐立现的病史,诊断不难。凡佩戴造口器材有间歇性困难,灌洗不成功或有肠梗阻病史者,都应想到有隐性造口旁疝存在。造口旁疝有时诊断也极端困难,因此诊断要细致,将造口器材去掉,完全暴露造口部位,首先做好仔细的腹部触诊,在卧位或立位检查,并叫病人作深呼吸。造口部位指诊也很重要,指诊可扪到造口旁皮下肿块。在检查中要注意造口处有无瘢痕,腹部肌肉有无缺损,皮肤是否完整。 病人疑有造口旁疝但体征阴性,作CT扫描有价值,William在一组回肠造口病人中,有20%造口旁疝被CT检查发现,其中2例有症状者进行修补。手术适应证 1、凡有嵌顿、绞窄、梗阻、瘘管、穿孔及造口缺血者,为绝对手术适应证 2、原造口位置不满意,行造口移位同时修补疝 3、原造口处合并肠脱垂而致绞窄或功能不满意 4、疝的存在妨碍佩戴造口袋或灌洗 5、疝颈过小使复位困难,有急性绞窄的发生或潜在的危险 6、造口旁疝巨大,严重影响体形外观 7、相对手术适应证:病人看不清造口位置或不能护理造口评价及治疗选择 并不是所有造口旁疝都需手术修补,多数作者同意小而无症状的造口旁疝首先应采用非手术治疗。非手术疗法常采用特制腹带或弹性腹带治疗,这可减轻脱垂症状,提高生活质量。 一般造口旁疝需手术修补者仅占10%~20%。Balslev经过仔细长期随访,仅15%(9/62)需手术治疗。需手术治疗者常为回肠造口旁疝。Williams等报告69%(9/13)回肠造口旁疝需手术治疗。Flesgman报告50%回肠造口旁疝需手术治疗,回肠造口旁疝应用非手术治疗较困难,因回肠内容物为液体,同样尿路造口旁疝也常需手术治疗。手术修补 当病人应用非手术治疗无效,或有绝对的手术适应证,则需行手术治疗。术前要除外原发性肿瘤复发或炎症性肠病。复发潜在性危险因素:如肥胖、肺部或尿路功能不全,都要在术前尽可能纠正。外科医生要考虑疝的大小,造口位置及造口处有无瘢痕影响手术治疗。术前要作好肠道清洁及腔内应用抗生素治疗,其他的术前准备如同清洁手术。 修补技术有以下3种: 1、原位修补法: 原位修补法由Thorlakson首创。在造口区外侧作半圆形或L形切口,显露及复位疝囊内容物,在造口周围10cm处显示前筋膜及筋膜缺损处,用非吸收缝线封闭造口周围的缺损区,也可用原来的剖腹切口做修补。 原位修补只适合较小的旁疝,术中要暂时钳闭造口,防止污染,术中及术后要使用有效抗生素,预防感染,争取一次成功。 2、造口移位: 多数作者认为,造口移位是最可靠的修补法。但移位要经腹手术,粘连分离后再做一新的造口,并发症较高。术前应与造口治疗师一同选择好造口位置。 Delvin提出一种标准的造口移位手术,行环形切口,游离造口及封闭,若疝巨大,切口扩大并作剖腹探查,一般将原剖腹切口再打开,疝复位,完全折除造口,同时在腹内外游离,选择新造口位置。 3、假体材料修补: 在过去的10多年中发展了耐受良好的综合性网体,可成功的应用于腹股沟、腹部及切口疝的修补,这促进了疝修补事业的发展,并可避免剖腹探查而形成另一个新的造口,复发率低。因为用Marlex网作环行修补,造口处薄弱的肌层组织是有保护作用。切口有环行、半环形、L形,在造口区外侧,网置入筋膜外、腹膜外或腹腔内,肠袢自网中心或旁边拉出。 1977年Rosin及Bonardi首先报告假体局部修补,4年后Lesilie介绍筋膜外合成Marlex网修补法。 1980年Sugarbaker介绍腹膜内合成网修补法,肠袢与外侧腹壁腹膜固定。 对Marlex网是用内置法还是外置法,有人形象地将Marlex比作澡盆内的塞子,采用它由外向内堵塞孔,水压必将塞子推开;若用塞子由内向外堵,水压将把塞子牢牢地顶在澡盆壁上。正确应用Marlex网大大降低造口旁疝的复发。 凡是应用合成网修补者都应需行以下原则: (1)术中一定要用抗生素治疗; (2)所有切口应在造口区之外侧; (3)造口区尽可能在手术区之外; (4)网下筋膜缺损尽量缝合; (5)合成网应该与筋膜缝合牢固,至少距疝缺损处3cm; (6)合成网置于皮下处一定要放引流。结果 局部修补效果不好,复发率有65%。造口移位是好的方法,特别是对巨大型及复发型,长期成功率为70%。 用假体局部修补效果良好,如同造口移位,感染及其他并发症并不多见,文献报告27例,只4例有局部感染,其中只1例严重,但无1例需取出合成网。文献上认为用合成网所致的感染率可控制而不需将网取出。修补类型的选择 当造口旁疝有手术指征时,外科医生应决定采用何种手术方法,治疗方法应该个体化,局部单纯修补一般不采用,这只限用于术中偶然发现为无症状小型造口旁疝。选择局部假体修补或造口异位要看造口条件、腹部情况、患者一般情况及外科医生的意见,Goligher及移位较好。文献上有11位作者比较了三种修补造口旁疝的结果:局部修补成功率为34%(11/32);造口移位成功率为69%(25/36),用假体修补成功率为95%(22/23),以上说明用假体修补成功率最高。 若造口位置不好,则最好用移位治疗,若疝在造口周围,未经腹直肌,则最好用移位治疗,若造口病人看不见造口部位,且肥胖,也采用造口移位治疗。术后治疗及并发症 术后3个月不能作体力劳动,其他同新造口一样,早期或轻度旁疝,可用合适的腹带保护压迫膨出部位以防止其复发。 严重的术后并发症除复发外一般不常见,血清肿是最常见的并发症,差不多所有的病人中都有不同程度的血清肿,有症状者有时需作穿刺治疗,但绝对要防止污染。应用假体组织者要避免作穿刺。感染性伤口并发症不常见,若有也很轻。文献上报告,应用Marlex网者,局部感染<15%,严重者<5%。单纯修补的复发率约70%。应用假体及移位者,复发率为5%~35%。预防 无可否认,造口旁疝是造口者的一个常见问题,这可致严重并发症,修补有时较困难,且易复发。如同其他的外科并发症,预防最重要,Goligher认为这类并发症很难预防,但是要牢记一些外科原则,如疝的危险因素、术前造口定位很重要,最好与造口治疗师共同选择造口位置,造口技术要很细心,选择手术切口也很重要,有人主张若正中切口,这可远离造口部位减少感染。造口经腹直肌处比在外侧为好,有人主张经脐部造口,这可降低疝形成机会。腹壁通道不能过大,只需通过肠袢就足够。 Bayer等建议用环形合成网置于造口周围预防疝,他报告43例,随防4年,无1例发生疝,仅7例发生并发症但与Marlex网有关。是否值得常规应用,还需要长期随访资料,但对高度危险的病人可以试用以预防疝发生。Goligher主张用腹膜外结肠造口以预防造口旁疝,这在理论上是有好处,但是技术较困难,对灌洗亦不方便,因此有人不同意用腹膜外结肠造口。小结 外科医生一定要记住,对造口长期生存者,手术最主要的部分是建立造口,即使造口仅有轻度功能不良,对病人的日常生活也将带来极大不便。建议造口一定要很仔细,要在高年资有经验的医生指导下进行,绝不能掉以轻心。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科4949人已读 - 精选 胃瘫的治疗
概述 胃瘫(gastroparesis)是腹部手术,尤其是胃癌根治术和胰十二指肠切除术后常见并发症之一,是指腹部手术后继发的非机械性梗阻因素引起的以胃排空障碍为主要征象的胃动力紊乱综合征,胃瘫一旦发生,常持续数周甚至更长时间,目前尚缺乏有效治疗方法。术后残胃和远端空肠正常的运动功能破坏是发生功能性排空障碍的主要原因。消化道造影和胃镜检查是诊断本病及与机械性梗阻鉴别的重要方法。采取非手术治疗一般均可治愈,针对胃排空动力学机制的改变采用促胃肠动力药物可能收到较好的疗效。胃瘫的临床重要性在于有时会被误诊为吻合口或输出袢的机械性梗阻而采取再手术治疗,因此,正确地诊断和治疗胃瘫,对避免盲目再手术,减轻病人痛苦具有重要意义。[编辑本段]1 临床特征: 病人多于术后数日内停止胃肠减压、进食流质或由流质饮食改为半流质饮食后出现上腹饱胀不适、恶心、呕吐及顽固性呃逆等症状,一般疼痛不明显,食后吐出大量胃内容物,可含有或不含有胆汁,吐后症状暂时缓解,胃肠减压抽出大量液体,每日1000-3000ml。胃瘫发生时,小肠及结肠动力功能一般不受影响,故患者可正常肛门排气、排便,体检发现胃振水音。胃镜检查及胃肠道碘油造影可排除流出道机械性梗阻,核素标记液体胃排空试验提示胃排空延迟。发病率:国内报道0.47-3.6% , 国外报道5%-24% 。[编辑本段]2 发病机制: 胃的正常运动功能包括容纳食物,调节胃内压,推进、搅拌、研磨食物等,其动力是由胃壁肌肉的收缩和括约肌的协调启闭完成。其功能除与进食等情况有关外,主要受神经及体液的调整。 本病发病机制尚未完全明确,可能的原因有多种,如术中麻醉药物的直接抑制作用,精神紧张,吻合口水肿,输出袢痉挛、水肿,长期应用抑制胃肠道运动药物,水、电解质与营养失调,饮食改变或术后早期进食不当,食物中脂肪含量过高,及变态反应,大网膜与吻合口周围团块状粘连,炎性肿块压迫等因素,术后整个消化道内环境改变、紊乱导致的空肠麻痹或痉挛为常见原因。 2.1 由于胃大部手术切除了远端胃、幽门,胃的完整性受到破坏,整个消化道内环境改变、紊乱,导致胃蠕动节律失常、胃动过速,产生逆行蠕动波,减弱了残胃的收缩, 丧失了对食糜的研磨功能。术后残胃和远端空肠的正常运动功能受到影响,空肠麻痹或痉挛使食糜传递阻力增加,干扰了残胃及小肠对内容物的清扫运动,致使胃排空失调。胃镜检查见胃内粘膜及吻合口水肿对胃排空也有影响,但胃镜可顺利通过证明吻合口水肿并非造成胃瘫的主要原因。 2.2 手术本身可通过多种途径激活抑制性交感神经反射系统,使胃肠交感神经活动增强。激活的交感神经纤维不仅可通过抑制胃肠神经丛的兴奋神经元抑制胃动力,还可以通过交感神经末梢释放的儿茶酚胺直接与胃平滑肌细胞膜上的α和β受体结合抑制平滑肌细胞收缩。近年研究表明迷走神经的损伤导致残胃运动减弱,影响术后胃张力的恢复,降低胃的储存和机械性消化食物的能力。 2.3 胃肠道激素分泌紊乱导致胃排空延迟亦是可能的原因。胃远端切除和胃空肠吻合术后胆汁返流造成胃酸、胃肠道激素、消化酶分泌与粘膜损伤等变化干扰胃的正常功能,加重了吻合口和残胃粘膜炎症和水肿。Coimbra CR研究发现IL-1β在术后胃排空障碍的发生中起着重要作用,但仍有待深入进行。 2.4 术前营养不良病人胃瘫发生率比较高,营养较差,如贫血、低蛋白血症,术后胃壁及吻合口水肿较多见。糖尿病是引起胃瘫的基础疾病之一,这主要是糖尿病可致供应内脏的植物神经病变及自主神经病变,使胃张力减退、运动减弱。 2.5 术前有胃流出道梗阻者较之无梗阻者胃瘫发生率高。胃大部切除术后B-Ⅱ式吻合较B-Ⅰ式胃瘫发生率高,这可能是B-Ⅰ式吻合更符合生理状态,胃肠运动更协调,另外端端吻合较端侧吻合更快地使胃肠动力恢复正常也是因素之一。Divita的研究表明在行胃肠吻合数年后,B-Ⅱ式吻合病人的胃蠕动呈痉挛而不协调,而B-Ⅰ式吻合的病人胃蠕动则协调有效。 2.6 术后腹腔感染、胆汁返流、吻合口水肿或残胃炎等加重了胃瘫的临床表现并延缓了排空时间,患者对手术恐惧及焦虑状态亦对胃瘫的发生有一定的影响。[编辑本段]3 诊断标准: 目前尚无通用的诊断标准,根据文献综合如下:(1)术后7天仍需行胃肠减压,或者终止胃肠减压进食流质饮食或由流质饮食改为半流质饮食后再次出现胃储留症状而需行胃肠减压者。(2)胃引流量>800ml/d,持续时间超过5天。(3)经一项或多项检查提示无胃流出道机械性梗阻征象。(4)无明确水、电解质酸碱失衡。(5)无引起胃排空障碍的基础疾病,如糖尿病、胰腺炎、结缔组织疾病等。(6)未应用影响平滑肌收缩的药物,如654-2、阿托品等 Yeo CJ]等提出的标准为胃管置放>10天,并具备下列1项:a.移除胃管后呕吐;b.术后第10天仍需使用胃动力药;c.重新置入胃管;d.不能恢复进食或由流食改进固体食物时障碍;或胃管置放少于10天但具备a-d中的2项。[编辑本段]4 诊断: 根治性胃大部切除术后胃瘫病人常有持续性上腹饱胀、嗳气、反酸及呕吐症状,或于术后数日拔除胃管进食流质或由流质改为半流质后逐渐出现上腹部胀痛不适,随之发生呕吐大量胃内容物,可伴有顽固性呃逆,胃肠减压抽出大量胃液,体格检查可见病人上腹部胀满、压痛,有胃振动水音,中下腹平软无压痛,无肠鸣亢进及气过水声,均应考虑存在胃瘫可能。首先要排除机械性梗阻因素,X线检查是一种临床上广泛应用的方法,口服或胃管内注入30%泛影葡胺, X线下动态观察胃蠕动及排空情况。胃瘫病人表现为残胃扩张、胃蠕动减弱或无蠕动,造影剂呈线状或漏斗状通过吻合口,但胃内造影剂残留多,有明显排空减缓征象,动态观察24小时可见远端空肠显影。术后10 天以后可行胃镜检查,可见残胃内大量潴留,残胃粘膜及吻合口水肿,残胃蠕动差,但胃镜可顺利通过吻合口进入输出袢,经胃镜检查可排除胃流出道机械性梗阻,对胃术后胃瘫诊断的确立有重要意义。 核素99mTc标记餐胃排空测定也能发现病人排空延缓,简便、无创、可定量。因此,被认为是测定胃排空最佳方法。不仅适用于全胃排空的测定,也同样适用于胃术后残胃排空的测定。有人报道应用盐水负荷试验,非吸收性色素液排空试验,扑热息痛吸收试验,及胃内压描记检查也有一定意义,但因其临床应用有较大局限性而未广泛开展。由于胃的运动受胃电控制,也可进行胃电图检查。目前使用的胃电图受到呼吸及心电的干扰太多,故其诊断价值难以确定。[编辑本段]5 预防与治疗: 西方学者多主张采用胃造口并附加空肠造瘘术来预防胃瘫的发生,有报道指出,胃肠吻合口大小对残胃排空有一定影响,吻合口较大,则残胃排空固体食物增快,故避免吻合口过小,可适当防止胃瘫发生。Brodsky等提出单层连续缝合法行胃肠吻合,术后胃瘫发病率明显降低。国内有人主张术前将硅胶鼻饲管和鼻胃管系在一起置入胃腔,术中将硅胶鼻饲管经吻合口置入十二指肠水平部(食管胃吻合)或距吻合口30-40cm的空肠上段(胃空肠吻合),术后6-12小时开始从硅胶管滴入中药煎剂,有一定的预防效果。 本病属功能性病变而非机械性梗阻,一经确诊主要应采用非手术治疗。 5.1 严格禁食、禁水,持续胃肠减压,一旦胃瘫诊断明确,胃管不要轻易拔除,最好于症状缓解确定无疑后再拔除,否则可能延长恢复时间。高渗温盐水或普鲁卡因洗胃,可减轻吻合口水肿。 5.2 补液,维持水、电解质及酸碱平衡。 5.3 给予PN或TPN,补充足够的热量、蛋白质、维生素及微量元素,纠正负氮平衡,酌情输全血、血浆或白蛋白。Casaubon PR 认为静脉输注葡萄糖、氨基酸、脂肪乳剂可明显抑制胃肠动力。其机制可能与抑制迷走神经兴奋、刺激胆囊收缩素(CCK)分泌有关。另外,肠内营养支持不失为一种治疗胃瘫有效手段,术前与胃管一起将鼻饲管插入胃中,术中将此管插入吻合口远端约20cm处,或术后胃镜检查时在胃镜帮助下将鼻饲管插入流出道15-20cm,用于输注营养液,可促进残胃功能恢复,改善机体营养状态。 5.4 胃肠动力药物的应用 5.4.1 甲氧氯普胺为多巴胺-2受体(DAR2)拮抗剂,作用于平滑肌可促进胃排空,可以减少胃酸返流。一般用量为10-20mg,每6-8小时1次,肌注或经胃管内注入。 5.4.2 多潘立酮为选择性周围性DAR2拮抗剂,通过阻断外周靶器官的DAR2发挥其促胃动力作用,增强胃蠕动,协调胃肠运动促进胃排空,减少食物运动时间。 一般剂量10-20mg,每6-8小时1次。 5.4.3 西沙必利为5-羟色胺4(5-HT4)受体激动剂,作用于肠肌间神经丛节前运动神经元的5-HT4受体,促进胆碱能神经纤维释放乙酰胆碱,促进平滑肌强烈收缩,加快胃排空和协调胃肠运动,对治疗胃瘫有较好效果。多用5-10mg,每6-8小时1次。 5.4.4 红霉素为大环内酯类抗生素,已于临床应用数十年,Petrakis J报道将其作为促进胃肠动力的药物,发现其具有胃动素相似的作用,但无刺激胃分泌的作用,能引起MMCⅢ相强烈收缩,促进胃排空,可明显减轻胃潴留。 5.4.5 新斯的明为拟副交感神经药物,有明显促进胃蠕动作用。常用剂量为0.5-1.0mg,肌注,每日2次。 5.4.6 Vaezi MF ,Tomita R报道称启动因子Cisapride可保持残胃张力,改善固体食物排空,减轻餐后腹部胀满感,剂量为15 mg/天 。 5.5 静滴氢化考的松或地塞米松,减轻吻合口水肿。 5.6 胃镜治疗,胃镜不仅对胃瘫诊断有帮助,同时对胃壁也是一种适度刺激,有些病人经胃镜检查后病情很快好转,可能为胃瘫发生机制中主要因为吻合口附近局限性肠麻痹或空肠输出袢痉挛所致,通过胃镜向输出袢注气刺激了空肠蠕动功能的恢复而使病情好转。此外,还可通过胃镜将营养管置入远端空肠行肠道营养支持。因此,胃镜不仅是检查方法,同时也是一种有效的治疗措施。因病例数尚少,还需更大宗的病例数加以证实。 5.7 有尿病及低蛋白血症病人应同时给予治疗纠正,Takahiko等认为血糖≥10mmol/L时,可导致胃电节律失常及胃内压降低,使胃排空延迟,因此,应监测并控制血糖平稳。 5.8 中药治疗,可于胃管或鼻饲管中注入中药煎剂以促进胃肠蠕动的恢复。 5.9 心理安慰,鼓励患者配合治疗,由于患者恶心、呕吐明显,时有顽固性呃逆,长期不能进食,需大量补液,多有焦虑、害怕、消极悲观情绪,应耐心向患者解释,消除其紧张心情和恐惧心理。另外,施术者本身对手术应充满信心,能耐心坚持等待一段时间,这为保守治疗提供前提条件。 5.10 手术治疗,关于再次手术,一般情况下一旦诊断明确,应坚持积极的非手术治疗,多数病人在3-5周内恢复,再次外科手术需谨慎。因为胃切除术后残胃排空延迟只是功能性的,本身并无器质性病变,过早手术探查往往不能发现梗阻因素,反而使病人受到不必要的损伤,增加术后并发症和病死率,加重无张力残胃的排空障碍,延长病程时间。只有上述内科治疗均无明显效果,在诊断上不能完全除外机械性梗阻因素者,才考虑再次手术探查。如决定手术治疗,通常采取全胃切除术。[编辑本段]6 预后 : 胃瘫患者多于3-5周内恢复,亦有报道70余天恢复。 患者胃动力的恢复常常突然发生,于1-2天内胃引流量明显减少,腹胀、恶心等症状很快缓解,即可拔除胃管,逐渐恢复饮食。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科7474人已读 - 精选 腹壁硬纤维瘤治疗进展
硬纤维瘤(desmoid tumor,DT)在临床上是一种少见的肿瘤,占软组织肿瘤的0.03%,由Muller于1838年首次命名。按其生长部位,可分为腹壁和腹壁外二类,后者由Nichols(1923年)首先报道。腹壁外DT比腹壁DT少见。 硬纤维瘤患者女性多见,尤其是腹壁DT,且多发生于育龄期女性。因而一般认为硬纤维瘤的发生与内分泌激素有关,已有实验证实雌激素诱发动物纤维瘤形成。遗传因素亦被证实与本病关系密切,在家族性腺瘤性息肉病中其发生率可高达8%~38%,较一般人群高852倍。据报道创伤与本病发生相关。 硬纤维瘤临床表现为一生长缓慢的实性肿瘤,症状表现与肿瘤所在部位有关。肿瘤较小时多无症状,肿瘤增大压迫邻近组织器官时,可伴疼痛,麻木不适,甚至引起器官功能障碍。临床查体和影像检查(B超、CT和核磁)对诊断有参考价值,但其主要作用在于了解肿瘤位置及与邻近组织器官的关系,为治疗提供帮助。主要依靠病理检查明确诊断,其组织学表现为成纤维细胞和成肌纤维细胞交织成束,成纤维细胞常侵犯邻近正常结构,周围有大量胶原基质,其中细胞数量较多。与恶性纤维肉瘤相区别在于缺乏恶性肿瘤的核和细胞浆表现,尤其不存在核分裂相。硬纤维瘤一般不发生转移,但反复复发行手术可能导致肿瘤转移。本病呈侵袭性生长,临床表现易复发,复发率高达25%~40%。故一般认为本病是一种低度恶性肿瘤。治疗以外科手术为主,由于本病具有侵袭性生长和易于复发的临床病理特点,应尽量行扩大切除术,但切除的范围和切缘组织学检查的意义仍有争论。一般切缘至少距肿瘤2~3cm以上,切下标本后应肉眼观察切缘是否为正常组织,如发现白色质硬组织,说明切缘未净,应扩大切除范围;如无法确定,应作冰冻病理检查,应重视对手术切缘的检查。文献报告切缘经病理检查无肿瘤者复发率仅为4%。对于因扩大手术而造成的组织缺损,可采用替代材料和皮肌瓣修复等方式。如腹膜缺损可用阔筋膜、尼龙、绦纶布、聚丙烯等替代。对于肿瘤较大或多次复发无法手术根治,放疗曾被认为是有效的。也有人认为辅助放疗可获得较好的局部控制率。如Kiel认为在病变广泛,手术不能根治,以及有小的边缘复发,放疗效果较为理想,他报道25例放射治疗,76%部分或完全缓解,59%痊愈。放疗剂量一般为50~60Gy。但也有很多报道未能支持放疗的有效性。药物治疗对本病有效,目前报道应用于本病的药物有阿霉素、放线菌素D和长春新碱,另一类治疗药物是环腺苷?磷酸盐(CAMP)调节剂,非甾类抗炎药物(NSAID)和抗内分泌制剂。由于本病的发生与雌激素关系密切,国外有报道使用三苯氧胺治疗本病有一定疗效
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科3022人已读 - 精选 胃间质瘤的治疗进展(转载)
来自美国的 Valsangkar 教授等总结了近十年胃肠道间质瘤(GIST)在手术、生物标记物、基因突变和治疗方面的进展,该综述发表在 Surgery 上。胃肠道间质瘤产生于卡哈尔间(Cajal)质细胞或共同的前体细胞,两者均表达 III 型酪氨酸激酶受体。酪氨酸激酶受体 c-KIT(CD117)或相关的酪氨酸激酶受体的突变导致细胞生长失控和间质瘤形成。胃肠道间质瘤属于非上皮、间叶细胞肿瘤。是最常见的腹部软组织恶性肿瘤。发病率和病理分型在美国,胃肠道间质瘤年发病率估计在每百万 3~7 人之间。欧洲、韩国和香港报道的更高些,为每百万 15~20 人。由于发病率数据是从肿瘤登记的大数据中提取的,而其中不记录良性肿瘤,通常假设胃肠道间质瘤的真实发病率可能更高。胃肠道间质瘤诊断的新发病例自 1998 年以后成倍增加。这是由于其可靠的生物标志物 c-KIT 和血小板源性生长因子受体 α 多肽的发现。回顾监测、流行病学与最终结果(SEER)的数据揭示了间叶细胞肿瘤中被归类为胃肠道间质瘤的比例正逐步增加。胃肠道间质瘤最常见于胃(50%~60%)、其次是小肠(30%~35%)、结肠和直肠(5%)、食道(<1%),以及少部分消化道外(肠系膜,大网膜和腹膜后;<5%)。平均诊断年龄为 63 岁。未满 20 岁的患者不到 1%。家族性症状如 Carney 三联征、家族性胃肠道间质瘤症状或胃肠道间质瘤相关的神经纤维瘤病类型,通常在 20 岁以内发现肿瘤。尽管间叶细胞肿瘤罕见,有明确分子特性定义的间叶细胞肿瘤类型不断增加。通常被分为胃肠道间质瘤、平滑肌瘤(良性平滑肌瘤或恶性平滑肌肉瘤)和神经鞘瘤。间叶细胞肿瘤的分类涉及消化道和周围软组织,现在还包括胃肠道间质瘤、炎性纤维性息肉、硬纤维瘤、滑膜肉瘤、炎性肌纤维母细胞瘤和透明细胞肉瘤。然而,胃肠道间质瘤仍然是影响消化道的最常见的间叶细胞肿瘤。胃肠道间质瘤为 c-KIT 和 PDGFRA 相关的间叶细胞肿瘤。胃肠道间质瘤临床表现、诊断和影像在很多患者中,胃肠道间质瘤的早期表现可以是非特异性的,如模糊的腹部不适和腹胀。高达 25% 的病人是行影像学检查时偶然发现的,如肾绞痛或损伤。症状与肿瘤大小相关。由于胃肠道间质瘤发生于粘膜下且不表现出局部浸润,其与粘膜层肿瘤相比在引起出血或梗阻症状前能长得更大。文献报道的平均直径在 10~13 cm,且大于 5 cm 的胃肠道间质瘤更可能引起症状。胃肠道间质瘤最常表现出的症状是消化道出血,腹部疼痛或类似于溃疡的症状。消化道出血的程度可以从隐性慢性出血导致的贫血到危及生命的黑便或呕血。有时胃肠道间质瘤也可表现为可扪及的肿块、肠梗阻或少数因巨大肿瘤腹腔内游离破裂的急性腹腔积血。1. 关于大小和症状近期有报导发现一类小胃肠道间质瘤。这些定义为直径小于 1 cm 的肿瘤首先在日本被报导,在高达 35% 的中老年尸检中被附带发现。这些微小肿瘤与临床发现的胃肠道间质瘤有同样的 KIT 或 PDGFRA 突变。由于其发病率更高,微小间质瘤被认为是胃肠道间质瘤的前体病变。然而,目前分子改变或二次打击是否导致肿瘤变大、恶性程度升高仍是未知的。现在微小胃肠道间质瘤是否需要影像学随访或预防性切除的标准仍有待确定。2. 肿瘤部位肿瘤解剖部位也与肿瘤病理学和预后变化相关。食管和胃间质瘤与小肠间质瘤相比,在被发现时大小通常较小且平均有丝分裂数更小。他们通常也有更好的总生存率。然而,小肠间质瘤也许对伊马替尼反应更好。大多数胃肠道间质瘤在腹腔内。先前的研究证明,在发现时,有 50% 的患者已经有转移。肝脏是最常见的转移部位,但很少侵犯区域淋巴结或腹腔外器官。切除标本的病理淋巴结受累通常被认为是种植性转移而不是真的淋巴结播散。行切除手术的原发性胃肠道间质瘤患者总复发风险约为 30%。无复发生存率在 R0 和 R1 切除间无差异。中位复发时间为 12~16 个月。80% 的复发出现在术后两年内。然而,术中肿瘤破裂或腹腔内出血显著降低了无瘤生存时间。3. 影像学诊断效果诊断的主要形式通常是 CT,磁共振也可以使用。胃肠道间质瘤于粘膜下层内生性生长,使其与其他上皮性肿瘤相比,在影像学上更难分辨大小和程度。如前所述,胃肠道间质瘤可被高分辨率三期 CT 视为常发生于胃或小肠的富血供、不规则的异型性肿块。同其他前肠肿瘤一样,三期 CT(口服和静脉造影,动脉和静脉期)可以更好的了解这些肿瘤血管的性质和程度。由于大部分转移在腹腔内,腹部 CT 扫描足以捕捉大部分的转移性病灶。由于在粘膜下生长,直视下上消化道内镜具有挑战性且无法准确定位活检标本。造影后,如果高度怀疑是间叶细胞肿瘤且可以切除,术前活检很大程度上是不必要的。然而,在明显转移的病例或手术切除边缘,组织活检是定位特定突变和系统分子治疗的关键。在许多医疗中心,超声内镜活检比经皮 CT 引导活检更多。对于组织活检,也可以考虑腹腔镜检查。获得的组织可以用于免疫组化和有丝分裂计数分析。细针穿刺也可以用于细胞学和组织学检查。后续免疫组化染色可用 KIT、PDGFRA、CDKN2A、PI3K 和 DOG1 标记。4. 影像学检查用于疗效评定用于评估胃肠道间质瘤分期和疗效的最常用的两种影像学检查为对比增强 CT 和正电子发射断层扫描(PET)。PET 可用于最初的评估和疾病进展趋势分析。标准化摄取值(SUV)和最大 SUV 使 PET 扫描能够定量肿瘤随时间代谢的趋势,而且可以同时比较同一肿瘤两个不同部位。胃肠道间质瘤对伊马替尼的反应最早可以在治疗 1 周后在 PET 扫描上看到。由于代谢反应先于解剖反应。具体而言,PET 扫描可以先于常规三期 CT 腹部和盆腔扫描几个月发现系统性分子治疗的反应。以往研究显示转移性胃肠道间质瘤经伊马替尼治疗后代谢减少超过 25%。另外,肿瘤表现出最大 SUV 减小 25% 以内被认为是有局部代谢改变。PET 扫描可以补充 CT 扫描模糊之处。例如,肝转移灶在 CT 扫描呈现等密度而在疾病评估时被遗漏,PET 扫描则能看到。虽然 PET 在这方面的作用仍然是前瞻性检验,它在提供肿瘤功能相关信息方面也有帮助。另一种 PET 扫描可能有帮助的情况是在新辅助化疗中对早期反应的评估(通过代谢活动降低证明),可能会改行手术而不是继续系统性分子治疗。酪氨酸激酶受体突变和胃肠道间质瘤发病机理胃肠道间质瘤发病机理主要为两个突变:KIT 基因(及其相关酪氨酸激酶 KIT 受体的过表达)和 PDGFRA 基因。胃肠道间质瘤患者有 80-85% 表现为 KIT 或 PDGFRA 突变阳性。后者是跨膜酪氨酸激酶受体,被认为传导下游多种信号通路包括 PI3K/AKT/mTOR 和 MAPK/STAT3 最终导致细胞增殖、血管生成和抗凋亡。所有这些途径被认为在胃肠道间质瘤发生发展中起关键作用。值得注意的是,KIT 和 PDGFRA 的突变是相互独立的,患者不会同时阳性。C-KIT 突变通常发现于外显子 9、11、13 或 17。胃肠道间质瘤的细胞形态包括纺锤形为主(70%)和上皮样外观(20%)。KIT 阳性的胃肠道间质瘤通常表现为梭型细胞形态,而 KIT 阴性的胃肠道间质瘤有 PDGFRA 突变可以是上皮样或混合型。家族性胃肠道间质瘤最常见的是 c-KIT 外显子 11 突变。基因芯片分析得到了更多的胃肠道间质瘤标记,最显著的是 DOG1、FLJ10261 基因,其广泛表达于所有突变类型的胃肠道间质瘤中。在免疫细胞化学中,DOG1 与钙离子门控蛋白 anoctinin-1 的表达有关。其在 97% 的胃肠道间质瘤中为阳性,与 c-KIT 一起在检测胃肠道间质瘤的敏感性可达 100%。DOG1 突变的意义和临床应用包括:DOG1 抗体比 KIT 抗体更敏感,尤其是在检测胃间质瘤和 PDGFRA 突变的间质瘤。DOG1 免疫反应未见于其他间叶细胞肿瘤,使其对胃肠道间质瘤高度特异。这些数据使得许多医疗中心将 DOG1 作为诊断胃肠道间质瘤的关键生物标志物。在广泛使用 DOG1 作为诊断前应确定其在其他肉瘤中的免疫反应。胃肠道间质瘤的治疗1. 局限性病灶手术切除在发现 c-KIT 和 PDGFRA 突变以前,手术切除是唯一可能治愈胃肠道间质瘤的方式。不到一半的患者因转移灶的存在,仅行原发灶切除。回顾分析 200 例手术切除病例,DeMatteo 等大仙 46% 的患者仅有原发病灶,47% 有转移,7% 表现为局部复发。仅有 33% 病人行 R0 切除。当原发肿瘤被切除后,肿瘤大小是一个影响预后的因素。此外,对于原发灶行 R0 切除的无转移病人,局部复发率为 35%,复发转到肝的有 44%,总体而言,5 年生存率仅为 54%。2. 过去腹腔镜手术治疗胃间质瘤仅行楔形切除这项技术从肿瘤学角度是安全可行的。更先进的腹腔镜技术一直在发展。近期一项研究比较了 78 例病人行腹腔镜胃楔形切除,胃大部切除术和腹腔镜内镜联合手术(LECS)。在双镜联合手术中,内镜用于剥离胃腔内肿瘤粘膜。在此研究中,所有术式均行肿瘤充分切除,对于小于 5 cm 的胃间质瘤行腹腔镜楔形切除是安全有效的。3. 酪氨酸激酶抑制剂用于治疗胃肠道间质瘤在伊马替尼问世之前,人们认为胃肠道间质瘤是耐药的,因为非靶向的传统化疗药物是无效的。1999 年首次报导胃肠道间质瘤表达 KIT 之后情况有所改变。此后不久,诺华公司推出了甲磺酸伊马替尼用于治疗慢性骨髓性白血病。伊马替尼能够抑制慢性骨髓性白血病发病过程中 Bcr-Abl 激酶。由于 KIT 和 Bcr-Abl 信号之间的相似性而有了伊马替尼用于胃肠道间质瘤晚期病人的 1 期临床试验并产生了效果。4. 伊马替尼用于治疗转移性胃肠道间质瘤伊马替尼已经在小型 1 期 2 期临床试验和至少两个多中心前瞻性随机对照 3 期试验中被证明对转移性胃肠道间质瘤有效。需要注意的是,伊马替尼是细胞色素 P450 系统抑制剂。因此,伊马替尼能和许多药物相互作用,包括华法林。此外,有些药物可能影响伊马替尼的代谢,可能导致临床效果降低。这类药物包括苯妥英钠、利福平和金丝桃草。治疗要点总结1.肿瘤大体切缘阴性(无论 R0/R1)的胃肠道间质瘤患者最有机会长期生存。2.腹腔镜切除术和腹腔镜内镜联合手术并发症发生率与开腹手术相当。3.转移性胃肠道间质瘤。a. 一线治疗药为伊马替尼 400 或 800 毫克每天;b.KIT 外显子 9 突变阳性患者可用伊马替尼起始剂量 800 毫克每天;c. 用药中断会导致生存期减少,伊马替尼应持续应用至疾病进展或手术切除。4.胃肠道间质瘤辅助化疗a. 胃肠道间质瘤患者行 R0 或 R1 切除后应用伊马替尼能提高生存时间;b. 突变分析显示外显子 11 缺失的患者预后最好。5.胃肠道间质瘤耐药a. 二线治疗药:舒尼替尼,一种多靶点的酪氨酸激酶抑制剂,在野生型胃肠道间质瘤及 KIT 外显子 9 突变病人中预后最好;b. 三线治疗药:瑞格菲尼 160 毫克每天用于二线治疗药如舒尼替尼治疗肿瘤进展的患者。6.新辅助治疗用于有切除可能的胃肠道间质瘤a. 术前应用伊马替尼 8-10 周能增加手术切除可能性及长期生存时间。胃肠道间质瘤的分子鉴别显著提高了诊断的准确性。虽然手术治疗是目前唯一潜在的治愈方法,在过去十年中,持续应用伊马替尼和舒尼替尼已显著降低本病死亡率并延长患者生存期。转移灶的完整切除也提高了长期生存的可能性。突变表型鉴定持续提高胃肠道间质瘤患者预后。同时,更加深入的大型前瞻性随机试验也在开展,以确定这种疾病更好的个体化治疗方法。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科3758人已读 - 精选 结肠息肉的治疗(转载)
由于息肉的性质难从肉眼判断,故一般发现后应手术摘除或切取作病理学诊断,由于所在部位息肉或腺瘤大小、个数、有蒂或无蒂及息肉性质不同而选择不同治疗方案。手术方法有蒂单个作内腔镜下圈套、电灼(凝)或结扎摘除。对体积较大者,不易行圈套切除或切开摘除,亦可选择肠壁、肠段切除。无蒂或广蒂者(图10),位于腹腔反折以下者作局部切除,反折以上者切开肠壁包括基底部肠壁一并切除或肠段切除。腺瘤病,包括家族性、非家族性,Gardner与Turcot病均有众多的肠瘤,易癌变且发生年龄早,如家族性腺瘤病一般50岁以前均全部癌变,故主张诊断为此病者全结肠直肠切除、回肠造瘘,但给较年轻患者带来终身的生活不便,故有人主张作全结肠切除回肠直肠吻合。留下的直肠是否为癌变来源,St Mark资料25年随访仅6.5%发生直肠癌,且多为早期,故术后严密随访确属必要。近来有人主张作直肠部分切除外加残留直肠的黏膜剥离,保留下段直肠肌管,回肠与直肠下段直接吻合。总之保留肛门功能,虽给手术增加一些难度,但能避免终生性回肠造瘘是可以的,也易于被患者所接受。圈套凝切法:先吸净周围附着息肉的黏液和粪水,抽出并注入空气以置换肠道内可能含有的氢气、甲烷等,以防电灼时发生爆炸,近息肉张开圈套丝,避免套圈过于贴近肠壁,损伤肠壁致死穿孔,套入后抽紧套丝,根据蒂的粗细选择不同的电流功率,切割勿过快,切割慢止血完善(图9)。活检钳凝切法:对0.5cm的广基病灶,用活检钳全部咬住,上提使基底呈幕状的狭细假蒂,随后通电流凝固数秒钟,局部呈灰白色即可将活检钳咬紧拉下组织送病理检查。电凝器灼除法:多为0.5cm以下病灶,多属良性,对钳切不能切除者,可以电凝止血器接触后以凝固电流烧灼切除。但勿过深以免穿孔或迟发性穿孔,后者可发生于术后2~7天。手术治疗:息肉及息肉病的手术治疗一般包括:局部切除、肠壁切除、肠段切除、次全结肠或全结肠直肠切除。视息肉的多少、有无蒂及所在的部位而定:手术选择癌变局限于黏膜层的原位癌:一致认为采用局部切除即可,但需病理证实。恶性息肉:为腺瘤伴癌浸润,侵及黏膜及黏膜下,结肠镜下切除易残留及淋巴结转移,因此主张证实为恶性者应再手术。小的扁平者可先行息肉切除,在内镜检查时如疑为恶性,需手术切除,故在内镜摘除时在局部注入India ink,待病理确诊后,为进一步手术中作标记。恶性瘤摘除后3~6个月随访,有复发则再手术切除肠段。浸润癌:癌变穿透黏膜下层时,处理意见不一。手术方式的选择主要取决于癌转移及复发的危险度。Nivation综合文献347例浸润癌,总的淋巴结转移率9%,其中无蒂腺瘤恶性变的转移率15%,癌残留6%。有蒂的转移率7.8%,其中癌残留2.3%。癌限于有蒂或腺瘤头部者,淋巴结转移率为3%,而癌进入颈、基部时淋巴转移率为20%。腺瘤癌变时有下列4项特征者,可行局部切除:A.肠镜和病理学检查均证实腺瘤完全切除;B.癌细胞分化好;C.切缘无癌;D.无血管和淋巴管受累。具有该4项者的淋巴结转移率<2%,且不高于肠切除术后的死亡率。如果具有相反的4项特征,其淋巴结转移率达41.7%。目前多数学者同意下述原则:浸润癌局限于带蒂腺瘤头部且具备上述各项者不需行肠切除术,局部切除加密切随访即可。有下列4项之一者需行肠切除术:A.带蒂腺瘤头部有浸润性癌且分化差;B.癌细胞侵入黏膜下淋巴管或静脉;C.切缘有癌;D.广基腺瘤的浸润性癌。Morson等应用上述原则对浸润性癌行腺瘤完全切除术,随访5年,无复发。少数人不同意上述原则,认为所有含浸润癌的腺瘤都应进行标准的肠切除术。腺瘤癌变浸润到肌层:一般认为,无论分化如何均需行根治术。但也有人报道,T2期直肠下段癌行局部切除加放疗,疗效满意。<0.5cm者可用活检钳凝除法将息肉全部切除,标本送病理检查;0.5~1.0cm者可用圈套凝切;如为多发性且逐一钳除不易者宜手术切除,肉眼判断为良性者,可采用电凝灼除法去除病灶。内镜下切除有蒂息肉及无蒂息肉:有蒂息肉于结肠镜检时一并圈套摘除,无蒂息肉小的可电灼摘除,大的可黏膜下注生理盐水。圈套电灼摘除后常见并发症为术后出血,0.1%~0.2%。术后1~3年随访1次,包括对进展性腺瘤原位癌者,或高度不典型增生。因腺瘤息肉淋巴管贯穿黏膜肌层,故伴重度不典型增生癌变者,均限于黏膜而无淋巴结转移。有蒂息肉可圈套切除。无蒂息肉的处理为:手术切除:>2cm的绒毛状广基腺瘤不宜经结肠镜分块切除,宜采用手术切除。位于腹膜反折以上不能经内镜切下者,应直接按结直肠癌手术处理,因此类患者有1/3以上伴浸润性癌变;能经内镜切除者,切除后须仔细进行病理检查,发现浸润癌时宜再行根治术。位于腹膜反折以下者可经肛或经骶行局部切除。腺瘤癌变的处理原则:9预后息肉病具有明显的癌变倾向。Lockhart-Mummcry曾预言“每个息肉病者,任其自然发展,终会发生癌变。单纯性息肉病主要分布于直肠和乙状结肠,最大的息肉直径4cm,均已有癌变。病人因症状加重就诊时癌变率为36%(Hullsiek)或73%(Dukes)。癌变的倾向性被认为和基因变异对致癌因子的敏感性升高有关。病程长短和息肉病癌变率呈正相关。Muto统计59例病人癌变情况,病程5年以内者癌变率为12.7%,5~10年病程者达41.8%,10年以上病程者癌变率更高(45.4%)。该组病例有4例20年后还未发现癌变。癌变和年龄有关。本病多在20岁左右发病,10岁以前,40岁以后发病者少。癌变年龄大都在30岁以后,比一般人早10~20年。Dukes分析大组病例后认为从发病到诊断癌变,平均相隔8~15年(表6)。按年龄组分析:癌变率19岁以下为29%,20~29岁为38%,30~39岁为82%,50~59岁为92%。息肉病发生癌变者,多中心性发生者多,直肠和乙状结肠癌变者多。临床活检时应注意这些特点。单纯性息肉病在手术或电灼治疗后残留的大肠黏膜有重新形成息肉的倾向性,再形成的息肉被称为“复发性息肉”。Jackman在56例的术后随访中发现,70%可出现复发性息肉,其中12.5%发展为癌,近年多主张作结肠全切。但至1962年,世界上也报告过10例单纯性息肉病自发消退的病例,其机制不清。10预防家族性腺瘤性息肉病处理的基本原则是在息肉发生癌变前切除病变肠管,并对其家族成员进行普查和随访。认真登记家谱这对于发现高危人群非常重要。对于家族中的子女,在青春期开始后即应定期进行结直肠检查,一般半年左右进行1次乙状结肠镜检查,直到40岁,如果到此时结直肠内还没有息肉,再出现息肉的机会就比较少。但是值得注意的是极少数患者在60岁以后还会出现息肉病。另外,对上消化道也应进行定期检查,尤其是十二指肠壶腹周围,以除外十二指肠和壶腹周围息肉的可能。近年来,许多作者通过对APC基因突变的检测发现没有临床症状的患者,准确率可达100%。这一方法避免了定期进行结肠镜检查的痛苦,为家族性腺瘤性息肉病患者的早期发现提供了1条新的途径。
李耀锋 副主任医师 济宁市第一人民医院 急诊腹部外科2075人已读






