王湛医生的科普号
- 精选 BRAFV600E突变肠癌患者的福音
BRAFV600E基因突变的结直肠癌是属于难治性肠癌,约占结直肠癌总数的5%~21%,是以侵袭性高、治疗效果不佳和预后差为特征、死亡率是BRAF野生型患者的2~3倍。为了突破这一难题,上海长征医院肿瘤科历经多年研究,创造出新型均衡型化疗联合靶向模式(FOLFIRI+维莫非尼+西妥昔单抗),其客观有效率(ORR)和疾病控制率(DCR)分别达到85%和100%,尤其是一线治疗的ORR高达91.7%,远高于目前指南推荐方案的40%~50%有效率。为了进一步提高治疗效果,我们根据基础和临床最新研究成果,将治疗方案中的普通伊立替康升级为伊立替康脂质体,使得新方案有更好的疗效和更低的不良反应。目前我们正在开展改良新方案用于BRAFV600E突变晚期结直肠癌患者一线治疗的临床研究,,研究预计招募75名符合条件的受试者参加该项研究,患者将按照2:1比例随机分配到试验组(50例)和对照组(25例),试验组采用盐酸伊立替康脂质体注射液(Ⅱ)+氟尿嘧啶+亚叶酸+维莫非尼+西妥昔单抗方案,对照组采用盐酸伊立替康脂质体注射液(Ⅱ)+氟尿嘧啶+亚叶酸±贝伐珠单抗方案。入组患者可获得伊立替康脂质体、维莫非尼免费赠药,本研究已通过上海长征医院生物医学伦理委员会审批(批件编号:2024SL096)。具体细节可向研究医师咨询。【研究医师】王湛,门诊时间:周四上午,地址上海市凤阳路415号,其他时间在上海市和田路64号(上海长征医院诊疗分部)并可扫描二维码,加入和登录王湛医生网上工作站后进行咨询。
 王湛 主任医师 上海长征医院 肿瘤科2385人已读
王湛 主任医师 上海长征医院 肿瘤科2385人已读 - 精选 攻疑克难---BRAF突变型晚期结直肠癌的治疗新进展王湛 主任医师 上海长征医院 肿瘤科1579人已读
- 精选 肠癌的“防”与“治”,筛查和规范是关键
提高结直肠癌疗效、降低死亡率的关键在于,做好肿瘤早期筛查以及诊疗过程的规范专业。海军军医大学附属长征医院肿瘤科副主任医师王湛建议,结直肠癌高危人群或50岁以上人群应接受定期的肠镜筛查。他指出,规范专业的诊疗可以远离过度医疗带来的痛苦和负担,也可以避免治疗不足而丧失最佳时机,特别是能够为晚期患者赢得“带瘤生存”之下良好的生活质量,并延长生存期。王湛医生认为,早期筛查的必要性在人群中的宣传力度需进一步加强。从不惑之年开始就应多加关注健康科普信息,结合家族史和自身健康状况,确定何时接受某些专科体检。一般来说,40岁后应接受胃镜检查,50岁以上应接受肠镜筛查。一个不争的临床事实是,初诊时中晚期结直肠癌患者远多于早期。部分适合手术的患者在接受根治性手术后,医生将根据肿瘤分期分型安排化疗。有复发转移不符合手术指征的晚期患者一般需要接受化疗联合靶向药物的治疗方案。王湛医生表示,化疗仍是结直肠癌的治疗基石。相比化疗单独一种方法,联合靶向药物的治疗有效率可提高15%-20%。晚期转移性结直肠癌的相关靶向药物贝伐珠单抗和西妥昔单抗等,被纳入2017版国家医保目录,其价格的大幅度降低无疑为中国肿瘤治疗事业和肿瘤患者家庭带来了新的曙光,显著的好处不仅减轻家庭经济负担,增加了患者对药物的可及性,同时也推动了结直肠癌的规范化治疗,让患者有更多机会接触到肿瘤的标准化治疗,进而提高了结直肠癌的临床疗效。对于晚期结直肠癌患者而言,完全根除肿瘤就目前的医学水平来看是不可能的,带瘤生存才是切合实际的目标,化疗联合靶向药物治疗是实现这一目标的一种手段。医患共同的追求是更好地治“人”而非治“癌”,让患者在症状得以控制的情况下获得良好的身心安慰。王湛医生认为,在通过常规化疗联合靶向治疗将肿瘤控制到一定程度后,使用低剂量的化疗联合靶向药物进行维持治疗,可以让晚期结直肠癌患者以最低的不良反应和经济付出为代价,获得最佳的生活状态,更好地回归社会、享受生活。
王湛 主任医师 上海长征医院 肿瘤科1465人已读 - 精选 癌痛对患者有什么影响?
长期的慢性疼痛对病人的影响是多方面的。会影响病人的情绪、睡眠、进食、消化及免疫功能等,这样又会加重疼痛的程度,促进肿瘤的生长。而且长期的疼痛会让患者对抗癌治疗产生怀疑,最终可能会放弃治疗。疼痛也会影响凝血功能,很多患者会产生静脉血栓,这也会导致病人出现危及生命的并发症。剧烈的癌痛还会对心血管功能、呼吸功能有一定的影响。有心脑血管疾病的患者,可能因为疼痛出现心脑血管危险。所以肿瘤疼痛对患者的生存是一种严重的威胁因素。
王湛 主任医师 上海长征医院 肿瘤科1893人已读 - 精选 肠癌靶向治疗前要进行基因检测吗?
靶向药物在肠癌的治疗中占据了非常重要的地位,目前肠癌的靶向药物大体上分两类,抗VEGF和抗EGFR,其中以贝伐珠单抗为代表的抗VEGF治疗是不需要做基因检测的,而以西妥昔为代表的抗EGFR治疗是要检测RAS基因的。有人会问,基因检测挺费事的,而且花费不低。那么直接使用不需要基因检测的靶向药物好了,这样做真的合适吗?有研究表明,在RAS野生型的患者中,抗EGFR治疗的客观有效率高于抗VEGF,这对于那些肿瘤负荷大或是进行转化治疗的患者来说就比较有意义了,因为更高的客观缓解率可以为他们争取更长的疾病控制时间和更多的手术机会。所以,选择靶向药物之前,基因检测还是很有必要的。
王湛 主任医师 上海长征医院 肿瘤科8749人已读 - 精选 什么是肠息肉、肠腺瘤?和肠癌有关系吗?
肠息肉指的是肠黏膜表面突出的一种赘生物,而不管它的大小、形态和组织学类型。肠息肉包括增生性息肉、炎症性息肉、错构瘤、腺瘤等等。因此,肠腺瘤是肠息肉中的一种类型。还有一种分类方法,就是根据组织学将息肉分为肿瘤性和非肿瘤性息肉,腺瘤就属于肿瘤性息肉,而增生性息肉、炎症性息肉、错构瘤属于非肿瘤性息肉。腺瘤是最为常见的肠道息肉,包括三种类型:管状腺瘤、绒毛状腺瘤和管状绒毛状腺瘤。腺瘤是具有癌变可能的,其癌变率主要和腺瘤的类型、大小以及合并上皮异型增生的程度有关。管状腺瘤的癌变率<5%,管状绒毛状腺瘤癌变率为23%,而绒毛状腺瘤的癌变率高达30%~70%。腺瘤直径在0.5cm者癌变率≤0.1%,<1cm者癌变率为1%~3%,1~2cm者为10%,而>2cm者为30%~50%。合并轻度上皮异性增生的腺瘤癌变率较低,如果是重度上皮异型增生,癌变率可达27%。目前研究认为80%以上的肠癌是由腺瘤演变而来,因此凡是检查发现到腺瘤均应该摘除。腺瘤在做肠镜检查的时候,肉眼和其他肠息肉进行鉴别有时较为困难,所以基本上息肉都会被摘除,然后进行病理学检查来判断是否是腺瘤。腺瘤摘除后的患者中有30%以上的会再长出新的腺瘤,所以这些患者治疗后仍然是高危人群,需要密切的观察。 图:肠息肉
王湛 主任医师 上海长征医院 肿瘤科3.3万人已读 - 患者故事 MTB:点亮疑难肠癌患者的生命之光 —分子精准治疗带来的新希望
引言:当标准治疗“失效”时,我们还能做什么? 肠癌是我国常见的恶性肿瘤之一,不少患者通过手术、化疗、靶向治疗等标准方案可获得良好疗效。然而,约15%-20%的患者却陷入“标准治疗无效、病情复杂多变”的困境:肿瘤基因突变罕见、多线治疗后耐药、原发灶不明等等,这些“疑难肠癌”患者,常常面临无药可用的绝望。 如今,一种名为分子肿瘤专家委员会(MTB)的创新模式,正在为这类患者打开一扇新的大门。通过多学科专家协作、基因检测指导、个体化方案设计,MTB让“山穷水尽”的疑难肠癌治疗,迎来“柳暗花明”的转机。 什么是MTB?——从“单打独斗”到“团队作战”MTB(MolecularTumorBoard)即分子肿瘤专家委员会,是由肿瘤科医生、病理学家、分子生物学家、遗传学家、生物信息学家等组成的多学科团队。他们共同分析患者的基因检测结果,结合最新研究进展,制定“量身定制”的治疗方案。 MTB与传统MDT的区别 MDT(多学科会诊):针对某种疾病(如肠癌)的临床讨论,由外科、内科、放疗科等医生参与,目标是选择最佳手术、化疗或放疗方案。 MTB(分子肿瘤委员会):聚焦于肿瘤的分子特征,从基因突变、信号通路、药物敏感性等角度,寻找潜在的治疗靶点或临床试验机会。 简言之,MDT解决“如何用好现有武器作战”,而MTB探索“如何发现新武器”。 MTB如何“破局”?—从基因密码中寻找生机 疑难肠癌的核心问题,往往隐藏在肿瘤的基因突变中。MTB的工作流程可分为三步: 1.基因检测:通过高通量测序(NGS)等技术,全面分析肿瘤组织的基因突变、融合、拷贝数变异等信息。 2.多学科解读:专家团队结合数据库(如COSMIC)、药监批准信息、临床研究数据,判断哪些突变是“可靶向”的。 3.制定方案:推荐匹配的靶向药、免疫治疗、临床试验,或探索跨适应症用药的可能性。 哪些患者适合MTB? 1.标准治疗失败或疗效不佳; 2.携带罕见基因突变(如ALK融合、BRAF非V600E突变); 3.肿瘤分子特征复杂(多原发灶、原发不明); 4.家族中有罕见遗传性肿瘤史。 真实案例:MTB如何改写患者的命运 案例一:绝境中的“钻石突变” 患者羊女士,70岁,2019年,杨女士因腹痛就诊,确诊为晚期肠癌伴肝转移。经历化疗、靶向治疗后,病情仍迅速恶化,出现大量胸腹水、呼吸困难,体力状态极差(ECOG评分4分)。 MTB介入:基因检测发现其肿瘤存在EML4-ALK融合突变(发生率<1%)。这种突变常见于肺癌,可被ALK抑制剂(如克唑替尼)有效控制,但在肠癌中极为罕见。MTB团队综合文献和临床数据后,决定尝试“跨适应症用药”——口服克唑替尼。 结果:治疗4周后,羊女士胸腹水明显减少,肿瘤标志物下降,体力恢复(ECOG评分2分),生存期延长超过2年。 案例二:破解“耐药密码” 患者郭女士,58岁 ,2021年,郭女士确诊肠癌伴腹膜转移,基因检测显示KRAS突变、MSS型(免疫治疗不敏感)。一线化疗联合贝伐珠单抗治疗后,肿瘤快速进展,腹腔广泛转移。 MTB介入:二次基因检测发现NRAS、TP53基因突变。MTB推荐“免疫+抗血管+靶向”三联方案(信迪利单抗+瑞戈非尼+化疗),并联合三氧化二砷(ATO)尝试修复TP53突变功能。 结果:治疗4周期后,PET-CT显示肿瘤负荷显著降低,肠镜复查原发病灶消失。患者持续缓解近1年,后接受手术切除残余病灶。 科学支持:MTB的疗效数据上海长征医院肿瘤科的实践显示,MTB显著改善了疑难肠癌患者的生存: 1.82例接受MTB推荐方案的患者:中位无进展生存期(PFS)延长40%,总生存期(OS)延长60%。 2.免疫治疗优化:MTB指导下的免疫联合方案(如PD-1抑制剂+抗血管药物),疾病控制率(DCR)达73.2%,部分患者肿瘤明显缩小。 这些数据证明,MTB不仅提供理论上的“可能性”,更能转化为真实的生存获益。 未来展望:从“精准”到“治愈”MTB的潜力远不止于此。目前,上海长征医院正通过多项临床研究探索更前沿的策略: 1.“老药新用”:如三氧化二砷(ATO)修复TP53突变功能,联合MEK抑制剂增强疗效。 2.免疫治疗突破:针对MSS型肠癌,通过短期免疫治疗“预热”肿瘤微环境,提高后续靶向药敏感性。 3.类器官药敏测试:利用患者肿瘤培养类器官,直接在体外筛选最有效的药物组合。 给患者和家属的话 疑难肠癌的治疗之路或许坎坷,但医学的进步从未停歇。MTB模式的出现,让“一人一方案”的精准治疗成为现实。基因检测技术、多学科协作、创新临床试验,正为无数患者点亮希望之光。请相信,当标准方案“失效”时,仍有无数医学专家在探索、在努力。您不是独自战斗,MTB将与您同行,共同寻找生命的更多可能。
 王湛 主任医师 上海长征医院 肿瘤科暂无已读
王湛 主任医师 上海长征医院 肿瘤科暂无已读 - 学术前沿 科学照亮希望之路:BRAF突变晚期结直肠癌精准治疗进展
BRAF基因突变,尤其是BRAFV600E突变,是导致结直肠癌细胞失控增殖的关键因素。这种突变使得癌细胞仿佛失去了基因“刹车”,导致它们疯狂增殖,形成肿瘤。尽管这类患者在所有结直肠癌患者中所占比例不高,约为8%-12%,但他们的生存预后却远不如其他患者。然而,近年来,随着靶向治疗、免疫治疗和个体化治疗方案的不断进步,科学家们正通过精准医疗的手段,为BRAF突变晚期结直肠癌患者带来新的希望。1.认识BRAF突变—为什么它是“难缠的对手”? 如果将人体比作一辆精密的汽车,基因就是控制这辆车行驶的“交通信号灯”。在正常情况下,基因会严格调控细胞的生长、分裂和死亡。然而,当某些基因发生突变时,就像交通信号灯突然失灵,细胞开始疯狂增殖,最终形成肿瘤。在结直肠癌中,BRAF基因突变就是这样一个“失控信号灯”,尤其是BRAFV600E突变,它让癌细胞获得了“超速行驶”的能力。BRAF基因编码的蛋白质是MAPK信号通路的关键成员。正常情况下,这条通路负责传递细胞生长和存活的信号。但当BRAF基因发生V600E突变时,这条通路会被持续激活,就像汽车的油门被一直踩着,导致癌细胞无限增殖、转移和耐药,临床表现出预后差、治疗反应低等特点。预后差指的是BRAFV600E突变患者的死亡风险是野生型患者的2倍,中位总生存期(OS)通常不足2年,且多伴随腹膜转移和广泛扩散。治疗反应低则是说传统化疗对这类患者效果有限,亟需精准治疗策略。2.为什么传统化疗“力不从心”?过去,化疗(如FOLFOX、FOLFIRI)联合抗血管生成药物(如贝伐珠单抗)是一线治疗的标准方案,但客观缓解率(ORR)仅40%左右,中位无进展生存期(PFS)约半年左右。究其原因,BRAF突变肿瘤的生物学行为更具侵袭性,且容易对化疗产生耐药,而二线化疗的有效率甚至低至个位数,所以很多患者经历多次化疗后,肿瘤仍快速进展。因此我们需要更精准的武器。3.靶向治疗的崛起—直击“失控信号灯”2019年,BEACON研究改写了BRAF突变患者的治疗格局。该研究显示,康奈非尼(BRAF抑制剂)+西妥昔单抗(EGFR抑制剂)的联合方案,将后线治疗的客观缓解率提升至20%,中位OS延长至9.3个月,显著优于化疗。康奈非尼直接抑制突变的BRAF蛋白,阻断MAPK信号通路。西妥昔单抗阻断EGFR受体,防止癌细胞通过旁路信号逃逸。因此EC方案成为全球指南推荐的后线治疗方案。类似的方案还包括达拉非尼+帕尼单抗、维莫非尼+西妥昔单抗。中国数据支持方面,NAUTICALCRC研究证实,中国患者使用EC方案的疗效与全球数据一致,中位PFS达4.2个月,疾病控制率(DCR)高达70%。4.四药方案的“中国智慧”上海长征医院肿瘤科提出了均衡性创新四药联合方案—维莫非尼+西妥昔单抗+5-FU+伊立替康(IMPROVEMENT方案)。这一组合在单中心研究中表现惊艳:CR(完全缓解率)10%,ORR为85%,DCR为100%。如果把癌细胞比作“强盗”,IMPROVEMENT方案就像派出三支特种部队——维莫非尼负责切断敌军的通讯(BRAF信号),西妥昔单抗堵住逃生通道(EGFR旁路),5-FU和伊立替康则直接发动空袭(化疗杀伤)。而2年之后的全球多中心BREAKWATER研究,使用了与IMPROVEMENT案相类似的双化疗(FOLFOX6)+双靶向(康奈非尼+西妥昔单抗)治疗方案,ORR为60%,疗效也明显高于传统的方案。5.免疫治疗的曙光大部分BRAF突变结直肠癌属于MSS型(微卫星稳定),这类肿瘤对PD-1抑制剂单药反应率极低,被称为“冷肿瘤”。但科学家们并未放弃,而是尝试通过联合治疗“撕掉隐身衣”。一项Ⅰ/Ⅱ期研究探索了康奈非尼+西妥昔单抗+纳武利尤单抗(PD-1抑制剂)的疗效:ORR50%,远超传统EC方案的20%;中位OS15.1个月,较历史数据几乎翻倍。BRAF抑制剂、抗EGFR单抗和PD-1抑制剂三者协同实现“联合作战”。6.未来方向—医学的“星辰大海”全球有数十项针对BRAF突变的临床试验正在进行,例如:CFT1946是一种口服BRAFV600E蛋白降解剂,能直接标记突变蛋白并引导其被细胞“回收站”分解,早期数据显示,其ORR优于传统抑制剂。还有泛BRAF抑制剂,对BRAFV600E在内的多种BRAF突变均有抑制作用。我们也鼓励合适的患者参加临床试验,参加临床试验就像“抢先体验未来科技”,或许你就是下一个医学奇迹的见证者!BRAF突变晚期结直肠癌的治疗曾是一片荆棘之地,但如今,靶向治疗、免疫治疗和个体化策略的进步,已为患者开辟出一条希望之路。科学家的每一次突破、医生的每一分努力、患者的每一刻坚持,都在为这条道路铺就新的砖石。确诊BRAF突变或许令人恐惧,但请记住—医学从未停止进步。今天的“难治之症”,可能正是明天“可愈之疾”。保持信心,与医生紧密合作,未来永远值得期待。
王湛 主任医师 上海长征医院 肿瘤科20人已读 - 就诊指南 晚期一线肠癌新的无化疗治疗方案
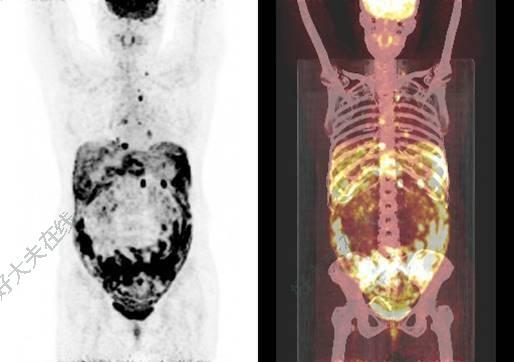
今天一位肠癌的老太太,由于年事已高,担心化疗的毒副作用,咨询是否有化疗以外的治疗方案,这样不能耐受化疗或不愿意化疗的病人其实还不少。为了满足这一部分患者的需求,我们从2年前就开始相关探索和研究,在肠癌中开展了APICAL研究,在一线晚期肠癌患者中采用无化疗的靶向+免疫方案,经过一系列的病例观察,发现取得了不错的效果,包括针对既往认为对免疫疗效不好的肝转移病灶,也取得了不错的效果(见下图)。现在APICAL研究正在进行,而且靶向和免疫药物都是免费的哦,如果有合适的病人可以和我们联系。
 王湛 主任医师 上海长征医院 肿瘤科421人已读
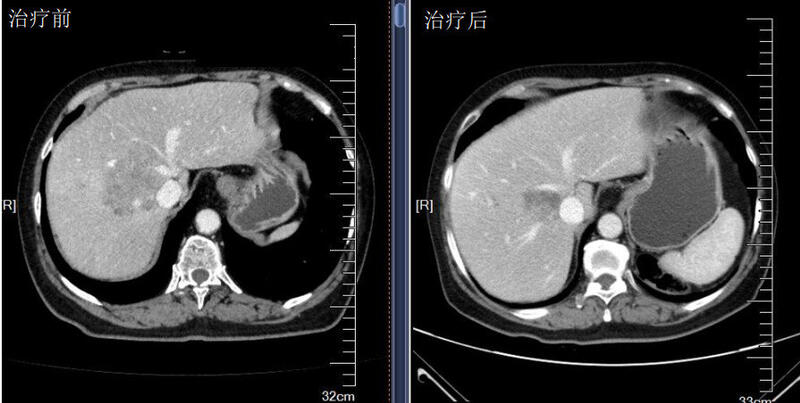
王湛 主任医师 上海长征医院 肿瘤科421人已读 - 案例 难治性肠癌
治疗前 一位晚期肠癌、腹腔腹膜广泛转移的病人,一线标准治疗原发性耐药,病情进展迅速,属于临床难治性肿瘤,常规二线治疗有效率低,如果病情再不能得到控制,患者将没有后续治疗的机会,因此我们遵循指南原则但没有窠臼于指南,结合最新的临床研究进展,将免疫治疗(PD-1抗体)和小分子抗血管TKI治疗前移,并配合化疗。 治疗后 治疗后2月 患者经过一个疗程治疗后患者临床症状显著缓解,三个疗程后基本达到完全缓解,影像学基本上看不到肿瘤了。创新治疗对于疑难肿瘤来说,不但是方法的更新,重要的是理念的前进,对患者而言是更多机会。
 王湛 主任医师 上海长征医院 肿瘤科274人已读
王湛 主任医师 上海长征医院 肿瘤科274人已读





