张颖医生的科普号
- 精选 子宫肌瘤患者饮食
由于膳食因素具有改变内源性激素分泌和炎性作用的潜能,膳食在子宫平滑肌瘤的病因学中可能发挥一定的作用。水果与蔬菜水果与蔬菜中含有的维生素、矿物质、抗氧化剂和植物化学成分可能降低平滑肌瘤的风险,每天或每周食用的种类和次数越多,发病风险越低。蔬菜中西兰花、卷心菜、大白菜、西红柿可降低肌瘤风险;水果中苹果和柑橘类水果更有效;水果的效果强于蔬菜,将水果和蔬菜综合在一起,肌瘤风险会显著降低。膳食脂肪目前的研究未显示膳食脂肪和肌瘤之间有密切关联。乳制品有研究显报道随着奶制品摄入量的增加肌瘤的风险降低,但其作用并不确切。维生素D虽然人体维生素D水平主要来源于阳光照射,但维生素D自然存在于一些食物中,如多脂鱼、肝脏和鸡蛋,而其他食物如牛奶或橙汁,也富含维生素D。有研究显示血浆维生素D水平较高的妇女患肌瘤的风险降低。鱼类尽管鱼类可能富含多不饱和脂肪,但也可能是毒素暴露的来源,特别是持久性有机污染物和其他植物雌激素化合物。美国有研究观察到食用深颜色的鱼可能导致肌瘤风险增加。但在不同国家食用的鱼类种类繁多,制作方法各异以及研究中持久性有机污染物的负荷不同,因此对这些结果的解释具有争议性。大豆研究显示大豆异黄酮与肌瘤风险之间无显著相关性,有研究调查了大豆高摄入量和低摄入量人群间肌瘤风险没有明确关联。因而大豆摄入量与肌瘤风险无关。肉类少数研究观察到食用牛肉和其他红肉会显著增加肌瘤的风险。酒精有研究证实饮酒与肌瘤风险增加有关,这与饮酒量、饮酒时间和酒的种类相关,饮酒时间越长、饮酒量越大的女性患肌瘤的风险就越高,尤其是啤酒摄入导致肌瘤的相关性最强。总体来讲,目前研究探讨膳食因素与肌瘤风险之间的关系,多数是横断面设计,严重降低了得出时间因果结论的能力。迄今为止,饮食和肌瘤风险之间的一致关联仅限于两个一致的发现:水果和蔬菜摄入量的增加可降低肌瘤风险、维生素D水平增高则肌瘤风险降低。
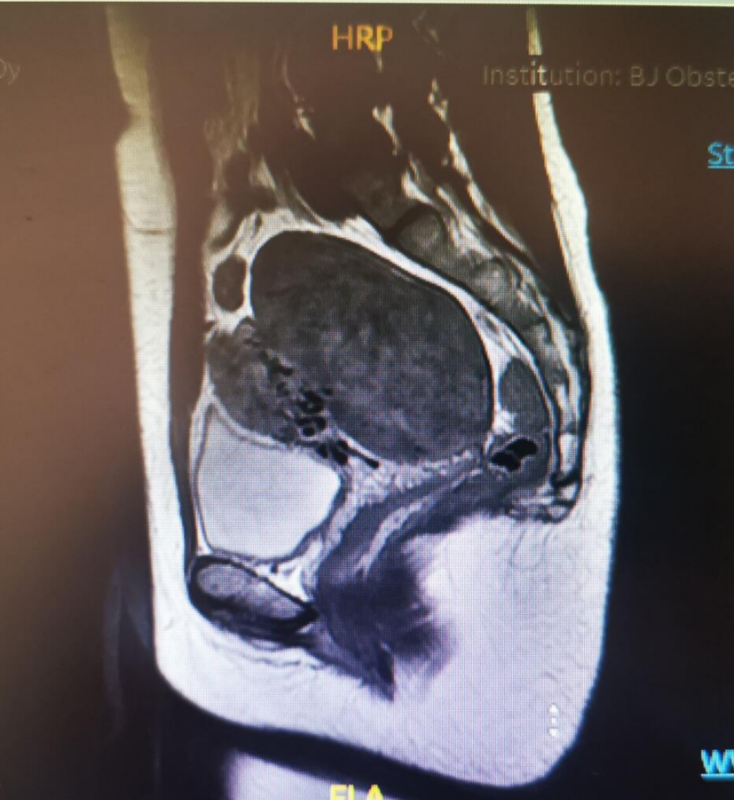
张颖 主任医师 北京妇产医院 妇科微创中心4467人已读 - 医学科普 子宫肌瘤的单孔腹腔镜手术
传统的多孔腹腔镜肌瘤剔除通常需要在脐部及左右侧下腹部共开四个切口,肌瘤需在腹腔内经粉碎后才能取出,粉碎的过程中如果将瘤体碎屑遗留在腹腔内,则可能继续生长在腹腔内长出多发性肌瘤;少见的情况下瘤体如果是恶性,则会发生灾难性后果。避免瘤体碎屑遗留于腹腔是手术大夫很重视的环节。单孔腹腔镜肌瘤剔除无需肌瘤粉碎,而是将瘤体提出于脐部切口处,像削苹果一样将肌瘤削成长条样取出,完美地避开了肌瘤粉碎环节;而且,脐部小切口的疤痕隐藏于脐孔内,实现术后腹部“无”疤痕。因而,单孔腹腔镜肌瘤剔除越来越得到广大患者的喜爱。但是,单孔腹腔镜手术要求技术高,而且并非所有的肌瘤都能适合单孔手术。比如肌瘤的大小,个数,位置等等都是需要综合考虑的因素,这需要医生的充分评估才能确定。
 张颖 主任医师 北京妇产医院 妇科微创中心935人已读
张颖 主任医师 北京妇产医院 妇科微创中心935人已读 - 医学科普 什么样的子宫内膜息肉需要切除
子宫内膜息肉是女性常见多发疾病,患病率可高达35%,对于多发性息肉,切除后也很容易复发,许多患者就很纠结,我的内膜息肉到底该不该切?一般临床上对于息肉的治疗掌握以下原则:据恶性可能性以及息肉与不孕的相关性来定息肉是否需要切除。1、对于直径≤1cm的息肉若无症状,1年内自然消失率约27%,恶变率低,可观察随诊。2、有以下情况的息肉建议切除:1)直径较大的息肉;2)多发性内膜息肉及复发性息肉;3)影响生育的息肉:息肉位于输卵管开口处、胚胎移植失败、不孕症合并息肉4)围绝经期及绝经后发现的息肉
 张颖 主任医师 北京妇产医院 妇科微创中心2183人已读
张颖 主任医师 北京妇产医院 妇科微创中心2183人已读 - 图文文章 北京妇产医院妇科微创中心开展系列单孔手术
北京妇产医院妇科微创中心开展系列单孔腹腔镜手术 为满足广大患者的需求,近年来,北京妇产医院妇科微创中心在原有多孔腹腔镜基础上熟练开展系列单孔腹腔镜技术,包括经脐部单孔及经阴道单抗腹腔镜手术,为更多患者提供更微创的医疗服务。单孔腹腔镜手术——传说中几乎不留疤的微创手术,真的有这么神奇吗?下面就让我们来进入单孔腹腔镜的世界!常规的腹腔镜手术需要在人体做3-5个切口,也称为多孔腹腔镜。而单孔腹腔镜手术是指通过1个切口进入人体,置入腹腔镜器械进行手术操作。根据入路的不同,单孔腹腔镜可分为经脐单孔腹腔镜手术及经自然腔道的腹腔镜手术。经脐单孔腹腔镜手术:经脐单孔腹腔镜是在肚脐做一个约2cm的切口,置入腹腔镜器械完成手术操作,这是妇科手术的常用入路。之所以选择肚脐,是因为肚脐是人体唯一一个天然的疤痕结构,选择此处置入腹腔镜器械不会增添腹部额外的手术疤痕。经自然腔道的内镜手术在妇科多通过经阴道穹窿置入腹腔镜器械完成手术。但由于术中污染可能性大、手术暴露相对困难,目前手术适应人群受到一定限制。 单孔腹腔镜手术有哪些优点?1、美容性:单孔腹腔镜手术最主要的优点就是它的微创美容性。肚脐是人体出生后脐带脱落留下的疤痕。此处的手术切口可以被肚脐皱褶掩盖,术后瘢痕不明显,更具有美容性,因而,单孔腹腔镜手术成为更多年轻及爱美女性的福音。2、低痛感:由于单孔手术中切口数量的减少,术后腹壁切口的疼痛会大大减轻。3、微损伤:手术可以“单刀直入”,对周围组织的损伤降至最低,术后发生粘连的机会更小。4、经济性:住院时间缩短,使得患者很快康复并顺利投入工作,为患者节省治疗费用。当然,单孔腹腔镜手术也存在缺点,如器械之间相互交叉干扰,容易打架,即存在所谓“筷子效应”,对施术者技术要求较高等,这些缺点随着技术的发展及经验积累正逐步得到解决。 那么,哪些人适合做单孔腹腔镜手术? 最常见的单孔腹腔镜手术包括子宫切除、附件切除、子宫肌瘤剔除、卵巢囊肿剥除、异位妊娠手术及部分恶性肿瘤手术等。但并非所有的经多孔腹腔镜完成的手术均能被单孔所替代,这需要术前充分的个体化评估,做到手术最小化创伤,保证患者最大化获益。对患者来说,如果你所就诊的医院可以提供单孔腹腔镜手术,可以跟医生沟通你是否适合做单孔,医生会根据具体情况选择最合适的治疗方式。目前,北京妇产医院妇科微创中心已熟练开展上述多种单孔腹腔镜手术,也标志着我院微创技术正式从腹部多孔的“微创时代”,迈进了单孔腹腔镜手术的“无疤时代”,为更多患者提供更为优质的医疗服务。为您服务,我们一直在路上!
张颖 主任医师 北京妇产医院 妇科微创中心218人已读 - 学术前沿 窄带成像在子宫内膜癌及癌前病变诊断中的应用
窄带光成像宫腔镜在诊断子宫内膜癌及内膜非典型增生中的价值[1]子宫内膜病变诊断的金标准仍为病理组织学检查,然而,能否准确地获得病变部位的病理组织决定了对子宫内膜病变诊断的敏感性。传统的诊断性刮宫(D&C)因不能明视宫腔内的病变情况因而在准确诊断子宫内膜病变中存在局限性,研究显示D&C对子宫内膜癌诊断的漏诊率可高达11%-35%【1,2,3】。宫腔镜能实现对宫腔内病变的直视观察,在其指导下的对病变部位的定点活检可明显提高病变的检出率,是目前宫腔内病变诊断中最常使用的方法【1, 4】。宫腔镜指导下的定位活检提高疾病诊断敏感性的基础是建立在宫腔镜对病变形态学正确识别基础上的。然而,由于宫腔内病变的复杂多样性及早期子宫内膜病变的不典型性,宫腔镜对病变表面形态学的评估具有很大的主观性。目前大样本的研究结果亦显示单纯应用宫腔镜对子宫内膜癌及子宫内膜异常增生诊断的敏感度仅达80%及56.3%【5】,因而,寻找更为有效的识别病变形态学的途径进而指导更准确的病理组织学活检从而提高诊断的敏感性成为目前临床面临的课题。随着光学成像技术的革新,窄带光成像(narrow band imaging,NBI)是近年发展起来的一种新的成像技术,因其能凸显病变表面微血管的形态学改变,可提高内镜对肿瘤病变识别的敏感性。NBI内镜目前已广泛应用于胃肠、膀胱、咽喉等肿瘤的早期诊断。由于血管的异常改变同样是子宫内膜癌及内膜不典型增生发生及病变发展的必备条件【6, 7】,本研究旨在评价NBI宫腔镜应用于子宫内膜癌及内膜非典型增生诊断中的价值。资料与方法:一、研究对象2009年6月~2011年6月在首都医科大学附属北京妇产医院妇科微创中心因异常子宫出血(Abnormal uterine bleeding, AUB)可疑子宫内膜病变实施宫腔镜诊断的患者共189例。病例的排除标准包括:月经期、阴道大量出血、妊娠相关性出血、粘膜下子宫肌瘤、宫颈肿瘤、激素治疗、血液系统相关疾病导致出血、全身状况不能耐受或局部炎症等不适宜行宫腔镜检查者。二、方法1、手术设备:Olympus公司电视宫腔镜系统,包括成像系统(Olympus EXERA II Video);照明系统配备有CLV—S40Pro光源(氙光源),能够提供普通白光和NBI两种模式;5.5 mm连续灌流宫腔检查镜;24F被动式连续灌流宫腔电切镜;5F活检钳;膨宫系统及宫腔灌流系统等部分。2、手术及诊断方法:对于生育期患者宫腔镜检查前采用2%利多卡因宫颈局部浸润麻醉;绝经期患者采用静脉麻醉,术前晚不进行宫颈预处理,若需行宫腔镜电切时给予间苯三酚100mg术中静脉输注以软化宫颈。膨宫液体为5%葡萄糖或5%甘露醇液,膨宫压力为80-100mmHg,灌流液流速260ml/min。手术均由具有5年以上宫腔镜诊治经验的医师进行。(1)阳性病灶诊断标准:将病变在镜下显示为子宫内膜癌及子宫内膜非典型增生图像改变者均记为阳性病灶。图像识别依文献【8】并结合术者的经验进行,阳性病变的诊断须从癌灶形态,血管特征及组织性状等三个方面综合评估,阳性病灶需具备的镜下诊断标准包括:1)内膜增厚突起高于周边内膜,或形成明显肿物;2)异型血管相;3)组织质地糟脆、坏死脱落致表面毛糙不规则等基本特征,其中异型血管相是镜下诊断阳性病变的必备条件。异型血管相在镜下显示为:1)血管分布不均、走形紊乱、或呈裸露状;2)血管直径粗细不均,伴有狭窄、中断、扩张或怒张等;3)特殊形状的血管团,如海葵状、蛙卵状、静脉瘤样等。 (2)宫腔镜检查:宫腔镜下病灶特征由二位术者共同判断,一致意见作为镜下最终诊断。检查时先在白光下进行,全面观察宫腔内病变情况,采集阳性病灶图像,并做出镜下诊断;白光检查后将光源转换为NBI模式,在NBI下再重新评估宫腔内病变情况,重新采集阳性病灶图像并做出镜下诊断。对白光和/或NBI下判定为阳性病灶的部位均行定点组织活检;对白光及NBI下均未发现阳性病灶的部位,于内膜增厚明显处取多点组织送病理;对于绝经后子宫内膜息肉样病变行息肉切除后送病理。(3)病理诊断:标本经固定、切片、染色后由两位病理医师进行评估,两人的一致意见作为最终的病理诊断结果。病理检查采用盲法进行,病理诊断医生不知道宫腔镜诊断结果。白光模式和NBI模式下对子宫内膜病变的诊断以病理诊断作为最后诊断的金标准进行评价。3、统计分析:应用SPSS11.5软件包进行统计分析,计算NBI与白光宫腔镜诊断子宫内膜癌及内膜非典型增生的准确度、灵敏度、特异度、阳性预测值、阴性预测值、漏诊率及误诊率,使用X2检验比较两组之间的差异,以P<0.05为差异有统计学意义。结 果一、宫腔内病变的构成及分布研究纳入患者189例,其中绝经前患者135例,绝经期患者54例,患者平均年龄47.2±6.3岁。共取病灶334份,以病理诊断为金标准,其中包括子宫内膜癌及子宫内膜非典型增生(≧Atypical Endometrial Hyperplasia AEH)在内的阳性病灶共126份,(子宫内膜癌36份、子宫内膜不典型增生90份);子宫内膜良性病变(<AEH)共208份:包括正常子宫内膜55份,子宫内膜息肉、腺瘤样息肉及息肉样增生53份、子宫内膜单纯增生61份,子宫内膜复杂增生39份。以病人为计算单位,子宫内膜癌及内膜非典型增生患者共61例(内膜癌21例,子宫内膜非典型增生40例),子宫内膜良性病变患者共128例。白光下共诊断阳性病灶126份,病理阳性101份,其中13例病灶白光为阳性而NBI阴性,病理1例为子宫内膜轻度非典型增生;NBI下共诊断阳性病灶136份,病理阳性病灶121份,其中23例病灶NBI为阳性而白光阴性,病理阳性21例,其中复杂增生伴轻度非典型增生15例,中度-重度非典型增生4例,重度非典型增生伴局灶腺癌变2例;白光及NBI下均为阴性病灶185份,其中病理阳性5份,均为轻度非典型增生。二、NBI及白光宫腔镜下子宫内膜癌及内膜非典型增生的形态学特点比较对内膜增生凸起、血管有无异型性以及内膜性状的识别是宫腔镜下判断子宫内膜良恶性病变的基本条件,其中血管异型性是形态学诊断子宫内膜癌及内膜非典型增生的必备条件。白光下仅可显示病变表面裸露的血管以及较为表浅部位或粗大血管;NBI模式下不仅使病变表面异型血管形态学改变的特征暴露的更为充分,而且还可以显示内膜下层增生的异型血管,更加全面显示病灶血管网(图1A,图1B;图2A,图2B)。在血管异型性的特征被凸显的背景下,内膜性状如内膜粗糙、坏死、内膜腺体分布等情况可较清晰显示(图3A,图3B),部分典型的内膜癌病灶表面组织坏死脱落,和蓝色及棕色的血管相映衬形成内膜癌特征性的外观杂乱的图像改变(图4A,图4B)。三、NBI与白光宫腔镜诊断子宫内膜癌及内膜非典型增生的评价白光和NBI宫腔镜对子宫内膜癌及子宫内膜非典型增生诊断的准确度(accuracy,Ac)、灵敏度(sensitivity,Se)、特异度(specificity,Sp)、阳性预测值(positive predictive value,+PV)、阴性预测值(negative predictive value,-PV)、误诊率(mistake diagnostic rate,α)、漏诊率(omission diagnostic rate,β),具体指标见表(表1)。NBI宫腔镜可明显提高对阳性病灶诊断的准确度及灵敏度,对病变的漏诊率显著降低;而与白光相比,NBI宫腔镜诊断特异度无统计学差异。表1:白光及NBI宫腔镜诊断子宫内膜癌及内膜非典型增生的评价宫腔镜检查AcSeSp+PV-PVαβ白光283/334(84.7%)101/127(79.5%)182/207(88.0%)101/126(80.2%)182/208(87.5%)25/207(12.0%)26/127(20.5%)NBI313/334(93.7%)121/127(95.3%)192/207(92.8%)121/136(89.0%)192/198(97.0%)15/207(7.2%)6/127(4.7%)X2P值14.0<0.00114.3<0.0012.80.073.9<0.0512.5<0.0012.80.0714.3<0.001讨 论一、NBI内镜诊断肿瘤的特点NBI是一种全新的内镜下显像诊断技术,在NBI系统中通过滤光器将红、绿、蓝3色光谱中的宽带光波进行过滤,仅留下415nm波长的蓝光和540nm波长的绿光。由于血红蛋白吸收的波长在415nm左右,蓝光可以很好地被血红蛋白吸收,从而使NBI内镜能够清晰显示出粘膜表层的微细血管结构和形态;而540nm波长绿光经反射后可以显示粘膜深层的血管,经成像后显现为蓝绿色【9】。因而,NBI对病变识别的最大优势在于可以清晰地观察到病变表面及深层血管的细微形态学改变。在肿瘤发生发展过程中,血管异常增生及形态结构的改变是其最根本特征及必备条件,NBI的应用使内镜对肿瘤性病变的诊断更为客观而准确。目前NBI内镜已广泛应用于胃肠、膀胱、咽喉和支气管等领域中,对于提高肿瘤诊断的敏感性、判定肿瘤的期别、指导肿瘤治疗及随访等都起到了传统白光内镜无法替代的重要作用【10, 11】。二、NBI宫腔镜在子宫内膜癌及内膜非典型增生诊断中的优越性及价值血管的异常增生是实体肿瘤形成的必备条件。大量研究结果表明在子宫内膜癌及子宫内膜不典型增生中同样伴有大量新生血管的形成、血管形态及功能的异常改变。这些异型血管的形成是区别子宫内膜癌、内膜非典型增生与子宫内膜良性增殖,如子宫内膜单纯增生及复杂增生等的重要特征,且血管的异型程度与肿瘤的期别及病人的预后具有明显的相关性【6, 7, 12, 13】,。这些特点奠定了NBI敏感地识别子宫内膜癌及子宫内膜非典型增生的基础。与胃肠及膀胱等部位的应用相比,NBI应用于宫腔内疾病的诊断起步较晚,2007年Olympus将 NBI成像应用于宫腔镜。目前国外已有初步研究显示了NBI宫腔镜对宫腔内疾病的诊断价值【14 15】。我们通过对189例患者的334份病变图像结合病理学诊断进行总结分析,NBI应用于宫腔内病变的诊断有着较为独特的优越性。首先,与其它部位的病变不同,由于子宫内膜在雌激素作用下增殖,子宫内膜的异常增生部分遮掩了血管异型性特点,使异型血管的改变在病变表面并不明显,白光下容易漏诊,而在NBI宫腔镜下子宫内膜深层的血管亦可被清楚显示,从而可明显提高诊断的敏感性、减少漏诊率。我们研究结果显示NBI对子宫内膜癌及内膜非典型增生诊断的灵敏度可由白光的79.5%提升至95.3%。而NBI诊断的特异度与白光相比无统计学差异,即在提高诊断敏感性的同时,误诊率没有增加,并未增加对病灶不必要的活检率;其次,对于异常子宫出血的病人,由于子宫内膜不规则脱落,即使在子宫内膜良性增生性病变,如子宫内膜单纯增生及复杂增生中,病变表面内膜亦可表现为粗糙而不规则,加之异型血管不能被很好显示,使白光对病变性质的诊断很大程度上依靠术者的主观判断,尤其对于经验较为缺乏的医师,白光诊断准确性较差。而在NBI模式下,能将有效显现的异型血管及病变表面的细微结构如内膜腺体增生、扩张、坏死等性状有机结合,使对病变的诊断更为客观而准确。我们研究结果亦证明,与白光相比,NBI诊断子宫内膜癌及子宫内膜非典型增生的准确度明显提高。子宫内膜癌及内膜非典型增生与子宫内膜良性增生性病变在治疗原则上具有本质性差别,宫腔镜诊断的主要目的在于能够敏感地识别病变指导活检以便使疾病得到及时正确的治疗。NBI能够明显提高对子宫内膜病变的识别率,在其指导下的内膜活检可进一步提高对内膜病变的诊断率。尽管本研究结果显示NBI在内膜病变的诊断中具有优越性,目前仍需要大样本的研究,不但要通过更进一步的随机对照研究来验证NBI在诊断子宫内膜癌及内膜非典型增生中的价值;更重要的,是需要通过对大量病变的观察来提取并总结病变的镜下图像特征,为NBI宫腔镜更客观、灵敏、特异的识别子宫内膜癌及子宫内膜非典型增生奠定基础,以发挥其更大的临床应用潜力。
张颖 主任医师 北京妇产医院 妇科微创中心4841人已读 - 论文精选 子宫非典型息肉样腺肌瘤
子宫非典型息肉样腺肌瘤临床治疗分析子宫非典型息肉样腺肌瘤(atypical polypoid adenomyoma,APA)是一类比较少见的宫腔内局灶性、息肉样病变,好发于生育年龄妇女,少部分为绝经后患者。APA绝大部分病例预后良好,但仍有8.8%的患者可发展或合并存在子宫内膜癌。目前随着宫腔镜的临床应用,多数病例在术前即可明确诊断,但由于临床对其生物学特点尚未充分认识,在临床治疗中常存在治疗不足和治疗过度。本研究总结了2005年6至2008年6月北京妇产医院妇科微创中心诊治的10例子宫非典型息肉样腺肌瘤患者的临床资料,对其临床特征、治疗方式及预后进行分析,以总结临床治疗经验,现报道如下。一、临床资料1、资料来源:2005年6月至2008年6月北京妇产医院妇科微创中心收治的子宫非典型息肉样腺肌瘤患者共10例,均有完整的临床资料,回顾性分析其临床特点、治疗及预后。2、一般情况及临床表现:患者发病年龄在27岁至60岁间,平均年龄为41.5岁,绝经期患者3例。生育期妇女主要临床表现为阴道不规则出血、经量增多、经期延长、经间期阴道出血、不孕等,绝经期患者主要表现为绝经后阴道出血、阴道异常排液及下腹痛。本组病例中不孕症患者3例,其中1例曾行IVF-ET失败。1例乳癌根治术后患者服用三苯氧胺1.5年。患者临床资料情况详见表1。3、超声检查:7例患者显示宫腔内偏强的回声,3例病变因部分区域发生囊性变在超声上显示为囊性区或小暗区,1例B超未发现宫腔内明显占位。血流指数可表现为低阻或高阻血流信号(RI 0.35~0.52),5例提示子宫肌层回声不均,提示可能合并子宫腺肌病。4、宫腔镜下形态学改变:所有病例均经宫腔镜检查定点组织病理学诊断。宫腔镜下见病变多位于宫腔下段,或脱出于宫颈口,直径1~4cm不等,表面光滑或呈分叶状,质地柔软或较硬,1例宫腔镜下图像和粘膜下肌瘤不易区分,2例APA-H的病变可见血供丰富和异型血管。5、手术情况:初始治疗:所有患者均进行了宫腔镜下“四步诊治法”进行子宫非典型息肉样腺肌瘤切除及宫腔内膜多点活检术。宫腔镜下“四步诊治法”具体操作如下:①首先从根蒂部完整切除子宫非典型息肉样腺肌瘤(step1);②切除根蒂部周围0.3~0.5cm左右的内膜组织(step2);③切除根蒂下方深约0.3cm左右的子宫肌层组织(step3);④宫腔其余部位的内膜组织多点活检(step4)。将上述各组织分别送病理检查,据病理结果决定是否行进一步治疗。进一步手术治疗:据宫腔镜下“四步诊治法”病理结果,进一步手术治疗共4例。2例高度结构异型指数APA(a high architecture index, APA-H)的患者及1例低度结构异型指数APA(a low architecture index, APA-L)同时合并子宫内膜轻度非典型增生的患者进一步行腹腔镜下全子宫切除术,其中两例绝经期患者术中同时切除了双侧附件;1例功能失调性子宫出血病史的患者子宫内膜病理为复杂增生,进一步行宫腔镜下子宫内膜切除术。6、药物辅助治疗情况:药物治疗2例。1例为APA-L、子宫内膜中度非典型增生的原发不孕患者,术后高效孕酮治疗6个月,目前促排卵治疗中;1例为为APA-L、子宫内膜单纯增生的原发不孕患者,术后经促排卵治疗后妊娠。 另4例APA-L患者,子宫内膜病理未见异常病变,宫腔镜“四步诊治法”术后未行任何辅助治疗,直接转入随诊,其中1例继发不孕的患者术后自然妊娠并分娩。7、随诊及预后:所有患者预后均良好。1例原发不孕子宫内膜中度非典型增生的患者,经高效孕酮治疗后行宫腔镜检查及内膜活检正常转入促排卵治疗;其余患者术后定期B随诊,随访6~34个月,均无复发证据。二、讨论1、病因根据2002年世界卫生组织分类标准,APA属上皮和间叶组织来源的混合性肿瘤发病机制不清,临床发现在Turner’s综合征进行长期激素替代的患者以及长期服用三苯氧胺的患者中APA发病率明显升高,且APA常与子宫内膜增生性病变合并存在,因而有学者认为APA的发生和雌激素刺激有关。2、临床及病理特点(1)发病年龄:文献报道APA好发于生育年龄妇女,平均年龄为39岁(25岁~73岁),96%为绝经前患者,而其中55%患者年龄小于40岁。本组病例绝经期患者比例较高,绝经前患者仅占70%,平均年龄为41.5岁,高于平均水平, 可能与绝经患者比例较高有关。(2)临床表现:APA最常见的临床表现为各种类型的阴道不规则阴道出血,如阴道淋漓出血、经量增多、经期延长、经间期阴道出血等,绝经后的患者最常表现为绝经后阴道出血;APA另一显著临床特点表现为不孕。部分不孕可能源于无排卵,常伴有子宫内膜增生性改变,如子宫内膜单纯增生、复杂增生、不典型增生等,另一部分不孕可能由于APA的存在干扰了宫腔内环境;APA其它临床表现还有阴道异常排液和下腹部疼痛等,可能与病灶脱出宫颈口表面感染坏死和刺激子宫异常收缩有关。(3)B超:息肉样腺肌瘤在超声上可显示以下特点,主要包括:①约30%的病灶中存在囊性区或小暗区。这些囊性区或小暗区在大体标本上多为小的出血灶,可能是由于病变部位内衬的子宫内膜受卵巢激素的影响剥脱出血引起;②病变常伴有后声影。由于病变组织中肌肉细胞增生肥大形成肌束,可与部分子宫肌瘤超声出现相似的后声影;③病变边界清楚但基底部与子宫肌层分界不清,且回声与子宫肌层相似;④常显示合并存在子宫肌层回声不均等子宫腺肌病改变,提示息肉样腺肌瘤和子宫腺肌病在组织起源上具有相关性。上述息肉样腺肌瘤的超声图像特点在区分APA和典型息肉样腺肌瘤病变中并无特异性,有学者尝试使用血流阻力指数来区分这两种病变,但检测表明APA的血流指数可表现为高阻或低阻,与典型息肉样腺肌瘤病变并无差异。(4)宫腔镜下病变形态学改变:宫腔镜下APA病变亦无特异性。镜下见病变常位于宫腔中下段,多数呈息肉样改变,质地较柔软,表面光滑,少数病变质地较硬,和粘膜下子宫肌瘤不易区分。宫腔镜下应特别注意病变血供情况,本组两例APA-H病变血供均较丰富,呈现血管异型。另外,由于APA常合并存在子宫内膜病变,宫腔镜下还应仔细观察子宫内膜情况。APA及合并的子宫内膜病变只有在宫腔镜下定位组织活检才能明确诊断。(5)病理:组织病理学上,APA由子宫内膜腺体和平滑肌组织两种成分构成,所谓的“非典型性”是指子宫内膜腺上皮细胞的异型性和腺体组织结构的异型性。Longacre等根据腺体组织结构的异型程度把APA分为APA-L和APA-H两种类型,认为若病变中含分枝及出芽等复杂结构腺体的成分≥30%时属APA-H,反之,腺体结构异型性<30%时则属APA-L,若APA-H有子宫肌层浸润倾向时则属低度恶性的APA(atypical polypoid adenomyoma with low malignant potential, APA-LMP),与APA-L相比,APA-H治疗后容易复发,但无统计学差异,而APA-LMP则具有反复复发和子宫肌层浸润等特点,部分病例可发展为子宫内膜癌。4、治疗充分认识APA的生物学特点是临床制定恰当治疗方案的基础,目前由于临床对其生物学特点未能充分认识,在治疗上常存在治疗不足和过度治疗。APA在生物学上具有以下显著特点:①大多数APA属良性病变,单纯病变切除即可达治愈;② APA保守治疗(刮宫或切除)术后,总体复发率为30.1%,而APA-H复发率则可达60%,反复复发容易发生子宫肌层浸润;③部分APA病例可合并存在子宫内膜病变,APA合并存在或发展为子宫内膜癌的几率为8.8%,远高于子宫内膜息肉发生内膜癌的风险率(0.8%)。通过以上特点可以看出,大多数APA临床预后良好,因APA好发于年轻或不孕患者,多数病人有生育愿望或要求保留子宫,因此,对于大多数年轻患者而言,采用子宫切除术则属于过度治疗,实施子宫切除不仅破坏了盆底的正常解剖,也给患者造成了巨大的心理压力和精神创伤;然而,鉴于部分APA容易复发并继发或合并癌变,又不能认为APA完全属于良性病变,部分病例应用刮除或单纯切除病变的治疗方法存在治疗不足,延误病情。 如何选择恰如其分的方法来治疗APA?建立在APA病理生理特点的基础上,近年来,我们在临床中应用宫腔镜下“四步诊治法”来充分评估并治疗APA取得满意效果。宫腔镜下“四步诊治法”的优势在于:Step1:宫腔镜下从根蒂部完整切除APA,避免了用传统刮宫方法治疗APA容易发生的病变残留,尤其是根蒂部残留而导致治疗后疾病复发的弊端,而且病变的完整切除便于组织学的全面检查;Step2:病变周围子宫内膜切除,明确病变周围的子宫内膜是否存在或合并子宫内膜病变,并进一步明确APA是否被完全切除而无残留;Step3:病变基底部子宫肌层切除,明确是否存在子宫肌层浸润;Step4:宫腔其余部位内膜组织多点活检,通过对内膜情况全面检查,明确有无合并存在的子宫内膜病变。“四步诊治法”对指导临床选择治疗方案是至关重要的:首先,根据 “四步诊治法”确定是否需进一步手术治疗。若病理提示为APA-H或Step2~4病理结果存在子宫肌层浸润或子宫内膜病变等高危因素时,对无保留子宫愿望的患者应行子宫切除术;反之,若病理无上述高危因素存在,年轻患者可保留子宫和生育功能。我们3例子宫切除患者中2例为APA-H,1例为APA-L合并子宫内膜非典型增生,而对于已排除高危因素保留子宫的患者临床随诊均无复发。因而,“四步诊治法”是临床决定手术范围的基础。其次,根据“四步诊治法”确定是否需进一步药物辅助治疗,尤其对不孕症患者的治疗具有重要指导意义。我们3例不孕症患者,其中1例内膜活检为早分泌期子宫内膜,术后仅对患者指导而自然受孕;1例内膜活检为单纯增生,辅助促排卵治疗而妊娠;1例内膜活检为中度不典型增生,使用高效孕酮治疗6个月,再次宫腔镜检查提示内膜蜕膜样改变,目前正在促排卵治疗中。总之,鉴于APA的病理生理特点,尽管多数病例临床预后良好,仍有部分病例存在高危因素,在临床医师和病理医师密切协作下,应用宫腔镜下“四步诊治法”对病变及宫腔内膜情况进行全面评估是指导临床选择恰当治疗方案的基础。图示1:APA患者宫腔镜手术示意图
张颖 主任医师 北京妇产医院 妇科微创中心2.1万人已读 - 论文精选 腹腔镜下子宫动脉阻断及子宫病灶切除在初治失败的剖宫产瘢痕妊娠中的应用
剖宫产瘢痕妊娠(Cesarean scar pregnancy,CSP) 是特殊的异位妊娠,其发生率约为1: 1800至1: 2216,占异位妊娠的6.1%。由于其解剖部位及病理生理的特殊性,此病目前尚缺少理想的、统一的治疗标准,临床处理不当会发生难以控制的大出血或病情迁延不愈,常导致子宫切除。近年来,我们对初次治疗失败的CSP在腹腔镜下先行双侧子宫动脉阻断后再行子宫病灶切除,成功保留了子宫,取得了满意治疗效果。现将2006年5月至2009年5月间因外院治疗失败而转入我院的4例CSP在腹腔镜下行保守性手术治疗的情况报道如下。一、临床资料1、一般情况:患者年龄28~36岁,平均31.8岁,3例患者既往有1次剖宫产史,1例患者有2次剖宫产史,发病至末次剖宫产的间隔时间为1.8~4.5年,平均为3.1年。2、临床症状及初始治疗情况:例1因停经52天阴道出血,尿HCG阳性,B超提示宫内妊娠,误诊为先兆流产行刮宫术,术中发生阴道大量出血急诊转入我院;例2停经40天,尿HCG阳性,误诊为宫内早期妊娠行药物流产,因无组织物排出而行清宫,清出物病理可见绒毛,术后3周一直有阴道出血,血人绒毛膜促性腺激素( human chorionic gonadotropin, HCG) 265.8 IU/L,B超提示子宫下段不均质回声3.1×3.5cm,凸向子宫浆膜层,局部血供丰富,诊断为CSP,口服米非司酮治疗两周,血HCG降至81.2 IU/L,间断性频繁出现多于平素月经量的阴道出血,B超提示子宫下段不均质包块5.6×4.5cm,血供丰富,血流指数0.23;例3停经42天,血HCG11286 IU/L,外院B超提示为CSP行刮宫术,术后2周仍有阴道淋漓出血,血HCG 8756 IU/L,给予MTX 60mg肌肉注射连用5天后改为口服米非司酮 50mg连续口服3天,血HCG1075IU/L,且瘢痕妊娠范围增大至7.2×5.3cm,在当地医院予以子宫动脉栓塞介入治疗,栓塞术后2周血HCG降至573 IU/L,3周后血HCG再度上升至11367.4 IU/L转入我院;例4停经48天,血HCG10504 IU/L,子宫下段包块直径4.5cm,局部血供丰富,诊断为CSP,行MTX肌注3次后出现阴道多量出血。3、治疗:4例病人均行腹腔镜下子宫动脉阻断及子宫瘢痕妊娠病灶切除术。例1急诊入院后B超检查见前壁下段肌层剖宫产切口处见实性不均质低回声约4cm,诊断为CSP,先在B超引导下于子宫下段放置宫腔球囊注入生理盐水20ml以暂时压迫止血减少阴道出血量后再行腹腔镜手术。腹腔镜下见4例妊娠病灶均向子宫浆膜层突出,病灶表面血管怒张。例2与例3包块较大,向两侧阔韧带内延伸。术中先行双侧子宫动脉阻断术,具体手术操如下:于宫骶韧带上方2cm 处打开阔韧带后叶分离出子宫动脉,以1号dexon线结扎阻断子宫动脉血供。双侧子宫动脉阻断后,撤出例1宫腔压迫球囊阴道活跃出血停止。子宫动脉阻断后再行病灶切除术,打开膀胱子宫反折腹膜下推膀胱后,先在腹腔镜监护下进行吸宫术,吸取大部分妊娠组织待包块明显减小后再行病灶切除。术中见妊娠种植处子宫肌壁组织菲薄,与正常子宫肌层组织间有明显分界,切除病灶后于子宫切口处以MTX50mg多点注射后再连续缝合子宫肌层。4、结果:所有手术均一次性顺利完成,无中转开腹,无手术并发症。手术时间60~80分钟,平均68.2分钟;手术失血量30~70ml,平均50ml;术后病人均恢复良好,病理在切除的子宫肌层瘢痕组织中均可见绒毛,血HCG术后3周均降至正常,月经恢复来潮时间23~35天。术后随访3~35月,月经均规律,术后患者均避孕,尚无妊娠发生。二、讨论1、剖宫产瘢痕妊娠治疗失败原因分析:CSP具有特殊的病理生理基础。首先,CSP的妊娠囊不在宫腔内,绒毛种植在子宫较低部位的剖宫产瘢痕处随后再进一步向宫腔内或向子宫浆膜层方向生长;其次,剖宫产瘢痕处存在子宫肌层缺陷,通常在超声下可见膀胱和妊娠囊间子宫肌层薄弱或缺失,部分妊娠囊向子宫浆膜面突出。由于胚胎种植处子宫肌层组织明显缺陷,蜕膜血管形成障碍,导致血管异常增生。建立在这些病理生理基础上,通常刮宫术不应作为CSP的初始治疗方案,本文两例采用刮宫术治疗均失败。主要原因在于:刮宫不但难以完全清除瘢痕内部的妊娠滋养层组织,残存的绒毛可继续生长导致治疗失败;而且由于着床部位子宫肌层薄弱容易发生子宫穿孔甚至损伤膀胱;再者,子宫瘢痕处薄弱的子宫肌层组织缺乏有效的子宫收缩止血机制,文献报道约76. 1%的病人刮宫时可发生难以控制的大出血。对于CSP的药物治疗,文献报道成功率不一,由于妊娠部位瘢痕纤维组织形成使药物渗透性较差,且妊娠物不能及时排出,导致病情迁延不愈,盆腔感染机会增加,治疗过程中局部组织坏死有再次发生大量出血的可能。近年来子宫动脉栓塞术(uterine artery embolization,UAE)逐渐应用于CSP的治疗,UAE可显著减少病灶血液供应可达到迅速止血的目的,同时疤痕病灶局部缺血缺氧促进胚胎及滋养细胞坏死、萎缩。由于随着栓塞后侧支循环的形成残留的绒毛组织可继续生长,因而,应慎重选择UAE单独作为治疗CSP的手段,特别是在妊娠病灶较大的情况下,局部组织坏死后吸收困难。本文一例应用UAE治疗失败,此种情况下UAE后应配合其它的保守性治疗方法。 2、腹腔镜下子宫动脉阻断及病灶切除的治疗优势:CSP初治失败最常见的原因为发生急性大出血或妊娠组织未被完全清除导致病情迁延不愈。因而,及时有效止血及病灶彻底去除是保证再次治疗成功的关键。对于病程较长的患者妊娠包块通常较大,如何彻底去除病灶是临床需慎重考虑的问题。既往对于初治失败的病例多选择子宫切除术,但子宫切除给年轻女性带来巨大的心理压力及精神创伤,尤其对于仍有生育要求的患者难以接受。建立在CSP病理生理机制基础上,多数学者认为对瘢痕部位妊娠病灶切除同时进行切口缝合而保留子宫是目前治疗CSP的最佳办法。病灶切除不仅可避免妊娠组织残留,术后血β-hCG可迅速恢复正常;而且绒毛种植处的瘢痕组织存在明显缺陷,完全切除可有效去除瘢痕部位的微小腔隙,有效避免再次发生CSP,有利于恢复正常妊娠。由于病灶部位血供丰富,切除过程中易发生大量出血,开腹手术可迅速缝合止血,因而CSP病灶切除多经开腹途径完成。随着UAE的应用可显著减少病灶部位的血液供应,为腹腔镜手术提供了安全有效的保证,腹腔镜下病灶切除及子宫修补具有手术时间少、住院时间短、病人恢复快等优点。但由于UAE不仅设备和操作技术要求高,而且不能和腹腔镜手术同次完成,医疗费用高,难以在临床推广应用。近年来我们采取了在腹腔镜下先行双侧子宫动脉阻断以减少病灶的血液供应后,再进行瘢痕妊娠病灶切除及子宫修补。这种手术方式不仅确保了手术的安全性及有效性,而且两种手术操作均可在腹腔镜下完成,明显减少了医疗费用开支,符合卫生经济学的原则。值得一提的是,当双侧子宫动脉阻断完成后,打开膀胱反折腹膜下推膀胱,然后在腹腔镜监护下吸宫,待妊娠包块体积明显缩小后再进行病灶切除,吸宫后可明显辨认胚物种植处子宫瘢痕肌层组织菲薄,和正常子宫肌层组织间有明显分界,这种方法可有效降低病灶切除难度、减少手术并发症并缩短整体手术时间,更凸显了腹腔镜手术的优势。本文4例手术均顺利完成,术中平均失血量仅50ml,术后迅速恢复正常。总之,随着腹腔镜技术的日臻成熟以及对CSP认识的深入,腹腔镜下子宫动脉阻断及病灶切除具备了微创、确效、经济等优点,将成为治疗初治失败CSP病例的有效方法。
张颖 主任医师 北京妇产医院 妇科微创中心5158人已读





