杨学勇医生的科普号
- 精选 一个来自南京家属的感言!
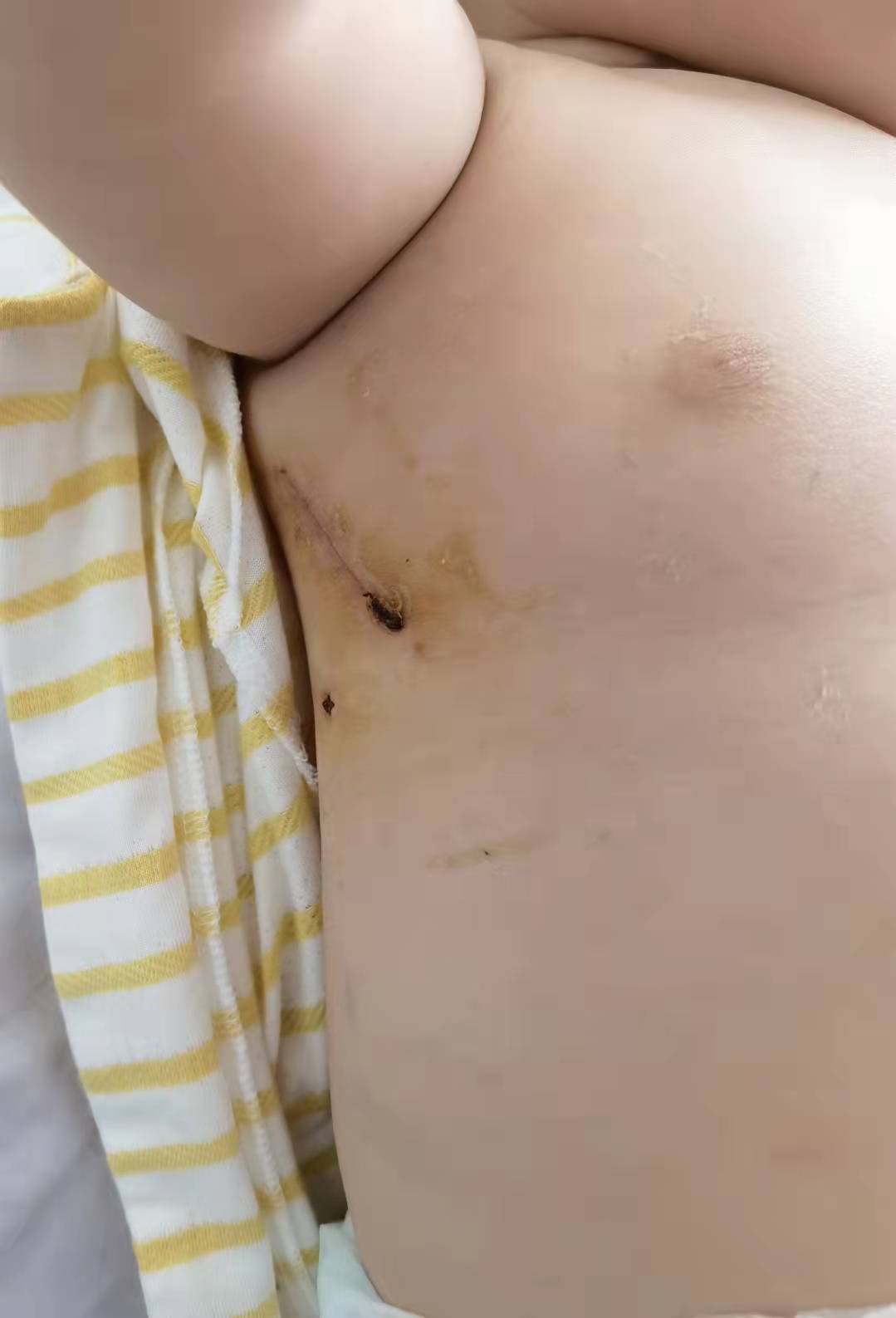
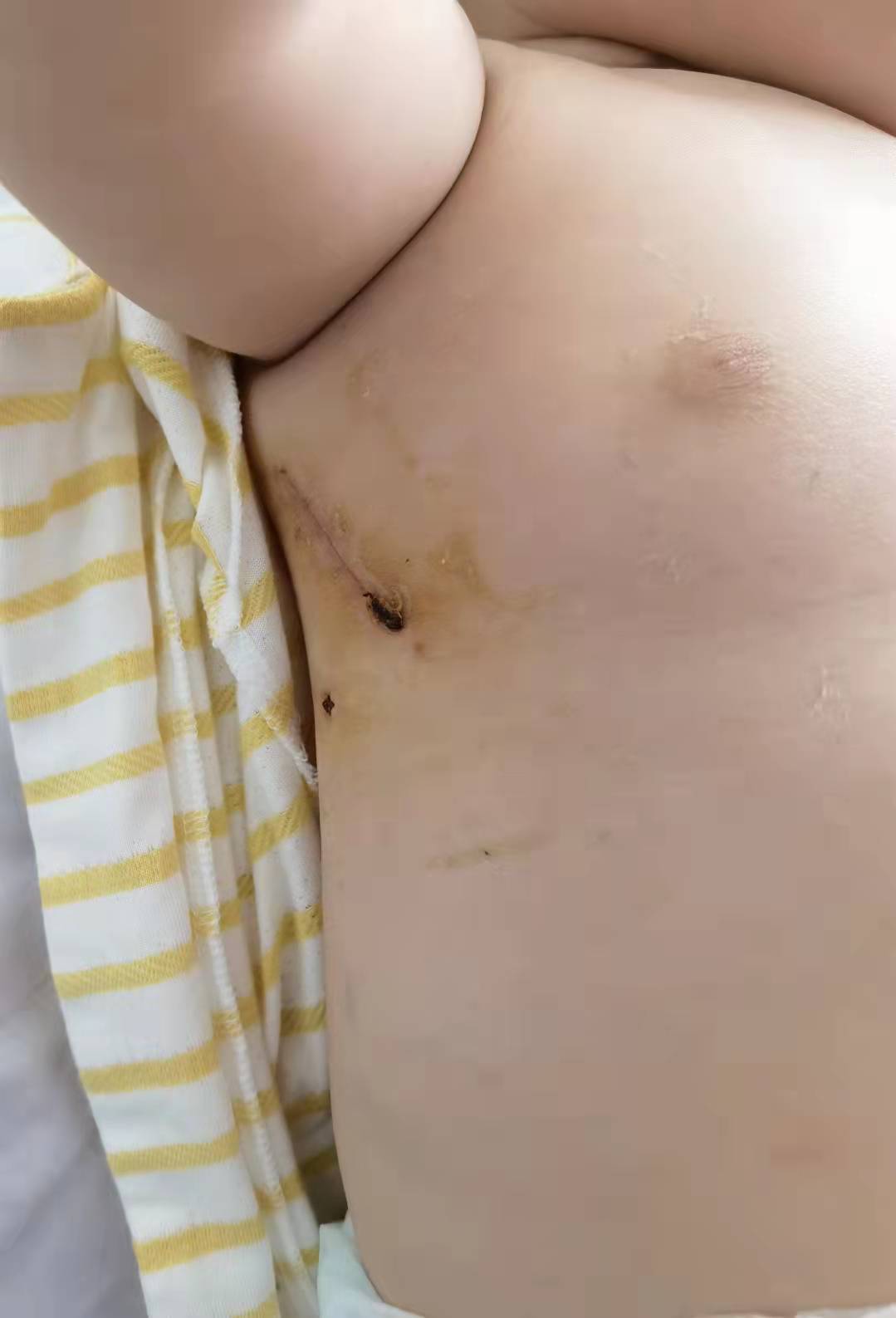
作为一名术后患儿的家长,我要发自肺腑的说一句:选择京都心胸外科真得是我最正确、最佳的、最好的选择!我儿是7个月室缺9mm和肺动脉高压,虽说手术不算难也不算棘手,但我在我们南京##医院三次会诊均要求正胸开刀,不建议采用侧切。对于一个小小孩来说,正胸开刀意味着漫长的术后恢复期(胸骨断裂),留下的长疤痕会给小孩成长带来深深的自卑,甚至还有鸡胸的可能。在无助彷徨之际,当我们把心超材料给到杨学勇主任看时,杨主任当即回复,他本人和京都的团队在右侧切技术非常成熟,我儿的情况完全可以到京都来进行右侧切,术后10左右能出院。经过反复查阅网上资料,我们知道京都心胸外科是响誉国内外的刘迎龙教授亲自领衔,更有刘迎龙教授的首席高徒杨学勇主任等一众原安贞的主刀医生加盟,麻醉师更是安贞小儿麻醉最好的欧阳川主任。这个基本是我们小老百姓能找得到,够得着的中国小儿心胸最强团队。我们联系上京都的那个主任,那个主任就能帮我们主刀,没有什么上海乱七八糟点刀费。所以我们毫不犹豫马上选择到京都来给我儿办理住院手术。果然一切都是我能想到的最好情况,主刀医生杨学勇主任不但医术精湛,技术高超(我儿手术前后3.5个小时,除去麻醉时间,实际杨主任用了1个多小时就完成了手术,手术切口4-5厘米),而且医德高尚,无时无刻耐心地解答我们家长的任何疑问,急我们家长之所急,常常下了手术第一时间就回复我的疑问,减轻我们的焦虑。术前晚上是张文凯主任为我作的术前讲解和告知。前后将近2个小时的时间,张主任不厌其烦的,耐心的跟我讲解了和回答了我所有的问题,并且无时无刻不在安慰我们家长,让我们更有信心将小儿送到手术台。术后在cuu的两天,两位主任下了手术会给我们发小孩的照片,让我们能看到小儿,极大缓解我们的思念。两天后小儿就能转二级病房了,我们家长可以派1人到二级病房照顾,这跟我们南京的医院7天不能相见真得相差太大,不但能让我们家长看到照顾到患儿,还能充分减轻小儿的惊恐与抛弃感,大大有助于患儿康复。在二级病房期间,不但杨主任,张主任等来关心康复情况,而且还好几次看到刘迎龙教授一个个去关心每个宝宝的康复情况(刘教授就亲自仔细去看我儿心电监护仪器20多秒,看看是否正常)我们从来没敢想过,我儿居然术后5天就能哈哈大笑,精气神恢复到到之前一样,而且脸色红润,应该很快就能出院了。这一切都离不开京都小儿心胸外科医疗团队高超医术和体贴的照顾!再一次衷心感谢我儿的救命恩人杨学勇主任,给了我儿拥抱健康,快乐成长的人生!感谢张文凯主任日常的照顾,感谢京都儿童医院小儿心胸外科全体医疗团队的帮助!愿天下所有先心患儿都能遇到刘迎龙教授、杨学勇、张文凯主任这样的医者。愿天下所有先心患者都能康复,健康成长!---周#爸爸2021-9-11
 杨学勇 主任医师 北京京都儿童医院 儿科177人已读
杨学勇 主任医师 北京京都儿童医院 儿科177人已读 - 精选 帮助他人 快乐自己———顶级团队的呵护!
北京安贞医院原小儿心脏中心主任、著名心脏专家、右侧腋下切口的开创者刘迎龙教授、原安贞医院小儿心脏中心外科组长杨学勇主任、原安贞医院小儿麻醉中心主任、全顶级麻醉师欧阳川教授、原安贞医院小儿心脏中心超声主任、著名小儿心脏超声专家耿斌主任、安贞医院体外循环科何美玲主任等一起组成顶级专家团队,在北京京都儿童医院为先心病宝宝提供全天候优质医疗服务。北京京都儿童医院是一家大型三级儿童专科医院,医保定点,就医环境温馨,管理人性化,住院可以2个家长陪护,极大减少了孩子的恐惧感和家长的焦虑。我们团队擅长右侧腋下小切口手术治疗先心病,特别是年龄在3个月到一岁的宝宝。目前体重最小的约3.5公斤,年龄最小的刚刚满月,最大体重106公斤。我们的宗旨:帮助别人、快乐自己!其它医院能做的我们希望做得更好,其它医院不能做的可以来我们这里看看,也许有机会!本科宗旨:省钱、省事、看好病!
 杨学勇 主任医师 北京京都儿童医院 儿科111人已读
杨学勇 主任医师 北京京都儿童医院 儿科111人已读 - 精选 室间隔缺损合并重度肺高压危险吗?
所谓血压,就是血液对血管壁产生的压力,是血液流动的动力。平常所说的高血压,指的是主动脉里的血压高了,而肺动脉高压指的就是肺动脉里的血压高了,简称“肺高压”。那肺动脉压力多大算肺高压,如果在海平面、静息状态下,经右心导管检查测定的肺动脉平均压大于或等于25毫米汞柱,就可以诊断为肺高压。肺动脉平均压(毫米汞柱):轻度26~40;中度41~55;重度>55。室间隔缺损合并重度肺高压危险吗?从文献和临床经验来看,2岁以内的肺高压一般对宝宝有保护作用,特别是半岁以内的宝宝!肺高压是宝宝的保护神,没有肺高压,可能宝宝在生后就需要马上手术了。这是为什么呢?这是室间隔缺损这种先心病和宝宝的生长发育决定的。室间隔缺损对宝宝的危害来自于缺损产生的左向右分流,分流越大,对宝宝影响越大。而肺动脉高压恰恰能减少左向右分流,造成一种虽然有缺损,分流却很少的现象。因为分流是因为缺损两侧有压力差所致,而肺动脉高压正好能减少这种压差。这就很容易解释,刚出生的宝宝,肺动脉压很高,宝宝虽然有大的室间隔缺损,却能正常发育,吃奶和呼吸都很好。随着月龄增长,宝宝的肺动脉压有个逐步下降的过程,一般生后3个月到正常水平,也就是平均压25毫米汞柱,宝宝的症状越来越重,吃奶和呼吸越来越费力,体重也增长缓慢。而这时候家长以为是肺动脉高压所致,实际上是肺动脉压下降所致。当然超过2岁,肺动脉高压的危害就会逐步显现,所以手术一般不要拖过2岁。
 杨学勇 主任医师 北京京都儿童医院 儿科52人已读
杨学勇 主任医师 北京京都儿童医院 儿科52人已读 - 精选 胎儿超声心动图的最佳孕周选择
目前推荐低风险的孕妇在20-23周之间作胎儿超声筛查先心病,而高风险的孕妇则在12-14周。当可以选择终止妊娠时,诊断越早对孕妇越好,可以使痛苦减到最小。然而妊娠早期胎儿心脏体积小,超声图像清晰度欠佳,诊断准确响,且胎儿心脏是动态发育过程,一些早期不明显,但是会随孕期的推移进行性发展的先天性心脏病无法在早期检出。因此,妊娠早期超声心动图检查只适用于高危胎儿,常需要至18-24周时复查,以提高胎儿心脏畸形显示率和精确性。在妊娠18~24周时,胎儿心脏发育已逐渐趋向完善,心内结构显示清晰,且胎儿活动度大,羊水量多,各种切面的显示率可达100% ,故在此时进行超声心动图检查最佳。妊娠晚期检查时,由于羊水减少,胎儿较大,体位相对固定,且枕前位居多,透声窗较差,声束容易受胎儿脊柱及肋骨声影影响而难以显示清晰的图像,检查效果较差。
杨学勇 主任医师 北京京都儿童医院 儿科2.1万人已读 - 精选 先心病术后注意事项
(1)6个月以内的先心病患儿宜母乳喂养;(2)如因特殊情况无法进行母乳喂养,需进行人工喂养时,人工喂养儿主食应是牛奶或奶粉,每天每千克体重给牛奶100~150毫升,适当加食糖和奶糕;(3)6个月以上的婴儿,除主食牛奶或奶粉外,要加辅食如米粥、菜泥、果泥、鱼糜、肉糜等;(4)1岁以上小儿可吃的食物较多,原则仍应少量多餐。避免吃在肠内产气的食物。如山芋、土豆、萝卜、蚕豆等,限制过量咸食;(5) 天气热时适当增加饮水量;(6)若患儿患有其他疾病时应适当减少饮食量;(7) 有心力衰竭症状的患儿,给低盐、少渣、半流质饮食;(8)应定期检查体格,观察营养是否充足,必要时请营养专家作饮食辅导。
杨学勇 主任医师 北京京都儿童医院 儿科2万人已读 - 精选 早产儿动脉导管未闭的床旁外科治疗
动脉导管未闭(PDA)是常见的先天性心脏病,其发病率在先天性心脏畸形中占第二位。PDA可以通过外科手术、介入和药物三种方法治疗。在早产儿中,PDA发病率很高,体重低于1750克的早产儿中45%有PDA,超过70%的PDA可以通过内科保守药物治疗而痊愈,但是对于那些比较粗大、严重影响心肺功能的PDA往往需要外科手术[4]。早产儿由于其各脏器发育不完全,PDA手术麻醉等方面与其它年龄阶段的儿童相比有很多特点,国内这方面的报道很少。现将我院1年多来NICU床旁手术治疗早产儿PDA的经验体会总结报道如下。1 临床材料和方法1.1 临床材料 2009年10月至2011年5月,经内科保守治疗无效的35例PDA患儿中,男22例、女13例,胎龄27 周~34 周,出生体重0.72~2.25kg(平均体重1.48kg)。其中低出生体重17例、极低出生体重15例、超低出生体重3例。35例患儿中有33例使用布洛芬治疗PDA失败,2例因伴有严重出血倾向未予布洛芬治疗而直接行手术治疗。全部35例患儿中,合并新生儿肺炎29例(83%)、新生儿呼吸窘迫综合症26例(74%)、新生儿贫血26例(74%)、低蛋白血症18例(51%)、严重的电解质紊乱16例(46%)、肺出血11例(31% )、颅内出血8例(23%)、心功能不全6例(17%)及坏死性小肠结肠炎4例(11%)。术前35例病例中32例使用呼吸机辅助呼吸治疗,术前呼吸机治疗时间最长29 天,其中5例因术前病情突然恶化急诊行手术治疗。1.2 诊断、麻醉和手术方法1.2.1 术前诊断 35例患儿入院后均给予床头超声心动图检查明确PDA诊断,其中33例经内科药物(布洛芬)保守治疗1~2疗程后,再次复查超声心动图明确动脉导管仍未闭合,心肺功能明显受损,不能脱离呼吸机或氧气,转而实施手术治疗;其余2例因术前存在药物(布洛芬)治疗禁忌症[,故未予药物处理,而直接行手术治疗。1.2.2 手术麻醉方法 所有患儿均在百万级NICU层流监护病房实施手术。术前准备:(1)应用抗菌素控制感染等;(2)术前三天应用Vk1等药物控制肺出血、颅内出血等;(3)术前均需要持续机械通气并准备两条静脉通路,动脉穿刺持续监测血压,一般选择胫后动脉、足背动脉或者股动脉;(4)术前将患儿移至恒温辐射台上,设定温度在32~34摄氏度,连续监测心电图、有创动脉压和血氧饱和度等。麻醉方法:(1)选用静脉麻醉方法,药物包括咪达唑仑0.1mg/kg,芬太尼5~20μg/kg,维库溴铵0.1~0.2mg/kg;(2)术中维持收缩压大于40mmHg,如果血压偏低,则泵入多巴胺,最高剂量达20μg/kg/min;(3)术中维持经皮血氧饱和度大于85%,如果手术操作中饱和度低于此值,需要暂停手术,手控呼吸,纯氧通气,使左肺完全膨胀,待血氧饱和度改善后再继续进行手术。 手术方法:全麻后患儿右侧卧位,取左胸后外侧第4肋间为手术入路,切口长约2 cm,逐层切开肌层,沿第5肋骨上缘切开肋间肌进入胸腔。牵开左肺暴露降主动脉,沿其长轴、靠近脊柱侧用电刀纵行切开降主动脉表面的后纵隔胸膜,上端到左锁骨下动脉起始部,下端超过动脉导管下方约1 cm,牵引线3~4针悬吊肺动脉侧胸膜使其遮挡左肺暴露动脉导管。游离导管均采用将动脉导管的降主动脉端充分游离,用直角钳先将10号丝线的一端从导管上窗由内向外绕过降主动脉后面牵出,然后再将此端绕过降主动脉后面从导管的下窗送回,完成对导管的环套。闭合动脉导管方法:双10号线结扎动脉导管;单10号线结扎动脉导管+钛夹钳钳夹;单纯钛夹钳钳闭动脉导管。结扎和(或)钳夹后探查导管区震颤消失。不关闭后纵膈胸膜。在第7肋间腋中线上放置引流管后关胸,术毕返恒温暖箱监护治疗。2结果 无术中死亡病例,没有术中大出血,35例患儿PDA结扎后平均动脉压均有不同程度升高,平均动脉血压最多升高30 mm Hg,最小升高6 mm Hg,(平均13.2 mm Hg)。脉压减小,术后患儿呼吸机辅助通气,呼吸机辅助时间最短3天,最长为2周(平均1周)。其中33例患儿术后恢复良好顺利出院,2例患儿因术后出现多功能脏器衰竭死亡。3 讨论 动脉导管为胎儿时期降主动脉和肺动脉之间的正常通道,正常新生儿出生后10~15小时,由于动脉导管管壁肌层收缩,管腔在功能上消失,达到功能性关闭,3个月内管壁进行性闭合,达到解剖学上的关闭。如果关闭机制异常使导管延迟关闭,即为动脉导管未闭。超声心动图可以明确诊断。早产儿因为生后氧诱导动脉导管收缩机制不成熟,而且动脉导管对血管活性物质的反应敏感性增高,往往导致其动脉导管持续开放[ 5, 6]。据统计,每2500~5000名活产婴儿中有1例PDA,在早产儿中,PDA的发病率明显增高,体重小于1000克者可高达80%[4]。 PDA由于动脉水平的分流,有可能导致心肺功能的衰竭危及生命。1939年,Gross等第一次成功结扎动脉导管,是PDA外科治疗的里程碑,PDA成为第一种可以通过外科手段治愈的先心病 [7]。1967年Porstman成功地利用心导管经过动脉将聚乙烯海绵塞子填塞未闭的动脉导管,开创了介入疗法,丰富了PDA治疗的手段[8]。介入疗法简便安全,无开胸所具有的风险,患者恢复迅速,逐渐取代开胸手术。但是介入治疗要求患儿体重要超过4Kg,这明显不适合早产儿。Heymann等首先报道药物治疗动脉导管未闭[9]。药物主要包括消炎痛和布洛芬(前列腺素的抑制剂),通过抑制前列腺素的合成来促进导管的闭合。与消炎痛相比,布洛芬疗效相同,副作用小。布洛芬为治疗早产儿PDA首选药物。 早产儿PDA通常采用药物保守治疗,可以使有明显血流动力学意义的PDA手术率大大降低。对那些药物治疗无效,而且尽管有适当的抗心衰治疗,但仍依赖呼吸机的早产儿,外科手术是主要治疗手段。本组35例患儿中33例曾经应用布洛芬治疗1~2个疗程,动脉导管仍然不能闭合,患儿仍然依赖呼吸机或者不能脱离氧气,PDA导致心肺功能衰竭进而影响其他脏器,患儿生命垂危。手术后,心肺功能明显改善。逐渐脱离呼吸机和氧气,恢复正常生长。手术时间约30分钟,出血量不超过5ml,创伤小,没有切口感染。我们认为对药物无效的早产儿动脉导管未闭,及时手术是明智选择。在初期,因为认识不足,手术时机把握不准,2例患儿合并了多脏器功能衰竭,特别是大量的肺出血后才手术,虽然成功结扎了动脉导管,但仍然没有能挽救患儿生命。从我们的经验来看,直径超过主动脉根部直径一半的PDA对患儿心肺功能影响重大,如果内科保守治疗无效,应该及早手术,否则可能会丧失治疗机会;而导管直径小于主动脉直径的一半时,患儿多能较好耐受,可以等待观察,将来如果不能闭合可以选择介入或者手术。 早产儿的各个脏器发育不完全,对外界环境适应能力差,从儿科病房向手术室的转运过程往往需要呼吸机、暖箱和许多监护设备,需要多方协调配合,人员需要多,这些困难使早产儿心脏手术在许多单位不能开展。我们单位NICU为百万级层流监护病房, 呼吸机和监护设备齐全,具备完成手术所需的无菌、麻醉和监护等条件,为手术的成功创造了极为有利的条件。 针对早产儿,我们在麻醉手术过程也做了相应改进。在手术时麻醉师密切监测患儿心率血压等指标,特别是经皮血氧饱和度,后者可以作为手术中心肺功能监测的敏感指标。在儿童或者成人,手术中较长时间压迫左肺也不会明显影响心肺功能,而早产儿略长时间压迫左肺往往导致血氧饱和度下降,进而影响心肌收缩,危及患儿生命。在手术中,如果血氧饱和度降至85%,我们会暂停手术操作,等麻醉师充分膨胀肺组织,血氧饱和度恢复正常后再重新开始手术。 早产儿动脉导管组织菲薄,稍有不慎就可能导致破裂,危及生命。手术中,我们均采用充分游离导管的降主动脉端,通过丝线的两次穿过降主动脉后面达到环套导管的目,避免直接游离导管,操作简便,手术风险大大降低。对于导管处理,初期采用单纯丝线结扎闭合导管或者单纯钛夹钳钳夹,一例出现喉返神经损伤,术后分析误伤的原因主要是单纯钛夹钳钳夹时局部组织游离不充分所致。现在我们均采用先游离动脉导管,用粗丝线结扎导管一道,结扎时切忌勿牵拉导管,避免大出血,再用钛夹钳在结扎线的降主动脉侧钳夹导管一道,这样可以减少再通的机会,同时减少单纯钛夹钳钳夹损伤喉返神经和钳夹导管组织不完全的机会。 本组资料显示,对于内科保守治疗无效的粗大的早产儿PDA及时手术常常可以挽救患儿生命,NICU可以满足手术需要。丝线结扎和钛夹钳钳夹结合,手术风险小,手术成功率高。床旁PDA手术值得推荐。
杨学勇 主任医师 北京京都儿童医院 儿科7243人已读 - 精选 什么是肺动脉高压?
在我国,由于经济、技术等方面的原因,许多先天性心脏病患者就诊延迟,常常合并严重的肺动脉高压,失去了最佳的手术时机,他们是否能从手术中获益是摆在医护人员面前的主要课题。肺动脉高压属于肺高血压。肺高血压是指肺内循环系统发生高血压,包括肺动脉高压、肺静脉高压和混合性肺高压。整个肺循环,任何系统或者局部病变而引起的肺循环血压增高均可称为肺高血压,对应英文为“pulmonary hypertension”。 肺动脉高压是指孤立的肺动脉血压增高,而肺静脉压力正常,主要原因是肺小动脉原发病变或其他的原发疾病而导致的肺动脉阻力增加,表现为肺动脉压力升高而肺静脉压力在正常范围内,所以需要肺毛细血管楔压(PCWP)正常才能诊断,对应英文为“pulmonary arterial hypertension”。 肺高压的诊断标准是:在海平面状态下、静息时、右心导管检查肺动脉收缩压>30 mm Hg(1 mm Hg=0.133 kPa)和(或)肺动脉平均压>25 mm Hg,或者运动时肺动脉平均压>30 mm Hg。此外,诊断肺高压,除了上述肺高压的标准之外,尚需包括肺毛细血管楔压≤15 mm Hg。需要强调,严格的诊断标准应参照右心导管检查数据,并非无创检查手段(比如彩色超声多普勒等)估测的数据。
杨学勇 主任医师 北京京都儿童医院 儿科1.2万人已读 - 精选 室间隔缺损的相关常识
室间隔缺损((Ventricular Septal Defect, VSD)是指两个心室的间隔组织完整性遭到破坏,致左右心室之间形成异常交通,有先天性和后天性之别,可作为单独畸形存在,也可以是其他复杂心脏畸形的一个组成部分,如法洛氏四联症、完全性房室管畸形、大动脉转位、三尖瓣闭锁和永存动脉干等。 一、发病率VSD作为唯一或者主要病变,其发生率在新生儿中约为0.2%。VSD在先天性心脏病中的发生率在新生儿中约为12-20%,是所有先天性心脏病中发病率最高的一种。二、胚胎发育与发病机制胚胎发育至第1月末,管型的单腔心脏即有房室之分。第2个月初,原始心腔开始分隔,伴随心房间隔的形成,心室底部出现原始心室间隔肌肉部,沿心室前、后缘向上生长,逐渐把心室腔一分为二,其上方中央部尚保留有半月形的室间孔。随着心腔的发育,心室孔逐渐缩小,正常与第7周末,由向下生长的圆锥隔,扩大的背侧心内膜垫右下结节,及发育的窦部间隔相互融合,闭合室间孔,形成完整的心室间隔,将左右心室腔完全隔开。如果在此发育过程中出现异常,即会造成相应部位的心室间隔缺损。一般系单个缺损,偶见多发者。 三、病理解剖及分型室间隔缺损可发生在室间隔各个部位或其交接部,临床上常用的是根据胚胎发育情况所划分的膜周型缺损、漏斗部缺损及肌部缺损三大类型,其中膜周部缺损最多见,漏斗部缺损次之,肌部缺损较少见。
杨学勇 主任医师 北京京都儿童医院 儿科8383人已读 - 经典问答 修补心脏的自体心包能被吸收而需要再次手术吗?
近日有先心病的家长问:杨医生好,听说心包修补房间隔缺损后10年,心包会被吸收,房间隔缺损会再次出现,需要再次手术,是真的吗?我肯定地回答:不可能!我专门查阅了国内外的相关文献。自1957年Gross首次将自体心包用于扩大右室流出道到现在,已经60多年。自体心包片作为心脏手术的修补物被国内外学者广泛应用,包括房间隔缺损修补、室间隔缺损修补、肺动脉扩大、右室流出道扩大、先天性主动脉瓣膜孔型缺失、三尖瓣成型、二尖瓣成型等等,而且应用范围在不断扩大。其实早在1970年HitoshiMohri教授等为了研究大动脉转位手术治疗中用自体心包做板障分隔心房内血流的科学性,就通过实验论证了心包补片是房间隔缺损永久性修补材料,无需更换。自体心包片用于先心病心脏直视手术的修补具有以下优点:①取材方便;②组织相容性好,抗感染力强,可避免绦纶片产生的感染性心内膜炎、溶血、栓塞之危险,残余漏发生率低;③有良好的柔顺性、机械强度大等。结论:自体心包安全可靠。 参考文献:[1]刘锦纷,郑景浩,苏肇伉,等.带瓣自体心包片重建右室流出道的临床研究[J].中华胸心血管外科杂志,2004,20(3):155.[2]陈绪发,朱晓东,陶凉,等.自体心包条加固三尖瓣瓣环成形术[J].中华胸心血管外科杂志,2003,19(2):120.[3]徐志云,张宝仁,邹良建,等.应用自体心包行器质性三尖瓣病变瓣膜成形术[J].中华胸心血管外科杂志,2003,19(6):376.[4]胡志伟∙自体心包片修补先天性心室间隔缺损62例临床报告∙临床心血管病杂志[J]1994,10:349.[5]SchoofPH,HazelkampMG,vanUlzenK,etal.Autologouspericardiumforventricularseptaldefectclosure.JHeartValveDis1998;7:407-409.[6]UllmanMV,GorenfloM,BolenzC,etal.Lateresultsafterextendedpulmonaryarteryreconstructioninthearterialswitchoperation.AnnThoracSurg2006;81:2259-2266[7]HitoshiMohri,etal. FateofautologouspericardiumandDacronfabricusedassubstitutesfortotalatrialseptumingrowinganimals.JThoracCardiovaseSurg,1970;59:710.
 杨学勇 主任医师 北京京都儿童医院 儿科70人已读
杨学勇 主任医师 北京京都儿童医院 儿科70人已读 - 就诊指南 室间隔缺损修补术----“风险最大”的心脏手术
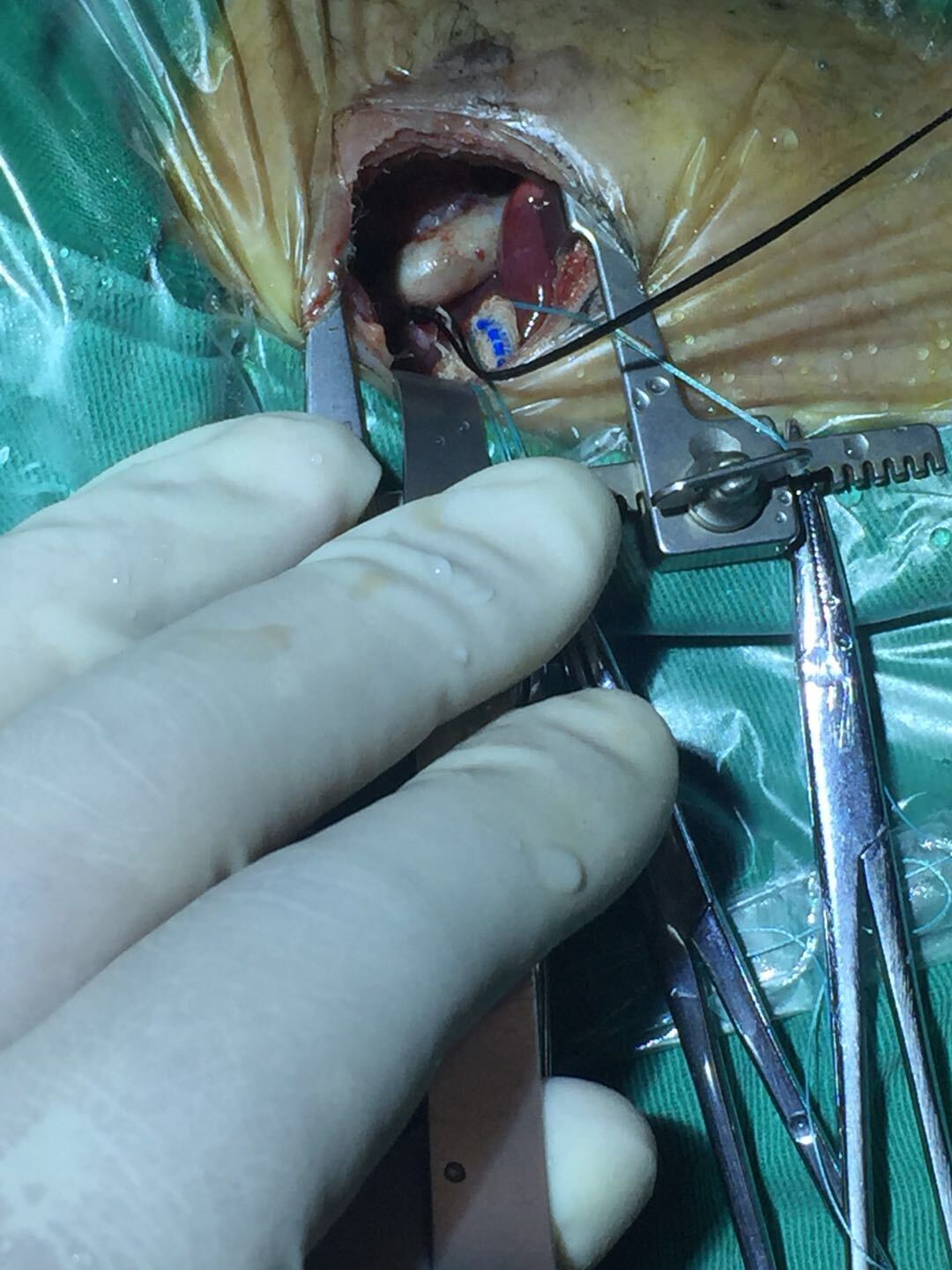
众所周知,室间隔缺损修补是最简单、最基础的先天性心脏外科手术,但为什么又是“风险最大”的先心病手术呢?今天就来分析一下。随着介入手术的逐步开展,大多数简单先心病,比如房间隔缺损和动脉导管未闭,均被内科介入封堵,不再需要外科。对外科医生来说,室间隔缺损就成为最先面对的先心病,初期练习操作的就是这种先心病。在有足够多的锻炼机会下,大约需要10-15年才能成熟。成熟外科医生之间的操作成功率差别就极小了,差别主要在于责任心。有经验的和新手之间的差别是巨大的,但为了年轻医生的成长,总是需要给机会,特别是在大的实习医院,导致室间隔缺损中很大一部分由未成熟的年轻医生主刀,术后并发症发生概率当然就会明显增大。总体统计下来,室间隔缺损反倒成了“风险最大”的先心病。其实我认为室间隔缺损修补术从来都不简单,需要高度重视。原因有两个:一、它是心脏外科操作的基础,室间隔缺损变化多端,缺损恰好在心脏的中心部位,稍微不留神,就容易损伤其周围重要的组织,导致无法挽回的损害。在我从医30年当中,几乎没有碰到过两个完成相同的室缺;二、鉴于心脏外科的复杂性,需要协调外科医生、麻醉医生、体外循环师、器械护士、巡回护士等等来进行团队协作才能准确高效地完成手术,中间哪个环节都不能有纰漏。心脏外科和其它很多专业相比,团队协作尤为重要,高超的团队协调能力是手术成功的保证,这绝不是单纯手术匠能胜任的。协调能力的培养不是一撮而就,需要不断提高。所以国外一个成熟的心脏外科医师大约需要17年的培养周期。在达到各方面都成熟之前,室间隔缺损修补术仍然是“风险最大”的先心病手术。
 杨学勇 主任医师 北京京都儿童医院 儿科910人已读
杨学勇 主任医师 北京京都儿童医院 儿科910人已读





