南方医科大学南方医院肿瘤科科普号
- 精选 ALK阳性晚期肺癌患者的福音:国产恩莎替尼成功上市
ALK阳性肺癌的福音:首个国产ALK抑制剂-恩沙替尼获批上市。ALK通路异常活化是晚期非小细胞肺癌(NSCLC)的重要致病机制。目前,针对这一类患者的靶向药物是ALK抑制剂,如克唑替尼、阿来替尼、赛瑞替尼(均为进口药物)。相比传统的克唑替尼,国产恩沙替尼与ALK结合力更强,对克唑替尼耐药突变体也表现出较强的抑制活性。一项针对ALK阳性非小细胞肺癌患者的全球多中心III期临床研究结果显示 :接受恩沙替尼治疗的患者中位无进展生存期为25.8个月,显著优于克唑替尼,尤其对脑转移疗效好,病灶控制率超过95%。安全性方面,患者耐受性良好,不良反应多为皮疹和转氨酶升高,大多为轻中度,容易处理。
尤长宣 主任医师 南方医科大学南方医院 肿瘤科1196人已读 - 精选 紧急告知!这些人不能打新冠疫苗
为落实新冠病毒疫苗“应接尽接” 的接种策略,解决受种人员和接种人员在禁忌症把握方面的一些模糊认识,减少因禁忌症把握不当造成的受众人员流失和医患矛盾,按照国家卫健委发布的《新冠病毒疫苗接种技术指南(第一版)》及知情同意书和疫苗说明书的内容对新冠疫苗接种的禁忌症及相关问题进行了进一步梳理和明确,快跟着一起看看吧! 1 既往接种疫苗出现严重过敏反应者(如急性过敏反应、血管神经性水肿、呼吸困难等)不能接种。 2 对疫苗成分及辅料过敏者不能接种,灭活新冠疫苗辅料主要包括:磷酸氢二钠、氯化钠、磷酸二氢钠、氢氧化铝。 3 对尘螨、食物(鸡蛋、花生、海鲜、芒果)、花粉、酒精、青霉素、头孢或者其他药物过敏,可以接种。 4 任何原因(感冒、伤口感染、局部炎症)引起的发热(腋下体温≥37.3℃),暂缓接种。 5 痛风发作、重感冒、心梗、脑梗等疾病急性发作期,暂缓接种。 6 心脏病、冠心病,冠状动脉粥样硬化等疾病,不是急性发作期,可以接种。 7 健康状况稳定,药物控制良好的慢性病人群不作为新冠疫苗接种禁忌人群,建议接种。 8 慢性疾病的急性发作期,或未控制的严重慢性病患者,不能接种。 9 高血压药物控制稳定,血压低于160/100mmHg,可以接种。 10 糖尿病药物控制稳定,空腹血糖≤13.9mmol/L,可以接种。 11 甲减患者服用稳定剂量左甲状腺素(优甲乐),甲功正常,可以接种。 12 慢性湿疹没有明显发作,可以接种。 13 慢性荨麻疹当前症状不明显,可以接种。 14 慢性鼻炎症状不明显,可以接种。 15 慢性肝炎不用吃药治疗,肝功正常,可以接种。 16 肺结核不是活动期,可以接种。 17 银屑病非脓疱型等急性类型,可以接种。 18 慢阻肺非急性发作期,无明显咳喘,可以接种。 19 强直性脊柱炎无急性疼痛表现,可以接种。 20 抑郁症药物控制良好,生活工作如常,可以接种。 21 用于治疗糖尿病的各种药物(包括注射胰岛素),均不作为疫苗接种的禁忌。 22 恶性肿瘤患者手术前后,正在进行化疗、放疗期间,暂缓接种。 23 免疫系统疾病(系统性红斑狼疮、类风湿关节炎、强直性脊柱炎、干燥综合征等等)总体原则是谨慎接种,一般来说, 在病情稳定时可以接种新冠灭活疫苗和重组亚单位疫苗。 24 恶性肿瘤术后超过三年,不再进行放化疗;肾病综合征;肾移植后吃免疫抑制药物;艾滋病患者、HIV 感染者,建议接种灭活疫苗和重组亚单位疫苗。 25 患有未控制的癫痫和其他严重神经系统疾病者(如横贯性脊髓炎、格林巴利综合症、脱髓鞘疾病等)暂缓接种。 26 月经期、备孕期、哺乳期可以接种,并且继续哺乳。 27 妊娠期不能接种。 28 接种后发现怀孕不需要终止妊娠,建议做好孕期检查和随访。 29 男性不存在因备孕不能接种新冠疫苗的问题。 30 新冠疫苗不推荐与其他疫苗同时接种。其他疫苗与新冠疫苗的接种间隔应大于 14 天 31 任何情况下,当因动物致伤、外伤等原因需接种狂犬病疫苗、破伤风疫苗、狂犬病免疫球蛋白、破伤风免疫球蛋白时, 不考虑间隔,优先接种上述疫苗和免疫球蛋白。 32 如果先接种了狂犬疫苗、破伤风疫苗、狂犬病免疫球蛋白、破伤风免疫球蛋白等,需先完成上述疫苗最后一针接种,间隔 14 天后可以接种新冠疫苗。 33 注射人免疫球蛋白者应至少间隔1个月以上接种本疫苗, 以免影响免疫效果。 34 既往新冠肺炎病毒感染者(患者或无症状感染者),在充分告知基础上,可在6个月后接种1剂新冠疫苗。 35 在疫苗接种前无需开展新冠病毒核酸及抗体检测。 36 接种后也不建议常规检测抗体作为免疫成功与否的依据。 37 现阶段建议用同一个疫苗产品完成接种。 38 如遇本市疫苗无法继续供应、或者异地接种等特殊情况, 无法用同一个疫苗产品完成接种时,可采用相同种类的其他生产企业的疫苗产品完成接种(比如中生北京所、中生武汉所、科兴中维替换)。 39 灭活疫苗需要接种2剂,未按程序完成者,建议尽早补种。免疫程序无需重新开始,补种完成2剂即可。 40 灭活疫苗在14-21天完成2剂接种的,无需补种。 41 现阶段暂不推荐加强免疫。灭活疫苗按照程序完成两针,不再加强。 42 其他情况请垂询接种点医。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科2014人已读 - 精选 免疫治疗知多少!
近年来肿瘤免疫疗法已成为肿瘤治疗领域的焦点。美国免疫学家詹姆斯·艾利森 (James Allison) 和日本生物学家本庶佑 (TasukuHonjo) 凭借「发现负性免疫调节治疗肿瘤的疗法」获得了 2018 年诺贝尔生理学或医学奖。与直接针对肿瘤细胞的传统治疗手段不同, 肿瘤免疫疗法是利用人身自身免疫系统对肿瘤进行杀伤。 那么关于免疫治疗,你到底了解多少呢? 什么是免疫治疗 恶性肿瘤是机体正常细胞恶变的产物, 具有不断增殖并有可能在体内转移的特点。为了生存和生长, 肿瘤细胞能够采用不同策略抑制人体的免疫系统, 使其不能正常地杀伤肿瘤细胞, 从而在抗肿瘤免疫应答的各阶段得以幸存。 人体免疫系统中负责监督和杀伤肿瘤细胞的主要细胞亚群包括杀伤性 T 细胞和 NK 细胞, 当肿瘤细胞在人体内无序分化并不受控制地增殖, 而杀伤细胞活性减弱, 不能有效地清除肿瘤细胞, 重大疾病就发生了。 随着生物技术的迅猛发展, 科学家已经可以在细胞分子水平上针对已经明确的致癌位点设计相应治疗药物, 使肿瘤细胞特异性死亡。虽然利用靶向药物可以对癌细胞进行准确杀伤, 但肿瘤细胞一直在跟免疫系统玩「猫鼠游戏」,「狡猾」的癌细胞具有一定的适应能力, 以逃逸免疫监视和攻击。 例如:免疫细胞表面表达 PD-1 蛋白, 肿瘤细胞则会表达一个免疫球蛋白样的分子 PD-L1。这两个分子相互结合后, 产生的信号被免疫细胞接收, 使免疫细胞的活性降低, 从而使得癌细胞逃过免疫细胞的追捕。因此, 调动体内免疫系统来杀伤肿瘤细胞是肿瘤治疗的新手段, 其机制是活化包括 T 细胞和 NK 细胞在内的杀伤性淋巴细胞, 靶向清除肿瘤细胞, 激活患者体内抗肿瘤免疫系统的应答。肿瘤免疫治疗能明显减少毒副作用, 显著提高治疗效率, 在替代放化疗药物上具备明显优势, 将为治愈肿瘤提供新手段。 像 PD-L1 这种可以抑制免疫细胞功能的关键「靶点」我们称之为免疫检查点。而通过抑制这些靶点从而重新启动激活免疫功能的药物就是大家熟知的免疫检查点抑制剂了。接下来简单介绍一下这几个常见的免疫检查点。 PD-1 是一种主要表达于活化的 CD4+T 细胞、CD8+T 细胞、B 细胞、NK 细胞 单核细胞和树突状细胞等免疫细胞中的跨膜蛋白, 主要功能是促进 T 细胞的成熟。正常情况下,PD-1 通过调节外周组织中 T 细胞的分化方向进而调控机体对外来或自身抗原的免疫应答反应, 防止免疫过激的发生。 B7-H1 同时也被称为 PD-L1,是一个对免疫系统起负作用的蛋白。主要表达于抗原递呈细胞、B 细胞、T 细胞、上皮细胞、肌细胞、内皮细胞和肿瘤细胞中, 并参与肿瘤相关的免疫应答反应。 PD-L1 在人的正常组织中表达量很低, 但是在肺癌、结直肠癌、卵巢癌等癌症中表达量非常高。因为其主要在肿瘤细胞中表达,所以将 PD-L1 抗体用于杀死肿瘤细胞的免疫治疗方法具有光明的前景。 CTLA-4 是 T 细胞上的一种跨膜受体,CTLA-4 与 B7 分子结合后诱导 T 细胞无反应性, 参与免疫反应的负调节。1996 年,JamesP. Allison 课题组证明使用 CTLA-4 抗体可以增强免疫功能,从而抑制肿瘤的发生发展。 介绍完与抑制免疫功能相关的免疫检查点后,再来介绍一下与之结合后可以阻断其发挥免疫抑制作用从而活化重启免疫系统的免疫检查点抑制剂。 Nivolumab 是一种完全人源化的单克隆抗体,通过阻断 PD-1 与其配体 PD-L1 或 PD - L2 的结合, 逆转肿瘤免疫逃逸的状态, 恢复 T 细胞杀伤肿瘤的活性, 达到抑制肿瘤生长的目的。Nivolumab 是最早进入Ⅰ期临床试验的抗 PD -1 的抗体药物,目前应用较为广泛,在多种恶性肿瘤的治疗中也已显示较好的治疗效果。 Pembrolizumab 是美国 FDA 批准用于治疗晚期黑色素瘤的药物之一,这是一种抑制 PD-1 的人源化单克隆抗体, 与 PD-1 有着高亲和力, 几乎去除了免疫原性和毒副作用。 CTLA-4 抑制剂 Ipilimumab 是一种抗 CTLA-4 的全人源单克隆抗体, 首先被用于黑色素瘤治疗, 由于其具有较好的疗效, 已于 2011 年 3 月被 FDA 批准用于治疗晚期黑色素瘤。但由于单独使用 Ipilimuma 的疗效有限, 现在多使用 Ipilimumab 联合其他治疗方案。 肿瘤免疫治疗的预测因子 在使用免疫检查点抑制剂进行治疗时,并不是会对所有的病人产生同样的治疗效果。有些病人用药后效果较好,有的则较差,那么,究竟什么样的病人会对免疫治疗产生更好的反应呢?有没有什么可靠的评价指标呢? PD-L1 研究发现,对 PD-L1 高表达的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,pembrolizumab 疗效更为显著。因此,KEYNOTE-010 研究首次采用前瞻性研究利用 PD-L1 表达来预测 pembrolizumab 的疗效,也最终证实 PD-L1 可作为预测 pembrolizumab 疗效的生物标志物。 对于肿瘤细胞 PD-L1 表达 ≥ 50% 的晚期 NSCLC 患者,pembrolizumab 较含铂类化疗有更长的 PFS 和 OS,且不良反应少。越来越多的证据支持:PD-L1 高表达的 NSCLC 患者更能从抗 PD-1/PD-L1 治疗(nivolumab、pembrolizumab、durvalumab、atezolizumab 和 avelumab)中 获 益 。 需要注意的是虽然 PD-L1 高表达人群获益更多,但对于多数肿瘤仅单独检测 PD-L1 并不能够筛选出优势人群。 肿瘤突变负荷(tumor mutation burden TMB) TMB 定义为体细胞基因组中突变的数目。TMB 决定了肿瘤的免疫原性,而肿瘤微环境则决定了 T 细胞的浸润、分布和功能,因此低免疫原性和高肿瘤免疫抑制微环境是免疫检查点抑制剂原发性耐药的基础,也影响其疗效。维持基因组稳定和 DNA 修复相关的基因突变能够导致体细胞突变频率增加,纠错能力减弱,导致超突变或微卫星不稳定性(microsatellite instability,MSI),同样会引起 TMB 的增加。 采用基因测序计算体细胞的 TMB 发现,高 TMB 与 pembrolizumab 治疗的 ORR、 PFS 和持续临床获益相关。错配修复缺陷(deficient mismatch repair,dMMR)的肿瘤可能对免疫检查点抑制剂敏感。TMB 作为免疫检查点抑制剂的疗效预测因子正越来越引起大家关注。 MSI MSI 通常由 dMMR 引起,dMMR 会累积高水平的突变并产生新抗原,因此对 PD-1/PD-L1 抗体有更高的敏感性。全外显子测序结果显示,MSI 肿瘤有更多的体细胞突变,且更高的体细胞突变率与更长的 PFS 相关,提示基于 dMMR 的抗 PD-1 治疗将是免疫治疗的突破口 γ-干扰素(interferoninterferon-γ IFN-γ) IFN-γ是一种由免疫细胞产生具有抗病毒调节免疫以及抗肿瘤活性的蛋白。PD-1 抑制剂治疗前肿瘤活检标本中 IFN-γ信号上调时,患者应答相对较好,所以 IFN-γ可能成为潜在的疗效预测指标。 肿瘤浸润淋巴细胞 肿瘤免疫微环境可以影响免疫治疗的效果。另一方面,免疫检查点抑制剂也只对特定的肿瘤浸润 T 细胞亚群发挥作用, CTLA-4+ PD-1+的肿瘤浸润 T 淋巴细胞含量与 PD-1 单抗疗 效密切相关,CTLA-4+PD-1+的肿瘤浸润 T 淋巴细胞含量越高,PD-1 单抗效果越好。 血清标记物 接受 pembrolizumab 治疗后基线的高嗜酸性粒细胞计数、高淋巴细胞计数与低血清乳酸脱氢酶的黑色素瘤患者有较好的 OS。外周血生物标志物如组织蛋白酶、磷脂酶 A2、硫氧还蛋白还原酶和白细胞介素受体相关激酶 3 可能成为 tremelimumab 的疗效预测因子。 基因谱 抗 PD-1 治疗黑色素瘤患者的基因组学和转录组学特征显示,原发耐药的肿瘤显示了不同的转录特征,表现为参与间充质转化调节、细胞黏附、 细胞外基质重塑、血管再生和伤口愈合的基因表达上调。肿瘤基因谱分析代表了个体的整体信息,无疑是未来实现肿瘤精准免疫治疗的重要方法。 免疫检查点抑制剂为基础的免疫治疗引领肿瘤治疗进入了一个新时代,寻找预测生物标志物 是实现肿瘤精准免疫治疗的必经之路。上述免疫检查点抑制剂疗效预测因子并非单独发挥作用, 多个预测因子的联合应用才能更好地筛选出优势人群,最大程度地使肿瘤患者临床获益。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科1240人已读 - 精选 使用免疫疗法之前,需要做基因检测么?
肿瘤的PD-L1染色是常见的免疫生物标记物之一。PD-L1染色,是指用特异的抗体来检测(肿瘤)组织中PD-L1蛋白的表达量。目前主流理论认为,部分肿瘤细胞通过高表达PD-L1蛋白来结合免疫细胞上的PD-1蛋白,从而抑制免疫细胞的攻击。而PD-1抑制剂的作用,正是打破这种PD-L1和PD-1的结合,从而激活免疫细胞,尤其是T细胞,完成对肿瘤细胞的攻击。是不是肿瘤表达PD-L1越多,PD-1免疫药物效果越好? 整体而言,PD-L1表达高的患者群体,响应免疫疗法的概率更高。但具体落实到个人,情况就很复杂了。PD-L1做临床生物标记物依然受到很大争议,主要就是因为它无法准确预测个体疗效。 * PD-L1之所以作为生物标记物不理想,有技术上的问题,尤其是染色本身问题多多。比如,抗体不同,结果可能不同,样品处理不同,结果也可能不同,等等。除此之外,更重要还有PD-L1自身的生物学原因。最主要的有两点: 第一是分布不均:PD-L1在肿瘤内部并非均匀分布,同一个肿瘤组织,可能一些部分表达阳性,一些部分表达阴性。这就带来了随机问题,因为取样可能取到阳性表达的部分,也可能取到阴性表达的部分。一块所谓“PD-L1阴性”的肿瘤组织,很可能换个地方取样检测,就是阳性的了。 * 第二是表达不稳定:PD-L1蛋白表达受到很多分子信号影响,会上下动态变化。一块看似表达低的肿瘤组织,或许第二天表达就高了。 那别的标记物呢?比如肿瘤突变负荷(TMB),免疫指数(Immune Score)等。但到目前为止,还没有一个完美的单独标记物。免疫系统和肿瘤之间的相互关系错综复杂,受到很多因素影响。最近甚至发现肠道菌群,甚至人的饮食习惯都能影响免疫疗法效果。所以大家目前倾向于认为,真正要预测免疫疗法效果,可能需要多种标记物的组合,而不会像靶向治疗那样有一个单一标记物。 目前中国临床治疗中,到底要不要做PD-L1检测呢? * 第一,取决于瘤种。有些肿瘤疗效和PD-L1表达量有一些关联,比如紫外线损伤相关的黑色素瘤,大家可以考虑做,但有些就没那么高,比如经典霍奇金淋巴瘤。它整体表达都比较高,就不用测了。 * 第二,取决于一线还是二线。在肺癌中,一线单独使用免疫药物可以考虑检测,因为研究发现PD-L1强阳性(>50%)的患者获益最大。但二线治疗目前不推荐,一方面是有研究发现PD-L1阴性患者也能获益,另一方面是因为二线患者有效治疗选择本来就很少,化疗效果也一般,再使用PD-L1来做选择意义有限。 * 第三,取决于是单独用免疫药,还是联合用药。在肺癌的一线临床试验中,如果PD-1抑制剂药物一线单独使用,PD-L1阴性患者几乎不获益,因此做检测很有价值,但免疫药联合化疗用于一线的时候,即使阴性患者也能受益,因此并不需要检测。 * 第四,取决于就诊医院。虽然说PD-L1检测比较快,但涉及20步以上的人工操作,中国很多医院病理科还没有建立起稳定的PD-L1染色质控系统,因此目前检测意义不大。 * 第五,取决于经济情况。任何检测,无论PD-L1,肿瘤突变负荷还是免疫指数,都是需要花钱的。而无论O药还是K药,在中国定价都是世界最低(一个月2万左右)。在经济条件允许,而且其它选择都不理想的时候,直接盲试免疫检查点抑制剂药物一段时间看情况,是一个非常现实的选择。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科2万人已读 - 精选 肿瘤放疗解惑:护理篇
放射治疗简称“放疗”,是利用电离辐射治疗恶性肿瘤的一种手段。电离辐射可诱导产生干细胞、组织和器官中的化学反应,引起生物分子结构的改变,破坏和阻止细胞分裂。 放疗是一把”双刃剑”,在杀灭肿瘤细胞的同时不可避免地会对身体的正常组织造成损伤,因此放疗患者的护理显得尤为重要。放疗前、放疗中、放疗后护理的重点是什么?我们都应该注意哪些问题?今天为您详细解答。 1.放疗前护理 ①心理护理,针对性地做好疏导工作。 ②劝导患者戒烟、戒酒,忌辛辣和酸醋食物,避免过熟过硬的食物,以免损伤黏膜。 ③局部避免冷热刺激,以免损伤皮肤。 ④局部避免光线的直接照射,夏日外出需戴帽子或撑阳伞。 ⑤切忌用手指直接接触或用手去剥干燥、脱落的痂皮,以免损伤皮肤而延长愈合的时间。 2.放疗期间护理 ①在照射时不可移动位置,以免照在正常组织上而漏掉肿瘤。 ②在照射前、后半小时内,嘱患者尽量不进食,以免引起条件反射性厌食。 ③每次放疗后安静休息 30-60 分钟,以减轻放射反应 ④鼓励患者多饮水,每日 2000 - 4000 ml,以利于毒素排泄 ⑤患者平时要养成良好的卫生习惯,饭后漱口可清除口腔中食物残渣,减轻口腔黏膜反应。 ⑥饮食指导:患者宜选高热量、高蛋白、高维生素、低脂肪、宜消化的清淡食物。同时也可选用人参、红枣、米仁以利于提高肌体免疫功能。 3.放疗后反应护理 消化道反应护理: ①放疗期间保持口腔清洁。 ②避免过冷、过热食物。 ③出现口腔黏膜溃疡,局部可涂溃疡合剂。 ④口干可用养阴生津的麦冬或金银花泡茶。 ⑤鼻咽或上颌窦照射时需要进行鼻咽及上颌窦冲洗。 皮肤反应护理: Ⅰ度反应:在照射数日后,皮肤出现红斑,有烧灼和刺痒感,继续照射,皮肤可变成暗红色,以后有脱屑,称为干性脱皮。处理:局部可扑消毒滑石粉、樟脑粉。 Ⅱ度反应:皮肤可出现高度充血、水肿、水疱形成,有渗出液,称湿性反应。处理:如皮肤无破裂及无炎症者,可暴露创面,涂2%甲紫或康复霜,一日数次。如有水疱及渗出液,应用 3% 硼酸液冷湿敷 1-3 天,待渗液吸收后,在用暴露疗法。 Ⅲ度反应:溃疡坏死,真皮层受损。由外科处理:将坏死组织剪除,冲洗伤口换药。 骨髓抑制护理: 若白细胞低于 3*109/L 时,应报告医生,暂停放疗,给予对症处理。 脑组织急性放射反应护理: ①严密观察体温、脉搏、呼吸、血压、神志、瞳孔、肢体活动情况,发现异常,及时汇报医生。 ②做好昏迷抽搐及瘫痪护理,防止脑衰和窒息发生。 4.外周血象下降 造血系统对放射线高度敏感,部分患者在放疗中可出现外周血象下降。 原因是放疗时骨髓内各种造血细胞的分裂繁殖受到抑制,向周围血中释放的成熟细胞(包括白细胞、红细胞和血小板)减少,射线对生成这三种细胞的前体细胞的放射敏感程度是一样的,而白细胞和血小板的寿命很短,因此外周血中计数很快下降,而红细胞的生产时间很长,贫血出现较晚。 ①白细胞和血小板下降到一定程度就会对人体产生影响并有一定的危害,如患者自觉全身乏力,易导致严重感染甚至败血症,有出血倾向,导致内脏、颅内出血致死亡。 ②当白细胞小于 3×109/L,血小板小于 70 ×109/L 时应暂停放疗,升血对症治疗,血象恢复后再开始治疗。 ③白细胞计数低于 1*109/L 时,则需采取保护性隔离措施,住单人病房,出入病房均需要戴口罩、帽子,病室每日用紫外线照射2次,保持患者被褥、衣裤的清洁 ④单纯放疗一般不易引起明显的血象下降,下降的多少与照射野大小、部位等因素有关。大面积照射患者,应每周检查血象1次,如全中枢放疗。放疗中应加强饮食营养,促进造血功能,食物宜高维生素、高蛋白。 5.发热 放疗过程中引起发热的原因有多方面。放疗本身造成的组织损伤,尤其是肿瘤组织坏死吸收;血象下降、免疫功能减退也易合并病毒或细菌感染而引起发热;联合化疗或其他免疫增强药等可使发热加重。因此出现发热,首先寻因。 ①低于 38℃ 的发热,可不用退热药物,多饮温开水,注意休息,促其排汗、排尿,多能耐受并稳定至正常。 ②如体温超过 38℃,引起明显头痛或全身不适,应使用退热药物,如阿司匹林、解热镇痛剂等,也可用湿毛巾行头部冷敷,待进一步明确发热原因后再做相应处理 ③如体温持续升高达 38.5℃ 以上,应暂停放疗,稳定病情,静脉输液给予支持,必要时应用抗生素、维生素及适量肾上腺素。 6.恶心、呕吐 化放疗所致恶心、呕吐的相关因素包括化疗药物致吐级别、剂量、给药途径和方法;放疗部位、面积及分割剂量等。发生恶心、呕吐应注意什么? ①呕吐时要注意体位,卧床患者头偏向一侧有利于呕吐物的排出,避免呕吐物误吸入呼吸道,引起窒息或导致肺部感染。 ②呕吐后用清水或淡盐水漱口,避免口腔残留胃内容物激发下一次呕吐。 ③呕吐后可少量多次饮水,补充水分,必要时可进食少量富含热量的流质,避免“空胃”。 ④呕吐频繁时,在 4-8 小时内禁食,必要时可延长至 24 小时,再缓慢进流质饮食。避免大量饮水,可选用肉汤、菜汤和果汁等,以保证体内营养的需要,维持电解质平衡。同时可使用止酸药物,预防消化道出血。 ⑤如果出现胃液颜色改变(咖啡色/鲜红/暗红)、小便量减少、皮肤弹性变差、精神差、眼眶下陷等情况,有消化道出血、脱水及电解质紊乱的可能,应立即就医。 7.适宜就餐时间 在治疗前后1-2小时避免进食,在每天最不易恶心的时间多进食(多在清晨)。当胃部有明显的饱胀感时应停止或减少进食。餐后勿立即躺下,以免食物返流,引起恶心。 8.放疗结束后护理 ①放疗结束后,应做一次全面体格检查及肝肾功能检查。 ②照射野皮肤仍需保护至少个月。 ③随时观察惠者局部及全身反应消退情况。 ④口腔受照射后3、4年内不能拔牙,特别是当出现放射性龋齿所致的牙齿颈部断裂时,牙根也不能拔除,平时可用含氟类牙膏预防,出现炎症时予以止痛消炎。 ⑤加强照射区的功能锻炼,如头颈部放疗后练习张口,乳腺癌放疗后练习抬臂锻炼等。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科4167人已读 - 精选 放疗解惑:原理篇
1.什么是放疗(放射治疗) 放疗是使用高能射线的电离辐射作用杀死癌细胞来治疗肿瘤的方法,和手术、化疗并列为肿瘤治疗的三大手段。X射线、γ射线和带电粒子如电子、质子和重离子是用于癌症放疗的常见辐射类型。 2.放疗怎么进行 最常用的是外照射放疗,放射线(X 射线,电子线,质子,重离子等)由体外的机器发射出,通过机器的旋转到特定的角度,让放射线进入肿瘤组织从而杀伤肿瘤。 3.加速器是什么? 也叫做直线加速器,能产生用于肿瘤治疗的高能射线。加速器是放射治疗最常用的治疗设备。 4.什么是放疗野 放射线指向并穿过的体内区域,也称作 “射野”。 5.什么是CT 模拟定位 通过 CT 扫描和图像的三维重建技术获得患者的影像资料,能够在三维空间显示肿瘤范围及其周围的正常组织,是三维适形放疗和调强放疗等精确放疗计划设计的重要前提和基础。在定位过程中常需采用 “面罩” 、“体膜” 等体位固定技术。 6.放疗敏感性是什么? 肿瘤细胞或正常细胞受放射线影响的难易程度。增殖分裂快的细胞容易被放射线损伤,放射敏感性高。 7.放疗是如何杀死癌细胞的? 放疗通过破坏DNA来杀死癌细胞。放疗既可以直接破坏DNA,也可以在细胞内产生带电基团(如自由基等),从而间接破坏DNA。当癌细胞的DNA受损无法修复时,癌细胞便停止分裂或死亡。当受损的癌细胞死亡后,它们会被身体的自然过程分解和消除。 8.放疗开始前的准备工作有哪些 ①CT 定位:拟进行放疗的患者,需要在放疗专用的 CT (计算机断层扫描)模拟机下完成扫描。为了提高治疗的精准性,医生常需使用适当的固定技术,如:面罩,头枕,真空垫等固定患者。固定器和体表标记线是确保患者每次都得到精准放疗的重要措施。 ②放疗计划的制定及靶区勾画:医生根据肿瘤的类型、大小、位置及其周边器官情况,决定使用何种放疗方法及治疗剂量。 ③放疗计划的设计:放疗物理师根据医生确定的放疗范围和要求的剂量,设计放疗计划,即治疗射线的角度和强度等,同时又保证正常器官所接受的剂量不超过安全范围。 ④放疗计划的评估:物理师完成初步放疗计划后交付放疗医生评估靶区和正常组织的剂量,物理师经常需要和医生不断协商并反复修改计划,最终完成一个获得医生认可的计划。 ⑤放疗:放疗开始前,相当一部分患者需要移床,即按原 CT 扫描时的坐标中心移至治疗计划结果的等中心参考点上,验证片由医生确认无误后,方可治疗。 9.物理师是做什么的? 放射物理是放射治疗中的一门重要学科,在肿瘤放射治疗过程中起着至关重要的作用,日常要完成放射治疗中的剂量监测、放射治疗质量保证、放射治疗质量控制、内外放射治疗计划设计、新技术开发应用,模拟定位,模型设计制作等工作。 10.放疗治疗单上的放疗剂量后面的 Gy 是什么 Gy 是放射线吸收剂量的单位( 1 Gy = 100 cGy = 1 J·kg^-1 ) 。吸收剂量表示放射线 (电离辐射)给予单位质量物质的能量。 11.SBRT 是什么 Stereotactic Body Radiation Therapy 体部立体定向放射治疗,又称立体定向消融放疗(Stereotactic Ablative Radiotherapy SABR)。它最常用于局限的单个小病灶的治疗,例如肺、肝等部位的恶性肿瘤及转移灶。该技术采用高的单次剂量(通常每次 6 Gy - 30 Gy),一般治疗 1 至 5 次,每日一次或隔日一次,整个治疗可在 1 到 2 周内完成。 12.SRS 是什么 立体定向放射外科(SRS) 的概念随着伽玛刀的发明和良好的治疗效果得以变成现实,成为一门新的分支学科。围绕立体定向放射外科的概念,不同医疗设备的发明及新技术相继出现。 二十世纪八十年代,Colombo 和 Betti 等学者对医用直线加速器加以改进,增加了立体定 向系统和准直器,采用非共面多弧度小野三维集束照射病灶,取得了与伽玛刀类似的治疗效果。将这种经过改进的直线加速器称为 X - 刀(X - knife)。一般采用分次治疗,在学术界称为立体定向放射治疗(stereotactic radiotherapy, SRT) 。 13.放疗治疗单上的 3DCRT、IMRT、 VMAT、IGRT、4D 分别指什么 3DCRT:3 - Dimensional Conformal Radiotherapy 三维适形放疗,根据照射部位(靶区)的三维形状,通过多叶准直器( MLC )修饰射线来进行放疗,使正常组织和器官被遮挡住免受不必要的照射。 IMRT:Intensity Modulated Radiation Therapy 调强放疗,根据照射部位(靶区)的三维形状, 射线从多个不同的角度进行照射,每个角度的射线强度和射束形状都相应调整,使射束形状与肿瘤形状匹配,同时使得靶区内剂量均匀。 VAMT:Volumetric-Modulated ArcRadiotherapy,容积调强放射治疗,机架在 360 度范围内单弧或多弧旋转进行治疗。通过加速器机架非匀速旋转,剂量率动态变化,电动多叶准直器( MLC )不断运动,以生成高质量的剂量分布。 IGRT: Image Guided Radiotherapy 图像引导放疗, 即是在影像图像引导下进行的放疗。IGRT 可以纠正放疗期间摆位、器官运动、肿瘤体积变化带来的误差,实现精准放疗。 4D:在三维的基础上加入了时间这个维度,通过动态捕捉呼吸运动引起的器官移动来进行影像重建,可以避免受呼吸运动影响大的胸腹部肿瘤(如胃癌,肺癌等)在放疗中出现漏照。 14.目前外照射放疗类型包括哪些? 3D-CRT、调强放疗(IMRT)、图像引导放疗(IGRT)、Tomo刀放疗(Tomotherapy)、立体定向放射外科SRS、立体定向放射治疗SBRT、质子治疗、重离子放疗等。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科1.2万人已读 - 精选 免疫治疗,王者归来
在很长一段时间里,手术、放疗、化疗一直是恶性肿瘤的三大治疗手段,牢牢占据着主导地位。而免疫治疗由于疗效不确切而被临床医生所忽视,特别在我国,由于“魏则西事件“的影响,免疫治疗在普通民众眼里,甚至有”图财不害命“的骗人之赚。但事实上,在恶性肿瘤的治疗史上,免疫治疗才是第一个非手术的癌症疗法。早在19世纪末期,美国纽约的柯里(coley)医生使用灭活的链球菌和沙门氏菌诱导感染,也就是“Coley毒素”治疗恶性肿瘤,便翻开了肿瘤免疫治疗的篇章。而在随后的数十年,肿瘤免疫治疗进展却乏善可陈。但随着新世纪的到来,在“肿瘤免疫监视学说”逐步被证实的基础上,免疫治疗也开启了新的纪元,迎来了厚积薄发的重大突破,宣誓肿瘤治疗的“王着归来“!以PD-1和PD-L1为代表的免疫检测点抗体无疑是真正的王者,自问世以来,所向披靡,获批了几乎所有常见恶性肿瘤的适应证,包括黑色素瘤、非小细胞肺癌、头颈部鳞癌、肾细胞癌、经典型霍奇金淋巴瘤、尿路上皮癌、结直肠癌、胃癌、肝细胞癌等。而对于目前全球死亡率最高的肺癌,PD-1和PD-L1抗体更是显示出了全程覆盖,全方位打击的能力。从晚期二线治疗的CheckMate 017、CheckMate 057、KEYNOTE-010、OAK研究,到一线治疗的CheckMate 026、KEYNOTE 024、BIRCH研究,仍至局部晚期的PACIFIC研究和早期新辅助治疗的研究,可谓是一路凯歌,捷报频传!在治疗方式的选择上,除了单药使用外,PD-1和PD-L1抗体更是”人见人爱,花见花开“,与几乎现有的肿瘤治疗手段均可联合,协同增效。与化疗联合的KEYNOTE-021、CheckMate227研究,与放疗联合的MYSTIC、NEPTUNE、ARCTIC研究,与其他免疫靶点药物联合的CheckMate 227、Lung-MAP研究,与抗血管生成靶向药物联合的IMpower150研究等,可谓是”百搭神药“,这些研究在很大程度上改变非小细胞肺癌(NSCLC)的临床实践,使PD-1和PD-L1抗体成为肿瘤医生的抗癌神器,也为患者带来显著的生存获益。肺鳞癌无疑是非小细胞肺癌中最坚固的堡垒,但仍抵挡不住PD-1和PD-L1抗体和传统化疗的联合攻击,KEYNOTE-407研究结果提示:Pembrolizumab(200mg, Q3W)联合卡铂/紫杉醇或者白蛋白紫杉醇,均可显著改善患者生存,该研究在2018ESMO会议上进一步更新了数据:Pembrolizumab联合卡铂/紫杉醇对比单纯化疗的中位OS为14.0个月vs 10.3个月,HR 0.67(0.48-0.93);Pembrolizumab联合卡铂/白蛋白紫杉醇对比单纯化疗为NR vs 12.6个月,HR 0.59(0.48-0.93);在最新的NCCN指南(2019第1版)也将该联合治疗方案作为“无使用Pembrolizumab禁忌肺鳞癌患者的首选方案(I类证据)。研究同时发现:对于肺鳞癌,与既往Socinski等的研究结论:相对紫杉醇,白蛋白紫杉醇可改善ORR,但不能改善OS不同的是,在KEYNOTE-407研究中,两种紫杉醇的ORR并无显著差别。在攻克肺鳞癌后,对于小细胞肺癌(SCLC)这个最后的堡垒,PD-1和PD-L1抗体也再显神威,在2018WCLC会议上公布并在《新英格兰医学杂志》同步发表的IMpower133研究结果显示:在标准化疗(依托泊苷100mg/m2, D1-3;卡铂, AUC=5)的基础上联合PD-L1抗体:atezolizumab, 1200mg,D1)可显著改善ES-SCLC患者的生存。中位OS从10.3个月提高到12.3个月,是20多年来SCLC治疗领域的首次突破。历经百年沧桑,PD-1和PD-L1抗体为代表的免疫治疗真正实现王者归来,其发现者:James P Alison的Tasuku Honjo获得2018年诺贝尔生理学和医学奖更是王者的成功加冕。当然,以免疫治疗为代表的抗癌之战才刚刚打响,未来的路还很长,尚有很多的问题需要探索:探讨最优的联合治疗策略;探讨免疫治疗用于早期、中期癌症的治疗模式;寻找生物标志物以实现精准免疫治疗;针对免疫反应过程中的其他靶点,研制新的药物;研制新一代免疫靶向药物,达到高效低毒,可入脑。
尤长宣 主任医师 南方医科大学南方医院 肿瘤科2182人已读 - 精选 辟谣!白蛋白五大谣言你是不是相信了?
临床上经常听到医生向药房询问是否有白蛋白供应,然而白蛋白此种「供不应求」的现象背后却隐藏着不少不合理使用的情况。 有一些对白蛋白的功能夸大的谣言,你是不是相信了?下面就让我们来一一辟谣!
 席菁乐 副主任医师 南方医科大学南方医院 肿瘤科2461人已读
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科2461人已读 - 精选 【一文读懂】男性乳腺癌那些事儿
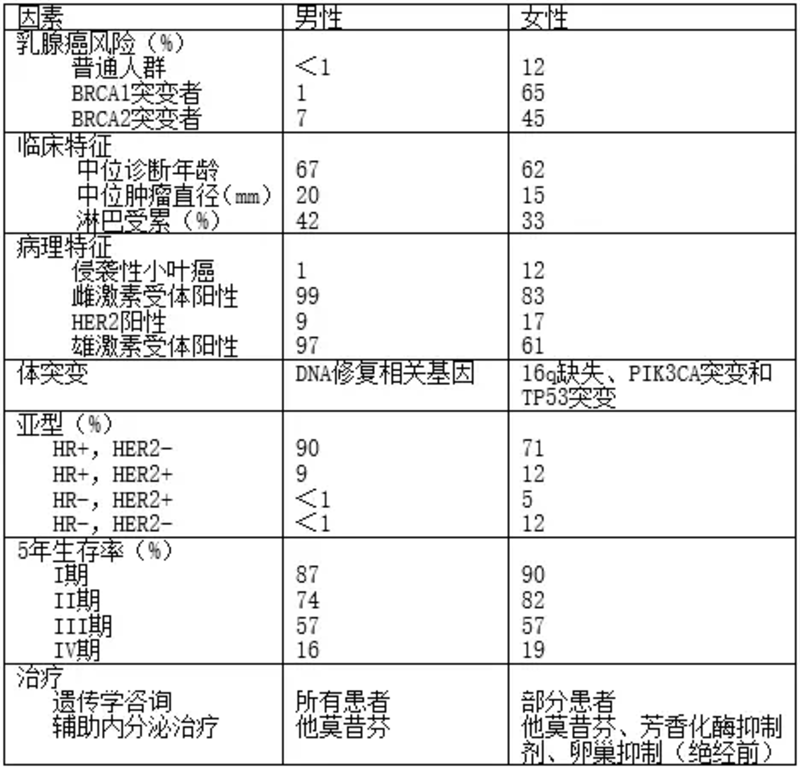
男性乳腺癌非常少见,因此缺少大宗临床研究数据,治疗推荐多由女性乳腺癌外推而来。过去10年,对男性乳腺癌的生物学特征、有效治疗和治疗结局做了较多研究,结果表明男性乳腺癌有许多独特特征,具体见表1。美国M.D. Anderson癌症中心的Giordano教授在NEJM上发文,对上述研究结果做了具体介绍。 流行病学与风险因素 男性乳腺癌约占所有乳腺癌的1%,SEER数据库中男性乳腺癌的年龄校正发生率由1975年的0.85/100,000增至2011年的1.43/100,000。男性终生罹患乳腺癌风险为1:1000,女性1:8,发病随年龄增加而增加。平均诊断年龄67岁,高于女性的62岁,黑人男性发病风险高于非西班牙白人男性。一级亲属罹患乳腺癌者发病风险增加一倍,男性乳腺癌的风险因素见表2。 突变BRCA是男性乳腺癌最明确的风险因素,BRCA1和BRCA2基因与DNA修复相关,5 -10%女性乳腺癌有上述基因突变,具此类基因改变女性70岁时发生乳腺癌的风险为45-65%,男性具有BRCA1突变者发生乳腺癌的风险为0-4%,BRCA2为4-16%,乳腺癌基础突变中BRCA突变比例较高,冰岛研究中BRCA2突变约占40%,携带BRCA的健康男性发生乳腺癌风险明显低于女性。 目前并不清楚BRCA突变是否影响诊断年龄和预后结果,NCCN指南推荐男性携带BRCA突变者应行乳腺自检训练,每年一次乳腺临床检查,BRCA1突变者筛查从35岁开始,同时考虑前列腺癌筛查,BRCA2突变者筛查从45岁开始。指南同时指出,支持男性乳腺癌影像学筛查的数据有限,不推荐钼靶检查和MRI检查。 与女性相似,另有几个基因与男性乳腺癌发生风险增加相关。CHEK2编码细胞周期免疫检查点激酶,参与DNA修复,其截短突变(CHEK2*delC)增加男性乳腺癌风险10倍,但也有研究显示CHEK2变体只中等增加男性乳腺癌风险。PALB2编码BRCA2相互作用蛋白,增加女性和男性乳腺癌发生风险,不过男性乳腺癌中PALB2突变发生率只有1-2%。另有报道,CYP17和RAD51B单核苷酸多态性、染色体2q35、5p12、6q25.1、10q26.13、16q12.1改变均增加男性乳腺癌风险,PTEN和雄激素受体突变也与男性乳腺癌相关。 放疗暴露也是男性乳腺癌风险因素,日本原子弹爆炸幸存者中男性乳腺癌发生率增加,并存在剂量-反应相关性。雌激素水平增高也是男性乳腺癌易感因素,男性乳腺癌计划研究中,雌激素水平前1/4与后1/4人群相比,乳腺癌发生率比值比2.47。 增加雌激素水平进而增加男性乳腺癌的情况包括男性乳房发育症、肝脏疾病、睾丸异常和肥胖。Klinefelter综合征或47,XXY核型患者,其特征是性腺机能减退、睾酮水平下降,男性乳腺癌风险增加。瑞典癌症注册研究中,患有Klinefelter综合征的男性乳腺癌风险增加50倍,英国队列研究显示,75岁时累积乳腺癌发生风险0.9%,乳腺癌增加可能与雌激素和雄激素比例增高有关。 临床表现与评估 多数男性乳腺癌表现为无痛性乳晕下肿块,其它征象包括乳头回缩与出血、皮肤溃疡和腋下淋巴结肿大。最需鉴别的疾病是男性乳房发育症,影像学有助于鉴别诊断,ACR推荐<25岁男性发现性质不明乳腺肿物时应行超声初检,≥25岁男性推荐钼靶初检,如钼靶结果提示癌症可能时推荐进一步超声检查。 钼靶检查时,男性乳腺癌多为偏心的乳晕后肿瘤,边缘不规则或呈放射状。怀疑乳腺癌时应进一步粗针活检证实诊断。由于对男性乳腺癌的认知不足,通常诊断时男性乳腺癌的肿瘤体积更大,也更易发生区域淋巴结转移。男性乳腺癌分期与女性一致,由于男性乳腺癌中BRCA突变风险增加,因此所有男性乳腺癌患者均应考虑遗传学检查。 病理特征 10%男性乳腺癌为原位导管癌,原位小叶癌非常罕见。多数男性乳腺癌为侵袭性癌,侵袭性导管癌最多见,较少见的组织学类型包括乳头状癌(2-3%)和粘液性癌(1-2%),小叶癌在女性乳腺癌中约占12%,在男性中只有1-2%。 总体而言,男性乳腺癌雌激素受体阳性、HER2阴性的比例高于女性。国际男性乳腺癌计划研究纳入了1483例男性乳腺癌,99%雌激素受体阳性,82%孕激素受体阳性,97%雄激素受体阳性,9% HER2阳性,42%为luminalA,49%为luminalB,9%为HER2阳性,<1%为三阴乳腺癌。 虽然男性雌激素受体阳性乳腺癌的体突变与女性相似,但突变频度却有不同。男性肿瘤更易发生影响DNA修复的基因体突变,较少发生16q缺失、PIK3CA突变、TP53突变和PI3K–AKT–mTOR途径基因突变。一项基因表达研究显示,男性乳腺癌存在二种独特亚型,M1和M2,二者在本质上完全不同于女性乳腺癌亚型。总之男性乳腺癌的生物学表现不同于女性,因此可能会产生不同的临床意义。 预后 研究显示男性乳腺癌的总生存率与预期生存低于女性乳腺癌,与男性乳腺癌诊断时多为进展期、年龄较大有关;此外黑人男性乳腺癌的结果差于白人男性;诊断时年龄较大、进展期疾病以及三阴乳腺癌生存率更差;虽然乳腺癌生存率不断改善,但男性乳腺癌生存率的改善落后于女性。 与女性乳腺癌一样,男性乳腺癌患者罹患第二原发癌风险增加,黑色素瘤、小肠癌、直肠癌、胰腺癌、前列腺癌和淋巴血液系统肿瘤发生风险增加。不清楚上述肿瘤发生风险增加是否与BRCA2之类的基因突变或是更多的关注与检查,或是其它因素有关。 治疗 目前尚无随机研究涉及男性乳腺癌局部治疗,现有治疗多外推于女性乳腺癌治疗。新诊断女性乳腺癌多行保乳手术,但多数男性乳腺癌行乳腺切除联合腋下淋巴结切除或前哨淋巴结活检,即便是早期男性乳腺癌且无手术禁忌,保乳手术也不常见,SEER数据显示只有18%的T1N0男性乳腺癌接受了保乳手术。观察性研究显示男性保乳手术患者的生存与乳腺切除手术患者的生存相似,且外观和功能性结果更优。前哨淋巴结活检是临床腋下淋巴结阴性女性乳腺癌的标准术式,该方法对男性乳腺癌同样可行。 根据女性乳腺癌指南,男性乳腺癌也应行术后辅助放疗。临床实践中,男性乳腺癌放疗应用不足,SEER数据显示只有42%的I期男性乳腺癌在保乳手术后接受了放疗治疗。尚无随机研究评估男性乳腺切除术后放疗的作用,但观察性研究提示淋巴结阳性男性乳腺癌放疗治疗有获益。 与女性乳腺癌相似,辅助或新辅助化疗以及HER2靶向治疗同样适合复发死亡风险高的男性乳腺癌,与局部治疗相似,目前无男性乳腺癌化疗的随机研究。1974年至1988年,NCI开展了一项男性乳腺癌前瞻性队列研究,31例II期男性乳腺癌伴淋巴结受累,给予乳腺切除和12周期环磷酰胺+甲氨喋呤+氟脲嘧啶化疗,随访5年、10年和20年生存率分别为80%、65%和42%,优于历史对照,说明男性乳腺癌辅助化疗能够改善生存。临床医师对男性乳腺癌拟行化疗时应权衡风险与获益,因为男性患者诊断年龄偏大,生命预期短于女性。 Oncotype DX 21基因检查与MammaPrint的应用正在增加,用以评估女性乳腺癌预后以及化疗是否可能获益。女性和男性乳腺癌Oncotype DX检测结果表明,与雌激素受体、增殖和侵袭相关的平均基因表达评分男性高于女性,平均复发评分男女相似,不过男性复发评分≥31和<11的患者明显高于女性。SEER注册处的322例男性乳腺癌复发评分数据结果支持Oncotype DX 21基因检查同样适用于男性,复发风险评分<18患者的5年乳腺癌特异性生存率99.0%,18-30者为95.9%,≥31者为81.0%,女性则分别为99.5%、98.6%和94.9%。数据表明男性高复发评分患者结果差于女性高评分患者。 多数男性乳腺癌为激素受体阳性,内分泌治疗是很重要的治疗组成。激素受体阳性男性乳腺癌的辅助内分泌治疗是5-10年的他莫昔芬,治疗时间需个体化确定,与女性一样,需权衡复发风险和副作用。他莫昔芬在男性乳腺癌转移、辅助治疗时均有生存获益,副反应包括静脉血栓、白内障、性功能异常、情绪变化、潮热和腿痉挛。 芳香化酶抑制剂对男性乳腺癌的疗效不清楚,可能有效性低于女性,有研究显示辅助性芳香化酶抑制剂的生存结果差于他莫昔芬。几项研究中评估了健康男性使用芳香化酶抑制剂后的激素变化,结果显示雌二醇水平下降50%,睾酮水平下降60%,黄体生成素和卵泡刺激素增高。男性使用阿那曲唑后雌二醇水平14.1 pg/ml,绝经后女性1 pg/ml,雌二醇在男性受抑不充分可能与下丘脑和垂体回路有关,加用促性腺激素释放激素(GnRH)类似物可克服这一缺陷。不适合他莫昔芬治疗男性,如血栓病史患者,可在辅助治疗中采用GnRH类似物±芳香化酶抑制剂治疗,单药芳香化酶抑制剂并非男性乳腺癌标准辅助治疗。 男性转移性乳腺癌的治疗与女性类似,但并无相关数据支持内分泌治疗的有效性。早期研究采用手术治疗,如睾丸切除、肾上腺切除和垂体切除,并发症非常多,现已不常规应用。男性乳腺癌转移的现代内分泌治疗与女性一致,包括他莫昔芬、芳香化酶抑制剂和氟维司群。 病例报告显示,无论单药芳香化酶抑制剂还是与GnRH类似物联合,均有治疗反应,但后者可能更优。氟维司群是选择性雌激素受体下调剂,对激素受体阳性男性转移性乳腺癌具有治疗作用,联合GnRH类似物治疗男性转移性乳腺癌,26%部分缓解,48%疾病稳定,反应率与女性相似。尚无研究比较氟维司群单药与氟维司群联合GnRH类似物,不过单药氟维司群可能也有治疗作用。 周期素依赖性激素(CDK)抑制剂或mTOR抑制剂与内分泌治疗联合,与单独内分泌治疗比较,可明显改善女性乳腺癌结果,但尚缺乏男性乳腺癌结果。NCCN指南推荐男性转移性乳腺癌的治疗与绝经后女性一致,缺点是芳香化酶抑制剂单药有效性可能劣于芳香化酶抑制剂与GnRH类似物的联合治疗,因此CDK抑制剂或mTOR抑制剂与内分泌治疗联合治疗男性转移性乳腺癌是合理选择。 治疗后随访 通常男性乳腺癌的随访与女性相似,然而钼靶检查的有效性尚不明确,影像学检查可能并非必需。男性接受GnRH类似物治疗时,增加骨丢失风险,因此推荐患者接受基线和每2年一次的骨密度评估。潮热是GnRH类似物和他莫昔芬最常见副作用,可采用文拉法辛治疗。 展望未来 男性乳腺癌仍有许多问题需要进一步明确,需要更多努力以减少男性乳腺癌的治疗不充分,更好的理解男性乳腺癌生物学,特别是与女性乳腺癌的不同。国际男性乳腺癌计划收集了1400余例男性乳腺癌进行分析,包括RNA测序等都在进行中,该组织还有一项关于男性乳腺癌生活质量的研究。上述研究的最终目标是开展男性乳腺癌治疗的临床研究。 其它正在进行的有关男性乳腺癌的研究包括口服选择性CYP17裂解酶抑制剂和雄激素受体阻滞剂有效性和安全性的研究,德国乳腺癌小组开展了一项2期临床研究,比较他莫昔芬、他莫昔芬联合GnRH类似物以及芳香化酶抑制剂联合GnRH类似物。 目前许多临床研究不但向女性乳腺癌均开放,也向男性乳腺癌开放,以建立男性乳腺癌治疗的证据基础,从而进一步改善男性乳腺癌的治疗结果。
 席菁乐 副主任医师 南方医科大学南方医院 肿瘤科1470人已读
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科1470人已读 - 精选 专家教您应对头颈部肿瘤5大放化疗常见不良反应
头颈部肿瘤是一大类疾病,常见的头颈部肿瘤包括鼻咽癌、下咽癌、副鼻窦癌、舌癌、喉癌、扁桃体癌、涎腺肿瘤等。虽然头颈部解剖复杂,组织来源众多,但大部分为鳞癌,有许多相同或相似的特征。 与其他恶性肿瘤一样,头颈部肿瘤也优先考虑手术安全切除。但由于头颈部集中了诸多重要器官,控制着视、听、嗅觉、呼吸、发声与进食等重要的生理功能,手术全部切除难度较大,因此常需要辅以同步放化疗。值得注意的是头颈部放化疗有较严重的急性和晚期毒性反应,那么常见不良反应有哪些,又该如何防治呢? 1 皮肤红、肿、热、微痒 专家支招:照射区域皮肤反应一般在治疗第二、三周后开始出现,主要包括红、肿、热、微痒等,开始有干性脱屑,部分患者可发展为湿性皮炎及至皮肤溃疡。故在放疗期间应穿着大圆领棉质衣服,避免暴晒、摩擦、抓挠以及用淋浴霜、肥皂擦洗颈部皮肤,建议使用皮肤辐射保护剂,每日涂抹放射野皮肤至少4-5次。治疗所致皮肤变黑等会随时间自然消退。 2 放射性黏膜反应 专家支招:口腔黏膜炎、鼻腔黏膜炎、咽喉炎等放射性黏膜反应,临床表现为口腔红斑、溃疡、咽痛、鼻腔干燥不适、鼻塞、声嘶等。其中口腔黏膜炎发生率为100%,常于治疗第二周开始逐渐加重,部分患者因黏膜损伤严重而被迫中断治疗,故治疗期间应避免烟酒、酸辣等刺激食品,保持口腔清洁,使用含氟牙膏三餐后刷牙,用盐水或朵贝尔液漱口,必要时可用0.2%的普鲁卡因液含漱止痛;鼻腔黏膜炎则可用复方薄荷油滴鼻,或用生理盐水每日1-2次冲洗鼻腔。症状明显时应主动联系医生予适量药物治疗。 3 厌食及恶心呕吐 专家支招:常见的全身反应有厌食、恶心呕吐、疲乏等,可以服用维生素B6、吗丁啉、胃蛋白酶等。另外加强营养,尽量进食含蛋白丰富的食物,如肉粥、蒸蛋、牛奶、蛋白粉等,避免过度清淡饮食,适度进食稍咸食物,治疗期间应避免体重减轻超过10%以上。如反应严重,可采用配合输液,静脉止吐、营养支持等治疗。 4 口腔干燥症 专家支招:口干症是头颈部肿瘤放化疗最常见的迟发毒性反应,是由于治疗过程中唾液腺功能受损导致分泌减少而引起。患者可随身携带水壶漱口或饮用,适当辅以生津去火的中药,如胖大海、麦冬、菊花、绿茶等冲泡服用。 5 颞下颌关节强直 专家支招:放疗后患者常有张口受限的情况,此为远期放疗反应,无特殊治疗措施,重在预防,故治疗期间即需练习张口运动,门齿间距3.5-4cm,维持5分钟,休息10分钟,坚持张口训练至少100次/天,并坚持终身。
席菁乐 副主任医师 南方医科大学南方医院 肿瘤科3348人已读



