杨建医生的科普号
- 医学科普 又一个复发性流产的保胎治疗成功
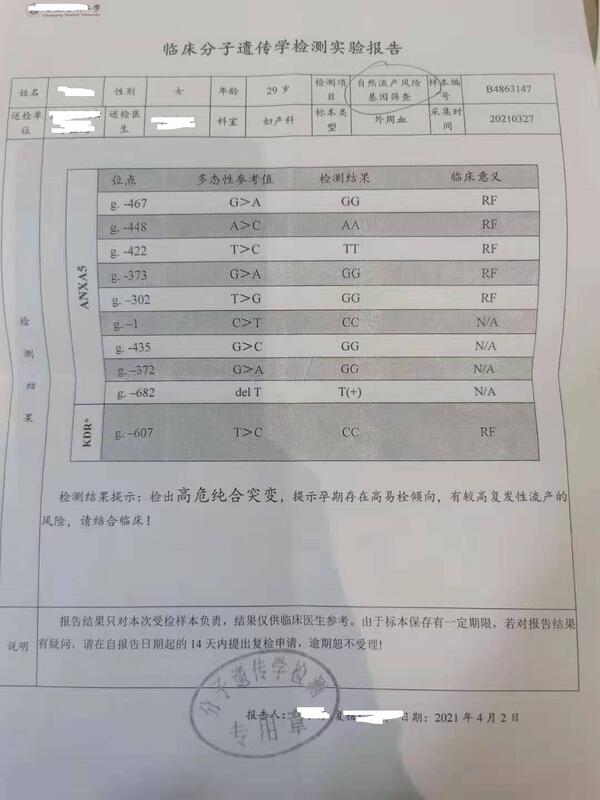
女,29岁,3年前两次自然流产在我院行人流术,G2P0,这半年一直在调整身体,自然流产的一般检查都查了的。均正常,包括:抗心磷脂抗体(ACL);抗β2GP-l抗体;狼疮抗凝因子(LAC),抗核抗体、D-二聚体、和部分血凝时间(APTT),类风湿因子、抗双链DNA抗体、抗干燥综合征SSA抗体、抗SSB抗体等。然,2021.4在重医查了自然流产的基因筛查,发现下面的问题:诊断易栓症。叶酸基因筛查:中危。孕前2个月在口服阿司匹林50mg每天一次,维生素b12,葡萄糖酸锌,叶酸。末次月经:2021.7.212021.8.22停经32天,血hcg175,孕酮31.7,叶酸正常值范围。少量阴道出血。那曲肝素钙3075iu皮下注射。黄体酮针40mg肌注,叶酸0.8mg。阿司匹林50mg每天一次。2021.8.25停经35天hcg756,孕酮18.3.PRL20.1雌二醇960.2pmol/l(大约261pg/l)。加上:补佳乐3mgbid地屈孕酮10mgbid2021.8.29hcg3703,孕酮27.5ng/ml2021.9.3hcg11547,雌二醇433.25pg/ml,孕酮大于40ng/ml,B超:孕囊1.20.7cm。强的松减量成5mg每天。2021.9.27孕9周多,目前没有问题。2021.11.14孕13周多,前面用药逐渐停药。2022,4月顺产。
 杨建 副主任医师 医生集团-重庆 线上诊疗科45人已读
杨建 副主任医师 医生集团-重庆 线上诊疗科45人已读 - 产科指南 2020卡前列甲酯专家共识,含:缩宫素、米索前列醇、卡孕栓的比较
指南要看,但也要思考:米索前列醇片,指南里面写得很清楚:WHO推荐用于产后出血预防联合用药选择中有缩宫素和米索前列醇,国内更多的是联合应用卡孕栓与缩宫素, 大量临床研究已经显示效果更好且副反应更小。用于预防产后出血,包括顺产、剖宫产、引产有高危因素,或者出血>200ml,要早用,胎儿娩出后立即用,可以明显减少出血,我国产后出血引起孕产妇死亡,依然发生率很高,预防产后出血更重要。本共识提出预警前移: 对于存在产后出血高危因素者, 在分娩后就可以采用两种一线宫缩剂联合用药; 当出血在200 mL且子宫收缩不好仍继续出血时及时采用宫缩剂的联合应用, 阻断出血继续增多 。比较:催产素半衰期5-7分钟,也有写1-6分钟的,所以作用时间短,一般肌注,或者静脉持续滴注来维持作用。米索前列醇,口服药物高峰15分钟,口服1.5小时完全吸收,半衰期36-40分钟。卡孕栓说明书为阴道给药, 2~3h血药浓度达峰值,半衰期约为30分钟, 持续有效时间 6~8h。从半衰期看,那么如果都从阴道或者直肠给药,米索前列醇可能作用持续时间更长。指南认为卡孕栓副作用比米索前列醇少,效果更好。指南认为直肠给药药代动力学效率不高,但我们换个角度考虑,如果在紧急缩宫止血的时候,建议口服舌下含化,起效最快,出血减少后直肠给药,吸收慢,但效果更持久。米索前列醇:根据最新发表证据,2017指南增加了米索前列醇的几条其他给药途径。涉及较多的为口腔颊黏膜给药途径,颊黏膜血流量大,渗透性较高,药代动力学效率高于经阴道给药,可以起到较好的吸收作用,给药 30 分钟后即可被完全吸收。指南建议的给药途径并未包含经直肠给药途径,主要是因为经直肠途径给药的药代动力学效率不高。------看来以前经验性经直肠给药的途径需要改变?但会不会吸收慢,反而持续时间更长呢,有时候我们需要的是子宫收缩的持续时间。缩宫素的药理作用决定其对于子宫下段促收缩作用差。前列腺素制剂具有子宫体和子宫下段的双重促收缩作用, 是与宫缩素最好的联合用药选择 。
杨建 副主任医师 医生集团-重庆 线上诊疗科4113人已读 - 医学科普 一个临床案例的讨论
http://mp.weixin.qq.com/s?__biz=MzI5MzU3MjA3OQ==&mid=2247491250&idx=1&sn=4241433fdcdcbda1551f48843d6aa8fb&chksm=ec714232db06cb245efd013da17c75df1afce30e14229abf3198b75fdff2c109f6a1f0a6be22&mpshare=1&scene=23&srcid=08135kbAV1WefWq0FicBqwPW&sharer_sharetime=1629767573440&sharer_shareid=28a29c5f2f288559ce3ab4d458665e56#rd上面的这个案例,讨论如下,可以给临床一些指导与思考,不恰当的地方,请指出:最开始小女孩在当地治疗的时候,雌激素一开始的剂量不够,按照戊酸雌二醇的功血止血的说明,4-6mg,每8小时一次。而小女孩开始使用的是3mg,每八小时一次,效果不好,后面再加量的。我们很多临床医生,在功血治疗的时候,常常就犯这样的错误,总想用小剂量一点的药物,害怕剂量大了,所以效果常常不好。功血的治疗,要求剂量要足够,12-24小时出血明显减少,3天出血完全停止,否则后面再加量效果反而不好。功血的指南里面关于黄体酮的描述:“对于急性AUB建议肌注黄体酮20mg/d×3天”,这个描述是不恰当的,容易给基层医生造成误解,现在很多文章都在引用,急性出血的时候,用这个治疗多数没有效果。有效的是可能你不用,过几天出血也会减少,只是巧合。第二时间太长,如果,一开始剂量就足够的话,那么一般3天血止,血止后巩固2天,然后每三天减量,雌激素就可以逐渐减少到维持剂量。但是,这个病人的治疗大剂量雌激素使用了九天血止,而且后面没有描述减量的时间,但是开始的剂量太大,维持的时间太长,促进子宫内膜过度生长,是造成后面子宫内膜过厚的原因。用药的不恰当,青春期功血,雌激素水平低的时候才用雌激素止血,而雌激素不低的情况下,或者紧急大量出血的时候,不建议使用单纯雌激素止血,这个小女孩出血时间长,出血量多,那么说明她的雌激素是不缺乏的,子宫内膜一定很厚才会造成大出血,说明雌激素水平不低。所以用大剂量雌激素止血是不恰当的,那么应该选择孕激素为主的止血方式,或者避孕药每天4片,血止每3天减量。小女孩短时间用大量的雌激素不至于造成子宫内膜癌变,所以后面B超发现子宫内膜太厚,还是应该采用停药撤退性出血的方法,辅助使用雄激素、止血药、收缩子宫的药物,减少撤退性出血,而不应该使用宫腔镜和诊断性刮宫。
杨建 副主任医师 医生集团-重庆 线上诊疗科493人已读 - 医学科普 一个幼稚子宫的病例(子宫发育不良)
一个病例:一个医师朋友来电话咨询,她在门诊接诊了一个18岁多的女孩,发育好,肥胖,以前一直没有来过月经。在电话中说检查都是正常的,但用了黄体酮后,只有很少的点滴出血。询问诊断及进一步治疗。我在电话中说,如果原发性闭经的话,激素水平又是正常促性腺激素水平,那么不外乎就常见的三个原因:米勒管发育不全综合征,真两性畸形,先天性肾上腺皮质增生症。目前除了染色体结果没有回来以外,其他检查结果电话中说都是正常的。按照这三个疾病来排除,感觉都不是,没有器质性的病变,真两性畸形也没有生殖器异常的表现,雄激素水平不高。当时,我也奇怪了,这是什么呢?难道就是少见的发育延缓,少数情况下,有些人月经就是来得晚???我告诉她,从电话中说的激素水平来看,是正常女性的激素水平,应该很快就会排卵来月经的。?好大夫工作室妇产科杨建后来吃午饭,我又想起了这个病人,心里就将原发性闭经的各种原因默默的过了一遍。突然想到会不会是幼稚子宫。因为,印象中有个子宫发育不良的病人,23岁左右,不用药就偶尔才来月经,子宫发育差,不怀孕,我当时还想,如果早点来看,吃药促进子宫生长就好了,过了青春期,再用药,效果就差了。所以,印象有点深。那么,这个病人会不会也是幼稚子宫呢?叫她把B超传给我看看:B超:宫体大小423324mm,内膜厚度7.1mm,左卵巢20mm11mm,右卵巢1814mm。那么,显然子宫是偏小的。正常人群整个子宫长度7-8cm,子宫横径4-5cm,前后径3-4cm,生育后横径会偏大,大约在4.5-5.5cm。我认为诊断为子宫发育不良,也就是幼稚子宫。我建议,吃2-3倍生理剂量的雌激素,促进子宫的发育。但是,资料显示要诊断幼稚子宫需要子宫腔与宫颈管的比例约1:1或者子宫体的长、宽、厚分别低于5厘米、4厘米、2厘米者,才能诊断子宫发育不良。而这个病人,前后径2.4cm,难道就不诊断了。紧接着我查了资料,想查找青春期女性不同年龄的子宫径线范围值。通过一段时间的搜索查找,终于找到两篇文章。其中有不同年龄子宫大小范围值:下面为文章1里面的截图:下面为文章2里面的截图:紧接着,重新让患者打了个B超,本意是让B超测量子宫腔与宫颈管的比例,但是B超医生没有测量,报告了宫体大小:45(长)44(宽)26(厚)mm,内膜7mm,右卵巢2314mm,左卵巢2013mm。前面的检查,B超:宫体大小423324mm,内膜厚度7.1mm,左卵巢20mm11mm,右卵巢1814mm。根据子宫腔与宫颈管的比例约1:1或者子宫体的长、宽、厚分别低于5厘米、4厘米、2厘米者的诊断标准,从两次B超结果来看,没有测量宫腔和宫颈管的比例,但是子宫体的大小诊断幼稚子宫不达标,而且B超医师认为要测量的3个数据之和小于标准才能诊断。我的疑问是,难道就不诊断了?妊娠期糖尿病的标准这些年来不是也改变了好多次吗?诊断其实也是人为定下的标准,这个标准我们知道有可能是个大多数幼稚子宫的标准,有些标准会将少数人排除在外,那么在诊断标准和正常人之间的部分人怎么办?第一次B超子宫体的长和宽都符合幼稚子宫标准,只是前后径不符合。如果测量子宫腔与宫颈管的比例,有可能符合1:1的诊断标准。再说子宫发育不良的时候,在正常子宫和符合发育不良标准的以外的,难道就不管它了???再看两篇文献摘录的不同年龄子宫大小,这个患者目前18岁,相当于图一的14岁,相当于图二的12岁,而患者实际年龄18岁多,但子宫发育明显延缓了4-6年。再看卵巢的大小,是不是也相当于12-13岁的卵巢大小。说明,这个患者的子宫发育肯定是有问题的。那么诊断就来了,这个患者应该是属于米勒管发育不全综合征,子宫发育不良。本病是副中肾管会合后短时期内即停止发育所致。症状主要是:女性到了性发育期的年龄,月经迟迟不来,或是月经稀少,乳房又不见明显隆起,阴毛稀少,即使月经来潮,量也特别少。关于治疗:文献是说用0.5-1mg补佳乐的生理剂量。我认为如果年龄小,身高发育差,骨龄明显小于实际年龄是可以的,以期待身高的继续增长,避免使用大剂量雌激素使身高停止生长。但如果身高已经发育得很好,年龄大于18岁已经成年,也过了16岁诊断原发性闭经的年龄,我认为还是较大剂量的雌激素更好,除非患者身高不达标。否则就会出现以前我所遇到的病例,患者到了育龄期该生育的时候,子宫还是很小,再吃药就没有用了。我印象里面促进子宫的发育是用2-3倍的雌激素剂量促进子宫发育。为了验证自己没有记错,我特意又去查了一下以前记录的文献:1.???????性腺发育不全患者应用天然雌激素,???服用克龄蒙3个月后有撤退性出血,但量少,加用补佳乐后,月经量有增多。单用克龄蒙与联用补佳乐比较有明显差异。2mg的戊酸雌二醇口服吸收后,理论上血液内的雌激素含量应该能达到早卵泡期水平,实际测量的浓度远远低于它的理论值。服用克龄蒙后的雌激素水平远远达不到生理周期的月经中晚期水平,服用克龄蒙3个周期后每日又加用补佳乐1片,亦即每日戊酸雌二醇3mg,测量血液中雌激素水平仍低于早卵泡期水平,对性腺发育不全患者激素补充以雌孕激素序贯疗法为宜,戊酸雌二醇使用3mg,甚至更大剂量,血中雌激素含量才能达到生理需要量,维持患者的第二性征发育和促进子宫发育更为有效。2.???????血浆雌二醇检测是评价雌激素替代治疗的金标准。药效学分析认为,血浆雌二醇浓度为40~100/,可基本达到临床治疗目的。这个患者相隔10天查了两次激素水平,第二次的雌激素25pg/ml是在最低限的水平,再低点就是绝经期的水平了。也证明了需要使用较大剂量的雌激素促进子宫的发育。因为按照上面的文献,需要血雌二醇达到40~100pg/ml,才能够达到治疗目的。
杨建 副主任医师 医生集团-重庆 线上诊疗科2359人已读 - 医学科普 再一个保胎治疗的经过追踪
患者贺某,33岁,G3P0,2011年自然流产一次(外伤,从楼梯上摔下去),2015年宫外孕一次。2020年7月我院行不孕手术,盆腔粘连,左侧输卵管积水,行伞端造口成型,术中宫腔镜检查发现宫腔粘连,左侧一半粘连封闭。7天后再次行宫腔镜粘连电切手术,术后球囊14天后放环3月,2020年11月取环,宫腔镜检查,宫腔形态大致正常,两次宫角凹陷消失,但见两个开口,插管通液无阻力。2020年12月,怀孕发现为宫外孕,我院腹腔镜行右侧输卵管切开取胚后缝合修复成型。月经周期30天,LMP:2021.3.104.6,28天,少量出血,以为是月经。4.7,29天,继续少量出血,血HCG305miu/ml,p63nmol/l(外院),观察4.11,33天,继续少量出血,血HCG1100miu/ml,p59nmol/l(外院),观察4.14,36天,少量出血,就诊我院门诊,血hcg4792miu/ml,p37.8ng/ml,B超0.80.3cm无回声。黄体酮20mg肌注,保胎灵口服。4.16,38天,出血增多,伴下腹坠胀,血hcg8779miu/ml,p80ng/ml,B超孕囊1.20.5cm,卵黄囊0.3cm。收住院。治疗不变。4.17,39天,住院后次日查房,发现4.14门诊查的激素水平中雌激素1280pmol(349pg/ml)。给予补佳乐3mgbid。孕酮正常的,所以黄体酮其实可以停的,但是没有管它,继续肌注。入院后查D二聚体,肝肾功,甲状腺功能,TORCH,抗心磷脂抗体,抗核抗体等无异常,血常规HB105g/l。予补铁。4.18,40天,出血减少,血hcg11888miu/ml,p80ng/ml,孕囊1.40.7cm,继续黄体酮20mg肌注,补佳乐3mgbid。4.21,43天,褐色分泌物,血hcg19617miu/ml,p56.2ng/ml,B超:孕囊1.81.0cm,见胎芽0.2及胎心,卵黄囊0.3。继续黄体酮20mg肌注,补佳乐3mgbid。4.24,46天,褐色分泌物,血hcg26535miu/ml,p80ng/ml,雌二醇:2321pmol(633.6pg/ml)。B超:孕囊1.71.0cm,胎芽0.4,卵黄囊0.3。补佳乐3mgbid。停黄体酮。叫患者下床适当活动,但患者几乎不下床,所以,陈旧性积血慢慢排出的时间会延长。今天出院。4.29,51天,褐色分泌物,血hcg73306miu/ml,p26.29ng/ml,雌二醇:569.76pg/ml。B超:孕囊2816mm,胎芽1.0,见3mm液性暗区。补佳乐3mgbid。黄体酮20mg肌注。5.6,59天,无出血,血hcg117912miu/ml,p29.54ng/ml,雌二醇:823.2pg/ml。B超:孕囊3519mm,胎芽1.5。补佳乐3mgbid。黄体酮20mg肌注。5.12,64天,再次出血,而且偏多,告知患者如果超过月经量保不住就只有放弃了,患者到外院住院,医师建议再观察,血hcg193382miu/ml,p46ng/ml,雌二醇:1118pg/ml。B超:孕囊4029mm,胎芽2.3。补佳乐2mgbid。嘱咐一周减少2mg直到停药。由于前面原因都几乎已经筛查完了,暂时未发现明确的出血原因,如果再出血,要么胚胎本身有问题,如果不流产则中期做胎儿畸形的相关筛查,要么与宫腔粘连引起的内膜瘢痕有关。5.19,71天。补佳乐1mgbid。6.5,12周+1天。目前无异常。停药,保胎结束,等待后面的畸形筛查。6.8,12周+4天,超声:双顶径22mm---13周4天,头臀径61mm---12周4天。NT:1.5mm,胎盘下缘距离宫颈内口22mm,脐带插入胎盘距上缘8mm。孕期的出血或许与胎盘脐带的异常有关。6.24无创DNA:低风险。7.31随访,无异常。12.9??39周顺利自然生产。
杨建 副主任医师 医生集团-重庆 线上诊疗科802人已读 - 妇科指南 【指南与共识】阴道松弛综合征的早期识别与修复整形专家共识杨建 副主任医师 医生集团-重庆 线上诊疗科1080人已读
- 内分泌指南 (2018)中国绝经管理与绝经激素治疗指南
指南 |中国绝经管理与绝经激素治疗指南(2018)好大夫工作室妇产科杨建2019-01-03休斯敦馆阅3744转53中华医学会妇产科学分会绝经学组【摘要】《中国绝经管理与绝经激素治疗指南(2018)》由中华医学会妇产科学分会绝经学组的全体专家在2012版指南基础上修订,并采纳了国内相关学术领域专家的修改意见,旨在指导医疗保健专业人士优化绝经过渡期及绝经后妇女的健康管理。本指南综合了本领域近年来的研究进展,也借鉴了近几年全球各大绝经学会相应指南中的重要信息,并纳入了证据水平和建议等级;保留了2012版指南中的规范绝经激素治疗(menopause hormone therapy, MHT)诊疗流程,并有所改进;增加了绝经的分期系统——生殖衰老研讨会分期+10,便于理解生殖衰老过程的临床、生物学、内分泌变化;肯定了MHT的最佳适应证是治疗血管舒缩症状(vasomotor symptoms,VMS)、生殖泌尿道萎缩相关问题和预防绝经相关的低骨量及骨质疏松症。MHT的风险取决于药物类型、剂量、使用时间、管理方式、启动时间以及是否使用孕激素。MHT应依据现有最好的证据个体化进行,定期重新评估是否继续或停止MHT,以获得最大收益及最小风险。对年龄小于60岁或绝经10年内无MHT禁忌证的妇女,针对VMS、骨量丢失和骨折,启动MHT治疗的收益风险比最高。只要无禁忌证,早发性卵巢功能不全患者应给予激素补充治疗至普通女性自然绝经的平均年龄,之后按照绝经后MHT原则进行。【关键词】指南;绝经;绝经激素治疗;激素补充治疗;血管舒缩症状;乳腺癌;心血管疾病;认知;绝经生殖泌尿综合征绝经的本质是卵巢功能衰竭。伴随卵巢功能的衰退,女性会出现多种绝经相关症状、组织萎缩退化和代谢功能紊乱,导致一系列身心健康问题。随着人类寿命的延长,绝经过渡期和绝经后期已成为女性生命周期中最长的一个阶段,需要对该阶段女性进行全面生活方式指导和健康管理,包括饮食、运动、控烟、限酒等,并指导适宜人群开展绝经激素治疗(menopause hormone therapy, MHT),或对非适宜人群采用非激素治疗,以缓解更年期相关症状,提高和改善其生命质量。MHT是针对卵巢功能衰竭而采取的一种治疗措施。经过多年实践证实,科学应用MHT可有效缓解绝经相关症状,绝经早期使用还可在一定程度上预防老年慢性疾病的发生[1- 2]。为使国内各级医师更好地开展绝经管理并指导治疗,中华医学会妇产科学分会绝经学组基于国内外最新循证医学结果和最佳证据,参考国际最新相关指南,结合我国具体情况,在2012年修订的《绝经期管理与激素补充治疗临床应用指南》[3]基础上,经多次讨论修改,制定本指南。本指南中应用的证据水平和建议等级来自英国皇家学院UK Green TOP指南[4]。1绝经的诊断和分期1.1诊断绝经是指月经永久性停止,属回顾性临床诊断。40岁以上女性末次月经后12个月仍未出现月经,排除妊娠后则可临床诊断为绝经(注:这个概念有误导之嫌,应该加上:并且激素水平符合绝经的表现。因为我遇到好几个50岁以后1-2年不来月经的,主管医生直接诊断“绝经”,次日查房,建议查激素水平来确定诊断,结果,激素水平显示患者没有绝经,只是闭经而已。如果不查激素,也不干预的话,子宫内膜长期受雌激素刺激,癌变的可能性明显增加)。绝经的真正含义并非指月经的有无,而是指卵巢功能的衰竭。单纯子宫切除的妇女,虽然不再有月经来潮,如卵巢功能正常,则不属于绝经范畴。1.2分期随着临床和科研的深入,需对生殖衰老过程进一步细分。2011年发表的“生殖衰老研讨会分期+10”(Stages of Reproductive Aging Workshop+10, STRAW+10)是目前公认的生殖衰老分期金标准[B][5]。该分期系统将女性生殖衰老分为3个阶段:生育期、绝经过渡期和绝经后期,每个阶段又进一步划分为早期和晚期;生育期增加了峰期,用阿拉伯数字-5~+2表示;生育期晚期和绝经后期早期进一步细分为2~3个亚阶段,采用阿拉伯数字后加英文字母a、b、c表示,故整个生殖衰老分期由10个特定阶段构成(图1)。生殖衰老分期系统的主要标准是月经周期长度改变。进入绝经过渡期早期(-2)的标志是月经周期长短不一(即月经紊乱),10次月经周期中有2次或以上发生邻近月经周期改变≥7 d;进入绝经过渡期晚期(-1)的标志是月经周期≥60 d,且卵泡刺激素(follicle-stimulating hormone,FSH)≥25 U/L。绝经后期早期的+1a阶段为最终月经(final menstrual period,FMP)后的1年,+1a结束方能明确绝经;+1b为+1a后1年;在+1a和+1b阶段,激素水平仍然波动较大;进入+1c阶段,FSH稳定升高,雌二醇持续维持在低水平。+2期为绝经后期晚期,此阶段女性健康问题更多体现在各种组织器官退行性改变导致的各种疾病,包括骨质疏松症、心脑血管疾病、认知功能障碍等。需注意的是,STRAW+10分期标准适用于大多数女性,但不适用于多囊卵巢综合征、早发性卵巢功能不全(premature ovarian insufficiency, POI)、子宫内膜切除和子宫切除、慢性疾病及化疗影响了卵巢功能的女性,这些情况下应采用内分泌指标和窦卵泡计数等支持标准确定其生殖衰老分期。图1生殖衰老研讨会分期+10系统FSH:卵泡刺激素; AMH:抗缪勒氏管激素;*在周期第2~5天取血;**依据目前采用的国际垂体激素标准的大致预期水平2绝经健康管理策略和绝经激素治疗的指导原则2.1绝经健康管理策略卵巢功能衰退是女性衰老的突出表现,女性将经历月经改变直至绝经,并伴随多种绝经相关症状。绝经对心血管、骨骼、认知会产生持续不良影响,需对绝经女性开展全面健康管理,包括每年健康体检、推荐合理饮食、增加社交脑力活动和健康锻炼。中国幅员辽阔,地域差别大,结合各地的饮食习惯,建议全谷物纤维、足量蔬菜和水果、每周2次鱼类食品、控糖(≤50 g/d)、少油(25~30 g/d)、限盐(≤6 g/d)、限酒(酒精量≤15 g/d)、戒烟,足量饮水(1500~1700 ml/d)[6]。每日规律有氧运动,每周累计150 min,另加2~3次抗阻运动,以增加肌肉量和肌力[B]。2.2绝经激素治疗指导原则[1-3,7-9]2.2.1 MHT属医疗措施,启动MHT应在有适应证、无禁忌证、女性本人有通过MHT改善生活质量的主观意愿前提下尽早开始[A]。2.2.2绝经过渡期女性与老年女性使用MHT的风险和获益不同。对年龄<60岁或绝经10年内、无禁忌证的女性,mht用于缓解血管舒缩症状(vasomotor>2.2.3不推荐仅为预防心血管疾病和阿尔兹海默病目的而采用MHT。雌激素缺乏后尽早开始MHT可使女性获得雌激素对心血管和认知的保护[A]。2.2.4有子宫的女性在补充雌激素时,应加用足量足疗程孕激素以保护子宫内膜;已切除子宫的妇女,通常不必加用孕激素[A]。2.2.5 MHT必须个体化。根据治疗症状的需求、获益/风险评估、相关检查结果、个人偏好和治疗期望等因素,选择性激素的种类、剂量、配伍、用药途径、使用时间[A]。2.2.6接受MHT的女性每年至少接受一次全面获益/风险评估,包括绝经症状评分、新发疾病筛查、全面体检、必要的检查检验,讨论生活方式和防控慢病策略,根据评估结果个体化调整MHT方案。目前尚无证据支持限制MHT应用的时间,只要获益/风险评估结果提示获益大于风险则可继续使用MHT[A]。2.2.7不推荐乳腺癌术后患者使用MHT[B]。2.2.8仅为改善绝经生殖泌尿综合征(genitourinary syndrome of menopause,GSM)时建议首选阴道局部雌激素治疗;当口服或经皮MHT不能完全改善生殖泌尿道局部症状时,可同时加用局部雌激素治疗[A]。2.2.9绝经后腹部脂肪增加与雌激素水平降低有关[B]。雌激素治疗可减少绝经后腹部脂肪堆积,减少总体脂肪量,改善胰岛素敏感度,降低2型糖尿病的发病率[A]。3绝经激素治疗的适应证和禁忌证3.1适应证不同年龄女性启动MHT获益不同,推荐在卵巢功能衰退后尽早启动。对于POI患者,只要无禁忌证,建议行MHT。3.1.1绝经相关症状月经紊乱、潮热、多汗、睡眠障碍、疲倦、情绪障碍(如易激动、烦躁、焦虑、紧张、低落)等[A]。3.1.2生殖泌尿道萎缩相关问题(GSM)阴道干涩,外阴阴道疼痛、瘙痒,性交痛,反复发作的萎缩性阴道炎,反复下尿路感染,夜尿、尿频、尿急等[A]。3.1.3低骨量及骨质疏松症存在骨质疏松症的危险因素及绝经后骨质疏松症。MHT可作为预防60岁以下及绝经10年以内女性骨质疏松性骨折的一线选择[A]。3.2禁忌证(1)已知或怀疑妊娠;(2)原因不明的阴道出血;(3)已知或可疑患乳腺癌;(4)已知或可疑患性激素依赖性恶性肿瘤;(5)最近6个月内患活动性静脉或动脉血栓栓塞性疾病;(6)严重肝肾功能不全;(7)血卟啉症、耳硬化症;(8)现患脑膜瘤(禁用孕激素)。4绝经激素治疗的慎用情况慎用并非禁用,在应用前和应用过程中应咨询相应专业医生,共同确定应用MHT的时机和方式,同时采取比常规随诊更为严密的措施,监测病情进展。4.1子宫肌瘤子宫切除术后或肌瘤剔除术后的女性可行MHT。保留子宫行MHT者,肌瘤<3>5 cm风险可能会增大,肌瘤3~5 cm者应根据患者情况综合判断。对肌瘤而言,雌激素口服比经皮更安全,替勃龙比雌孕激素连续联合疗法(estrogen progestogen therapy, EPT)更安全[3,7,10]。4.2子宫内膜异位症子宫内膜异位症患者自然绝经后需MHT者,建议使用EPT(E+P)或替勃龙治疗,不建议使用序贯疗法,雌激素应使用最低有效剂量。严重子宫内膜异位症行子宫及双侧附件切除后的患者,如需MHT,建议使用雌孕连续联合激素方案或替勃龙治疗至少2年后再改为单用雌激素[11]。4.3子宫内膜增生症子宫内膜不典型增生的治疗原则是子宫切除。无不典型子宫内膜增生症须在治疗完全逆转后,才可考虑MHT。EPT对保留子宫的女性具有更高的安全性;全子宫切除术后是否需联合使用孕激素尚无明确证据。所有患者均应密切随访,有子宫者定期行子宫内膜活检术[12]。4.4血栓形成倾向所有绝经后女性开始MHT前均需对血栓形成的危险因素、血栓栓塞病史及家族史进行详细了解和评价,具有阳性病史者建议专科就诊咨询,必要时行易栓症相关筛查。经皮雌激素的血栓风险显著低于口服雌激素[13- 14]。4.5胆囊疾病MHT可能促进胆囊结石的形成,增加胆囊手术风险。经皮雌激素可能具有较高的安全性[15]。4.6系统性红斑狼疮雌激素在系统性红斑狼疮(systemic lupus erythematosus,SLE)的病理过程中可能起重要作用。SLE患者更容易出现卵巢早衰和骨质疏松。已有证据提示SLE活动期患者不适合MHT,病情稳定或处于静止期者可在严密观察下行MHT。此外,SLE患者有更高的血栓形成风险,应用经皮雌激素可减少血栓形成[16]。4.7乳腺良性疾病及乳腺癌家族史影像检查提示的乳腺增生并非病理性改变,不是MHT的禁忌证。组织学诊断的乳腺增生,尤其非典型增生,需咨询专科医生是否可行MHT。其他乳腺良性疾病包括脂肪坏死、乳腺纤维瘤、乳管乳头状瘤的乳腺癌风险尚不确定[17]。大多数乳腺癌是散发的,并无家族聚集性。MHT不会进一步增加有乳腺癌家族史女性乳腺癌的风险,也不会增加卵巢切除术后BRCA1或BRCA2基因突变女性的乳腺癌风险[18]。4.8癫痫、偏头痛、哮喘MHT中雌激素剂量的增加与癫痫发作频率增加相关[4]。先兆偏头痛是卒中高危因素,雌激素对偏头痛的作用与其血清浓度波动密切相关。血清雌二醇水平波动可能影响女性患者哮喘发作的严重程度,使用经皮雌激素或EPT可能具有更高的安全性。5绝经激素治疗常用药物和方案5.1常用口服药物5.1.1雌激素天然雌激素:17β-雌二醇、戊酸雌二醇、结合雌激素。注:结合雌激素片主要成份为:含有从孕马尿液中提取的雌激素混合物,为水溶性雌激素硫酸钠盐混合物。它是雌酮硫酸钠与马烯雌酮硫酸钠的混合物。同时还含有硫酸钠结合物、17α-氢马烯雌酮、17α-雌二醇和17β-_氢马烯雌酮。戊酸雌二醇是人体天然雌激素17β-雌二醇的前体。5.1.2孕激素5.1.2.1天然孕激素:微粒化黄体酮。5.1.2.2合成孕激素:地屈孕酮、17ɑ-羟孕酮衍生物[如醋酸甲羟孕酮(medroxyprogesterone acetate,MPA)]、19-去甲睾酮衍生物(如炔诺酮、醋酸炔诺酮、左炔诺孕酮、地诺孕素)、19-去甲孕酮衍生物(如诺美孕酮)、螺内酯衍生物(如屈螺酮)等。地屈孕酮是最接近天然的孕激素,对乳腺刺激较小。屈螺酮具有较强的抗盐皮质激素作用和一定的抗雄激素作用。推荐应用天然雌激素、天然或最接近天然的孕激素[A]。注:地屈孕酮,我最不喜欢用的孕激素,现在全国的妇产科医生多数都在用,我认为被吹得太神了,厂家的广告果然厉害,所以从心里抵触。注意,天然孕激素是微粒黄体酮和黄体酮针剂。地屈孕酮是合成的,只是接近天然。5.1.3雌、孕激素复方制剂5.1.3.1雌、孕激素序贯制剂雌二醇/雌二醇地屈孕酮片(注:芬吗通):每盒28片,前14片仅含雌二醇,后14片每片含雌二醇及10 mg地屈孕酮。因雌二醇含量不同分为两种剂型1/10和2/10,1/10中每片含1 mg雌二醇,2/10中每片含2 mg雌二醇。戊酸雌二醇/戊酸雌二醇醋酸环丙孕酮片(注:克龄蒙):每盒21片,前11片每片含2 mg戊酸雌二醇;后10片每片含2 mg戊酸雌二醇及1 mg醋酸环丙孕酮。5.1.3.2雌、孕激素连续联合制剂雌二醇/屈螺酮片(注:安今益):每盒28片,每片含雌二醇1 mg和屈螺酮2 mg。5.1.4替勃龙替勃龙有效成分为7-甲基-异炔诺酮,属于组织选择性雌激素活性调节剂,2.5 mg/片。口服后在体内代谢后产生较弱的雌激素、孕激素和雄激素活性,对情绪低落和性欲低下有较好的效果,不增加乳腺密度[19][A]。5.2常用非口服药物5.2.1经皮雌激素雌二醇凝胶,每2.5 g含雌二醇1.5 mg,每日经皮涂抹;半水合雌二醇皮贴,每贴每日释放17β-雌二醇50 μg,每周更换1次。雌激素经皮给药避免了口服的肝脏首过效应,减少了对肝脏合成蛋白质及凝血因子生成的影响。相对于口服,经皮雌激素的静脉血栓、心血管事件、胆囊疾病的风险显著降低,改善性欲的作用更优[14][A]。5.2.2经阴道雌激素雌三醇乳膏:每克乳膏含雌三醇1 mg;普罗雌烯阴道胶丸:每粒含普罗雌烯10 mg;氯喹那多-普罗雌烯阴道片:每片含普罗雌烯10 mg和氯喹那多200 mg;结合雌激素软膏:每克软膏含结合雌激素0.625 mg。雌三醇对子宫内膜刺激小,对血浆雌二醇水平基本无影响;普罗雌烯属于严格局部作用的雌激素,不吸收入血,不刺激子宫内膜增生;结合雌激素可轻度升高血浆雌二醇水平,对子宫内膜作用亦为轻度。5.2.3左炔诺孕酮宫内系统(levonorgestrel intrauter-ine system,LNG-IUS)含LNG 52 mg,每日向宫腔释放LNG 20 μg,维持5年。LNG使子宫内膜腺体萎缩、间质蜕膜化、内膜变薄,可预防和治疗子宫内膜增生[12][A],亦可用于MHT的子宫内膜保护[20][C]。5.3具体方案5.3.1单孕激素补充方案:适用于绝经过渡期早期,调整卵巢功能衰退过程中的月经问题。5.3.1.1口服:地屈孕酮10~20 mg/d或微粒化黄体酮200~300 mg/d或醋酸甲羟孕酮4~6 mg/d,于月经或撤退性出血的第14天起,使用10~14 d。5.3.1.2宫腔内放置:LNG-IUS,尤其适合于有子宫内膜增生的患者。5.3.2单雌激素补充方案:适用于子宫已切除的妇女,通常连续应用。5.3.2.1口服:戊酸雌二醇0.5~2 mg/d、或17β-雌二醇1~2 mg/d、或结合雌激素0.3~0.625 mg/d。5.3.2.2经皮:半水合雌二醇贴0.5~1帖/7 d;或雌二醇凝胶0.5~1计量尺/d,涂抹于手臂、大腿、臀部等皮肤(避开乳房和会阴)。5.3.3雌孕激素序贯方案:适用于有完整子宫、围绝经期或绝经后仍希望有月经样出血的妇女。5.3.3.1连续序贯:在治疗过程中每天均用药。可采用连续序贯复方制剂:雌二醇/雌二醇地屈孕酮片(注:芬吗通)(1/10或2/10) 1片/d,共28 d;也可连续用口服或经皮雌激素28 d,后10~14 d加用孕激素。5.3.3.2周期序贯:在治疗过程中每周期有3~7 d不用任何药物。可采用周期序贯复方制剂戊酸雌二醇片/雌二醇环丙孕酮片(注:克龄蒙),1片/d,共21 d;也可采用连续用口服或经皮雌激素21~25 d,后10~14 d加用孕激素,然后停药3~7 d,再开始下一周期。5.3.4雌、孕激素连续联合方案:适用于有完整子宫、绝经后不希望有月经样出血的妇女。可每天采用雌激素(口服或经皮)加孕激素,连续给药;也可采用复方制剂如雌二醇/屈螺酮片1片/d(注:安今益),连续给药。5.3.5替勃龙:1.25~2.5 mg/d,连续应用。5.3.6阴道局部雌激素的应用:可使用雌三醇乳膏、普罗雌烯阴道胶丸或霜、结合雌激素软膏,1次/d,连续使用2周,症状缓解后改为2次/周。短期(3~6个月)局部应用雌激素阴道制剂,无需加用孕激素<1+>,但缺乏超过1年使用的安全性数据,长期使用者应监测子宫内膜。6规范绝经激素治疗诊疗流程[21]6.1总体诊疗流程首先评估拟采用MHT患者的适应证、禁忌证和慎用情况。有适应证、无禁忌证、慎用情况控制良好者可予以MHT;存在禁忌证,或慎用情况尚未控制但急需治疗绝经相关症状者,给予非激素治疗。所有接受MHT的女性应同时进行健康指导。原则上不推荐女性60岁以后或绝经10年以上开始启用MHT。MHT应用中应定期随访,并评估风险和利弊,个体化调整MHT方案(图2)。6.2更年期门诊初次接诊流程接诊流程包括病史采集,经查体和必要的辅助检查以判断就诊对象的绝经状态,并进行医学处理前的基本临床检查(图3)。初次接诊的重要目的是判断是否有MHT的适应证,是否存在禁忌证和/或慎用情况。图2MHT临床规范诊疗流程MHT:绝经激素治疗6.3方案选择对所有患者进行更年期健康指导。拟接受MHT的患者,根据患者本人的意愿和病情特点,如子宫、全身或局部症状的个体化差异,风险和利弊评估结果,选择恰当的个体化MHT方案;不可或不愿接受MHT的患者,推荐非MHT疗法(图4)。6.4复诊和随访MHT的定期随诊非常重要。复诊的主要目的在于了解治疗效果,解释可能发生的乳房胀痛和非预期出血等副反应,关注MHT获益和风险,个体化调整方案,鼓励适宜对象坚持治疗。MHT的使用期无特殊限定,可按个体情况和本人意愿调整MHT方案或改变治疗策略,年长女性应更谨慎评估MHT风险和关注不良事件。只要获益大于风险,鼓励坚持规范用药,定期随访(图5)。图3更年期门诊初次接诊流程FSH:同图1; MHT:同图2;TSH:促甲状腺激素图4绝经激素治疗方案选择策略MHT:同图27绝经激素治疗的长期获益与风险7.1绝经后骨质疏松症绝经后由于雌激素缺乏,骨转换增加,骨吸收大于骨形成致骨量丢失加速,导致骨质疏松症发生风险明显增加。MHT通过抑制破骨细胞活动和降低骨转化以减缓绝经后女性骨量丢失,对于绝经前后启动MHT的女性,可获得骨质疏松性骨折一级预防的好处[2,22][A]。7.2心脑血管疾病对于年龄<>[23][A]。低剂量经皮雌激素(<50>[24][B]。不建议单纯为预防冠心病启动MHT[A]。近几年的随机临床试验,如DOPS[25]、KEEPS[26]、ELITE[27],证实了绝经早期启用MHT是可降低心血管损害并可能获益的“机会窗” <1+>。MHT相关静脉血栓栓塞症(venous thromboembolism,VTE)的风险随年龄增长而增加,且与肥胖程度呈正相关。口服MHT增加VTE事件风险,有VTE个人史的女性禁用口服雌激素治疗[A]。经皮雌激素不增加VTE的风险<2++>,有VTE高风险(包括体质量指数>30 kg/m2、吸烟、易栓症家族史)的女性,经皮雌激素可能更安全[24][B]。某些孕激素,如MPA,导致VTE风险增大[C]。7.3中枢神经系统MHT可改善与绝经相关的轻中度抑郁症状<1++>。及早开始MHT对降低阿尔茨海默病和痴呆风险有益,特别是手术绝经的女性[28][B]。>60岁或绝经10年以上才启用MHT会对认知功能产生不利影响,增加痴呆风险<1+>。MHT可能会增加癫痫患者的发作频率<1-~2->,与帕金森病风险无关[B],对偏头痛、多发性硬化症的影响尚不确定[B]。图5绝经激素治疗复诊与随访MHT:同图27.4 2型糖尿病雌激素可增加胰岛素敏感度[29],提高碳水化合物的代谢,有助于血糖控制,可减少或延缓发展为2型糖尿病。雌激素口服与经皮给药相比,能更大程度减少糖尿病的发展,尤其在绝经10年内受益更明显,但不提倡MHT用于预防2型糖尿病[30][A]。糖尿病患者冠心病风险发生率高,应用MHT时需加强监护,血糖控制不佳者,应慎重权衡MHT的利弊[B]。7.5绝经后肌肉骨关节症状绝经后肌肉骨关节症状是常见躯体症状,表现为肩、颈腰背部肌肉和肌腱疼痛;关节症状主要表现为肩、膝,腰骶关节和手指关节等部位的疼痛,常伴有骨关节炎。雌激素缺乏与骨关节炎发生有一定关系,MHT能够减少软骨的降解和关节替代手术<1+>。7.6肌肉减少肌肉减少症(下文简称肌少症)是一种以进行性骨骼肌质量减少和力量降低、功能下降为特征,进而引起相关衰弱、跌倒、残疾等不良事件的综合征。研究表明,体内性激素水平降低可能是肌少症发生的关键机制之一[31]。睾酮和雌激素水平下降加速肌肉减少及骨骼肌质量下降。对绝经后女性应用MHT可预防女性肌少症的发生[32][B]。7.7乳腺癌MHT引起的乳腺癌风险很小,治疗结束后风险逐渐降低[33][B]。乳腺癌风险增加主要与MHT方案中添加的合成孕激素有关,并与孕激素应用的持续时间有关[34]。天然孕激素和选择性雌激素受体调节剂优化了对代谢和乳腺的影响。与合成孕激素相比,微粒化黄体酮或地屈孕酮导致乳腺癌的风险可能更低[35]。现有数据显示,口服和经皮雌激素给药途径之间的乳腺癌风险并无差异[36]<2+>。7.8子宫内膜癌有子宫的女性,MHT方案中应加用足量及足疗程的孕激素以保护子宫内膜[A]。连续联合方案对防止子宫内膜增生和子宫内膜癌最有效,MHT序贯方案中孕激素的使用时间不应短于10~14 d[37][A]。7.9宫颈癌随机对照研究(WHI和HERS)显示,使用MHT不增加宫颈癌的风险[A]。长期队列研究结果类似[38][B]。7.10卵巢癌根据现有数据,MHT与卵巢癌的风险关系仍不明确[39- 40][B]。7.11肺癌WHI和观察性研究提示:单用雌激素或EPT均不增加肺癌的发病率[A];EPT≤5年,对所有类型肺癌有保护性作用;任何方案MHT治疗5~10年,对非小细胞肺癌有保护性作用;EPT≥10年的吸烟者肺癌风险增加[B];EPT肺癌的死亡风险较高,但不增加50~59岁妇女的肺癌死亡率[41- 42]。7.12结直肠癌MHT可降低结直肠癌发生风险[43- 44]<2++>。3项荟萃分析结果显示,MHT停止4年后仍然对结直肠癌风险降低具有有益的作用[45- 46][A]。7.13上消化道癌MHT与肝细胞癌之间无明确相关性[47]。MHT可能降低胃癌发生的风险[48]。MHT是否增加胆囊癌、食管癌发生风险目前仍有争议[49][C]。8绝经相关症状的治疗策略8.1血管舒缩症状8.1.1 MHT:对于无禁忌证的女性,雌激素是治疗VMS最有效的措施,同时可改善睡眠障碍、情绪不稳定等绝经症状,提高绝经女性健康相关的生活质量[50- 51][A]。8.1.2非MHT:主要用于有MHT禁忌证和对MHT有顾虑不愿意使用者。8.1.2.1选择性5-羟色胺再摄取抑制剂、选择性5-羟色胺和去甲肾上腺素双重再摄取抑制剂、可乐定对缓解VMS有一定效果,但不能作为MHT替代方案,可用于有MHT禁忌证的女性[52][A]。加巴喷丁对VMS有效,但副作用较前述药物多[53][B]。8.1.2.2经随机对照试验研究证实,某些中成药(如香芍颗粒[54]和坤泰胶囊[55])对缓解VMS及其他绝经期症状有效。某些植物药(如黑升麻[56])对缓解VMS及其他绝经症状可能有效。这些药物的长期安全性仍需更多的循证医学研究数据支持[C]。8.1.2.3生物同质激素:指具有与内源性激素相同分子结构的合成的外源性激素。尚无有力的证据支持该类激素制剂的安全性及有效性,不推荐使用[7,57][B]。8.1.2.4植物雌激素:常见的有大豆异黄酮。该类激素疗效尚存在争议,且缺乏长期的安全性研究数据,不推荐使用[58]。8.1.2.5其他:正念减压疗法、星状神经节阻滞、针灸、催眠等可能起到辅助治疗作用[59- 60][B]。8.2泌尿生殖系统症状GSM包括与绝经雌激素缺乏相关的外阴、阴道、尿道和膀胱症状与体征。生殖道症状包括生殖道干燥、烧灼、刺激,阴道润滑缺乏导致的性问题和疼痛。泌尿道症状包括尿急,尿痛和反复泌尿系感染。雌激素对GSM治疗最有效。8.2.1对于以GSM为主的绝经后女性:若无系统MHT禁忌证,首选阴道局部雌激素治疗[61];若有系统MHT禁忌证或生殖泌尿道萎缩症状,首选润滑剂和湿润剂治疗,若无效,可在严密观察下短期选择阴道局部雌激素治疗[62][A]。8.2.2全身症状明显同时合并GSM者,系统应用MHT可使GSM得到缓解;若缓解不明显,可在系统应用MHT的同时阴道局部应用低剂量雌激素[63]。8.2.3阴道局部雌激素治疗可减少复发性尿路感染的次数[64]<1+>。8.2.4不推荐使用系统MHT治疗压力性尿失禁[65][A]。8.2.5膀胱过度活动症(overactive bladder,OAB)是一种以尿急症状为特征的症候群,常伴有尿频和夜尿症状,伴或不伴急迫性尿失禁。阴道使用雌激素对改善尿急、尿频症状有优势<2+>,推荐抗胆碱能药物与局部雌激素联合使用作为治疗绝经后女性OAB的一线药物[66],同时结合生活方式改变及膀胱训练[A]。补充雌激素常与盆底锻炼、子宫托、盆底手术联合使用,改善胶原合成和阴道上皮萎缩症状,但在子宫脱垂治疗有效性方面缺乏证据。8.3绝经女性的性健康和避孕8.3.1绝经女性的性健康绝经症状与绝经期妇女生活质量密切相关。增龄和性激素水平的下降导致了绝经期妇女性功能障碍(female sexual dysfunction, FSD)发生率增高,心理和社会因素也有影响[67][B]。绝经期FSD的最常见表现是性欲减退,其次是与生殖道萎缩相关的性交困难和疼痛[68][C]。8.3.1.1 MHT可改善轻度至中度FSD(尤其在疼痛方面)[69][A],替勃龙也对FSD具有治疗价值[70][A]。睾酮治疗可能对性欲和/或性兴奋缺乏的妇女有用[71][A]。8.3.1.2阴道保湿和润滑剂能够有效治疗轻度至中度阴道干燥以缓解性交时的不适和疼痛[2][B]。8.3.2围绝经期避孕没有具体针对年龄的避孕方法禁忌证。复方口服避孕药可在避孕同时缓解绝经相关症状,缓解阴道干涩,但高龄女性使用复方口服避孕药的潜在血栓风险高于年轻女性[C],选择屏障法避孕更安全。孕激素宫内缓释系统(LNG-IUS)长效、可逆,可提供围绝经期的高效避孕(失败率<>[72][A]。不推荐绝经后女性使用复方口服避孕药代替MHT,复方口服避孕药更高的雌激素活性可能导致心血管不良事件风险增加[D],且对骨骼的保护作用不及MHT[72]。9早发性卵巢功能不全POI指女性在40岁前卵巢功能衰退的临床综合征,以停经或月经稀发4个月、间隔>4周,连续2次FSH>25 U/L为主要特征[73,74]。40岁以下和30岁以下女性POI的发病率分别为1%和0.1%[75]。由于雌激素水平下降更早出现,POI患者低雌激素相关问题如骨质疏松、心血管、泌尿生殖道健康问题及认知功能减退问题风险更大。POI女性MHT获益更多,风险更小。只要POI患者无禁忌证,应给予性激素补充治疗(hormone replacement therapy, HRT)至普通女性自然绝经的平均年龄,之后按照MHT原则进行[B]。POI患者年轻时需要相对较大剂量的雌激素[76],推荐剂量为17β-雌二醇2 mg/d、结合雌激素1.25 mg/d或经皮雌二醇75~100 μg/d。由于患者诊断POI后仍有5%的怀孕几率[77],在POI早期有避孕需求者可考虑短期应用复方口服避孕药(compound oral contraceptives,COCs),但不宜长期应用。HRT与COCs相比,对骨骼及代谢更有利[78]<1->。10小结卵巢功能衰退将给女性带来长期健康危害,严重影响其生活质量。因此,绝经管理理应成为妇产科专业工作者的必然使命。应针对不同需求和不同基础健康状态,采用最适宜于患者的措施改善相关症状,减轻由于雌激素缺乏带来的长期不良影响,让绝经过渡期和绝经后期妇女更具尊严地生活。参与制定本指南的专家组名单(按姓氏汉语拼音排序)曹媛(郑州大学第一附属医院)陈蓉(北京协和医院)陈子江(山东省立医院)丁岩(新疆医科大学第一附属医院)符书馨(中南大学湘雅二医院)郭雪桃(山西医科大学第一医院)惠英(北京医院)金敏娟(浙江省湖州市妇幼保健院)马颖(中国医科大学附属盛京医院)雷小敏(三峡大学附属仁和医院)李佩玲(哈尔滨医科大学附属第二医院)林元(福建省妇幼保健院)吕淑兰(西安交通大学医学院第一附属医院)罗敏(北京协和医院)穆玉兰(山东省立医院)任慕兰(东南大学附属中大医院)阮祥燕(首都医科大学附属北京妇产医院)史惠蓉(郑州大学第一附属医院)舒宽勇(江西省妇幼保健院)唐良萏(重庆医科大学附属第一医院)王世宣(华中科技大学同济医学院附属同济医院)吴洁(南京医科大学第一附属医院)谢梅青(中山大学孙逸仙纪念医院)徐春琳(河北医科大学第二医院)徐克惠(四川大学华西第二医院)徐苓(北京协和医院)杨欣(北京大学人民医院)阴春霞(长春市妇产医院)郁琦(北京协和医院)张绍芬(复旦大学附属妇产科医院)张淑兰(中国医科大学附属盛京医院)张学红(兰州大学第一医院)张雪玉(宁夏医科大学总医院)张治芬(杭州市妇产科医院)周红林(昆明医科大学第二附属医院)朱瑾(复旦大学附属妇产科医院)主要执笔人谢梅青(中山大学孙逸仙纪念医院)陈蓉(北京协和医院)任慕兰(东南大学附属中大医院)参考文献[1]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised Global Consensus Statement on Menopausal Hormone Therapy[J]. Climacteric,2016,19:313- 315.[2]Baber RJ, Panay N, Fenton A. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy[J]. Climacteric,2016,19:109- 150.[3]中华医学会妇产科学分会绝经学组.绝经期管理与激素补充治疗临床应用指南(2012版)[J]. 中华妇产科杂志,2013,48:795- 799.[4]Royal College of Obstetricians and Gynaecologists.Development of RCOG Greentop Guidelines (Clinical Governance Advice No. 1)[EB/OL]. https://www.rcog.org.uk/green-top-development.[5]Harlow SD, Gass M, Hall JE, et al. Executive summary of the Stages of Reproductive Aging Workshop +10: addressing the unfinished agenda of staging reproductive aging[J]. Climacteric,2012,15:105- 114.[6]中国营养学会.中国居民膳食指南(2016)[M].北京:人民卫生出版社,2016:10- 11.[7]The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of The North American Menopause Society[J]. Menopause,2017,24:728- 753.[8]Committee on Gynecologic Practice. Committee Opinion No. 698: Hormone Therapy in Pri-mary Ovarian Insufficiency[J]. Obstet Gynecol,2017,129:e134-e141.[9]Sarri G, Davies M, Lumsden MA, et al.Diagnosis and management of menopause: summary of NICE guidance[J].BMJ,2015,351:h5746.[10]Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative random-ized controlled trial[J]. JAMA,2002,288:321- 333.[11]Moen MH, Rees M, Brincat M, et al. EMAS position statement: managing the menopause in women with a past history of endometriosis[J]. Maturitas,2010,67:94- 97.[12]Gallos ID, Shehmar M, Thangaratinam S, et al. Oral progestogens vs levonorgestrel-releasing intrauterine system for endometrial hyperplasia: a systematic review and metaanalysis[J]. Am J Obstet Gynecol,2010,203:541- 547.[13]American College of Obstetricians and Gynecologists. ACOG committee opinion no. 556: Postmenopausal estrogen therapy: route of administration and risk of venous thromboembolism[J]. Obstet Gynecol,2013,121:887- 890.[14]Bergendal A, Kieler H, Sundstrom A, et al. Risk of venous thromboembolism associated with local and systemic use of hormone therapy in peri- and postmenopausal women and in relation to type and route of administration[J]. Menopause,2016,23:593- 599.[15]Liu B, Beral V, Balkwill A, et al. Gallbladder disease and use of transdermal versus oral hormone replacement therapy in postmenopausal women: prospective cohort study[J]. BMJ,2008,337:a386.[16]Canonico M. Hormone therapy and hemostasis among postmenopausal women: a review[J]. Menopause,2014,21:753- 762.[17]马薇,金泉秀,吴云飞,等.乳腺增生症诊治专家共识[J].中国实用外科杂志,2016,36:759- 762.[18]Rebbeck TR, Friebel T, Wagner T, et al. Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group[J]. J Clin Oncol,2005,23:7804- 7810.[19]Cummings SR, Ettinger B, Delmas PD, et al. The effects of tibolone in older postmenopausal women[J]. N Engl J Med,2008,359:697- 708.[20]Somboonporn W, Panna S, Temtanakitpaisan T, et al. Effects of the levonorgestrel-releasing intrauterine system plus estrogen therapy in perimenopausal and postmenopausal women: systematic review and meta-analysis[J]. Menopause,2011,18:1060- 1066.[21]中华医学会妇产科学分会绝经学组.绝经相关激素补充治疗的规范诊疗流程[J].中华妇产科杂志,2013,48:155- 158.[22]de Villiers TJ, Stevenson JC. The WHI: the effect of hormone replacement therapy on fracture prevention[J]. Climacteric,2012,15:263- 266.[23]Hawkes N. HRT increases risk of blood clots and stroke, finds new analysis[J]. BMJ,2015,350:h1336.[24]L’Hermite M. HRT optimization, using transdermal estradiol plus micronized progesterone, a safer HRT[J]. Climacteric,2013,16:44- 53.[25]Schierbeck LL, Rejnmark L, Tofteng CL, et al. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial[J]. BMJ,2012,345:e6409.[26]Harman SM, Black DM, Naftolin F, et al. Arterial imaging outcomes and cardiovascular risk factors in recently meno-pausal women: a randomized trial[J]. Ann Intern Med,2014,161:249- 260.[27]Hodis HN, Mack WJ, Henderson VW, et al. Vascular Effects of Early versus Late Postmeno-pausal Treatment with Estradiol[J]. N Engl J Med,2016,374:1221- 1231.[28]Gleason CE, Dowling NM, Wharton W, et al. Effects of Hormone Therapy on Cognition and Mood in Recently Postmenopausal Women: Findings from the Randomized, Controlled KEEPS-Cognitive and Affective Study[J]. PLoS Med,2015,12:e1001833, e1001833.[29]Bitoska I, Krstevska B, Milenkovic T, et al. Effects of Hormone Replacement Therapy on Insulin Resistance in Postmenopausal Diabetic Women[J]. Open Access Maced J Med Sci,2016,4:83- 88.[30]Stuenkel CA. Menopause, hormone therapy and diabetes[J]. Climacteric,2017,20:11- 21.[31]Maggiolini M, Picard D. The unfolding stories of GPR30, a new membrane-bound estrogen receptor[J]. J Endocrinol,2010,204:105- 114.[32]Greising SM, Baltgalvis KA, Lowe DA, et al. Hormone therapy and skeletal muscle strength: a meta-analysis[J]. J Gerontol A Biol Sci Med Sci,2009,64:1071- 1081.[33]Davey DA. Menopausal hormone therapy: a better and safer future[J]. Climacteric,2018:1- 8. doi: 10.1080/13697137.2018.1439915. [Epub ahead of print].[34]Kotsopoulos J, Gronwald J, Karlan BY, et al. Hormone Replacement Therapy After Oopho-rectomy and Breast Cancer Risk Among BRCA1 Mutation Carriers[J]. JAMA Oncol,2018. doi: 10.1001/jamaoncol.2018.0211. [Epub ahead of print].[35]Stute P, Wildt L, Neulen J. The impact of micronized progesterone on breast cancer risk: a systematic review[J]. Climacteric,2018,21:111- 122.[36]Crandall CJ, Hovey KM, Andrews C, et al. Comparison of clinical outcomes among users of oral and transdermal estrogen therapy in the Women’s Health Initiative Observational Study[J]. Menopause,2017,24:1145- 1153.[37]Sjogren LL, Morch LS, Lokkegaard E. Hormone replacement therapy and the risk of endome-trial cancer: A systematic review[J]. Maturitas,2016,91:25- 35.[38]Jaakkola S, Pukkala E, K Lyytinen H, et al. Postmenopausal estradiol-progestagen therapy and risk for uterine cervical cancer[J]. Int J Cancer,2012,131:E537-E543.[39]Bassuk SS, Manson JE. Oral contraceptives and menopausal hormone therapy: relative and attributable risks of cardiovascular disease, cancer, and other health outcomes[J]. Ann Epidemiol,2015,25:193- 200.[40]Beral V, Gaitskell K, Hermon C, et al. Menopausal hormone use and ovarian cancer risk: individual participant meta-ana-lysis of 52 epidemiological studies[J]. Lancet,2015,385:1835- 1842.[41]Manson JE, Chlebowski RT, Stefanick ML, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials[J]. JAMA,2013,310:1353- 1368.[42]Schwartz AG, Ray RM, Cote ML, et al. Hormone Use, Reproductive History, and Risk of Lung Cancer: The Women’s Health Initiative Studies[J]. J Thorac Oncol,2015,10:1004- 1013.[43]Grodstein F, Martinez ME, Platz EA, et al. Postmenopausal hormone use and risk for colorec-tal cancer and adenoma[J]. Ann Intern Med,1998,128:705- 712.[44]Grodstein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorectal cancer: a review and meta-analysis[J]. Am J Med,1999,106:574- 582.[45]Prentice RL, Pettinger M, Beresford SA, et al. Colorectal cancer in relation to postmenopau-sal estrogen and estrogen plus progestin in the Women’s Health Initiative clinical trial and obser-vational study[J]. Cancer Epidemiol Biomarkers Prev,2009,18:1531- 1537.[46]Manson JE, Chlebowski RT, Stefanick ML, et al. Meno-pausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials[J]. JAMA,2013,310:1353- 1368.[47]Mcglynn KA, Sahasrabuddhe VV, Campbell PT, et al. Reproductive factors, exogenous hor-mone use and risk of hepatocellular carcinoma among US women: results from the Liver Cancer Pooling Project[J]. Br J Cancer,2015,112:1266- 1272.[48]Camargo MC, Goto Y, Zabaleta J, et al. Sex hormones, hormonal interventions, and gastric cancer risk: a meta-analysis[J]. Cancer Epidemiol Biomarkers Prev,2012,21:20- 38.[49]Brusselaers N, Maret-Ouda J, Konings P, et al. Menopausal hormone therapy and the risk of esophageal and gastric cancer[J]. Int J Cancer,2017,140:1693- 1699.[50]Maclennan AH, Broadbent JL, Lester S, et al. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes[J]. Cochrane Database Syst Rev,2004:D2978.[51]Cintron D, Lahr BD, Bailey KR, et al. Effects of oral versus transdermal menopausal hormone treatments on self-reported sleep domains and their association with vasomotor symptoms in recently menopausal women enrolled in the Kronos Early Estrogen Prevention Study (KEEPS)[J]. Menopause,2018,25:145- 153.[52]Loprinzi CL, Sloan J, Stearns V, et al. Newer antidepressants and gabapentin for hot flashes: an individual patient pooled analysis[J]. J Clin Oncol,2009,27:2831- 2837.[53]Toulis KA, Tzellos T, Kouvelas D, et al. Gabapentin for the treatment of hot flashes in women with natural or tamoxifen-induced menopause: a systematic review and meta-analysis[J]. Clin Ther,2009,31:221- 235.[54]陈蓉,郁琦.香芍颗粒临床应用指导建议[J].中国实用妇科与产科杂志,2015,31:419- 420.[55]李存存,王晶晶,陈潮,等.坤泰胶囊与激素替代疗法治疗更年期综合征有效性和安全性比较的Meta分析[J]. 中国中西医结合杂志,2013,33:1183- 1190.[56]中华医学会妇产科学分会绝经学组.莉芙敏临床应用指导建议[J].中国实用妇科与产科杂志,2012,28:556- 557.[57]Gaudard AM, Silva DSS, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms[J]. Cochrane Database Syst Rev,2016,(8):D10407.[58]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms[J]. Cochrane Database Syst Rev,2013,(12):D1395.[59]Carmody J, Crawford S, Churchill L. A pilot study of mindfulness-based stress reduction for hot flashes[J]. Menopause,2006,13:760- 769.[60]Carmody JF, Crawford S, Salmoirago-Blotcher E, et al. Mindfulness training for coping with hot flashes: results of a randomized trial[J]. Menopause,2011,18:611- 620.[61]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of Symptoms of the Menopause: An Endocrine Society Clinical Practice Guideline[J]. J Clin Endocrinol Metab,2015,100:3975- 4011.[62]Faubion SS, Larkin LC, Stuenkel CA, et al. Management of genitourinary syndrome of menopause in women with or at high risk for breast cancer: consensus recommendations from The North American Menopause Society and The International Society for the Study of Women’s Sexual Health[J]. Menopause,2018,25:596- 608.[63]Gandhi J, Chen A, Dagur G, et al. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management[J]. Am J Obstet Gynecol,2016,215:704- 711.[64]Caretto M, Giannini A, Russo E, et al. Preventing urinary tract infections after menopause without antibiotics[J]. Maturitas,2017,99:43- 46.[65]Castro RA, Arruda RM, Bortolini MA. Female urinary incontinence: effective treatment strategies[J]. Climacteric,2015,18:135- 141.[66]Chughtai B, Forde JC, Buck J, et al. The concomitant use of fesoterodine and topical vaginal estrogen in the management of overactive bladder and sexual dysfunction in postmenopausal women[J]. Post Reprod Health,2016,22:34- 40.[67]Appa AA, Creasman J, Brown JS, et al. The impact of multimorbidity on sexual function in middle-aged and older women: beyond the single disease perspective[J]. J Sex Med,2014,11:2744- 2755.[68]Iglesia CB. What’s new in the world of postmenopausal sex?[J]. Curr Opin Obstet Gynecol,2016,28:449- 454.[69]Pines A, Sturdee DW, Maclennan AH. Quality of life and the role of menopausal hormone therapy[J]. Climacteric,2012,15:213- 216.[70]Biglia N, Maffei S, Lello S, et al. Tibolone in post-menopausal women: a review based on recent randomised controlled clinical trials[J]. Gynecol Endocrinol,2010,26:804- 814.[71]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline[J]. J Clin Endocrinol Metab,2014,99:3489- 3510.[72]Linton A, Golobof A, Shulman LP. Contraception for the perimenopausal woman[J]. Climacteric,2016,19:526- 534.[73]Webber L, Davies M, Anderson R, et al. ESHRE Guideline: management of women with premature ovarian insufficiency[J]. Hum Reprod,2016,31:926- 937.[74]中华医学会妇产科学分会绝经学组.早发性卵巢功能不全的激素补充治疗专家共识[J].中华妇产科杂志,2016,51:881- 886.[75]Sternfeld B, Wang H, Quesenberry CJ, et al. Physical activity and changes in weight and waist circumference in midlife women: findings from the Study of Women’s Health Across the Nation[J]. Am J Epidemiol,2004,160:912- 922.[76]Sullivan SD, Sarrel PM, Nelson LM. Hormone replacement therapy in young women with primary ovarian insufficiency and early menopause[J]. Fertil Steril,2016,106:1588- 1599.[77]Bidet M, Bachelot A, Bissauge E, et al. Resumption of ovarian function and pregnancies in 358 patients with premature ovarian failure[J]. J Clin Endocrinol Metab,2011,96:3864- 3872.[78]Cartwright B, Robinson J, Seed PT, et al. Hormone Replacement Therapy Versus the Combined Oral Contraceptive Pill in Premature Ovarian Failure: A Randomized Controlled Trial of the Effects on Bone Mineral Density[J]. J Clin Endocrinol Metab,2016,101:3497- 3505.2018 Chinese Guidelineon Menopause Managementand Menopause Hormone TherapyMenopause Group, Obstertrics and Gynecology Branch, Chinese Medical AssociationDepartment of Obstetrics and Gynecology, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730, ChinaCorresponding author:YU Qi Tel: 010- 69155012,E-mail:yuqimd@163.com【Abstract】This guideline has been announced by experts of Menopause Group, Obstetrics and Gynecology Branch, Chinese Medical Association on menopause management and menopause hormone therapy (MHT) to help healthcare professionals in optimizing their management of transitionally menopausal and postmenopausal women. New results on MHT and menopause management after 2012 as well as all of the important information from main international guidelines were reviewed. Levels of evidence and grades of recommendations were also included. The standardized MHT flowcharts of diagnosis and treatment were retained and improved from the last version. The menopause staging system, Stages of Reproductive Aging Workshop +10 (STRAW+10), was added to facilitate the understanding on clinical, biological, and endocrine changes in the reproductive aging process for doctors in this field. Vasomotor symptoms (VMS), genitourinary syndrome of menopause, and prevention of menopause-related low bone mass and osteoporosis were reconfirmed as the indications for MHT. The risks of MHT depend on types, dosages, time of use, management, start-up time, and whether progesterone is used. To maximize the benefits and minimize the risks, MHT should be individualized based on the updated evidence, and the benefit-risk ratio should be reassessed annually. For women within 10 years after menopause, or younger than 60 years old with no contraindications, MHT for the treatment of VMS and prevention of bone loss and fractures has the most favorable benefit-risk ratio. Premature ovarian insufficiency patients should be treated with hormone replacement therapy till the average age of natural menopause and followed by the postmenopausal MHT.【Keywords】guideline; menopause; menopause hormone therapy; hormone replacement therapy; vasomotor symptoms;breast cancer; cardiovascular disease; cognition; genitourinary syndrome of menopauseMedJPUMCH,2018,9(6):512-525本指南同期发布于《中华妇产科杂志》2018年第11期基金项目:中国医学科学院医学与健康科技创新工程(2017- 12M- 1- 002);国家重点研究发展计划(973计划) (2018YFC1002105)DOI:10.3969/j.issn.1674-9081.2018.06.007【文章编号】1674-9081(2018)06-0512-14【文献标志码】A【中图分类号】R711通信作者:郁琦电话:010- 69155012,E-mail:yuqimd@163.com中国医学科学院北京协和医学院北京协和医院妇产科,北京100730
杨建 副主任医师 医生集团-重庆 线上诊疗科1.3万人已读 - 医学科普 胚胎停育的保胎治疗
追踪,待续:女31岁,结婚后刚刚怀孕,出现胚胎停止发育的倾向。追问病史,以前有多囊卵巢综合征,曾服用达英35治疗高雄激素和调整月经,体型微胖。本次47天检查时发现血hcg增速减慢,47天时下降,去一家医院给开了地屈孕酮开始保胎治疗。从经验判断,大概率保胎效果不好,因为血HCG和孕酮都下降了。但是患者32岁,怀孕不容易,而且一直没有任何症状,考虑是多囊卵巢综合征等内分泌原因造成的异常。如果是胚胎异常造成的就不能保胎治疗了。准备保胎到70天,不行再放弃。好大夫工作室妇产科杨建???????????????????????血hcg?????孕酮????E2?????B超?????????????????????末次月经8.17??????????(miu/ml)(ng/ml)pg/ml)2020.9.13停经28天???现代21.94????20.92???80.532020.9.26停经6周-1天现代11662.4???30.84???604.4??孕囊1.20.8cm,隐约见卵黄囊。处理:无?????????????????????2020.10.5停经7周+1天人民?25316.4??15.01??????????孕囊2.40.82.2,胎芽0.60.3cm,见胎心??地屈孕酮1天2片2020.10.6停经7周+2天妇幼20751.6??18.6??????处理:hcg下降,去了两家医院不给打针2020.10.7?????????????????????????????????处理:诊所:黄体酮针3/天+地屈孕酮4/天2020.10.8停经7周+4天?妇儿36213.3??31.26???381.15?处理:黄体酮针2+地屈孕酮4+补佳乐6????2020.10.9停经7周+5天?妇儿34449.3??31.31???369.58?处理:黄体酮针2+地屈孕酮4+补佳乐6???2020.10.15停经8周+4天妇儿42217.2??24.74???659.95??孕囊3.02.0?,顶臀径1.6,见胎心,处理:黄体酮针3+地屈孕酮4+补佳乐6??2020.10.25停经10周-1??妇儿50874.4??37.76???1147.3??孕囊4.63.3?,顶臀径2.5,见胎心,处理:黄体酮针2+地屈孕酮4+补佳乐4????本来想保胎到10周左右决定是否继续,但因为一直没有出血等症状,所以,考虑胚胎本身可能没有问题,但hcg和孕酮值增长速度太慢,理论上hcg值8-10周进入最高峰值,每个医院的测定值不一样,但大致8-20万不等。胚胎相对来说,生长缓慢约1周以上。孕酮在打针的情况下也增长不满意,后来询问地屈孕酮也没有停药,考虑可能存在一些未发现的问题。虽然这是第一次妊娠,但年龄较大,好不容易保胎到10周了,也不想放弃,所以准备查查相关方面的检查:夫妻双方染色体,TORCH,妇科检查及白带常规,甲状腺功能,(空腹)血糖和胰岛素水平,血常规+ABO、Rh血型,肝肾功能,抗心磷脂抗体(ACL),抗β2GP-l抗体,狼疮抗凝因子(LAC),血小板聚集实验(PagT)、抗核抗体、抗双链DNA测定、D-二聚体、和部分血凝时间(APTT)、纤维蛋白原,血脂(包括甘油三酯,总胆固醇,血浆粘度等)、封闭抗体等。其中TORCH,甲功,血糖,血常规,凝血,D-二聚体已经检查了,只有血常规里面血红蛋白158,红细胞压积47.1,属于血液浓缩,嘱咐减少油脂类饮食,适当增加蔬菜,适度饮水,适度运动。2020.10.29停经10周+3--------------------------------处理:黄体酮针2+地屈孕酮4+补佳乐22020.10.31停经10周+5天???65230.9??32.58???1273.82?---处理:黄体酮针2+地屈孕酮42020.11.10停经12周+1天????????顶臀径5.459cm,NT1.7mm?,处理:地屈孕酮4(其他医生给吃的)到12周了,基本上保胎成功了。从所有的检查结果来看,除了血常规有浓缩的表现以为,其他都没有发现问题,所以,考虑这次胚胎有停止发育的倾向,主要是多囊卵巢综合征,造成的黄体功能不全,雌激素水平偏低,及胰岛素抵抗(父亲多年糖尿病患者偏胖)造成的。不是胚胎本身的问题。如果有出血,检查没有发现异常,没有其他疾病,保胎后继续出血1周以上,就要考虑可能是胚胎本身的问题,那么就不能盲目的继续保胎下去了。2021.4.21:目前怀孕35周,一切顺利。一些思考:国庆节回家看父亲。侄女32岁,结婚后刚刚怀孕,出现胚胎停止发育的倾向,我叫她到当地医院打黄体酮针,竟然去了两家医院都不给打针。只给开了地屈孕酮保胎和其他的一些在我看来属于保健品的东西。另外一个更年期多年的远亲,当地医院给开了莉芙敏片,吃了2年,一直没有效果。于是,我有感而发,谈谈个人观点。首先,我认为,目前国内很多医院,被国外的大医药公司给攻陷了,本来一种用了10几年甚至几十年的非常有效的好药,由于种种原因,逐渐快要退出历史舞台。国外大医药公司主要采取的办法是从国内的最高学府开始“洗脑”,资助开学术会议,大医药公司资助国内各种会议,这些知名的大牌专家讲课,介绍这些新药,本来是个双赢的局面。但是为了某些利益,那些曾经的经典用药就逐渐被淘汰了。估计只有少部分人才会坚持治疗有效的经典用药原则。比如上面说的黄体酮针。可以通过计算打几针次日早上查血可以升高孕酮多少值(应该是协和医院做的实验证实的),来准确的用于保胎治疗。但是,现在国内多数医院由于被会议,文章等的洗脑,都喜欢开口服的地屈孕酮或者其他药物。这些药物的吸收利用每个人不一样,比如我侄女吃的2片一天2次,次日只升高了3ng/ml,从15升高到18(不能确定疗效)。我改成黄体酮针,3针肌注,次日升高到34。至少说明地屈孕酮保胎不能确定疗效,而应该用经典的黄体酮针注射来准确计算使用剂量。莉芙敏我改成了替勃龙(利维爱),利维爱已经使用了几十年,疗效确切,而且也一直是协和医院在率先推广使用。可是......隐约记得最早的莉芙敏说明书,主要是用于雌激素依懒性肿瘤术后的替代治疗,比如子宫内膜癌,由于担心用雌激素替代治疗使肿瘤复发,所以推荐使用植物类制成的莉芙敏,因为市场上只有这一种,我觉得用于肿瘤病人可以接受。但是,现在的说明书,直接写成:治疗功效:用于更年期综合征,症见潮热、盗汗、失眠、烦躁、抑郁、头痛、心悸等。然后大量在围绝经期病人使用。可笑的是,这就是中药啊,偌大的中药大国,竟然使用外国的单一成分植物药,而且价格贵得离谱,而说到自己国家的中药时多数西医都是一种不信任的态度。建议国内的中药厂家都到国外去建厂,改个名,再拿回中国销售,必然很香。说实话,我不是完全反对这些药物的,但是,作为医生,在使用上,我们是不是应该想一想,哪个药物更适合?2020年9月《实用妇产科杂志》:绝经激素治疗的临床应用如何优化绝经激素治疗:相对年轻,仅有月经失调,无明显绝经相关症状的围绝经期女性,选择单用孕激素。已经切除子宫有绝经相关全身症状的女性,只需雌激素即可。口服或者经皮。围绝经期或者绝经早期,希望有月经,雌孕激素序贯治疗。年龄较大,绝经时间较长,不再希望有月经来潮的女性,建议选择雌孕激素联合或者替勃龙(利维爱)。若以GSM症状为主,首选阴道局部低剂量雌激素治疗。全身症状合并阴道局部症状,则全身用药+局部用药配合。我再次查了2018年的“中国绝经管理与绝经激素治疗指南(2018)”,里面可根本没有提到莉芙敏。摘录如下:5绝经激素治疗常用药物和方案5.1常用口服药物5.1.1雌激素天然雌激素:17β-雌二醇、戊酸雌二醇、结合雌激素。5.1.2孕激素5.1.2.1天然孕激素:微粒化黄体酮。5.1.2.2合成孕激素:地屈孕酮、17ɑ-羟孕酮衍生物[如醋酸甲羟孕酮(medroxyprogesteroneacetate,MPA)]、19-去甲睾酮衍生物(如炔诺酮、醋酸炔诺酮、左炔诺孕酮、地诺孕素)、19-去甲孕酮衍生物(如诺美孕酮)、螺内酯衍生物(如屈螺酮)等。5.1.3雌、孕激素复方制剂5.1.3.1雌、孕激素序贯制剂5.1.3.2雌、孕激素连续联合制剂5.1.4替勃龙(利维爱)替勃龙有效成分为7-甲基-异炔诺酮,属于组织选择性雌激素活性调节剂,2.5mg/片。口服后在体内代谢后产生较弱的雌激素、孕激素和雄激素活性,对情绪低落和性欲低下有较好的效果,不增加乳腺密度[19][A]。5.2常用非口服药物5.2.1经皮雌激素5.2.2经阴道雌激素5.2.3左炔诺孕酮宫内系统(levonorgestrelintrauter-inesystem,LNG-IUS)
杨建 副主任医师 医生集团-重庆 线上诊疗科1543人已读 - 专业知识 子宫脱垂和尿失禁手术之我见
子宫脱垂和尿失禁手术之我见:好大夫工作室妇产科杨建手术方法越简单,损伤越小,效果越好,异物越少,才是最好的方法。深以为然。关于子宫脱垂:几年前曾经听过一个会议,中日友好医院的凌斌教授讲了一个盆腔器官脱垂治疗的报告,前段时间无意中把会议的书拿出来翻看,他讲到,治疗盆腔器官脱垂,手术要恢复解剖,恢复生理功能,尽可能少的异物,尽可能小的损伤。无独有偶,前几天,也就是2020年9月26日的北京一个微创会议上,我在手机直播上正好看了一段,恰恰看了同济的童晓文教授的演讲。他对这些年的盆底手术做了一个总结,大意是盆底和尿失禁手术现在的各种医院做了许多不同方法的手术,各种新式手术遍地开花,而手术方法越多,越说明治疗这个疾病没有根本的最好的办法。他说,20多年来,他看见了各种不同的手术,有些手术某些人做了几例,写了几篇文章就消失了,或者做了几例,效果不好,并发症出现,也就不提了。并发症在你做了一定数量手术的时候,一定会出现。学做新的手术,要做成熟的,要做经典的,要跟好的老师学,学正规的手术。一直以来,我自己对于盆底补片手术的开展,也是一直抱有谨慎的态度,因为,网片的侵蚀感染等并发症一旦发生,作为异物,它是很难取出来的。我们都知道的美容手术,注射式隆胸,曾经风靡一时,但是后来出现问题的人,想要再取出来取干净,却是比登天还难。有一段时间,一种注射式阴道填充技术在美容小医院普遍开展,我遇到过两个注射后感染,形成了巨大的脓肿,患者承担了非常大的痛苦和后果。后来这种注射式方法好像也销声匿迹了。所以,手术的指征把握就显得很关键。美国FDA曾一度警告,网片在盆底应用时要严格掌握指征。其实,对于子宫脱垂,有一种比较简单有效的方法,值得基层医院推广,那就是:腹腔镜子宫腹壁悬吊术,在凌斌教授的那次会议上也提到过。这种方法是传统开腹手术的演变,2004年在川医进修时,就看见王平教授曾经开腹做过一例。现在有了腹腔镜的微创方法,我觉得值得推广和提倡。腹腔镜子宫腹壁悬吊术,具体又包括两种:腹壁圆韧带悬吊固定,腹壁子宫悬吊固定。前者只缝合圆韧带,在腹直肌前鞘外打结固定,后者,缝合子宫在腹直肌前鞘外打结固定,后者手术效果更好。最适合临近绝经年龄和绝经后的子宫脱垂患者,因为这样子宫再出现比如肌瘤需要再次手术的机会要小很多。当然,即使以后需要切子宫或者做其他手术,腹腔镜下剪刀分离恢复解剖结构还是比较容易的。在子宫极度后屈,子宫内膜异位后壁粘连等情况下,即使简单的做圆韧带的折叠缝合,将子宫变成水平或者前位,都是有好处的。腹腔镜子宫腹壁悬吊手术方法简单,效果立竿见影,副作用几乎没有。我认为,是治疗子宫脱垂的最好的方法,符合前面两位大咖说的简单,损伤小,效果好,无异物的原则,还保留了子宫。只不过,其他的手术方法包括补片,涉及到医院新手术的开展研究以及经济效益等问题。这种最简单有效的手术方法,我觉得值得推广和提倡。关于压力性尿失禁:女性轻度的尿失禁发生在更年期的,部分人局部补充点雌激素,再通过功能锻炼就可以恢复。轻中度尿失禁,我一般是做传统的尿道折叠术联合阴道前后壁修补,重度尿失禁才做TVT,TVT-O,TOT,TVT-S等吊带手术,2007年国际尿控协会认为尿道中段悬吊术是目前治疗压力性尿失禁的金标准,指的是中度或者重度。随着后来各国吊带手术并发症的增多,2012年前后美国FDA严格限制吊带手术只用于重度尿失禁。某些欧美国家甚至禁止做吊带手术。多年来许多人的观点都是传统手术效果不好,我现在一般重度尿失禁也是选择传统手术,但是我手术后的病人效果都不错,所以,我认为传统手术的效果与个人的操作方法有非常大的关系。这段红色字体为后面出现了一个复发病例,补上来的:这种简单的手术从2014年到2021年现在做了6-7年了。但是,不得不提的是,做腹腔镜腹壁悬吊的时候,一定要做阴道前后壁的修补,将阴道中下段缩紧到2指,当然不能缩小到影响性功能。因为最近(2021年3月)我遇到了失败的病例,是因为个别人阴道不膨出,就没有修补阴道壁,结果这个病人是个清洁工,经常要劳动,久站,而且她的皮肤非常细嫩,手术时还和周围人说,她的皮肤太细嫩,刀子吹皮即破,没有想到几个月后,她来医院说手术失败了。我心里也是懊恼和疑惑不已,线断了?不可能啊,两根10号丝线;结松了,不会这么巧吧,两根线分别打结的啊。好在病人能接受再次手术,因为这个手术本来就非常简单,没有破坏,没有后遗症,跟她说就像补衣服,线缝在腹壁上就完了,没有任何其他损害。带做疑惑再次手术,发现线没有断,子宫底部靠近前壁也与腹壁粘连了的,但是宫颈确实再次到达阴道口了啊,也就是说从宫颈到宫底,患者的子宫长度由正常的7-8cm被拉长到至少15cm以上。所以,这个患者的复发我考虑有几个因素:1.患者的皮肤太嫩,体质特殊,子宫估计和皮肤一样娇嫩,韧性差,容易在腹腔压力下拉伸延长;2.长久站立劳动的工作性质,使腹压增加的因素持续存在;3.阴道壁没有修补,阴道虽然没有膨出,但相对松弛,给子宫再次膨出造成了机会。所以,后续我将总结经验,一定要缩紧阴道,并且改良悬吊缝合手术方法(做了两处改良),杜绝复发,将这个简单的手术继续发展下去。下面我们来看看尿失禁和盆底器官脱垂有多少手术方式:压力性尿失禁有一百多种手术方式,子宫脱垂的手术方式也较多。我罗列的是目前常见的手术方式,还有很多没有写上来。一、压力性尿失禁阴道前壁修补术2.耻骨后尿道固定悬吊术Burch术3.阴道无张力尿道中段悬吊术(1)耻骨后路径①TVT术②SPARC术③IVS术(2)闭孔路径①MONARC术②TOT术③TVT-O术④改良TVT-O术(3)非耻骨后/闭孔路径4.植入人工尿道括约肌5.自体筋膜悬吊术二、盆腔器官脱垂1.传统手术①阴道闭合术②曼式手术③阴式子宫切除+阴道前后壁修补术2.现代手术①骶骨阴道固定术②骶棘韧带固定术③高位子宫骶韧带悬吊术④经阴道后路悬吊带术⑤保留子宫的改良后路阴道壁悬吊术⑥全盆底重建术(网片)
杨建 副主任医师 医生集团-重庆 线上诊疗科2620人已读 - 产科指南 2015 胎膜早破的诊断与处理指南
2015 胎膜早破的诊断与处理指南发布日期: 2015-01-31制定者: 中华医学会妇产科学分会产科学组出处: 中华妇产科杂志.2015,50(1):3-8.由于现在知识产权保护挺严格的,不知道贴出来会不会符合要求,所以,贴点主要的。分为足月PROM 和未足月PROM值得注意的是要应用消毒的窥器进行检查,并且避免指检以防止上行性感染。1. 足月PROM的常见并发症:足月PROM常常是即将临产的先兆,50%的孕妇在胎膜破裂后12 h内自行临产,20%的孕妇在12~24 h内临产,25%的孕妇在24~72 h内临产,5%的孕妇72 h内仍不能临产。足月PROM的主要并发症是宫内感染。破膜时间越长,临床绒毛膜羊膜炎的风险越大,进而导致母体的产褥感染、新生儿感染、败血症等。2. PPROM的常见并发症:PPROM有15%~25%者合并有临床症状的绒毛膜羊膜炎。孕周越早绒毛膜羊膜炎的风险越大。PPROM最主要的并发症是早产,由于早产儿不成熟及宫内感染导致的各种并发症,包括新生儿呼吸窘迫综合征(respiratorydistress syndrome,RDS)、脑室内出血(intraventricularhemorrhage,IVH)和坏死性小肠结肠炎(necrotisingentercolitis,NEC)、败血症等。尽管积极保胎等处理仍有约50%的早产胎膜早破在破膜后1周内分娩,是早产的主要原因。其他常见的并发症有胎儿窘迫、胎盘早剥。胎膜早破导致羊水过少、脐带受压甚至脐带脱垂,从而发生胎儿窘迫甚至胎死宫内。PROM 发生后宫腔压力的改变约2%~5%的PPROM者发生胎盘早剥。急性临床绒毛膜羊膜炎的主要表现为孕妇体温升高(体温≥37.8 ℃)、脉搏增快(≥100次/min)、胎心率增快(≥160次/min)、宫底有压痛、阴道分泌物异味、外周血白细胞计数升高(≥15×109/L或核左移)。。孕妇体温升高的同时伴有上述2个或以上的症状或体征可以诊断为临床绒毛膜羊膜炎[8-9],阴道检查可造成阴道内细菌的上行性感染,可增加绒毛膜羊膜炎及产后子宫内膜炎、胎儿感染及新生儿感染的风险,在期待保胎、引产过程中或产程中应尽量减少不必要的阴道检查(Ⅱ/B级)。3. 绒毛膜羊膜炎的处理:临床诊断绒毛膜羊膜炎或可疑绒毛膜羊膜炎时,应及时应用抗生素,诊断绒毛膜羊膜炎尽快终止妊娠,不能短时间内阴道分娩者应选择剖宫产术终止妊娠。有条件者胎儿娩出后进行新生儿耳拭子和宫腔分泌物培养及胎盘胎膜送病理检查,但是有典型的临床感染的症状如果无病理支持并不能否认宫内感染的诊断。新生儿按高危儿处理。(Ⅱ/B级)。(五)预防B族溶血性链球菌上行性感染PROM 是B 族溶血性链球菌(group Bstreptococcus,GBS)上行性感染的高危因素,是导致孕妇产时及产褥期感染、胎儿感染及新生儿感染的重要病原菌,应重视GBS感染的防治。这一相关问题也越来越受到国内围产医学界的重视。若之前有过筛查并且GBS阳性则在发生胎膜破裂后立即使用抗生素治疗,若未行GBS 培养,足月PROM破膜时间≥18 h或孕妇体温≥38 ℃也应考虑启动抗生素的治疗。对PPROM 孕妇有条件者建议行阴道下1/3及肛周分泌物的GBS培养。GBS培养阳性者,即使之前已经应用了广谱抗生素,一旦临产,应重新给予抗生素治疗。青霉素为首选药物,如果青霉素过敏则用头孢菌素类抗生素或红霉素。预防GBS感染的抗生素用法(针对GBS培养阳性者):(1)青霉素G首次剂量480万单位静脉滴注,然后240万单位/4 h直至分娩;或氨苄青霉素,负荷量2 g静脉滴注,然后每4 小时1 g的剂量静脉滴注直至分娩。(2)对青霉素过敏者则选用头孢唑啉,以2 g作为起始剂量静脉滴注,然后每8小时1 g直至分娩。(3)对头孢菌素类过敏者则用红霉素500 mg,每6小时1 次静脉滴注;或克林霉素900 mg 静脉滴注,每8 小时1次。2. 确定处理方案:依据孕周、母胎状况、当地的医疗水平及孕妇和家属意愿4个方面进行决策:放弃胎儿,终止妊娠;期待保胎治疗;如果终止妊娠的益处大于期待延长孕周,则积极引产或有指征时剖宫产术分娩。(1)立即终止妊娠放弃胎儿:①孕周<24周:为无生机儿阶段,由于需期待数周才能获得生存可能,早产儿不良结局发生率较高,且母儿感染风险大,多不主张继续妊娠,以引产为宜。②孕24~27周+6者要求引产放弃胎儿者,我国仍然采用≥28孕周才算进入围产期,孕24~27周+6尚未进入围产期者,可以依据孕妇本人及家属的意愿终止妊娠。(2)期待保胎:①孕24~27周+6符合保胎条件同时孕妇及家人要求保胎者;但保胎过程长,风险大,要充分告知期待保胎过程中的风险。但如果已经羊水过少,羊水最大深度<20 mm 宜考虑终止妊娠。②孕28~33周+6无继续妊娠禁忌,应保胎、延长孕周至34周,保胎过程中给予糖皮质激素和抗生素治疗,密切监测母胎状况。(3)不宜继续保胎采用引产或剖宫产终止妊娠:①孕34~36周+6,已接近足月者,90%以上的胎儿肺已经成熟,新生儿发生RDS的概率显著下降,早产儿的存活率接近足月儿,则不宜保胎;虽然从新生儿感染的结局方面当前尚无充分证据证明积极引产可显著减少新生儿严重感染的发生率,但是积极引产可以减少绒毛膜羊膜炎、羊水过少、胎儿窘迫等导致的新生儿不良结局(Ⅱ/B级)。对于孕34~34周+6由于有约5%以上的新生儿会发生RDS,目前,国内外学术界对于是否延长孕周至35周尚无统一的意见,建议依据孕妇本人状况和意愿及当地医疗水平决定是否期待保胎,但要告之延长孕周有增加绒毛膜羊膜炎等发生的风险。(二)期待保胎过程中的处理1. 促胎肺成熟:产前应用糖皮质激素促胎肺成熟能减少新生儿RDS、IVH、NEC的发生,且不会增加母儿感染的风险(Ⅰ/A级)。(1)应用指征:<34孕周无期待保胎治疗禁忌证者,均应给予糖皮质激素治疗。但孕26周前给予糖皮质激素的效果不肯定,建议达孕26周后再给予糖皮质激素。≥34孕周分娩的新生儿中,仍有5%以上的NRDS发生率,鉴于我国当前围产医学状况和最近中华医学会妇产科学分会产科学组制定的早产指南,建议对孕34~34 周+ 6的PPROM孕妇,依据其个体情况和当地的医疗水平来决定是否给予促胎肺成熟的处理,但如果孕妇合并妊娠期糖尿病,建议进行促胎肺成熟处理。2. 抗生素的应用:导致PPROM 的主要原因是感染,多数为亚临床感染,30%~50%的PPROM羊膜腔内可以找到感染的证据。即使当时没有感染,在期待保胎过程中也因破膜容易发生上行性感染。对于PPROM预防性应用抗生素的价值是肯定的,可有效延长PPROM的潜伏期,减少绒毛膜羊膜炎的发生率,降低破膜后48 h内和7 d内的分娩率,降低新生儿感染率以及新生儿头颅超声检查的异常率(Ⅰ/A级)。具体应用方法:ACOG推荐的有循证医学证据的有效抗生素,主要为氨苄青霉素联合红霉素静脉滴注48 h,其后改为口服阿莫西林联合肠溶红霉素连续5 d。具体用量为,氨苄青霉素2 g+红霉素250 mg 每6 小时1 次静脉点滴48 h,阿莫西林250 mg联合肠溶红霉素333 mg每8小时1次口服连续5 d。青霉素过敏的孕妇,可单独口服红霉素10 d。应避免使用氨苄青霉素+克拉维酸钾类抗生素,因其有增加新生儿发生坏死性小肠结肠炎的风险。但由于我国抗生素耐药非常严重,在参考ACOG推荐的抗生素方案的前提下要依据个体情况选择用药和方案。4. 期待过程中的监测:保守期待治疗时高臀位卧床休息,避免不必要的肛查和阴道检查,动态监测羊水量、胎儿情况、有无胎盘早剥及定期监测绒毛膜羊膜炎和临产的征象。当前没有对于监测的最佳频率达成共识,目前的监测手段包括定期超声监测胎儿生长和羊水量、胎心监护、及感染指标的检测,保胎时间长者可以考虑行宫颈分泌物培养和中段尿培养及时发现绒毛膜羊膜炎。卧床期间应注意预防孕妇卧床过久可能导致的一些并发症,如血栓形成、肌肉萎缩等。若保守治疗中出现感染、胎儿窘迫、胎盘早剥、羊水持续过少时,应考虑终止妊娠,而病情稳定者可期待至孕≥34 周后终止妊娠。
杨建 副主任医师 医生集团-重庆 线上诊疗科2640人已读





