胡群超医生的科普号
- 精选 放疗会引起骨折吗?
最近,在与接受术后辅助放疗患者沟通的过程中,发现患者朋友对于治疗期间可能发生的“骨损害“不太理解。当我们初次接触放射治疗时,由于内心对未知事物的恐惧,往往会触发患者难以控制的担忧。曾接诊过一位常规术后辅助放疗的妇科肿瘤患者,她在外照射2-3次后,主诉出现没有特殊原因的骨痛,描述疼痛症状在放疗结束后当天尤其明显,而在连续性放疗的休整期(周六/周日),症状则自动缓解了。此时,她回想起医生交代过可能有的“骨损害“,立刻紧张起来。常见的误解:放疗会导致骨折???答案是:对于没有基础骨转移病变的患者,单纯的术后辅助放疗并不会直接引起骨折。理论上,抗肿瘤治疗方式本身,的确可能会引起骨质丢失,这个过程有个洋气的英文名,叫做cancer treatment induced bone loss (CTIBL)。实质上,是由于接受抗肿瘤治疗而发生的骨质疏松或骨量减少,常见于接受糖皮质激素治疗的患者。此外,出于不同原发肿瘤治疗的需求,其他抗肿瘤治疗,包括化疗、内分泌治疗、放疗以及靶向治疗等也可能通过不同的机制导致骨重塑失调。先来看下什么是骨量减少和骨质疏松?如下图所示,骨量的减少会导致骨微结构破坏,造成骨脆性增加,从而引起骨折。临床治疗中,探讨主动骨保护较多的肿瘤包括乳腺癌、前列腺癌、肺癌、多发性骨髓瘤等容易发生骨转移和骨侵犯的恶性肿瘤。对于接受放疗的患者而言,是否存在骨转移,以及患者年龄、治疗前的骨密度基线储备是引发骨相关事件的重要因素。研究表明,早期乳腺癌患者使用芳香化酶抑制剂、化疗诱导绝经和促性腺激素释放激素激动剂(如戈舍瑞林)治疗1年后,骨量丢失可达4%-8%左右1-2 。 对于老年乳腺癌患者,在化疗、激素治疗尤其是卵巢功能抑制和芳香化酶抑制剂治疗后,根据美国临床肿瘤学会骨健康指南,通常建议进行骨密度(BMD)检测,并根据检查结果考虑是否使用双膦酸盐药物类药物。绝经前的女性如果正在接受可能导致早绝经的治疗(比如化疗、卵巢去势、妇科肿瘤相关的卵巢切除术),也应该常规检查骨密度。 如果骨密度报告提示结果T-值低于-2.5,则通常建议采用药物治疗。而T值在-2.5~ -1.0之间,结合年龄、体重指数和既往吸烟、用药史,综合考虑后可采用药物治疗。若T值高于-1.0,则不必即刻的药物治疗。那么如何预防抗肿瘤治疗相关的骨质丢失,以及由此导致的骨质疏松呢?1. 要监测:对于接受内分泌治疗的乳腺癌和前列腺癌患者,以及接受卵巢切除的年轻妇科肿瘤患者,建议定期评估骨折风险,接受必要的骨密度测定检查。2. 要适当干预:同时,在日常饮食中补充钙质和维生素D:建议维生素D的每日摄入量在1000-2000IU,钙剂则在1000mg/天。如果有肾脏基础性疾病或急性肾功能损害的患者,则需要在咨询肾内科建议后,进行合理的维生素和钙质补充。3. 严重骨质疏松者,要治疗:请务必到正规医院进行咨询和诊疗。此外,对于肿瘤患者而言,还需要注意规律的复查随访,及时发现潜在的骨转移病变并接受相应治疗,以防病理性骨折的发生。参考文献:1. Shapiro CL, Manola J, Leboff M. Ovarian failure after adjuvant chemotherapy is associatedwith rapid bone loss in women with early stage breast cancer. J Clin Oncol, 2001,19(4);3306-3311.2. Warming L, Hassager C, Christiansen C. Changes in bone mineral density with age in men and women: A longitudinal study. Oseteporos Int, 2002, 13(2): 105-112.3. Eastell R, Hannon RA, Cuzick J, et al. Effect of an aromatase inhibitor on BMD and bone turnover markers: 2-year results of the anastrozole, Tamoxifen, Alone or Combination (ATAC) trial. J Bone Miner Res, 2006,21(8):1215-1223.
胡群超 主任医师 上海市同仁医院 放疗科2538人已读 - 精选 妇科肿瘤放疗,初始“三连问”
近期接诊了不少妇科肿瘤需要接受盆腔外照射(简单来说,就是放疗)的患者,相对于手术“手起刀落”的简单明了,患者和家属对放疗都感到非常陌生,第一次接触不免存在很多疑惑和些许焦虑。今天就患者朋友常见的“三连问”,为大家简单做个解答。第一问:医生,我今天来看病,跑一趟不容易,可以现在就开始放疗吗?首先,放疗和手术一样,都是恶性肿瘤综合治疗中非常重要的手段。在放疗前,也同样需要对患者进行全面的评估。血液学、影像学(CT或磁共振、PET-CT)等检查,可以帮助医生完善评估的全面性,明确放疗的治疗风险,排除放疗禁忌。病情评估过程的等待,相当于战斗开始前,了解敌情的准备工作,当信息掌握越全面时,我们对战局的控制越有主动性和把握性。其次,目前大多数外照射的治疗计划都需要多个岗位的专业人员,经过多个环节来共同完成。医生诊疗过程中,与患者之间建立了最直接的联系。放疗开始前,首先由医生评估患者是否有放疗的必要性,然后安排有指征的患者行CT定位。随后在获取的CT定位图像中勾画需要照射的范围(即靶区),同时也要将周围的正常组织(如小肠、结肠、直肠、膀胱、肾脏和脊髓等重要器官结构)勾画并保护起来,以便减轻患者治疗期间的不适反应。随后,将由物理师通过TPS系统来精确计算照射的剂量,规划靶区的剂量覆盖,从而获取计算机和直线加速器可以执行的治疗计划。当医生和物理师共同确认计划的合理性和安全性后,物理师会再对计划进行质量确认,即模拟运行,确认无误后方可由治疗师为患者实施放疗。总之,所有的等待时间,都是为了给患者提供更好的治疗方案!以下的治疗流程可供参考。第二问:放疗疼吗?妇科放疗通常有两种手段:盆腔外照射和近距离放疗。根据患者朋友的疾病情况和治疗需求,通常会采取其中一种,或序贯采用两种方案先后治疗。具体的放疗方案和治疗流程,患者朋友可以与主诊医生直接沟通,详细了解。先来看看外照射的“大机器”治疗的时候,患者躺在个体化制作的体膜上,保持稳定不动即可,类似CT检查的感觉,治疗过程中不会有特殊的疼痛感受。再来看看,近距离治疗的“小机器”:近距离治疗的过程中,医生会在患者体内放入施源器。施源器的类型选择,需要根据患者是否接受过手术、疾病分期来综合考虑。目前我科均采用三维CT引导的近距离治疗,保证了每次治疗的精确性和个体化适应性。治疗流程如下:治疗前阴道冲洗->施源器置入-> CT扫描->治疗靶区勾画->物理师精算计划->医生、物理师共同确认计划->近距离治疗->撤除施源器->完成治疗。近距离治疗施源器置入的过程中,需要扩阴器撑开阴道,过程中患者不免存在疼痛或不适感。对于未行手术的患者而言,建议在外照射期间即可行每日阴道冲洗,这有助于减轻近距离治疗过程中的不适感。第三问:放疗期间,我有事情,可以请假几天再接着治疗吗?通常,针对妇科肿瘤的外照射是周一至周五治疗,连续5-6周完成整个放疗疗程。治疗期间,只要患者一般状态良好,血常规等实验室结果提示耐受,都强烈建议按计划连续治疗,任意中断治疗可能会影响放疗的整体效果。而针对近距离治疗,由于每次照射的剂量较大,前后两次的治疗期间会安排间隔休息。根据患者疾病情况,建议每周实施1-2次治疗。时间安排也同样建议遵医嘱执行。
胡群超 主任医师 上海市同仁医院 放疗科2295人已读 - 精选 HPV知多少?
每年的3月4日,是“国际HPV知晓日”International HPV Awareness Day什么是HPV?HPV,是一种看不见的DNA病毒,中文名为人乳头瘤状病毒。由于这种病毒的持续感染,尤其是高致病风险亚型的不断作祟,常常导致宫颈、外阴等肛门生殖道恶性肿瘤,变成我们看得见的疾病!目前,已知的HPV亚型有150多种,其中高致病风险的亚型有14种。HPV-16和18亚型与至少70%宫颈癌的发生有密切关系。HPV主要是通过性接触等途径传播。目前,WHO推荐儿童在15岁之前接种HPV疫苗,最佳接种年龄在11-12岁。HPV疫苗接种遇到的那些问题:国外研发的疫苗适合中国人群吗?在中国人群中的检测结果提示,我们现症感染的HPV高危亚型前5位为:16、18、52、58和53,与国外人群的情况基本一致。现有商品化的9价疫苗基本覆盖了高风险亚型。疫苗接种前需要常规做早孕检查吗?目前,接种前并没有临床指南明确要求做早孕检查,而且在怀孕的极早期并不能100%明确怀孕状态。第一次接种后,发现怀孕了,是否能继续妊娠?是否能接受第二次疫苗注射?首先,明确怀孕后,在孕期是不建议做有计划的HPV疫苗接种的;如果遇到第一次接种后发现怀孕的情况,通常建议推迟第二次疫苗的注射时间。其次,如果接种疫苗期间发现怀孕,且孕期检查并未发现明确异常,并不因疫苗接种要求终止妊娠。哺乳期的女性能接种HPV疫苗吗?HPV疫苗属于灭活型疫苗,不影响哺乳的安全性。疫苗接种前需要做HPV的DNA筛查吗?无强制推荐。如果已经感染了HPV,还能接种HPV疫苗吗?既往感染过HPV可能影响疫苗的免疫保护效能,但多价疫苗因涵盖了多个亚型,对未同时感染多个高危亚型的人群仍有一定的保护作用。有免疫抑制等特殊情况的人群是否能接种HPV疫苗?对于HIV感染或接受器官移植的人群,并不是HPV疫苗接种的禁忌症。但因其免疫状态受到抑制,通常建议常规接受3针的注射计划。参考资料:1.Committee Opinion, Obstetricians and Gynecologists Women’s Health Care Physicians. 20172.Comparison of the long-term impact and clinical outcomes of fewer doses and standard doses of human papillomavirus vaccine in the United States: A database study. 2020, Feb.
胡群超 主任医师 上海市同仁医院 放疗科2962人已读 - 精选 乳腺癌放疗期间皮肤副反应处理:一二三,齐步走~
放射治疗,有一个民间“曾用名”,叫做“烤电”。早年受到放疗设备和技术的限制,涉及浅表部位肿瘤放疗时,皮肤反应通常较大。治疗期间,患者会出现照射区域皮肤红肿、发黑,甚至破损感染。放疗引起的皮肤反应,与患者的治疗体验、生活质量都息息相关。那么,药物预防放射性皮炎有必要吗?不看广告,看疗效!给各位患者朋友列举一些研究结果,以供参考:1. 芦荟胶 vs. 安慰剂(即无特殊治疗)上世纪90年代,有两个大型的随机III期临床研究,针对乳腺癌放疗期间采用皮肤防护剂的效果进行分析——研究主角是芦荟胶。结果提示,乳腺癌患者放疗时采用芦荟胶与不进行特殊处理,两者皮肤反应没有差异。而部分患者可能对芦荟胶中的某些成分敏感性有差异,会出现接触性皮炎。2. 芦荟提取物 vs. 婴儿爽身粉一项来自加拿大多个肿瘤中心的随机临床研究,纳入248位接受术后放疗的乳腺癌患者,主要比较了芦荟提取物、婴儿爽身粉对放疗急性皮肤反应的影响。结果发现,放疗期间预防性使用芦荟提取物或其他皮肤乳膏并不能显著减轻皮肤反应,而爽身粉制剂可以改善皮肤的干爽程度,减少汗液,从而减少湿性反应。3. 比亚芬 vs. 常规皮肤护理比亚芬是一种促进皮肤损伤愈合的外用制剂。上世纪90年代经过美国FDA批准,可用皮肤破损的外用治疗,促进局部愈合。一项来自美国NCI的临床研究,分析了放疗期间使用比亚芬和其他水乳制剂及常规皮肤护理时,乳腺癌患者出现2-3度皮肤反应的比例。结果发现,三者没有显著的差异。当然,在这个研究设计中,常规皮肤护理组的患者接受了除比亚芬以外其他多个不同的乳液制剂,只有16%的患者没有采用任何外用药物。简单来说,就是难以就此确认明确有效的预防放射性皮炎药物。4. 湿润烧伤膏 vs. 比亚芬161位接受放疗的乳腺癌患者在放疗期间预防性采用皮肤外用药物:一组外用Mebo(β-植物甾醇)薄荷烧伤膏,一组采用比亚芬软膏,治疗期间每周观察并评价皮肤反应。结果发现,两组患者发生2-3度皮肤反应的比例没有差异。但采用Mebo软膏的患者,其皮肤瘙痒或疼痛的程度较轻,这可能与其中含有的薄荷成分有关。一切的改善,重点都源于放疗技术的进步!随着乳腺癌保乳手术率的提高,很多女性在肿瘤安全治疗的前提下,获得了器官保留的机会,同时获得更多心理和生活质量改善方面的支持。乳腺癌放疗技术的进步,从原来二维治疗,跨入调强放射治疗时代。乳腺癌大分割(+同期加量)放疗、部分乳腺照射及加速部分乳腺照射等多种放疗方案的选择,让更多适用新技术的患者在获得相同疗效的基础上,实现了更短疗程、更轻皮肤副反应的目标。那么乳腺癌放疗期间,皮肤反应到底要如何处理呢?简单总结为三点:第一,保持放疗部位皮肤清洁、干爽。尤其是夏天到来以后,人体散热出汗、近腋窝的皮肤更需要轻柔擦拭、吸去汗液。第二,建议贴身穿着的衣物为全棉质地,亲肤柔软为宜。内衣的尺码应贴身,但不紧勒,放疗期间不要穿着带钢圈的胸衣。第三,保持健康的生活习惯,均衡营养摄入,适量活动,不吸烟,保证充足的睡眠。放疗期间每周至少面诊一次,便于医生及时评估皮肤等各项反应。通常,不需要预防性外用药物或药膏。如遇皮肤反应明显,如红肿程度严重,甚至出现局部破溃,伴有渗液,则应在医生指导下用药,并进行皮肤病损处理。参考文献:1. Int J Radiat Oncol Biol Phys.1996 Sep 1;36(2):345-9.2. Int J Radiat Oncol Biol Phys.2000 Dec 1;48(5):1307-10.3. Clin Breast Cancer.2015 Jun;15(3):181-90.e1-4.4. Am J Clin Oncol.2018 Dec;41(12):1257-1262.5. Clin Breast Cancer.2018 Oct;18(5):e825-e840.
胡群超 主任医师 上海市同仁医院 放疗科2270人已读 - 精选 放疗开始前,你可能关心的那些问题
问题1:放射治疗是否和化疗一样,会掉毛发?答:通常,放射治疗区域内的毛发生长会受影响。部分放疗准备需要患者做理发准备,如脑转移需要照射头部时,在放疗前建议患者剃发。放疗结束后,毛发可以逐渐恢复生长。问题2:放射治疗是否和化疗一样痛苦?答:接受静脉化疗时,通常患者会有恶心、呕吐、胃口减退、乏力、脱发或触觉神经改变等不舒服的症状。根据所用化疗方案的不同,症状表现或严重程度可能不同,待化疗结束后,患者可逐渐恢复。放射治疗方案的实施是一个连续的过程,以常规治疗方案为例。患者周一至周五每天照射一次,每次实际照射时间为数十分钟;周六周日休息,以保证照射区域及其周边的正常组织得以修复。放疗期间也会出现不适症状,常见不良反应在开始照射后的10-14天出现。其症状表现与照射部位有关,若有不适症状建议联系主诊医生,可以通过对症支持性治疗缓解症状,保证治疗安全。问题3:乳腺癌患者放疗可能的不适症状答:乳腺癌患者通常在手术以后接受辅助治疗。根据病情严重情况,手术方式(保留乳房或改良根治术),放射治疗的范围和剂量并不完全相同。放疗期间常见的不良反应是:皮肤发红、干燥、脱屑;照射后期部分敏感的患者会有灼热感,严重者出现皮肤红肿、破损。患侧上肢的水肿,失锻炼后的上肢活动受限等。以上症状通常是逐步发生,建议治疗期间按医嘱进行随访复查,症状早期处理后可以得到控制,随后逐渐恢复。问题4:妇科肿瘤行盆腔放疗可能的不适症状?答:可能出现腹痛、大便次数增多,便中带血;尿频、尿急、尿痛;部分患者出现照射区域(如腹股沟)皮肤,会阴区黏膜反应,局部水肿等。此外,还可能出现恶心、乏力、贫血、白细胞降低等全身反应。鉴于患者病情需要,照射范围的大小存在个体性差异,每个人的不适症状及严重程度也有不同,待治疗完成后可逐渐恢复。问题5:手术做的很成功,化疗也做过了,放疗是不是没必要做了?答:手术和放疗都是局部治疗的手段,化疗是全身性治疗,不同的治疗手段目的不同,要达到的预期效果也不同。手术以后的化疗和放疗,称之为辅助治疗,主要目的是减少肿瘤复发和转移的风险,提高患者的生存。对于临床有复发风险的患者,术后的辅助放疗可以降低手术局部以及周围区域的肿瘤复发和进展几率。不仅可以提高手术彻底切除后肿瘤控制的效果,部分情况下还能降低肿瘤细胞远处转移的风险,从而延长患者的生存。问题6:放疗是不是必须和手术配合做?答:通常情况下,早期诊断的肿瘤可以直接手术切除,然后根据手术病理评估肿瘤复发的风险以后,再决定是否在手术以后给予放疗,我们称之为“术后辅助放疗”。但有些妇科肿瘤(如宫颈癌)发现的时候已经比较晚,手术难以根治性切除,那么可以通过放疗联合化疗的方法进行治疗,同样可以达到不错的肿瘤控制效果,我们称之为“根治性放化疗“。问题7:放疗需要每天住院治疗吗?答:通常,患者是周一到周五接受治疗,周六周日休息,每次治疗时间约15-20分钟。一般状况良好的患者可以接受门诊治疗。问题8:我是妇科肿瘤患者,医生建议放疗的同时做化疗,我觉得自己肯定吃不消,拒绝化疗/放疗。答:医生通常会建议以下三类妇科恶性肿瘤患者在放疗的同时接受化疗:1、失去手术机会需接受根治性放化疗的患者;2、术后存在很高复发风险的患者;3、部分复发进展后的患者。在制定方案前,医生会针对患者的一般身体状况、血液检查结果,以及既往抗肿瘤治疗的耐受性进行分析和评估,在评估患者能耐受的前提下给予治疗建议。由于放疗是连续的阶段性治疗,在治疗随访过程中,医生也会根据患者的不良反应程度进行相应调整。所以,不妨先听听医生的建议。问题9:放疗期间,感觉不舒服时,想要暂停治疗,等体力恢复以后再继续治疗。答:通常放疗至10-14天,患者开始出现不舒服的症状。根据症状严重程度,医生会具体判断是否需要暂停治疗,或给予积极对症处理后继续治疗。由于治疗暂停时间过长可能对肿瘤控制效果造成影响,故在可耐受的前提下,不建议中断治疗。问题10:医生,放疗的次数越多是否肿瘤控制得越好?给我多照几次吧答:通常,一个给定的放疗方案其照射总的剂量和照射次数是固定的,照射剂量的大小需要考虑肿瘤的控制,还有周围正常组织的耐受。并不是照的次数越多越好。问题11:医生,我化疗是每隔三周做一次,那我放疗开始的时间是否需要和化疗间隔三周?答:对于乳腺肿瘤而言,有放疗指征的患者是在化疗结束后开始放疗。妇科肿瘤患者根据病情不同,存在同期放化疗或序贯放化疗。按照肿瘤综合治疗的整体方案,放疗前需要评估患者一般情况、完善血液学等检查,排除禁忌症就可以开始治疗。没有严格的三周间隔规定。
胡群超 主任医师 上海市同仁医院 放疗科3730人已读 - 医学科普 哺乳后乳腺硬结长久不退,会恶变吗?
今天遇到一位患者妈妈咨询,她女儿10多年前产后哺乳期间出现了乳腺的硬结,很多年以后感觉这个硬结持续存在,担心乳腺会不会有恶变的可能。 理论上,哺乳期间出现的乳腺硬性结节,多是乳汁淤积导致乳腺导管不通畅所致,阻塞伴局部感染发作时可能会加重为急性乳腺炎。发作时需要接受抗感染治疗和乳腺导管的疏通。哺乳后的乳腺硬结与乳腺的恶性病变并没有直接相关性。尽管乳腺癌已成为当前发病率最高的恶性肿瘤,但随着诊疗技术和药物的快速发展,乳腺癌患者的总体预后较好。其中,乳腺癌早期识别和诊断使得早期患者的5年生存达到了90%以上。因此,做好适龄及高风险女性患者的乳腺疾病筛查,具有重要意义。 什么是乳腺癌筛查?乳腺癌筛查是在特定年龄段或有乳腺癌家族史的群体中检查无乳腺癌症状者有无乳腺癌早期征象的方法,主要借助乳腺X线钼靶摄影进行,年轻患者也可考虑接受超声筛查。筛查乳腺癌是为了在其生长、扩散或引起问题前尽早发现。 具体哪些人群推荐接受乳腺癌筛查?一些乳腺癌高危人群,如直系亲属中有多位乳腺癌患者,且呈现年轻时发病的情况,建议女性家庭成员需考虑在40岁前接受筛查,必要时进一步接受遗传基因方面的专业咨询。此外,定期乳腺X线钼靶摄影筛查通常持续至74岁,一些健康且期望寿命超过10年的人群会选择之后继续定期接受该筛查。接种新冠疫苗后会影响乳腺癌的筛查吗?一般推荐新冠疫苗接种和乳腺筛查时间间隔不应过近。由于部分女性朋友在接种某种新冠疫苗后会出现短期的腋窝淋巴结肿大,这有时会导致较难精确解读乳腺X线钼靶摄影。因此,通畅推荐在接种前或末次接种至少4-6周后安排乳腺X线钼靶摄影。
 胡群超 主任医师 上海市同仁医院 放疗科149人已读
胡群超 主任医师 上海市同仁医院 放疗科149人已读 - 医学科普 国外研发的HPV疫苗适合中国人群嘛?
HPV疫苗接种之快问快答
 胡群超 主任医师 上海市同仁医院 放疗科61人已读
胡群超 主任医师 上海市同仁医院 放疗科61人已读 - 图文文章 子宫内膜癌病理报告里的p53免疫组化结果怎么看?
p53作为重要的抑癌基因,它的突变状态和很多肿瘤的发生、发展都有密切关系。TP53基因的突变状态可辅助诊断高级别子宫内膜样癌和浆液性癌的分类,且对疾病预后的分析有重要意义。在子宫内膜癌分子分型指导精准治疗的时代,基因测序可以讲p53突变状态更进一步细分为:高拷贝和低拷贝两类。而实际临床实践中,术后病理报告更常用的是免疫组化的方法对p53状态进行第一步分析,p53免疫组化着色的异常与TP53基因突变有高度一致性。 分析解读p53的免疫组化结果,有助于辅助推断TP53基因的突变状态,可有效分类患者,实现最经济有效、便捷的预评估。对于妇科肿瘤而言,p53的免疫组化染色没有确定的阈值可参照,不能简单理解为正常/野生型、突变所谓“阴性”、“阳性”两种分类。所谓“阴性”着色,可能意味着完全无着色、也可能意味着是无突变的正常着色;“阳性”可能代表的是异常过表达、或胞质着色,也可能是正常着色。 对于p53免疫组化结果的判定,目前推荐分为3类:野生型表达、过表达以及完全缺失。 P53野生型免疫组化着色的特点是阴性、弱阳性、强阳性细胞混杂; 完全缺失突变的类型,免疫组化的判读需要结合非淋巴细胞、纤维细胞或非肿瘤的上皮细胞作为内参照;某些p53异常剪切突变或截短突变(表现为蛋白羧基端截短),p53蛋白可检测,表现为正常/野生型染色。 参考文献:MartinKöbel,M.D.,InterpretationofP53ImmunohistochemistryinEndometrial Carcinomas:TowardIncreasedReproducibility.InternationalJournalofGynecologicalPathology,2018.
 胡群超 主任医师 上海市同仁医院 放疗科7156人已读
胡群超 主任医师 上海市同仁医院 放疗科7156人已读 - 医学科普 恶性肿瘤,为什么要进行的基因检测?
在抗肿瘤治疗过程中,我们发现即便是同一部位、同一病理类型的恶性肿瘤,不同患者对于同一治疗方案的反应和最终疗效仍存在差异。尤其是在肿瘤疾病进展后,经过既往多线药物选择后复发或转移的肿瘤细胞,其对药物的应答反应存在明显的个体差异。进入肿瘤的精准治疗时代后,如何选择特定有效的人群,让特定药物较快体现精准疗效,避免不必要的药物浪费和药物不良反应?肿瘤的基因检测为患者提供了治疗方案优化选择的依据。 什么是肿瘤的基因检测?恶性肿瘤的发生和发展,通常是由于人体内基因变异,破坏了正常细胞生长、分化和修复的功能及节律,从而引起的疾病。肿瘤的基因检测,是通过高通量测序等方法找到与肿瘤发生、发展相关的突变基因,分析个体对于特定抗癌药物的敏感性,从而帮助患者制定针对性和更优化的治疗方案,最大程度上提高治疗的有效性。 哪些肿瘤患者推荐采用基因检测?1) 对于罹患有明确治疗靶点的瘤种和病理亚型的恶性肿瘤患者,均推荐靶点基因检测,并根据检测结果选择用药(常见病种如:肺腺癌、乳腺癌、结直肠癌、卵巢癌等);2) 对于既往靶向药物用药后进展,考虑靶向药物耐药的患者;3) 拟通过基因检测获取免疫治疗、内分泌药物用药指导的患者(如肺腺癌、结直肠癌、乳腺癌、子宫内膜癌)4) 用于评估肿瘤复发风险,从而指导临床个体化选择“低毒高效”的治疗决策方案(如乳腺癌、肺癌、结直肠癌);5) 对于有家族遗传性肿瘤病史的患者,遗传学的评估可以帮助患者家属明确患癌风险,从而做到早诊、早治、早干预。 哪些是肿瘤高危人群?大约5%-10%的恶性肿瘤存在家族遗传性,如BRCA1/2基因的突变常会在家族体系中形成代际传递,而携带这些突变基因的人群也具有更高的罹患恶性肿瘤的风险。遗传学筛查中对肿瘤患者的直系亲属进行基因检测,可以预测相应肿瘤的发生风险,从而对高危人群做积极预防、密切随访,甚至做预防性的干预术,从而降低癌症的发病率。 基因检测疼吗?根据疾病预防、遗传学咨询或恶性肿瘤临床治疗的需求,选择基因检测样本的不同,需要就诊者配合获取检测组织样品也各不相同:1) 高风险人群的遗传筛查可考虑抽取外周血,取样方便,相对无创;2) 有明确肿瘤占位的患者,或伴有胸腹水等转移性病灶的前提下,可以考虑穿刺活检、手术、外周血、胸腹水等取样;3) 淋巴瘤患者根据具体病情可考虑组织、外周血、脑脊液等取样;4) 血液系统恶性肿瘤,一般建议外周血和骨髓取样。
 胡群超 主任医师 上海市同仁医院 放疗科1200人已读
胡群超 主任医师 上海市同仁医院 放疗科1200人已读 - 医学科普 妇科肿瘤患者,哪些情况下需考虑选择PET-CT检查?
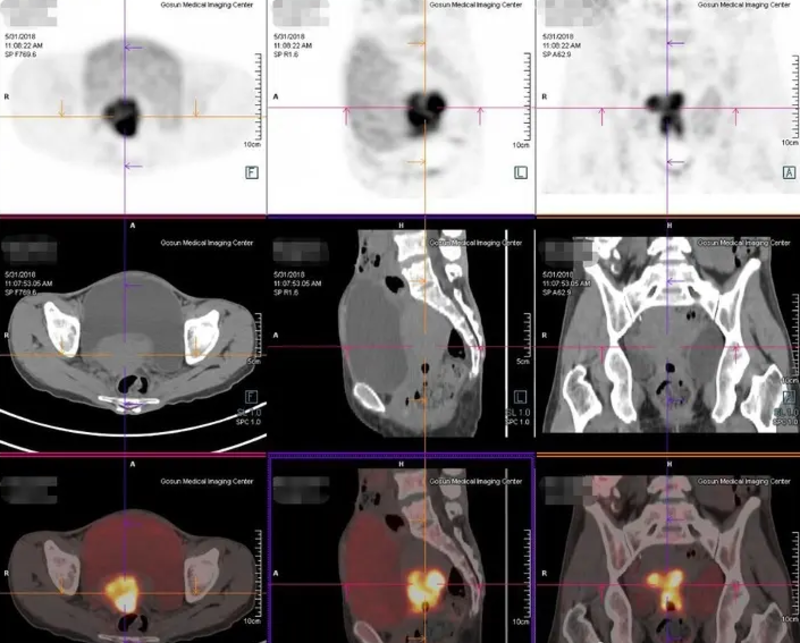
PET-CT一种功能影像学检查手段,其扫描范围广,一次检查的成像可以包括从头到脚的整个人体。该检查能够在解剖学的基础上,进一步反映出原发肿瘤及转移病灶的代谢状况。抗肿瘤治疗前的PET-CT显像有助于恶性肿瘤患者发现或排除远处转移灶,明确首诊肿瘤的分期,以便制定更合理的整体治疗方案。常见的妇科肿瘤,包括宫颈癌、卵巢癌及子宫内膜癌,由于其发病机制、疾病分期及进展特点不同,治疗前后是否需要PET-CT检查,以及选择检查的时机也略有差异。对于宫颈癌患者而言,一般推荐以下有条件的患者使用PET-CT检查:1)FIGO分期为IB1期及以上的初诊患者疗前分期(包括IB1期有保留生育功能需求的患者);2)因其他原因行单纯子宫切除术意外发现宫颈癌,需全身评估的患者;3)拟行放射治疗需影像学辅助勾画靶区(对于不能手术的宫颈癌患者,PET-CT检查有助于确定淋巴结转移的范围);4)存在高危因素的患者治疗结束3-6个月后随访监测;5)随访过程中有可以出现复发转移的患者,包括出现临床症状或相关肿瘤标志物升高的患者。一般核素骨扫描仅用于怀疑有骨转移的患者,做骨转移病灶的评估。对于子宫内膜癌患者而言,PET-CT一般较少用于初诊的常规评估。但如果存在以下情况,可推荐有条件者在治疗前采用PET-CT检查:1)有临床合并症不是和行手术治疗的患者2)怀疑存在非常见部位的转移,比如骨转移或中枢神经系统;3)病理活检提示为高级别肿瘤,包括低分化子宫内膜癌,乳头状浆液性癌,透明细胞癌和癌肉瘤。卵巢癌通常起病隐匿,首诊时不少患者已经是处在疾病进展期。治疗前进行PET-CT显像,一方面有助于疾病良恶性的判断,另一方面也有利于发现隐匿的转移灶,使治疗前的分期更准确。同时,PET-CT联合增强CT扫描有利于小病灶的检出。当然,由于PET-CT检查的价格较高,在临床选择时会根据疾病诊断和治疗的需求进行个体化推荐。主要用于常规影像学检查诊断分期不明确,有可能影响治疗方案、治疗后评价疗效或复发后确定转移范围等情况。一般结合临床治疗需求,对于以下情况可推荐使用PET-CT:1)盆腔肿物良恶性难以鉴别;2)卵巢上皮来源肿瘤治疗结束后随访监测;3)恶性生殖细胞肿瘤及恶性性索间质肿瘤,随访过程中出现典型症状、体检发现异常或肿瘤标志物升高;4)I期G2-3及II-IV期的未成熟畸胎瘤、任意期别的胚胎性肿瘤、任意期别的卵黄囊瘤和II-IV期的无性细胞瘤瘤化疗后的随访监测。
 胡群超 主任医师 上海市同仁医院 放疗科970人已读
胡群超 主任医师 上海市同仁医院 放疗科970人已读






