中山大学附属第七医院放射科科普号
- 精选 文献第43期——症状性颅内动脉狭窄患者随机二级预防试验
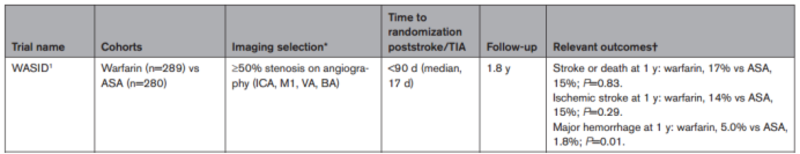
今日阅读一篇Stroke,《RandomizedSecondaryPreventionTrialsinParticipantsWithSymptomaticIntracranialAtheroscleroticStenosis》,《症状性颅内动脉粥样硬化性狭窄患者的随机二级预防试验》 Abstract颅内动脉粥样硬化性狭窄是缺血性脑卒中的一个普遍原因。它与无症状性脑梗死的关联及其对认知障碍和痴呆的贡献强调了对疾病预防和有效管理策略的迫切需要。尽管在过去的几十年里对二级卒中预防治疗进行了广泛的研究,颅内动脉粥样硬化性狭窄与其他原因相比,仍然表现出明显更高的卒中复发率。本综述的重点是随机二级预防试验,包括抗血栓治疗、血管内治疗、开放手术治疗和远期缺血调节。它旨在对每个试验的主要发现及其对未来研究工作的影响提供一个有见地的概述。 抗血栓形成试验Warfarin自20世纪70年代进行第一次随机试验以来,抗血栓治疗,即阿司匹林,一直是中风二级预防的主要手段。先前的随机双盲试验WASID表明,华法林在预防ICAS患者卒中复发方面可能比阿司匹林更有效。 然而,WASID试验未能显示阿司匹林组和华法林组在2年后缺血性卒中、脑出血或死亡发生率上的差异(华法林,22%vs阿司匹林,21%;风险比,1.04[95%CI,0.73-1.48];P=0.83)。出于安全考虑,WASID的入组提前停止:华法林组大出血和死亡率较高(大出血:华法林8.3%vs阿司匹林3.2%;P=0.01;死亡率:华法林9.7%,阿司匹林4.3%;P=0.02)。华法林的疗效和危害可能取决于INR。治疗性INR(2-3)患者的缺血性卒中发生率(5.1/100患者年)和大出血发生率(3.5/100患者年)明显低于整体华法林组,无论INR如何。然而,INR<2的患者缺血性卒中发生率较高,而INR>3的患者大出血发生率较高。尽管值得注意的是WASID对大出血的定义比以前的试验更广泛。这表明华法林在达到目标INR范围时可以有效降低缺血性卒中。在新型口服抗凝剂时代,稳定的治疗水平更容易实现,重新审视抗凝在ICAS治疗中的作用可能是有益的。目前,加拿大一项正在进行的临床试点RCT正在比较低剂量利伐沙班联合阿司匹林与阿司匹林单独治疗约100例脑缺血患者,这些患者归类于30%至99%的ICAS(URL:https://www.clinicaltrials.gov;唯一标识符:NCT04142125)。中国的另一项随机对照试验旨在比较低剂量利伐沙班加阿司匹林与氯吡格雷加阿司匹林对约1180例50%至99%的症状性ICAS患者的影响(URL:https://www.clinicaltrials.gov;唯一标识符:NCT05700266)。此外,在美国,CAPTIVA试验(颅内血管粥样硬化的抗凝和抗血小板治疗的比较;URL:https://www.clinicaltrials.gov;唯一识别码:NCT05047172)正在研究低剂量利伐沙班加阿司匹林对抗2种抗血小板方案在预防症状性ICAS患者1年内缺血性卒中、脑出血或死亡(70%-99%)的效果。最终,WASID在两组中观察到的2年主要终点率约为22%,这并不令人满意,并强调需要对这一高危人群进行更好的药物治疗。 氯吡格雷和阿司匹林在WASID之后的十年里,临床试验的重点转向了寻找一种替代阿司匹林的抗血小板方案。双重抗血小板治疗,即在复发性中风的高风险患者中风后30天内给予氯吡格雷和阿司匹林,出现在世人面前。在CLAIR试验(氯吡格雷加阿司匹林与阿司匹林单独用于减少急性症状性脑或颈动脉狭窄患者的栓塞)中,研究人员检测了氯吡格雷和阿司匹林对亚临床微栓塞的短期影响,作为中风或短暂性脑缺血发作(TIA)前2周内斑块不稳定的成像生物标志物。患者在中风或短暂性脑缺血发作后7天内随机分为氯吡格雷加阿司匹林或阿司匹林单独组。在入组的第2天和第7天重复磁共振成像(MRI)和经颅多普勒检查。与单独使用阿司匹林相比,双重抗血小板治疗在第2天和第7天减少了一半的微栓塞负担。在仅有ICAS的患者亚组中也观察到类似的结果。两组MRI显示的新发卒中数无差异(P=0.26);然而,这项研究并没有检测出复发性缺血性中风的发生率。短期使用氯吡格雷和阿司匹林治疗症状性ICAS也得到SAMMPRIS试验结果的支持(StentingandAggressiveMedicalManagementforPreventingRecurrentStrokeinIntracranialStenosis;表2)。 虽然SAMMPRIS不是一项抗血栓试验,但其实验组氯吡格雷加阿司匹林经常与WASID中的阿司匹林组进行比较,表明双重治疗的患者在30天内卒中发生率较低。其他非ICAS特异性随机对照试验的亚组分析表明,替格瑞洛联合阿司匹林在预防对氯吡格雷反应差的动脉粥样硬化性狭窄患者卒中复发方面可能优于氯吡格雷加阿司匹林。由于在非ICAS特异性随机对照试验中,对狭窄的位置和百分比的定义不同,在解释结果时应谨慎。作为CAPTIVA的一部分,除了研究低剂量利伐沙班联合阿司匹林治疗症状性ICAS的疗效,本试验将比较替格瑞洛联合阿司匹林与氯吡格雷联合阿司匹林的疗效。 西洛他唑和阿司匹林西洛他唑是一种具有血管扩张和血小板抑制特性的磷酸二酯酶抑制剂,在主要的东亚人群中减少复发性中风,在糖尿病患者中减少颈动脉壁增厚(早期动脉粥样硬化改变的标志)。目前,还没有大型随机对照试验专门评估西洛他唑对ICAS患者继发性卒中预防的有效性。几项评估西洛他唑对颅内狭窄进展影响的小型研究得出了不同的结果。TOSS试验(西洛他唑治疗症状性颅内动脉狭窄的试验)招募了因大脑中动脉或基底动脉疾病引起的中风或TIA2周内的韩国患者。患者随机分为西洛他唑加阿司匹林组和阿司匹林单药组。该研究经历了很高的随访失失率:30%的初始西洛他唑-阿司匹林组和20%的初始阿司匹林组在6个月的随访MRA中失访。在完成研究的患者中,与阿司匹林组相比,西洛他唑-阿司匹林组在6个月时狭窄进展较少(西洛他唑-阿司匹林,6.7%vs阿司匹林,28.8%),狭窄减退较多(西洛他唑-阿司匹林,24.4%vs阿司匹林,15.4%)(P=0.018)。相比之下,在另一项单独的研究CATHARSIS(西洛他唑-阿司匹林治疗复发性卒中颅内动脉狭窄)中,西洛他唑-阿司匹林组和阿司匹林组在2年时颅内狭窄的进展方面没有差异(西洛他唑-阿司匹林,9.6%vs阿司匹林,5.6%;P=0.53)。探索性分析显示,在调整患者基线特征后,西洛他唑-阿司匹林组在MRI上出现的卒中和无症状脑梗死较少(优势比为0.34[95%CI,0.12-0.96];P=0.04)。由于几个因素,很难直接比较TOSS-I和CATHARSIS。首先,他们的入组时间不同。Toss-I研究对象为卒中或短暂性脑缺血发作(TIA)后2周内的急性卒中患者,此时可能发生动脉粥样硬化斑块的动态变化;CATHARSIS试验入选的亚急性卒中患者的研究时间为缺血事件后2周至6个月。其次,评估狭窄严重程度的方法各不相同。Toss-I根据非对比MRA上的信号强度定性地确定狭窄的严重程度,而宣泄法使用Wasid标准定量测量狭窄程度。CATHARSIS试验相对较低的进展率也可能反映了自TOSS以来10年来发展的更好的风险因素管理。两项试验的样本量和TOSS-I的高流失率限制了西洛他唑预防ICAS进展有效性的结论。TOSS-II试验 ,一项由TOSS-I研究人员进行的随访试验-通过MRA比较西洛他唑和氯吡格雷对症状性ICAS进展的影响。患者在卒中或TIA发生2周内随机接受西洛他唑加阿司匹林或氯吡格雷加阿司匹林。与TOSS-I队列相比,更多的患者出现中度或重度狭窄。7个月时,9.3%的西洛他唑-阿司匹林组和15.5%的氯吡格雷-阿司匹林组出现狭窄进展(P=0.092)。同时,30.2%和23.7%的患者出现狭窄消退(P=0.139)。在后分析中,西洛他唑-阿司匹林组症状性狭窄的总体变化更有利(P=0.049)。虽然血管直径的变化可以作为ICAS血管病变的替代标志物,但它可能不能准确反映TOSS-II所建议的卒中复发风险。在随访中,新的MRI阳性卒中没有统计学差异(西洛他唑-阿司匹林,18.7%vs氯吡格雷-阿司匹林,12%;P=0.078)。ICAS中卒中的各种机制,如动脉源性栓塞、远端灌注受损和穿支疾病,促成了这种复杂性。因此,在ICAS中识别特定的病理机制可能具有重要的治疗意义。 血管内治疗试验几项随机对照试验(表2)比较了经皮腔内血管成形术和支架植入术(PTAS)与药物治疗对症状性ICAS患者的影响。到目前为止,没有证据支持血管内治疗作为症状性ICAS的初始治疗。裸金属支架针对WASID药物治疗组卒中复发率高的问题,SAMMPRIS试验旨在评估使用Wingspan系统的PTAS治疗症状性ICAS的有效性和安全性。患者在卒中或TIA后30天内随机分组。平均入组时间为7天。所有参与者接受氯吡格雷治疗3个月,每天服用阿司匹林,并加强危险因素管理,目标血压(BP)和胆固醇目标。试验提前结束,因为与强化药物治疗组相比,支架组的缺血性中风、脑出血或死亡的30天发生率高于预期(PTAS,14.7%对内科治疗组5.8%;P=0.009)。在PTAS组,30天内中风或死亡的比率高于预期,而与Wasid数据相比,保守治疗组的卒中或死亡率显著低于预期。3年后,保守组继续显示出优于支架置入术的优势。Miao等人在中国的一个单中心RCT研究了在大脑中动脉狭窄患者中使用支架植入装置的组合,包括自膨式和球囊可扩张式支架。球囊可膨胀支架在VISSIT试验中进行了专门研究(用于缺血性中风治疗的Vitesse颅内支架研究)。SAMMPRIS使用的Wingspan系统是一种自膨式支架,具有复杂的输送系统,需要在导丝上多次交换导管。在SAMMPRIS中,6例蛛网膜下腔出血中有3例是导丝末端的移动导致血管穿孔。球囊可膨胀支架可以提供良好的安全性,因为它们需要的导管更换次数较少。在VISSIT中,对30天内中风或短暂性脑缺血发作的有症状的ICAS患者进行了球囊扩张支架加药物治疗与单纯药物治疗的比较。然而,出于安全考虑,VISSIT也被提前终止。支架组30天的卒中和死亡率高于内科保守治疗组(24.1%vs.9.4%;P=0.05)。在1年的随访中,PTAS组和内科组分别有36.2%和15.1%的患者在符合条件的动脉区域复发中风或短暂性脑缺血发作(P=0.02)。这3项随机对照试验的结果巩固了人们的担忧,即接受PTAS治疗的患者中风或死亡率较高并不是特定类型的裸金属支架(BMS)系统所特有的。 裸支架与药物洗脱支架然而,ICAS的这些好处的全部程度仍然不清楚。在最近一项评估Nova颅内DES系统安全性和有效性的随机对照试验(NOVA试验)中,西罗莫司洗脱支架被发现在有症状的颈内动脉患者中,1年时支架内再狭窄的发生率低于BMS系统(DES,9.5%比BMS,30.2%;P<0.001)。二次分析显示,DES组在有症状的ICAS区域的缺血性卒中比BMS组少(DES,0.8%比BMS,6.9%;P=0.03);然而,两组30天的中风或死亡率相似(DES,7.6%对BMS,5.3%;P=0.46)。多项较小规模的研究已经开始研究利用其他新型药物洗脱冠状动脉支架系统治疗ICAS的安全性和有效性。如果这些发现有希望,DES将需要在RCT中对照医疗管理进行测试,以确定它们治疗ICAS的有效性。 球囊成形术与内科保守治疗虽然没有发表的随机对照试验评价原发性球囊血管成形术与支架置入术或药物治疗的疗效,但非随机研究表明,ICAS的亚最大原发性血管成形术相对安全。一项中国随机对照试验正在进行中,比较颅内球囊血管成形术与药物治疗对70%-90%症状性ICAS患者的影响(URL:https://www.clinicaltrials.gov;唯一标识符:NCT03703635)。 注重患者选择与药物治疗相比,无论使用何种类型的支架,PTAS与更高的卒中复发率和死亡率相关。因此,有一种转变倾向于改进患者选择,并确定可能从PTAS中获益的并发症发生率较低的个体。在美国和中国的几个前瞻性登记研究通过实施以下措施将支架置入术的围手术期风险降低到<3%:排除TIA和穿支卒中患者,选择3周内没有卒中的患者,在支架置入术前评估抗血小板治疗的耐药性,实施严格的介入后血压指南,并确保有经验的介入医师参与。CASSISS试验(中国血管成形术和支架置入术治疗症状性颅内严重狭窄)基于注册表中观察到的令人鼓舞的结果,采用精确的患者选择标准招募患者。由于患者术中并发症的风险较高,穿孔动脉卒中和前3周卒中患者被排除在外。由于这种精确的选择标准,支架植入组在30天内卒中或死亡的发生率较低(5.1%),而保守治疗组的发生率更低(2.2%)。两组在1年内卒中或死亡方面无差异(PTAS,8.0%vs医学,7.2%;P=0.82)。尽管选择围手术期并发症风险较低的患者,支架植入术可能无法提供比药物治疗更长期的益处。血液动力学衰竭和缺乏强健侧支的患者被假设为可能从血运重建术中获益最多的患者的一部分。在SAMMPRIS的事后分析中,侧支血流受损的定性评估与合格动脉区域内卒中复发相关在前循环分水岭型梗死患者中,支架置入术组18.2%(10/55例)和药物治疗组26.4%(14/53例)发生卒中复发(P=0.30)。分水岭梗死是侧支和灌注不良的一种表现,虽然不显著,但支架置入术可能比医学治疗更有利尽管如此,值得注意的是,超过60%的侧支血流不良的患者在3年后仍无卒中发生,这表明需要区分导致远端血流动力学严重损害的狭窄和不会导致远端血流动力学损害的狭窄。对于灌注代谢不匹配的亚组患者,支架置入可能比药物治疗更有益。作为CAPTIVA的一部分,一部分参与者将接受定量MRA,直接测量受影响血管区域的血流,并提供颅内狭窄侧支模式和下游血流动力学影响的定量信息。目的是确定中风复发风险最高的患者,这些患者仅靠药物治疗可能不足以进行灌注增强。 开放性手术试验ICAS的开放手术选择非常有限。1985年,一项大型研究调查了颅外-颅内搭桥手术,通过连接颞浅动脉和大脑中动脉,对近期半球卒中、视网膜梗死或伴有同侧颈内动脉或大脑中动脉粥样硬化性狭窄或闭塞的TIA患者进行手术。他们发现颅外-颅内吻合术围手术期卒中发生率较高,且对预防复发性脑缺血无益处在大脑中动脉狭窄≥70%的患者亚组中,24%的内科组和44%的外科组再次发生致死性或非致死性卒中(P<0.05)。此外,没有证据表明,与吻合不良的参与者相比,术后血管造影术评估结果良好的参与者的转流结果更好。没有其他预先指定的次级或亚组分析显示颅外-颅内分流术有好处。 另外,脑硬膜颞浅动脉血管融通术是一种间接旁路手术,将颞浅动脉与脑表面接触,产生颅外侧支至颅内血管,从而促进逐渐的侧化。它已在儿童和成人非动脉硬化性烟雾病中显示出良好的结果。尽管在一项单臂II期试验中对药物治疗进行了优化,但仍对52例有症状的颈内动脉远端低灌注症患者进行了脑硬脑膜动脉闭塞的可行性研究:ERSIAS(脑硬膜下动脉闭塞)。卒中或死亡率为9.6%,这表明在这一高危人群中,脑-脑-动脉-血管-血管系统是相对安全和可行的。还需要额外的研究来评估ICAS患者的安全性和长期疗效,这些患者是中风复发的高危人群,尽管进行了最大限度的治疗。 远程缺血适应试验缺血调理是一种临时性的、低发病率的缺血损伤,可提供对更严重的缺血损伤的保护。虽然这个概念起源于20世纪80年代的心脏病学文献,但它已经在临床前模型和几个缺血性中风的临床试验中得到检验。远程缺血调节(RIC)是一种在临床卒中环境中实施缺血调节的实用方法,它涉及到血压袖带在收缩压以上的反复膨胀和收缩,以诱导暂时性肢体缺血。远程是指诱导缺血到远离目标器官的血管床,在这种情况下,是指大脑。RIC可能改善脑灌注和减轻血栓炎症标志物,但其神经保护机制仍不清楚。尽管如此,每日RIC已被证明是安全可行的,为ICAS患者提供潜在的神经保护。在同一研究人员(Mengetal)的第二项研究中,对58名年龄在80-95岁之间的狭窄患者进行了RIC评估。患者在缺血性卒中或TIA后7天内随机接受RIC或假袖带充气,并随访6个月。RIC组采用与第一次试验相同的血压袖带方案,而假手术组采用相同的方案,但袖带膨胀仅为30mmHg,防止上臂动脉闭塞。与之前的研究类似,RIC组在6个月时的MRI缺血性卒中发生率较低(RIC,6.7%,而假手术,17.8%)。虽然这两项随机对照试验的结果很有希望,但它们受到样本量小和由于方案不符合而导致的高辍学率的限制(表3)。只有符合方案的患者才被纳入分析。在完成研究的患者中,RIC仅引起轻度不适,对血压、心率或局部组织没有不良影响。在RICA试验(症状性颅内动脉粥样硬化性狭窄患者的慢性远端缺血适应)中,57例症状性ICAS患者在卒中或TIA后30天内入组。RIC或假袖带充气方案每天进行12个月,随后自愿使用,中位数为3.5年。在前12个月内观察到高不依从率(>50%)。意向治疗分析显示,RIC组与假手术组缺血性卒中发生率无显著差异(RIC组,16.9%vs假手术组,19.0%;风险比,0.87[95%CI,0.74-1.03];P=0.12)。在预先指定的方案分析中,RIC组缺血性卒中的发生率降低(RIC,14.7%vssham,18.7%;校正风险比,0.76[95%CI,0.59-0.99];P=0.037)。没有严重的不良反应报告。总的来说,这些临床研究表明,RIC与传统的血管危险因素管理相结合,可以减少ICAS患者的复发性卒中。然而,在将RIC纳入常规护理之前,需要解决主要的局限性。首先,RIC的疗效和实用性受到治疗不依从性的极大限制。尽管长期每日RIC耐受性良好且无重大不良反应,但临床试验中使用的方案耗时,包括每天一次或两次50分钟的疗程。 此外,由于中风导致运动功能受损的患者可能需要辅助才能使用RIC装置,这进一步降低了依从性。其次,最佳的RIC方案,包括卒中后RIC启动的时间、周期数和缺血持续时间,仍然不确定。目前在这些临床试验中实施的RIC方案是基于早期临床前心脏病学研究缺乏有效的脑生物标志物来监测RIC的治疗效果,使得设计有效和高效的RIC方案用于ICAS的二级卒中预防变得复杂。 目前,没有正在进行的多中心试验调查ICAS患者的RIC。然而,一项较小的研究(网址:https://www.clinicaltrials.gov;唯一标识符:NCT05599009)正在检查RIC和ICAS背景下的脑血流量。大多数正在进行的RIC研究都集中在急性缺血性卒中的情况下,在中国和西班牙有一些多中心随机对照试验(URL:https://www.clinicaltrials.gov;唯一标识符:NCT04980651,NCT04977869,NCT03375762NCT04980625)。其中一项研究(NCT03375762)旨在通过代谢组学和脂质组学鉴定RIC的系统生物标志物。这些正在进行的试验将为未来的临床应用提供有价值的见解。
 杜佳航 医师 中山大学附属第七医院(深圳) 放射科95人已读
杜佳航 医师 中山大学附属第七医院(深圳) 放射科95人已读 - 精选 介入文献第23期——肝硬化背景下门静脉血栓形成
今日阅读综合介入的一篇文献,来自JournalofClinicalMedicine。标题是《PortalVeinThrombosisintheSettingofCirrhosis:AComprehensiveReview》《肝硬化背景下门静脉血栓形成:综述》 共同通讯作者,JavierCrespo,来自西班牙瓦尔德基拉侯爵大学医院。 JoséIgnacioFortea Abstract:门静脉血栓形成是肝硬化患者最常见的血栓形成事件,在晚期肝病的背景下,门静脉血栓形成的发生率增加。尽管门静脉血栓形成是常见的肝硬化并发症,但门静脉血栓形成对肝脏失代偿和总死亡率的影响仍然存在争议。直接口服抗凝剂和用于门静脉再通的介入技术的出现扩大了我们的治疗手段。然而,缺乏大型前瞻性观察研究和随机试验导致了当前指南的异质性诊断和治疗建议。本文就肝硬化患者门静脉血栓形成的病理生理、临床特点、诊断和治疗作一综述。 Text:1.Introduction 门静脉阻塞可因恶性肿瘤(通常但不恰当地称为恶性血栓形成)而发生,其中阻塞继发于门静脉狭窄,和/或肿瘤直接侵犯门静脉,或由于非恶性门静脉血栓形成(PVT)。后者被定义为发展于门静脉主干和肝内门静脉分支的血栓,也可能涉及脾静脉(SV)或肠系膜上静脉(SMV)。 在没有再通的情况下,门静脉腔被消除,门静脉-门静脉侧支形成,导致门静脉海绵瘤。非恶性PVT可在两种情况下发生,取决于有无肝硬化。这种区分是至关重要的,因为病因、表现、自然史和治疗方案不同。以前的早期文献将这两种情况下的患者合并在一起,应该考虑到这一点以便更好地解释结果。 本文就肝硬化PVT的病理生理、临床特点、诊断和治疗作一综述。尽管PVT是众所周知的肝硬化并发症,但其对肝功能失代偿和总死亡率的贡献仍然存在争议。因此,对其最佳管理没有共识,临床指南或共识会议中也没有明确的建议。 2.AnatomyoftheVenousPortalSystem 肝脏是一个血管丰富的器官,从双重血液供应中接收高达总心输出量的25%。肝动脉输送氧合良好的血液,约占肝脏总血流量的25%,而其余75%是由门静脉供应的脱氧血。这两个传入血管系统流入肝脏的改良毛细血管网络,由有孔的窦组成。血液从窦状窦流入中央静脉,再流入肝静脉,然后流入下腔静脉。 肝门静脉系统是体内最著名的门静脉系统,因此得名。后者被定义为一种循环系统,其中静脉连接两个毛细血管床而不首先将血液输送到心脏。 在肝门静脉系统中,来自整个胃肠道(食道上部和直肠远端除外)、胰腺、胆囊和脾的毛细血管血液被输送到肝窦。 门静脉是一条8厘米长的无瓣管道,起始于胰颈后方SMV和SV的汇合处。肠系膜下静脉(IMV)是一种分支血管,通常在SV内引流(高达40%的病例)。然而,在这个静脉的引流中有许多变种。 IMV进入SV与SMV汇合角(30%)或SMV(20%)。其他较不常见的变异(10%)包括进入SV或SMV的肠系膜副静脉。 门静脉在妊娠第二个月和第三个月由两个卵黄静脉发育而成,它们排出卵黄囊。这些静脉彼此之间形成很少的吻合,从而导致门静脉的形成。偏离这些吻合口的正常过程会导致门静脉分支模式的变化。它在肝脏内的分布是节段性的,与肝动脉密切相关。 程勇等人将这些肝内门静脉变异分为五种不同的类型: 肝内门静脉呈节段性分布,与肝动脉密切相关。(A) I型(65-80%):门静脉主干(MPV)进入门静脉后分为较大的门静脉右支(RPV)和较小的门静脉左支(LPV)。RPV分为前支(供应V、VIII段)和后支(供应VI、VII段)。LVP水平向左走,然后向内侧走(供应I、II、III、IV段)。(B) II型(10~15%):MVP三分叉,分为右前支、后支和LPV。(C) III型(0.3%~7%):门静脉右后支起于门静脉右前支后,为第一支,左门静脉为终末支。(D) IV型(0.6~2.7%):RPV分叉,其中VII段分支为RPV的第1支。(E) V型(1.3-2.4%):右室静脉三分叉,其中VI段的分支作为右室静脉的一个独立分支出现较早。(F) 肠系膜下静脉(IMV)引流的不同变种。I:脾静脉引流(SV)。II:肠系膜上静脉(SMV)与SV汇合处的引流。III:向SMV引流 3.Classification 在文献中,PVT的术语和分类系统差异很大,大多数仅在肝移植(LT)人群中出现。表1列出了已出版的四种主要PVT分类系统: 最近,美国肝脏研究学会(AmericanAssociationfortheStudyoftheLiver,AASLD)关于血管疾病的最新指南和BavenoVII研讨会推动建立描述PVT的标准化术语,以便对未来的研究进行比较和外部验证。他们建议对初始部位、管腔梗阻范围/程度和PVT慢性化进行系统性记录,以便后续评估自发病程和/或对治疗的反应。 门静脉血栓形成的分类。(A) 确定门静脉血栓的范围及其与门静脉主干(MPV)的关系至关重要。肠系膜上静脉(SMV)和脾静脉(SV)受累的特点对预后和治疗有重要意义。(B) 门静脉海绵样变。慢性PVT继发的MPV萎缩(以红色标出)导致门静脉血管肥大,并伴有门静脉-门静脉分流。 与上述一致,PVT的初始描述必须详细说明血栓的位置和范围,明确是否累及肝内分支、门静脉主干、SV和/或SMV。这些位置的管腔闭塞的百分比被分为完全闭塞(没有持续的管腔)、部分闭塞(血栓阻塞50%的原始血管管腔)和轻微闭塞(血栓阻塞50%的原始血管管腔)。如果有,则必须报告海绵样变(即未见原始门静脉的大体门静脉-门静脉侧支)。这不仅对于治疗决策和评估治疗反应非常重要,而且对于确定血栓形成部位与PVT临床表现之间的相关性也非常重要。事实上,SMV受累可能导致肠缺血和异位静脉曲张的发生,而SV血栓形成可能导致胃底静脉曲张的出现。 就血栓形成的时间进程而言,如果假定PVT存在少于6个月,则将PVT归类为新近PVT,如果PVT持续时间超过该时间框架,则归类为慢性PVT。术语近期比急性更受欢迎,因为后者意味着临床症状,而PVT通常是无症状和偶然诊断的。这就是为什么在相当大比例的患者中不可能进行精确的年代测定。6个月阈值的选择是基于对102例近期非肝硬化性PVT患者的前瞻性研究的数据。 在这项研究中,尽管持续抗凝,但PVT诊断后6个月内未能再通导致大多数患者发生海绵状转化。在肝硬化组中也观察到类似的结果。当慢性梗阻持续并发生海绵样变时,首选后者。然而,海绵样变不是慢性PVT的同义词,因为这种发现可以在PVT发病后1-3周内表现出来。 最后,根据自发病程和/或对治疗的反应,PVT可分为进行性(血栓增大或完全闭塞)、稳定型(大小和闭塞无变化)或消退型(血栓减小或闭塞程度减小)。 4.PathophysiologyandRiskFactors与任何其他血栓一样,PVT的发病机制通常是多因素的,目前认为主要由Virchow三联征中的三个生理因素(血流缓慢、高凝状态和内皮损伤)的相互作用决定。然而,这些因素对PVT发展的确切作用尚未完全阐明。 4.1.ReducedBloodFlow 门静脉血流速度下降继发于门静脉侧支循环的“窃血效应”,加上临床上常见的门静脉高压症(CSPH)患者门静脉内径的增加,似乎是肝硬变患者发生门静脉高压症的最重要因素。具体地说,提出了门脉流速15厘米/秒的阈值来识别发生PVT的高风险患者。这是由Zocco等人在一项对100名肝硬变患者进行为期一年的前瞻性研究中首次报道的。从那时起,其他回顾和前瞻性研究证实了这一发现。 然而,一项针对肝细胞癌的超声筛查前瞻性试验的大型卫星研究并未证实这一点,并对门静脉血流速度测量的重复性提出了担忧,从而使特定阈值的推广变得不确定。在这方面的进一步间接数据来自确定门静脉内径较大和存在较大的门静脉侧支血管作为发生门静脉血栓的危险因素的研究。经颈静脉肝内门体分流术(TIPS)通过增加门静脉血流恢复PVT通畅的有效性也支持门静脉血流动力学改变在PVT发展中的这一主要作用。 由于非选择性β阻滞剂(NSBB)可能通过减少心输出量和引起内脏动脉收缩来减少门静脉血流量,因此有人认为它们可能增加门静脉血栓形成的风险。 这一点非常重要,因为NSBB的适应症最近有所扩大,现在不仅被推荐用于静脉曲张出血的一级或二级预防,而且还被推荐用于预防代偿性晚期慢性肝病和CSPH患者的失代偿。 最近的一项系统回顾和荟萃分析显示,接受NSSB治疗的患者发生门静脉血栓形成的风险增加(OR4.62,95%可信区间2.50-8.53;p<0.00001)。然而,在样本大小、PVT定义和肝病分期方面存在高度的异质性,并且大多数研究没有评估混杂因素的潜在作用。 事实上,在两项大型前瞻性研究中,在调整了与门静脉高压症严重程度相关的变量后,NSBB与门静脉高压症风险增加无关。因此,NSBB的使用不应基于这一担忧而受到限制,考虑到其在肝硬变患者中的更大益处,更应如此。 4.2.AlterationsinCoagulation 长期以来,肝硬化被认为是血小板减少和常规凝血试验异常导致的获得性出血性疾病。然而,与遗传性凝血病不同,肝硬化影响凝血级联的整个谱(即促凝和抗凝因子),并且与血小板活性亢进和血管性血友病因子水平升高相关,所有这些都导致“止血再平衡”。 这种新的平衡是脆弱的,很容易倾向于出血前表型或血栓前表型。此外,有人认为这种潜在的血栓前状态与肝病的进展密切相关,也可能与PVT的发生有关。 几项研究已经评估了与肝硬变相关的止血改变是否会增加PVT的风险,并在其他地方进行了广泛的综述。传统的凝血试验(例如凝血酶原时间或部分凝血活酶时间)不能充分反映这种新的止血平衡,因为它们没有考虑抗凝剂因素对凝血酶的抑制。 长期以来,FVIII和蛋白C之间的比值被认为反映了凝血潜能的增加,尽管最近有数据挑战了这一假设,表明尽管可以预测肝硬变并发症的发展,但它与肝硬变患者的凝血状态无关。关于它在PVT中的作用,发表了相互矛盾的结果。在其他与肝硬变相关的止血变化中也观察到了类似的发现,如因子II与蛋白C的比率、凝血因子水平、血栓调节蛋白抵抗、纤溶标志物、纤溶酶原激活物抑制物1水平或粘弹性参数。 值得注意的是,前述研究评估了全身血液中的凝血因子,很少有研究评估门静脉是否代表高凝的血管床。虽然最初的研究描述了这一区域存在相对高凝状态,但最近的一项研究未能在接受TIPS置入术的肝硬变患者中重复这一发现。它在PVT发生中的假设作用没有得到检验,因为这些研究中没有一项评估了PVT患者。 关于血小板聚集在PVT发生中的作用的数据较少。与先前的研究相反,最近的研究表明,在这些患者中,尤其是在失代偿期和门静脉中,血小板功能亢进。此外,这种增加的血小板聚集能力与进一步失代偿、死亡和PVT的风险更高相关。与这些发现一致,最近的一项研究表明,ADAMTS-13/vonWillebrand因子比值可预测PVT。这些结果为评价抗血小板药物预防PVT和阻止疾病进展的使用奠定了合理的基础。 其他可能导致肝硬变患者血液高凝的因素是全身性炎症,这是失代偿性肝硬变以及肝细胞癌的公认特征。对前者的研究很少,结果相互矛盾。 最近的一篇论文发现,血清白蛋白与PVT呈负相关,并提示白蛋白通过抑制氧化应激而减少血小板的激活,从而调节止血系统。根据作者的说法,这些发现建立了随机干预研究的理论基础,以调查白蛋白预防肝硬变PVT的有益效果。在长期的白蛋白给药试验中没有提供这方面的信息。 就肝细胞癌而言,越来越多的证据表明,它与血栓前改变(即血小板活化和功能增强、凝血酶生成增强、纤溶功能低下和血栓前微泡水平升高)有关,这些改变可能协同促进高凝状态和血栓形成。 关于遗传性和其他获得性血栓前疾病在PVT发生中的作用,目前的数据是相互矛盾的。现有的有限数量的研究大多是小样本量的病例对照研究。他们的研究设计、目标人群(不同种族和地理位置)、PVT的诊断标准以及对血栓形成情况的评估差异很大,导致结果不一致。此外,这些研究中没有一项正确评估血栓形成是否会影响疾病的进展速度或治疗反应。 在不同的亲血栓基因缺陷中,因子VLeiden和凝血酶原G20210A突变是研究最多的。三项荟萃分析得出结论,它们增加了肝硬变患者门静脉血栓形成的风险,尽管其中一项研究没有显示出与凝血酶原突变的相关性,而且所有这些研究都受到纳入研究质量的影响。 遗传性蛋白C、蛋白S或抗凝血酶III缺陷因同时存在肝脏合成功能障碍而难以检测。然而,它们的水平似乎与PVT的发展无关。亚甲基四氢叶酸还原酶C677T和纤溶酶原激活物抑制剂1型4G-4G突变也被认为是PVT的独立预测因素,尽管这些多态性与血栓形成风险增加并无明确关联。 其他获得性血栓前疾病在肝硬化合并PVT患者中的作用较少评估。与非肝硬化PVT相比,骨髓增殖性疾病和抗磷脂综合征的相关性迄今尚无定论。 由于数据相互矛盾,目前的指南并没有强烈建议在PVT诊断前或血栓形成后对这些疾病进行筛查。 总之,并无确凿证据表明肝硬化相关的止血改变或遗传性和其他获得性血栓前疾病导致的高凝状态在PVT的病理生理学中起主要作用。 4.3.EndothelialDamage内皮损伤 在Virchow三联征的三个组成部分中,内皮功能障碍在PVT生成中的假设作用研究最少,部分原因是内脏区域难以进入。因此,我们需要开展更多研究来比较合并或不合并PVT的肝硬化患者汇管区血液中的内皮特异性标志物。 硬化治疗、既往腹部手术史、脾切除和门体分流手术造成的内皮损伤也被认为是PVT的危险因素,尽管其中一些手术引起的门静脉血流改变也促进了血栓的形成。 5.Epidemiology 流行病学 PVT是肝硬化最常见的血栓事件。由于所纳入人群(接受肝移植的患者是研究最多的)、PVT的定义以及用于诊断PVT的检测方面的研究存在异质性,因此很难确定PVT的发病率和患病率。 少数前瞻性研究报告的1年内发病率在1.6%至4.6%之间。最近的一项荟萃分析显示,一年和三年的累积发病率分别为4.8%和9.3%。 这种发生率在代偿和失代偿患者中有所不同。在后一项荟萃分析中,Child-PughA级和Child-PughB-C级PVT的总发生率分别为9.9%和18.3%。肝癌的发生率更高(高达40%)。 发病率也因疾病病因而异,有证据表明PVT更常与非酒精性脂肪性肝病相关。 6.ClinicalManifestationsandPrognosticImpact 临床表现和预后影响 PVT的诊断通常是无症状的,通常通过常规的影像检查发现。PVT的症状是非特异性的,包括恶心、呕吐、轻度腹痛、腹泻和食欲不振。由于PVT延伸至SMV而导致的肠系膜缺血是很少见的。 晚期肝硬变患者比非肝硬变患者更容易避免这种并发症的发生,这是因为门静脉系统侧支的频繁存在实现了减压。 因此,在PVT特征(病程、闭塞程度和肝病分期)和临床表现之间建立相关性是很重要的。例如,在急性腹痛的情况下,超声(US)发现部分闭塞的PVT不应推迟进行对比增强计算机断层扫描(CT)或磁共振(MR)扫描,以排除腹痛的其他原因(例如毛囊炎或门静脉恶性浸润),并更好地确定PVT的真正范围。 在其他情况下,PVT的诊断与肝脏失代偿一致,同样,时间关系不应直接解释为因果关系的证据。事实上,PVT对肝硬变的自然病程和预后的影响是有争议的,PVT是进展性疾病的表现,还是疾病进展的实际原因仍有待阐明。 在患者选择标准(代偿性vs.失代偿性)、血栓形成的程度和范围(闭塞性vs.非闭塞性)、治疗策略(抗凝vs.非抗凝)、样本量和随访时间方面,不同研究之间的差异导致了相互矛盾的数据。 因此,几项前瞻性和回顾性研究表明,PVT不是疾病进展或死亡率增加的原因,而一项随机研究——Villa等人的研究间接提出了相反的观点。在这项小型对照试验中,ChildB-C级(7~10分)肝硬化患者接受为期12个月的4,000IU/d依诺肝素治疗不仅预防了PVT,而且改善了生存率和失代偿。 此外,PVT被证明与静脉曲张出血的高风险以及内窥镜下控制出血和再出血的失败独立相关。 在肝移植受者中,门静脉血栓对肝移植术后存活率的影响似乎取决于手术时门静脉血栓的大小和程度。两个大型移植数据库的分析表明,PVT是移植后存活的一个强有力的独立预测变量,但没有根据PVT的级别对这种风险进行分层。 其他研究和荟萃分析表明,只有完全闭塞的PVT才会增加移植后的死亡率。结果更差的门静脉血栓延长的阈值尚不清楚,但可能与非解剖门静脉重建(肾门静脉吻合、腔静脉半转位或门静脉动脉化)的需要有关。由于增加了技术难度和增加了移植物缺血时间,这些病例的预后更差。 遗憾的是,没有随机对照试验表明PVT治疗可改善移植后生存率。由于这些不一致的结果和缺乏随机对照试验,指南的建议存在差异。因此,AASLD关于血管疾病的指南指出,没有足够的数据建议以改善移植后结局为目标的移植前PVT治疗。BavenoVII共识建议对潜在的肝移植受者进行抗凝治疗,其目的是防止血栓再形成或血栓进展,以促进肝移植中充分的门静脉吻合,降低术后发病率和死亡率。 同样,一些指南只建议在筛查肝细胞癌时对潜在的肝移植候选者进行门静脉血栓的筛查,而其他指南则没有提出任何具体建议。 7.NaturalHistory PVT在自然病史方面也是一种异质性疾病,这种异质性使得PVT在静脉血栓中显得独特。一方面,PVT的自发性再通被广泛描述。最近一项比较抗凝与未抗凝的肝硬变门静脉血栓患者的Meta分析显示,自发性门静脉再通率为42%。这种事件的发生概率在代偿性肝硬变或部分门静脉血栓形成(高达70%)中较高,而在失代偿期肝硬变和肝移植患者中则低得多。用于分期血栓范围的不同成像技术也导致了所报道的自发再通率或进展率的异质性。除了这些因素之外,目前尚不清楚PVT自发改善或进展的其他预测因素,因此难以评估用于治疗PVT的不同治疗方法的真实疗效。必须指出的是,虽然PVT可能会自发消退,尤其是在非闭塞性和代偿性肝硬化的情况下,但在未经治疗的患者中,有33%发生了PVT进展。 另一方面,抗凝后的门静脉再通率明显低于其他血栓,特别是在陈旧性血栓中。Driever等人最近对这一发现提出了解释。在他们的研究中,他们描述了79名患者在肝移植期间收集的非恶性肝硬变PVT的成分和结构。他们观察到,所有的PVT都包括门静脉血管壁内膜增厚,外观类似于内膜纤维化,只有三分之一的血栓含有额外的富含纤维蛋白的血栓。基于这些发现,他们建议将PVT的名称改为门静脉狭窄,并且大多数患者缺乏纤维蛋白可能解释了抗凝治疗再通率低的原因。 8.Diagnosis门静脉血栓的初步诊断通常用多普勒超声,这种诊断技术是门静脉血栓的首选筛查方法。 支持这种恶性侵袭的发现包括门静脉内径增大、注射造影剂时动脉相血栓强化、新生血管、肿瘤到血栓的距离小于2厘米、肿瘤大小>5厘米。最近提出的Avena标准综合了所有这些发现,除了肿瘤大小,还包括甲胎蛋白>1000ng/dL。对于达到以上其中3项的患者,可以准确地做出恶性侵犯的诊断(100%敏感性、94%特异性、80%阳性预测值和100%阴性预测值)。 关于门静脉血栓的“年龄”,近期门静脉血栓的特征包括低回声和低密度血栓,门静脉平扫时门静脉密度增加,门静脉密度增加,增强CT扫描中心透明。相关的肝脏血流灌注改变也可以表现为动脉期肝实质增强,门脉期增强减弱。相反,血栓壁内的钙化和海绵状肿瘤的存在提示慢性(图3)。必须指出的是,前者只能用US或CT发现,而不能用MR检查,而且在PVT发病后1-3周内可发生海绵状改变(图4)。 图3.CT增强扫描门静脉血栓形成的不同表现。(A)轴向面显示门脉主干部分闭塞性门静脉血栓形成,无侧支或其他门脉高压间接征象。(B)门静脉血栓形成时出现侧支循环伴脐静脉再开放和脾脏肿大。(C)斜平面示门脉主干部分闭塞性门静脉血栓形成,右叶下段肝灌注缺损。(D)肝硬化患者的慢性门静脉血栓形成。注意门静脉钙化是慢性的间接征象。萎缩性肝伴脾肿大、侧支和腹水常出现在肝硬化的情况下。 图4.门静脉海绵样变。(A)显示门静脉主干被起源于门静脉血管的门静脉侧支取代的轴位平面。(B)门静脉的冠状面及其海绵样变与构成门静脉侧支的新血管的缠绕。9.Prophylaxis 只有一项试验评估了抗凝在预防PVT中的作用。在Villa等人的这项研究中,70名肝硬变患者(ChildB7-C10)被随机分成两组,一组接受预防性剂量的依诺肝素(每天4000IU,共48周),另一组不接受治疗。 接受依诺肝素治疗的患者的门静脉血栓发生率较低,失代偿事件的持续减少超出了门静脉血栓减少的预期。作者暗示依诺肝素诱导的肠道屏障功能的改善和减少细菌易位是一个潜在的机制。也有人推测,这些有益的作用也可能与抗凝的抗纤维化作用有关。 事实上,越来越多的证据表明,与肝硬变相关的潜在血栓前状态可能会导致肝纤维化的发展和肝病的进展,可能是通过在肝脏微循环中产生血栓导致实质消退,以及通过凝血酶和凝血因子Xa通过蛋白酶激活的受体激活肝星状细胞。一项使用利巴罗班代替依诺肝素的验证性研究结果令人热切期待。 10. Treatment 在肝硬变的背景下是否治疗门静脉血栓取决于血栓的年龄和范围、症状的存在和患者的移植状态。 对于担心肠缺血的患者,建议尽早开始抗凝,并立即咨询手术、危重护理、介入放射学和血液学。在没有缺血症状的患者中,现有关于治疗有益效果的薄弱证据以及PVT对肝硬变自然病程的不确定影响解释了当前指南的异质性建议。在这种情况下,治疗的目的是防止血栓扩大,这可能会导致门脉高压的进展,阻碍未来的肝移植,或阻止传统的门静脉端到端吻合,从而降低移植后的发病率和死亡率。总体而言,尤其是在非LT候选患者中,治疗应在个案基础上加以考虑。表2显示了关于治疗适应症和其他问题的不同指南的建议。 10.1.NoTreatment 对于抗凝治疗的生存获益不确定性较大的无症状非肝移植候选者,通常考虑采用保守方法。在这种情况下,最近的指南建议对小的肝内门静脉分支血栓形成或门静脉微阻塞(管腔阻塞50%)采取保守的方法。如果连续成像出现进展,则应考虑抗凝治疗。 后一种策略也可以应用于门静脉血栓慢性完全闭塞或门静脉海绵样变性的患者,这些患者没有明确的抗凝治疗益处。这些患者抗凝的主要目的是防止血栓复发,并在较小程度上再通。在这种情况下的决策过程应该基于出血风险、SMV受累、是否存在血栓形成、LT候选和患者喜好。因此,美国胃肠病学会关于肝脏和肠系膜循环障碍的指南建议,只有当有(I)遗传性血栓形成倾向的证据,(Ii)血栓的进展,(Iii)由于血栓延伸到肠系膜静脉而导致的肠缺血病史,或(Iv)等待LT的患者有PVT时,慢性PVT患者才能抗凝。 10.2.Anticoagulation 抗凝是PVT治疗的主要手段。大多数评估肝硬变患者抗凝药物安全性和有效性的研究都是小规模的回顾性研究,这些研究在纳入标准、PVT的大小(以部分闭塞的PVT为主)、抗凝的时机和类型以及结果的评估方面各不相同。此外,抗凝决定是基于提供者的判断,而不是基于预定义的方案。 由于这些局限性,这些研究和汇总数据Meta分析的数据表明,抗凝在实现门静脉再通方面是安全有效的,但其对生存期的影响仍不确定。 在有效性方面,后者的Meta分析显示,任何程度的再通的再通率在66.6%至71.5%之间,完全门静脉再通的再通率在40.8%至53%之间。相比之下,尽管抗凝,血栓进展率在5.7%到9%之间。早期应用抗凝药物(一项研究<14天或其他研究<6个月)对于治疗成功至关重要,平均再通时间为5.5至8个月。然而,据报道,即使在治疗一年后也有延迟反应。 与良好应答相关的其他因素包括较低的疾病晚期、较低的广泛血栓形成、SMV闭塞程度<50%、较低的血小板计数、既往无PHT相关出血以及基线时较低的脾脏厚度。重要的是,当停止抗凝治疗时,30-40%的患者会复发PVT。从停止抗凝治疗到血栓复发的时间为2~5个月。所有这些发现解释了现行指南中关于抗凝治疗至少6个月,以及在肝移植前维持抗凝治疗的建议(表2)。值得注意的是,无论决定是否开始抗凝治疗,均缺乏证据建议具体的影像学检查时间或类型。AASLD建议每2~3个月进行1次系列影像学检查,以评估治疗应答情况,如果选择保守治疗,则每3个月进行1次影像学检查,但如果PVT进展,则考虑抗凝治疗。 接受抗凝治疗的患者早期再通率明显高于未接受治疗的患者(总再通率为25%~42%,优势比为2.61~4.8;完全性门静脉再通为33%,优势比为2.14~3.4)。同样,PVT进展在未经治疗的患者中更有可能(33%,优势比在0.06至0.26之间)。 抗凝治疗下这些较高的再通率的影响仍不确定,两项荟萃分析显示静脉曲张出血风险降低,另一项荟萃分析显示总存活率提高。一项未发表的个体患者数据荟萃分析也显示总体存活率增加,并发现抗凝的益处很大程度上取决于门静脉再通。 无论影响如何,抗凝治疗被证明是安全的,与未接受治疗的患者相比,大出血和小出血的发生率相似(10.3~11%)。此外,在发生上消化道出血的肝硬化患者中,抗凝治疗与5天治疗失败或6周死亡率的增加无关。在接受抗凝治疗的肝硬化PVT患者中,血小板计数低于50×109/L是任何部位出血的危险因素。这些患者发生PVT的风险也较高,因此应根据具体情况评估治疗方案。 目前的抗凝选择包括维生素K拮抗剂(VKAs)、普通肝素、低分子肝素(LMWH)、磺达肝素和直接口服抗凝剂(DOAC)。表3显示了每种治疗方案的主要特点。大多数已发表的研究都使用了VKA和LMWH,两者似乎都有类似的效果。 10.2.1.UnfractionatedHeparin普通肝素 在存在肾功能不全和/或担心肠缺血的患者中,可以使用普通肝素治疗PVT,因为抗凝作用可能迅速逆转。然而,静脉给药排除了将其用作长期治疗的可能性。 10.2.2.LowMolecularWeightHeparin(LMWH)低分子肝素 低分子肝素传统上被认为是PVT的首选治疗方法。由于其非肠道给药,患者的依从性和生活质量可能会受到影响。 因此,对于最终将接受VKA或DOAC的患者,它通常被用作一种“过渡”疗法。这种“过桥”疗法的持续时间在不同的中心有很大的不同,一些中心同时启动LMWH和VKA(一旦INR达到2-3的治疗范围就停止LMWH),而另一些中心(与我们的中心类似)将口服抗凝推迟一个月。然而,在某些特定的患者中,LMWH可能比VKA更合适,例如对于需要定期穿刺术的顽固性腹水患者或INR延长的患者。 就剂量而言,一项小型研究表明,每天两次服用依诺肝素1毫克/公斤具有类似的疗效,但并发症少于每天1.5毫克/公斤。对于出血风险高的患者(例如,严重的血小板减少症),是否有必要减少剂量尚不清楚,一项小型研究表明,减少剂量与疗效下降无关。在晚期疾病患者中,由于抗凝血酶III(与低分子肝素结合的底物)水平较低,测量抗凝血因子Xa活性以监测低分子肝素的抗凝效果可能会导致治疗过量。因此,尽管有足够的抗凝作用,但肝硬变患者的抗Xa水平显著降低。尽管有这个限制,我们仍然使用抗Xa水平来帮助我们调整LMWH治疗中有出血并发症的患者的剂量,尤其是在存在肾功能障碍和病态肥胖的患者。 10.2.3.Fondaparinux 磺达肝癸钠磺达肝素通过与抗凝血酶III选择性高亲和力结合来抑制活化因子X。与肝素不同,磺达肝素不直接抑制凝血酶或血小板第四因子。因此,肝素引起的血小板减少的风险要低得多。它每天给药一次,比大多数LMWH更方便。 关于磺达肝素的有效性和安全性,在一项包括124名肝硬化和PVT患者的回顾性研究中,将磺达肝素与低分子肝素进行了比较。磺达肝素在36个月时显示出较高的门静脉血栓消退率(77%对51%;p=0.001),但出血率也较高(27%对13%;p=0.06)。在提出正式建议之前,还需要进行进一步的前瞻性研究。 10.2.4.VitaminKAntagonists 维生素K拮抗剂在等候名单和非等候名单队列中,采用上述“过桥”战略的VKA被证明是安全和有效的。与LMWH相比,再通率和不良反应似乎相似。VKA的主要局限性是治疗窗口狭窄,以及由于在晚期肝硬变患者中观察到INR基线升高而导致剂量不足的风险。 10.2.5.DirectOralAnticoagulants 直接口服抗凝剂 DOAC,包括直接凝血酶抑制剂(Dabigatran)和凝血因子Xa抑制剂(rivaroxaban、apixaban和edoxaban),最近被添加到PVT治疗中。它们的主要优点是固定剂量的口服,与其他药物的相互作用较差。目前可用的数据表明,在Child-PughA级患者中使用DOAC没有重大的安全性问题,在Child-PughB级患者中应谨慎使用(一些作者不推荐在这些患者中使用利伐沙班,因为它们的血药浓度和药效学效应增加)。在Child-PughC级患者中,不推荐使用DOAC。 关于它们在肝硬变中的药代动力学,我们知之甚少。使用失代偿期肝硬变患者血浆进行的体外研究表明,用凝血酶生成试验测定抗凝血酶的效力存在差异。药物代谢的各个步骤的缺陷,如血浆蛋白结合、细胞色素P450功能、胆汁排泄和潜在的肝硬变引起的肾脏清除的缺陷,可能部分解释了这些结果,尽管还需要更大的体内研究。 几项回顾性研究和荟萃分析观察到,在受心房颤动、静脉血栓栓塞或pvt影响的肝硬化患者中,doac与vka相比,在出血并发症方面具有相似或更好的安全性。Nisly等人进行了一项系统综述和荟萃分析,只考虑根据国际血栓与止血学会(InternationalSocietyonThrombosisandHaemostasis)定义,主要安全性结局为大出血的研究。他们发现DOACS和传统抗凝剂在这方面没有重大差异。然而,必须指出的是,晚期肝硬化患者的出血风险增加。在一项回顾性研究中,Semmler等观察到自发性出血与肝病严重程度显著相关。 由于越来越多的证据,它们更容易给药,以及逆转剂(达比加兰的idarucizumab和利伐沙班和apixaban的andexanetalfa)的存在,这些药物的使用越来越多。目前的障碍,除了对晚期肝病患者的安全性问题外,还有它们的高成本和有限的可获得性。 10.3.TransjugularIntrahepaticPorto-SystemicShunt TIPS术 PVT此前被认为是创建TIPS的禁忌症。然而,新的介入放射学技术的引入使技术成功率提高到86.7-95%。必须强调的是,大多数可用数据来自在纳入标准和采用的处理方法上不同的小型、非受控和回溯性队列。此外,传统治疗难以解决的门脉高压并发症,而不是门脉高压本身,是肝硬变和门静脉高压症患者放置门静脉高压症的最常见的适应症。 两项荟萃分析显示,TIPS术后再通率为81-84.4%,完全再通率为73%。主要并发症发生率为10%。与抗凝相比,TIPS在门静脉再通方面具有更高的有效性。 关于门静脉高压相关并发症,两项随机对照试验评估了TIPS与标准疗法(内镜套扎+普萘洛尔+抗凝)相比,在肝硬化PVT患者中预防静脉曲张再出血的有效性。两项研究均显示,TIPS在预防再出血和PVT再通方面更有效,且不增加肝性脑病和不良反应的风险。然而,这些有益作用并未转化为生存期的改善。 这两个试验都在TIPS后使用了抗凝,尽管TIPS后的抗凝指征尚不清楚。事实上,目前的证据不支持使用它来进一步提高再通率,尽管在静脉血栓扩大到SMV的情况下可以考虑使用它。 门脉海绵状肿瘤或无可辨认的肝内门脉主干或分支的患者是最具挑战性的。对于这些患者,改良的经脾或被称为门静脉再通-TIPS的方法被证明将技术成功率提高到90%以上(范围为75-100%)。 在这些操作中,门静脉再通是通过血管成形术/支架置入和随后的TIPS置入来确保系统流出。TIPS失败的原因可能是门静脉远端或脾-肠系膜汇合处缺乏锚定区。根据上述情况,目前的指南建议对有肝硬变和门静脉血栓的患者考虑以下适应症的提示:(1)抗凝反应不充分或禁忌症;(2)慢性门静脉高压相关并发症,难以治疗;(3)阻碍移植物与受体门静脉之间生理性吻合的慢性门静脉高压症。 图5显示了根据最新的BavenoVII共识的治疗算法。 10.4.Thrombolysis 溶栓 局部或全身溶栓被认为是近期PVT抗凝治疗的辅助手段。小病例系列报告的有效率与单用抗凝治疗相似,但具有与手术相关的发病率和死亡率的高风险。基于这些初步观察,目前的指南只建议在专门的中心对尽管抗凝但仍存在肠道缺血的非常特定的患者进行溶栓治疗。 10.5.OtherConsiderations 其他考虑事项 门静脉高压症并发症的处理不应与其他肝硬变患者不同。必须在实施适当的胃肠道出血预防措施后开始抗凝。因此,未接受NSBB的失代偿期患者应接受筛查内窥镜检查,而具有明确临床显著门静脉高压症状的代偿性晚期慢性肝病患者可直接开始接受NSBB。否则,上消化道内窥镜检查应在不符合BavenoVI标准的患者中实施。如果符合这些标准,这一决定应根据PVT的年龄和程度以及是否开始抗凝治疗而个体化。重要的是,最近的数据表明,抗凝不应推迟,直到静脉曲张被根除或β完全阻断。本建议也适用于二级预防措施的设置。 事实上,通过预防性的内窥镜精索静脉曲张结扎术持续低分子肝素治疗不会增加肝硬变患者的出血风险,在非肝硬变的门静脉高压症患者中也有类似的发现。在这方面需要更多的数据。肝细胞癌侵犯门静脉的患者不能从抗凝中受益。 然而,在少数情况下,最初的“恶性”血栓会导致血流停滞,从而导致血栓形成和症状性门静脉血栓形成(例如,肠缺血)。在这种罕见的情况下,在权衡风险和益处后,可能会考虑抗凝。对于与癌症相关的近期(非肝硬化性)内脏静脉血栓形成,国际血栓和止血学会推荐使用低分子肝素或DOAC。他们建议将低分子肝素应用于腔性胃肠癌、活动性胃肠粘膜异常、泌尿生殖道癌出血风险高的患者,或正在接受与DOAC有潜在相关药物相互作用的现有系统治疗的患者。 最后,我们对肝移植后PVT的预防有几点看法。肝移植前PVT是PVT复发的危险因素,如果进行非解剖吻合术,或者如果肝移植前PVT的程度和范围很大,风险更大。根据西班牙肝移植学会和西班牙血栓和止血学会最近达成的共识,对于没有凝血障碍、肝移植功能障碍或低血小板计数(<30,000-50,000/微升)的有PVT危险因素的患者,建议在术后24小时内开始治疗性低分子肝素(即1mg/kg)。危险因素包括肝移植前门静脉血栓形成、门静脉血流缓慢(再通后)<1300毫升/分或<65毫升/分/100克、取栓过程中血栓部分切除或静脉内膜损伤、非生理性门静脉回流重建和受体亲血栓形成障碍。在无并发症的情况下,应在肝移植后至少延长治疗2个月,然后进行个体化治疗。 11.Conclusions 门静脉血栓形成是肝硬变患者最常见的血栓形成事件。最近DOAC的加入和新的门静脉再通放射学技术是治疗这一并发症的重大突破。然而,缺乏大型前瞻性观察研究和随机试验解释了其对肝硬变自然病程的影响的不确定性,以及当前指南中的异质性诊断和治疗建议。因此,需要未来的研究来填补目前的知识空白,并可能需要多中心合作。
 杜佳航 医师 中山大学附属第七医院(深圳) 放射科129人已读
杜佳航 医师 中山大学附属第七医院(深圳) 放射科129人已读 - 精选 介入文献第17期——钇90玻璃微球治疗肝癌2022版专家共识更新
今日阅读肿瘤介入的一篇文献,来自EurJNuclMedMolImaging(impactfactor:10.1)1区标题是《Clinical,dosimetric,and reportingconsiderationsfor Y-90glassmicrospheresin hepatocellularcarcinoma:updated2022recommendationsfrom an internationalmultidisciplinaryworkinggroup》《Y-90玻璃微球在肝癌治疗中的临床、剂量学和注意事项:国际多学科工作组2022年更新建议》 通讯作者Riad Salem,来自美国芝加哥的西北范伯格医学院放射科。 其他作者包括Siddharth A. Padia,来自美国加州大学洛杉矶分校放射系。Marnix Lam,来自荷兰乌得勒支大学医学中心放射学和核医学系。等等。 Abstract:Purpose:根据最近发表的临床报告和试验,TheraSphere全球剂量学指导委员会(DSC)再次召开会议,审查新的数据,并更新之前发表的肝细胞癌(HCC)治疗的临床和剂量学建议。 Methods:TheraSphere全球DSC由多个学科的医护人员组成,涉及使用钇-90(Y-90)玻璃微球的经动脉放射栓塞(TARE)治疗HCC。采用Delphi法对2019年1月至2021年9月期间发表的文献进行了回顾、讨论和评审。本更新文件中所包含的建议包括文献综述的结果和委员会成员的专家意见和经验。 (关于Delphi法:又名专家意见法。流程:确定主题——组成专家小组——专家根据资料提出意见——收集所有意见再发给各专家,循环四轮,可修改意见——最后达成共识) Results:经过委员会讨论,建议扩展到适用于HCC患者的5种常见临床场景,以支持Y-90玻璃微球更个体化的有效治疗。现有的临床方案进行了更新,以反映HCC患者在剂量学方法和治疗模式方面的最新发展。 Conclusion:结合疾病表现、肿瘤生物学和治疗意愿更新了共识,以用于指导Y-90玻璃微球TARE在HCC中的临床实践和剂量学方法。 Text:Method:该委员会由介入放射科医师、放射肿瘤科医师、核医学医师、临床科学家、肿瘤内科医师和物理学家组成,再次召开了4次2小时的虚拟会议,并进行了另外一次离线审查,为更新建议做准备。在第一次会议上,委员会审查了之前的建议、最近发表的文献,并讨论了更新情况。为了识别之前推荐的文献,我们结合以下检索词在PubMed中进行了检索:经动脉放射栓塞、TARE、近距离放射治疗、内部放射治疗、SIRT、Y90、钇-90、theraphere、肝细胞癌和HCC。 委员会还考虑了是否有必要根据新数据改变以往建议的推荐程度和/或共识强度(表1和2)。根据德尔菲法,虚拟会议期间的简要共识定义见表2。成员们的强烈分岐意见被记录在案,并在建议中酌情作为注意事项予以突出。 在第二次和第三次会议上,委员会成员审查了修订后的建议,并集体讨论了每一项修改。在会议之间,主要作者(RS)根据委员会的讨论和意见修订了建议。第四次也是最后一次会议对建议进行了全面审查,并审阅了文稿草稿。指导委员会成员随后有机会独立审阅和修改文稿,最后的意见由第一作者纳入文稿。投稿前,所有作者均正式认可了文稿及其建议。 纳入自2019年1月1日以来发表的所有TARE治疗HCC的研究。如果指导委员会成员提出建议,则对这一时间范围之外的其他研究进行审查。本综述未包括针对技术难题而非临床诊治的文献。这份更新后的文件中所记载的建议纳入了批判性文献综述以及委员会成员的专家意见和经验。表3、4、5、6和7中提出的所有建议均须遵守各国的监管和临床标准。 鉴于与Y-90玻璃微球TARE相关的模式和治疗目标的变化,委员会同意将临床场景从4个扩展到5个,将多病灶单侧和双侧疾病建议分开,并修改每种疾病的定义。修订后的建议如下: Curativeintent治疗的目的:放射节段切除术Radiationsegmentectomy:局限性疾病(位于≤2节段的一个或多个肿瘤)。采用现代手段,超选择性地传递到肝脏的亚节段【称为血管小体(即由肝动脉的特定分支灌注的肝脏区域)】,目的是向肿瘤和正常组织传递消融剂量。放射节段切除术不再狭义地定义为≤2节段,而是包括较小的肝节段切除。 表3 方案1:建议使用Y-90玻璃微球进行放射节段切除术 治疗目的 •如果非移植候选者(如:孤立T1,孤立/多灶性UNOST2-T3),则明确治疗。在适当选择的患者(例如:单发/多灶性UNOST1-T2-T3期)中,肿瘤控制具有治愈性治疗的潜力,用于过渡/降期直至可移植。 患者选择 1. Child-PughA级,选择B7,肿瘤分期UNOSt1~t3期(如果可能过渡或降期至移植和节段性输注,可考虑Child-PughB7-C[罕见情况])2. 既往接受过肝脏治疗(即手术切除、消融、体外放射治疗或立体定向放射治疗)的患者可接受治疗。对于既往接受过化疗栓塞的患者,在标测血管造影期间对血管供应和通畅性进行的血管造影评估将确定患者是否符合TARE标准。患者可在体外放射治疗或立体定向放射治疗后接受Y-90玻璃微球TARE,但仍需更多数据来确定疗效和安全性。早期数据提示,在保留肝功能的患者中,它是安全的。3. 毗邻结肠、胆囊和胃的肿瘤可以安全地治疗;在这种特殊的邻近结构的辐射毒性已被报道,但极为罕见4. 对于多灶性疾病,可以在同一次治疗中对两个独立的Couinaud节段进行多次放射性肺段切除术,包括两个节段,这两个节段将定义为正常基础肝脏或代偿良好的肝硬化患者的双叶疾病(例如:第6节段的1个病灶,第2节的1个病灶)。历史上,放射性肺段切除术定义为≤2个肺段;然而,目前的定义包括将Y-90玻璃微球输注到更小的肝段(称为血管体),目的是向组织提供消融剂量。最近的研究报告,Y-90玻璃微球TARE输注在ALBI-1患者中可达25%,具有良好的耐受性,并注意到在ALBI-2和Child-PughB级患者存在超过14%的额外肝毒性。5. 对于既往接受过肝切除术的患者,考虑到剩余FLR和潜在毒性,应谨慎选择放射性肝段切除术。治疗前的考虑因素包括肝切除术后肝细胞肥大的程度、切除至复发的时间以及肝实质的总体积。因此,在这种情况下使用放射性肺段切除术需要进一步研究。 治疗计划诊断和靶体积定义 理想的诊断成像应该是增强磁共振(MR),也可以使用增强CT。两种成像方式都被认为是可以接受的。 1. CT测定血管体体积;这是测定灌注量的金标准和首选方法;2. 如合并节段性门静脉侵犯,则应在CT证实的MVI/PVT范围内进行治疗;3. 如果怀疑微卫星病变,则治疗CT所见病灶的更大范围(即病变越大,所需的安全边界越宽);推荐的标准为血管造影/CT边缘≥1cm。 Mappingand99mTc-MAA:1. 对预防性栓塞的需求很低(除非灌注部位的远端分支连通胃肠道)(例如,肝左动脉注射伴副胃左动脉远端出现,肝左动脉注射伴食管分支远端出现);2. 进行锝-99m大颗粒聚合白蛋白(99mTc-MAA)肝叶灌注和Y-90节段灌注,以限制灌注肿瘤的小节段分支的导管插入次数;3.由于肿瘤负荷小(低分流)和规定活动量受限(灌注体积小),肝分流分数的升高限制了预期剂量很少是一个问题。对于小肿瘤(即小于5cm的肿瘤)和无MVI/PVT的情况,发生高肝分流的风险较低。在这种情况下,有可能在治疗计划过程中取消99mTc-MAA标测步骤。然而,需要更多的研究来评估这一概念。在这种情况下,仍然需要剂量学来确定剂量。剂量计算和剂量学考虑:1.单室模型剂量学更常见。2.血管小体的灌注治疗体积的靶区吸收剂量至少为400Gy,无上限。中位剂量为400Gy时,100%患者的肿瘤组织达到完全病理性坏死。在灌注量为500gy时也有类似的结果。前瞻性验证表明,使用这种方法的不良事件很少。3.最近的研究表明,≥400Gy的局部较高剂量可获得更好的病理和临床结果。可能存在剂量上限,但根据现有文献,目前尚不清楚。在处理体积较小的情况下,剂量通常由可用的最低瓶确定(即校准时为3GBq)。4.建议在第1周(周三/周四/周五)或第2周早期(周一/周二)给药,以复现已发表的文献结论。对于玻璃微球,有初步数据表明,第1周后期和第2周早期的微球特异性活性(估计≥297Bq)可能与接受放射性肝段切除术的小肿瘤病理性坏死增加有关。 治疗给药:1. 在治疗前确保没有造影剂回流到邻近的血管体2. 整个肿瘤(和微卫星病灶)应该位于灌注的血管体内3. 缓慢注射Thersphere®微球a).由于范围较小,放射性肝段切除术的误差范围较低b).缓慢注射,尽量减少气泡形成4. 考虑在节段分支中使用2.1/2.4F(或更小)微导管。如果使用少于2F,会有不完全给药的风险,请谨慎使用5. 可考虑当日计划99mTc-MAA和治疗方法(即,高吸收剂量需要低活动量给药,肺吸收剂量高的几率极低)。 结果评估/随访:1. 理想情况下,使用与初始评估疾病负担相同的成像方式(增强CT或多相增强MR)2. 如果3-6个月时mRECIST评分没有CR,考虑再治疗。 放射肝叶切除术Radiationlobectomy:单侧病变,最终目的是控制疾病,在治疗肝叶萎缩的情况下正常肝叶肥大,为未来手术切除提供足够的剩余肝体积。 表4 方案2:建议使用Y-90玻璃微球进行放射性肝叶切除术 治疗目的:在肝移植可用器官有限的情况下(例如:UNOST2-T3,unilobarT4a),增加可接受根治性手术切除的患者数量。 患者选择:1. 放射性肺叶切除术适用于以下情况下不可切除的Child-PughA患者:a)FLR不充分 和/或b)在手术和/或之前,需要对肿瘤生物学和反应进行时间测试c)使肿瘤不再侵犯肝静脉和/或下腔静脉d)可能延迟手术或其他治疗代替手术2. 考虑可切除的患者,因此不应有导致患者无法接受手术的合并症 Mappingand99mTc-MAA:a)进行肝叶99mTc-MAA和肝叶Y-90输注。b)在大灌注量的情况下,如果肝分流分数高,则肝剂量升高可能是一个问题 剂量计算和剂量学考虑:1. 最近的一项随机研究利用99mTc-MAA的多室模型表明,当第1周(周三)治疗的最小计划肿瘤吸收剂量≥205Gy(平均331Gy)和正常组织吸收剂量(NTAD)≤120Gy时,肝脏储备≥30%的患者的肿瘤反应得到优化,总生存期延长。Child-PughA级患者第1周(周三)正常肝注射的最小阈吸收剂量为88Gy,以确保至少有10%的肝细胞肥大。一项正常组织并发症概率的回顾性研究确定了ChildA级患者在胆红素水平≥1.1mg/dL或未灌注的全肝(包括灌注和未灌注正常肝)分别接受50Gy或90Gy照射时的最大耐受剂量,采用4天衰减法,以最大限度地减少肝功能障碍。2. 如果采用单室模型,考虑到隐含的Child-PughA状态,对于接受放疗的肝叶切除术患者,建议肝叶吸收剂量限值为140-150Gy。最近的一项随机研究表明,对于经过严格选择的患者(Child-PughA级和肝储备功能30%),第1周(周三)治疗时,以肝叶吸收剂量150Gy(平均178Gy)和全肝剂量150Gy为目标是安全的,可以使用。如果在1~3个月时发现轻微的肥大,应考虑再次治疗。3. 现有文献支持在第1周(周三)至第2周(周二)进行治疗。目前还没有确定最佳的时机。4.在仔细考虑剂量学和肝功能的情况下,相同体积的重复治疗是安全的。 治疗给药:1. 放射性肺叶切除术最常见于右叶肝细胞癌。治疗右叶肿瘤,诱导左叶肥大,等待手术。2. 治疗应以肺叶方式进行(即对整个肺叶进行治疗)。如果在其他方面,肝段治疗在技术上可能可行,但目标是使对侧肺叶肥大过渡到切除,则可以考虑“改良”放射性肺叶切除术,即单次肺段肿瘤灌注(肝段的单室剂量≥400Gy;放射学肝段切除术,见上一节)后,进行肝叶灌注100Gy,以使肝叶肥大。a)在技术上可行的情况下,改良放疗肝叶切除术优于单肝叶灌注b)在a)情况下,如果患者不接受手术,则通过实施根治性高吸收剂量肝段切除术来最大限度地控制肿瘤。 结果评估及随访:1. 建议在治疗后1个月、3个月、6个月和9个月进行影像学检查并动态评估FLR。计算FLR时应将右叶体积减去肿瘤体积。2. 留出至少3-6个月的时间进行肝体积代偿;只要肿瘤控制良好,较长的等待时间是可以接受的。3. Y-90放射栓塞后门静脉栓塞目前处于研究阶段。门静脉栓塞后的放射栓塞也是在研究[22]4. TARE术前、术后通过普美显增强MRI进一步确定是否达到了足够的FLR,是否需要额外的治疗,或患者是否最终适合后续的手术切除,有待研究。5. TARE后是否行外科切除应有外科医师参与并共同决定。在某些情况下,由于肿瘤完全缓解,外科切除可能被认为是不必要的,放射肺叶切除术成为决定性治疗。 Palliativeintent姑息的目的:无大血管侵犯或门静脉血栓形成(MVI/PVT)的多灶性单叶病变,以姑息和延缓进展为目标。应用在特定的患者中,可能是为了转换治疗方案。 无MVI/PVT的多灶性双叶疾病,以姑息和延缓进展为目标,通常联合或序贯全身治疗。 合并MVI/PVT的HCC,以姑息和延缓进展为目标。在特定的患者中,目的可能是为了转换治疗方案。 本文档中使用的关键定义在原始文献中有定义,在此列出,以方便参考:Meanabsorbdoses平均吸收剂量:数量用灰色表示(Gy),以描述在特定的质量(kg)内的感兴趣体积(VOI)内沉积的平均能量(J)。平均吸收剂量称为“剂量”,与“活度”或“剂量”(GBq)明显不同。 MIRDschemaMIRD模式:医疗内部辐射剂量(MIRD)模式适用于单室和多室剂量计量模型。任何VOI质量的特定VOI(即灌流体积、肺叶、肿瘤或正常组织)中的平均吸收剂量(D)记为M,假设D在永久植入微球且无生物清除的每个体积中均匀分布。用这个模式,VOI中的D为: 其中,A为植入VOI的90Y的净活度,F为肺分流分数。例如,如果2.2GBq的玻璃微球被注入1%的残余和5%的肝分流,在肝组织中的净植入活性将是2.2×(0.99)×(0.95)=2.07GBq。2.07GBq将代表MIRD公式中确定最终组织剂量的最终活性。 Single-compartmentmodel:MIRD剂量学模型假设90Y微球(因此吸收剂量)在VOI内均匀分布。在该模型中,只计算了VOI上均匀的平均D值,没有考虑肿瘤和正常实质内Y-90活性分布。实际上,富血供的肿瘤会吸收更多的微球,接受更高的剂量,而正常的肝组织会吸收更少的微球,接受更低的剂量。 Multiple-compartmentmodel:一种基于MIRD的剂量测定方法,在多个VOI中测定D,如肿瘤VOI和正常肝实质VOI。肺也代表了可以估计D的另一个腔室(基于单腔室模型)。分区建模指的是多室剂量测定方法,分别报告肿瘤D(Gy)=A(GBq)×(50(Gy∕kg∕GBq)(1−F))M(kg)和非肿瘤剂量,采用单一平均肿瘤摄取比(T:N比)。 Clinicalscenarios:方案1:HCC的放射性肝段切除术 之前被定义为≤2个Couinaud肝段,相当于亚选择性或超选择性放射栓塞。在大多数情况下,可实现显著≤1的超选择性亚段输注。对于放射性肝段切除术,应考虑所治疗的肝脏总体积的百分比。在既往接受过手术切除的情况下,只要残余的肝组织足够,就可以考虑进行放射性肝段切除(特别是在观察到术后明显肥大的情况下)。在肝功能稳定但下降的情况下,应谨慎进行放射性肝段切除术,并考虑其他选择。 方案2:HCC的放射性肝叶切除术 根据患者生物学和绘图结果,可以使用单室或多室剂量学方法。肝胆闪烁显像(HBS,包括99mtc-亚氨基二乙酸[HIDA]或99mTc-mebrofenin])和磁共振成像中使用Eovist/Primovist造影剂是新兴的试验性技术,正应用于Y-90治疗前后FLR的局部功能评估。我们需要更多的数据来支持将其作为放射性肝叶切除术和切除计划的标准程序。 方案3:多灶单叶HCC,无大血管侵犯(MVI/PVT) 对于无MVI/PVT的多灶性单叶病变患者,放射栓塞可用于姑息和预防疾病进展。在这一人群中,目标应是在保留肝功能的同时最大限度地提高肿瘤剂量。委员会建议对Child-PughA级患者进行放射栓塞治疗,并进行多学科肿瘤委员会审查,特别是对肝功能障碍更严重的Child-PughB级患者。在特定的病例中,如果这组患者出现放射性肝叶切除术的反应和代偿性肥大,可以考虑切除。 方案4:无MVI/PVT的多灶性双叶HCC 在无MVI/PVT的多灶性双叶HCC中,治疗的主要目标通常是姑息、延缓疾病进展,以及与其他肝脏导向疗法和/或全身性治疗的序贯(表6)。与其他临床情况一样,目标应该是最大限度地增加肿瘤的辐射剂量,同时最大限度地减少剩余正常肝实质的剂量。 伴有门静脉血栓形成(MVI/PVT)的HCC患者预后较差。这些患者通常不被认为适合移植或切除,化疗栓塞可能无法获得最佳结局。经过细致的患者选择和剂量学计划,放射栓塞可能在不损害肝功能的情况下在该人群中获得长期持久缓解。委员会建议在定义应选择哪些MVI/PVT患者接受Y-90玻璃微球TARE治疗方面做出改变,从之前较宽泛的建议缩小至Child-PughA5或A6级患者(可考虑放射性肺段切除术的节段MVI/PVT除外)。 这些患者首选多室剂量测定,以确保达到最大的肿瘤吸收剂量(TAD),同时最小化正常组织吸收剂量(NTAD),并允许在预处理计划期间评估MVI/PVT靶向评估。与前面讨论的方法一样,在微球沉积可能有限的情况下,要在MVI/PVT中达到预期的TAD,足够高的比活度(给药时每个微球的放射性量)非常重要。鉴于本研究和其他近期研究的数据,委员会选择将推荐程度从B提高到A,委员会的共识程度适中。 Discussion: 2019年以来发表的30多篇论文和摘要的结果提示更新了基于Y-90玻璃微球的HCC患者TARE的治疗建议;包括DOSISPHERE-01、LEGACY和TARGET研究。虽然之前的研究强调了影像学完全缓解患者的总生存期改善,但近期DOSISPHERE-01和TARGET研究的数据进一步确定了TAD、肿瘤缓解和总生存期之间的关联。 对于病灶局限的患者,Y-90TARE仍是最有效和耐受性良好的治疗选择。基于近期发表的推荐意见的重要更新包括对放射性肝段切除术和肝叶切除术的更具体剂量学建议,将多灶性单叶和双叶疾病分为不同的建议集,并提供了Y-90玻璃微球TARE用于门静脉血栓患者的背景。 其他多室剂量学更新包括提出了新的肿瘤和NTAD阈值,并纳入了潜在肝功能的影响。99mTc-MAA显像评估Y-90玻璃微球的分布,确定治疗方案的分布,以及采用多室剂量学方法选择合适的Y-90活度时选择肿瘤还是NTAD作为主要驱动因素。 提高外科切除的转化率 最近的研究和发表的建议已经证明了个体化剂量学在将不可切除的患者转化为可切除患者中的效用。最近的一些报道表明,这种方法不仅提高了肿瘤的总体缓解率,而且当TAD超过300Gy时,缓解率大约增加一倍。在其中一项研究中,在有或无MVI/PVT的多灶性单叶HCC中,使用多室剂量学对不可切除HCC的转换效果优于标准的肝叶单室剂量学(分别为36%和4%)。采用单室放射性治疗或改良肝叶切除术可获得局部肿瘤控制和对侧肝叶肥大,作为手术前的桥接策略。综上所述,这些数据表明,随着TAD的增加,治疗效果会持续改善。 在选择NTAD靶点之前,部分研究提供了关于NTAD最大限度的指导,并支持对肝功能(即基线胆红素)进行评估。 单叶和双叶HCC的不同治疗方法 基于新的全身性治疗方案的批准,委员会决定将无MVI/PVT的单叶和双叶疾病分为两种不同的临床场景。全身性治疗是目前晚期疾病的标准治疗。然而,在治疗计划的早期考虑TARE是很重要的,因为它在提供细胞毒性作用方面发挥着重要作用,能同时确保肿瘤控制、保留肝功能和保留未来的治疗选择。对于这些患者,首选多室剂量学方法,相对于疾病范围和肝功能充分评估TAD和NTAD。部分中心发表了Y-90玻璃微球TARE治疗双叶肝细胞癌的经验,表明多室剂量学方法在双叶肝细胞癌治疗中是合适且有益的。 基于基线胆红素水平,单叶肝移植的NTAD值为50~90Gy,高于双叶肝移植40~70Gy。然而,需要更多的临床数据来更好地定义双叶患者的合适范围。对于双叶HCC患者,在多室剂量学方法不可行而采用单室剂量学的情况下,建议选择较低的靶区(即灌注体积120Gy);在制定此类治疗计划时,应在评估可能的治疗方案时仔细评估临床状况和肝功能。在姑息治疗的情况下,建议对TAD和NTAD采取更保守的治疗方法,而在治疗意图包括降期或转为手术切除的患者中。 MVI/PVT的治疗目标 对于有MVI/PVT的HCC患者,应根据治疗目标(即有可能降期或转化为切除术)和细致的患者选择来决定TARE是应作为单药治疗还是与全身性治疗联合使用。在DOSISPHERE-01和TARGET中,Y-90玻璃微球TARE作为单药治疗在MVI/PVT患者中进行了评估。DOSISPHERE-01中患者的选择基于肿瘤和MVI/PVT的双重靶向,这对肿瘤控制和MVI/PVT的消除至关重要。在DOSISPHERE-01研究中,接受多室剂量学治疗的MVI/PVT患者中,超过40%的患者转为手术切除,而在单室剂量学组中,没有患者转为手术切除。 在肝硬化肝功能持续下降的情况下,可在早期考虑全身用药,并在多学科评估后联合Y-90;然而,需要进一步的研究来更好地确定具体的时机和治疗算法。多室剂量学是该患者人群的首选治疗方案。 未来的方向:在肝硬化肝功能持续下降的情况下,可在早期考虑全身用药,并在多学科评估后联合Y-90;然而,需要进一步的研究来更好地确定具体的时机和治疗算法[48,49]。多室剂量学是该患者人群的首选治疗方案。 1.治疗计划中的功能评估在对FLR不足的Y-90玻璃微球TARE患者制定治疗计划的同时,除容量评估外,还提出了功能评估。传统上,手术切除的时机只关注对侧肝叶的肥大;然而,越来越多的证据表明,肝胆动态显像可以评估局部肝功能是否足够,从而确定是否适合治疗。虽然功能恢复和容量恢复的时间进程是平行的,但功能恢复滞后于容量恢复。功能评估可能更好地指导与治疗成功相关的关键临床决策,如随访时间、是否需要额外的Y-90治疗以及手术时机或额外观察。需要更多的研究来证实功能评估在制定此类治疗决策中的效用。 2.剂量学的可变性和可重复性 99mTc-MAA成像用于估计Y-90玻璃微球分布已提高了临床效用。NTAD表现出更好的重现性,这为其作为安全阈值提供了信心。虽然TAD的可重复性可能不太理想,但DOSISPHERE-01、TARGET和其他近期的单中心研究表明,TAD可预测患者结局(如肿瘤缓解和总生存期)。迄今为止的研究对所有患者进行了评估以确定可重复性。然而,筛选多室肿瘤剂量学预测可能不可靠的患者是恰当的。在这种情况下,建议默认为MIRD。最近的研究指出,在多灶性疾病中,变异可能是由已发表数据的有限样本量、操作者经验和肿瘤方向(因此T:N)的变异所驱动,提示需要进一步优化患者选择,以提高多房室剂量学的准确性和可重复性。 Conclusion: 虽然Y-90玻璃微球TARE是HCC治疗的关键工具,但合适的患者选择、多学科会诊以及在治疗方案中考虑替代或联合治疗是实现患者最佳结局的关键。更新版Y-90玻璃微球TARE肝癌治疗推荐中纳入了多项新进展,旨在改善患者选择、毒性反应和预后。
 杜佳航 医师 中山大学附属第七医院(深圳) 放射科621人已读
杜佳航 医师 中山大学附属第七医院(深圳) 放射科621人已读 - 精选 超期(195天)下腔静脉Tulip滤器成功取出
女患,30岁。2016年 2月9日 患者怀孕6个月,突发左下肢深静脉血栓。2月11日在重庆某知名三甲医院行下腔静脉滤器(COOK公司生产的Tulip滤器)置入+置管溶栓,2月19日出院,因要保胎,滤器滞留。3月1日至5月22日因有孕在身,低分子肝素抗凝,未进行滤器取出术,5月25日生产后改为口服拜瑞妥。5月末重庆知名三甲医院介入科表示滤器植入时间过长、风险太大,经科室研究,决定不予滤器取出术;患者为取出体内的滤器而咨询过国内多家知名大医院,均不愿为其施行滤器取出术。2016年8月20日患者于好大夫网站读到中国医科大学附属四院介入科肖亮教授关于滤器取出的相关文章,随即联系沟通,8月23日赶到沈阳,入中国医大四院,进行下腔静脉CTV、肺动脉CTA及颈静脉超声等术前检查评估,8月24日在肖亮主任带领主治医师方继承及研究生邢卓越,采用微创介入技术成功取出超期下腔静脉Tulip滤器(留置体内195天)。整个介入手术持续了2个小时,术后下腔静脉造影显示下腔静脉通畅,造影剂无外溢。这次取出的超期滤器正常可取出的期限是90天,取出前已超期105天,据不完全统计,这是国内同型号下腔静脉滤器成功取出的超期最长的一个病例。
肖亮 主任医师 深圳市第三人民医院 放射介入科2130人已读 - 精选 疑难性下腔静脉滤器取出的技巧及策略
童家杰1,申景1,魏东升2通讯作者:肖亮,男,1972年生,教授,主任医师,博士生导师研究方向:肿瘤与血管病介入治疗及影像诊断E-mail:xiaoliangcmu@163.com下腔静脉滤器置入对于致命性肺动脉栓塞的预防作用已经得到医学界广泛的认同和接受[1-2]。由于永久留置的下腔静脉滤器可能引起下腔静脉闭塞、血栓形成及复发性深静脉血栓形成等并发症[3–4],可回收式腔静脉滤器可在一定的时限内被取出,从而避免了长期留置造成的不良反应。由于可回收腔静脉滤器置入时可能出现倾斜、回收钩贴壁,在体内留置期间因血管壁组织增生可能造成滤器与血管壁融合,从而降低滤器回收的成功率。近年来,采用常规圈套技术无法成功取出的可回收腔静脉滤器的情况逐渐增多,关于其回收问题引起广大医务工作者的关注。目前国内有关疑难性下腔静脉滤器回收技巧的报道较少[5–7]。本文通过我院遇到的疑难性下腔静脉滤器取出术的病例进行总结,回顾疑难性下腔静脉滤器的回收技巧及策略,现报告如下:1材料和方法:一般资料 2005年11月至2010年10月期间我院收治的采用常规圈套技术无法成功取出的下腔静脉滤器置入术后患者11例,采用导管辅助法,异物钳法及股静脉剖开等方法行下腔静脉滤器取出术,其中男8例,女3例;平均年龄42.8岁,22岁-71岁(具体病历资料详见表1)。使用介入器材包括1500px长的12F鞘(COOK, 美国),直径15mm的鹅颈捕捉器(Amplatz Goose Neck,ev3 Inc, 美国),异物钳,5FCobra导管或猪尾导管(COOK, 美国),0.035″超滑导丝(Terumo, 日本)。滤器取出过程 先经颈内静脉或股静脉入路行正侧位下腔静脉造影,证实滤器所处位置及倾斜贴壁情况,再于透视监视下,送12F长鞘至滤器近端,将含有超滑导丝的5F导管、鹅颈捕捉器、异物钳经长鞘送入体内,根据需要进行如下操作:(1)导管扭转法 将导管前送,使其进入圈套器内,尔后逐渐缩小圈套器直径,套牢导管。利用导管头端的曲度,使其贴近滤器回收钩贴壁处,旋转导管,与滤器主肢缠绕在一起。同时横向摆动导管,力争使回收钩与血管壁分离,如成功分离,回撤导管,前送圈套器套取滤器回收钩;如不能成功分离,沿导管前送圈套器,至回收钩水平,略微张开圈套器,反复上下运动,套取回收钩,一旦套住,马上前送圈套器套管,套牢回收钩,前送长鞘,将滤器取出(图1)。(2)导管成袢法 先将猪尾导管及导丝送至滤器近端,努力使导丝头端进入粘连处滤器与血管壁之间的缝隙,再沿导丝将导管跟进到该缝隙中,回撤导丝,使导管恢复曲度,形成一个半开放圈套,然后旋转并回撤导管,将组织粘连处机械性分开。一旦滤器回收钩与下腔静脉壁分离,采用圈套器套住滤器回收钩,固定圈套器,前送回收鞘,将滤器回收(图2)。(3)导管-捕捉器成袢法 在上述操作中,导管进入粘连处滤器与血管壁之间的缝隙后,调整导丝,使其返折,并将导管一同返折;然后前送圈套器,捕获导管头并套牢,形成闭合的袢状结构,同时回撤导管与圈套器,使袢在缝隙中移动,至粘连处,继续用力回拉,将粘连组织分开。如果袢状结构解体后通过粘连处,则需要重复上述操作,直至粘连组织被分开。最后,采用圈套器将滤器收入鞘中,取出体外(图3)。(4)异物钳法 当滤器与血管壁组织粘连严重、鹅颈捕捉器无法将滤器完全收入长鞘时,可以使用异物钳增大拉力。由于异物钳控制方向的能力较弱,置入前需先用鹅颈捕捉器将滤器部分收入长鞘中,再置换异物钳(图4)。(5)静脉剖开法 当滤器与血管壁完全分离但无法完全进入长鞘时,需要采用静脉剖开的办法协助滤器取出(图5)。滤器取出后复查下腔静脉造影,观察下腔静脉有无穿孔及对比剂外溢。术中及术后24小时持续监测血压、脉搏。术后给予抗凝、抗炎治疗3-5天。随访4-12月复查血管超声。2 结果10例患者成功地回收下腔静脉滤器,总的技术成功率90.9%(10/11)。采用导管扭转法成功取出2例;采用导管成袢法成功取出1例;采用导管-捕捉器成袢法成功取出4例;采用异物钳法成功取出1例;采用导管-捕捉器成袢法结合异物钳法成功取出1例;1例采用捕捉器及长鞘捕获未张开的滤器,由于该滤器带有双向倒钩,无法全部进入鞘中,最后于股总静脉处剖开血管,取出滤器。1例患者在滤器回收过程中,由于滤器与血管壁粘连紧密,套牢回收钩后,前送长鞘并用力回拉捕捉器时,回收钩断裂,最后家属放弃,取出失败。取出过程中,在剥离粘连组织时,患者感到腹部或后腰部短暂钝痛,随后自行缓解。复查下腔静脉造影示下腔静脉无穿孔及对比剂外溢征象。术中及术后24小时血压及脉搏无明显波动。回收过程平均透视时间57.2分(17-115分)。滤器平均体内留置时间为37.8天( 0-80天)。术后5天内全部患者安然出院。随访期间,复查血管超声未出现下肢静脉血栓形成。3 讨论下腔静脉滤器置入的并发症随置入时间延长而增多;下肢深静脉血栓脱落造成肺动脉栓塞的风险却随之降低。将滤器长期留置于体内,滤器本身作为人体内异物可诱发下腔静脉血栓形成,进而再次发生肺动脉栓塞。为了避免并发症的发生,最简单的方法就是取出滤器。滤器取出困难的最主要原因是组织融合、滤器倾斜、回收钩与下腔静脉壁粘连导致不能被捕获。Marquess等[8]报道Tulips滤器置入体内475天后仍能取出的病例,但回收成功率在置入时间超过12周的病例中明显降低。在滤器回收之前,下腔静脉正位造影可以显示滤器在左右方向上有无倾斜,侧位造影可以显示滤器前后方向上有无倾斜。发现滤器倾斜,单纯捕捉器法有时也可以成功捕获滤器。这是因为只有严重的滤器倾斜才会导致回收钩贴壁,接触时间较长才能造成粘连。对于置入时间很短的病例(14天之内)可以利用下腔静脉管径随呼吸节律发生周期性变化的规律,采用增高胸腔内压力(深吸气后屏息同时做呼气的动作),使下腔静脉回流减慢,下腔静脉管径略增粗,此时使用捕捉器套取回收钩即可。此方法适用于回收钩触及下腔静脉壁,但尚未与之粘连的病例。对于体内留置时间短,滤器回收钩与下腔静脉壁粘连轻的病例,使用导管扭转法的成功率较高。采用导管扭转法的时候要确保导管穿越Tulip下腔静脉滤器的主肢外侧;在旋转导管时不应过于用力,避免将导管和滤器紧密缠绕在一起,无法撤出导管。如果适度的旋转并回撤导管后发现Tulip下腔静脉滤器未移动,则应放弃该方法。导管成袢法的操作中,应避免导管进入滤器锥状部,因为这种情况下,导管回撤时产生的拉力受力点位于滤器回收钩的下方,受力方向为纵向,而不会直接作用于组织粘连处,无法产生可以促进回收钩脱离血管壁的径向拉力。导管-捕捉器成袢法的关键在于确保形成的袢位于滤器与血管壁之间的缝隙中。具体方法为捕获导管之前,回拉导管,证实其位于上述缝隙中;捕获困难时,可以引入导丝,依靠导丝寻找并进入圈套器,再沿导丝捕获导管。如上述方法仍不奏效,还可将超硬导丝送入滤器与血管壁之间的缝隙,引入直径10mm的球囊导管,扩张粘连处,使其分离。Van等[9]采用上述方法对一组平均年龄为40岁,平均留置时间58天的38枚难取出的Tulip滤器进行介入手术,成功达97%(37/38)。本组中7例属于滤器倾斜大于15度,回收钩与下腔静脉壁融合的情况,采用上述方法均成功取出。这说明只要方法使用得当,大多数的可回收式滤器是可以成功取出的。当下腔静脉滤器内充盈血栓时[9],可在滤器上方再置入一枚滤器,取出原有下腔静脉滤器,以防止直接取出原有下腔静脉滤器时,滤器内血栓脱落造成肺动脉栓塞,取出原有下腔静脉滤器后,再取出新置入的滤器。综上所述,采用多种辅助性圈套技术回收疑难性下腔静脉滤器的成功率较高,可有效提高下腔静脉滤器回收率,有一定临床应用价值。参考文献:1. Roehm JOF Jr, Johnsrude IS, Barth MH, et al. The bird’s nest inferior vena cava filter: Progress report. Radiology 1988; 168(3): 745– 749.2. Taylor FC, Awh MH, Kahn CE Jr, et al. Vena Tech vena cava filter: Experience and early follow-up. J Vasc Interv Radiol 1991; 2(4): 435– 440.3. Berczi V, Bottomley JR, Thomas SM, et al. Long-term retrievability of IVC filters: should we abandon permanent devices? Cardiovasc Intervent Radiol. 2007;30(5):820-8274. PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005;112(3):416-4225.肖亮,申景,童家杰等. 经颈静脉回收Günther Tulip腔静脉滤器的初步经验. 介入放射学杂志, 2011;20(5):366-3716.肖亮,童家杰,解世洋等. 导管辅助法回收贴壁Tulip滤器的初步经验. 介入放射学杂志, 2011;20(5):372-3767.肖亮,申景, 解世洋等. 医源性血管内异物介入取出6例的初步经验.山西医药杂志, 2011;40(5):432-4348. Marquess JS, Burke CT, Beecham AH, et al. Factors Associated with Failed Retrieval of the Günther Tulip Inferior Vena Cava Filter. J Vasc Interv Radiol 2008; 19(9):1321–1327.9. Van Ha TG, Vinokur O, Lorenz J, et al. Techniques Used for Difficult Retrievals of the Günther Tulip Inferior Vena Cava Filter: Experience in 32 Patients. J Vasc Interv Radiol 2009; 20(1):92–99.表1 病例信息及临床资料列表序号性别/年龄滤器类型留置时间原因处理方法结果取出途径透视时间1男/69岁Vena Tech0天未张开静脉剖开取出成功股静脉90分2男/24岁Optease14天大量血栓导管扭转取出成功股静脉26分3男/48岁Tulip80天倾斜贴壁捕捉器成袢取出成功颈内静脉78分4女/31岁Tulip70天组织融合异物钳取出成功颈内静脉115分5女/43岁Tulip14天倾斜贴壁导管扭转取出成功颈内静脉17分6女/41岁Tulip45天倾斜贴壁捕捉器成袢取出成功颈内静脉40分7男/22岁Tulip46天组织融合 回收钩断裂家属放弃取出失败5分8男/35岁Tulip35天倾斜贴壁导管成袢取出成功颈内静脉28分9男/24岁Tulip42天倾斜贴壁捕捉器成袢取出成功颈内静脉47分10男/63岁Optease14天倾斜贴壁捕捉器成袢取出成功股静脉38分11男/71岁Tulip64天倾斜贴壁 组织融合 滤器翻转捕捉器成袢异物钳取出成功股静脉93分
肖亮 主任医师 深圳市第三人民医院 放射介入科1.3万人已读 - 精选 肿瘤患者合并静脉血栓形成的治疗方法
恶性肿瘤在向周围组织浸润生长的过程中常常侵袭邻近的血管结构。但临床上出现的症状多数为静脉系统受累,表现为静脉回流受阻和/或静脉血栓形成。虽然这些恶性肿瘤血管并发症多数情况下不会直接加快恶性肿瘤的发展进程,但它们的存在却严重地影响恶性肿瘤治疗方案的制定并加重病人的身体负担。因而针对肿瘤血管并发症的治疗一直是临床医生不可回避的医疗问题。上腔静脉阻塞综合征(SVCO)是各种原因造成上腔静脉的管腔狭窄或完全闭塞,导致上腔静脉血液回流障碍,产生头颈部及上肢水肿的综合征侯群。常作为胸腔内肿瘤的并发症之一,如肺癌、淋巴瘤、间皮瘤,也可为胸外肿瘤浸润、压迫所致。上腔静脉阻塞的肿瘤患者同时合并上肢静脉血栓形成,症状会更加严重,大多数恶性上腔静脉阻塞综合征的患者无法进行开胸手术、切除肿瘤;单纯手术清除血栓也无法解决静脉回流受阻的问题。盆腔肿瘤或淋巴结转移癌的患者常因为下腔静脉及髂静脉受压或被侵袭,使其血管腔闭塞,同时还可能合并下肢深静脉血栓形成。此时病人多数已失去手术切除肿瘤及淋巴结的机会。对于这些患者,介入治疗可以很好地解决静脉回流受阻的问题及静脉血栓的清理。如行介入治疗,需先行腔静脉滤器置入,防止致死性肺栓塞,再行静脉支架置入和溶栓导管置入,并给予抗凝、溶栓治疗,达到改善患者症状,提高生存质量的目的。中国医科大学附属第四医院介入科,在学科带头人、科主任、博士生导师,肖亮教授的带领下,已开展此类的介入治疗,取得了良好的临床效果。如有需要这种介入治疗患者可以拨打咨询电话:024-62041081、18040099289。或通过微信与肖教授联系。
肖亮 主任医师 深圳市第三人民医院 放射介入科2827人已读 - 精选 结(直)肠癌的肠道支架治疗
随着国人的饮食结构日趋西方化,我国结(直)肠癌的发病率逐年升高。大多数结(直)肠癌患者在确诊的时候,结(直)肠病变处管腔已明显狭窄,出现肠梗阻的症状。由于肠梗阻的近端结(直)肠管腔扩张明显、肠壁呈炎性肿胀,病变远端的结(直)肠管腔较细、肠壁较薄,如果此时进行结(直)肠癌病变切除手术,病变两端结(直)肠的管腔差异巨大,不适合直接吻合,只能先进行近端肠管的造瘘术,等待一段时间后,再二次开腹手术,吻合肠管,封闭造瘘口。现在的介入技术可以为合并肠梗阻的结(直)肠癌患者提供一种更加合理的治疗方案,即先行经肛门结(直)肠支架置入术;术后积极进行洗肠、消炎治疗,解除梗阻,排除蓄积的肠内容物,使肠梗阻近端明显扩张的结(直)肠管腔回缩,肠壁炎性肿胀消退;然后进行结(直)肠癌病变切除,直接吻合两端肠管,一次性完成手术。这样的治疗方案可以为患者减少一次开腹手术的损伤,整个治疗周期明显缩短,病人可以更早地恢复正常生活;同时,介入性肠道支架置入术的医疗费用也较开腹手术的费用略低。另外,经肛门结(直)肠支架置入术还用于无法行外科手术切除的结(直)肠癌患者,可以免除开腹造瘘手术的损伤、改善患者的生存质量、延长患者的存活时间。中国医科大学附属第四医院介入科,在学科带头人、科主任、博士生导师,肖亮教授的带领下,已开展此类的介入治疗,取得了良好的临床效果。如有需要这种介入治疗的结(直)肠癌患者可以拨打咨询电话:024-62041081、18040099289。或通过微信与肖教授联系。
肖亮 主任医师 深圳市第三人民医院 放射介入科2346人已读 - 精选 下腔静脉滤器一定要取出来吗?
下腔静脉滤器置入对于致命性肺动脉栓塞的预防作用已经得到医学界广泛的认同和接受。下腔静脉滤器置入的并发症随置入时间延长而增多;下肢深静脉血栓脱落造成肺动脉栓塞的风险却随之降低。将滤器长期留置于体内,滤器本身作为人体内异物可诱发下腔静脉血栓形成,进而再次发生肺动脉栓塞。永久留置的下腔静脉滤器还可能引起下腔静脉闭塞、下腔静脉穿孔及复发性深静脉血栓形成等并发症。为了避免并发症的发生,最简单的方法就是取出滤器。那就是说,下腔静脉滤器一定要取出来吗?回答是并非所有的下腔静脉滤器都必须取出来。什么情况下,下腔静脉滤器不需/不能被取出?或者说什么情况下,下腔静脉滤器应该永久留置于体内?第一种情况是置入的滤器是永久性腔静脉滤器(技术性不可取出)。第二种情况是病人预计生存期很短(如恶性肿瘤晚期广泛转移等)。第三种情况是滤器内捕获大块血栓(直径大于10mm)同时无法采用溶栓药物消融;或是患者下肢深静脉内存在较多的新鲜血栓(有发生脱落的可能);或是患者存在血液系统疾病静脉血栓反复复发者。第四种情况是滤器在体内留置时间超过其产品说明书中提示的回收期限(此种情况为相对禁忌症,不是绝对不能取出,只是取出的技术难度很大、成功率较低、副损伤较大)。第五种情况是滤器倾斜、回收钩贴壁(无法成功捕获)、滤器与静脉粘连致密(虽捕获成功,但无法剥离、取出),这种情况属于疑难性下腔静脉滤器取出的范畴,对于经验丰富的介入科专家来讲,在特种介入器材的辅助下,成功取出的可能性还是较高的。是否取出下腔静脉滤器的决定需要综合多方面的检查结果及临床信息,而在置入下腔静脉滤器之前,选择下腔静脉滤器类型的时候,就应该为将来滤器取出作初步打算。总体上讲,大多数深静脉血栓及肺动脉栓塞的患者应该在体内血栓性病变基本被消除后,取出下腔静脉滤器。如果在可取出式腔静脉滤器取出过程中遇到困难,应尽早寻求上级医院的医疗帮助,尽可能地取出滤器。中国医科大学附属第四医院介入科,学科带头人、科主任、博士生导师肖亮教授曾进行过20例疑难性下腔静脉滤器取出术,成功取出18例,另外2例无法取出,取得了良好的临床效果。如有需要行疑难性下腔静脉滤器取出术的患者可以拨打咨询电话:024-62041081、18040099289。或通过微信与肖教授联系。本文系肖亮医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载。
肖亮 主任医师 深圳市第三人民医院 放射介入科1.8万人已读 - 引用 文献第40期——人工智能帮助优化临床血糖管理
今日阅读一篇AI模型与糖尿病有关的文章,来自《NatureMedicine》。题目是《Optimizedglycemiccontroloftype2diabeteswithreinforcementlearning:aproof-of-concepttrial》《强化学习优化2型糖尿病血糖控制:一项概念验证试验》 通讯作者陈颖,现于复旦大学中山医院内分泌科工作。 综述2型糖尿病(T2D)治疗的个人剂量和及胰岛素方案的优化是一个颇费资源的挑战。本文提出一种基于模型的强化学习(RL)框架(名为RL-DITR)。在对T2D住院患者进行评估后,与其他深度学习模型和标准临床方法相比,RL-DITR实现了更优的胰岛素用量方案【平均绝对误差(MAE)为1.1 ± 0.03 U】。研究者进行了从模拟到实际的循序渐进的临床验证,通过盲法回顾的定量(MAE为1.18 ± 0.09 U)和定性指标分析,显示AI系统对出住院患者在血糖控制方面的表现优于初级和中级医生。此外在16名T2D患者中进行了单臂、患者盲法、概念验证可行性试验。主要结果是在试验期间平均每日毛细血管血糖差值,从11.1(±3.6)降至8.6(±2.4) L−1(P < 0.01),满足预先指定的终点。未发生严重低血糖或高血糖伴酮症。 正文在本研究中,研究者构建了一个T2D住院患者的电子健康记录大型数据集(EHRs),连续记录至少7日的胰岛素使用方案和血糖反应。每位患者被表示为特征向量的时间序列,包括人口统计、血生化检测、药物和胰岛素使用信息。基于连续的住院患者EHR数据,开发了一种基于RL的动态胰岛素滴定方案(RL-DITR),该方案包括跟踪个体血糖状态变化的患者模型和用于长期护理的多步规划的策略模型。 此外,引入了SL(强化学习模型),通过使用临床医生的专业知识来确保安全,同时通过与动态环境的反复试验交互来优化结果,这可以模仿并潜在地增强医生在临床决策中的作用。 为了验证临床实用性进行了一系列评估:(1)使用定量指标和定性评估对人工智能与医生进行的内部验证;(2)使用定性临床评估和重测对人工智能和内科医生的外部验证;(3)基于重测的前瞻性部署研究;(4)一项最终的概念验证可行性临床试验。 临床评估表明,RL-DITR系统可以提供潜在的动态管理皮下注射胰岛素改善T2D住院患者血糖控制的益处。 结论数据集特征和系统概述共有12,981名T2D住院患者119,941天被纳入AI模型发展阶段分析。平均年龄59.2 ± 14.5 ,女性占42.6%。患者的基线特征见于扩展数据表1。 为了将患者信息表示为一个动态的演化过程,将患者数据处理为多维的时间标准化特征。使用ClinicalBERT预训练模型和自然语言处理(NLP)流水线从真实世界的数据中提取与临床相关的序列特征(方法)。将所有特征离散化到7个时间步长,以获得多维时间特征。 图1.T2D患者动态胰岛素剂量滴定AI系统从开发到部署的示意图a.AI系统模型的发展—基于RL-DITR系统的模型包含“患者模型”与“决策模型”。左边,构建了一个大型的多中心EHR数据集,包括T2D住院患者的长期连续临床观察和用药记录。中间,以标准化的时间序列数据作为输入,患者模型产生隐藏状态转移、状态预测和奖励估计。右边,通过将患者模型作为环境进行交互来优化策略模型。b.全面评估AI系统,逐步融入现实世界的临床工作流程。左边,进行了多中心的回顾性研究,包括在内部和外部队列中进行定量和定性评估。在HIS部署人工智能后,在某学院医院进行了一项前瞻性研究,并进行了重测。右边,进行了一项概念验证可行性试验,以评估人工智能系统的血糖控制和医生满意度。 研究者提出RL-DITR是一个基于模型的RL,由两个部分组成:一个是通过学习环境动态来表征糖尿病进展状态的患者模型,另一个是通过对学习模型进行规划来管理糖尿病的政策模型。具体来说,患者模型通过动态函数和预测函数来表征糖尿病状态。给定患者从入院到时间步长T的轨迹时间特征(如入院状态、住院观察和治疗计划)的输入,动力学函数生成患者的隐藏状态。然后迭代地更新隐藏状态,然后在K步之前循环展开。在每个时间步长T+k(k<k),预测函数接收前一步生成的隐藏状态作为输入,输出对临床状态的预测,包括血糖值和血糖控制的“目标范围内”(WTR)(图1a和扩展数据图1)。WTR表示每个时间点的血糖值在3.9-10.0mmolL−1的目标范围内。 扩展数据图1.AI系统的发展a、人工智能系统中患者模型和策略模型的顺序决策过程。给定一个轨迹,对于初始步骤,表示函数fR接收来自轨迹的过去观测值O1:t作为输入。该模型随后循环展开K步。在每一步κ∈[1,K],策略模型π接收到隐藏状态st+K−1,并在+K−1处产生动作。患者模型的动力学函数fT随后接收前一步的隐藏状态st+k−1和+k−1处的动作作为输入,产生下一步的隐藏状态st+k,患者模型的预测函数预测糖尿病状态yt+k−1。隐藏状态和操作会定期更新。 b、AI系统培训管道。左边是病人模型学习,用于病人跟踪。给定隐藏状态st和实际动作at,患者生成预测状态yt来估计当前状态yt,并产生下一个状态st+1。估计奖励rt与实际奖励rt的比较是由yt计算出来的。以状态转移一致性损失LT和状态预测监督损失Lp为目标,对患者模型进行联合优化。右边,结合监督学习和强化学习的动态方案的策略更新。策略模型π接收隐藏状态st,然后生成动作t。 随后,患者模型接收前一步的隐藏状态和动作at作为输入,产生下一步的隐藏状态st+1并返回奖励rt。策略模型π以联合强化学习LRL1、LRL2和监督学习LSL为目标进行联合优化。然后,构建政策模型,对长期护理进行多步骤规划。在每个步骤中,通过与患者模型作为环境进行交互来优化策略模型。策略模型通过融合基于SL和患者模型的RL以及联合学习进行训练。通过基于患者模型的RL,政策模型可以学习个性化的治疗轨迹,改善长期临床结果。同时学习临床医生在合理剂量范围内使用SL治疗T2D患者的治疗实践。 人工智能模型预测患者血糖状态的性能为了建立一个动态的、个性化的人工智能临床医生来管理T2D患者,构建了基于模型的RL框架。首先测试了患者的血糖变化轨迹是否可以通过两个验证集的患者模型预测,包括内部测试集和外部测试集。对于实际状态轨迹和基于模型的状态滚动的比较,在内部测试和外部测试集中,预测的葡萄糖值都准确地遵循过渡趋势(图2a、b)。案例研究结果还表明,人工智能模型能够在大时间步长(k=7)上生成患者葡萄糖状态的个性化信息。对于总体血糖预测,将个体水平的预测汇总到群体水平的结果中,然后将其用于进一步分析。AI模型在内部测试集中表现良好,Pearson相关系数(PCC)为0.70(95%置信区间(CI):0.70,0.71),平均绝对误差(MAE)为2.13(95%CI:2.12,2.15)mmolL−1(图2c)。在外部测试集上进行评估时,AI模型的PCC为0.71(95%CI:0.70,0.72),MAE为2.28(95%CI:2.25,2.30)mmolL−1(图2d)。如扩展数据表2所示,结果表明此模型比其他基线模型有了实质性的改进。 图2.a,b,内部测试集(a)和外部测试集(b)患者的实际患者轨迹和基于模型的状态滚动的比较。每个基于单个患者的预测值,都是在前一天最后一个时间步的K步内生成的(提前1天K=7)。蓝色曲线是测量的患者血糖值,橙色曲线是预测的血糖值。c,d,内部测试集(c)和外部测试集(d)中使用AI葡萄糖模型生成的预测血糖值与实际血糖值的相关性分析。e,f,显示每日WTR预测在内部测试集(e)(n=20,961治疗日)和外部测试集(f)(n=16,077治疗日)上性能的ROC曲线。每个预测值都是基于前一天的最后一个时间步。箱形图显示了中位数(中线)、四分位数范围(铰链)和1.5×四分位数范围(须)(n=1000个样本的bootstrapping)。我们的RL-DITR系统生成的每个值都代表了一个个人水平的预测。然后将这些数据汇总起来,得出人口水平的结果。相关分析显示,c和d的CI值为95%。AUROC,受者工作特征下面积;ROC,接收机工作特性。 研究了患者预后(WTR比率)与患者模型估计的累积奖励之间的相关性。AI模型表现出良好的性能,内部测试集的Spearman相关系数(SCC)为0.80,外部测试集的SCC为0.73(扩展数据图2e,f)。研究者观察到,低累积奖励的治疗行为与低WTR比率相关,而高累积奖励的治疗行为在高WTR比率下获得了更好的血糖结果。结果表明,患者模型评价与临床结果高度相关,可作为RL模型的交互环境。 e-f,目标范围内血糖比率(WTR)与临床医生治疗行动的估计累积奖励的相关性分析。e为内部测试集,f为外部测试集。阴影区域表示95%置信区间。人工智能系统的概念验证可行性临床试验与治疗期的前24小时相比,在治疗期的最后24小时观察到7点毛细血管血糖谱有相当大的改善(图6b)。 与治疗后24小时相比,AI治疗前24小时的平均每日血糖、餐前血糖和餐后血糖均下降,分别从11.1(±3.6)mmolL-1降至8.6(±2.4)mmolL-1、10.2(±2.8)mmolL-1降至7.8(±2.2)mmolL-1和12.3(±4.2)mmolL-1降至9.7(±2.4)mmolL-1。试验结束时,70.3%的餐前血糖达到5.6~7.8mmolL−1的目标范围,68.8%的餐后血糖达到<10.0mmolL−1的目标范围。人工智能干预期间七点血糖的患者示例如扩展图7a所示。 讨论由于人体代谢的复杂性,糖尿病患者的血糖管理仍然具有挑战性,这就要求开发更适应和动态的血糖调节算法。传统的胰岛素滴定在很大程度上依赖于医生的经验,遵循临床指南。为了应对个性化胰岛素滴定算法在血糖控制方面的挑战,我们基于RL的架构专为个别患者量身定做,在临床监督下实现精确治疗。首先,我们构建了一个患者模型,作为中间步骤,为策略模型提供环境动态(葡萄糖动态)的知识。我们提出的基于患者模型的RL模型可以进行多步骤规划,以提高处方一致性。此外,由于多步骤计划可以被解释为从现在到未来一段时间内模型的意图,它为解释提供了更多的信息和直观的信号。此外,我们基于RL的系统为正在接受皮下胰岛素注射的T2D患者提供连续和实时的胰岛素剂量建议,将临床决策的最佳策略与经验丰富的医生的模仿相结合。 此研究的另一个优势是,在各种临床场景中对基于人工智能的临床决策系统进行了全面的早期临床验证。这些验证被视为护理和质量保证审查的标准,评估人工智能系统的临床性能,并为其从开发到采用到临床实践的有效整合提供基础。在临床部署中,此人工智能框架提供了潜在的好处,包括自动读取来自EHR的大量输入,集成复杂的数据和可访问的胰岛素剂量界面。用户友好的界面,旨在与医生的工作流程保持一致,在常规临床实践中获得了更多的采用意愿。
 杜佳航 医师 中山大学附属第七医院(深圳) 放射科98人已读
杜佳航 医师 中山大学附属第七医院(深圳) 放射科98人已读 - 引用 文献第39期——SIR关于髂骨静脉支架置入的指导意见
《介入放射学会关于慢性髂股静脉闭塞支架置入治疗的指导意见》参与撰写者包括:SureshVedantham,华盛顿大学医学院 IdoWeinberg,马萨诸塞大学总医院 结果:髂静脉支架置入关于使用血管内支架置入治疗慢性髂股静脉阻塞的最佳现有证据,按研究设计分组,总结如下。很少有精心设计的、高质量的研究客观地评估支架置入术对慢性静脉疾病的影响。许多研究提供了有限的信息,重要的联合干预措施,如联合药物治疗和浅静脉回流的管理。由于几乎所有已发表的研究的方法学质量都很低,因此本文的建议反映了证据和专家共识的结合,即如何优化患者的预后,尽管与髂静脉支架置入的安全性和有效性有关的许多问题仍存在不确定性。 随机对照试验在一项单中心、双盲、随机对照试验中,51例患有中度或重度慢性静脉疾病(临床病因学-解剖-病理生理[CEAP]临床分类,静脉临床严重程度评分[VCSS]≥10或视觉模拟评分[VAS]疼痛评分>2)和髂静脉阻塞(闭塞或>50%区域狭窄)的肢体随机接受或不接受髂静脉壁支架置入(BostonScientific,Marlborough,马萨诸塞州),由静脉造影和血管内超声(US)引导。该研究包括疾病扩展到下腔静脉(IVC)的患者,但排除了普通股静脉闭塞的患者。在支架组的所有患者中,初始髂静脉再通的残余梗阻<20%。一期和二期支架通畅率分别为92%和100%,中位随访时间为11.8个月。VAS疼痛评分和VCSS的平均改善更大(两种量表,支架组为6.5分,非支架组为1.0分;P<0.001)和QOL(ShortForm-36HealthSurvey,multipledomains,P<0.001)在支架置入术患者与未置入术患者之间比较。 局限性包括样本量小,单中心表现,PTS和NIVL患者的数据混合,基线不平衡(分配支架置入的肢体基线VAS评分和VCSSs较高,深静脉和穿支静脉瓣膜反流较少)。 正在进行的随机对照试验慢性静脉血栓形成:辅助导管导向治疗(C-TRACT)临床试验是一项正在进行的多中心、开放标签、评估盲、随机对照试验,由美国国立卫生研究院(国家心脏、肺和血液研究所)赞助。本研究旨在随机选取374例中度或重度PTS伴髂静脉阻塞(伴或不伴延伸至下腔静脉或股总静脉)的患者,在静脉造影和血管内超声引导下接受或不接受髂静脉支架置入术。两组患者均通过药物、压缩和溃疡治疗积极改善PTS。主要结局是6个月VCSS,盲目评估和调整基线;24个月的随访包括PTS严重程度、生活质量、安全性、成本效益、支架通畅和瓣膜反流的评估。 慢性近端深静脉疾病最佳静脉内治疗(包括支架置入术)与最佳非静脉内治疗(Best)试验是一项多中心、开放标签、评估盲法、随机对照试验,由英国心脏基金会赞助。本研究计划随机选择328例慢性静脉疾病和髂静脉疾病患者(与C-TRACT临床试验不同,BEST试验包括PTS患者和无DVT病史的NIVLs患者)接受或不接受静脉造影和血管内US引导的静脉内支架重建。 两组患者将接受最佳的药物治疗,包括有或没有抗血栓药物的压迫治疗。主要终点是6个月时的VCSS,盲法评估。随访将延长至12个月,评估PTS严重程度、症状缓解、生活质量、安全性、成本效益和支架通畅性。 系统评价只有2篇系统综述专门针对髂支架置入治疗慢性静脉疾病和髂静脉阻塞。两者都受到显著异质性和纳入研究质量差的限制。最近由Seager等人进行的一项系统综述回顾了关于静脉支架置入的有效性和安全性的现有数据。共纳入16项研究(n=2431例患者),其中2649例肢体尝试置入支架,2586例(97.6%)肢体初步手术成功。由于异质性显著,没有进行正式的荟萃分析。5项纳入的研究(n=295例患者)报告了支架置入后静脉疾病严重程度(CEAP、静脉功能障碍评分、VillaltaPTS评分或VCSS评分)的降低。 有三项研究报道了支架置入后静脉疾病特异性生活质量评分(慢性静脉功能不全生活质量问卷[CIVIQ-20]或静脉功能不全流行病学和经济研究[VEINES]-生活质量测量)的统计学显著改善。在14项研究(n=2410条肢体)中,支架通畅时间在6-48个月之间,原发性通畅率为32%-99%,继发性通畅率为66%-96%。 另一项系统评价汇集了22项研究(n=2240例患者,包括1118例PTS患者和1122例NIVL患者)的数据。放置支架的总技术成功率为95%。疼痛、水肿和溃疡的完全缓解率分别在69%、63%和70%(PTS患者)和81%、68%和81%(NIVL患者)中观察到。PTS患者1年的初始通畅率为79%,NIVLs患者为96%。PTS患者1年的二次通畅率为94%,NIVLs患者为99%。 观察性研究已经完成了4项用于静脉使用的尼替诺支架的安全性和有效性的前瞻性多中心研究,其中3项研究的结果在撰写本文时已发表。这些研究的设计类似于评估支架治疗髂静脉阻塞(通常定义为完全闭塞或狭窄导致静脉管腔直径减少≥50%)的使用,但在研究的特定人群中有所不同。这些研究排除了下腔静脉疾病或恶性静脉阻塞的患者。这些研究的主要局限性包括缺乏未植入支架患者的对照组;因此,他们无法深入了解支架植入是否以及在多大程度上可以提供超过保守治疗的益处。 VERNACULAR研究中,170名患有症状性慢性静脉疾病或髂股静脉流出道阻塞的患者(93名PTS、71名NIVL)行Venovo静脉支架(波科)置入术(CEAP临床分级≥3或VCSS疼痛项≥2),其中只有9%的患者合并股总静脉疾病。术后1年通畅率为88.6%(PTS患者81.8%;NIVL患者97.1%)。 VCSS疼痛评分(支架置入前,2.3[2.1-2.4],相对于支架置入后,0.6[0.5-0.7])和生活质评分量(CIVIQ-20,支架置入前,49.3[46.5-52.0],相对于支架置入后,33.6[31.0-36.2])(P<0.001)。 36个月的随访时支架通畅率为79.5%(PTS患者70.0%;NIVL患者93.6%) VIRTUS研究:Vici静脉支架系统治疗慢性髂股静脉流出道阻塞。170名患有症状性慢性静脉疾病或髂股静脉流出道阻塞(完全闭塞或狭窄程度≥50%,CEAP临床分级≥3或VCSS疼痛评分≥2)的患者(PTS患者127;NIVL患者43)行VICI静脉支架(波科)置入。约37%合并股总静脉病变的患者需要行支架置入。行静脉造影的125名患者术后1年的原发通畅率为83.2%(PTS79.8%;NIVL96.2%)。1年后的继发通畅率为98.4%。 与基线评分相比,还观察了12个月内VCSS(置入支架前,10.0±5.1,置入支架后,5.6±4.1)、VAS疼痛评分(置入支架前,45.9±29.1,置入支架后,23.1±26.2)和生活质量评分(CIVIQ-20,置入支架前,55.4±19.4,置入支架后,41.7±20.0)的变化(上述比较均P<0.001)。 ABRE研究:167名患症状性慢性静脉疾病或髂股静脉流出道阻塞的患者(PTS95;NIVL72)行Abre静脉自膨支架(美敦力)置入。患者需要CEAP临床分级≥3或VCSS疼痛项≥2并且完全闭塞,静脉造影显示50%直径狭窄,或髂静脉血管内US显示50%面积狭窄。约44%的患者将支架置入股总静脉。随访12个月,原发性通畅率为88.2%(PTS为79.8%,NIVL为98.6%),继发通畅率为94.1% (PTS为89.3%,NIVL为100%)。 PTS患者,支架置入后12个月的平均VCSS和静脉QOL评分低于基线水平s(VCSS,置入支架前,8.8±0.5,置入支架后,5.0±0.4;QOL,支架置入前为49.1±2.5,支架置入后为69.0±2.6)。NIVLs患者亦相似(支架置入前为9.0±0.5,支架置入后为4.3±0.4;QOL,支架置入前46.8±3.0,支架置入后71.8±3.1)。 在撰写本文时,VIVO研究的全队列结果尚未发表,该研究评估了Zilver静脉支架(CookMedical,Bloomington,Indiana)治疗症状性髂股静脉阻塞的安全性和有效性。 其他有关的研究下面我们总结了一些现有的较早前瞻性研究和大型观察系列的结果。由于这些研究存在重要的方法学局限性,包括样本量小、缺乏盲法和缺乏合适的对照组,因此它们不能作为支架疗效的明确评估。然而,这些研究中的补充数据,为全面了解静脉支架置入的效果提供了有用的背景。 四项前瞻性、单臂研究。Delis等评估了23例慢性静脉疾病(CEAP临床分类3-6)和髂腔静脉阻塞肢体的静脉生理功能。所有接受治疗的患者均成功植入支架。 在支架放置后平均随访8.4个月时,静脉流出分数、小腿肌泵功能(射血分数增加)改善,残余静脉分数降低(P<001)。出现症状的15条肢体静脉性跛行全部消失。 在Rosales等的一项研究中,34例慢性静脉疾病(CEAP临床分类3[n=27]或6[n=7])和髂静脉梗阻患者行Wallstent支架置入(32例患者成功,94%)。C3患者的VCSSs从基线到支架置入术后3个月的变化(支架置入术前的中位评分为9[5-12]对比 1[0-11];P=0.0001)和C6患者(支架置入术前的中位评分为21[18-29]对比7[6-14];P=.002)。 另一项研究对52例置入支架的PTS合并髂股静脉闭塞或狭窄患者报告了VCSS(置入支架前,中位数为14,置入支架后,中位数为5)、Villalta评分(中位数,置入术前,18分,与支架置入术后,8分),CIVIQ-20静脉生活质量评分(平均增加,15.6±12.5分),小腿围(平均减少,右腿12毫米,左腿20毫米),大腿围(平均减少,右下肢23毫米,左下肢33毫米)(P<0.001)的变化。 在已发表的最大单中心研究中,对慢性静脉疾病的髂股骨静脉支架置入术(n=982例患者,包括518例NIVLs患者和464例PTS患者),严重肢体疼痛(VAS评分>5,支架置入术前,54%,支架置入术后,11%)、严重水肿(3级,支架置入术前,44%,支架置入术后,18%)和生活质量(多个CIVIQ-20亚量表)的改善被改善;然而,没有进行统计比较。在本研究中,98%的患者使用了wallstent。经过6年的随访,原发性通畅率为67% (NIVL为79%,PTS为57%),继发性通畅率为95% (NIVL为100%,PTS为86%)。在这一研究进行分析,静脉完全闭塞支架置入的通畅率明显低于静脉狭窄支架置入的通畅率。治疗往往是成功的,即使支架需要延伸至股总静脉(尽管通畅率略低)。 血栓后病变与非血栓性病变PTS患者支架置入后血栓形成的几率高于NIVLs患者。相比NIVLs患者,PTS患者的髂静脉病变常延伸至较长的静脉段,呈致密纤维化,并累及关键的流入和/或流出静脉因此,在PTS患者中,确保从股静脉或股深静脉流入股总静脉的质量和通过下腔静脉流出的质量是很重要的。由于浅静脉(如大隐静脉)没有周围肌肉的支撑,它们往往不能很好地作为髂静脉支架的主要流入道。在治疗PTS时,重要的是安全地预扩张目标静脉,以确保足够的支架扩张,并在干预后更积极地使用抗血栓治疗。在一些患者中,球囊膨胀会引起疼痛,这可能会导致医生未能进行充分的预扩张;因此,术前计划应考虑全身麻醉是否最佳,特别是如果计划治疗长段闭塞。相比之下,在NIVL患者中,支架可能保持开放,但以下问题更为明显:(a)由于NIVL的诊断通常难以识别,因此诊断具有挑战性,通常需要侵入性影像学检查;(b)由于形态学特征决定临床有意义的表现的信息有限,并且由于症状(如疼痛和肿胀)通常具有非静脉的或多因素的病因,因此很难预测哪些患者在经过NIVL放置支架后将受益。这就产生了过度治疗正常功能静脉的巨大风险——例如,在一些回顾性研究中,使用50%面积狭窄阈值并不能预测支架置入后的临床改善程度,狭窄程度也不能预测支架通畅程度。即使无症状的患者也可以表现出髂静脉压迫的影像学特征,目前尚不完全清楚为什么有些患者有症状,而另一些患者没有。因此,尽管临床严重程度是一个相关的考虑因素,但不应从下肢症状和解剖性狭窄的同时存在自动推断出因果关系。(c)由于NIVL病变血管通常短而椭圆(通常保留大部分静脉的管腔口径),纤维化程度较低,这些静脉可以随着腔内压力和血管内容积的变化而表现出更大的动态变异性。这些特征会损害支架固定,并产生更大的支架迁移潜力。因此,对于NIVL来说,在患者选择、狭窄的影像学评估以及支架的大小和放置过程中,细致的护理是必不可少的。 辅助手段当狭窄在血管内超声上测量到至少54%的面积减少时,支架置入的临床改善达到最佳。然而,对于NIVL,临床改善的最佳预测是血管直径狭窄至少61%。另一方面,即使静脉造影、血管直径和血管面积测量同时显示狭窄≥50%,支架置入术(在本研究中定义为VCSS降低>4点)仅在52%的治疗患者中出现显著的临床改善。尽管血管内US信息增强了对髂静脉的评估,但血管内超声测量的预测价值还不够高,不足以声称具有良好的诊断效果。因此,来自临床评估、患者病史和其他静脉形态学指标的信息应与血管内超声和静脉造影一起用于确定严重慢性静脉疾病患者的适当治疗策略。 在另一项对155例下肢慢性静脉疾病的回顾性研究中,多平面静脉造影往往低估了血管内US的狭窄程度,并且往往无法定位血管内超声确定的最大狭窄点、髂静脉汇合处和最佳远端支架着陆区。 在最近对41例盆腔静脉疾病患者的研究中,仰卧位患者血管内超声测量的横截髂静脉面积明显低于左卧位患者;仰卧位导致更多的患者表现为明显的髂静脉狭窄。因此,依靠仰卧位血管内超声评估作为评估髂静脉病变的唯一方法时应谨慎。 这些研究的局限性包括样本量小(总体以及PTS和NIVL亚组),缺乏一个真正的金标准来比较几个参数的影像学评估(包括什么构成“显著”髂静脉狭窄),在VIDIO研究中使用二元切点来定义临床改善,以及缺乏对血管内US是否导致改善长期结果和成本效益的评估。一项随机试验(IGuideU研究)正在进行中,以评估与延迟血管内超声相比,早期血管内超声是否能促进静脉溃疡愈合。 抗血栓形成的治疗四项回顾性队列研究评估了抗血栓治疗的使用。在Arendt等人的一项研究中,在接受完全治疗性抗凝治疗的患者(n=26)和未接受或亚治疗性抗凝治疗的患者(n=25)之间,血栓性并发症或患者报告的症状改善没有差异。在一项回顾性研究中(n=106),在PTS和全髂静脉闭塞的患者中放置支架,存在多个静脉流出段闭塞(优势比[OR],4.596;95%可信区间[CI],1.424-18.109),高凝状态(OR,3.835;95%CI,1.207-12.871)和使用的抗凝药物类型与较高的早期(<3个月)支架血栓形成率独立相关。具体来说,术后>10天使用低分子肝素与较低的再闭塞几率相关(OR,0.012;95%ci,0.001-0.130)。在另一项单中心回顾性研究中(n=87),使用三联治疗(抗凝、阿司匹林和噻吩吡啶抗血小板药物)在预防支架置入术后血栓复发方面似乎比双重抗血小板治疗更有效(OR,0.07;P=0.01)。 结论SIR认为血管内支架置入术治疗慢性髂股静脉阻塞可能对某些患者有帮助,但风险和益处尚未在精心设计的高质量研究中得到充分量化。目前建议在支架置入前仔细选择患者和优化保守治疗,并注意合适的支架尺寸和高质量的操作技术。
 杜佳航 医师 中山大学附属第七医院(深圳) 放射科76人已读
杜佳航 医师 中山大学附属第七医院(深圳) 放射科76人已读



