聊城市人民医院泌尿外科科普号
- 引用 儿童夜间遗尿(尿床)治疗方法选择策略,基于最新循证医学
引言尿床bedwetting(夜间遗尿nocturnal enuresis),定义为睡眠期间的尿失禁,在整个儿童时期非常普遍。夜间多尿(nocturnal polyuria)、夜间逼尿肌过度活动(nocturnal detrusor overactivity)和高睡眠觉醒阈值(a high sleep arousal threshold)是发病机制的因素。尽管许多儿童在没有任何干预的情况下,其遗尿症可自行消失,但症状仍可能会持续到青春期和成年。最近的研究表明,尿床的儿童比夜间保持干燥的儿童自尊要低得多。国际儿童尿失禁学会(the International Children’s Continence Society,ICCS)发布了一份标准化文件,对单症状夜间遗尿症提出治疗建议。主要推荐的治疗方法包括一般的膀胱训练(行为疗法)、遗尿症警报和/或去氨加压素。目前这一领域的循证医学是有限的。此外,由于遗尿症也常伴有非泌尿系统并发症,包括睡眠呼吸紊乱和注意缺陷多动障碍,对这些疾病的治疗也会影响遗尿症。临床问题1对于患有单一症状的夜间遗尿症的儿童,与没有治疗相比,行为疗法会增加干燥夜晚的数量吗?单一症状遗尿症的治疗支柱之一是行为疗法。目前推荐的一般膀胱建议包括定期排尿、良好排尿姿势和便秘治疗。还包括限制夜间液体摄入、夜间唤醒儿童排尿、日常延迟排尿以增加膀胱容量等。在单一症状的夜间遗尿症患者中,建议采取行为干预(而不是不干预)作为可接受的一线治疗方法(基于低质量证据的条件推荐)。该建议基于以下判断:在没有任何严重不良事件的情况下,行为干预的益处大于危害。临床问题2对于患有单一症状的夜间遗尿症的儿童,与没有治疗相比,警报疗法是否会增加干燥夜晚的数量?对于单症状性夜间遗尿症患者,建议通过响铃/蜂鸣器型警报进行警报干预,作为一线治疗方案(基于中等质量证据的条件建议)。该建议基于中等证据质量和最小不良事件。临床问题3对于患有单一症状的夜间遗尿症的儿童,去氨加压素(desmopressin)治疗与不治疗相比,是否会增加干燥夜晚的数量?对于单症状夜间遗尿症患者,建议将口服去氨加压素作为一线治疗方案(基于中等证据质量的条件建议)。尽管严重的副作用并不常见,但需要警告患者和家庭注意水中毒和低钠血症和癫痫的风险。临床问题4在使用去氨加压素和/或床警报治疗失败的儿童中,额外的药物治疗会增加干燥夜晚的数量吗?去氨加压素和床警报是夜间遗尿症的一线治疗选择。去氨加压素减少了每周的湿夜数,尽管当药物停止时通常不能保持这种效果。床警报也是尿床的有效治疗方法,一旦治疗停止,更多的儿童会保持干燥。但有些孩子使用去氨加压素和/或床警治疗效果不佳。对于耐受丙咪嗪的儿童,建议使用奥昔布宁oxybutynin+丙咪嗪imipramine的组合(基于中等质量证据的条件推荐)。这种联合治疗的不良反应很少发生。然而,预计丙咪嗪单药治疗失败的人群规模较小。由于潜在的心脏毒性,三环类药物不建议作为ICCS夜间遗尿症的一线治疗。对于单症状性夜间遗尿症患者,建议联合治疗:警报+去氨加压素desmopressin;警报+丙咪嗪imipramine;警报+奥昔布宁oxybutynin;或抗胆碱能药物anticholinergic+去氨加压素(基于低质量证据的条件性建议)。试验结果不一致,该建议基于以下判断:在没有任何严重不良事件的情况下,联合治疗的潜在益处大于危害。临床问题5在使用去氨加压素和/或遗尿症警报的儿童中,进行额外的非药物治疗会增加干燥夜晚的次数吗?在使用去氨加压素和/或床警报进行一线治疗后夜间不完全干燥的患者,一些家庭可能想知道是否有任何额外的非药物治疗可能有所帮助。对于单症状夜间遗尿症患者,如果去氨加压素和/或床警报治疗失败,建议通过一些行为训练来补充,如过度学习、干床训练或奖励系统(overlearning, dry bed training, or reward systems)(基于低质量证据的条件建议)。本建议基于以下判断:在没有任何严重不良事件的情况下,联合治疗的潜在益处大于危害。建议反对其他补充治疗,包括针灸和草药(有条件的建议是基于非常低质量的证据)。本建议基于以下判断:在没有明确治疗益处的情况下,潜在的危害大于益处。临床问题6对于伴有睡眠或精神疾病的儿童,非创伤性治疗会增加干燥夜晚的数量吗?虽然夜间遗尿症与注意力缺陷多动障碍(ADHD)和睡眠呼吸紊乱密切相关,但这些合并症的治疗如何影响夜间遗尿尚未明确定义。这些人群的高质量证据有限。建议对伴有ADHD和睡眠呼吸紊乱的遗尿症患者进行额外的非泌尿外科治疗(基于低质量证据的条件建议)。如果没有确诊ADHD或睡眠呼吸紊乱,不建议采用这些治疗方法。该建议基于以下判断:在没有明确治疗益处的情况下,报告的不良影响、潜在的危害大于益处。
赵伟 主任医师 聊城市人民医院 泌尿外科1352人已读 - 精选 肾盂、输尿管及膀胱尿路上皮癌化疗
以顺铂为基础的化疗是转移性尿路上皮癌(mUC)的标准一线治疗方案,有效率高。但仍有较高的复发风险,另外,30%~50%的尿路上皮癌(UC)患者可能因各种原因而无法接受顺铂治疗。10%~15%的肌层浸润性膀胱尿路上皮癌(MIBC)患者在确诊时已出现转移,MIBC行根治性膀胱切除术后,高达50%的患者会出现转移。膀胱癌一旦侵犯到膀胱外,无论采取何种治疗,不管是否有效,90%的患者将在5年内死于膀胱癌。局部晚期上尿路尿路上皮癌(UTUC)患者术后辅助化疗可以改善生存。以顺铂为基础的新辅助化疗NAC)在RC(根治术)中可获得30%~40%的pCR(完全缓解),延长了MIBC患者的总体生存期(OS)。与单纯RC手术相比,NAC的5年OS获益为5%~8%。转移性尿路上皮癌(mUC)患者体能状况欠佳和有内脏器官(如肺、肝脏、骨)转移与生存时间缩短有相关性。尽管以顺铂为基础的化疗让大量患者获得了客观缓解,但是绝大多数患者最终仍会有病情进展。对于初始治疗失败的患者,目前尚无标准的二线化疗方案。对于含铂的联合化疗后复发的患者,我们推荐采用以PD-1或PD-L1为靶点的免疫检查点治疗。对于不适合顺铂治疗的晚期尿路上皮癌,可选的治疗方案包括:①可选择以卡铂为基础的化疗方案或无铂类化疗方案(如紫杉醇联合吉西他滨)。②单药化疗是合理的替代选择,或者也可以采取最佳支持治疗。应根据患者的体能状态、价值观和偏好等临床因素选择治疗方案。③对于可获得针对程序性细胞死亡-1蛋白(PD-1)或其配体(PD-L1)的药物的患者,可采用此类药物。④对于肿瘤易感性成纤维细胞生长因子受体(FGFR)3或2基因突变的患者,在此类患者接受含铂化疗和免疫治疗发生进展后给予厄达替尼。HER2靶向治疗:人类表皮生长因子受体2(HER2)属于受体酪氨酸激酶类原癌基因,在人类多种恶性肿瘤中可检测到HER2蛋白高表达,表达水平越高,肿瘤的侵袭性越高。免疫组化染色检查(IHC)和荧光原位杂交技术(FISH)分别应用于肿瘤组织中HER2蛋白的表达和HER2基因扩增的分析。HER2靶向治疗药物曲妥珠单抗已经广泛应用于HER2蛋白高表达的晚期乳腺肿瘤及胃肠道肿瘤,并取得良好的治疗效果,但在膀胱癌的靶向治疗疗效仍未取得共识。爱地希(维迪西妥单抗),荣昌生物制药(烟台),目前适应症是胃癌2021年。适应症膀胱根治术前的新辅助化疗:基于顺铂的新辅助化疗可延长总生存期,故对于合适的患者应当考虑该治疗。MIBC行根治术前可选择新辅助化疗(T2~T4a期),但不建议进行新辅助放疗。新辅助化疗的疗程尚无明确界定,但至少要用2~3个周期基于顺铂的联合化疗。膀胱根治术后的辅助化疗:膀胱根治术后病理若显示淋巴结阳性或为pT3-4,术前未行新辅助化疗者术后可采用辅助化疗。NIBC采取保留膀胱的全身化疗:对于不能或不愿行根治性膀胱切除术和尿流改道术的肌层浸润性膀胱尿路上皮癌患者,最大限度TURBT手术后,以顺铂为基础的化疗联合放疗,是一种保留膀胱的替代治疗方法。据报道,完全缓解率达到60%-80%,可使40%-45%的患者保留完整膀胱存活4-5年,长期存活达50%-60%。经治疗后,需要通过膀胱镜和活检再次评估,如无残余病灶,也要警惕有残余病灶存在的可能;如病灶仍存在,则行挽救性全膀胱切除。转移性尿路上皮癌:全身化疗是转移性尿路上皮癌(mUC)(包括膀胱癌、输尿管癌和肾盂癌)的标准治疗、优选初始治疗方法。仅有淋巴结转移的患者生存情况明显优于有内脏转移(最常见于肺、肝和骨)的患者。重要的是,一小部分有淋巴结或肺远处转移的患者可能通过联合化疗治愈。上尿路尿路上皮癌(UTUC)患者常有慢性肾脏病,因而很难或无法使用基于顺铂的化疗方案。这时可选择单药化疗或检测点抑制剂免疫治疗。如果在基于铂类的化疗后疾病进展,则PD-1或其配体(PD-L1)的抗体类检测点抑制剂免疫治疗是重要手段。UTUC根治术前新辅助化疗:目前尚无确定意见。虽然新辅助化疗不是上尿路恶性肿瘤的标准治疗,回顾性研究表明,它可改善DFS。术前基于铂类的化疗理论上有用,但会降低肾功。UTUC根治术后辅助化疗:对于高危患者,即原发肿瘤T3-T4期和/或淋巴结阳性的患者,uptodate建议在肾输尿管切除术后给予基于顺铂的辅助化疗(Grade2B)。需注意,UTUC根治术后肾功能会进一步降低,20%~25%的患者难以耐受以铂类为基础的化疗(因为GFR太低)。患者符合以下标准中至少1项,即不适合进行以顺铂为基础的化疗方案:基于20220418uptodate《膀胱和尿路转移性尿路上皮癌的治疗》①WHO或ECOG体能状态评分≥2分;②Karnofsky评分<60分;③肾小球滤过率(GFR)<60ml/min;④纽约心脏协会(NYHA)分级为III级或更高的心力衰竭;⑤2级或以上周围神经病变,即感觉改变或感觉异常(包括麻刺感)但不影响日常活动;⑥2个连续频率中听力损失25dB(经听力测试)。对于医学上健康的患者(不满足以上任何标准),我们推荐采用基于顺铂的联合化疗进行初始治疗。化疗应选择含铂类的联合化疗方案,GC方案(吉西他滨和顺铂)和MVAC方案(氨甲蝶呤、长春碱、阿霉素、顺铂)为一线化疗方案。吉西他滨加顺铂(GC)方案,该方案与MVAC方案具有相似的活性水平,GC方案有效性与MVAC方案类似,但毒性作用更弱。因此,许多医生将GC方案而不是MVAC方案,作为晚期膀胱尿路上皮癌患者的标准一线化疗方案。在GC方案中加入第3种药物(紫杉醇)未能显示出三联方案具有显著的优势。GC四周给药方案,即吉西他滨(1000mg/m2,于第1、8和15日使用)加顺铂(70mg/m2,于第2日使用),以28日为一个周期,最多6个周期。GC方案的另一种给药计划为3周给药方案替代4周给药,尽管还没有在随机III期试验中比较GC的这些不同给药方案,但其结果似乎相近。2020中国指南:GC方案可延长生存期约13.8个月,反应率为49%,吉西他滨1000mg/m2,第1、8天静脉滴注,顺铂70mg/m2第2天静脉滴注,每3周(21天方案)为一个周期。如果肾功能损害(30ml/min<GFR<60ml/min)或者患者不耐受顺铂的情况下,可以选择卡铂代替顺铂。全身化疗2~3周期后进行评价,如肿瘤减小或稳定,则追加2周期化疗。最多使用6周期化疗。如化疗2~3周期后评价肿瘤无反应,则应更换治疗方案。对于肾功能处于边界范围或轻度异常情况下(eGFR为40~60ml/min).顺铂可以考虑分次给药进行(如35mg/m2,dl、d2或dl、d8)。2021ASCO:一项吉西他滨联合顺铂方案(GC方案)与甲氨蝶呤+长春碱+多柔比星+顺铂方案(MVAC方案)对照用于晚期尿路上皮癌一线治疗的随机对照亚期临床研究显示,GC方案与MVAC方案的疗效相当,两组的客观有效率为49.4%与45.7%。中位无进展生存时间为7.7个月与8.3个月,中位总生存时间为14.0个月与15.2个月,但GC方案治疗导致的中性粒细胞减少性发热、中性粒细胞减少脓毒症和黏膜炎显著低于MVAC对照组。推荐用法:吉西他滨1000mg/m2,d1,d8,d15,顺铂70mg/m2,d1或d2,每28天为一周期。或者,吉西他滨1000mg/m2,d1、d8,顺铂70mg/m2,d1或d2,每21天为一周期。2021ASCO:最新随机试验显示,术后90天内接受吉西他滨联合铂类的辅助化疗(4周期)对进展期上尿路尿路上皮癌有生存获益。若eGFR<50ml/min,可使用卡铂(AUC=4.5/5)代替顺铂。对于因身体虚弱或有合并症而无法接受顺铂的患者,治疗选择有基于卡铂的方案(卡铂+吉西他滨,或者卡铂+吉西他滨+紫杉醇)、非铂类的联合治疗(如紫杉醇+吉西他滨)或者单药治疗(如吉西他滨)。对于不适合使用顺铂且肿瘤表达程序性细胞死亡配体1(PD-L1)的患者,可以采用阿替利珠单抗进行检查点抑制剂免疫治疗。(202204uptodate)如果患者不适合任何含铂类的化疗方案,我们会提供检查点抑制剂免疫治疗。基于卡铂的化疗方案:对于适合接受联合化疗但不能接受顺铂的患者(如,有肾功能障碍、神经病变、严重听力损失或心衰),我们建议使用卡铂+吉西他滨方案。对于需要立即进行细胞毒化疗的症状性或大块型病灶患者,我们也使用此方案。卡铂联合吉西他滨方案与MCAVI方案疗效相当,但毒性反应更小,因此支持在其他方面适合联合化疗、但存在肾功能损害或体能状态不佳(ECOG评分≥2)的患者中采用这种方案。然而,在选择治疗方案前明确肾功不全的基础原因非常重要。若肾功能减退的基础原因较简单且可逆(如原发肿瘤导致的尿路梗阻),则应先进行纠正,这有利于标准MVAC方案或GC方案的应用。(202204uptodate)阿替利珠单抗:对于肿瘤表达PD-L1的晚期尿路上皮癌患者,若不适合基于顺铂的化疗,其初始治疗也可以选择阿替利珠单抗进行全身免疫治疗。另一种选择是使用不含顺铂的化疗方案。此时,在两种方案的选择中,我们通常优选免疫疗法来治疗无自身免疫疾病且病灶局限于淋巴结的惰性癌症患者,除此之外则优选化疗。(202204uptodate)肾功相关问题:相当一部分老年人的GFR计算值<60mL/(min·1.73m2)。肾功能受损可导致峰值血药浓度较高及化疗暴露时间延长,依赖肾脏排泄清除的药物(如甲氨蝶呤、顺铂)产生过度毒性。老年患者中血清肌酐不是肾功能的可靠指标,因为GFR下降可能被肌肉量同步丢失所掩盖。多种公式用于估计肌酐清除率,这些公式都是基于血清肌酐以及年龄和体重。现有计算器可根据理想体重和血清肌酐水平来计算肌酐清除率。肾功能不全但体能状态良好的患者可接受化疗,但要调整给药剂量,以确保不损害疾病结局也不导致过度毒性。体能状态:衡量癌症患者生理储备和功能状态的最常用方法是医生评估的体能状态。有两种广泛使用的量表:Karnofsky体能状态(KPS)量表和美国东部肿瘤协作组(ECOG)量表。ECOG体能状态和KPS均有助于评估患者耐受化疗的能力及评估短期预后。无论年龄大小,体能状态差(如ECOG体能状态>2、KPS<60)的患者通常对化疗的耐受性较差,中位OS较短。然而,体能状态往往不能充分反映老年患者功能障碍的程度。日常生活能力:根据日常生活能力(ADL)和工具性日常生活力(IADL)量表,可以更全面地了解老年患者的功能状态。ADL是指基本生活所必需的技能,包括进食、梳妆、移动及如厕。IADL是指在社区独立生活所需的技能,包括购物、财务管理、家务、准备餐食和服药能力。老年癌症患者,在开始治疗前应评估共存疾病和功能障碍的程度,并且应将结果并入总体治疗计划。使用顺铂期间要充分水化,保证患者尿量每天不低于2000ml。顺铂主要毒副反应之一是肾损害,顺铂的肾毒性是一种剂量累积毒性,主要和顺铂导致的肾小管坏死有关,目前预防肾损害发生最有效的方法是水化。只要在使用顺铂前后进行充分的水化就可以预防和减少化疗所导致肾功能损害的发生。故对于肾功能不全的患者,通常使用肾毒性较小的卡铂的化疗方案。第1、8天吉西他滨1000mg/m2十第2天顺铂70mg/m2静脉滴注,每3周为一个周期,连续治疗4-6个周期(疗程)。每次化疗前预防性应用辅助药物帮助减轻化疗的毒副作用。顺铂2小时避光静脉滴注。用顺铂后需配合水化利尿,记24小时尿量,保持在2000-3000ml/24小时。其他中心经验202204uptodate:吉西他滨(1200mg/m2,第1和8日)+顺铂(75mg/m2,第2日),每21日为一个周期,持续6个周期。北京协和医学院肿瘤医院:吉西他滨为1000mg/m2,第1、8天静脉滴注,顺铂为70mg/m2,自第2天开始分2~3d静脉滴注。301医院:第1天吉西他滨1000mg/m2静脉输注,第2天顺铂70mg/m2静脉输注,第8天吉西他滨1000mg/m2静脉输注,每21d为一疗程,如患者耐受差,可采用分剂量给药方案。共完成4个周期,末次化疗后2~3后周行根治性膀胱切除术。上海仁济医院:吉西他滨用1000mg/m2于化疗第1、8天静脉滴注,顺铂用量为70mg/m2,于化疗第1天起分2-3天连续静脉滴注。依据WHO标准将化疗副反应分为0~IV级。主要不良反应为骨髓抑制及消化道反应,其中血液学毒性最常见。其他中心经验:①空军军医大学第二附属医院:38例患者共接受150周期的静脉化疗,平均3.95周期。患者总体耐受良好,大多数的毒性反应是胃肠道反应,包括恶心、呕吐、腹泻等,血液系统毒性主要为I~II度骨髓抑制,包括白细胞减少、血小板减少、贫血等,经过升高白细胞、血小板等对症治疗可缓解,仅1例患者因贫血给予输血治疗,无因毒性反应终止化疗或导致死亡的病例。如不给予有效预防措施,顺铂(剂量>70mg/m2)治疗后的迟发性呕吐风险介于60%-90%。新辅助化疗的主要不良反应有消化道反应、贫血及白细胞减少等,但不增加术后了~4级并发症发生率。对含顺铂化疗所致恶心呕吐的治疗,指数最高的3类药物是3型5-羟色胺(5-HT3)受体拮抗剂、神经激肽-1受体(NK1R)拮抗剂以及糖皮质激素(尤其是地塞米松)。此外,抗精神病药奥氮平与其他止吐药联用时,止吐活性相当高。上述药物可单独使用(糖皮质激素),也可联合使用。如果用于含顺铂化疗方案,推荐在第1-4日给予地塞米松。预防迟发性呕吐的推荐方案为:第1日联合使用NK1R拮抗剂、地塞米松、5-HT3受体拮抗剂和奥氮平,第2-4日联合使用地塞米松和奥氮平。对于接受顺铂治疗的患者,不推荐单独使用5-HT3受体拮抗剂预防迟发性呕吐。对于以顺铂为基础的化疗引起的迟发性呕吐的治疗,第二代5-HT3受体拮抗剂帕洛诺司琼似乎优于其他5-HT3受体拮抗剂。CINV控制不良时的治疗:使用顺铂时出现1次或2次呕吐发作的结果并不理想,但仍反映出相当大的止吐效果。因此,通常应保留原始止吐方案。可以加用其他药物,包括劳拉西泮或阿普唑仑、奥氮平、多巴胺能拮抗剂(如丙氯拉嗪、硫乙拉嗪、氟哌啶醇),或静脉给予大剂量甲氧氯普胺来代替5-HT3拮抗剂。对于接受顺铂和其他高度致吐性药物的患者,我们推荐联合使用5-HT3受体拮抗剂、地塞米松和NK1R拮抗剂进行止吐治疗。我们还建议加用奥氮平。吉西他滨导致的骨髓抑制一般需要7~10天恢复。吉西他滨化疗后的主要毒副反应是血液学毒性。单独使用吉西他滨化疗的患者发生III-IV度骨髓抑制的比率约为17%~29%。重组人血小板生成素注射液:本品适用于治疗实体瘤化疗后所致的血小板减少症,适用对象为血小板低于50×109/L且医生认为有必要升高血小板治疗的患者。每瓶装量1.0ml。7500单位/1毫升(7500U/1ml),15000单位/1毫升(15000U/1ml)。【替代方案:白介素-11,升血小板胶囊和氨肽素片】恶性实体肿瘤化疗时,预计药物剂量可能引起血小板减少及诱发出血且需要升高小板时,可于给药结束后6~24小时皮下注射本品,剂量为每日每公斤体重300U,每日一次,连续应用14天;用药过程中待血小板计数恢复至100×109/L以上,或血小板计数绝对值升高≥50×109/L时即应停用。当化疗中伴发白细胞严重减少或出现贫血时,本品可分别与重组人粒细胞集落刺激因子(rhG-CSF)或重组人红细胞生成素(rhEPO)合并使用。采用实体瘤疗效评价标准(ECIST)1.1版评估化疗疗效,①完全缓解(CR):所有靶病灶消失;②部分缓解(PR):靶病灶最长径总和缩小≥30%;③疾病稳定(SD):靶病灶最长径总和缩小<30%或增加<20%;④疾病进展(PD):靶病灶最长径总和增加≥20%或出现新病灶。客观缓解率(ORR)=(CR+PR)例数/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%。采用美国国立癌症研究所不良反应事件通用术语标准(NCI-CTC)4.0评价不良反应,分为0~4级。将化疗疗程中最严重的不良反应作为患者最终的不良反应数据。III级及以上不良反应被定义为严重不良反应。不良反应被分为血液学毒性和非血液学毒性。血液学毒性包括骨髓抑制、肝肾功能损害;非血液学毒性包括消化道反应、其他(心肌毒性、脱发、发热等)。经动脉给药的区域化疗(IAC)可用于MIBC的局部区域治疗。其常用的技术包括经股动脉穿刺皮下埋置植入式导管药盒系统(PCS)、超选择性膀胱动脉介入化疗、经髂内动脉介入化疗,以最后一种应用最广。经髂内动脉介入化疗:其优势是药物集中在肿瘤供血动脉,疗效相当于全身静脉化疗的2~4倍,全身不良反应较少,通过膀胱癌的主要供血动脉骼内动脉,化疗药物对膀胱黏膜下肌层、膀胱周围组织、盆腔周围淋巴结和血管内可能残留的肿瘤细胞的杀伤作用较强,可降低肿瘤复发率和转移风险。动脉介入化疗后,膀胱肿瘤的供血动脉出现水肿、狭窄甚至闭塞,肿瘤血供减少,生长受限,TURBT术中可见肿瘤缩小变软,表面苍白,术中出血量也相对减少,提高了膀胱保留率。体表面积计算公式:休表面积(m2)=0.0061身高(cm)+0.0128体重(Kg)-0.1529。估算肾小球滤过率(eGFR)的方法:使用慢性肾脏病流行病学合作(CKD-EPI)计算。ECOG体能状态评分Karnofsky评分纽约心脏协会(NYHA)分级美国国立癌症研究所不良反应事件通用术语标准(NCI-CTC)4.0版2017年美国癌症联合委员会(AJCC)膀胱癌TNM分期和组织学分级
 赵伟 主任医师 聊城市人民医院 泌尿外科2393人已读
赵伟 主任医师 聊城市人民医院 泌尿外科2393人已读 - 引用 2018版转移性前列腺癌诊治中国专家共识
中国抗癌协会泌尿男生殖系肿瘤专业委员会前列腺癌在中国的发病率逐年升高。据估计,2015年我国前列腺癌新发病例有60 300例,死亡病例约26 600例[1]。我国大多数前列腺癌患者在初诊时就已经出现转移,在北京、上海和广州进行的一项研究结果显示,国内新诊断的前列腺癌患者中,54%的患者在诊断时已发生远处转移(包括骨和腹部器官转移)[2]。发生远处转移的患者,5年相对生存率从未转移患者的80%降至30%[3],无进展生存时间是未转移患者的一半[4]。近年研究结果显示,转移性激素敏感性前列腺癌(metastatic hormone sensitive prostate cancer,mHSPC)患者中,具有高危因素的患者加用阿比特龙和多西他赛治疗其总体生存时间能获得更明显的受益[5,6]。mHSPC患者进展后将转变为转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)。患者一旦进入mCRPC阶段,预后一般较差。目前阿比特龙和多西他赛已经正式在中国上市用于治疗mCRPC,恩杂鲁胺及其他多种药物在临床试验中被证实可以有效地延长mCRPC患者的总体生存时间,并即将在中国上市。如何正确地应用目前的治疗手段,为中国转移性前列腺癌患者制定最佳的诊疗方案是摆在临床医师面前的重要问题。中国抗癌协会泌尿男生殖系肿瘤专业委员会组织专家撰写了本共识,希望帮助临床医师做出合理的临床决策,延长患者生存时间和提高生活质量。一、转移性前列腺癌的分类与定义(一)mHSPC的定义mHSPC指对雄激素剥夺治疗(androgen deprivation therapy,ADT)有疗效应答的转移性前列腺癌。转移性未接受过内分泌治疗的前列腺癌(metastatic hormone naive prostate cancer,mHNPC)指未接受过ADT的转移性前列腺癌。虽然这两个名词的应用尚未统一[7],但临床中绝大多数mHNPC都是mHSPC。为简明起见,本共识中以mHSPC代指两种临床状态。(二)mCRPC的定义mCRPC指持续ADT后疾病依然进展的转移性前列腺癌。除了明确的远处转移灶外,诊断mCRPC还应同时具备以下2个条件:(1)血清睾酮达到去势水平(< 50 ng/dl或1.7 nmol/L);(2)生化进展或影像学进展:生化进展是指间隔1周或以上连续3次测量前列腺特异抗原(prostate specific antigen,PSA)上升,连续两次较最低值升高50%以上,且PSA>2 μg/L;影像学进展是指全身核素骨显像发现2个或2个以上的新病灶或符合实体瘤反应评价标准的软组织病灶增大。目前认为,仅有症状进展不足以诊断为CRPC。二、转移性前列腺癌的诊断对于新诊断且疑似转移性前列腺癌的患者,专家经讨论建议进行下列检查以明确是否存在转移,制定治疗方案。(一)淋巴结和远处转移情况的评估1.CT和MRI:CT和MRI可以通过淋巴结形态和大小判断转移情况。CT和MRI也能协助判断肿瘤在临近组织、器官和远处器官的转移情况。2.全身核素骨显像检查:骨骼是前列腺癌最常见的远处转移部位。局部高危的前列腺癌患者,建议进行全身核素骨显像检查以明确有无远处转移。3.氟化物PET和PET-CT,胆碱能PET-CT和MRI:18F-氟化钠PET或PET-CT与全身核素骨显像具有类似的特异度和更优越的灵敏度。胆碱能PET-CT特异度高于全身核素骨显像,但灵敏度是否具有优势还不明确。磁共振弥散加权成像在高危前列腺癌患者中检测骨转移比全身核素骨显像更灵敏。值得注意的是,胆碱能PET-CT和磁共振弥散加权成像也可以检测腹部器官转移,而全身核素骨显像和18F-氟化钠PET-CT仅用于检测骨转移。4.前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)靶向PET-CT:68Ga或18F标记的PSMA PET-CT比全身核素骨显像检查和常规MRI可更灵敏地检出微小转移灶。一项关于PSMA PET-CT在108例中高危患者术前和术后管理中应用的前瞻性多中心研究结果显示,与传统分期相比,分别有25%和6%的患者检测到额外的淋巴结和骨、腹部器官转移,其中21%的患者的诊治模式因此而改变[8]。建议有条件的医院开展此检查,具体建议请参照《前列腺特异性膜抗原靶向分子影像检查在前列腺癌患者中应用的中国专家共识》[9]。(二)淋巴结和远处转移检查的建议胆碱能PET-CT、MRI和PSMA PET-CT比传统的全身核素骨显像联合胸腹盆腔CT、MRI能更灵敏地检测淋巴结、骨和腹部器官转移灶,建议有条件的中心采用。尚无上述设备的中心,仍建议全身核素骨显像联合胸腹盆腔CT、MRI进行判断。三、转移性前列腺癌的治疗措施(一)新型内分泌治疗药物1.醋酸阿比特龙(abiraterone acetate):醋酸阿比特龙是一种高效、选择性、不可逆的CYP17酶抑制剂,能够阻断睾丸、肾上腺组织、前列腺癌组织中雄激素的合成[10]。常见的不良反应是外周性水肿、低血钾和高血压。2.恩杂鲁胺(enzalutamide):恩杂鲁胺是第二代雄激素受体信号转导抑制剂,能够抑制雄激素受体核易位、转录结合及辅助活化因子的募集[11]。常见的不良反应是疲劳和高血压,癫痫发作的发生率为0.6%,主要发生于既往有癫痫病史的患者。(二)细胞毒性药物1.多西他赛(docetaxel):多西他赛通过抑制微管解聚,减弱bcl-2和bcl-xL基因的表达促使肿瘤细胞凋亡[12]。常见的不良反应是骨髓抑制、疲劳、脱发、腹泻、神经病变和血管神经性水肿。2.卡巴他赛(cabazitaxel):卡巴他赛是新一代的紫杉烷类药物,在多西他赛抵抗的动物模型中亦表现出抗肿瘤活性[13]。常见的不良反应是骨髓抑制、腹泻、恶心呕吐和疲劳。3.米托蒽醌(mitoxantrone):米托蒽醌是一种拓扑异构酶Ⅱ抑制剂,干扰肿瘤细胞DNA的复制、转录与修复。常见的不良反应包括恶心、呕吐、脱发、心脏毒性和骨髓抑制,其中骨髓抑制和心脏毒性为延迟性作用。最严重的不良反应是不可逆的心肌病,并可能引起心力衰竭[14]。4.雌莫司汀(estramustine):雌莫司汀,即雌二醇氮芥磷酸盐,可发挥雌激素的抗前列腺癌作用,同时通过抑制微管解聚并与核基质结合发挥其细胞毒作用。常见的不良反应包括胃肠道毒性、乳房胀痛或男子女性型乳房、下肢水肿、血栓形成和心血管意外[15]。(三)免疫治疗Sipuleucel-T是一种自体源性细胞免疫疗法,可以调动患者自身的免疫系统对抗肿瘤细胞。常见的不良反应包括畏寒、发热和头疼,通常为暂时性[16]。(四)骨转移治疗相关药物1.唑来膦酸(zoledronic acid):唑来膦酸通过抑制破骨细胞的活化和功能从而阻断病理性骨溶解。常见的不良反应包括贫血、发热及肌肉痛,少见下颌骨坏死[17]。2.223Ra:223Ra能够发射高能α射线,促使骨转移部位的肿瘤细胞双链DNA断裂。223Ra的3~4级血液学毒性发生率较低(中性粒细胞减少为3%,血小板减少症为6%,贫血为13%)[18]。3.地诺单抗(denosumab):地诺单抗可以抑制破骨细胞RANKL的活性从而抑制骨转移的发生。常见的不良反应包括低钙血症及下颌骨坏死[19]。应用地诺单抗或唑来膦酸持续超过2年的患者,需要关注下颌骨坏死的风险。四、mHSPC治疗策略1.对于mHSPC患者,推荐ADT联合阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(1次/d)治疗(证据级别1):一项大型多中心随机对照三期临床研究(LATITUDE研究)结果显示,对于高危mHSPC患者("高危"指满足以下2条:Gleason评分≥8分,全身核素骨显像发现≥ 3个病灶,或存在腹部器官转移灶),阿比特龙可使死亡风险降低38%,延长影像学无进展生存时间(33个月比14.8个月),推迟PSA进展时间(33.2个月比7.4个月),并能减缓疼痛的进展,推迟症状性骨相关事件发生和化疗类药物的应用[4]。此外,STAMPEDE研究阿比特龙组的入组患者包含了高转移负荷和低转移负荷的患者,结果仍显示阿比特龙可使死亡风险降低37%,并使治疗失败的风险下降71%[20]。2.对于能耐受化疗的高转移负荷(存在腹部器官转移,或者存在4处以上转移,其中至少1处在脊柱或骨盆以外)的mHSPC患者,推荐ADT联合多西他赛75 mg/m2(每3周1次)治疗6个周期,在输注多西他赛前12、3和1 h,分别口服地塞米松7.5 mg(证据级别1):一项大型多中心随机对照研究(CHAARTED研究)结果显示,多西他赛可推迟进展至CRPC的时间(20.2个月比11.7个月)和延长临床无进展生存时间(33个月比19个月),使高转移负荷组死亡风险降低39%,但低转移负荷组死亡风险与对照组相比差异无统计学意义[5]。3.对于低转移负荷患者推荐ADT联合阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(1次/d)治疗,或单纯ADT,或ADT联合抗雄激素类药物(combined androgen blockade,CAB)治疗(证据级别3)。4.对于不能耐受或不愿意接受多西他赛或阿比特龙联合泼尼松治疗的患者,推荐ADT或CAB治疗(证据级别1)。五、mCRPC治疗策略(一)无疼痛或轻微疼痛症状的mCRPC1.轻微疼痛定义:可被非甾体抗炎药缓解的疼痛。2.治疗建议:(1)阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(2次/d)(证据级别1):三期临床试验结果显示,对于不合并腹部器官转移的无症状或症状轻微的mCPRC患者,阿比特龙可明显延长影像学无进展生存时间(16.5个月比8.3个月)。此外,阿比特龙能减缓疼痛的进展,推迟化疗和阿片类药物的应用,同时也能推迟体能状况的恶化。研究结果最终提示,阿比特龙能够将总体生存时间延长至34.7个月[21]。(2)恩杂鲁胺160 mg(1次/d)(证据级别1):三期临床试验结果显示,与对照组相比,恩杂鲁胺能降低81%的影像学进展风险和29%的死亡风险。此外,恩杂鲁胺能改善各次要研究终点,包括推迟化疗的应用、推迟骨相关事件的出现、延长PSA无进展生存时间、提高软组织病灶反应率(59%比5%)、提高PSA下降≥50%的患者比例(78%比4%)。恩杂鲁胺还能减缓疼痛的进展、推迟阿片类药物的首次应用及体能状况的恶化[22]。(3)多西他赛75 mg/m2(每3周1次)联合泼尼松5 mg(2次/d,根据化疗周期而定,通常使用6~8周期)(证据级别1):与米托蒽醌相比,每3周给药的多西他赛方案可延长中位生存时间(18.9个月比16.5个月)并提高生活质量(22%比13%)[14]。应用时机应在与患者讨论后决定,用药方案应根据患者的临床状态及偏好个体化制定。每周给药的米托蒽醌+泼尼松方案虽然不能使总体生存时间获益,但可控制、缓解疾病,提高患者生活质量(证据级别2)[23]。(4)不愿意接受上述治疗的患者:单纯去势的患者可以尝试CAB治疗。CAB治疗的患者尝试抗雄激素类药物撤退或换用第一代抗雄激素类药物或皮质类固醇类药物,约30%的患者出现一过性PSA下降,但尚无生存获益的证据,因此,不作优先推荐(证据级别4)。(二)合并明显疼痛症状的mCRPC1.多西他赛75 mg/m2(每3周1次)联合泼尼松5 mg(2次/d,根据化疗周期而定,通常使用6~8周期)(证据级别1):证据同样来源于多西他赛和米托蒽醌的随机对照研究:三期临床试验结果显示,多西他赛组PSA反应率为45%,疼痛缓解率为35%,疼痛缓解维持时间为3.5个月,中位生存时间为18.9个月[14]。2.阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(2次/d)或恩杂鲁胺160 mg(1次/d):尽管阿比特龙及恩杂鲁胺用于未化疗mCRPC患者的随机对照临床试验中未纳入存在明显疼痛症状的患者[17,18],但两种治疗方案均在化疗失败后疼痛明显的mCRPC患者中被证实可带来明显临床获益,阿比特龙的疼痛缓解率和疼痛缓解中位持续时间分别为45%和4.2个月[24],恩杂鲁胺可使疼痛进展风险降低44%[25],专家一致认为阿比特龙或恩杂鲁胺是合适的治疗方案(证据级别4)。(三)多西他赛化疗后进展的mCRPC1.阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(2次/d)(证据级别1):与安慰剂联合泼尼松的治疗方案相比,阿比特龙联合泼尼松可以延长中位生存时间4.6个月(15.8个月比11.2个月)。次要研究终点也体现出阿比特龙的优势:中位PSA无进展生存时间延长(8.5个月比6.6个月),影像学无进展生存时间延长(5.6个月比3.6个月),PSA下降程度≥50%的比例更高(29%比5.5%)[26]。2.恩杂鲁胺160 mg(1次/d)(证据级别1):与对照组相比,恩杂鲁胺可延长总生存时间4.8个月(18.4个月比13.6个月)。同时,PSA反应率更高(54%比2%),软组织病灶反应率更高(29%比4%),中位PSA无进展生存时间延长(8.3个月比3.0个月),影像学无进展生存时间延长(8.3个月比2.9个月),骨相关事件发生延迟(16.7个月比13.3个月)[11]。3.卡巴他赛25 mg/m2(每3周1次)联合泼尼松5 mg(2次/d,根据化疗周期而定)(证据级别1):针对先前接受过多西他赛化疗的mCRPC,卡巴他赛治疗的中位生存时间优于米托蒽醌(15.1个月比12.7个月)[27]。4.其他治疗方案(生存获益不明):如果中断多西他赛化疗前评估化疗有效,可以再次尝试化疗(证据级别4)。米托蒽醌联合泼尼松可缓解前列腺癌引起的疼痛症状(证据级别2)。(四)体能状态差的mCRPC美国东部肿瘤协作组制定的体能状态评分常被用于肿瘤患者的分类。通常体能状态评分≤1的肿瘤患者能够耐受上述治疗,而体能状态评分≥2的患者则很难从上述治疗中受益。因此,针对体能状态差的mCRPC患者,推荐以下的治疗方案。1.未接受过多西他赛化疗:(1)阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(2次/d)或恩杂鲁胺160 mg(1次/d)(证据级别3):虽然阿比特龙或恩杂鲁胺的临床研究中仅纳入体能状况好的患者[17,18],但专家一致认为阿比特龙或恩杂鲁胺在体能状况差患者中的耐受性优于化疗,是合理的选择。(2)由肿瘤导致的体能状况差:既往体健,但由于肿瘤在骨骼或实质器官迅速进展,导致严重疼痛、虚弱、体重下降的患者可尝试多西他赛或米托蒽醌化疗,然而必须关注治疗剂量和不良反应(证据级别4)。(3)由骨痛导致体能状态差的mCRPC患者:在体能状态评分低、单纯骨转移伴骨痛的CRPC患者中,223Ra可延长患者的生存时间。如果体能状态评分差是由骨痛引起,应用223Ra治疗或可使此类患者受益(证据级别4)[18]。2.曾接受过多西他赛化疗:可采用最佳支持治疗、阿比特龙、恩杂鲁胺或放射性核素治疗(证据级别4)。(五)特定类型的mCRPC1.mHSPC阶段使用新型方案的mCRPC:(1)mHSPC阶段使用阿比特龙联合泼尼松+ADT的患者:目前尚无在此类患者中开展的临床研究。mCRPC阶段建议使用多西他赛75 mg/m2(每3周1次)联合泼尼松5 mg(2次/d,根据化疗周期而定)方案,应用时机应在与患者讨论后决定,用药方案应根据患者的临床状态及偏好个体化制定(证据级别4)。(2)mHSPC阶段使用多西他赛+ADT的患者:目前尚无在此类患者中开展的临床研究,mCRPC阶段建议使用阿比特龙1 000 mg(1次/d)联合泼尼松5 mg(2次/d)方案(证据级别4)。2.一线雄激素剥夺治疗无反应,临床或影像学进展但PSA不升高的患者要考虑前列腺癌伴神经内分泌分化或前列腺小细胞癌。可以考虑行病灶穿刺活检明确诊断。对这些患者可以采取联合化疗方案,如顺铂联合依托泊苷、卡铂联合依托泊苷(证据级别3)[28]。(六)骨相关治疗1.延长生存时间的治疗:对于仅有骨转移的CRPC患者,推荐每4周1次223Ra治疗,共6个周期。一项三期临床试验结果证实,相对于安慰剂组,每4周1次共6周期的223Ra治疗能将总生存时间延长3.6个月(证据级别1)[18]。2.支持治疗:每4周应用地诺单抗120 mg或唑来膦酸4 mg预防骨相关事件发生(证据级别1)。相对于安慰剂,接受唑来膦酸治疗的CRPC患者骨相关事件发生率更低(38%比49%)。唑来膦酸也能延长进展至骨相关事件的中位时间(488 d比321 d)[29]。需要注意的是,对于基础肌酐清除率<30 ml/min的患者,不能用唑来膦酸进行治疗。相较于唑来膦酸疗法,地诺单抗可明显延长骨相关事件的发生时间(20.7个月比17.1个月),但总体生存时间和无进展生存时间差异无统计学意义[30]。另外,应用地诺单抗时无需根据患者肾功能进行剂量调整,但迄今并无在基础肌酐清除率<30 ml/min的患者中应用地诺单抗的研究。3.姑息性放疗:前列腺癌骨转移灶大多对放疗敏感。针对特定病变部位的外照射放疗可使绝大多数患者的疼痛出现部分或完全缓解。对于有多处骨转移灶的CRPC患者,采用全身89Sr放射性核素治疗对于缓解症状可能有效,但有严重骨髓抑制和输血依赖性的风险[31]。怀疑有脊髓压迫,需要立即诊断和治疗。治疗方案有外科瘤体减灭术+放疗、内固定术+放疗或放疗+类固醇治疗(证据级别1)。这类患者接受ADT时,应联合抗雄激素类药物以避免发生睾酮急剧上升导致的疾病急速恶化,如截瘫等。如使用促性腺激素释放激素激动剂,建议联合抗雄激素类药物以防止闪烁现象;如使用促性腺激素释放激素抑制剂,则无需联合抗雄激素类药物。(七)可选治疗1.雌莫司汀和雌激素:一项前瞻性临床研究结果表明,使用雌莫司汀客观反应率约为18%,与安慰剂组相比第1个月PSA反应率更高(47.5%比4.4%),但中位生存时间两者无明显差异[32]。雌激素PSA反应率约为29%,临床研究结果表明,其可以缓解部分骨痛症状,但会增加血栓风险[33]。2.临床试验:由于mCRPC患者的长期预后不佳,推荐患者积极参加新药临床实验。六、寡转移前列腺癌的治疗寡转移指肿瘤介于器官局限性疾病和广泛转移之间的一个特殊阶段,对于前列腺癌来说通常指转移灶的个数≤5个[34]。专家一致认为,在临床研究的情况下,可以在进行系统性全身治疗的基础上,选择性地对寡转移前列腺癌进行原发灶和转移灶的手术或放疗。系统性全身治疗包括ADT、ADT联合阿比特龙或联合化疗等方式。STAMPEDE研究的数据表明联合阿比特龙治疗可能使寡转移(低肿瘤负荷)前列腺癌患者受益[20]。参与本共识讨论和审定的专家参与本共识讨论和审定的专家(按姓氏笔画排序):王晓民(哈尔滨医科大学附属第四医院)、邓耀良(广西医科大学附属第一医院)、叶定伟(复旦大学附属肿瘤医院)、史本康(山东大学齐鲁医院)、邢金春(厦门大学附属第一医院)、朱刚(中国医学科学院肿瘤医院)、朱绍兴(浙江省肿瘤医院)、朱耀(复旦大学附属肿瘤医院)、齐隽(上海交通大学医学院附属新华医院)、孙兆林(贵州省人民医院)、李长岭(中国医学科学院肿瘤医院)、李传洪(西藏自治区人民医院)、李军(甘肃省肿瘤医院)、李鸣(新疆维吾尔自治区人民医院)、何朝宏(郑州大学附属肿瘤医院)、邹青(江苏省肿瘤医院)、陈捷(南昌大学第一附属医院)、郑祥义(浙江大学医学院附属第一医院)、居正华(福建省肿瘤医院)、胡志全(华中科技大学同济医学院附属同济医院)、袁建林(空军军医大学西京医院)、徐勇(天津医科大学第二医院)、高平生(宁夏回族自治区人民医院)、靳风烁(陆军军医大学大坪医院)、廖洪(四川省肿瘤医院)、潘铁军(广州军区武汉总医院)、魏少忠(湖北省肿瘤医院)执笔专家:朱耀
赵伟 主任医师 聊城市人民医院 泌尿外科9228人已读 - 精选 皮质醇增多症(库欣综合征)围手术期注意事项
肾上腺皮质腺瘤所致的库欣综合征概述 皮质醇增多症(库欣综合征,CS):患者的高皮质醇血症通常是由分泌促肾上腺皮质激素(ACTH)的垂体肿瘤(库欣病)、非垂体肿瘤异位分泌ACTH或者肾上腺腺瘤或肾上腺癌分泌皮质醇引起。 库欣综合征(皮质醇增多症):约20%的显性库欣综合征病例是由肾上腺皮质腺瘤引起的。在50岁以上的患者中,高皮质醇血症的程度及库欣综合征的很多临床表现往往都不那么严重。肾上腺偶发瘤患者中常见亚临床库欣综合征(轻度皮质醇增多症,不伴库欣综合征的临床表现)。然而,此类患者中常见葡萄糖耐受不良和高血压。 有4种不同的肾上腺疾病可引起库欣综合征,这类肾上腺疾病所致的库欣综合征,也称ACTH非依赖性库欣综合征,又称肾上腺性库欣综合征。①肾上腺肿瘤(最常见)应采用单侧肾上腺切除术,而②双侧肾上腺小结节样增生(又称原发性色素结节性肾上腺皮质病,PPNAD)以及③双侧肾上腺大结节样增生(又称双侧肾上腺腺瘤样增生,AIMAH)患者需要双侧肾上腺切除术【后面这两种很少见】。④肾上腺皮质癌有些也可以分泌皮质醇。【2019年中国泌尿外科指南:曾认为双侧肾上腺切除术是治愈的主要手段,但术后需终身皮质激素替代。AIMAH 和PPNAD均为良性病变,治疗目的在于控制CS,因此保留肾上腺的手术方式可能是合理的选择,尽管存在二次手术风险,但可避免激素依赖。】 肾上腺皮质肿瘤所致的库欣综合征:也称肾上腺皮质腺瘤型皮质醇增多症。国外报道良恶性比例差不多,均占皮质醇增多症的6-10%,国内报道良性发生率大于恶性。不受下丘脑和垂体调控,且下丘脑和垂体处于被抑制状态,且肿瘤以外的肾上腺组织,包括同侧和对侧,均呈萎缩状态。肾上腺皮脂腺瘤一般体积较小,大小与功能不呈正比。腺癌除了分泌皮质醇,还分泌少量雄激素。亚临床CS占肾上腺偶发瘤的5%~20%。 库欣综合征体征:向心性肥胖、满月脸、水牛背、皮肤紫纹、低血钾、碱中毒等表现。体重增加和向心性肥胖是最常见的体征。 所有库欣综合征患者的治疗目标都是使下丘脑-垂体-肾上腺功能恢复正常,以及随后逆转类库欣体征/症状和合并症。 一侧肾上腺存在自主功能性腺瘤,可能通过负反馈机制使另一侧肾上腺萎缩。例如,在肾上腺腺瘤导致的库欣综合征中,腺瘤自主分泌的皮质醇抑制下丘脑分泌的促肾上腺皮质激素释放激素(CRF)和垂体分泌的促肾上腺皮质激素(ACTH),从而导致剩余肾上腺的类固醇合成减少并最终萎缩。切除单侧肾上腺后,恢复完整的下丘脑-垂体-肾上腺皮质(HPA)轴和剩余肾上腺的正常大小可能需要2年时间。类似原理适用于长期糖皮质激素治疗。 由于高皮质醇血症状态,小血管和毛细血管脆性增高,脂肪皂化和水肿,发生术中渗血、分离困难及术后切切口感染或血肿的风险较高。 分泌皮质醇的肾上腺腺瘤推荐腹腔镜肾上腺肿瘤切除术,推荐保留部分正常的肾上腺组织(2019年中国泌尿外科指南)。 库欣综合征的躯体症状和体征在有效治愈后2-12个月内逐渐缓解。高血压、骨质疏松和葡萄糖耐受不良会有所改善,但可能不会完全消失。库欣综合征的骨质疏松大约在高皮质醇血症被治愈后6个月时开始改善,对于有明显骨丢失的患者,推荐口服双膦酸盐治疗:补钙、补充维生素D和性腺类固醇替代治疗可能也有帮助。 异位促肾上腺皮质激素综合征患者术后肾上腺功能恢复最快,其次为库欣病,单侧肾上腺腺瘤最慢。可依据清晨血皮质醇和促肾上腺皮质激素(ACTH)兴奋试验来判断肾上腺功能的恢复情况决定停药时间(北京协和医院)。 术前评估及准备 控制血压、血糖,补充充分的蛋白质,纠正电解质紊乱,改善心功能,预防和治疗体内可能的感染,发现及预防下肢静脉血栓。 术前心脏彩超。 由于凝血级联反应激活以及纤维蛋白溶解受损,库欣综合征可造成高凝状态,患者发生静脉血栓栓塞性疾病的风险升高至10倍以上,尤其是接受手术的患者,静脉血栓形成风险增加,特别是术后4周内。因此,建议术前评估静脉血栓形成风险,于围手术期预防静脉血栓栓塞,根据情况需考虑抗凝治疗。术前下肢静脉彩超,术后下床之前安排行下肢静脉彩超。 必要时进行骨骼系统X线和骨密度检查,评价骨质疏松和可能的骨折。 注意少数患者存在精神心理障碍。 糖皮质激素补充 激素补充指征:1)所有分泌皮质醇肿瘤的切除;2)库欣病、AIMAH、PPNAD行双侧肾上腺全切或一侧肾上腺全切、对侧次全切者;3)亚临床库欣综合征,肾上腺偶发瘤术后肾上腺皮质功能低减者。 激素补充原则:激素的替代治疗目前尚无统一方案,但应遵循术中、术后给药,先静脉后口服,逐渐减量等。围手术期禁食期间静脉给予琥珀酸氢化可的松,进食后改为氢化可的松口服;根据复查的血清ACTH及血浆总皮质醇(PTC)结果,皮质激素剂量逐渐递减至停药;遇到疾病和生理应激因素或出现肾上腺皮质功能减退症状时应及时增加剂量。 激素类药物的药理特点:根据糖皮质激素的药理特性,在围手术期术后的应激状态中,无论何种病因的库欣综合征,都首选静脉滴注氢化可的松【氢化可的松或醋酸可的松为短效类激素,药物在血中作用时间约8~12h,易于模拟生理性激素分泌,方便药物剂量调节】。在术后长期口服糖皮质激素的维持替代治疗阶段,氢化可的松也为首选,其次为泼尼松或泼尼松龙。考虑到地塞米松缺乏盐皮质激素活性,且对下丘脑‐垂体‐肾上腺(HPA)轴的抑制作用较强,不利于肾上腺功能恢复,应避免在库欣综合征的围手术期使用。 氢化可的松和强的松口服的比较:氢化可的松用法大都以静滴或肌注为主,而口服氢化可的松在激素替代治疗中的应用却很少。强的松是一种无活性的前体药物,口服后需经肝脏代谢活化成有活性的氢化可的松方能发挥其治疗作用,而相当一部分皮质醇增多症患者常伴有肝功能异常,长期使用更易造成肝损害。另外,相对于氢化可的松来说,强的松作为中效激素,其作用时间较长,药物相对容易蓄积,对HPA轴的抑制较长及不良反应较多。氢化可的松作为人体肾上腺分泌的天然皮质醇激素,不管从生理活性、代谢过程还是不良反应等都要优于目前大部分人工合成的皮质醇激素,且在人体内广泛分布氢化可的松和可的松之间相互转换的酶系统,其活性受到机体自身的调控,因此是糖皮质激素治疗的理想选择。 瑞金医院经验:术后激素替代治疗2~12个月,平均6.2个月。2012年1月起开始采用快速撤退皮质醇激素替代治疗方案。具体如下:①术中快速静脉滴注氢化可的松100mg;②术后当天再给子静脉滴注氢化可的松100mg;③术后第1天,静脉滴注氢化可的松200mg;④术后第2天开始给予口服醋酸可的松,起始剂量50mg,每8小时1次;⑤术后第3天给予口服醋酸可的松50mg,每12小时1次,之后逐渐减量,至术后第5天减量至25mg,每12小时1次;⑥术后7d左右,减量至生理替代剂量37.5mg/d(25.0mg+12.5mg)维持治疗。患者围手术期如出现乏力、纳差、发热等皮质醇不足的表现,则立即增加皮质醇激素的用量。 天津医科大学总医院(2012年):术前均不用糖皮质激素,术中静滴氢化可的松100mg,术后当日、第1日、第2日分别静滴氢化可的松100mgq12h、100mgq12h和100mgqd,从术后第2天开始口服氢化可的松40mg,每日3次,每7天减量20mg,直至20mg/d维持剂量治疗。【若用强的松,则为:第2日开始同时口服强的松(又称泼尼松、去氢可的松)10mgtid,每7d减量5mg,直至5mggd维持剂量治疗。】分别于术后第1、2、6、7天检测血、尿皮质醇水平,并观察血压、心率、电解质及临床症状变化情况。出院后随访6个月,检查血皮质醇及尿皮质醇水平。 中华医学会内分泌学分会《库欣综合征专家共识》(2011年):肾上腺性库欣综合征患者可于术前30min静脉滴注氢化可的松100mg,肿瘤切除后再给予氢化可的松100mg。术后第1天静脉滴注氢化可的松200~300mg,之后每天逐渐减量50%。如減药过程中出现血压下降、心率增快、乏力加重、恶心、食欲明显下降时,应立即增加氢化可的松用量直至症状好转。术后维持期序贯减量:根据患者的耐受情况,口服糖皮质激素可每隔2~4周减量1次,每次氢化可的松减量5~10mg/d或泼尼松(龙)减量1.25~2.5mg/d,减药过快易发生糖皮质激素撤药综合征。 2019年泌尿外科诊疗指南 遵循原则:①术中、手术当日静脉给子氢化可的松。②术后禁食期间可选择静脉给予氢化可的松、地塞米松或醋酸可的松,进食后改为泼尼松口服。③皮质激素剂量逐渐递减至停药。遇疾病和生理应激因素或出现肾上腺皮质功能减退症状时应及时增加剂量0.5~1倍,症状明显者静脉给子氢化可的松。以往在手术前几日就开始补充激素的方法缺乏理论依据。 给药方案:①术中氢化可的松100mg静脉滴注。②术后当日再静脉滴注氢化可的松200 mg。③术后第1天给子静脉氢化可的松200mg(上午8时125mg,下午4时75mg),次日减量至150mg(上午8时100mg,下午4时50mg )。正常进食后改为泼尼松口服,20~30 mg/d,据病情减量至15~20mg/d出院。此后每4周减2.5mg,注意观察是否有肾上腺皮质功能不全的症状,如食欲差、恶心、心率快、神情淡漠、疲乏嗜睡等,监测血浆皮质醇和ACTH,证实肾上腺皮质分泌功能恢复正常,方可减停药,般需4~6个月,但少数患者恢复过程可长达1-2年。 推荐的给药方案: ①术前30分钟静滴氢化可的松100mg。 ②术后当日再静滴氢化可的松200mg。 ③术后第1天静滴氢化可的松200mg(上午8时125mg,下午4时75mg)。 ④术后第2天静滴氢化可的松150mg(上午8时100mg,下午4时50mg )。 ⑤术后第2天晚上开始口服泼尼松(又称强的松、去氢可的松)10mg tid,据病情减量至15~20mg/d出院,此后每4周减2.5mg(天津医科大学总医院是每7d减量5mg),直至5mg gd维持剂量治疗。【若是口服氢化可的松,则氢化可的松40mg,每日3次,每7天减量20mg,直至20mg/d维持剂量治疗】 分别于术后第1、2、6、7天检测血、尿皮质醇水平,并观察血压、心率、电解质及临床症状变化情况。 急性肾上腺皮质功能不全(肾上腺危象)的处理 常见于肾上腺全切除术后或皮质醇增多症肾上腺肿瘤切除术后24h内至2周。 表现为厌食、腹胀、恶心、呕吐、乏力、精神不振、疲乏嗜睡、肌肉僵痛、低血压、心率过速、白细胞升高、电解质紊乱,以及不明原因的高热甚至昏迷等。 首先应密切监测生命体征、血容量和24h尿量变化;补液及血管活性药物以维持有效循环血容量,必要时予以胶体或血液制品,纠正水、电解质平衡。 补充肾上腺皮质激素是关键,最初1~2小时内迅速静脉滴注氢化可的松150mg,5~6小时内达500mg,第2~3天可予氢化可的松300mg,然后每日减少100mg。 期间应定期复查ACTH及血浆皮质醇,根据结果酌情更改激素用量。 出院后随访复查 出院后随访至少6个月,检查血皮质醇、尿皮质醇和ACTH水平。 监测症状如食欲、体力、血压和电解质水平等。 每隔1~2个月复查清晨血皮质醇和ACTH(服用首剂糖皮质激素前采血),查电解质、血糖等。 如果在维持期减药过程中出现重症疾病、急诊手术等应激情况,应将糖皮质激素增加至2~4倍的应激剂量,以防止出现肾上腺危象。
赵伟 主任医师 聊城市人民医院 泌尿外科1566人已读 - 引用 生殖道支原体感染诊治专家共识
支原体概述支原体(Mycoplasma)归属于柔膜体纲,支原体目(Mycoplasmatales),支原体科;其下分为支原体属、脲原体属。能够从人体分离出的支原体共有 16 种,其中 7 种对人体有致病性。常见的与泌尿生殖道感染有关的支原体有解脲支原体(U. urealyticum,Uu)、人型支原体(M. hominis,Mh)、生殖支原体(M.genitalium,Mg)。 解脲支原体和人型支原体在我国开展检测时间较早,大多数医院都能检测。生殖支原体自上个世纪 80 年代才被人们发现,受检测条件所限,Mg 仅在我国极少数医院开展检测。泌尿生殖道支原体存在无症状携带支原体在泌尿生殖道存在定植现象,人群中存在着相当数量的支原体携带者而没有症状和体征,以 Uu 最为突出。解脲支原体可分为两个亚型:Parvo 生物型和 T960 生物型。进一步可分为 14 个血清型:Parvo 生物型由解脲支原体血清型 1、3、6、14 组成;T960 生物型则包括解脲支原体 2、4、5、7、8、9、10、11、12、13 血清型。这两种亚型培养形成的菌落外观一致,划分亚型主要依据基因组之间的差异,需要使用核酸检测的方法。具有 Parvo 生物群特征的支原体又被称为微小脲原体(Ureaplasma parvum,Up),Up 常见于临床无症状携带,在健康体检人群中常常是 Up 的单一血清型检出,大多数人认为 Up 属于正常菌群。有 T960 生物群特征的支原体仍被称为解脲支原体(Ureaplasma urealyticum,Uu)。自从分子生物学方法能够分型检出 Uu 和 Up 后,各国学者都致力于研究二者致病性之间的差异,目前没有明确证据证明一种 Uu 的致病能力强于另一种,仅有大量证据证明 Up 易于被携带。综上,阴道内经培养检出解脲支原体的几率较高,但常无明确的临床意义,在临床工作中需要谨慎的判断泌尿生殖道检出解脲支原体Uu的临床意义。泌尿生殖道支原体感染能够导致或相关的疾病1. 尿道炎支原体是泌尿系感染的常见致病微生物,由支原体导致的泌尿系感染以尿道炎最为多见,其他还包括肾盂肾炎等。目前认为非淋菌造成的尿道炎中,40% 与衣原体感染相关,40% 与支原体相关,其余病因尚不清楚。Uu 和 Mg 已被证明是男性非淋菌性尿道炎病原体。2. 宫颈炎和盆腔炎近年来,已有大量证据证明生殖支原体 Mg是宫颈炎、子宫内膜炎、盆腔炎、男性生殖道疾病和输卵管性不孕的病因。生殖支原体有很重要的临床意义,但我国的生殖支原体临床检测很少。 约有 10% 的盆腔炎患者能培养出 Mh,同时,有研究表明 Mh 感染还可致产后发热,其原因可能是造成了子宫内膜炎。3. 绒毛膜羊膜炎及早产已有很多证据表明解脲支原体可以导致羊膜腔内感染。目前,大多数临床研究认为不需要对孕期下生殖道检出 Uu 的患者进行干预和治疗。4. 泌尿生殖道支原体的检出对男性精液质量的影响有很多临床研究显示解脲支原体可能影响精子活动度,其原因可能是支原体粘附影响精子活动,也有可能是支原体诱导抗精子抗体的产生。支原体与精子活动度之间有相关性,但未能明确其致病性。5. 泌尿生殖道支原体的检出对辅助生殖的影响多项研究表明,男女双方生殖道 Uu 培养阳性对 IVF 的受精率、异常受精率、卵裂率、临床妊娠率及流产率均没有明显影响,认为宫颈解脲支原体阳性不影响体外授精及胚胎移植的妊娠结局。支原体的检测支原体的培养是目前国内医疗机构进行解脲支原体Uu和人型支原体Mh检测的主要手段,而且主要是使用液体培养基直接检测并同时进行支原体药敏试验。但是,这种方法有时候会受到细菌或真菌的污染导致假阳性,因此需要固体培养基确认菌落形态才能最后诊断。而且这种方法不能区分 Up 和 Uu。区分 Uu 和 Up 主要使用核酸检测的方法。生殖支原体在一般支原体培养基中不生长。在固体培养基上菌落大小极不一致,由于分离培养难度大,临床极少使用培养方法检测生殖支原体。血清学方面与肺炎支原体有很多交叉反应的抗原决定簇,目前主要靠 DNA 探针和 PCR 检测技术进行研究,以克服血清学上的交叉反应。检测 Uu、Mh、Mg 均可以采用 16S rRNA 保守区设计引物,采用核酸检测的方法还可以区分 Uu 和 Up。各种各样的血清学检测方法,包括凝集反应、补体结合、间接红细胞凝集、代谢抑制试验、酶联免疫吸附试验,均被用于进行生殖道支原体的血清学变化检测。这些方法虽然有助于生殖道支原体致病作用的研究,但在临床工作中这些血清学试验没有实用性。不同标本的临床评价1. 男性受检者检测样本尿道拭子:男性患者常常因为尿道炎的症状进行支原体检测,通常可以进行尿道拭子,采用支原体培养或PCR核酸检测的方法进行检测。尿道拭子的采集有一定痛苦,容易造成男性的畏惧而避免检查。前列腺液及精液:怀疑男性生殖道感染的患者有时会进行前列腺液或精液的检查,前列腺液或精液排出时经过尿道,不可避免的会携带尿道内的微生物,尿道内可能存在支原体定植,因此可能被污染。尿液检测:一般仅适用于 RNA 检测方法,优点为无创、方便、敏感性和特异性高。可用于大规模人群筛查。目前新的核酸检测方法可以采用尿液检测,减轻了男性患者采样的痛苦,便于男性筛查。2. 女性受检者检测样本宫颈拭子与阴道拭子:是女性最常进行的检测手段,可培养或核酸检测,如前所述,女性下生殖道内有很高的比例出现支原体定植,因此需要审慎的评估感染风险,确定是否需要治疗。以 Uu 为例,如果不能进行 Up 和 Uu 的区分,判断 Uu 导致的感染性疾病时则需要更加谨慎。尿液检测:同样适用于RNA 检测方法,优点为无创、方便、敏感性和特异性高,可用于大规模人群筛查。对于泌尿生殖道支原体检出的处理原则解脲支原体Uu阳性但无症状:无需治疗(携带者)。Uu 经感染治疗后症状体征消失,仅 Uu 实验室检查结果为阳性时,应考虑是否转为 Uu 携带,不必继续药物治疗。男性若确诊为 Uu 性尿道炎,建议同时治疗性伴,期间注意避免无保护性交。男性精液质量异常且有生育需求时,男女双方建议同时治疗一疗程。如果能够进行生殖支原体检测,应该在怀疑尿道炎和宫颈炎时积极进行 Mg 检测。治疗盆腔炎时,应考虑支原体可能参与盆腔炎的发病,抗菌谱宜覆盖支原体。支原体感染的治疗方案因为支原体没有细胞壁,因此支原体对作用于细胞壁的抗生素耐药。因此,内酰胺类及糖肽类抗生素对支原体无效。抑制蛋白合成的抗生素对大多数支原体有效。人型支原体Mh对林可霉素敏感,但对红霉素耐药; 与之相反,解脲支原体对红霉素敏感,但林可霉素耐药。协同试验的结果表明,根治解脲支原体相当困难,即便只根除下生殖道的解脲支原体也并非易事。这可能与阴道的酸性环境使红霉素等抗生素失活有关。人型支原体对克林霉素敏感,而解脲支原体对克林霉素仅中度敏感。氨基糖苷类有抗支原体的作用。 四环素类是常用的治疗支原体感染的药物。但是已经发现了对四环素耐药的生殖道支原体变种,因此四环素不再对支原体普遍有效。 在某些情况下,需使用针对人型支原体的特殊抗生素,可以选择克林霉素,尤其是在四环素无效的情况下。针对性治疗解脲支原体时,主要是治疗男性的非淋球菌性尿道炎的时候,如四环素无效,可以选择红霉素或氟喹诺酮类抗菌药物。常见的治疗泌尿生殖道支原体感染的方案为:多西环素 100 mg,po,bid,7 d;阿奇霉素 1 g,单次口服,或 0. 25 g,qd,po,首剂加倍,共 5 ~ 7 d;左氧氟沙星 500 mg,po,qd,7 d;莫西沙星 400 mg,po,qd,7~14 d。如果患者存在盆腔炎,需按照盆腔炎治疗方案进行治疗,总疗程 14d。随访明确为支原体感染的患者需要在治疗后随访,采用培养法宜在停药后两周复查,采用核酸检测法宜在停药后 4 周复查。综上所述,我国支原体检测技术相对落后,大多数医院不能进行 PCR检查,限制了泌尿生殖道支原体感染的研究,我国泌尿生殖道支原体检测水平亟待提高。另外,对于支原体感染,一定要充分评估患者及配偶感染的危险因素,根据不同支原体的致病特点区别对待,这样才能提高对支原体感染的诊治水平。
赵伟 主任医师 聊城市人民医院 泌尿外科5317人已读 - 精选 聊城市人民医院进入机器人手术时代!
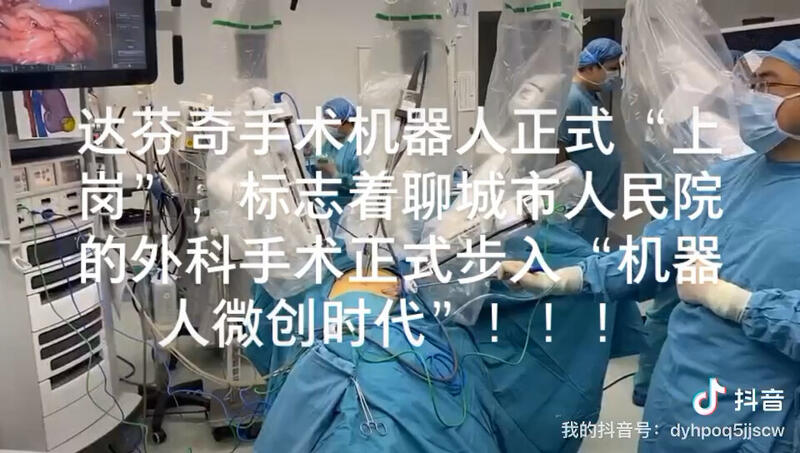 赵伟 主任医师 聊城市人民医院 泌尿外科909人已观看
赵伟 主任医师 聊城市人民医院 泌尿外科909人已观看 - 引用 巨输尿管症(MGU)
概述巨输尿管症是Caulk(1923年)首先描述的。定义:统指输尿管扩张,是将一类与输尿管直径增加有关疾病的统称。没有统一的病理生理学标准。诊治的重点:区分→梗阻型还是非梗阻型、原发性(膀胱输尿管连接部动力缺乏)还是继发性(如膀胱功能障碍)。分类巨输尿管症可能存在梗阻、反流,或者二者兼有,或者二者皆无。分类参数:梗阻性、非梗阻性、反流性、非反流性。原发性梗阻性巨输尿管症病因不清,最常见的原因是膀胱输尿管连接处存在3-4cm蠕动障碍(动力性梗阻)。多数远端输尿管呈纺锤样扩张,尽管可以累及整个输尿管,肾盂输尿管连接部无扩张或轻度扩张。远端输尿管功能的改变,包括肌排列紊乱、肌发育不良、肌肥大或管壁纤维化等。其他原因还有:先天性输尿管狭窄、输尿管瓣膜等。继发性梗阻性巨输尿管症最常发生在排尿功能障碍(神经源性和非神经源性)或膀胱出口梗阻时。当通过输尿管膀胱连接部的压力在40cmH2O以上时,输尿管排出尿液阻力增加。如果压力持续存在,输尿管膀胱连接部会出现失代偿、膀胱输尿管反流、输尿管扩张。其他梗阻性原因:包括输尿管膨出、输尿管异位、膀胱憩室、输尿管再植后纤维化、腹膜后肿瘤或团块以及变异血管的外在压迫。反流性巨输尿管症(包括原发性和继发性)因为反流的存在,膀胱的排空和充盈循环,直接传递压力至输尿管,导致输尿管扩张。扩张和扭曲的输尿管组织学变化:输尿管壁的僵硬、细胞外基质的改变、较差的动力学、无效的蠕动等。定量组织学研究证实正常平滑肌组织被胶原大量替代,进展性沉积导致了高的胶原-平滑肌比例。这些改变,在远端输尿管尤其明显,在影像学上显示特征性的扩张。反流性梗阻性巨输尿管症较少见,在反流病例中,同时存在梗阻的约2%。输尿管远端发育不良所致。原发性非梗阻性非反流性巨输尿管大多数新生儿的MGU属于此类。可以自发性消退。继发性非梗阻性非反流性巨输尿管通常有一个明确的病因,如在尿路感染时,细菌内毒素抑制输尿管蠕动,可以导致明显的输尿管扩张。肾病或其他导致尿量明显增加,超过蠕动能力的病理情况,都可以导致输尿管扩张,如精神性烦渴、尿崩症等。诊断症状:成人通常因出现肾功能减退、反复感染、结石或反复腰痛等症状被发现此病。B超和CTU:评估肾积水、输尿管扩张程度。膀胱造影:了解有无反流(重要)。ECT:用于判断肾功能和梗阻程度。膀胱镜检查和逆行造影:很少作为孤立的检查,为了避免感染,最好在外科手术前进行。转归许多生前诊断的MGU,可以自发性消退。一般来说,婴幼儿的非梗阻性巨输尿管症宜先观察。成人型病情发展相对缓慢,对轻型梗阻且无并发症采用保守治疗,定期监测肾功能。对肾功能受损较重、有反复感染及结石等并发症者,宜尽早手术治疗。治疗治疗方案的选择决定巨输尿管症治疗方案的关键,在于明确病变的类型、对肾和输尿管的影响程度、以及是否出现并发症。成人梗阻性巨输尿管症,对轻型且无显著并发症者,多数可采取保守观察,或经内镜定期扩张有梗阻部分的输尿管,用抗生素控制感染,定期检测肾功能。如果巨输尿管症已经导致患侧肾脏无功能,可以行肾输尿管全长切除术。合并明确感染者,宜先留置双J管或经皮肾穿刺造瘘术,感染控制后再手术。成人反流性巨输尿管症,应首先治疗下尿路梗阻。手术适应症:原发性梗阻性或原发性反流性巨输尿管症,尤其是合并肾功损害、结石、反复感染。手术原则无论何种病因,输尿管膀胱吻合术的手术要点均是切除末端病变输尿管、对扩张的输尿管进行裁剪(缩窄或折叠)(当直径超过1.5cm时)、再植时的抗返流措施(长度/直径比5:1)。对于扩张明显的输尿管再植,推荐在膀胱外操作。手术(输尿管膀胱再植术)开放手术Hendren的输尿管裁剪及膀胱粘膜下隧道抗反流吻合术。应用最普遍,但手术复杂。Ehrlich的输尿管折叠及粘膜下隧道术。Pezovic的膀胱外做粘膜下隧道法将输尿管不做裁剪和折叠,而是在膀胱外做粘膜下隧道,输尿管在隧道内会自行折叠。Tatlieen的抗返流乳头法不分离梗阻段下方的输尿管,仅在扩张部将其切断,于末端纵行劈开2cm,外翻形成2-3cm乳头,用可吸收线将创缘间断缝合,固定在输尿管外膜,若输尿管扩张较轻且管壁厚,可不形成乳头,直接插入膀胱内2cm,将来上皮化后,也可以形成抗反流乳头。腹腔镜手术膀胱外再植需要有一个较长的学习曲线,腹腔镜在膀胱逼尿肌和粘膜之间层面分离是困难的。腹腔镜经膀胱外输尿管裁剪及粘膜下隧道法输尿管膀胱再植术腹腔镜经膀胱外抗返流乳头法输尿管膀胱再植术
赵伟 主任医师 聊城市人民医院 泌尿外科5878人已读 - 精选 三维可视化技术指导下的腹腔镜巨大肾上腺手术,使手术更加安全!
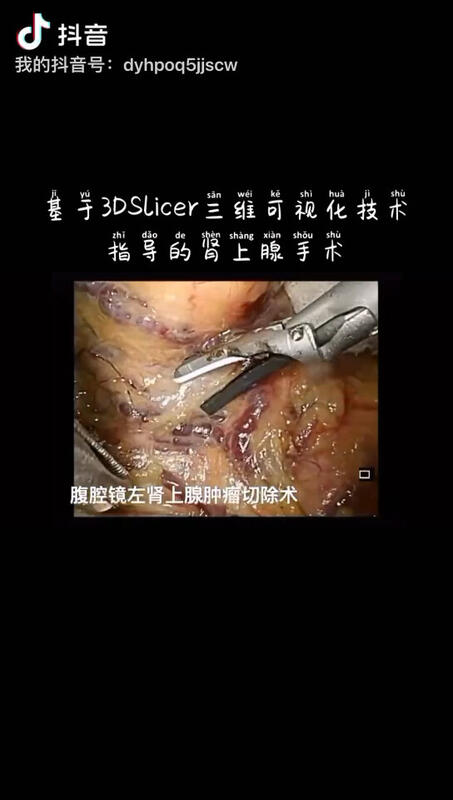 赵伟 主任医师 聊城市人民医院 泌尿外科1378人已观看
赵伟 主任医师 聊城市人民医院 泌尿外科1378人已观看 - 引用 女性尿道外口囊肿
女性尿道外口囊肿,包括尿道旁腺囊肿和尿道憩室相关解剖女性尿道腺体在胚胎学上与男性前列腺同源,分为尿道周围腺体和尿道旁腺。尿道旁腺(paraurthralgland)为一组分支腺体,大约有6~30条腺管开口于尿道。其中最大的2个尿道旁腺是Skene腺,分别开口于尿道口粘膜5点和7点处,在女性受到性刺激时分泌粘液润滑阴道前庭。另外,女性尿道的后方又有一分泌黏液的腺体,如黄豆大小,左右各一,向内开口于前庭后方小阴唇与处女膜之间的沟内,称为前庭大腺(bartholin gland)。概念女性尿道旁腺囊肿(脓肿)又称尿道旁腺囊状扩张或潴留性囊肿,临床上较少见,多发生于20~40岁左右的成年已育女性。女性尿道旁腺分布于尿道中下段的粘膜下层,有细小的腺管通向尿道外口的两侧。如果腺管排出口阻塞,腺体分泌物堆积而扩张,则可形成尿道旁腺囊肿;一旦感染,常成为慢性尿道炎的隐灶,亦可形成尿道旁腺脓肿。病因先天性尿道旁腺囊肿:由于尿道旁腺发源于胚胎期泌尿生殖窦,该泌尿生殖窦结合处上皮连接不完善或错位,可致腺体导管梗阻。囊壁为移行上皮细胞覆盖。潴留性囊肿:尿道炎症病变时,尿道旁腺受细菌感染,腺管水肿、狭窄,分泌物上皮组织。可表现为反复尿频、尿急、尿痛,局部红肿及灼痛等炎症表现,可形成尿道旁腺脓肿。尿道口损伤或外阴手术等操作,引起尿道旁腺腺管排出口阻塞,使腺体呈囊状扩张,出现后天性尿道旁腺囊肿。诊断尿道旁腺囊肿可以伴随症状,触诊是诊断女性尿道旁腺囊肿的基本手段,常规查体加尿道膀胱镜检通常即可确诊,一般不需额外影像检查。可能的影像学检查指彩超、CT、MRI等。鉴别诊断尿道憩室:需注意将尿道旁腺囊肿与尿道憩室进行鉴别,前者主要因尿道周围腺体在炎症或外界损伤下导致腺体开口部位的堵塞,并形成明显的囊状结构,病灶位置相对表浅。而后者则主要指如果尿道周围囊状组织出现解剖异常到导致其与尿道想通则表现为尿道憩室的形成。尿道憩室最直接的检查方法是行膀胱尿道镜检,排泄性膀胱尿道造影和经阴道B超检查对之确诊也有帮助。膀胱尿道镜检发现开口,输尿管导管试插成功后,造影确诊为尿道憩室。查体:沿阴道前壁向尿道口按压时可见液体流出,肿块体积是缩小。前庭大腺囊肿(脓肿):多由于前庭大腺管阻塞,分泌物聚集而形成。囊中小的一般不需要治疗,囊中增大并继发感染的,要尽早手术治疗。手术治疗有囊肿切除手术、囊肿造口术,囊肿特大的要采用切开后激光排除内容物、引流治疗。尿道黏膜脱垂:能通过肿块中央插入导尿管进入膀胱可以确诊。异位的输尿管囊肿:囊内为尿液,可行B超、IVP、膀胱尿道造影确诊。尿道阴道新生物:为实性肿物。手术方式:尿道旁腺囊肿切除术囊肿造口(开窗)术适应证:如果囊肿体积较大、位置较深或与周围组织粘连较重,也可行囊肿造口术(又称囊肿开窗术)。此法操作较简单,手术时间短,出血少,恢复快,不易损伤尿道、阴道、直肠等邻近组织脏器,不留瘢痕,且能保持尿道旁腺分泌粘液的润滑功能,有脓肿形成者亦可直接行此术式。
赵伟 主任医师 聊城市人民医院 泌尿外科1.3万人已读 - 精选 腹腔镜右肾盂成形术
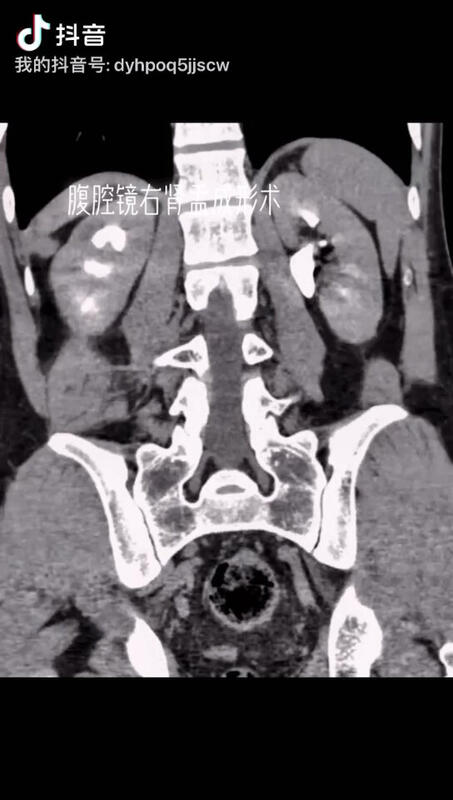 赵伟 主任医师 聊城市人民医院 泌尿外科942人已观看
赵伟 主任医师 聊城市人民医院 泌尿外科942人已观看



