龙岩市第二医院科普号
- 引用 查出肺部结节我该怎么办?
体检查出肺部结节我该怎么办? 随着健康理念的深入和经济水平的提升大家开始更加重视身体健康。体检也就频繁了。 每年都有人被查出肺结节 肺结节是肺癌筛查中最常发现的类圆形、密度增高的肺部阴影。如果从大小来看,直径小于5毫米的叫做微小结节,直径在5毫米至10毫米的叫做肺小结节,小于3厘米的为肺结节,而如果直径大于3厘米就是肿块了。 肺结节的原因有炎症引也的,也有自身免疫引起的,大家最担心的是肿瘤。由炎性假瘤、肺部感染、结核、真菌感染等诸多原因都可以是以结节为表现,但通常是良性的,一般不需要外科手术治疗。而磨玻璃样结节、实性结节又是怎么回事?是否都是恶性的?磨玻璃样结节是指肺内密度轻微增加,呈模糊的云雾状。在临床上检出率很高,比较会认为是肺癌,其实不是所有的磨玻璃样结节都是恶性的,有可能是感染性病变,尤其是真菌感染可能性大。 实性结节是指肺内圆形或类圆形密度增高的阴影。它需要排除肺结核、肺炎、肺结节病等。可以通过PET-CT,肺穿刺,气管镜介入亲集标本检查,甚至微创手术等以明确诊断。 增殖灶、纤维灶一般是肺内良性的病变。多数是由于既往发生过肺部炎症,待感染灶好转吸收后所遗留下来的疤痕。一般不需要担心。有些经过进一步治疗也会吸收。 但是不是所有结节,都可以简单的以它的名称来判断良恶性。 那体检出来的肺结节应该怎么办? 建议找呼吸内科专科医生进一步判断。 如有如下表现,则要高度怀疑肺癌。 1.结节形状:结节长得多形,恶性可能性越大,比如有分叶、毛刺、胸膜牵拉、小泡征等。 2.结节大小:如果实性结节大小超过1.5厘米,或者部分实性结节大小超过8毫米,其恶性的概率就高。如直径小于5毫米的肺结节恶性概率低于1%,而超过2厘米的肺结节恶性概率达64%——82%,在定期复查中结节不断增大,就要特别警惕恶性。 3.结节位置:恶性肿瘤常好发于右上肺。 体检查出肺结节,我该怎么办? 专家:避免过度治疗! 那肺结节是否都需要手术?或应该怎么随访? 其实不是所有的磨玻璃样结节都需要切手术。 对于刚发现的磨玻璃结节,建议定期随访复查。如果结节大于5毫米,建议3个月、6个月、12个月和24个月的CT检查。大多数感染引起的磨玻璃结节在自身免疫力的作用下会逐渐消散。如怀疑炎症引起,则抗感染治疗。但多次检查都 没有明显变化,甚至有变大或密度增高,就需要引起警惕了,可选择手术或继续观察。 在临床上许多磨玻璃结节在手术切除后经病理证实,属于早期的肺腺癌,但也不是一发现磨玻璃结节必须马上开刀。这种肿瘤往往属于“惰性肿瘤”,生长速度缓慢,手术效果良好,适当时间的复查随访并不会影响治疗效果和患者生存率。过小、过早进行手术都会导致过度治疗。因此,磨玻璃结节需要早筛早诊,如何治疗应该由呼吸内科和胸外科协作判断处理。 对那些大于1.5厘米或在8-15毫米但长相多形的实性结节,经过医生诊断通常是手术切除,而对于大小在8-15毫米但长相不古怪的实性结节,通常建议3个月、半年复查一次,如果变大则按照高危结节手术。对直径小于5毫米的实性结节,通常是1年随访一次,如果变大则按照高危结节处理。 不同形状肺结节的具体治疗方案需经专业医生给出不同的最佳治疗方案。 比起治疗,预防更重要。 建议,年龄大于40岁的,且有以下任一危险因素的人,每年至少做一次低剂量螺旋CT检查,这也是目前最有效的筛查方式: (1)每年吸烟大于400支或20包,或曾经每年吸烟大于400支或20包,但戒烟时间不足15年者; (2)有环境或高危职业暴露史(如石棉、铍、铀、氡等接触者); (3)合并慢性阻塞性肺病(COPD)、弥漫性肺纤维化或既往有肺结核病史者; (4)既往罹患恶性肿瘤或有肺癌家族史者,尤其一级亲属家族史; 另外,长期接触厨房油烟、二手烟、粉尘、燃气及其他有挥发性物质的人也要注意。 最后祝大家健康!保护环境是目前最为重要的预防措施。重视健康、重视环保、人人幸福!!! 你觉得有用,有帮助,可在下点?
黄旺 副主任医师 龙岩市第二医院 呼吸科2376人已读 - 引用 甲状腺癌诊疗规范(2018年版)
一、概述甲状腺癌(Thyroid Cancer)是一种起源于甲状腺滤泡上皮或滤泡旁上皮细胞的恶性肿瘤,也是头颈部最为常见的恶性肿瘤。近年来,全球范围内甲状腺癌的发病率增长迅速,据全国肿瘤登记中心的数据显示,我国城市地区女性甲状腺癌发病率位居女性所有恶性肿瘤的第4位。我国甲状腺癌将以每年20%的速度持续增长。根据肿瘤起源及分化差异,甲状腺癌又分为:甲状腺乳头状癌(papillary thyroid carcinoma,PTC)、甲状腺滤泡癌(follicular thyroid carcinoma,FTC)、甲状腺髓样癌(medullary thyroid carcinoma,MTC)以及甲状腺未分化癌(anaplastic thyroid cancer,ATC),其中PTC最为常见,约占全部甲状腺癌的85%~90%,而PTC和FTC合称分化型甲状腺癌(differentiated thyroid carcinoma,DTC)。不同病理类型的甲状腺癌,在其发病机制、生物学行为、组织学形态、临床表现、治疗方法以及预后等方面均有明显不同。DTC生物行为温和,预后较好。ATC的恶性程度极高,中位生存时间仅7~10个月。MTC的预后居于两者之间。二、诊疗技术和应用(一)高危人群的监测筛查有如下病史时需要高度警惕甲状腺癌,尽早进行筛查:①童年期头颈部放射线照射史或放射性尘埃接触史;②全身放射治疗史;③DTC、MTC或多发性内分泌腺瘤病2型(MEN2型)、家族性多发性息肉病、某些甲状腺癌综合征[如多发性错构瘤综合征(multiple hamartoma syndrome)、Carney综合征、沃纳综合征(Wernersyndrome)和加德纳综合征(Gardnersyndrome)]等的既往史或家族史。(二)临床表现1.症状大多数甲状腺结节患者没有临床症状。通常在体检时通过甲状腺触诊和颈部超声检查而发现甲状腺小肿块。合并甲状腺功能异常时可出现相应的临床表现,如甲状腺功能亢进或甲状腺功能减退。晚期局部肿块疼痛,可出现压迫症状,常可压迫气管、食管,使气管、食管移位。肿瘤局部侵犯重时可出现声音嘶哑、吞咽困难或交感神经受压引起霍纳综合征(Horner syndrome),侵犯颈丛可出现耳、枕、肩等处疼痛等症状。颈淋巴结转移引起的颈部肿块在未分化癌发生较早。髓样癌由于肿瘤本身可产生降钙素和5-羟色胺,可引起腹泻、心悸、面色潮红等症状。2.体征甲状腺癌体征主要为甲状腺肿大或结节,结节形状不规则、与周围组织粘连固定,并逐渐增大,质地硬,边界不清,初起可随吞咽运动上下移动,后期多不能移动。若伴颈部淋巴结转移,可触诊颈部淋巴结肿大。3.侵犯和转移(1)局部侵犯:甲状腺癌局部可侵犯喉返神经、气管、食管、环状软骨及喉,甚至可向椎前组织侵犯,向外侧可侵犯至颈鞘内的颈内静脉、迷走神经或颈总动脉。(2)区域淋巴结转移:PTC易早期发生区域淋巴转移,大部分PTC患者在确诊时已存在颈淋巴转移。PTC 淋巴结转移常见原发灶同侧、沿淋巴引流路径逐站转移,其淋巴引流一般首先至气管旁淋巴结,然后引流至颈静脉链淋巴结(Ⅱ~Ⅳ区)和颈后区淋巴结(Ⅴ区),或沿气管旁向下至上纵隔(Ⅶ区)。Ⅵ区为最常见转移部位,随后依次为颈Ⅲ、Ⅳ、Ⅱ、Ⅴ区。同时,PTC 淋巴结转移以多区转移为主,仅单区转移较少见。Ⅰ区淋巴转移少见(<3%)。少见的淋巴结转移部位有咽后或咽旁淋巴结(3)远处转移:肺部是甲状腺癌常见的远处转移器官,甲状腺癌也可出现骨转移和颅内转移。分化型甲状腺癌较未分化甲状腺癌或分化差的甲状腺出现远处器官转移的可能性低。4.常见并发症大部分的甲状腺癌是分化型甲状腺癌,生长相对较缓慢,极少引起并发症。MTC因分泌降钙素和5-羟色胺,可引起患者顽固性腹泻,从而引起电解质紊乱。未分化癌生长迅速,可引起重度呼吸困难等并发症。(三)实验室检查1.实验室常规检查甲状腺癌实验室常规检查的目的是了解患者的一般状况以及是否适于采取相应的治疗措施,包括血常规、肝肾功能等其他必要的实验室检查。如需进行有创检查或手术治疗的患者,还需要进行凝血功能等检查。甲状腺癌患者通常可伴有钙、磷和镁等离子的代谢异常,血清钙磷镁水平测定,有助于甲状腺功能的评估。对需要将促甲状腺激素(thyroid stimulating hormone,TSH)抑制到低于TSH正常参考范围下限的DTC患者(特别是绝经后妇女),根据医疗条件酌情评估治疗前基础骨矿化状态并定期监测;可选用血清钙/磷、24小时尿钙/磷、骨转换生化标志物测定。2.甲状腺激素、甲状腺自身抗体及肿瘤标志物检查(1)甲状腺激素检测:包括血液中四碘甲状腺原氨酸(甲状腺素,thyroxine,T4),三碘甲状腺原氨酸(triiodothyronine,T3),游离T4(free thyroxine,FT4)和游离T3(free triiodothyronine,FT3)以及TSH的测定。TSH检测是明确甲状腺功能的重要初筛试验,临床普遍将TSH作为判断甲状腺功能紊乱的首要依据。所有甲状腺结节患者,特别是甲状腺癌高度疑似或确诊患者均应检测血清TSH水平。在需要应用甲状腺核素显像鉴别诊断甲状腺结节良恶性时,血清TSH水平降低是重要的指征之一。在进行TSH抑制治疗的甲状腺癌患者中,也需要定期检测血甲状腺激素水平,并根据检测结果调整左甲状腺素(levo-thyroxine,L-T4),L-T4最终剂量的确定有赖于血清TSH的监测。(2)甲状腺自身抗体检测:自身免疫性甲状腺疾病相关的自身抗体主要有抗甲状腺球蛋白抗体(anti-thyroglobulin antibodies,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibodies,TPOAb)和TSH受体抗体(thyrotropin receptor antibody,TRAb)。在DTC患者中,TgAb是血清甲状腺球蛋白(thyroglobulin,Tg)的一个重要的辅助实验。血清Tg水平还受到TgAb水平的影响,当TgAb存在时,会降低血清Tg的化学发光免疫分析方法检测值,影响通过Tg监测病情的准确性;因此,每次测定血清Tg时均应同时检测TgAb。甲状腺过氧化物酶(thyroid peroxidase,TPO)是甲状腺激素合成过程中的关键酶,TPOAb的出现通常早于甲状腺功能紊乱,参与桥本甲状腺炎和萎缩性甲状腺炎发病中的组织破坏过程,引起临床上甲状腺功能减退症状。TRAb检测结果阳性提示患者存在针对TSH受体的自身抗体。(3)甲状腺癌肿瘤标志物检测:包括甲状腺球蛋白(thyroglobulin,Tg),降钙素(calcitonin,Ct)和癌胚抗原(carcinoembryonic antigen,CEA)。Tg是甲状腺产生的特异性蛋白,但血清Tg测定对甲状腺疾病病因诊断缺乏特异性价值。因此,临床上一般不将血清Tg测定用于DTC的术前诊断。DTC患者治疗后的随访阶段,血清Tg变化是判别患者是否存在肿瘤残留或复发的重要指标,可将血清Tg用于监测DTC术后的复发和转移。还要根据DTC患者采取的手术方式和甲状腺组织的保留情况进行综合分析。对于已清除全部甲状腺的DTC患者,只要出现血清Tg升高就提示有分化型甲状腺癌复发或转移的可能,提示进一步检查。对于未完全切除甲状腺的DTC患者,仍然建议术后定期(每6个月)测定血清Tg,术后血清Tg水平呈持续升高趋势者,应考虑甲状腺组织或肿瘤生长,需结合颈部超声等其他检查进一步评估。DTC随访中的血清Tg测定包括基础Tg测定(TSH抑制状态下)和TSH刺激后(TSH >30mU/L)的Tg测定。为更准确地反映病情,可通过停用L-T4或应用重组人促甲状腺素(recombinant human thyrotropin,rhTSH)的方法,使血清TSH水平升高至>30mU/L,之后再行Tg检测,即TSH刺激后的Tg测定。停用L-T4和使用rhTSH后测得的Tg水平具有高度一致性。复发危险度中、高危DTC患者,随诊复查时可选用TSH刺激后的Tg。应注意,如果DTC细胞的分化程度低,不能合成和分泌Tg或产生的Tg有缺陷,也无法用Tg进行随访。对超声难以确定良恶性的甲状腺结节,可进行穿刺活检,测定穿刺针冲洗液(包括囊实性结节的囊液)的Tg水平,可有助于提高确诊率;对查体可触及的以及超声发现的可疑颈部淋巴结,淋巴结穿刺针冲洗液的Tg水平测定,可提高发现DTC转移的敏感度。MTC患者建议在治疗前同时检测血清Ct和CEA,并在治疗后定期监测血清水平变化,如果超过正常范围并持续增高,特别是当Ct ≥150 pg/ml时,应高度怀疑病情有进展或复发。血清Ct和CEA检测,有助于髓样癌患者的疗效评估和病情监测。(4)用于诊断的相关分子检测:经FNAB仍不能确定良恶性的甲状腺结节,可对穿刺标本进行某些甲状腺癌的分子标记物检测,如BRAF突变、Ras突变、RET/PTC重排等,有助于提高确诊率。检测术前穿刺标本的BRAF突变状况,还有助于甲状腺乳头状癌的诊断和临床预后预测,便于制订个体化的诊治方案。 (四)超声检查1.结节的良恶性鉴别超声检查操作简便、无创而廉价,高分辨率超声可检出甲状腺内直径>2 mm 的微小结节,清晰地显示其边界、形态及内部结构等信息,是甲状腺最常用且首选的影像学检查方法,推荐所有临床触诊或机会性筛查等方式发现甲状腺结节的患者均进行高分辨率颈部超声检查。颈部超声检查可证实甲状腺结节存在与否,应确定甲状腺结节的大小、数量、位置、囊实性、形状、边界、钙化、血供及与周围组织的关系,同时评估颈部有无异常淋巴结及其部位、大小、形态、血流和结构特点等。甲状腺结节恶性征象中特异性较高的为:微小钙化、边缘不规则、纵横比>1;其他恶性征象包括:实性低回声结节、晕圈缺如、甲状腺外侵犯、伴有颈部淋巴结异常超声征象等。颈部淋巴结异常征象主要包括:淋巴结内部出现微钙化、囊性变、高回声、周边血流,此外还包括淋巴结呈圆形、边界不规则或模糊、内部回声不均、淋巴门消失或皮髓质分界不清等。对甲状腺结节及淋巴结的鉴别能力与超声医师的临床经验相关。甲状腺影像报告和数据系统(TI-RADS)对甲状腺结节恶性程度进行评估,有助于规范甲状腺超声报告,建议在有条件的情况下采用,但目前TI-RADS分类并未统一,可参考表1标准。超声造影技术及超声弹性成像可作为超声诊断PTMC的补充手段,但不建议常规应用。表1 TI-RADS分类分类评价超声表现恶性风险0无结节弥漫性病变01阴性正常甲状腺(或术后)02良性囊性或实性为主,形态规则、边界清楚的良性结节03可能良性不典型的良性结节<5%4可疑恶性恶性征象:实质性、低回声或极低回声、微小钙化、边界模糊/微分叶、纵横比>15%~85%4a具有1种恶性征象5%~10%4b具有2种恶性征象10~50%4c具有3~4种恶性征象50%~85%5恶性超过4种恶性征象,尤其是有微钙化和微分叶者85%~100%6恶性经病理证实的恶性病变无2.超声引导下细针穿刺活检(US-FNAB)FNAB利用细针对甲状腺结节进行穿刺,从中获取细胞成分,通过细胞学诊断对目标病灶性质进行判断。US-FNAB可提高取材成功率和诊断准确率,同时有利于穿刺过程中对重要组织结构的保护及判断穿刺后有无血肿,推荐作为进一步确定甲状腺结节良恶性的诊断方法。FNAB可分为细针抽吸活检和无负压细针活检,临床工作中可酌情选择或联合使用。为提高FNAB的准确性,可采取下列方法:在同一结节的多个部位重复穿刺取材;在超声提示可疑征象的部分取材;在囊实性结节的实性部位取材,同时可进行囊液细胞学检查。(1)甲状腺结节US-FNAB的适应证:直径>1cm的甲状腺结节,US有恶性征象者,推荐进行US-FNAB;直径≤1cm的甲状腺结节,不推荐常规行穿刺活检,但若存在以下情况之一,可考虑超声引导下FNAB:US提示甲状腺结节有恶性征象;伴US所见颈部淋巴结异常;童年期有颈部放射线照射史或辐射污染接触史;有甲状腺癌家族史或甲状腺癌综合征病史;18F-FDG显像阳性;伴血清降钙素水平异常升高。(2)US-FNAB的排除指征:经甲状腺核素显像证实为有自主摄取功能的热结节;超声检查提示为纯囊性的结节。(3)甲状腺结节US-FNAB的禁忌证:具有出血倾向,出、凝血时间显著延长,凝血酶原活动度明显减低;穿刺针途径可能损伤邻近重要器官;长期服用抗凝药;频繁咳嗽、吞咽等难以配合者;拒绝有创检查者;穿刺部位感染,须处理后方可穿刺;女性行经期为相对禁忌证。3.随访中的超声检查对于未行手术治疗的患者超声随访中应注意原结节体积是否增大或出现前述恶性征象。结节体积增大指结节体积增大50%以上或至少有2条径线增加超过20%(且超过2mm),此时有FNAB的适应证;对于囊实性结节,应根据实性部分的生长情况决定是否进行FNAB。对于甲状腺术后患者随访中应注意扫查术床区是否存在实性占位及颈部淋巴结是否有恶性表现。超声对术床良性病变和复发病灶鉴别困难,对颈部淋巴结的评价同术前。术后可疑颈部淋巴结的穿刺指证:对于最小径>8mm且超声提示异常的淋巴结应行细针穿刺物洗脱液检查(FNA-Tg);对于<8 mm的淋巴结在没有增长或威胁到周围重要结构时可以不进行FNA或其他干预。(五)影像学检查1.电子计算机断层成像(CT)正常甲状腺含碘量高,与周围组织密度明显不同,CT平扫即可清楚显示甲状腺,注射对比剂后,对比度更加良好。CT扫描对评价甲状腺肿瘤的范围、与周围重要结构如气管、食管、颈动脉的关系及有无淋巴结转移有重要价值。由于甲状腺病变可侵入上纵隔或出现纵隔淋巴结肿大,故扫描范围应常规包括上纵隔。CT对中央组淋巴结、上纵隔组淋巴结和咽后组淋巴结观察具有优势,并可对胸骨后甲状腺病变、较大病变及其与周围结构的关系进行观察,可清晰显示各种形态大小的钙化灶,但对于最大径≤5 mm结节及弥漫性病变合并结节的患者观察欠佳。对于甲状腺再次手术的病例,了解残留甲状腺、评估病变与周围组织的关系及评价甲状腺局部及颈部的复发很有帮助。如无碘对比剂使用禁忌证,对于甲状腺病变应常规行增强扫描。薄层图像可以显示较小的病灶和清晰显示病变与周围组织、器官的关系。2.磁共振成像(MRI)组织分辨率高,可以多方位、多参数成像,可评价病变范围及与周围重要结构的关系。通过动态增强扫描、DWI等功能成像可对结节良、恶性进行评估。其不足在于对钙化不敏感,检查时间长,易受呼吸和吞咽动作影响,故甲状腺MRI检查不如超声及CT检查普及,目前在甲状腺的影像检查方面应用不多。3.正电子发射计算机断层成像(PET-CT)不推荐作为甲状腺癌诊断的常规检查方法,对于下列情况,有条件者可考虑使用:①DTC患者随访中出现Tg升高(>10ng/ml),且131I诊断性全身显像(Dx-WBS)阴性者查找转移灶;②MTC疗前分期以及术后出现降钙素升高时查找转移灶;③甲状腺未分化癌疗前分期和术后随访;④侵袭性或转移性DTC患者进行131I治疗前评估(表现为PET-CT代谢增高的病灶摄取碘能力差,难以从131I治疗中获益)。4.甲状腺癌功能代谢显像甲状腺癌功能代谢显像原理是利用甲状腺癌细胞对一些放射性显像药具有特殊的摄取浓聚机制,将这些显像物引入体内后可被甲状腺癌组织摄取和浓聚,应用显像仪器如SPECT或SPECT-CT、PET-CT进行扫描,获取病灶位置、形态、数量及代谢等信息进行定位、定性、定量分析。在进行131I治疗分化型甲状腺癌(DTC)之前,通常需要明确DTC患者术后残留甲状腺的大小和功能情况,一般会进行甲状腺显像。甲状腺显像原理是正常甲状腺组织具有选择性摄取和浓聚碘的能力,锝与碘属于同族元素,也能被甲状腺组织摄取和浓聚,只是99mTcO4-进入甲状腺细胞后不能进一步参加甲状腺激素合成。99mTcO4-物理半衰期短,发射140keV的γ射线,能量适中,甲状腺受辐射剂量小等,目前临床上多使用99mTcO4-进行甲状腺显像。(六)声带功能评估1.术前评估甲状腺癌患者术前因常规进行间接喉镜检查,评估双侧声带活动情况,若出现声带活动减弱甚至固定的征象,应高度怀疑肿瘤压迫或侵犯喉返神经,在术前做好相应的手术预案,并和患者充分沟通,告知有术后气管切开或气管造瘘的风险。如果术前间接喉镜检查不满意,可进行术前电子纤维喉镜或纤维支气管镜检查,评估双侧声带活动情况。此外,对于临床或影像学检查(如颈部CT)怀疑肿瘤紧邻或侵犯气管的患者,应进行术前纤维支气管镜检查,评估肿瘤是否侵透气管全层至气管腔内,以及侵犯范围大小,是否影响麻醉气管插管等,据此来制订相应的手术方案和麻醉方案。2.术后评估术中发现肿瘤侵犯喉返神经,或术中喉返神经检测提示喉返神经功能受影响,术后可行纤维电子喉镜评估声带运动恢复情况。因双侧喉返神经受侵犯而进行的术中气管造瘘或术后气管切开的患者,可进行喉镜的评估声带活动情况,决定拔除气管套管或进行气管造瘘修补的时机。(七)甲状腺癌细胞病理诊断规范 甲状腺癌的细胞病理诊断规范由甲状腺细针穿刺(fine needle aspiration,FNA) 的取材、制片和诊断报告等部分组成。1.FNA的取材甲状腺FNA的取材方法有触诊引导的FAN和超声引导的FNA两种。触诊引导的FNA仅适用于可触及的实性结节;对于不可触及的结节,囊实性结节或先前有过不满意的FNA的结节均应行超声引导下FNA。甲状腺FNA常用穿刺针的外径为22G~27G,对于纤维化明显的病灶可选择较粗的穿刺针,而对于血供丰富者可选较细的穿刺针。FNA操作时可以给少量负压或无负压运针,运针应多角度、快速进行。每个结节的进针次数1~3次,视针吸物的量而定。对于囊实性结节应有针对性的取实性区。2.FNA的制片细胞标本的制片技术包括常规涂片、液基制片和细胞块切片。常规涂片是最常用的制片方法,穿出的细胞直接涂在玻片上,潮干,酒精固定。如果穿出物为囊性液体,液基制片的方法会使囊液中的细胞富集,从而获得一张较常规涂片细胞量更为丰富的涂片。对于临床怀疑是甲状腺少见类型的肿瘤,如髓样癌、未分化癌、转移性癌等最好加做细胞块,以便于行免疫细胞化学检测。常规涂片与液基制片联合应用可提高诊断的准确性,有条件的单位还可开展细胞标本的现场评估,以提高取材的满意率。3.细胞病理学诊断报告细胞病理学诊断报告采用TBSRTC(The Bethesda System for Reporting Thyroid Cytopathology)报告系统,在此报告系统中,细胞学诊断分为六级:I级,不能诊断/不满意;Ⅱ级,良性;Ⅲ级,意义不明的非典型细胞/意义不明的滤泡性病变;Ⅳ级,滤泡性肿瘤/可疑滤泡性肿瘤;Ⅴ级,可疑恶性和Ⅵ级,恶性(表2)。不同细胞学诊断分级的患者其恶性风险不同,临床管理措施也不同(表3)。表2 甲状腺TBSRTC报告系统Ⅰ 不能诊断/不满意囊液标本上皮细胞量少其他(如血多遮挡细胞、细胞过度干燥等)Ⅱ 良性符合良性滤泡结节(包括腺瘤样结节和胶质结节等)符合桥本甲状腺炎符合亚急性甲状腺炎Ⅲ 意义不明的非典型细胞/意义不明的滤泡性病变Ⅳ 滤泡性肿瘤/可疑滤泡性肿瘤如果是嗜酸细胞肿瘤,则请注明Ⅴ 可疑恶性可疑甲状腺乳头状癌可疑甲状腺髓样癌可疑转移性癌可疑淋巴瘤Ⅵ 恶性甲状腺乳头状癌甲状腺低分化癌甲状腺髓样癌甲状腺未分化癌鳞状细胞癌混合成分的癌(注明具体成分)转移性恶性肿瘤非霍奇金淋巴瘤其他表3 甲状腺TBSRTC各诊断分级的恶性风险及临床管理诊断分级恶性风险临床管理不能诊断/不满意5%~10%重复FNA(超声引导下)良性0~3%随诊意义不明的非典型细胞/意义不明的滤泡性病变10%~30%重复FNA/分子检测/手术滤泡性肿瘤/可疑滤泡性肿瘤25%~40%分子检测/手术可疑恶性50%~75%手术恶性97%~99%手术(八)甲状腺癌组织病理诊断规范1.重要性及目的不同的甲状腺肿瘤病理类型,其生物学行为也会区别较大,从良性的甲状腺腺瘤、交界性甲状腺滤泡性肿瘤到甲状腺癌,对患者的预后、治疗都会有很重要的影响,甲状腺癌的淋巴结转移情况同样对患者治疗策略具有重要意义。为了更好地为临床医师提供为患者制订更加精准的随诊、治疗方案的依据,让不同级别的医院、不同的病理医师能够站在相同的平台进行患者诊治的交流,规范的甲状腺组织病理诊断十分重要。2.术前穿刺病理诊断术前超声定位粗针穿刺,可以收集肿瘤组织送检组织病理学诊断,在标本充足,形态典型的情况下可以明确诊断。由于FNA在甲状腺癌诊断中具有明显优势,组织学穿刺一般不作为常规,在部分可疑少见类型的病例可作为补充使用。3.术中冰冻病理诊断目的是对术前未做穿刺病理诊断或病理诊断不明确的甲状腺结节定性,对淋巴结有无转移进行明确,以决定甲状腺切除的术式或淋巴结清扫的范围。送检冰冻注意事项如下。甲状腺:(1)标本离体后不加任何固定液尽快送往病理科。(2)如果肿瘤结节<5mm,在肿瘤处做标记(如切开或系缝线)。(3)甲状腺交界性肿瘤、甲状腺滤泡癌的诊断需术后对标本进行整体观察,充分取材后确诊。(4)冰冻石蜡不符情况需在术前或冰冻前作为知情同意告知患者及家属,并签字。淋巴结:(1)单独送检,以增加送检分区的目的性和病理诊断的准确性,避免漏诊。(2)离体后尽快送检,保持标本新鲜,放至透明塑料小袋或标本盒中,做好密封,送至病理科。(3)过小标本不能在体外放置过久,避免干硬,造成无法冰冻制片或显微镜下无法准确观察。(4)如果病理显微镜下发现淋巴结内有砂粒体,应该进行连续切片,寻找有无转移的证据。(5)淋巴结术中冰冻阴性,而术后石蜡深切出现转移癌的情况并不少见,需在术前或冰冻前作为知情同意告知患者及家属,并签字。4.术后石蜡病理诊断取材注意事项(1)垂直于长轴行2~3mm平行切开。(2)仔细检查,注意微小癌或结节。(3)对多发病灶,如怀疑恶性,每个病灶均应取材。(4)怀疑为包膜内或微小侵袭性滤泡癌病例,肿瘤结节被膜全部取材。(5)注意肿物与被膜的关系。(6)注意检查甲状腺周围组织(带状肌、淋巴结或甲状旁腺)。诊断规范:即病理报告中应包含的内容。(1)病理类型、亚型、病灶数目。(2)纤维化及钙化情况。(3)有无脉管及神经侵犯(近被膜处小神经侵犯还是喉返神经分支)。(4)甲状腺被膜受累情况。(5)带状肌侵犯情况。(6)周围甲状腺有无慢性淋巴细胞性甲状腺炎、结节性甲状腺肿、腺瘤样改变等。(7)淋巴结转移情况+淋巴结被膜外受侵情况。(8)pTNM分期(AJCC第8版)。(9)必要的免疫组化。(九)鉴别诊断1.甲状腺腺瘤:本病多见于20~30岁年轻人,多为单结节,边界清,表面光滑,生长缓慢,突然增大常为囊内出血,无颈淋巴结转移和远处转移。2.结节性甲状腺肿:多见于中年以上妇女,病变可长达数年至数十年,常累及双侧甲状腺,为多结节,大小不一,病程长者可有囊性变,肿物巨大可出现压迫气管,使气管移位,并有不同程度的呼吸困难的表现;当肿瘤压迫食管,会出现吞咽困难的表现。可发生癌变,肿物增大明显加快。3.亚急性甲状腺炎:常认为是由病毒感染引起,病期数周或数月,发病前常有呼吸道感染的病史,可伴有轻度发热,局部有疼痛,以吞咽时明显,可放射到耳部,甲状腺弥漫性增大,也可出现不对称的结节样肿物,肿物有压痛。本病为自限性疾病,约经数周的病程可自愈。少数患者需手术以排除甲状腺癌。4.慢性淋巴细胞性甲状腺炎(又称桥本甲状腺炎):为慢性进行性双侧甲状腺肿大,有时与甲状腺癌难以区别,一般无自觉症状,自身抗体滴度升高。本病对肾上腺皮质激素较敏感,有时需要手术治疗,少量X线治疗效果好。5.纤维性甲状腺炎:甲状腺普遍增大,质硬如木,但常保持甲状腺原来的外形。常与周围组织固定并产生压迫症状,常与癌难以鉴别。可手术探查,并切除峡部,以缓解或预防压迫症状。三、甲状腺癌的诊断:分类和分期(一)甲状腺癌的组织学分类根据世界卫生组织(World Health Organization,WHO)的定义,甲状腺肿瘤的组织学分类主要分为:原发性上皮肿瘤、原发性非上皮肿瘤与继发性肿瘤。甲状腺肿瘤的分类I.原发性上皮肿瘤A.滤泡上皮肿瘤良性:滤泡性腺瘤。恶性:甲状腺癌。①分化型甲状腺癌:乳头状癌(PTC)、滤泡状癌(FTC)、分化差癌 ;②未分化癌(ATC)。B.C细胞肿瘤(MTC)C.滤泡上皮与C细胞混合性肿瘤Ⅱ.原发性非上皮肿瘤A.恶性淋巴瘤B.肉瘤C.其他Ⅲ.继发性肿瘤约95%的甲状腺肿瘤来源于甲状腺滤泡细胞,其余的多来源于C细胞(甲状腺滤泡旁细胞)。滤泡上皮与C细胞混合性肿瘤十分罕见,同时含有滤泡上皮来源与C细胞来源的肿瘤细胞,其在组织来源上是否作为一种独立的甲状腺肿瘤尚有争议。甲状腺恶性淋巴瘤是最常见的甲状腺非上皮来源肿瘤,可独立发生于甲状腺,亦可为全身淋巴系统肿瘤的一部分。甲状腺肉瘤、继发性甲状腺恶性肿瘤等在临床中较少见,多为零星个案报道。1.PTC及其亚型PTC亚型近年来较多被关注,最常见的是经典型和滤泡亚型。经典型约占PTC 50%左右,主要形态特征是乳头结构和核型改变,核分裂象罕见,砂砾样钙化较为常见,主要位于淋巴管或间质。文献报道20%~40%的病例会出现鳞状化生。常见淋巴管侵犯,血管侵犯不常见,但也可出现。免疫表型:乳头状癌TG、TTF1、PAX8及广谱CK阳性;CK20、CT及神经内分泌标记通常阴性。滤泡亚型主要以滤泡性生长方式为主,具有经典型PTC的核型。发生率占PTC的40%左右。PTC其他常见亚型包括弥漫硬化性、高细胞亚型和柱状细胞亚型等,一般认为预后较经典型和滤泡亚型差。(1)弥漫硬化型:多见于年轻女性患者,双侧或单侧甲状腺腺叶弥漫性增大受累,具有自身免疫性甲状腺炎的血清学特点。形态学特点见显著硬化,大量砂砾体,慢性淋巴细胞性甲状腺炎背景,肿瘤细胞巢常呈实性,伴广泛鳞状化生,容易侵犯甲状腺内淋巴管及甲状腺外组织。RET重排常见,而BARF突变罕见。约10%~15%的病例发生远处转移,最常见转移至肺。(2)高细胞亚型:主要组成细胞的高度是宽度的2~3倍,有丰富的嗜酸性胞质,具有经典型的核型特点。高细胞区域至少占30%。常见于年龄较大患者,侵袭性比经典型强,更容易发生甲状腺外侵犯及远处转移。大多数病例有BRAF突变(60%~95%)。(3)柱状细胞亚型:这种罕见亚型由假复层柱状细胞构成,缺乏经典型乳头状癌的核型。肿瘤细胞偶可显示核下空泡及透明胞质,类似于子宫内膜癌或肠型腺癌。免疫染色CDX2通常阳性。TTF1不同程度阳性。(4)筛状-桑葚样亚型:这种亚型被认为是甲状腺癌的一种独特亚型,可出现在散发性病例,也可以出现在家族性腺瘤性息肉病,几乎总是发生在女性。散发性病例通常为单灶,而家族性常为多灶。肿瘤通常是包膜内病变,具有筛状、滤泡、乳头、梁状、实性及桑葚样结构等混合的生长方式。包膜/血管侵犯常见。乳头通常被覆柱状形态的细胞,缺乏腔内胶质。核并非特别透明。免疫染色TTF1常斑驳阳性。TG局灶或弱阳性。B-catenin显示特征性核阳性。2.FTC及其亚型FTC是甲状腺滤泡细胞来源的恶性肿瘤,缺乏乳头状癌核型特征,有包膜或浸润性生长方式。发病率6%~10%。包含亚型:①滤泡癌,微小浸润型(仅包膜侵犯);②滤泡癌,包膜内血管浸润型;③滤泡癌,广泛浸润型。FTC淋巴结转移较PTC少见而易发生远处转移。Hürthle(嗜酸性)细胞肿瘤是一类通常有包膜的嗜酸细胞组成肿瘤,滤泡细胞来源,可归为FTC或独立成为一种类型,较为罕见。分为:Hürthle(嗜酸)细胞腺瘤和Hürthle(嗜酸)细胞癌。具有乳头状核特征的非浸润性滤泡性肿瘤(Non-invasive follicular thyroid neoplasm with papillary-like nuclear features,NIFTP)是一类界清或有包膜的、滤泡型生长方式的非浸润性肿瘤,肿瘤细胞具有乳头状癌核特征。3. MTC及其亚型MTC是甲状腺C细胞(滤泡旁细胞)来源的恶性肿瘤。发病率2%~3%,分为散发性和家族性,散发性约占全部髓样癌的70%,好发于50~60岁,家族性发病年龄轻,约占30%,是常染色体显性遗传疾病。多发性神经内分泌肿瘤(multiple endocrine neoplasia,MEN)2型,包括2A、2B和家族性髓样癌,目前家族性髓样癌被认为是MEN2A的疾病谱。血清降钙素的水平与肿瘤负荷相关,但也有<1%的病例为非分泌性的。血清CEA的检查是髓样癌随诊过程中的重要指标,尤其是在降钙素低水平时,更有意义。髓样癌的镜下特征多样,可以与甲状腺任意恶性肿瘤相似,典型结构为实性、分叶、管状或岛状。肿瘤细胞体积变化较大,可以是圆形、多角形、浆细胞样或梭形。细胞核低-中度异型,核分裂活性相对较低。亚型:根据细胞和结构特征分为不同类型,乳头型/假乳头型、滤泡型(管状/腺样)、梭形细胞型、巨细胞型、透明细胞型、嗜酸细胞型、黑色素型、鳞状亚型、副节瘤样型、血管肉瘤样型、小细胞型、包膜内甲状腺髓样癌等。免疫组化指标:髓样癌可以表达:降钙素、神经内分泌标记物(CD56、突触素、嗜铬素A)、TTF-1、PAX8和CEA等。不表达TG。4.甲状腺低分化癌和ATC甲状腺低分化癌是显示有限的滤泡细胞分化的甲状腺滤泡性肿瘤,在形态和生物学行为上介于分化型甲状腺癌(甲状腺乳头状癌及滤泡癌)和未分化型甲状腺癌之间。主要的组织学形态有岛状、梁状和实性,核分裂象易见,大片坏死可导致残留肿瘤细胞呈血管外皮瘤样聚集在血管周围,甲状腺低分化癌可以同时伴有不同比例的分化型癌成分,但有研究显示即使出现10%的甲状腺低分化癌成分也伴随着侵袭性行为和对预后的不良影响。甲状腺低分化癌的Ki-67指数通常在10-30%,BCL2、CyclinD1通常阳性,P53、P21和P27灶状阳性。鉴别诊断主要包括原发甲状腺髓样癌、甲状旁腺癌和转移到甲状腺的癌。ATC是由未分化的甲状腺滤泡细胞构成的高度侵袭性恶性肿瘤。患者典型症状为迅速增大、质硬、固定的颈部包块伴广泛侵犯周围组织,大约30%~40%患者伴有远处转移如肺、骨和脑。主要的组织学形态有肉瘤样、瘤巨细胞样和上皮样,以上形态可单独或不同比例混合出现,也可以出现灶状的鳞状分化或异源性分化;通常伴有坏死、多量的核分裂象和血管侵犯。免疫组化:TTF1和TG通常阴性,PAX8大概一半病例阳性,CK可以在上皮样分化区域阳性,LCA、肌源性标记和黑色素瘤标记等主要用于排除性诊断。鉴别诊断:其他类型高度恶性肿瘤如肌源性肉瘤、恶性黑色素瘤和大细胞淋巴瘤等。非滤泡和滤泡旁细胞来源的高度恶性的甲状腺原发肿瘤一般也归为ATC范畴,例如鳞状细胞癌、肉瘤、黏液表皮样癌等。(二)甲状腺癌的分期1.AJCC分期针对甲状腺癌的分期包括根据术前评估(病史、查体、辅助检查)确立的临床分期(cTNM)和根据术后病理的病理分期(pTNM),具体分期标准如下(AJCC 第8版)。甲状腺乳头状癌、滤泡癌、低分化癌、Hürthle细胞癌和未分化癌pTX:原发肿瘤不能评估pT0:无肿瘤证据pT1:肿瘤局限在甲状腺内,最大径≤2cmT1a 肿瘤最大径≤1cmT1b肿瘤最大径>1cm,≤2cmpT2:肿瘤2~4cmpT3:肿瘤>4cm,局限于甲状腺内或大体侵犯甲状腺外带状肌pT3a:肿瘤>4cm,局限于甲状腺内pT3b:大体侵犯甲状腺外带状肌,无论肿瘤大小带状肌包括:胸骨舌骨肌、胸骨甲状肌、甲状舌骨肌、肩胛舌骨肌pT4:大体侵犯甲状腺外带状肌外pT4a:侵犯喉、气管、食管、喉反神经及皮下软组织pT4b:侵犯椎前筋膜,或包裹颈动脉、纵隔血管甲状腺髓样癌pTX:原发肿瘤不能评估pT0:无肿瘤证据pT1:肿瘤局限在甲状腺内,最大径≤2cmT1a 肿瘤最大径≤1cmT1b肿瘤最大径>1cm,≤2cmpT2:肿瘤2~4cmpT3:肿瘤>4cm,局限于甲状腺内或大体侵犯甲状腺外带状肌pT3a:肿瘤>4cm,局限于甲状腺内pT3b:大体侵犯甲状腺外带状肌,无论肿瘤大小带状肌包括:胸骨舌骨肌、胸骨甲状肌、甲状舌骨肌、肩胛舌骨肌pT4:进展期病变pT4a:中度进展,任何大小的肿瘤,侵犯甲状腺外颈部周围器官和软组织,如喉、气管、食管、喉反神经及皮下软组织pT4b: 重度进展,任何大小的肿瘤,侵犯椎前筋膜,或包裹颈动脉、纵隔血管区域淋巴结:适用于所有甲状腺癌pN0:无淋巴结转移证据pN1:区域淋巴结转移pN1a:转移至Ⅵ、Ⅶ区(包括气管旁、气管前、喉前/Delphian或上纵隔)淋巴结,可以为单侧或双侧。pN1b:单侧、双侧或对侧颈淋巴结转移(包括Ⅰ、Ⅱ、Ⅲ、Ⅳ或Ⅴ区)淋巴结或咽后淋巴结转移。乳头状或滤泡状癌(分化型)年龄<55岁TNMⅠ期任何任何0Ⅱ期任何任何1年龄≥55岁Ⅰ期10/x020/x0Ⅱ期1~2103a~3b任何0Ⅲ期4a任何0ⅣA期4b任何0ⅣB期任何任何1髓样癌(所有年龄组)Ⅰ期100Ⅱ期2~300Ⅲ期1~31a0ⅣA4a任何01~31b0ⅣB期4b任何0ⅣC期任何任何1未分化癌(所有年龄组)ⅣA期1~3a0/x0ⅣB期1~3a103b~4任何0ⅣC期任何任何12.甲状腺癌的预后相关因素某种特定的肿瘤特点将影响肿瘤预后。可能最重要的因素是肿瘤的组织类型,原发肿瘤大小,局部浸润,坏死,血管浸润,BRAF突变,远处转移。(1)组织类型虽然典型乳头状癌患者的生存率很好,但肿瘤死亡率在特定的分化子类型之间有很大差别。分化好的肿瘤有包膜,约占乳头癌的10%,是良好预后的表现。预后不好与下面因素有关:①高细胞乳头状癌亚型,10年死亡率达25%。②柱状细胞乳头状癌亚型,增长迅速,死亡率高。③弥漫性硬化性亚型,整个甲状腺浸润。滤泡样变异性乳头状癌,特征是具有滤泡样结构、典型的乳头状细胞,在有包膜的情况下比起一般乳头状癌没有显示更坏的预后。滤泡状癌的典型特征是有包膜的孤立肿瘤,比乳头状癌更富有侵袭性。滤泡状癌通常有微滤泡结构,由于滤泡细胞浸润至包膜或血管而诊断为癌,浸润至血管者预后比浸润包膜者更差。大多数滤泡状癌侵袭性小,一般只轻度穿破包膜而不发生血管转移,这些病变与滤泡腺癌相似,发生远处转移或致死的可能性较小。通过FNA或冰冻切片无法鉴别滤泡腺瘤和低侵袭性滤泡状甲状腺癌,只能通过永久组织切片,看到滤泡细胞浸润包膜才能确诊。高侵袭性滤泡状甲状腺癌不是很常见,又是会在手术中发现其侵袭周围组织及血管。80%的高侵袭性的滤泡状甲状腺癌发生转移,导致20%的患者在被诊断后几年内死亡。预后差与诊断时患者年龄大,肿瘤分期高,肿瘤体积大密切相关。乳头癌与滤泡癌预后相似,如果肿瘤局限于甲状腺内,直径小于1.0cm,或微转移两者都有较好的预后。如果出现远处转移,高侵袭,则预后差。(2)原发肿瘤大小乳头状癌<1cm,命名为微小癌,通常为体检发现,致死率几乎为0。另外一些生物学行为较差小乳头癌的临床表现不同。例如,约20%的多发微小癌出现颈淋巴结转移;一些研究发现近60%的颈淋巴结转移来自多发的微小癌,这种肿瘤更可能出现远处转移。肿瘤<1.5cm乳头癌或滤泡癌发现远处转移可能性较小,而较大肿瘤30年内复发率为33%。<1.5cm乳头癌或滤泡癌30年死亡率为0.4%,而较大肿瘤(>1.5cm)为7%(P<0.01)。实事上肿瘤大小与预后、死亡率呈线性关系。(3)局部侵犯10%的分化甲状腺癌出现局部侵犯,造成局部器官功能不全,增加死亡率。局部入侵的肿瘤局部复发是没有入侵的2倍,33%有局部入侵的患者死亡。(4)淋巴结转移区域淋巴转移对预后作用有争议。一些学者认为发现区域淋巴结转移不影响复发和生存率。另外一些学者认为淋巴结转移是局部复发和癌相关死亡率的高危因素之一。淋巴转移与远处转移有一定相关性,尤其是那些双侧颈淋巴结转移,或穿破淋巴结包膜,或纵隔淋巴结转移。(5)远处转移对于乳头状癌和滤泡型癌来说远处转移是引起致死的主要原因。10%的乳头状癌、25%的滤泡型癌会出现远处转移,近50%的病例在诊断时即有远处转移。远处转移在霍斯勒细胞癌和年龄>40岁的患者中发现率更高(35%)。远处转移位置:在13个研究中报道的1231名出现远处转移的患者当中,肺转移(49%)、骨转移(25%)、肺和骨转移(15%)、中枢神经系统(CNS)或其他软组织转移(10%)。大病灶肺转移不浓聚131I和小结节转移在X线上可以发现,而131I不浓聚者预后差。3.分化型甲状腺癌的复发风险分层DTC疾病复发率风险分级系统,其根据术中病理特征如病灶残留、肿瘤大小与数目、病理亚型、包膜血管侵犯、淋巴结转移与外侵、术后刺激性Tg水平、分子病理特征等因素将患者复发风险分为低、中、高危3层(表4)。对于高危组DTC强烈建议术后行辅助治疗;中危组可行辅助治疗;低危组一般不行清甲治疗,但须行内分泌治疗。表4 DTC复发风险分层危险分层 临床病理特征低危 甲状腺乳头状癌(包括以下所有) 无区域淋巴结或远处转移 大体肿瘤无残留 肿瘤无外侵 非恶性程度高的组织学亚型 首次术后全身核素扫描未见甲状腺床外的摄碘灶 无血管侵犯 cN0或少于5个微小淋巴结转移(直径<0.2cm)滤泡状亚型乳头状癌,位于甲状腺内,未突破包膜;甲状腺乳头状微小癌,位于甲状腺内,单发或多发,包括BRAFV600E突变滤泡性甲状腺癌,位于甲状腺内,分化好,有包膜侵犯且无血管侵犯,或仅有微小血管侵犯中危 甲状腺周围组织的微小侵犯术后首次核素显像有颈部病灶摄碘恶性程度高的亚型(高细胞、柱状细胞、弥漫硬化等)伴有血管侵犯,cN1或5个以上淋巴结转移的pN1,转移淋巴结直径小于3cm多灶性甲状腺乳头状微小癌伴或不伴BRAFV600E突变高危 明显侵犯甲状腺周围软组织肿瘤残留远处转移术后血清Tg提示远处转移pN1且转移淋巴结大于3cm滤泡性甲状腺癌广泛浸润血管四、甲状腺癌的外科治疗和常见并发症(一)甲状腺癌的外科治疗1.治疗原则DTC的治疗以外科治疗为主,辅以术后内分泌治疗、放射性核素治疗,某些情况下需辅以放射治疗、靶向治疗。MTC以外科治疗为主,某些情况下需辅以放射治疗、靶向治疗。未分化癌的治疗,少数患者有手术机会,部分患者行放疗、化疗可能有一定效果,但总体来说预后很差、生存时间短。同时需要注意,肿瘤治疗的个体化很重要,每一个患者病情、诉求不同,临床诊治有一定灵活性。2.分化型甲状腺癌的外科治疗(1)原发灶的处理肿瘤T分级为T1、T2的病变,多局限于单侧腺叶,建议行患侧腺叶及峡部切除。对于部分有高危因素的患者,也可行全甲状腺切除。这些高危因素包括:多灶癌、淋巴结转移、远处转移、家族史、幼年电离辐射接触史等。一些考虑术后有必要行核素治疗的病例,也可行全甲状腺切除。对于位于峡部的肿瘤,肿瘤较小者可行扩大峡部切除,肿瘤较大或伴有淋巴结转移者可考虑全甲状腺切除。T3病变肿瘤较大或已侵犯甲状腺被膜外肌肉,建议行全甲状腺切除。但对于一些较靠近甲状腺被膜的病灶,其本身可能不大,但是已经侵犯被膜外组织,可以行患侧腺叶及峡部切除,同时切除受侵犯的被膜外组织。具体手术方案需权衡手术获益和风险。T4病变已经侵犯周围结构器官,一般建议全甲状腺切除。T4a病变在切除甲状腺的同时需要切除受累的部分结构器官,如部分喉(甚至全喉)、部分气管、下咽和部分食管等,并需要准备一定的修复方案。T4b病变一般认为属于不可手术切除,但需根据具体情况判断有无手术机会,可能需要血管外科、骨科、神经外科等多学科协作。但总体而言,T4b病变很难完全切净,预后不佳,手术风险较大,术后并发症较多。是否手术治疗需要仔细评估病情,重点考虑患者能否从手术中获益。有时,姑息性的减状治疗是必须的,例如气管切开缓解呼吸困难等。(2)区域淋巴结的处理中央区淋巴结(Ⅵ区):cN1a应清扫患侧中央区。如果为单侧病变,中央区清扫范围建议包括患侧气管食管沟及气管前。喉前区也是中央区清扫的一部分,但喉前淋巴结转移的病例不多见,可个体化处理。对于cN0的患者,如有高危因素(如T3~T4病变、多灶癌、家族史、幼年电离辐射接触史等),可考虑行中央区清扫。对于cN0低危患者(不伴有高危因素),可个体化处理。中央区清扫的范围,下界为无名动脉上缘水平,上界为舌骨水平,外侧界为颈总动脉内侧缘,包括气管前,所以内侧界为另一侧的气管边缘。清扫该区域内的所有淋巴脂肪组织。右侧需特别注意喉返神经所在水平深面的淋巴脂肪组织。需要注意保护喉返神经,同时尽可能保护甲状旁腺及其血供,如无法原位保留甲状旁腺则应行甲状旁腺自体移植。侧颈部淋巴结处理(Ⅰ~Ⅴ区):DTC侧颈部淋巴结转移最多见于患侧Ⅲ、Ⅳ区,其次为Ⅱ区、Ⅴ区、Ⅰ区较少见。侧颈淋巴结清扫建议行治疗性清扫,即术前评估或术中冰冻证实为N1b时行侧颈清扫。建议侧颈清扫的范围包括Ⅱ、Ⅲ、Ⅳ、ⅤB区,最小范围是ⅡA、Ⅲ、Ⅳ区。Ⅰ区不需要常规清扫。颈部分区示意图和各区的具体划分见图1和表5。咽旁淋巴结、上纵隔淋巴结等特殊部位淋巴结在影像学考虑有转移时建议同期手术切除。3. MTC的外科治疗对于MTC,建议行全甲状腺切除。如为腺叶切除后确诊的MTC,建议补充甲状腺全切除。个别情况下,偶然发现的微小病灶MTC腺叶切除后,也可考虑密切观察。MTC较易出现颈部淋巴结转移,大部分患者就诊时已伴有淋巴结转移,切除原发灶同时还需行颈部淋巴结清扫术(中央区或颈侧区),清扫范围除临床评估外,还需参考血清降钙素水平。MTC的手术治疗宜比DTC手术略激进一些,追求彻底切除。4.未分化癌外科治疗少数未分化癌患者就诊时肿瘤较小,可能有手术机会。多数未分化癌患者就诊时颈部肿物已较大,且病情进展迅速,无手术机会。肿瘤压迫气管引起呼吸困难时,尽可能减瘤后,行气管切开术。5.围手术期治疗甲状腺癌术后除常规补液之外,为减轻神经水肿,可给予地塞米松、神经营养类药物辅助治疗。全甲状腺切除的患者术后注意复查甲状旁腺素、血钙,有低钙症状者注意补充钙剂,能进食后及时给予口服维生素D及钙制剂。一侧喉返神经损伤的患者急性期常有进食进水呛咳,对于一些高龄患者有必要时可予鼻饲,以减少吸入性肺炎的发生。必要时在床旁置气管切开器械包备用。双侧喉返神经损伤的患者一般术中即行气管切开,带气管套管,术后注意气管切开口的护理。颈部淋巴结清扫的患者,术后注意颈肩部的功能锻炼。术后应根据病理分期及危险分层制订辅助治疗方案,并告知患者。(二)常见的术后并发症手术并发症是外科治疗疾病过程中发生的与手术相关的其他病症,这些病症有一定的发生概率,并不是可以完全避免的。1. 出血甲状腺癌术后出血的发生率1%~2%,多见于术后24小时以内。主要表现为引流量增多,呈血性,颈部肿胀,患者自觉呼吸困难。如果引流量>100ml/h,考虑存在活动性出血,应及时行清创止血术。患者出现呼吸窘迫时应首先控制气道,急诊情况下可床旁打开切口,首先缓解血肿对气管的压迫。甲状腺癌术后出血的危险因素包括合并高血压、患者服用抗凝药物或阿司匹林等。2.喉返神经损伤、喉上神经损伤甲状腺手术喉返神经损伤的发生概率文献报道为0.3%~15.4%。喉返神经损伤的常见原因有肿瘤粘连或侵犯神经、手术操作的原因等。如果肿瘤侵犯喉返神经,可根据情况行肿瘤削除或一并切除神经。如果切除神经,建议有条件时行一期神经移植或修复。一侧喉返神经损伤,术后同侧声带麻痹,出现声音嘶哑、饮水呛咳。手术操作本身可能损伤喉返神经,这种情况并不能完全避免。双侧喉返神经损伤,术后可出现呼吸困难,危及生命,手术同期应行气管切开术,保证气道通畅。喉上神经损伤,患者术后声音变低沉。术中处理甲状腺上动静脉时应注意紧贴甲状腺腺体精细解剖,可减少喉上神经损伤的概率。术中神经监测(intraoperative neuromonitoring,IONM)技术可帮助术中定位喉返神经,可在下标本后检测喉返神经的功能,如有神经损伤还可帮助定位损伤的节段。对二次手术、巨大甲状腺肿物等情况、术前已有一侧神经麻痹等情况,建议有条件时使用IONM。沿被膜精细解剖、术中显露喉返神经、合理应用能量器械、规范使用IONM可以减少神经损伤的概率。3.甲状旁腺功能减退术后永久性的发生率约2%~15%,多见于全甲状腺切除后。主要表现为术后低钙血症,患者出现手足发麻感、口周发麻感或手足搐搦,给予静脉滴注钙剂可缓解。对于暂时性甲状旁腺功能减退,可给予钙剂缓解症状,必要时加用骨化三醇。为减轻患者术后症状,可考虑预防性给药。永久性甲状旁腺功能减退者,需要终身补充钙剂及维生素D类药物。术中注意沿被膜的精细解剖,原位保留甲状旁腺时注意保护其血供,无法原位保留的甲状旁腺建议自体移植。一些染色技术可辅助术中辨别甲状旁腺,如纳米碳负显影等。4.感染甲状腺手术多为Ⅰ类切口,少部分涉及喉、气管、食管的为Ⅱ类切口。甲状腺术后切口感染的发生率约1%~2%。切口感染的危险因素包括癌症、糖尿病、免疫功能低下等。切口感染的表现包括发热、引流液浑浊、切口红肿渗液、皮温升高、局部疼痛伴压痛等。怀疑切口感染,应及时给予抗菌药物治疗,有脓肿积液的,应开放切口换药。浅表切口感染较易发现,深部切口感染常不易早期发现,可结合超声判断切口深部的积液。极少数患者可因感染引起颈部大血管破裂出血,危及生命。5.淋巴漏常见于颈部淋巴结清扫后,表现为引流量持续较多,每日可达500~1000ml,甚至更多,多呈乳白色不透明液,也称为乳糜漏。长时间淋巴漏可致容量下降、电解质紊乱、低蛋白血症等。出现淋巴漏后,应保持引流通畅。首先可采取保守治疗,一般需禁食,给予肠外营养,数日后引流液可由乳白色逐渐变为淡黄色清亮液体,引流量也会逐渐减少。如果保守治疗1~2周无明显效果或每日乳糜液>500ml,则应考虑手术探查和结扎。手术可选择颈部胸导管结扎、颈部转移组织瓣封堵漏口,或者选择胸腔镜下结扎胸导管。6.局部积液(血清肿)甲状腺术后局部积液的发生率约1%~6%。手术范围越大其发生概率越高,主要与术后残留死腔相关。术区留置引流管有助于减少局部积液形成。治疗包括密切观察、多次针吸积液以及负压引流。7.其他少见并发症甲状腺手术还可引起一些其他的并发症,但是发生率低,如气胸(颈根部手术致胸膜破裂引起)、霍纳综合征(颈部交感神经链损伤)、舌下神经损伤引起伸舌偏斜、面神经下颌缘支损伤引起口角歪斜等。图1 颈部淋巴结分区表5颈部淋巴结分区解剖分界分区解剖分界上界下界前界(内侧界)后界(外侧界)IA下颌骨联合舌骨对侧二腹肌前腹同侧二腹肌前腹IB下颌骨二腹肌后腹二腹肌前腹茎突舌骨肌IIA颅底舌骨水下缘平茎突舌骨肌副神经平面IIB副神经平面胸锁乳突肌后缘III舌骨下缘水平环状软骨下缘水平胸骨舌骨肌外缘胸锁乳突肌后缘IV环状软骨下缘水平锁骨VA胸锁乳突肌与斜方肌交汇顶点环状软骨下缘水平胸锁乳突肌后缘斜方肌前缘VB环状软骨下缘水平锁骨VI舌骨胸骨柄上缘对侧颈总动脉同侧颈总动脉VII胸骨柄上缘无名动脉上缘颈总动脉(左)无名动脉五、分化型甲状腺癌的131I 治疗(一)DTC术后死亡危险分层及复发危险分层2009年ATA指南首次提出复发风险分层的概念,并于《2015ATA指南》进行了更新。该复发风险分层以术中病理特征如病灶残留程度、肿瘤大小、病理亚型、包膜侵犯、血管侵犯程度、淋巴结转移特征、分子病理特征及术后刺激性Tg(sTg)水平和131I治疗后全身显像(Rx-WBS)等权重因素将患者的复发风险分为低、中、高危3层。利用这一分层系统指导是否对DTC患者进行131I治疗。1.低风险分层PTC:符合以下全部。(1)无远处转移。(2)所有肉眼所见肿瘤均被彻底切除。(3)肿瘤未侵犯周围组织。(4)肿瘤不是侵袭性的组织学亚型及未侵犯血管。(5)若行131I治疗后全身显像,未见甲状腺床外摄碘转移灶显影。(6)合并少量淋巴结转移(如cN0,但是病理检査发现≤5枚微小转移淋巴结,即转移灶最大直径均≤0.2cm)。(7)甲状腺内的滤泡亚型甲状腺乳头状癌;甲状腺内的分化型甲状腺滤泡癌合并被膜侵犯及伴或不伴轻微血管侵犯(<4处);甲状腺内微小乳头状癌不论是否多灶、是否伴有BRAFV600E突变阳性,都属于低风险分层。2.中风险分层 符合以下任1项。(1)镜下见肿瘤侵犯甲状腺外软组织。(2)侵袭性组织学表现(如高细胞、靴钉样、柱状细胞癌等)。(3)伴血管侵犯的甲状腺乳头状癌。(4)若行131I治疗后全身显像,可见颈部摄碘转移灶显影。(5)淋巴结转移(cN1,病理检査发现>5枚转移淋巴结,转移灶最大直径均<3cm)。(6)BRAFV600E突变阳性的甲状腺腺内乳头状癌(直径1~4 cm)。(7)BRAFV600E突变阳性的多灶的甲状腺微小癌合并腺外浸润。3. 高风险分层 符合以下任1项。(1)明显的腺外浸润。(2)癌肿未完整切除。(3)证实存在远处转移。(4)术后高Tg水平提示远处转移者。(5)合并较大淋巴结转移(任何淋巴结转移灶直径≥3cm)。(6)甲状腺滤泡癌广泛侵犯血管(>4处血管侵犯)。(二)131I治疗指征1.《2015ATA指南》对高危复发危险分层患者强烈推荐131I治疗。2.对中危分层患者可考虑131I治疗,但其中有镜下甲状腺外侵犯但癌灶较小或淋巴结转移个数少、受累直径小且不伴高侵袭性组织亚型或血管侵犯等危险因素的中危患者经131I治疗后未能改善总体预后,可不行131I治疗。3.对低危分层患者,不推荐行131I治疗。4.《2015ATA指南》对低危人群中淋巴结受累≤5 个(无节外侵犯、累及<0.2 cm)者,已不再推荐行131I治疗。但若从便于通过监测血清Tg水平及131I全身显像后续随访的角度来看,可行131I清甲治疗。(三)131I治疗禁忌证1.妊娠期或哺乳期妇女2.计划6个月内妊娠者。(四)131I清甲治疗剂量1.推荐采用 30mCi进行中、低危患者的清甲治疗。2.对于伴有可疑或已证实的镜下残存病灶或高侵袭性组织学亚型(高细胞型、柱状细胞型等)但无远处转移的中、高危患者,推荐131I辅助治疗剂量为150mCi。3.对于甲状腺未近全切术后,需要清灶治疗的患者,考虑使用较高剂量的131I。4.颈部残留手术未切除的DTC组织、伴发颈部淋巴结或远处转移,但无法手术或患者拒绝手术的、全甲状腺切除术后不明原因血清Tg尤其是刺激性Tg水平升高者,清甲治疗同时应兼顾清灶治疗,131I剂量为100~200mCi。对于青少年、育龄妇女、高龄患者和肾脏功能轻中度受损的患者,可酌情减少131I剂量。(五)TSH抑制治疗的目标1.对于高危患者,初始TSH应控制在<0.1 mU/L。2.对于中危患者,初始TSH应控制在0.1~0.5 mU/L。3.对于未检出血清Tg的低危患者,不论是否已行131I清甲治疗,TSH应控制在0.5~2 mU/L。4.对于已行131I清甲治疗并且低水平Tg的低危患者,或未行131I清甲治疗、Tg水平稍高的低危患者,TSH应控制在0.1~0.5 mU/L。5. 对于腺叶切除患者,TSH应控制在0.5~2 mU/L。6.对于影像学疗效不满意(SIR)的患者,在没有特殊禁忌证的情况下,TSH应无限期控制在<0.1 mU/L。7. 对于血清学疗效不满意(BIR)的患者,根据初始ATA危险分层、Tg水平、Tg变化趋势以及TSH抑制治疗的不良反应,应控制TSH在0.1~0.5 mU/L。8. 对于初始评为高危,但治疗反应为满意(临床或血清学无病状态)或疗效不明确的患者,TSH控制在0.1~0.5 mU/L最多5年,并随后降低TSH抑制程度 。9.对于治疗反应为满意(临床或血清学无病状态)或疗效不明确的患者,特别是复发危险为低危者,TSH控制在0.5~2 mU/L。10.对于未行131I清甲治疗或辅助治疗并且为疗效满意或疗效不明确的患者,满足颈部超声阴性,抑制性Tg较低或未检出,并且Tg或TgAb未呈增高趋势,TSH控制在0.5~2 mU/L。(六)局部或远处转移患者的应用131I清灶治疗的原则1.对于无法手术切除的摄碘病灶推荐131I治疗。最大耐受剂量上限为150mCi。2.对于肺转移的治疗,病灶仍摄取碘并出现临床有效,每隔6~12个月再次施行治疗。经验性治疗剂量推荐为 100~200mCi,对于70岁以上患者的剂量为100~150mCi。3.对于骨转移灶,剂量为100~200mCi。4.中枢神经系统转移都应当首先考虑外科手术或立体定向外照射。(七)Tg阳性131I全身扫描阴性患者的治疗原则1.对于停服 L-T4 所致的sTg<10ng/ml或应用rhTSH所致的sTg<5 ng/ml的患者,续行TSH抑制治疗,并密切随访,但若血清Tg逐渐升高或存在疾病进展(PD)的其他证据,可行131I经验性治疗。2.对于停服L-T4所致的sTg>10ng/ml或应用rhTSH所致的sTg>5ng/ml,Tg或TgAb水平持续升高,并且颈部、胸部影像学、18F-FDG PET-CT阴性的患者,可行131I经验性治疗,剂量100~200mCi。但若Rx-WBS仍为阴性,则将其归为碘难治性DTC的范畴,需终止131I治疗。六、甲状腺癌的放射治疗甲状腺癌对放射治疗敏感性差,单纯放射治疗对甲状腺癌的治疗并无好处,外照射放疗仅在很小一部分患者中使用。放射治疗原则上应配合手术使用,主要为术后放射治疗。具体实施应根据手术切除情况、病理类型、病变范围、年龄等因素而定。1.对恶性程度较低的癌如分化好的乳头状癌或滤泡癌仅在无法再次手术切除时才考虑介入。2.当肿瘤累及较重要的部位如气管壁、气管食管沟、喉、动脉壁或静脉内有瘤栓等而手术又无法切除干净,且131I治疗又因残存较大无明显效果时才可考虑术后放射治疗。3.对年轻患者,病理类型一般分化较好,即使出现复发转移也可带瘤长期存活,且131I治疗和再次手术都为有效的治疗手段,应慎用外照射。4.对分化差的癌或未分化癌,如手术后有残留或广泛淋巴结转移,应及时给予大范围的术后放射治疗,以尽可能地降低局部复发率,改善预后。(一)放射治疗指征1.高分化的乳头状腺癌和滤泡状腺癌目前国际上广泛采取的外照射的指征见图2。图2. DTC的放疗指征中国医学科学院肿瘤医院放疗科外照射的指征包括:①肿瘤肉眼残存明显而且不能手术切除,单纯依靠放射性核素治疗不能控制者;②术后残存或复发病灶不吸碘者。2.髓样癌外照射治疗:对手术不能全切,或是复发的患者,是否应该进行外照射尚缺乏有力的证据,但是通常认为外照射有助于这些患者的局部控制图3 髓样癌的放疗指征3.未分化癌(ATC)综合治疗是主要的治疗方式,而且要根据患者的具体情况,进行个体化的治疗。外照射治疗:放疗可作为术前、术后综合治疗的一部分发挥作用。也可以采用单纯放疗,可行高剂量放疗(推荐剂量高达60Gy)4.甲状腺癌远处转移病灶姑息放疗甲状腺癌出现远处转移病灶如肺、肝、骨、脑且伴有临床症状,可以考虑手术/RAI联合EBRT/SBRT,以减轻症状,减缓肿瘤进展。(二)外照射技术1.放疗前应详细检查以明确肿瘤的具体清况,为靶区的制定作准备(1)对出现声嘶、吞咽困难、喘鸣者表明肿瘤已侵出甲状腺体范围而达喉返神经、食管、气管等。(2)颈部详细检查有无肿大淋巴结以确定有无区域性淋巴结转移。(3)间接喉镜检查以明确有无声带麻痹而肯定是否有喉返神经受侵。(4)颈部超声、CT可用于明确肿瘤具体侵犯范围及颈部淋巴结肿大情况;X线胸片,腹部超声、骨扫描应常规检查以除外远地转移的可能。(5)术后放疗者应详细了解手术情况、术后有无残留及术后病理结果。2.照射剂量甲状腺外照射剂量通常分为大分割方案和常规分割放疗方案。按常规剂量分割方式:分次剂量200cGy,每日1次,每周5次,大野照射5000cGy,然后缩野针对残留区加量至6000~7000cGy,注意脊髓量勿超过耐受量。美国头颈学会(American Head and Neck Society,AHNS)的治疗剂量指南:对于有肉眼残留的病灶,通常给予70Gy,对于镜下残留或者肿瘤经手术剔除的区域66Gy,高危微小病灶残留区域(包括甲状腺床、气管食管沟、Ⅵ区淋巴结引流区)60Gy,低危为小病灶区域(包括未受侵的Ⅲ~Ⅴ区、上纵隔淋巴结)54~56Gy。部分研究显示对于分化型甲状腺癌,可采用大分割方式,单次剂量2.5~3.0Gy,可以获得更好的局部控制。这个结论尚需进一步的研究证实。3.外照射的并发症急性并发症:1~2度的反应较常见,约在80%以上,包括咽炎、黏膜炎、口干、味觉改变、吞咽困难、吞咽疼痛、放射性皮炎等。3度以上的反应少见,咽炎的发生率最高(<10%),其余反应<5%。晚期并发症:包括皮肤肌肉纤维化,食管气管狭窄,咽部狭窄导致吞咽困难,颈内动脉硬化,第二原发癌等。七、甲状腺癌的全身治疗内科治疗对部分对放射性碘治疗不敏感并出现远处转移患者和甲状腺未分化癌有效。化疗对分化型甲状腺癌疗效差,靶向治疗更为重要;而对甲状腺未分化癌主要的内科治疗是化疗。(一)分子靶向治疗1.分化型甲状腺癌存在血管内皮生长因子(VEGF)及其受体(VEGFR)的高表达和诸如RET异位、BRAFV600E突变、RAS点突变等变异。作用于这些靶点的多激酶抑制剂可延长中位无进展生存期,并使部分患者的肿瘤缩小。2.对于进展较迅速,有症状的晚期放射性碘难治性分化型甲状腺癌(乳头状癌、滤泡状癌和Hürthle细胞癌)患者,可考虑使用多激酶抑制剂索拉非尼。索拉非尼在我国获批的适应证是:局部复发或转移的进展性的放射性碘难治性(RAI)分化型甲状腺癌。3.对于进展较迅速,有症状的晚期甲状腺髓样癌患者,国外指南推荐vandetanib和cabozantinib。(二)化学治疗对于ⅣA期和ⅣB期甲状腺未分化癌,可考虑在放疗基础上加用化疗。化疗可以与放疗同步使用,也可在放疗后辅助性给予。使用的药物包括紫杉类、蒽环类和铂类,具体方案见表6。同步化放疗时,化疗方案推荐采用每周方案。对于ⅣC期甲状腺未分化癌,可考虑给予全身化疗。推荐用于ⅣC期甲状腺未分化癌的方案包括紫杉醇联合铂类、多西紫杉醇联合多柔比星、紫杉醇单药、多柔比星单药。具体方案见表7。表6 用于ⅣA期和ⅣB期甲状腺癌未分化癌辅助化疗或同步化放疗的化疗方案方案药物/剂量频度紫杉醇/卡铂紫杉醇 50 mg/m2,卡铂 AUC 2 mg/m2静脉注射每周多西他赛/多柔比星多西他赛 60 mg/m2静脉注射,多柔比星 60 mg/m2静脉注射(须聚乙二醇化非格司亭支持)每3~4 周多西他赛/多柔比星多西他赛 20 mg/m2静脉注射,多柔比星 20 mg/m2 静脉注射每周紫杉醇30~60 mg/m2静脉注射每周顺铂25 mg/m2静脉注射每周多柔比星60mg/m2静脉注射每3周多柔比星20 mg/m2静脉注射每周表7. 用于IVC期甲状腺未分化癌的化疗方案方案药物/剂量频度紫杉醇/卡铂紫杉醇 60~100 mg/m2,卡铂 AUC 2 mg/m2静脉注射每周紫杉醇/卡铂紫杉醇 135~175 mg/m2,卡铂 AUC 5~6 mg/m2静脉注射每3~4 周多西他赛/多柔比星多西他赛 60 mg/m2静脉注射,多柔比星 60 mg/m2静脉注射(聚乙二醇化非格司亭支持)每3~4 周多西他赛/多柔比星多西他赛 20 mg/m2静脉注射,多柔比星 20 mg/m2 静脉注射每周紫杉醇60~90 mg/m2静脉注射每周紫杉醇135~200 mg/m2静脉注射每3~4 周多柔比星60~75 mg/m2静脉注射每3周多柔比星20 mg/m2静脉注射每周八、甲状腺癌的中医中药治疗甲状腺癌在中医学中属瘿瘤范畴,现代研究结合古代医家对本病的认识,都认为情志因素是本病发病的主要原因,此外还与虚、痰、瘀、热、毒、饮食关系密切,临床常见虚实兼杂,多因素相杂共同致病。(一)辨证论治目前,中医在治疗甲状腺癌方面一是配合手术、化疗、放疗,减轻化疗、放疗以及术后的负荷,在减轻不良反应、提高体力、改善食欲、抑制肿瘤发展、控制病情等方面起到辅助治疗及终末期支持治疗作用;二是作为不接受手术和放化疗患者的主要治疗手段。适应人群:围手术期、放化疗、靶向治疗期间、治疗后恢复期及晚期患者。治疗方法:口服汤药,中药制剂,中成药,其他中医疗法(外敷、针灸等)。(二)治疗方案1.正气亏虚常见于先天身体虚弱或手术、放化疗后损伤正气。代表方剂:八珍汤、当归补血汤、十全大补汤、补中益气汤加减。2.阴虚火旺常见于放疗后或素体不足。代表方剂:知柏地黄丸加减。3.肝肾不足常见于放化疗后骨髓抑制或素体不足。代表方剂:六味地黄丸加减。4.肝郁气滞代表方剂:海藻玉壶汤或半夏厚朴汤加减。5.寒痰凝滞代表方剂:阳和汤合半夏消瘰丸加减。6.毒瘀互结代表方剂:西黄丸或小金丹加减。九、甲状腺癌多学科综合治疗模式和随访(一)甲状腺癌的多学科综合治疗模式甲状腺癌尤其是分化型甲状腺癌(DTC)预后良好,死亡率较低,有较长的生存期。一般需要多学科规范化的综合诊治过程,包括外科、病理科、影像诊断科、核医学科、放疗科、内分泌科、肿瘤内科等,针对不同的患者或者同一患者的不同治疗阶段应实施个体化精准治疗。甲状腺癌的治疗、随访过程中应以外科为主导。根据患者不同病情与核医学科、内分泌科、放疗科、肿瘤内科等共同协商制订个体化的综合治疗方案。1.对于低危分化型甲状腺癌患者,外科手术+术后的外源性甲状腺素的替代治疗或TSH抑制治疗即可。2.对于远处转移高危分化型甲状腺癌患者,外科手术+术后131I治疗+术后TSH抑制治疗是主要的综合治疗模式。3.对于不可手术切除的局部病灶,可以考虑局部射频消融或外照射。4.甲状腺髓样癌的治疗应以外科治疗为主,不需要TSH抑制治疗,但需要甲状腺素补充治疗。5.对于甲状腺未分化癌,如果无远处转移和气道梗阻,可首选外照射+手术/手术+外照射。外科的作用主要是解除气道梗阻(气管切开),在条件许可的情况尽量切除肿瘤。(二)甲状腺癌的术后随访对甲状腺癌患者进行长期随访的目的在于:①对临床治愈者进行监控,以便早期发现复发肿瘤和转移;②对DTC复发或带瘤生存者,动态观察病情的进展和治疗效果,调整治疗方案;③监控TSH抑制治疗的效果;④对DTC患者的某些伴发疾病(如心脏疾病、其他恶性肿瘤等)病情进行动态观察。1.分化型甲状腺癌(DTC)术后需要给予外源性甲状腺素抑制治疗。根据术后复发危险度决定TSH抑制治疗的程度。每次调整口服外源性甲状腺素的剂量后,4~6周随访复查甲状腺功能,待达到理想的平衡点后可酌情延长随访间隔,3~6个月复查1次,如有不适可随时检测甲状腺功能。2.对已清除全部甲状腺(手术和131I清甲后)的DTC患者,应定期检测血清Tg水平,建议采用同种检测试剂。 对血清Tg的长期随访从131I清甲治疗后6个月起开始,此时检测基础Tg(TSH抑制状态下)或TSH刺激后(TSH >30mU/L)的Tg。131I治疗后12个月,复查测定TSH刺激后的Tg。随后,每6~12个月复查基础Tg。 复发危险度中、高危者可在清甲治疗后3年内复查TSH刺激后的Tg。 3.DTC随访期间应定期进行颈部超声检查,评估甲状腺床和颈部中央区、侧颈部的淋巴结状态。术后首次超声检查建议为:高危患者术后3个月,中、低危患者术后6个月。 如发现可疑病灶,检查间隔可酌情缩短。对可疑淋巴结可行超声引导下穿刺活检和/或穿刺针冲洗液的Tg检测。4.DTC患者在手术和131I清甲治疗后,可根据复发危险度,在随访中选择性应用Dx-WBS。(1)中低危复发风险度的DTC患者如Dx-WBS未提示甲状腺床以外的131I摄取,并且随访中颈部超声无异常、基础血清Tg水平(TSH抑制状态下)不高,无需进行Dx-WBS。(2)中高危复发危险度的DTC患者,长期随访中应用Dx-WBS对发现肿瘤病灶可能有价值,建议检查间隔6~12个月。如果患者在随访中发现Tg水平逐渐升高,或者疑有DTC复发,可行Dx-WBS检查。5. CT和MRI不是DTC随访中的常规检查项目。在下述情况时应行颈胸部CT或MRI检查:①淋巴结复发广泛,彩超无法准确描述范围;②转移病灶可能侵及上呼吸消化道,需要进一步评估受侵范围;③高危患者中血清Tg水平增高(>10ng/ml)或者TgAb升高。而Dx -WBS阴性时如可能进行后续131I治疗,检查时应避免使用含碘对比剂。若行含碘对比剂的增强扫描,建议在扫描后4~8周行131I治疗。6. 目前不推荐在DTC随访中常规使用18F-FDG PET显像,但在下述情况下可考虑使用(1)血清Tg水平增高(>10ng/ml)而Dx-WBS阴性时,协助寻找和定位病灶。(2)对病灶不摄碘者,评估和监测病情。(3)对侵袭性或转移性DTC者,评估和监测病情。7.DTC的长期随访还应纳入以下内容(1)131I治疗的长期安全性:包括对继发性肿瘤、生殖系统的影响。但应避免过度筛查和检查。(2)TSH抑制治疗的效果:包括TSH抑制治疗是否达标、治疗的不良反应等。(3)DTC患者的伴发疾病:由于某些伴发疾病(如心脏疾病、其他恶性肿瘤等)的临床紧要性可能高于DTC本身,所以长期随访中也要对上述伴发疾病的病情进行动态观察。(三)发现DTC复发或转移后的处理局部区域复发或转移可发生于甲状腺残留组织、颈部软组织和淋巴结,远处转移可发生于肺、骨、脑和骨髓等。针对复发或转移病灶,可选择的治疗方案依次为:手术切除(可能通过手术治愈者首选手术治疗)、131I治疗(病灶可以摄碘者)、外照射治疗、TSH抑制治疗情况下观察(肿瘤无进展或进展较慢,并且无症状、无重要区域如中枢神经系统等受累者)、化学治疗和新型靶向药物治疗及获批的药物临床试验(疾病迅速进展的难治性DTC患者)。最终采取的治疗方案必须考虑患者的一般状态、合并疾病和既往对治疗的反应。甲状腺已完全清除的DTC患者,在随访中血清Tg水平持续增高(>10ng/ml),但影像学检查未发现病灶。对这类患者,可经验性给予3.7~7.4GBq(100~200mCi)131I治疗;如治疗后Dx-WBS发现DTC病灶或血清Tg水平减低,可重复131I治疗,否则应停止131I治疗,以TSH抑制治疗为主。(四)甲状腺髓样癌术后随访术后甲状腺功能的随访与DTC一致,但不需要TSH抑制治疗。由于血清降钙素和CEA与甲状腺髓样癌有较好的特异性,为随访复查时的必查项目。对于手术后血清降钙素和CEA水平恢复正常的患者,其随访期可参考低危分化型甲状腺癌;对于血清降钙素和CEA尽管没有恢复正常,但处于较低水平者,可参考高危分化型甲状腺癌患者;对于仍处于较高水平的患者,应密切随访,建议3~6个月复查超声,并根据血清降钙素和CEA上升的幅度,结合CT或MRI明确肿瘤范围,必要时行PET-CT检查。附件1 第7版 AJCC甲状腺癌分期美国癌症联合会(AJCC)甲状腺癌 TNM 分类(第7版2010)原发灶(T)注:所有分类都可以分为:(s)单灶和(m)多灶(最大者直径决定分期)Tx原发肿瘤不能评价T0没有原发肿瘤证据T1T1肿瘤最大直径≤2cm且局限在甲状腺内T1a肿瘤最大直径<1cm且局限在甲状腺内T1b肿瘤最大直径大于1cm且≤2cm且局限在甲状腺内T2肿瘤最大直径大于2cm且≤4cm且局限在甲状腺内T3肿瘤最大直径>4cm且局限在甲状腺内或有任何微小腺体外侵犯(如侵犯带状肌或甲状腺周围脂肪组织)T4a任何大小肿瘤侵犯甲状腺包膜以外至皮下软组织、喉、气管、食管或喉返神经T4b肿瘤侵犯椎前筋膜或包裹颈动脉或纵隔血管所有未分化癌归为T4期T4a腺体内未分化癌T4b肉眼侵犯腺体外的未分化癌区域淋巴结(N)(包括中央区淋巴、颈侧区淋巴结和上纵隔淋巴结)Nx区域淋巴结不能评估N0无区域淋巴结转移N1区域淋巴结转移N1a肿瘤转移至Ⅵ区(气管前、气管旁、喉前/Delphian淋巴结)N1b肿瘤转移至单侧、双侧或对侧颈部(Ⅰ、Ⅱ、Ⅲ、Ⅳ或Ⅴ区),或咽后淋巴结,或上纵隔淋巴结(Ⅶ区)远处转移(M)M0无远处转移灶M1有远处转移灶美国癌症联合会(AJCC)甲状腺癌 TNM 分期(第7版2010)乳头状或滤泡状癌(分化型)髓样癌(所有年龄组)年龄<45岁TNMTNMⅠ期100Ⅰ期任何任何0Ⅱ期200Ⅱ期任何任何1300年龄≥45岁Ⅲ期11a0Ⅰ期10021a0Ⅱ期20031a0Ⅲ期300ⅣA4a0011a04a1a021a011b031a021b0ⅣA期4a0031b04a1a04a1b011b0ⅣB期4b任何021b0ⅣC期任何任何131b0所有未分化癌归为Ⅳ期4a1b0ⅣA期4a任何0ⅣB期4b任何0ⅣB期4b任何0ⅣC期任何任何1ⅣC期任何任何1
杨晓霞 主任医师 龙岩市第二医院 内分泌科6187人已读 - 引用 中国催乳素型垂体腺瘤诊治专家共识
催乳素(PRL)腺瘤是最常见的功能性垂体腺瘤,约占成人垂体功能性腺瘤的40%-45%,以20 -50岁的女性患者多见,成人患者男女比例约1:10。规范化的诊断和治疗垂体催乳素腺瘤对恢复和维持正常腺垂体功能、预防肿瘤复发等具有重要的意义。一、临床表现垂体催乳素腺瘤的主要临床表现为性腺功能减退及其继发症状,可因发病年龄、性别、持续时间及催乳素增高程度的不同而有所差异;还可有垂体占位产生的局部压迫症状;垂体混合腺瘤或多发内分泌腺瘤病患者,还可出现其他激素水平增高相应的临床表现。1.高催乳素血症临床表现:(1)性腺功能减退:青春期前起病的患者可表现为原发性性腺功能减退,即女孩原发性闭经,男孩无青春发育,睾丸容积小。育龄期女性多有月经周期的改变,出现不同程度的月经稀少甚至闭经,通常影响排卵,引起不孕。血清雌激素水平低落可引起乳腺萎缩,阴毛脱落,外阴萎缩、阴道分泌物减少、骨质疏松等症状。男性患者雄激素水平下降可导致性欲减退、阳萎、射精量及精子数目减少、不育及骨质疏松等。因男性患者症状隐匿且特异性低,常被忽视导致就诊时间晚。(2)泌乳:女性高催乳素血症患者中30% - 80%发生自发或触发泌乳,出现性功能低下后由于雌激素水平低下,泌乳的发生率也降低。男性患者可有轻度乳腺发育,少数患者也可出现泌乳。(3)体重增加:具体病因不清,可能与钠水储留、脂肪分化异常、性功能低下及下丘脑功能异常等有关。2.肿瘤局部压迫症状:多见于垂体催乳素大腺瘤。最常见的局部压迫症状是头痛、视野缺损(最常见为双颞侧偏盲)。若肿瘤向两侧生长,可包绕海绵窦,影响第Ⅲ、Ⅳ、Ⅵ对脑神经及第Ⅴ对脑神经眼支功能,引起眼睑下垂、瞳孔对光反射消失、复视、眼球运动障碍、面部疼痛等。若肿瘤破坏蝶窦或筛窦骨质还可出现脑脊液漏。大腺瘤压迫正常垂体组织还可引起其他垂体前叶功能受损表现,如甲状腺功能减退或肾上腺皮质功能减退等。3.多激素混合腺瘤或多发内分泌腺瘤病症状:合并分泌生长激素、促甲状腺激素、促肾上腺皮质激素等的催乳素混合腺瘤可伴有其他垂体前叶激素分泌过多表现,如肢端肥大症、甲状腺功能亢进、库欣综合征等。此外,垂体瘤还可是多发内分泌腺瘤病(MEN),特别是MEN-I型的表现之一,故要注意有无胰腺神经内分泌肿瘤、甲状旁腺功能亢进等其他内分泌腺体功能异常表现。4.垂体卒中:垂体催乳素腺瘤可能发生垂体卒中,一般发生于大腺瘤。急性垂体卒中可表现为剧烈头痛,常伴恶心呕吐,严重者可有急性视神经障碍、眼睑下垂及其他颅神经症状,甚至昏迷。但也有许多为无症状的垂体卒中。二、诊断典型临床表现结合高催乳素血症的实验室检查与鞍区影像学检查,可作出催乳素腺瘤诊断。1.高催乳素血症:对疑诊垂体催乳素腺瘤的患者,静脉取血测催乳素的要求是:正常进食早餐(种类为碳水化合物,避免摄入蛋白质和脂肪类食物),于上午10:30 -11:00休息0.5 h后静脉穿刺取血。如果血清催乳素> 100 - 200 ug/L,并排除其他特殊原因引起的高催乳素血症,则支持催乳素腺瘤的诊断。如血清催乳素<100 ug/L,须结合具体情况谨慎诊断。2.鞍区影像学检查:鞍区MRI增强影像有助于垂体腺瘤的发现,动态增强成像有助于垂体微腺瘤的发现。三、鉴别诊断1.病理性高催乳素血症:多见于下丘脑·垂体疾病,以垂体催乳素腺瘤最为多见。此外,其他下丘脑,垂体肿瘤、浸润性或炎症性疾病、结节病、肉芽肿以及外伤、放射性损伤等均是由于下丘脑多巴胺生成障碍或阻断垂体门脉血流致使多巴胺等PIF不能到达腺垂体所致。由于PRL释放因子(PRF)增多引起高PRL血症的情况见于原发性甲减、应激刺激。慢性肾功能衰竭患者由于肾小球滤过清除催乳素障碍而导致高催乳素血症。肝硬化患者由于雌激素及催乳素在肝脏的灭活障碍致血催乳素升高。2.生理性高催乳素血症:主要发生于妊娠、乳头刺激或应激的时候。在妊娠期间,催乳素的水平呈逐步升高趋势,至分娩时达高峰,但升高的幅度因人而异,其升高原因与孕期的高雌激素水平有关。3.药物性高催乳素血症:很多常用药物可引起催乳素水平升高,如多巴胺受体拮抗剂、含雌激素的口服避孕药、某些抗高血压药、阿片制剂及H2受体阻滞剂等。其中多巴胺受体拮抗剂是一些具有安定、镇静或镇吐作用以及抗抑郁、抗精神病类药物,在常用剂量时催乳素水平一般不超过100 ug/L;氯丙嗪和甲氧氯普胺(胃复安)的作用最强,25 mg氯丙嗪可使正常人血清催乳素水平增加5-7倍。长期应用胃复安治疗时,催乳素水平可升高15倍以上。四、垂体催乳素腺瘤的药物治疗1.药物治疗适应证:对不同大小的垂体催乳素腺瘤,其治疗的目的是不一样的。对催乳素微腺瘤患者,治疗的目的是控制PRL水平,保留性腺功能和性功能;对催乳素大或者巨大腺瘤患者,除了控制PRL水平、保留垂体功能之外,还要控制和缩小肿瘤体积,改善临床症状,防止复发。垂体催乳素腺瘤首选多巴胺受体激动剂治疗,推荐的治疗方案见图1。药物治疗的适应证包括:不孕不育,肿瘤引起神经系统症状(尤其是视力缺失),烦人的泌乳,长期的性腺功能低下,青春期发育改变,预防妇女由于性腺功能低下引起的骨质疏松。轻度的高催乳素血症,月经规则,想怀孕的妇女需要治疗。2.药物选择:多巴胺激动剂(DA),为PRL腺瘤患者的首选治疗,目前主要有溴隐亭(BRC)和卡麦角林(CAB),其他还有培高利特(pergolide)和喹高利特(quinagolide)。药物能使绝大多数病人PRL水平正常和肿瘤体积显著缩小,而且药物治疗适用于各种大小的肿瘤。由于培高利特和喹高利特较少使用,因此本共识不作推荐。(1)溴隐亭:服用方法:溴隐亭(2.5 mg/片)治疗的初始剂量为0.625 -1. 25 mg/d,建议晚上睡前跟点心口服。每周间隔增加1. 25 mg直至达到2片/d或3片/d。通过缓慢加量计划和睡前跟点心同服的方法来减少上胃肠道不适和直立性低血压的不良反应。7.5 mg/d为有效治疗剂量,如果肿瘤体积和PRL控制不理想,则可以逐步加量至15 mg/d。继续加量并不能进一步改善治疗效果。因此,不建议15 mg以上的大剂量,而是建议改为卡麦角林治疗。由于溴隐亭已经证实其安全有效,且价格相对便宜,在我国大部分医疗部门可以提供,因此溴隐亭为我国推荐治疗催乳素腺瘤的首选药物。(2)卡麦角林:服用方法:0.5 mg/片的初始治疗剂量为,每周0. 25-0.5 mg,剂量每月增加0. 25-0.5 mg直到PRL正常,很少需要剂量超过每周3 mg。对比溴隐亭,卡麦角林服用更方便,患者的耐受性更好,对溴隐亭耐药的患者可选用卡麦角林治疗。(3)药物不良反应:溴隐亭的不良反应包括:头痛、头晕,恶心、呕吐、消化性溃疡等消化道症状,鼻腔充血,便秘,体位性低血压,严重的患者甚至会出现休克表现;乏力、焦虑、抑郁、酒精不能耐受;药物诱发垂体瘤卒中。卡麦角林的不良反应同溴隐亭,消化道不良反应比溴隐亭轻,其他包括精神疾病,潜在的心脏瓣膜病。3.催乳素微腺瘤治疗:临床上治疗PRL微腺瘤的首要目的是保留性腺功能和生育功能,而药物治疗能显著有效地达到这一目的,即药物能有效得控制PRL水平,而且经过长期有效的DA治疗,微腺瘤经常缩小,有时会消失。由于只有5% - 10%的微腺瘤进展为大腺瘤,因此,控制肿瘤体积不是药物治疗的首要目的,对于不想生育的妇女可以不接受DA治疗。停经的妇女可以接收雌激素治疗,但应该对PRL水平进行定期评价,包括复查动态强化MRI以观察肿瘤大小变化。4.催乳素大腺瘤和巨大腺瘤治疗:治疗催乳素大或者巨大腺瘤患者,除控制PRL水平、保留垂体功能之外,还要缩小肿瘤体积以改善临床症状。除了急性肿瘤卒中诱发视力急剧下降需要急诊手术减压之外,DA仍然是绝大多数催乳素大或巨大腺瘤患者的首选治疗。对于敏感病例,开始药物治疗后1或2周内即可以使PRL水平迅速下降,同时肿瘤明显缩小,视力改善。DA治疗通常能有效恢复视觉功能,其效果与外科行视交叉减压手术相当。所以,视野缺失的大腺瘤患者不再被认为是神经外科急症。但在一些耐药病例,药物治疗几个月肿瘤体积也不会明显缩小。肿瘤的持续缩小乃至消失需要几个月或甚至几年的时间。药物治疗后定期的MRI复查是需要的,开始治疗后的3个月1次,之后半年复查1次,以后可以间隔长一些。治疗的目的是PRL水平尽量控制在正常水平,为了能最大程度地缩小肿瘤体积甚至于促使肿瘤消失,最好是降低PRL水平到可能的最低值。即便PRL水平下降到正常范围,仍需服用足量的DA用以进一步缩小肿瘤体积。当PRL水平保持正常至少两年,肿瘤体积缩小超过50%,才考虑DA逐步减量,因为在这一阶段,低剂量能维持稳定的PRL水平和肿瘤大小。然而,停止治疗可导致肿瘤的增大和高催乳素血症的复发。基于这一原因,对大或者巨大腺瘤患者药物减量或停用后必需进行严密随访。五、垂体催乳素腺瘤的外科治疗垂体催乳素腺瘤选择手术治疗需根据以下情况综合判断:肿瘤大小、血催乳素水平、全身情况、药物治疗反应,患者的意愿以及对生育的要求。微腺瘤占垂体催乳素腺瘤大部分,且绝大多数不会生长,所以手术干预通常不作为首选。外科治疗目的:(1)迅速缓解内分泌异常,血催乳素降至正常范围。(2)保留正常垂体功能。(3)尽可能减少肿瘤复发。(4)脑脊液漏修补术。绝大多数手术可以采用经鼻蝶窦人路,只有少数耐药的侵袭型巨大垂体腺瘤需要开颅手术。近年来,随着神经导航及内镜等仪器设备的发展及手术微创技术水平的提高,经验丰富的手术团队可以使经蝶窦入路手术更精确、更安全、损伤更小、并发症更少。因此,经蝶窦入路手术也是垂体催乳素腺瘤患者除药物治疗之外的另一选择。手术适应证:(1)垂体微腺瘤经药物治疗3-6个月无效或效果欠佳者。(2)药物治疗反应较大不能耐受者。(3)巨大垂体腺瘤伴有明显视路压迫,药物治疗无法控制血催乳素和缩小肿瘤体积。或经药物治疗3 -12个月后,血催乳素水平降至正常,但肿瘤体积仍没有变化,需考虑垂体无功能腺瘤可能。(4)侵袭性垂体腺瘤伴有脑脊液鼻漏,或药物治疗后出现脑脊液鼻漏者。(5)带瘤生存的心理承受能力不足或拒绝长期服用药物治疗者。(6)药物治疗或其他原因引致垂体瘤卒中,表现剧烈头痛和急剧视力减退者。(7)垂体大腺瘤伴囊变,药物治疗通常无法缩小肿瘤体积。(8)经验丰富的术者认为有较高手术全切除预期,且充分考虑到患者手术的意愿。手术几乎没有绝对禁忌证,相对禁忌证绝大多数与全身状态差及脏器功能障碍相关。对于这些患者,应在手术治疗之前进行治疗,改善全身情况。手术疗效与手术者的经验、肿瘤的大小、侵袭程度及病程有关。微腺瘤的手术效果较大腺瘤好。在多数大的垂体治疗中心,60% -90%的微腺瘤患者术后催乳素水平可达到正常,大腺瘤患者达到正常的比例则较低,约为50%,而巨大侵袭型垂体瘤的术后生化缓解率几乎为零。术前血催乳素水平与术后缓解率呈负相关,可作为判断手术预后的参考指标,患者术前血催乳素<200>200 ug/L的患者。多巴胺激动剂能使部分肿瘤纤维化,但是否增加手术的困难和风险,尚存争议。近来有作者认为术前药物治疗可以提高肿瘤全切除率。术后催乳素水平正常的患者中,长期观察有0%-40%患者会出现复发。影响复发判断的因素是术后缓解标准、随访时间和垂体微腺瘤所占比例。术后5年复发率约为20%。术后第1天的血PRL水平能比较准确地反映预后情况,可以作为手术疗效的评价指标之一。有术者认为,术后即刻催乳素水平降至10 ug/L以下者,术后5年未见复发。垂体大腺瘤复发率明显高于微腺瘤。术后轻度催乳素升高者,也可能是因为垂体柄偏移或手术损伤垂体柄导致的垂体柄效应有关系,而不一定表示肿瘤残留或复发。经蝶窦手术的内分泌并发症包括垂体前叶功能低下、一过性或持续性尿崩症以及抗利尿激素(ADH)分泌不当,术后持续性垂体前叶功能减退的发生率与肿瘤体积大小呈负相关。其他并发症包括视神经的损伤、周围神经血管的损伤、脑脊液鼻漏、鼻中隔穿孔、鼻窦炎、颅底骨折等,其中罕见的并发症包括颈动脉海绵窦段的损伤等,可危及生命。但是,近年来,有经验术者的垂体瘤手术并发症发生率逐年下降。垂体微腺瘤的手术并发症发生率总体不超过5%,死亡率<1%< span=''>,并发症多为一过性尿崩。虽然开颅手术的并发症发生率高,但耐药的巨大垂体腺瘤毕竟少数,手术目的为尽可能缩小肿瘤体积,而非全切肿瘤。推荐患者到有丰富垂体瘤手术经验的医院完成手术,这样可以减少手术并发症,保留残存垂体功能,提高手术疗效。六、垂体催乳素腺瘤的放疗外照射放疗(external beam radiotherapy,EBRT)和立体定向放射外科(stereotactic radiosurgery,SRS)治疗1.适应证:由于多巴胺激动剂药物治疗对催乳素腺瘤有良好疗效,且手术切除肿瘤、或减压能够快速缓解占位性效应和临床症状,因此多数情况下,EBRT和SRS仅作为药物无效、不耐受,手术后残留、复发,或一些侵袭性、恶性催乳素腺瘤患者的选择。2.方法与剂量学:目前,EBRT包括调强放疗(Intensity-modulated Radiotherapy,IMRT)和影像引导的放疗(Image-guided Radiotherapy,IGRT)等技术,可以实现治疗的影像定位和靶区塑形。一般治疗总剂量45-54 Gy,1.8-2 Gy/d,每周治疗5d,持续5-6周。用于较大的、或侵袭性生长的肿瘤。SRS是放射治疗的一种特殊形式,在立体定向头架的引导下,一次性高剂量射线,或大分割(≤5次)精准聚焦照射在靶区上,更有效地杀死肿瘤细胞。最常见的设备包括伽玛刀,改良的直线加速器和质子柬设备。单次剂量的SRS,一般对体积较小的肿瘤,靶区周边12 -16 Gy的剂量,足以控制肿瘤生长。达到高催乳素正常化需要更高剂量,对小型分泌型腺瘤周边剂量可高达20-35 Gy,并有一定的疗效潜伏期。3.疗效评价:无论EBRT还是SRS,单纯控制肿瘤生长可达到8g%-100%;高催乳激素水平正常化仅约30%。报道使高分泌激素水平正常化的疗效潜伏期为数月至数年,SRS较EBRT的为短。4.合并药物治疗的问题:理论上,药物治疗对肿瘤细胞有保护作用,可能影响射线作用的发挥。在放射治疗前1 -2个月最好停止激素抑制药物使用,放射治疗1周后,再继续这些药物的治疗。5.不良反应:常规放疗在治疗后10 - 20年中,垂体功能低下的累加风险可超过50%,甚至有100%的报道。GKRS后新的垂体功能低下发生率约为0-33%,发生高峰为4-5年。对视神经损伤概率1% -2%。放疗后远期的脑血管病,神经认知障碍不可忽视。七、垂体催乳素腺瘤患者的妊娠相关处理基本的原则是将胎儿对药物的暴露限制在尽可能少的时间内。溴隐亭对胎儿安全性较高,垂体催乳素腺瘤妇女应用溴隐亭治疗,怀孕后自发流产、胎死宫内、胎儿畸形等发生率与正常妇女妊娠的产科异常相近;催乳素微腺瘤患者怀孕后瘤体较少增长,而大腺瘤患者怀孕后瘤体增长可能性达25%以上。在妊娠前有微腺瘤的患者,催乳素水平降至正常,恢复规律月经后可以妊娠。但由于黄体功能维持的需要,应在孕12周后停药;对于有生育要求的大腺瘤妇女,需在溴隐亭治疗腺瘤缩小后方可允许妊娠,妊娠期间,推荐全程用药。正常人怀孕后PRL水平逐渐升高,但最高不超过300-400 ug/L。对孕前垂体催乳素腺瘤的患者主要应注意临床表现,如出现视野缺损、头痛、视力下降,特别是视野缺损或海绵窦综合征,如出现肿瘤卒中应立即加用溴隐亭,若1周内不见好转,应考虑手术治疗并尽早终止妊娠(妊娠接近足月时)。八、垂体催乳素腺瘤患者的哺乳期用药没有证据支持哺乳会刺激肿瘤生长。对于有哺乳意愿的妇女,除非妊娠诱导的肿瘤生长需要治疗,一般要到患者想结束哺乳时再使用多巴胺受体激动剂。九、垂体催乳素腺瘤患者的不孕不育相关治疗1.女性催乳素腺瘤患者的不孕不育相关治疗:(1)药物治疗催乳素水平正常后仍无排卵者。可采用克罗米芬或来曲唑等口服促排卵药物促排卵,但应注意口服促排卵药只适用于下丘脑-垂体轴有一定功能的患者,即单用孕激素可以有撤退出血者,垂体大腺瘤或手术破坏垂体组织较严重者无效。(2)低促性腺激素者的促性激素促排卵:垂体腺瘤压迫或术后腺垂体组织遭破坏、功能受损而导致低促性腺激素性闭经的患者,可用外源性人促性腺激素(Gn)促排卵。Gn分为人垂体促性腺激素和人绒毛膜促性腺激素(hCG)。人垂体促性腺素又分为促卵泡刺激素(FSH)和黄体生成素(LH)。不育治疗时,可采用人绝经后尿促性腺激素(HMG)促进卵泡成熟后以HCG诱发排卵。2.男性催乳素腺瘤患者不育的相关治疗:垂体催乳素腺瘤经药物治疗,血PRL水平降到正常后,男性下丘脑-垂体-性腺轴的功能异常一般可以恢复正常,勃起功能障碍和性欲低下明显改善,生精能力也逐渐恢复。部分患者因垂体瘤压迫或手术损伤导致促性腺激素细胞功能障碍,在血清PRL水平下降后睾酮水平仍不能恢复正常,应该同时进行雄激素补充治疗以恢复和保持男性第二性征或用促性腺激素治疗恢复生育功能。
杨晓霞 主任医师 龙岩市第二医院 内分泌科1876人已读 - 精选 含碘高的食物
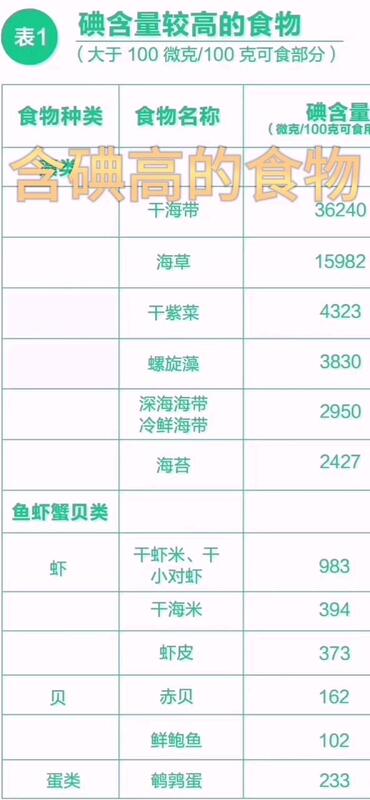 杨晓霞 主任医师 龙岩市第二医院 内分泌科112人已观看
杨晓霞 主任医师 龙岩市第二医院 内分泌科112人已观看 - 引用 《中国糖尿病膳食指南(2017)》的8条营养健康推荐意见
过去20年间,我国糖尿病患病率呈现迅猛增长的态势,根据2013年发表在《美国医学会杂志》(JAMA)的研究报道显示,中国成人糖尿病患病率高达11.6%。糖尿病现已成为严重影响国人身心健康的慢性非传染性疾病之一,而不少人对糖尿病的饮食都存在误区,比如不敢吃鱼虾肉、不敢吃主食、不敢吃水果等。2017年5月22日,中国营养学会第13届全国营养科学大会暨全球华人营养科学家大会上正式发布了《中国糖尿病膳食指南(2017)》。该指南为中国糖尿病患者提供了切实可行的膳食建议,主要推荐内容见下:一、吃、动平衡,合理用药,控制血糖,达到或维持健康体重。1. 控制腰围,预防腹型肥胖,男性腰围不超过90cm,女性腰围不超过85cm;2. 平衡膳食,控制总热量及总碳水化合物摄入。合理饮食,预防营养不良,成年人体重指数应在18.5~23.9kg/m2之间;3. 规律运动,以有氧运动为主,每周至少3次,每次不少于20分钟。二、主食定量,粗细搭配,全谷物、杂豆类占1/3。1. 主食定量,摄入量因人而异;在医生或者营养师的帮助下,确定适合自己的主食量;2. 选择低GI(Glycemic Index,血糖生成指数)主食,避免白米白面等过精细主食,搭配杂粮杂豆(如小米、燕麦、薏米、紫米、绿豆、红豆、黑豆),全谷物、杂豆类应占主食的。三、多吃蔬菜,水果适量,种类、颜色要多样。1. 增加新鲜蔬菜摄入量以降低膳食GI,建议餐餐有蔬菜;2. 每天300-500克新鲜蔬菜(生重),其中深色蔬菜(如绿色叶子菜、橙色胡萝卜、紫色甘蓝、红色番茄等)占一半以上;3. 两餐之间适量选择低GI的水果。水果颜色、形状尽量多样化。四、常吃鱼禽,蛋类和畜肉适量,限制加工肉类。1.常吃鱼虾蟹贝及禽肉,猪牛羊等畜肉要适量摄入,尽量少吃肥肉;2.每周不超过四个鸡蛋(或每两天一个鸡蛋),蛋白跟蛋黄一起吃;3.腊肉、香肠、烤肉等烟熏、腌制、烘烤等肉类制品要少吃,限制摄入量。五、奶类豆类天天有,零食加餐合理选择。1.保证每日300g液态奶或相当量奶制品的摄入;每天摄入豆浆、豆干、豆腐等大豆制品;2.零食选择选择适量开心果、扁桃仁、核桃等坚果,但要注意摄入量;根据自己的情况选择适合的加餐餐数,部分低GI主食、水果可作为加餐食物,计入总碳水化物中。六、清淡饮食,足量饮水,限制饮酒。1. 烹调注意少油少盐,成人每天烹调油25~30克,食盐用量不超过6克;2. 推荐饮用白开水,成人每天饮用量1500~1700毫升;尽量避免含糖软饮料;3. 饮料可选淡茶;4. 不推荐糖尿病患者饮酒。七、定时定量,细嚼慢咽,注意进餐顺序。1. 定时定量进餐,餐次安排视病情而定;2. 控制进餐速度,早晨15~20分钟,中晚餐30分钟左右;3. 细嚼慢咽,每口饭菜最好咀嚼25~30次;4.改变进餐顺序,先吃蔬菜、再吃肉类、最后吃主食。八、注重自我管理,定期接受个体化营养指导。1. 注重包括饮食控制、规律锻炼、遵医嘱用药、监测血糖、足部护理以及高低血糖预防和处理等六方面的自我管理;2. 定期接受营养(医)师的个体化营养指导,频率至少每年四次。按指导执行,养成良好的饮食习惯。
杨晓霞 主任医师 龙岩市第二医院 内分泌科2207人已读 - 精选 乳糜血就是“泛着浮油的血”或称为“脂血”、“牛奶血”,血浆呈乳白色或混浊状。
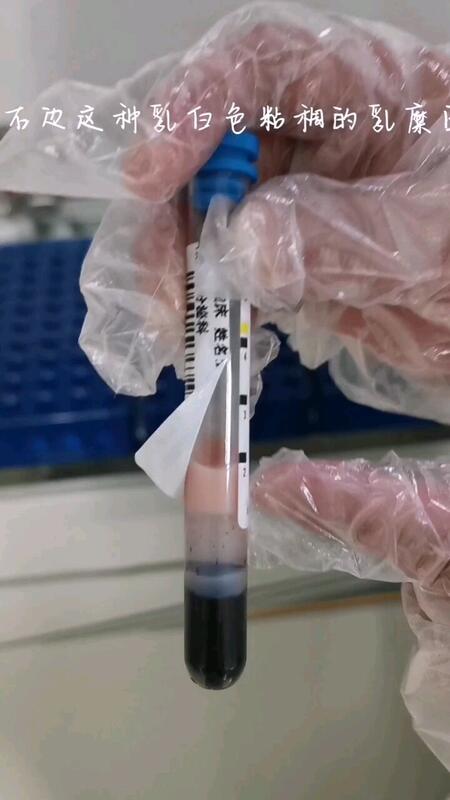 杨晓霞 主任医师 龙岩市第二医院 内分泌科54人已观看
杨晓霞 主任医师 龙岩市第二医院 内分泌科54人已观看 - 引用 妊娠合并甲减的诊治
一、甲状腺激素(TH)是促进机体生长和发育的重要激素母体甲状腺激素水平与胎儿大脑发育密切相关,在脑发育的第一时期(妊娠1~20周)起关键作用,即使少量缺乏也会导致脑发育迟缓,造成后代智力低下。甲状腺功能减退症(甲减)是由于各种原因导致的低甲状腺素血症或甲状腺激素抵抗而引起的全身性低代谢综合征。妊娠对甲状腺和甲状腺功能均具有明显影响。母体甲状腺自妊娠开始即出现一系列适应性的生理改变,如甲状腺腺体增大,血供增加,甲状腺激素水平和甲状腺免疫微环境发生特异性改变等。碘充足地区女性,妊娠期间甲状腺腺体体积增加10%;在碘缺乏地区,甲状腺腺体体积增加20%~40%。甲状腺素(T4)和三碘甲状腺原氨酸(T3)增加50%,每天碘需求量增加50%。这些生理变化可导致妊娠早期甲状腺功能正常的碘缺乏妇女在妊娠晚期发生甲减。妊娠期甲减可损害子代的神经智力发育,增加流产、早产、低体重儿、死胎和妊娠期高血压疾病等的发生风险。二、妊娠合并甲减的筛查建议对所有孕妇首次产前检查时,应仔细询问有无甲状腺功能异常和(或)使用甲状腺激素或抗甲状腺药物(甲巯咪唑、卡比马唑片或丙基硫氧嘧啶)史。并推荐对具有甲减危险因素的孕妇进行甲状腺功能筛查,其危险因素包括:(1)有甲状腺功能异常或甲状腺手术史。(2)有甲状腺功能异常家族史。(3)患甲状腺肿。(4)甲状腺过氧化物酶抗体(TPOAb)阳性。(5)症状和体征提示甲状腺功能亢进(甲亢)或甲减。(6)患1型糖尿病。(7)有流产或早产史。(8)有其他自身免疫疾病史。(9)不孕症。(10)有头颈部放射治疗史。(11)患有病理性肥胖,体重指数(BMI)≥40。(12)年龄>30岁。(13)孕产妇曾接受胺碘酮治疗。(14)孕产妇曾接受含锂药物治疗。(15)孕产妇近6周内曾接触碘放射性造影剂。(16)居住在中度至重度碘缺乏地区。有条件的医院和妇幼保健部门应对孕早期妇女开展甲状腺疾病筛查。筛查指标选择TSH、FT4和TPOAb。筛查时机选择在孕前和妊娠8周以前。三、妊娠合并甲减的治疗药物治疗目的是及时、足量补充外源性甲状腺激素,纠正母体甲状腺激素不足,保证妊娠过程母体对胎儿甲状腺激素供应,以改善妊娠期临床甲减患者的妊娠结局。治疗妊娠合并甲减的首选替代药物是左旋甲状腺素(L-T4),强烈建议不用其他甲状腺制剂如T3或干甲状腺片治疗。 妊娠期临床甲减的L-T4完全替代治疗的剂量可达到2.0~2.4 μg /(kg·d)。起始剂量为50~100 μg/d,若TSH<10 mU/L,则开始治疗时给予L-T4剂量为100μg,每3~4周复查甲状腺功能,以50μg为单位调整剂量,尽快达标,至实验室检查指标正常后维持,并每6~8周复查1次。正在治疗的甲减患者,如果计划妊娠,应在医师指导下调整剂量,使TSH值优化到<2.5 mU/ L。较低的TSH值(未孕的参考范围内)会降低妊娠早期TSH值升高的风险。鉴于妊娠期母体和胎儿对甲状腺激素需求量增加,故正在治疗中的甲减妇女,妊娠后应立即增加L-T4剂量25%~30%,以尽快有效防止妊娠早期发生低甲状腺素血症。L-T4的增加量个体差异很大,孕妇甲减病因及孕前TSH水平均可影响L-T4增加量。不同患病人群根据病因采取不同治疗方案。自身免疫性甲状腺炎引起的甲减需增加L-T4剂量35%~45%;甲状腺切除等甲状腺损伤导致的甲减,需增加70%~75%。产后L-T4应恢复至孕前的剂量,并于产后6周复查血清TSH,调整L-T4剂量。妊娠合并甲减的治疗目标是维持整个妊娠过程中血清TSH水平在妊娠期特异的参考值范围以内,即妊娠早期0.1~2.5 mU/L,妊娠中期0.2~3.0 mU/L,妊娠晚期0.3~3.0 mU/L。血清FT4水平为非孕妇女正常范围的1/3,T4为非孕妇女正常范围的1.5倍。因此,一旦确诊临床甲减,应立即到内分泌科进行规范化治疗,尽早达到上述治疗目标。临床甲减孕妇甲状腺功能的监测频度在妊娠前半期(1~20周)为每4周1次。妊娠26~32周应检查1次血清甲状腺功能指标。长期以来对妊娠期亚临床甲减是否应该治疗存在不同意见。尽管妊娠期亚临床甲减也有增加不良妊娠结局和后代神经智力发育损害的风险,但尚无足够的循证医学证据建议对TPOAb阴性的亚临床甲减孕妇用或不用L-T4治疗,推荐对TPOAb阳性的亚临床甲减孕妇应用L-T4治疗。治疗方法、目标和监测频度与临床甲减相同。对于没有进行治疗的亚临床甲减孕妇应监测是否进展为临床甲减, 16~20孕周前应每4周测定血清TSH和FT4,在26~32孕周之间至少测定一次。对妊娠期单纯性低甲状腺素血症增加不良妊娠结局和后代神经智力发育损害的证据不足,故不推荐常规治疗。四、结论综上所述,妊娠合并甲减可对孕产妇产生严重危害,导致后代智力受损,并与多种不良妊娠结局相关。及时诊断和有效治疗能够消除不良影响,明显改善母儿预后。因此,建议妊娠早期特别是对具有甲状腺疾病危险因素的妇女进行甲状腺功能筛查。妊娠合并甲减的治疗首选L-T4,并且对TSH进行动态监测,及时增加L-T4剂量,使TSH水平尽早达标,保证母胎健康。关于妊娠合并亚临床甲减的筛查和治疗方面,则有待于进一步的深入研究和论证。
杨晓霞 主任医师 龙岩市第二医院 内分泌科1768人已读 - 精选 双能源CT上小指的那一团绿色就是痛风结节。左手第1指远节指骨旁及第5指近侧指间关节周围痛风结晶形成。
 杨晓霞 主任医师 龙岩市第二医院 内分泌科144人已观看
杨晓霞 主任医师 龙岩市第二医院 内分泌科144人已观看 - 引用 2型糖尿病的综合控制目标
2型糖尿病的综合控制目标:空腹血糖控制目标4.4~7.0 mmol/L;血压控制目标为<140/80 mmHg。甘油三酯控制目标为<1.5 mmol/L;合并心血管病时,低密度脂蛋白胆固醇(LDL-C)控制目标为<1.8 mmol/L;未合并心血管病,但是年龄>40岁并有≥1种心血管危险因素者,LDL-C控制目标为<2.6 mmol/L。
杨晓霞 主任医师 龙岩市第二医院 内分泌科9323人已读 - 精选 1型糖尿病的特点
 杨晓霞 主任医师 龙岩市第二医院 内分泌科319人已观看
杨晓霞 主任医师 龙岩市第二医院 内分泌科319人已观看



