中山大学孙逸仙纪念医院口腔科科普号
- 精选 免疫治疗后进展如何治疗?
介绍免疫治疗代表了肿瘤学治疗的一次范式转变。与直接针对肿瘤本身的传统疗法不同,免疫治疗的目标是克服由肿瘤及其微环境引起的免疫抑制,从而使免疫系统能够识别并杀死癌细胞。2011年,当时美国食品药品监督管理局(FDA)批准了首个免疫检查点抑制剂——一种靶向CTLA-4的单克隆抗体ipilimumab的应用。随后,两种额外的免疫检查点抑制剂(pembrolizumab和nivolumab)也相继获批,它们均靶向PD-1。这三种抑制剂最初被批准用于治疗不可切除或转移性黑色素瘤。此外,其他免疫检查点抑制剂随后被批准用于多种癌症,包括黑色素瘤、非小细胞肺癌、胃癌、头颈部鳞状细胞癌和肾细胞癌。因此,免疫治疗在肿瘤临床实践中的应用日益增加。免疫治疗表现出独特的治疗反应类型,如假性进展(pseudoprogression)、超进展(hyperprogression)、长期治疗反应(longdurationofresponse)以及治疗停止后的疾病消退(diseaseregression)。这些反应模式与化疗的典型反应不同,且不完全适用于实体瘤反应评估标准(RECIST)的评价工具,但对于治疗决策具有重要的临床意义。此外,某些不良事件可能被误诊为疾病进展,例如肺泡内纤维炎性肺结节和类似于肉芽肿病的肉芽肿。对于这些反应类型,应在临床上进行准确识别,并根据具体反应类型选择相应的治疗方法。在本文中,我们将评估免疫治疗相关的不同反应类型,并描述针对表现出此类反应的患者的相关治疗选择。假性进展尽管假性进展尚未被统一定义,但通常被描述为由治疗效果引起的肿瘤生长,而非真正的疾病进展。因此,假性进展可能表现为肿瘤体积的暂时性增大、新病灶的出现,或者二者兼有(通过影像学证实),但不会伴随临床恶化,随后通常会出现疾病稳定或反应。假性进展可以是早期(治疗的前12周内)或延迟性(治疗12周后)。这种现象可能是由于炎症细胞浸润肿瘤,或是免疫治疗引发的水肿或坏死所致。一种区分假性进展和真实疾病进展的新方法是利用影像学。一种有前景的免疫成像技术是使用靶向免疫细胞受体(如CTLA-4、PD-1、PD-L1和CD3)的特定示踪剂。例如,可以利用与PD-L1抗体结合的⁸⁹Zr-atezolizumab示踪剂以及氨基酸示踪剂¹¹C-甲基-L-蛋氨酸。另一种新兴的方法是通过液体活检监测KRAS突变的染色体不稳定性变化,并量化循环肿瘤DNA(ctDNA),研究表明在假性进展的情况下ctDNA水平会下降。然而,目前这些方法尚未被验证为区分假性进展和真实进展的可靠工具。现有的RECIST指南无法有效区分接受免疫治疗的癌症患者的假性进展和真实进展。为了解决这一问题,引入了新的免疫治疗RECIST(iRECIST)标准,该标准基于RECIST1.1,但增加了对于RECIST1.1所定义的进展后肿瘤回缩的定义。根据iRECIST,免疫未确认进展性疾病被定义为符合RECIST1.1标准的进展性疾病(病灶直径总和增加超过20%)。然而,需要在接下来的评估中(4至8周后)确认进展,只有在该时间点确认进展,才能被定义为免疫确认进展性疾病。这一修订使得能够识别非典型反应,例如假性进展后随之而来的真正反应识别假性进展具有重要的临床意义,因为对于显示假性进展的患者,避免过早终止免疫治疗至关重要。相反,对于真实进展的患者,及时切换到替代治疗方案则非常重。鉴于假性进展的发生率较低,对于符合RECIST1.1定义的进展患者,应优先与那些临床状况改善且对免疫治疗耐受性较好的患者探讨后续治疗方案。值得注意的是,假性进展患者的临床结果优于真实进展患者,但不如对免疫治疗有典型反应的患者。一项针对542例接受nivolumab治疗的晚期非小细胞肺癌患者的回顾性研究比较了假性进展患者(n=14)、真实反应患者(n=111)和真实进展患者(n=286)的结果。假性进展患者的无进展生存期中位数为7.3个月,而真实反应患者尚未达到;相比之下,真实进展患者的中位总生存期为6.4个月(p=0.001)。总体而言,假性进展的发生率因肿瘤类型而异,平均发生率低于10%(见表2)。在迄今为止最大的一项分析中,涉及19项临床试验和2400名参与者,研究了nivolumab和pembrolizumab在各种晚期实体肿瘤(如黑色素瘤、非小细胞肺癌、肾细胞癌及头颈鳞状细胞癌)中的效果,发现151名患者(6.3%)发生了假性进展。在这些癌症中,除了错配修复缺陷肿瘤和头颈鳞状细胞癌外,所有癌症类型均观察到假性进展。分离性反应另一种非典型反应是分离性反应,其定义为部分肿瘤同时出现退缩,而其他肿瘤进展(类似于化疗和靶向治疗中的混合反应)。一项回顾性研究检查了160名接受PD-1或PD-L1抑制剂治疗的晚期非小细胞肺癌患者中的非典型反应(假性进展和分离性进展),发现其中8例(5%)为假性进展,12例(8%)为分离性反应。具有非典型反应(未区分假性进展和非典型反应)的患者相比于疾病进展患者,其中位总生存期显著更长(9.8个月vs6.1个月;p<0.0001)。分离性进展的诊断需要通过CT影像的深入分析。由于进展的病灶可能代表假性进展,因此需要进行监测。如果患者临床状况稳定,其管理方式应与假性进展患者相似。然而,如果患者临床恶化,应考虑继续使用免疫检查点抑制剂治疗,并对进展病灶进行局部消融治疗。超进展我们将超进展(hyperprogression)定义为免疫治疗期间疾病的快速进展。目前,对于超进展的定义尚无一致意见,不同研究采用了不同的定义。大多数定义基于影像学检查,要求进行基线前CT扫描,并通过重复CT扫描来确定肿瘤生长动力学的增加(基于最长直径总和的变化)或肿瘤生长速率的增加(基于肿瘤体积的变化)。超进展的概念与随机试验中免疫检查点抑制剂与化疗的整体生存曲线一致,这些试验显示,在治疗的前几周和几个月内,化疗的整体生存率优于免疫治疗,两种治疗组的整体生存曲线存在交叉。这一发现表明,有一部分患者在接受免疫检查点抑制剂治疗时,其疗效可能不如化疗。然而,由于缺乏随机临床试验将患者分配至免疫检查点抑制剂、化疗或观察组(如果适用)并比较肿瘤生长情况,关于超进展的数据仍然稀缺。迄今为止最大的一项研究是一项回顾性分析,该研究在接受PD-1或PD-L1抑制剂的406名患者中发现了56例(14%)超进展患者,而在接受化疗的59名患者中发现了3例(5%)。超进展患者的中位总生存期为3.4个月(95%CI2.8–7.5),而疾病进展患者的中位总生存期为6.2个月(95%CI5.3–7.9)。其他研究中,超进展的发生率从<10%【32–34】到>25%不等。这一广泛的范围可能反映了癌症类型和治疗方法的异质性,以及超进展定义的差异。超进展的预测因素包括年龄、性别、转移部位数量以及特定的基因组异常。年龄超过65岁的患者更容易发生超进展,这可能与年龄相关的免疫功能下降和肿瘤微环境的变化有关;女性患者发生超进展的风险也较高,可能与激素水平及免疫调控的性别差异相关。此外,具有两个以上转移部位的患者更易发生超进展,提示较高的转移负荷可能增加免疫治疗失败的风险。基因组异常方面,TP53和MDM2扩增与超进展风险密切相关;TP53突变可能导致细胞周期调控失常,而MDM2扩增则通过抑制p53通路削弱抗肿瘤免疫反应。此外,EGFR突变和KRAS突变在部分研究中也被认为可能增加超进展的发生率。这些预测因素为临床医生在制定治疗方案时提供了重要参考,并强调了针对这些高危患者优化治疗策略的必要性。在头颈鳞状细胞癌患者中,超进展更常见于局部复发病例,尤其是发生在放疗区域的复发。由于这些预测因素在不同研究中的结果并不一致,需要进一步研究以验证这些因素。目前对超进展的生物学理解尚不足。一些小鼠模型研究(包括来自非小细胞肺癌患者的异种移植模型)表明,抗PD-1抗体的晶体片段域与特定肿瘤相关巨噬细胞上的Fc受体的相互作用可能导致这些巨噬细胞向更具侵袭性的促肿瘤行为重新编程。人类研究数据同样稀缺。一项2019年的研究评估了接受免疫检查点抑制剂治疗的非小细胞肺癌患者的治疗前肿瘤样本,发现MPO+髓系细胞与超进展直接相关,而PD-L1表达与超进展呈负相关。另一项研究比较了接受nivolumab治疗的晚期胃癌患者治疗前和治疗后的肿瘤样本,发现超进展患者的肿瘤浸润增殖性(Ki67+)效应调节性T细胞显著增加,而未发生超进展的患者则减少。这一扩大的效应调节性T细胞群可能抑制肿瘤反应性PD-1+效应T细胞,因此,其耗竭可能有助于预防或治疗超进展。从临床角度来看,一些患者在接受免疫治疗时可能会迅速出现临床恶化,这可能与显著缩短的总生存期相关。对于这些患者,应考虑停止免疫检查点抑制剂治疗并切换至其他治疗,或者建议其参与临床试验。被误解为疾病进展的不良反应免疫检查点抑制剂治疗与广泛的免疫相关不良事件相关。一些病例报告描述了可能被误解为疾病进展的免疫相关不良事件。Pradère及其同事报道了两例接受pembrolizumab单药治疗的黑色素瘤患者,这两名患者出现了多个肺结节,最初被认为是转移灶,但肺活检显示是肺泡内纤维炎性结节。类似地,Rambhia及其同事报道了55例接受免疫检查点抑制剂治疗的患者(其中78%为黑色素瘤患者),这些患者出现了类似于肉芽肿病的肉芽肿,其表现与疾病进展相似。这些类似肉芽肿病的肉芽肿最常涉及淋巴结、肺和皮肤。最终,通过活检确认这些肉芽肿,并通过停用免疫检查点抑制剂和使用免疫抑制治疗(包括或不包括类固醇)进行治疗。值得注意的是,由于类似疾病进展的免疫相关不良事件报告较少,这些数据应谨慎解读。真实进展后的治疗关于免疫治疗后真实进展的治疗,目前仍缺乏充分的研究证据,因此最佳治疗方案需要根据多种因素进行个体化设计。首先,进展的类型至关重要,例如寡转移进展患者可能从局部治疗中获益,而广泛性转移性疾病则需采用全身性治疗方案。其次,需要区分进展是由原发性抗药性还是继发性抗药性引起,因为原发性抗药性可能需要完全不同的治疗策略。是否因毒性或疾病进展提前终止免疫检查点抑制剂也是一个关键考量,尤其是在毒性未能完全恢复的情况下。此外,进展发生的时间(在治疗期间还是治疗完成后)对后续治疗选择也有影响,治疗完成后的进展可能需要重新挑战免疫治疗或采用不同的治疗方法。患者的既往治疗历史(如使用过的药物和疗效)以及个人因素(如年龄、合并症和整体健康状况)同样是制定治疗方案的重要依据。综合考虑这些因素,有助于为患者提供更有针对性的治疗策略,从而优化治疗效果和生活质量。进展后治疗与原发性和继发性抗药性免疫检查点抑制剂的抗药性可分为两种类型:原发性抗药性:患者最初对免疫检查点抑制剂无反应。继发性抗药性:患者最初对免疫检查点抑制剂有反应,但随后出现抗药性。无论是原发性还是继发性抗药性,均可能由适应性免疫抗药性引起(即肿瘤被免疫系统识别后适应免疫攻击的机制)。其影响因素如下:类型描述外在因素- 肿瘤微环境:免疫抑制性细胞因子、免疫逃逸机制等。- 内分泌和代谢因素:糖代谢或脂质代谢紊乱影响免疫反应。- 环境因素:类固醇使用、年龄增长、宿主遗传学异常等。内在因素肿瘤基因组特性和分子信号通路的改变(如PD-L1过表达或突变)。免疫表型框架及治疗策略Chen和Mellman提出了一个免疫表型框架,用于指导抗药性患者的个性化治疗方案:免疫表型机制推荐治疗策略免疫荒漠型肿瘤未被免疫系统识别(免疫无知)或免疫耐受,缺乏T细胞初始激活。化疗、放疗、靶向治疗或其他免疫检查点抑制剂的组合治疗。免疫排除型抗药性涉及基质因素(如机械屏障、血管因子或免疫抑制性趋化因子状态)。抗基质药物(如抗纤维化疗法)和抗血管生成药物的联合治疗。免疫炎症型涉及耗竭的T细胞、抑制性细胞、细胞因子或替代性检查点。与其他免疫检查点抑制剂或免疫调节剂的组合治疗(如抗CTLA-4和抗PD-1联合使用)。预防原发性抗药性的组合治疗研究表明,组合疗法可能在预防原发性抗药性中发挥重要作用。以下是一些关键的组合疗法及其示例研究:组合疗法试验双重免疫检查点抑制剂-晚期黑色素瘤中,nivolumab+ipilimumab与单药疗法(nivolumab或ipilimumab)比较研究。免疫检查点抑制剂+靶向治疗-JAVELINRenal101试验:avelumab(抗PD-L1)+axitinib对比sunitinib治疗晚期肾细胞癌。免疫检查点抑制剂+化疗/联合疗法-非鳞状非小细胞肺癌中,atezolizumab联合化疗或bevacizumab显示出疗效。继发性抗药性治疗的研究继发性抗药性患者的治疗方案正在探索之中。一个关键研究是Morpheus研究(NCT03337698),该研究正在评估基于免疫治疗的组合疗法,用于治疗含铂方案及PD-1或PD-L1抑制剂治疗失败后的转移性非小细胞肺癌患者。此类研究重点在于为抗药性患者开发创新性二线治疗方案。通过结合患者的免疫表型和具体病情特点,上述框架和研究为个性化治疗提供了坚实的理论基础和实践依据寡进展后的治疗当患者在最初的成功治疗后(部分缓解或疾病稳定持续数月)出现疾病进展,但仅限于一个或少数几个部位(即寡进展)时,治疗方法可能包括继续使用免疫检查点抑制剂,同时针对进展部位采用局部治疗(如手术、消融或立体定向消融放疗)。一项回顾性研究调查了52名接受免疫检查点抑制剂单药或联合治疗的转移性黑色素瘤患者,这些患者发生了寡进展(1至3个部位),进展部位随后通过局部治疗进行管理。结果显示,3年无进展生存率为31%,5年疾病特异性生存率为60%,表明该方法具有潜在疗效。局部放疗的系统性效应(旁观者效应):累积证据表明,局部放疗偶尔可诱导系统性效应,对未接受放射治疗的病灶产生反应(称为旁观者效应)。这种效应在与免疫检查点抑制剂联合治疗时更为常见。其机制包括:肿瘤细胞因放疗死亡后释放肿瘤抗原,由抗原递呈细胞在肿瘤引流淋巴结中呈递,从而激活T细胞。激活的T细胞对抗放疗靶病灶以及其他部位的肿瘤细胞。此外,放疗已在前临床模型中被证明可以上调PD-1和PD-L1轴,这进一步支持局部治疗与抗PD-1或PD-L1抑制剂持续治疗相结合的合理性。特定临床情境下的进展后治疗在免疫治疗失败后的治疗决策中,针对不同临床情境制定基于数据的个性化策略是关键。1.因免疫相关不良事件提前停用免疫检查点抑制剂的患者对于因免疫相关不良事件而提前停用免疫检查点抑制剂的患者,重新挑战(rechallenge)可能是一种选择。研究表明,再次使用免疫检查点抑制剂时,超过一半的患者可能出现免疫相关不良事件的复发或新发。例如:一项研究包括93名因免疫相关不良事件停用抗PD-1或PD-L1疗法的患者,其中40名接受了重新挑战。结果显示,22名患者(55%)复发了相同或新发的不良事件,严重程度与初次事件相当或略轻。在另一项针对167名因免疫相关腹泻或结肠炎停药的患者中,重新接受免疫检查点抑制剂治疗的患者中有57名(34%)再次发生类似的不良事件。此外,对于毒性涉及心脏或神经系统的患者,不建议重新挑战,因为此类毒性可能导致严重或不可逆的后果。2.完成免疫疗程后进展的患者对于完成免疫检查点抑制剂治疗的患者,如果疾病在疗程结束后进展,再次使用免疫检查点抑制剂或挽救疗法可能是有效的选择。例如,在KEYNOTE-10试验中:690名PD-L1表达的晚期非小细胞肺癌患者接受了pembrolizumab治疗,其中79名(11%)完成了35个周期的治疗(约2年)。在这些患者中,14名(2%)在治疗后进展并接受了第二次pembrolizumab治疗,结果显示6名患者(43%)获得部分缓解,5名患者(36%)疾病稳定。这表明,重新挑战免疫检查点抑制剂可能恢复肿瘤对免疫治疗的敏感性,尤其是在首次治疗有效的患者中。3.持续治疗期间进展的患者对于在免疫治疗期间出现疾病进展的患者,化疗、靶向治疗或临床试验是主要的挽救治疗选择。继续使用免疫检查点抑制剂的效果通常较差。例如:一项研究评估了18名接受PD-1抑制剂(nivolumab或pembrolizumab)治疗后改用PD-L1抑制剂(atezolizumab)的患者。结果显示,0%的患者获得完全或部分缓解,39%的患者疾病稳定,61%的患者疾病进展。这表明,对于治疗期间进展的患者,应考虑更换治疗方案或参加临床试验。4.结合局部治疗的策略对于寡转移进展的患者,局部治疗(如放疗、消融或手术)与免疫检查点抑制剂的联合应用显示出一定的效果。例如:一项回顾性研究中,52名转移性黑色素瘤患者在发生1-3个部位的寡转移进展后接受了局部治疗,同时继续免疫检查点抑制剂治疗。3年无进展生存率为31%,5年疾病特异性生存率为60%。此外,放疗的旁观者效应(abscopaleffect)在免疫治疗中有所观察,可能进一步增强系统性抗肿瘤免疫反应。免疫治疗后的挽救治疗在免疫治疗失败或疾病进展后,挽救治疗是一种关键的后续治疗策略,其选择需根据患者的病情特征、既往治疗史以及整体健康状况进行个性化设计。挽救治疗包括化疗、靶向治疗、免疫治疗再挑战以及临床试验等多种方法。首先,化疗仍是免疫治疗后最常见的挽救方案之一。免疫治疗可能通过改变肿瘤微环境增强化疗的效果。例如,肿瘤中的免疫激活可能破坏其耐药性屏障,从而提高化疗药物的疗效。特别是对于没有明确驱动基因突变的患者,化疗通常是标准选择之一。其次,靶向治疗在免疫治疗失败后也显示出显著的疗效。对于携带特定基因突变(如EGFR、ALK、BRAF突变)的患者,靶向药物可以针对性地抑制肿瘤生长。例如,在ALK重排的非小细胞肺癌患者中,使用克唑替尼等ALK抑制剂可能是有效的挽救策略。靶向治疗通过精准定位肿瘤的分子靶点,减少对健康组织的影响,同时实现较高的治疗效果。再挑战免疫治疗也是一种潜在选择,尤其适用于对初次免疫治疗表现出部分或完全反应但随后进展的患者。再挑战的理论基础是记忆性T细胞的激活,这些T细胞可能在免疫治疗间隔期重新发挥作用,从而恢复患者对免疫检查点抑制剂的敏感性。再挑战的成功率通常依赖于患者的免疫状态以及疾病进展的模式。此外,对于无法通过常规治疗方案控制疾病的患者,临床试验提供了新颖的治疗选择。当前的临床试验正在评估双重免疫检查点抑制剂组合、新型免疫调节剂(如STING激动剂、TLR激动剂)、以及细胞疗法(如CAR-T或TIL疗法)等策略。这些前沿疗法为标准治疗失败的患者提供了希望,并可能带来更长的生存期或更好的生活质量。最后,联合治疗策略正在被广泛研究,这些策略将免疫治疗与化疗、靶向治疗或抗血管生成药物结合使用。例如,在非小细胞肺癌患者中,atezolizumab与化疗和bevacizumab联合治疗显示出显著的临床疗效。联合治疗通过多途径增强抗肿瘤作用,有助于克服免疫抗药性并进一步控制疾病。总之,免疫治疗后的挽救治疗需要根据患者的具体情况进行个性化决策。化疗、靶向治疗、免疫治疗再挑战以及临床试验均是重要的选择,而联合治疗策略也显示出广阔的应用前景。通过综合评估患者的病情和治疗背景,制定最佳挽救治疗方案对改善患者预后至关重要。结论免疫治疗的引入为多种癌症的治疗带来了革命性的变化,但随着其广泛应用,疾病进展后的管理变得日益复杂。在免疫治疗失败后,针对患者具体情况选择合适的挽救治疗方案至关重要。挽救治疗方法包括传统化疗、靶向治疗、免疫治疗再挑战、以及创新的临床试验策略。化疗作为一种传统疗法,在免疫治疗失败后仍显示出一定疗效,尤其是对于没有特定驱动基因突变的患者。此外,对于具有驱动基因突变的患者,靶向治疗提供了精准高效的选择,通过针对肿瘤分子靶点实现更好的控制。而免疫治疗再挑战作为一种潜在策略,尤其适用于曾经对免疫治疗有反应但随后进展的患者。再挑战可能通过重新激活记忆性T细胞恢复患者对免疫治疗的敏感性。对于常规治疗无效的患者,临床试验提供了探索新型治疗方法的机会,例如双重免疫检查点抑制剂、免疫调节剂、以及细胞疗法等。这些前沿治疗方法可能为患者带来更长的生存期和更好的生活质量。此外,联合治疗策略,如免疫治疗与化疗、靶向治疗或抗血管生成药物的结合,为克服抗药性和提高疗效提供了新的途径。总之,免疫治疗后的挽救治疗需要全面评估患者的病情、治疗背景以及个体特征,以制定最优方案。通过个性化的综合管理,不仅能够延长患者的生存时间,还可以显著改善其生活质量,为癌症治疗的未来提供了新的希望。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科191人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科191人已读 - 精选 鳞状细胞癌分哪些?
(1)普通鳞状细胞癌:恶性,常有淋巴结转移,术后易复发肉眼观:呈菜花状,亦可坏死脱落形成溃疡。癌组织切面呈灰白色或浅褐色,向深部结缔组织呈浸润生长,边界不清。细胞呈鳞状分化和侵犯周围正常组织。镜下观察:鳞状分化的癌细胞呈不同程度的细胞内或细胞外角化,细胞排列呈实性巢状、条索状或岛状结构;在分化较好的癌巢中,周边细胞呈基底细胞样、内部为棘细胞,可见细胞间桥;中央可见角化珠或癌珠。较大的癌巢内可见坏死。肿瘤间质常见纤维结缔组织增生,可伴有数量不等的淋巴细胞浸润。癌旁黏膜上皮呈不同程度异常增生。高分化鳞癌与正常鳞状上皮类似,即含有数量不等的基底细胞和具有细胞间桥的鳞状细胞,角化明显,核分裂像少,非典型核分裂和多核细胞极少,胞核和细胞多形性不明显。中度分化鳞状癌具有独特的多形性和核分裂,包括非正常核分裂,角化不常见,细胞间桥不明显。低分化鳞癌以不成熟的细胞为主,有大量正常或不正常的核分裂,角化非常少,细胞间桥几乎不能发现。(2)疣状癌(verrucouscarcinoma):床表现:一种非转移性高分化鳞癌的亚型,以外生性、疣状缓慢生长和边缘推压为特征,与长期使用烟草及HPV-16、18感染相关。老年男性多见。75%发于口腔,下唇多见(颊、舌背、龈、牙槽黏膜均可发生)。病变开始为边界清、细的白色角化斑块、迅速增厚,发展成钝的乳头状或疣状,表面突起通常表现为宽的基底或无蒂。一般无症状,不出现溃疡、出血。由厚的棒状乳头和具有明显角化的分化良好的鳞状上皮呈钝性突入间质内构成。鳞状上皮缺乏一般恶性肿瘤的细胞学改变,细胞较鳞状细胞癌中的细胞大,核分裂象少见,仅位于基底层,有时可见上皮内微小脓肿。疣状癌呈推进式侵犯间质,无浸润边缘。密集的淋巴细胞,浆细胞是常见反应。瘙周上皮下陷呈杯状包围在疣状癌的周边。含传统的鳞状细胞癌的病灶称杂交瘤,其具有局部复发和转移的潜能。(3)基底细胞样鳞状细胞癌:由基底样细胞和鳞状细胞组成。基底样细胞小,核浓染,没有核仁,胞质少,排列紧密,分叶状实性排列。小叶周边细胞呈栅栏状排列,多见粉刺样坏死。常伴有鳞状细胞癌的成分,鳞状细胞和基底样细胞间的分界可以非常突然。(4)乳头状鳞状细胞癌:以显著的乳头状生长为特点,有纤细的纤维血管轴心,表面覆以肿瘤性的、不成熟的基底样或多形性的细胞。常见坏死或出血,间质侵袭由单个或多个癌巢构成,在肿瘤-间质界面有大量的淋巴细胞浆细胞浸润。如未见间质浸润,则将病变称为非典型乳头状增生或原位乳头状癌。(5)梭形细胞癌:由原位或侵袭性的鳞状细胞和恶性的梭形细胞构成。梭形细胞成分常构成肿瘤的大部分,有时只见梭形细胞。(6)棘层松解性鳞状细胞癌:一个少见的亚型,肿瘤细胞的棘层松解,形成假的腔隙和假的腺管分化的外观。棘层松解性鳞状细胞癌的组织学表现与其他鳞状细胞癌相似,但具有一些独特的特点。该肿瘤的细胞形态多样,包括圆形、多角形、梭形和不规则形等。细胞核大小不一,染色深浅不一,核分裂像多。此外,棘层松解性鳞状细胞癌的细胞排列方式也较为特殊,呈现出明显的片巢状或旋涡状排列。棘层松解性鳞状细胞癌的细胞形态学改变与其他鳞状细胞癌有所不同。该肿瘤的细胞核大而深染,核沟较明显,核分裂像多。此外,棘层松解性鳞状细胞癌的细胞质较为丰富,有时出现空泡状或透明状改变。在显微镜下观察时,可以发现该肿瘤的细胞之间缺乏角化珠和细胞间桥粒蛋白的表达,这是导致棘层松解的主要原因。棘层松解性鳞状细胞癌的生长方式与其他皮肤肿瘤有所不同。该肿瘤的生长速度较快,且容易发生转移和扩散。棘层松解性鳞状细胞癌的生长方式通常为浸润性生长,侵犯周围组织,破坏器官结构。在生长过程中,该肿瘤容易形成卫星结节或发生区域淋巴结转移。(7)腺鳞癌:鳞癌部分可以是原位癌或浸润癌,腺癌成分多见于肿瘤的深部,为腺结构,其衬里细胞为基底样细胞、柱状或产黏液细(8)玻璃样(透明细胞)鳞状细胞癌:角质形成细胞由于水溶肿而显得透明。(9)隧道型鳞状细胞癌:燧道型鑾状细胞癌.呈内生性生长伴充满角蛋臼的深部穿透性窝,生长缓,但向深部浸润,可侵入骨或周围软组织,细胞缺乏细胞异型性。(10)乳头状鳞状细胞癌.比较少见。
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科715人已读 - 精选 IgG4相关疾病及唾液腺
概述:免疫球蛋白G4相关疾病(ImmunoglobulinG4relateddisease,IgG4-RD)是一种免疫介导的全身性疾病,其特征为血清IgG4水平升高、淋巴细胞浸润、纤维化和由此产生的器官功能障碍。该疾病首先在2003年提出,用于描述先前认为的一类同时发生的不相干疾病(见下图)。38%的IgG4相关疾病,累及唾液腺。图片来自网络属于IgG4相关疾病谱的疾病I型自身免疫性胰腺炎(淋巴浆细胞硬化性胰腺炎)硬化性胆管炎腹膜后纤维化((Ormond’sdisease)肥厚性硬脑膜炎米库利奇病(Mikulicz’sdisease)里德尔甲状腺炎(Riedel’sthyroiditis)库特纳瘤(Ku¨ttner’stumor)嗜酸性粒细胞性血管中心性纤维化多灶性纤维硬化炎性假瘤纵隔纤维化炎性主动脉瘤心包炎和动脉周围炎广泛肾小管间质沉积的特发性低补体血症肾小管间质肾炎硬化性肠系膜炎流行病学:由于IgG4-RD是一种新发现的实体,其发病率和患病率尚未确定。大多数IgG4-RD流行病学研究均在日本进行,重点关注I型自身免疫性胰腺炎。日本I型自身免疫性胰腺炎的患病率估计为2.2例/100000。然而,由于胰腺只是可能累及的许多器官之一,因此这可能低估了IgG4-RD的患病率。病理生理学:虽然IgG4-RD可以影响任何器官,但它对某些器官系统有偏好。大唾液腺、眼眶、泪腺、胰腺和胆道系统、肺、肾、主动脉和腹膜后腔、脑膜和甲状腺受影响最大。该疾病通常遵循双相过程,其特征在于初始炎症阶段,随后是纤维化结果。在炎症阶段,多克隆B和T细胞亚群浸润受影响的组织,并经历相互活化、抗原介导的相互作用,导致促纤维化细胞因子如IL-1B、IL-6、干扰素-g、转化生长因子-B和血小板衍生生长因子B的分泌。尽管尚未显示细胞毒性T淋巴细胞直接诱导组织纤维化,但已显示来自IgG4-RD患者的浆母细胞在体外激活成纤维细胞和胶原蛋白产生。促进幼稚B细胞成熟为成熟浆细胞,导致IgG4的产生和分泌。目前,IgG4抗体对IgG4-RD发病机制的贡献知之甚少,但已提出IgG4抗体和细胞毒性T淋巴细胞协同作用诱导组织炎症。在疾病的第二阶段,即纤维化阶段,先天性免疫细胞(如M2巨噬细胞)浸润IgG4-RD病变并分泌促纤维化细胞因子,包括IL-10、IL-13和IL-33。活化的成纤维细胞开始存款细胞外基质,导致致密的基质反应,扭曲组织结构,导致器官功能障碍和可能的器官衰竭。临床表现:由于IgG4-RD可影响多个器官系统,因此临床表现多种多样。患者出现与受影响器官系统相关的症状。约75%的患者有多器官受累;由于受累器官可能有亚临床受累,多器官疾病可能随着时间的推移而演变。IgG4-RD通常与过敏性疾病相关。患者可能出现IgE水平升高和外周嗜酸性粒细胞增多。约40%至44%的IgG4-RD患者有过敏性疾病史,包括过敏性鼻炎、哮喘、荨麻疹、湿疹和过敏性肺炎。在唾液腺受累的患者中,最常见的表现是孤立的双侧颌下腺肿大;然而,腮腺和舌下腺也经常增大并伴有触痛。即使肉眼看起来正常,小唾液腺也会受到影响。口干症经常出现,但不像舍格伦综合征那样严重。涎石症,唾液淤积,和粘液栓及继发的涎腺炎也是常见症状。临床分型:IgG4相关疾病的临床表型Group1(肝胆胰)Group2(腹膜后,主动脉)Group3(头颈部局限)Group4(Mikulicz/系统性)主要累及器官胰腺、肝脏、胆道系统腹膜后,主动脉眼眶、泪腺、唾液腺、鼻窦泪腺、唾液腺、鼻窦、胰腺、胆道系统、肾、肺、淋巴结、前列腺年龄老年人老年人年轻人老年人性别男男女男种族白人白人亚洲人无差别血清IgG4上升正常或轻度上升上升显著上升病理检查:颌下腺组织学显示IgG41浆细胞浸润[100x,IgG4免疫染色]。(图片来源:CourtesyofM.BoydGillespie,MD,Memphis,TN.)IgG4-RD的5个组织病理学标志:致密淋巴浆细胞浸润、“Storiform”模式的组织纤维化、闭塞性静脉炎、浸润性IgG4+浆细胞和免疫组织化学上IgG4+/IgG+浆细胞比超过40%。通常认为,细针穿刺活检可能不足以识别IgG4-RD的形态学特征。血清学检查:血清IgG-4升高是IgG4-RD的特征性发现,但该标志物对IgG4-RD既不敏感也不特异。它在大约50%至90%的患者中升高。血清IgG4升高的程度与疾病的严重程度和受累器官的数量相关。在9项病例对照研究的荟萃分析中,包括1235例IgG4-RD患者和5696例对照,血清IgG4正常上限范围为135至144mg/dL。使用正常值上限作为临界值,血清IgG4升高为IgG4RD诊断提供了87%的灵敏度和83%的特异性。使用正常值上限两倍的临界值(270-280mg/dL)提供了增加的特异性(95%),但降低的灵敏度(63%)。因此,血清IgG4水平是有信息的,但作为独立的诊断测试是不准确的。炎症的血清学标志物,如红细胞沉降率和C反应蛋白可能在IgG4-RD中升高,但是非特异性标志物。约一半患者的红细胞沉降率中度升高。约一半患者的CRP也升高,但与主动脉/主动脉周围受累的IgG4-RD尤其相关约30%至44%病例的特应性与IgG4-RD相关因此,35%至67%的病例存在血清IgE浓度升高。嗜酸性粒细胞增多症在约三分之一的病例中被发现。影像学检查:单独的放射学检查通常不能确定IgG4-RD的诊断,但可以提供有用的辅助数据。IgG4相关的自身免疫性胰腺炎是例外。计算机断层扫描(CT)和MRI通常显示胰腺弥漫性增大,伴包膜样边缘,无导管扩张,无低密度肿块。这些结果可在适当的临床环境中诊断IgG4相关自身免疫性胰腺炎。相反,IgG4相关涎腺炎的影像学表现是非特异性的。CT扫描和MRI显示大唾液腺弥漫性增大,无其他显著发现。在某些病例中,腮腺可能存在浅表增强。这一发现与舍格伦综合征相反,典型的“盐和胡椒”CT扫描和MRI表现。多普勒超声检查是IgG4相关性涎腺炎的首选成像方式,与舍格伦综合征相比,IgG4-RD特异性的结节和网状结构。PET扫描的特异性较差。诊断指南:已经发表了多个共识声明和指南,以帮助临床医生准确诊断IgG4-RD。目前的诊断标准是在2011年第一届IgG4-RD国际研讨会上制定的。这些标准根据临床、血清学和病理学数据将IgG4-RD分类为确定性、很可能或可能。当无法获得病理学确认时,可提供IgG4-RD的可能诊断。Umehara,Hisanorietal.“ComprehensivediagnosticcriteriaforIgG4-relateddisease(IgG4-RD),2011.” Modernrheumatology vol.22,1(2012):21-30.doi:10.1007/s10165-011-0571-z治疗:IgG4-RD的治疗取决于疾病的严重程度、受影响的器官系统和个体患者因素。IgG4-RD通常在早期炎症阶段比在发生不可逆器官损伤的后期纤维化阶段对治疗的反应更大。IgG4-RD通常遵循复发-缓解过程。因此,重要的是要考虑初始治疗方案以及长期维持治疗。糖皮质激素糖皮质激素是所有活动性IgG4-RD患者的一线治疗药物。一般而言,患者在数天至数周内对中等或高剂量类固醇迅速产生反应。如果患者对类固醇无反应,则IgG4-RD的诊断应受到质疑,因为IgG4-RD是典型的类固醇反应。治疗持续时间高度可变,但目前的指南建议在3至6个月的疗程内逐渐减量之前,继续使用最初的类固醇剂量2至4周。更快的减量或早期停药与更高的复发率相关。免疫抑制剂许多传统的免疫抑制剂已被用于治疗IgG4-RD,但缺乏证据支持其使用。甲氨蝶呤、硫唑嘌呤、吗替麦考酚酯、来氟米特、他克莫司、环孢菌素A、环磷酰胺和艾拉莫德都曾与皮质类固醇联合使用以诱导缓解。当存在多器官受累或血清IgG4水平高等相关疾病特征时,这些免疫抑制剂与皮质类固醇联合给药,作为初始治疗方案的一部分。观察性研究表明,与单独使用类固醇或免疫抑制剂相比,免疫抑制剂和类固醇双重治疗在实现缓解方面具有上级优势。此外,传统免疫抑制剂在有皮质类固醇禁忌症的患者中可能发挥作用。生物制剂(单抗)利妥昔单抗在IgG4-RD中最重要的作用可能是维持治疗。利妥昔单抗在预防复发方面比其他传统免疫抑制剂更有效;然而,其剂量和给药方案尚未明确确定。多种其他生物制剂已用于孤立的难治性IgG4-RD病例,如阿巴西普、英夫利昔单抗和dupilumab,但它们在治疗IgG4-RD中的作用尚未明确。手术由于IgG4-RD是一种全身性疾病,其特征是对药物治疗高度敏感,因此手术干预不是标准治疗方案。切除或切口活检可用于诊断目的。手术对IgG4-RD涎腺炎的进一步作用尚未得到充分研究。据我们所知,目前尚无使用唾液内镜或唾液内镜治疗IgG4-RD患者的病例系列报告。唾液腺内窥镜检查有可能通过清除唾液腺结石和碎片、扩张狭窄导管和浸润皮质类固醇药物来治疗IgG4相关的涎腺炎,这已被证明在其他自身免疫性疾病的治疗中是有用的。总结:IgG4-RD是一种相对较新定义的全身性疾病,通常累及唾液腺。多学科诊疗和研究,需要在今后的治疗过程中发挥更大作用。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科106人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科106人已读 - 精选 什么是颌骨囊肿的开窗减压术?
颌骨囊肿一般因为早期无任何症状,发现时候就已经很大了。做完整刮治手术,会导致剩余骨质较为薄弱,引起下颌骨骨折。若节断性切除后做骨移植,对于一个良性肿瘤来说,患者所付出的代价较大。付出代价多大,可以参照文章《分享|腓骨瓣修复上颌骨缺损手绘》。虽然不是同一疾病,但修复方式相同,十分直观。因此,有一种“试一试”的治疗方式,就是将囊肿开窗。有袋化的开窗减压术是通过将囊肿衬里缝合到口腔黏膜上,将囊肿转化为袋状。做上塞治器或者置引流管。患者每天用盐水冲洗囊腔,如果到了一年,囊肿明显缩小,那么就会有骨质形成。那时再进行手术,不仅完整刮除的概率较高,而且还避免了骨折和骨修复。同时最大程度保留了颌骨的形态。这种治疗在保存重要的解剖结构和恒牙方面比直接刮治术并发症少。其缺点是病理组织留在原位,会产生粘连,在随后的刮治过程中,需要更加仔细刮除,以免复发。另外,成釉细胞瘤、鳞状细胞癌或骨内黏液表皮样癌可由含牙囊肿内的细胞发展而来。颌骨囊肿开窗减压术在20世纪60年代提出,但未成为主流。随着功能外科的普及,该观念得以被人接受。据研究,其成功率大致有70%~85%之间。同时,缩小不明显的患者也有不同程度的缩小。该术最可能发生的并发症即是感染。术中应当注意不要暴露太多骨面,同时将黏膜和囊壁缝合。术后,会有食物残渣掉入腔内,但如果每日认真冲洗,一般不会造成感染。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科276人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科276人已读 - 精选 面瘫,不可忽视的腮腺肿瘤
关于面瘫的文章,之前写过两篇,今天写第三篇。前面两篇是老号写的。第一篇是面瘫中最常见的一种类型,就是贝尔氏面瘫。一般通过急性期的扩血管、抗水肿激素治疗可以缓解。康复期辅助理疗,可以改善功能。第二篇是关于陈旧性,或者叫晚期面瘫的皮瓣修复,通过游离皮瓣,进行血管和神经吻合。可以恢复部分功能。但这并非是面瘫的全部。如果你面瘫了,一个医生让你去拍个CT。绝对不是过度诊疗。因为颅内的占位,也可以造成面瘫。同时,口腔颌面外科最常见的腮腺肿瘤,如果是恶性的,也会累及面神经。造成面瘫。如果仅仅通过理疗,或者针灸。不仅没有效果,还耽误病情。病例一,男,37岁,右侧腮腺导管癌,cT4bN0M0,ⅣB期。现病史:2023年5月底患者开始出现右侧面瘫症状,右侧嘴巴紧绷及右侧闭眼不全为主,2023年6月初就诊某中医院,诊断为“面瘫”,予“针灸理疗”+“营养神经药物”治疗,未完全好转,之后完善MRI检查,建议来我院就诊。2023年8月1日来我院门诊就诊,行穿刺活检,病理示:“涎腺导管癌”。现行MDT制定后续治疗方案。专科检查: 颜面不对称,右侧面部较饱满突出,右侧腮腺区见一巨大肿物,上至眶底平面,下至下颌骨下缘,前过咬肌前缘,后近乳突区,皮肤表面光滑,肿物偏硬,界欠清,无明显触痛,无出血。右侧面部表情肌瘫痪,右侧皱眉额纹消失,右侧眼睑闭合不全,右侧口角下垂,右侧鼻唇沟变浅。舌体伸舌居中,活动自如。开口度、开口型基本正常。余口腔黏膜无红肿、破溃、斑块等,口内卫生一般,双侧腮腺导管口无红肿溢脓。双侧颞下颌关节无明显异常。双侧颈部及颌下未扪及肿大淋巴结。病例二,女 63岁,现病史:2个月前,2023年4月23日患者开始出现右侧面瘫,2023年4月25日就诊于外院,予“甲钴胺+抗生素+维生素B”治疗,具体剂量不详,无明显好转。2023年5月5日就诊于广州高端私立医院神经内科,排查脑卒中可能,继续予“弥可保0.5mgtid+维生素B110mgtid+维生素B610mgtid营养神经”,“银杏叶提取物1mltid改善局部循环”,及“针灸理疗+面部神经操”,诉稍有好转。2023年5月23日理疗时发现右侧腮腺区肿物,之后逐渐肿大,2023年6月27日就诊于某私立肿瘤医院,行“影像学检查和右腮腺区肿物粗针穿刺活检术”,病理示“恶性肿瘤,符合中-低分化腺癌,倾向为导管源性可能。”。2023年7月5日因“右侧面瘫、右侧腮腺肿物伴偶有疼痛”来我院进一步诊治,拟诊断为“[右侧腮腺腺癌]”收入我科。起病以来,体力情况良好,胃纳良好,睡眠情况良好,大便正常,小便正常,体重无明显减轻。专科查体:颜面不对称,开口度、开口型异常,右侧面部表情肌瘫痪,右侧皱眉额纹消失,右侧眼睑闭合不全,右侧口角下垂,右侧鼻唇沟变浅,。右侧腮腺区耳下及耳后见一肿物,约50mm40mm30mm,后至乳区域,前至咬肌前缘区,上及对耳屏部,下至下颌角区,皮肤表面光滑,质偏硬,边界欠清,触痛明显,无出血。舌体伸舌居中,活动自如。余口腔黏膜无红肿、破溃、斑块等,口内卫生一般,双侧腮腺导管口无红肿溢脓。双侧颞下颌关节无明显异常。双侧颈部及颌下未扪及肿大淋巴结。由于担心触犯互联网的规定,就不放患者照片了。但从文字描述中,已经可以知道:这两个患者都出现了面瘫,同时都求助于针灸和理疗。结果等到面部变形,或者转诊检查后,才发现是腮腺恶性肿瘤。而第一个患者,肿瘤侵犯了颅底和海绵窦,基本失去了手术的机会。而第二个患者,理疗和推拿导致胸锁乳突肌大面积水肿,颈部摸起来硬硬的,我们和影像科老师研究半天,也不知道这是水肿,还是转移了。可以预见,随着全科诊疗和私立医院的兴起,一些易于推广的治疗,如理疗、针灸会更加深入人心。不怪全科医生孤陋寡闻,因为腮腺肿瘤确实是小众疾病。就连患者都说,查了很久,都不知道这个病去哪里看。所以,规范的诊疗,对全科医生尤为重要。在病人出现面瘫的时候,首先排除颅内肿瘤或者其他区域肿瘤性病变,是最为关键的。排查了这项后,再结合体征,确定是否是贝尔氏面瘫。再根据发病时间,到底是急性期,还是晚期。可以选择不同的治疗方案。这是思考问题的方式。这里并不是说针灸和理疗不适合。大家可以看到,针灸和理疗,适用于面瘫中特定时期。而治疗前,若是照个CT,就绝对不会出现这样的情况。患者和医生,都应该有极其清醒的思维。今天讲了下面瘫为什么要拍CT。接下来几天会介绍下腮腺的恶性肿瘤。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科186人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科186人已读 - 精选 药物相关性颌骨骨坏死患者的口腔管理
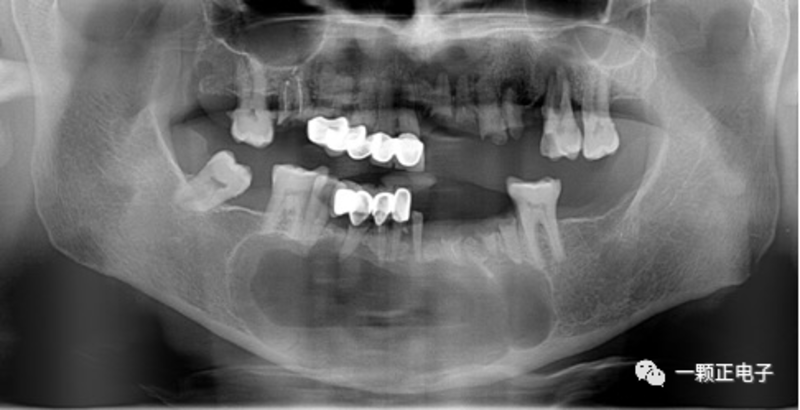
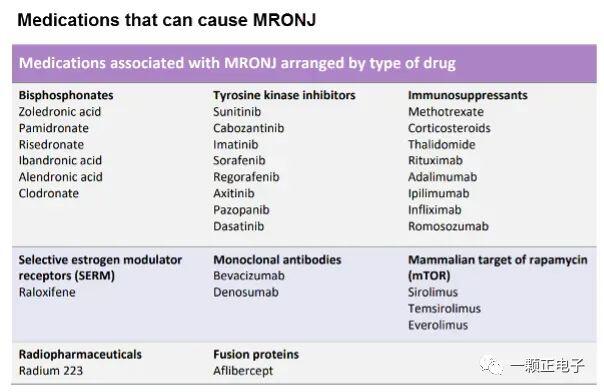
药物相关性颌骨坏死(medication-inducedostenecrosisofthejaw,MRONJ)是一种慢性骨坏死暴露的疾病,通常伴有疼痛、原发或继发感染。临床上,患者主诉一般是口臭、饮食和言语困难。通常表现为:口腔黏膜溃疡,骨暴露,伴有剧烈疼痛。病变一般是持续性的。对于口服阿仑膦酸盐的患者,MRONJ的发病率为1:10000~1:25000。以下是可以引起MRONJ的3种主要药物:1、双膦酸盐双膦酸盐是一类用于治疗骨质疏松和恶性骨转移的药物。其通过抑制破骨细胞的募集和活性来抑制骨吸收,从而缩短破骨细胞的寿命。此类药物可在体内存留数年,患者会出现生理骨沉积和骨重塑受损。同时,双膦酸盐类药物具有抗血管性,可直接杀伤肿瘤。成为一种重要的抗癌药物。常见的双膦酸盐类药物有:第一代双膦酸盐类药物:依替膦酸钠第二代双膦酸盐类药物:氯膦酸钠、帕米膦酸钠和替鲁膦酸钠最新一代双膦酸盐类药物:阿仑膦酸钠、奈立膦酸钠、奥帕膦酸钠、利塞膦酸钠以及伊班膦酸钠、唑来膦酸。2、RANK配体抑制剂RANK配体抑制剂(地诺单抗,狄诺塞麦)是一种抗RANK配体(RANK/L)的人源化抗体,可抑制破骨细胞功能和相关的骨吸收。3、抗血管生成药物通过与干扰血管生成信号级联的各种信号分子结合,干扰新血管的形成。准备服用抗吸收药物的患者的口腔护理对于即将接受放疗的患者,口腔医生应该开展抗吸收药物治疗前的情况调查。大多数MRONJ发生在患者服用抗吸收药物6个月或更长时间后。如果可能,抗吸收药物治疗应该在侵入性手术后4-6周开展。同时,口腔预防、龋齿控制和牙体保存至关重要。要加强口腔卫生护理。及时对患牙及牙周病变进行处理。服用抗吸收药物患者的口腔护理建议口腔医生按照现有指南,突出预防。消除潜在的感染部位,同时进行口腔修复。同时,予以预防性的口腔卫生指导。发生药物性颌骨坏死患者的口腔护理对于已经确诊MRONJ病变的患者。主要治疗目的是改善患者的舒适感。治疗应当针对消除和控制疼痛、防止骨外露。如果暴露的骨头有尖锐的边缘,应予以消除。文献报道的MRONJ治疗方式,比如小清创、下颌骨节段切除等,都未能证明彻底有效。由于双膦酸盐半衰期特别长,因此停药后,一般不会发生愈合。停止口服双膦酸盐类药物6-12月后,部分自发性游离或清创伤口,会发生愈合。抗生素如青霉素V、阿莫西林或克林霉素有助于减少局部感染发生。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科183人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科183人已读 - 精选 为什么任何临床指南都是“仅供参考”?
教科书和指南,是指导临床医生工作的重要文献工具。另外,还有一般的临床科研文献,比如前瞻性的研究、回顾性的研究、个案总结以及综述心得。传统医学,还有一类医案。教科书一般权威,但滞后。指南一般一年修订2-3次。而其他的研究,也可以做参考。回顾性研究的证据级别较低。而个案总结和医案的证据级别是最低的。但是有时候,对于罕见的病情,无法进行大规模临床研究。这类报导也可为医生的工作,提供指导依据。还有一类,叫做基础研究。这里指的“基础”,权威的分法是分为解剖、生理、病理学、医学生物学这几个方向。也有的医学院,将药学院作为基础医学的一部分。最近几十年,分子生物学大大发展。人们把“基础医学”和“基础研究”等同于研究分子机制,这是错的。甚至临床医学,也泡在实验室做WB。但因为只有不懂的,才是高大上的。所以,当这些技术涌入的时候,人们往往失去了方向。近几年,随着技术的普及,这样的趋势被有所控制。基础研究得出的结论,是证据级别最低的。其中,研究的级别,从低到高分别是细胞、小鼠、狗、灵长类动物。毕竟,撒一包盐在培养皿,癌细胞也会死光。往往,三期临床试验和meta分析,是提供指南依据的文献。然而,这也代表着,指南是很死板的。比如,同样一种药,药商不一样,可能存在细微差别。很多研究证实作用效果差不多。但是A药有临床三期,B药没有。指南里就会推荐A药。化药年代,不同厂家的药,化学式一样,那还好办。但是生物医药年代,很多药物蛋白结构不同,结合位点不同,就十分严格了。另外一种情况,临床三期写的是晚期肿瘤有效,指南里就会写推荐晚期病人使用。在一个药物安全性和有效性都得到证实的情况下,晚期病人有效,早期必然也有效。因为没有证据,所以指南里不会写。所以,你知道早期病人也有效,但是指南里的适应症会限制到晚期,你这时候使用,都叫超适应症用药。一般出现这种情况的原因,是晚期患者结束战斗快,得出结论速度快。如果晚期有效,才可以开展早期研究,不然就存在疑似耽误病情的伦理问题。另外,早期病灶本身患者可以获得很长生命,观察时间也久,得出结论也久。还有一种情况,因为每个试验,都会有年龄限制,比如18-65岁。那么,在药物说明和指南上,没有证据显示65岁以上人群使用会如何。所以,一般在说明书上就写适用于18-65岁人群。这就限制了临床医生的使用。指南虽然有种种限制,但是在医疗技术规范化推广的时候,有重大用处。发达国家施行的分级诊疗制度,全科医生就是在指南范围内,对一部分病人进行处理。如果难度提高,就会转诊到专科医生处。这几年,医疗提倡规范化。医生要规范化培训,医院也要规范化建设。指南越来越受重视。很多基层医院的医生喝酒的时候会说:“我们虽然是小医院,但是很正规,因为是按照指南来的。”大学附属医院的医生,也十分重视指南。虽然他们往往不按指南进行治疗。因为每个医院都会有独门绝技,比如有的医院的诊断水平十分高超,有的医院放疗设备非常好,有的医院手术技能非常厉害。还有的医院icu非常强,人家不敢做的手术,你都敢做。做了去了icu,都能治好出来。那么,指南的指导意义就差了,指南里的有些方案,不仅要考虑有效,还要考虑可及性。经常,一个老牌大医院的医生,到另外一个老牌大医院去学习,会发出赞叹:“我x,你们这里是这么搞的。”然后大骂:“我们医院xxx部门、xxx科真是拖后腿,不然我们也这么搞。”但是大学附属医院的医生也看指南,因为要发文章,做科研。要看看指南里怎么说,我能不能改变指南。还有一类人,十分关注指南。就是那些老说别人不按指南治疗的人。前段时间,这方面的新闻确实不少。指南的设定,会有不少条件。比如,你认为这样的治疗更加有效,发表了文章。写信给NCCN,要求他们重视。但NCCN也很为难,会回信说:“在美国,这样的治疗是集中在社区医院做的,他们的治疗,完全达不到你文章中说的精度,然而,你的文章说要做到如何如何,患者才能最获益。是因为在中国,这样的治疗是在专科医生手下完成的。”(这个故事,是别人的真实故事,在此只能隐姓埋名表达个意思,不然有人看着我指中国医疗技术好,美国差,肯定心里不爽)。所以说,不完全按照指南治疗,并不是不规范行医。有时候指南要考虑到普适性。有位老前辈给我们讲过一个故事:有个患者在微信群里观察,发现跟着A教授治的,都得到很好的结果,而跟着B教授治的,都得到了较差的结果。后来,发现B教授是死板得执行指南,规范到死的诊疗模式。还会有患者,告诉你xx国家,这个病如何治疗?我给他说这在我们本科学习中都有定论了。然后他要给你议论一番。我只能说任何地域和专科,都会有局限性。所以,如果观察仔细,会发现,任何指南都会提一句话:仅供参考。治疗要参考指南,但不是要和指南一样。超适应症治疗和有依据地改变治疗方式,也是应对指南僵化的一种方式。但是:如果指南或研究明确禁止的治疗,你要是尝试,那就是违规了。因为这代表,这个治疗已经有相当证据表明是错误的。
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科171人已读 - 精选 肿瘤重度免疫治疗相关不良反应概述
一、免疫检查点抑制剂(Immunecheckpointinhibitors,ICIs) ICIs包括抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)、抗程序性细胞死亡蛋白1(PD-1)及其配体(PD-L1)抗体等药物。ICIs引起的免疫相关不良反应(Immune-relatedadverseevents,irAEs)的发生,一般认为是两方面造成的。一方面是irAEs构成免疫耐受的经典突破,导致自身抗原反应性和病原性自身抗体的产生或原发性自身免疫疾病。另外一方面,不同的免疫致病机制会导致irAEs,进而每个受影响的器官中会出现不同的病理学表行。二、流行病学和分级 ICIs所致的irAEs发生率为54%-76%,可发生于多器官中,中位发生时间为治疗开始后的2-16周。其按美国癌症协会不良反应可分为G1-G5(CommonTerminologyCriteriaforAdverseEvents,CTCAE,网址:https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_archive)。特定的irARs发生的时间和频率不同,通常在前4周发病的概率较高。不同的癌肿可能驱动不同器官特异性免疫微环境的改变而出现不同的irAEs。在ICIs中,ipilimumab最常见的irAEs为皮肤毒性、胃肠道毒性和肾毒性,Pembrolizumab为关节痛,肺炎,和肝脏毒性。Nivoluma则主要表现为内分泌毒性。Atezolizumab最常发生甲状腺功能低下。三、IrAEs的临床特点1、广泛性:多器官受累。2、滞后性:往往在治疗后数周出现。3、不可预测性:需要早诊断和适当治疗。4、不同ICIs产生的不良反应谱不同。5、与化疗相比,发生率低,耐受性好,且大多数是可逆的。四、IrAEs诊疗流程:预防、检测、评估、治疗和监测1、预防:在治疗前进行IrAE进行宣教,密切观察ICIs治疗后出现的不适。2、检测:治疗前后的基本实验室和影像学检查。包括:影像学检查,一般血液学检查,皮肤黏膜检查,甲状腺功能检查,肾上腺及垂体功能检查,静息或活动时到血氧饱和度检查、心肌酶等。3、评估:患者用药后出现新症状或原症状是否加重。4、治疗: 1级反应,严密监测下继续治疗,神经系统及血液系统毒性除外。 2级反应,停止治疗,直到症状或实验室指标恢复到1级反应或更低。可给予糖皮质激素,如泼尼松0.5-1mg/(kg d)或等剂量其他激素。 3级反应,停止治疗,给予高剂量糖皮质激素,如泼尼松1-2mg/(kg d),或等剂量其他激素。激素应持续4-6周以上。对于某些使用高剂量激素48-72小时后仍未改善的反应,可选择英夫利昔单抗(Infixiamab)(很好记,“应付利息”)。或症状恢复到1级反应或更低时,可考虑恢复治疗,但应该谨慎。 4级反应,永久停止治疗。 对于不同级别的irAEs,应当采取分级管理,标本兼治的原则。同时,对于某些特定器官的特异性irAEs(胰腺炎、垂体炎)等,应完善专科会诊和转诊。5、监测: 症状体征及定期实验室检查。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科219人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科219人已读 - 精选 抗肿瘤相关免疫治疗不良事件(副反应)的识别、判定
注:本文中对治疗中出现的不良反应称为副作用,在临床试验中称为不良事件。随着肿瘤免疫治疗的应用及相关临床试验成为热点,如何提高免疫相关的不良事件的识别、判定的科学性和稳健性,提高临床试验说明书撰写质量和患者用药安全。在国家药品监督管理局的部署下,药审中心组织制定了《抗肿瘤治疗的免疫相关不良事件评价技术指导原则》。现整理如下:1)免疫相关不良事件(irAE)的定义抗肿瘤药物/治疗临床试验中,经判定与免疫机制有因果关系的所有级别的药物不良反应。另外,需注意,irAEs实际上是抗肿瘤药物作用机制介导引起的“不良反应”。需要明确其范围。如上图。2)判定医学考虑IrAE是由免疫机制介导发生的,临床表现主要与免疫细胞的活化相关,具有如下特征:A)通常为脱靶免疫反应,可累及单个或多个器官系统;B)部分产品的剂量-暴露量-安全性特征不明确,低剂量也可能导致严重irAE;C)发生时间多样,部分在用药后较快发生(如细胞因子释放综合征通常在48小时内发生),并迅速加重;部分具有迟滞效应,在用药数月后发生;部分在停药后发生并持续加重;D)部分irAE的发生率极低,需大样本和长时间观察才能暴露;E)不同作用机制的产品可具有相似的irAE。基于上述irAE的特点,在临床试验中,往往难以完全参照ADR(药物不良反应)判定的一般原则进行判定,进一步考虑因素如下:(1)针对目标irAE(包括疑似irAE)是否使用了全身类固醇治疗、其他免疫抑制治疗或内分泌替代治疗,以及治疗后转归;(2)病理检测结果(如有);(3)靶点免疫学机制;(4)事件与治疗的时间相关性,包括长期用药后发生,重新用药后事件是否再次出现或加重,以及停药后发生并加重的情形;(5)该事件同靶点药物已报告并明确为irAE;(6)目标irAE严重程度,单器官还是多器官/系统累及;(7)患者自身免疫疾病病史和基线疾病状态;(8)安全性相关生物标记物的支持(如有);(9)排除其他病因,与临床表现相似的非免疫事件的重要临床鉴别诊断(如免疫相关性肺炎和感染性肺炎);(10)排除其他可导致目标不良事件的合理解释(例如感染,合并用药和基础疾病);3)判定流程在产品总体医学判定上,申办者可结合研究方案的定义、数据收集等各方面考量,制定科学的流程进行判定。当前针对irAE总体判定流程,包括但不限于以下方式:(1)基于试验总体AE通过预设流程进行综合评价。(2)在研究者判定结果基础上,申办者按照预先设定的流程进一步评价汇总。研究者通常基于医疗经验进行irAE判定;申办者在研究者判定的基础上,基于在既往临床试验中获得的经验,再次进行irAE判定。(3)采用预设医学逻辑进行计算机程序判定。需要考虑程序预设医学逻辑的科学性、严谨性和全面性,并经过充分验证。4)说明书免疫相关不良事件的呈现(一)一般原则研究者是临床试验中AE药物相关性的首个判定主体,直接与受试者接触掌握其全面临床信息,因此,研究者的评价结果有重要的价值。建议在SCS等研究资料中,合理呈现研究者和申办者的判定结果,提供申办者的详细评价流程,CTCAE严重等级4~5级判定不一致的病例宜有合理的分析解释。说明书通常呈现经申办者判断、技术审评部门核定后确认与药物相关的不良反应。建议采用本指导原则所推荐的irAE定义,并参照已发布的《抗肿瘤药物说明书不良反应数据汇总指导原则》和《抗肿瘤创新药上市申请安全性总结资料准备技术指导原则》,以汇总形式在说明书【不良反应】项下呈现irAE。原则上,说明书【不良反应】信息的撰写基于申办者汇总判定后的数据。说明书中应呈现重要器官/系统(如免疫相关性心肌炎、免疫相关性肺炎和免疫相关性内分泌疾病)的irAE信息,包括临床试验中发生率较高的irAE,以及发生率低但可导致严重后果的irAE。可合并情况下,建议以术语簇形式呈现irAE(例如免疫相关性内分泌疾病),减少呈现单个PT术语所导致的发生率分散和临床关注度的下降,汇总同时建议准确呈现单个免疫相关事件的发生率,如垂体炎、甲状腺功能减退症、肾上腺功能不全和糖尿病等。在系统性呈现iAE时,建议涵盖如下因素:目标irAE在临床试验中的汇总累积发生率、严重级别3级及以上事件发生率、导致死亡结局的irAE发生率、典型临床表现、至事件发生时间、持续时间、是否导致治疗暂停或终止、剂量-暴露量-效应特点(如有)、高危人群特征(如有)、预后和临床转归等。建议明确目标irAE需要使用系统性皮质醇激素、其他免疫抑制剂治疗或内分泌替代治疗的比例以及转归,为医患提供更有价值信息。对于不同适应症,如果特定irAE在某个特定肿瘤类型下具有显著的性质、频率或严重程度差异,呈现时应加以强调同靶点产品可能具备的相似的irAE特征,靶点机制相关的严重、罕见和需要特别关注的irAE可能因产品当前暴露量和访视时间有限而尚未报告,因此,建议在说明书中提示本品尚未报告但同类上市产品已报告的irAE,以充分提醒医患用药风险。(二)特殊情形的考虑(1)对照设计的临床试验,在CSR和SCS中可考虑呈现试验组和对照组的irAE,但当对照组为安慰剂或非免疫治疗药物/疗法时,不建议在说明书中呈现安慰剂/阳性对照药的irAE。(2)对照临床试验中采用交叉设计时,由于试验组和对照组交叉人群所接受的免疫治疗方案和暴露时间可能不同,建议在CSR和SCS中单独呈现交叉人群的irAE。在说明书【不良反应】撰写中,可参照《抗肿瘤药物说明书不良反应数据汇总指导原则》,将相对同质人群的irAE数据汇总呈现。(3)免疫联合治疗设计的试验,判定irAE与其中特定药物的相关性存在一定挑战,当前有如下建议:①如免疫联合治疗与单药治疗具有相似的irAE特征,建议明确irAE与联合治疗的相关性,不过度强调与某一目标药物的相关性。与单药相比,免疫联合治疗在irAE性质、频率或严重程度方面观察到提高时,呈现时应加以强调。②如免疫联合治疗与单药治疗具有显著不同的irAE特征,建议尽可能明确iAE与方案中的单药的相关性。(4)免疫联合非免疫治疗中,如果免疫与非免疫治疗具有相似的AE特征(例如,免疫治疗和靶向治疗均已知与甲状腺疾病有关),经充分医学评价仍无法确定所观察到的AE是irAE还是非irAE时,须用保守方法,将AE视为irAE,不应仅依据两者特征相似,而排除irAE。总结:本技术指导原则旨在阐述药品监管机构当前对抗肿瘤治疗临床试验irAE的评价和说明书撰写考虑,目标是提高安全性报告和说明书等资料质量,加强对参与临床试验的受试者和上市后用药的患者人群的保护。本技术指导原则尚不能涵盖抗肿瘤治疗中iAE识别、判定和说明书撰写的所有情形,鼓励研发从业者与药品监管机构及时沟通,持续完善本指导原则。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科709人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科709人已读 - 精选 放疗后相关肉瘤
今天,我们来聊一聊放疗后相关的肉瘤。 口腔颌面部的肉瘤,不管是骨组织来源的肉瘤还是软组织来源的肉瘤,都是比较难治的。由于肉瘤的发生在口腔颌面部的几率较小,仅仅占口腔肿瘤的1%,全身肉瘤的5%。所以,各个单位治疗的方式,很难达到共识。 其中有一种情况,是患者原来因为鼻咽癌或者其他癌症进行过放疗,在5年以后出现在原肿瘤以外的地方,出现肉瘤。这种几率,在放疗后的患者中,大概占千分之一。属于小众中的小众。在医学上,称为“第二原发癌”。 这类病人的治疗,是以手术为主的综合治疗。因为在全身其他地方,肉瘤的手术范围是跨关节切除,以保证切地彻底干净。这就对颌面部的肉瘤根治带来了困难。一般而言,下颌骨较小的肉瘤,可以保证充分切除。但是上颌骨的肉瘤,很难保障切除范围。因为,很容易牵涉到颅底等重要结构。如果肉瘤出现复发,又容易以非常迅速的速度生长。 一般出现放疗相关的肉瘤,比较难以引起重视。很多放疗后的颌骨,会有坏死或者炎症,伴随疼痛。有的时候,肿瘤和颌骨坏死一起发生,比较难以判断。颌面部的神经麻木,是肉瘤侵蚀神经的一个比较重要的临床症状。如果出现这样的情况,应该在复诊的过程中,及时反馈。 一般肉瘤,对放疗是有比较好的反应的。但是放疗相关的肉瘤,对放疗的反应较差。同时,因为伴随颌骨坏死,很难加大剂量,进行彻底的放疗。 化疗对于这类疾病,有一定的效果。不管是术前化疗,还是术后化疗。常见药物主要有甲氨蝶呤(M)、异环磷酰胺(I)、博来霉素、顺铂(P)及阿霉素(A)等。目前最常见的诱导化学疗法是MAP或MAPI,为期10周。对于40岁以上的患者,推荐使用AP双重疗法,有较好效果。下图可见各种化疗方案的效果。 在免疫治疗方面,现在得到的结果是比较沮丧的。很多免疫治疗的方式,在I期和II期临床试验得到了阴性结果。我们常见的免疫检查点抑制剂,比如PD-1抑制剂,也未能显著提高治疗效果。 靶向治疗,在肉瘤中,是可以有所作为的。但是现在所有的靶向药,都非针对肉瘤开发。而是和其他肿瘤有类似的靶点的超适应症用药。主要的靶向治疗药,归纳如下,划线部分为比较常用及有前景的治疗方式: ■受体酪氨酸激酶(RTK)相关途径 针对RTK设计的多靶点酪氨酸激酶抑制剂(TKI)是目前骨肉瘤靶向治疗中取得进展最快的药物类别。以安罗替尼、阿帕替尼为代表的国产TKI,以及瑞戈非尼、帕唑帕尼等为代表的进口药物,在大量的骨肉瘤临床实践中已经明确了其重要价值。 ■ TP53 FDA和EMA授予了TP53抑制剂APR-246(PRIMA-1 MET)的孤儿药和快速审批通道资格。 ■ 细胞周期相关分子 CCNE1扩增、RB1失活、CDK4/6扩增等,其中CCNE1扩增在多个瘤种中被认为与化疗耐药有关。CCNE1扩增在骨肉瘤中出现频率可高达30%以上,虽然目前没有直接针对CCNE1的靶向药物,但通过作用于其下游的细胞周期蛋白CDK1/2/5/9、使用多靶点CDK抑制剂如Dinaciclib进行治疗,从理论上是可行的,亦有团队使用骨肉瘤PDX动物模型得到了明确的治疗效果。。 ■ PTEN-PI3K-AKT-TSC1/2-mTOR通路 较为高频的突变为PTEN及TSC1/2,其中抑癌基因PTEN的突变出现在超过50%的高级别骨肉瘤中。 肉瘤二线治疗药物中的依维莫斯就是典型的mTOR抑制剂,已被列入美国国家综合癌症网络(NCCN)治疗指南 PI3K突变在骨肉瘤中较为少见,且该药有导致血糖升高的副作用。 ■ BRCA及同源重组修复缺陷HRD PARP抑制剂如奥拉帕利在BRCA突变/HRD患者中能产生“合成致死”的效果。 ■ ATRX与端粒相对于能导致PARP抑制剂敏感的HRD,ATRX突变反倒会导致端粒延长(ALT)保证同源充足修复。ATRX突变在骨肉瘤中占20%-30%左右,在其他肿瘤包括软组织肉瘤中也颇为常见,曾经被认为是“不可靶”的突变。但近期的基础研究发现,ATRX突变驱动肿瘤的过程依赖一种叫ATR的蛋白激酶,因此研究人员开发了ATR抑制剂针对ATRX突变患者。 ■ 极光激酶A/B 极光激酶(Aurora kinase,AURK)拥有诗意的名字,但AURK家族的突变如AURKA、AURKB会导致肿瘤的发生发展,其在骨肉瘤中也不鲜见。AURK家族突变的肿瘤可对多种常规治疗方式耐药,而AURK抑制剂的研发为这类肿瘤带来了一定的希望。目前已有部分临床试验尝试探索AURKA、AURKB抑制剂对骨肉瘤的作用,但离临床正式应用仍有很长距离。 ■ MAPKKK-MAPKK-MAPK通路 以RAS-RAF-ERK为代表的MAPKKK-MAPKK-MAPK通路也是多种肿瘤中频繁出现突变的高危通路。在骨肉瘤中,虽然RAS(包括KRAS、NRAS等)和RAF(包括BRAF等)的突变在骨肉瘤中并不频繁,但抑癌基因NF1的突变在骨肉瘤中频率不低。NF1的失活突变会导致RAS的异常激活,后者通过MAPKKK-MAPKK-MAPK的级联放大对肿瘤细胞的生长提供非常强烈的信号。 另外,在一些研究中,溶瘤病毒的使用得到较好的效果。但是对于病毒载体和基因靶点,有较多选择,还没有定论。 最后说下题外话,颌面部肉瘤的发病率是极小的,同时放疗后产生肉瘤的概率也很小。之前有很多名称,比如放疗诱导的肉瘤等。这样的说法,就表示和放疗具有因果关系。那就不是很客观。医学上,称这类癌症,叫第二原发癌。因为很多肿瘤病人,他属于易患癌的体质,他如果不做放化疗,也肯能可能导致复发,也可能在其他地方长一个新的肿瘤(原发)。如果诊断为复发,那么病理分型会和原发肿瘤一致。也就是复发的肿瘤细胞,一般是原来肿瘤细胞的后代。而第二原发,一般是独立的。也就是说,可能原来是个鳞状细胞癌,现在是个肉瘤。 但是,很多保险公司,如果看到病历。他会认为,第二原发癌会和原来肿瘤有关系,或者和放疗有关系。尤其他看到诊断是:放疗后颌骨肉瘤。这个病种又十分罕见,所以保险公司欺负你,你也没办法联合他人杯葛,同时他损失你一个客户,可能也不会有太大影响。但是对你来说,可能就是绝对天大的损失。这个时候,需要很明确得坚持立场,进行斗争,保护合法权益(文章封面,是星巴克员工发现有女孩被搭讪,在杯子上写道:“你是否安全,如果有危险,掷杯为号。如果合法权益得到侵犯,也需要寻求帮助。
 曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科1113人已读
曹昊天 主治医师 中山大学孙逸仙纪念医院 口腔科1113人已读



