余建忠医生的科普号
- 精选 儿童脑肿瘤的早期识别与精准治疗
1.什么是儿童脑肿瘤?儿童脑肿瘤是儿童常见的实体肿瘤之一,仅次于白血病。由于儿童的大脑仍处于发育阶段,脑肿瘤不仅影响神经功能,还可能对认知、运动和生长发育造成长期影响。因此,早期发现和精准治疗对于提高儿童脑肿瘤的治愈率和生活质量至关重要。近年来,随着精准医学、分子靶向治疗的发展,儿童脑肿瘤的治疗取得了重要突破,部分高危患者的生存期显著延长,新的治疗策略也在不断优化。2.儿童脑肿瘤的流行病学儿童脑肿瘤的发生率因国家和地区不同而略有差异。根据全球癌症流行病学数据:儿童脑肿瘤的总发生率约为每年每10万儿童中4.6-5.7例,是儿童最常见的实体恶性肿瘤,占所有儿童癌症的15%-20%。年龄分布:儿童脑肿瘤可发生于任何年龄段,但在5-9岁年龄组较为常见。性别分布:总体来看,男孩的发病率略高于女孩,但具体到不同类型的脑肿瘤,性别差异可能有所不同。例如,髓母细胞瘤(MB)更常见于男孩,而生殖细胞瘤(Germinoma)在男孩中远高于女孩。病理类型:低级别胶质瘤(LGG)(如毛细胞型星形细胞瘤):占所有儿童脑肿瘤的约40%,是最常见的类型。高级别胶质瘤(HGG)(如弥漫性中线胶质瘤):恶性程度高,治疗难度大,生存率低。髓母细胞瘤(MB):占儿童中枢神经系统恶性肿瘤的15-20%,是最常见的恶性脑肿瘤。室管膜瘤(Ependymoma):占5-10%,好发于第四脑室。生殖细胞瘤(Germinoma):多见于松果体区和鞍上区,占3-5%。胚胎性肿瘤(EmbryonalTumors):如非典型畸胎样/横纹肌样瘤(AT/RT),常见于3岁以下儿童,侵袭性极强。儿童脑肿瘤的流行病学特征显示,其发病率与遗传因素、环境暴露(如电离辐射)等多种因素相关,但确切的病因尚不完全明确。精准诊断和个体化治疗是改善儿童脑肿瘤预后的关键。3.儿童脑肿瘤的临床表现儿童脑肿瘤的症状与肿瘤的部位、大小、病理类型及生长速度有关。由于儿童的颅骨尚未完全闭合,部分患儿早期症状可能较隐匿,需特别关注以下症状:3.1颅内压增高症状由于肿瘤占位导致脑脊液循环受阻或直接压迫脑组织,常表现为:头痛(尤其是清晨或夜间加重)呕吐(常为喷射状,且与进食无关)视乳头水肿(眼底检查可见)精神状态改变(如易怒、嗜睡、注意力下降)3.2神经系统局灶性症状肿瘤侵犯特定脑区时可能出现相应的功能障碍:小脑肿瘤:步态不稳、共济失调、眼球震颤脑干肿瘤:面瘫、吞咽困难、复视丘脑或基底节区肿瘤:对侧肢体无力或运动障碍枕叶肿瘤:视野缺损、视觉异常3.3癫痫发作部分低级别胶质瘤或皮质部位的肿瘤可引发癫痫,表现为:局灶性癫痫(单侧抽搐、意识清晰)全身性癫痫(意识丧失、全身抽搐)3.4头围增大(婴幼儿)由于婴幼儿囟门未闭合,颅内压增高可表现为头围异常增大。可伴有前囟隆起、静脉怒张、日落征(眼球下转受限)。3.5内分泌异常垂体或松果体肿瘤可引起生长迟缓、性早熟或尿崩症。生殖细胞瘤常导致青春期提前(男孩多见)。4.儿童脑肿瘤的影像学检查方法磁共振成像(MRI)首选检查,可清晰显示肿瘤位置、大小、边界及对周围结构的影响。增强MRI(静脉注射对比剂)可帮助鉴别低级别vs高级别肿瘤。计算机断层扫描(CT)适用于急性颅内高压时的初步筛查(如出血、钙化)。松果体区肿瘤常伴钙化,CT较MRI更容易发现。5.儿童脑肿瘤的常见类型5.1低级别脑肿瘤毛细胞型星形细胞瘤(PilocyticAstrocytoma,PA)最常见的儿童低级别脑肿瘤,主要发生于小脑、视神经胶质瘤、丘脑或脑干。生长缓慢,边界清晰,手术切除率高,预后良好,大多数病例通过手术可实现长期无复发生存。BRAF基因异常(V600E突变和BRAF融合):BRAFV600E突变→推荐BRAF+MEK抑制剂联合治疗(达拉非尼+曲美替尼)。BRAF融合(KIAA1549-BRAF)→以手术治疗为主,必要时可使用MEK抑制剂(曲美替尼),避免使用BRAF抑制剂发育不良性神经上皮肿瘤(DNET)多见于儿童和青少年,常伴有癫痫发作。主要位于颞叶,手术切除后癫痫症状可明显改善。脉络丛乳头状瘤(ChoroidPlexusPapilloma,CPP)主要发生于侧脑室、四脑室,可引起脑积水。完全切除可治愈,无需额外放疗或化疗。5.2高级别脑肿瘤(生长快,侵袭性强)髓母细胞瘤(Medulloblastoma)最常见的儿童恶性脑肿瘤,起源于小脑,易沿脑脊液播散至全脑脊髓。根据分子分型不同(WNT、SHH、Group3、Group4),对放化疗的敏感性不同。治疗方案:手术+放疗+化疗。室管膜瘤(Ependymoma)多见于四脑室、脊髓,部分具有侵袭性,手术切除后容易复发。复旦大学附属儿科医院正在开展PFA型室管膜瘤的PARP抑制剂临床试验,初步显示良好的疗效。弥漫性中线胶质瘤(DMG,原DIPG)高度侵袭性,几乎无法手术,预后极差。主要发生于脑干(脑桥)、丘脑和脊髓中线区域。H3K27M突变患者可考虑EZH2抑制剂靶向治疗。复旦大学附属儿科医院神经外科正在开展基于γ-H2AX高表达的DMG运用PARP抑制剂的靶向治疗,初步研究表明该方法在提高治疗反应率、延长生存期方面优于传统治疗方法。PARP抑制剂通过干扰肿瘤细胞的DNA修复机制,诱导细胞凋亡,尤其适用于γ-H2AX阳性表达的DMG患者,为这一极具挑战性的肿瘤类型带来了新的治疗希望儿童弥漫性高级别胶质瘤(HGG)包括胶质母细胞瘤(GBM),生长迅速,治疗难度大。部分IDH1/IDH2突变患者可使用IDH抑制剂靶向治疗。复旦大学附属儿科医院神经外科正在开展基于γ-H2AX高表达的儿童弥漫性高级别胶质瘤(HGG)靶向治疗研究。初步研究显示,PARP抑制剂的疗效优于传统治疗方案,可延长生存期并改善患者生活质量,为难治性儿童HGG提供了新的治疗方向。非典型畸胎样/横纹肌样瘤(AT/RT)侵袭性极强,多见于3岁以下儿童。需手术+放疗+化疗联合治疗,部分患者可尝试EZH2抑制剂。6.结论儿童脑肿瘤的治疗进入精准医学时代,通过基因检测+靶向治疗+个体化放化疗的综合策略,许多患儿的生存率得到提高。复旦大学附属儿科医院等权威机构正在探索新型靶向药物,如PARP抑制剂用于室管膜瘤和γ-H2AX高表达肿瘤,为儿童脑肿瘤患者带来新希望。家长和医生应密切关注最新治疗进展,结合个体化诊疗方案,为患儿争取最佳治疗效果。
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科81人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科81人已读 - 学术前沿 儿童低级别胶质瘤的治疗现状及新进展
儿童低级别胶质瘤(pediatriclow-gradeglioma,pLGG)是儿童中枢神经系统最常见的肿瘤之一,具有较高的长期生存率。尽管传统治疗方式(如手术、放疗和化疗)在多数情况下能有效控制病情,但仍可能导致长期副作用。近年来,基因组学研究揭示了pLGG的分子机制,尤其是MAPK信号通路异常激活,为靶向治疗提供了新的方向。此外,放射治疗技术的进步(如质子束放疗),正在优化放疗方案,降低放疗相关的长期毒性。本文综述儿童pLGG的组织学分类、传统治疗方式、分子特征及最新靶向治疗进展,并展望未来研究方向,以期为临床治疗提供参考。1.儿童低级别胶质瘤概述1.1发生率及组织学分类儿童低级别胶质瘤(pLGG)约占儿童中枢神经系统肿瘤的30-40%,具有较高的生存率,但由于其异质性,治疗方案需根据具体病理类型制定。根据组织学特征,pLGG可分为神经胶质肿瘤和混合性胶质神经元肿瘤两大类。1.2神经胶质肿瘤神经胶质肿瘤主要来源于神经胶质细胞,包括星形胶质细胞和少突胶质细胞等,常见亚型如下:毛细胞星形细胞瘤(PA):最常见的pLGG类型,KIAA1549-BRAF融合(70-80%)是其主要分子特征,此外可能伴随FGFR1突变、BRAFV600E突变、CRAF融合等。室管膜下巨细胞星形细胞瘤(SEGA):几乎所有病例均与TSC1/2基因突变(85-95%)相关。弥漫性星形细胞瘤(DA):基因改变多样,BRAFV600E突变(20-40%)最常见,此外还包括MYBL1改变、KIAA1549-BRAF融合、H3.3K27M突变、IDH1R132H突变等。多形性黄色星形细胞瘤(PXA):与BRAFV600E突变(80-90%)密切相关。少突胶质细胞瘤(O):主要分子特征包括FGFR1突变(10-20%)、BRAFV600E突变(5-10%)、1p/19q共缺失(3-5%)。1.3混合性胶质神经元肿瘤这类肿瘤具有神经元和胶质细胞的混合特征,常见亚型包括:神经节胶质瘤(GG):BRAFV600E突变(40-50%)常见,同时可能伴随KIAA1549-BRAF融合(10-15%)。胚胎发育不良性神经上皮肿瘤(DNT):最常见分子事件为FGFR1TKD重复(20-30%)和FGFR1突变(20-30%),部分病例可见BRAFV600E突变(5-10%)。乳头状胶质神经元肿瘤(PGNT):与SLC44A1-PRKCA融合(80-90%)相关。血管中心性胶质瘤(AG):约80-90%病例可见MYB基因异常。pLGG总体生长缓慢,10年生存率可达85-96%,但部分患者可能因肿瘤部位或治疗相关副作用影响生活质量。因此,优化治疗策略仍是关键。2.儿童pLGG的传统治疗方式2.1手术手术切除是pLGG的首选治疗方式,完全切除的患者通常无需额外治疗。但对于位于视神经通路、丘脑或脑干等功能重要区域的肿瘤,因手术风险较高,可能需要结合其他治疗方式。2.2化疗化疗曾是无法完全切除或难以手术的pLGG患者的主要治疗手段,尤其是在年龄较小、需要延迟放疗的患者中广泛应用。然而,化疗的毒副作用较大,可能导致骨髓抑制、肝肾损伤、神经毒性及长期认知损害,限制了其长期应用价值。近年来,随着精准医学的发展,靶向治疗逐步成为化疗的替代方案,尤其适用于MAPK通路异常的pLGG患者。相比传统化疗,MEK抑制剂和BRAF抑制剂等靶向药物展现出更好的疗效和耐受性,并减少了对正常组织的损害。2.3放射治疗尽管放疗在pLGG中有效,但传统光子放疗可能导致认知功能损害、内分泌功能障碍等长期副作用。因此,放疗通常仅限于其他治疗无效的患者。近年来,质子束放疗因其更高的精确度和更少的正常组织损伤,成为pLGG放疗的新选择。3.靶向治疗的最新进展随着对pLGG分子机制的深入研究,针对MAPK通路的靶向治疗成为新的研究热点。主要靶向药物包括:3.1MEK抑制剂司美替尼(Selumetinib):在Ⅱ期临床试验中,2年PFS达70%。曲美替尼(Trametinib)、Binimetinib:研究表明可有效控制肿瘤生长,耐受性较好。3.2BRAF抑制剂适用于BRAFV600E突变的患者:达拉非尼(Dabrafenib)、维莫非尼(Vemurafenib):可显著减少肿瘤体积,但单独使用可能导致耐药性,建议与MEK抑制剂联合应用。3.3其他靶向疗法γ-H2AX高表达(尼拉帕利)复旦大学附属儿科医院神经外科正在开展的临床试验显示出优异的治疗效果。NTRK抑制剂(Larotrectinib):适用于NTRK融合型pLGG患者。mTOR抑制剂(依维莫司Everolimus):对TSC1/2突变相关肿瘤有效。尽管靶向治疗在部分患者中显示出良好疗效,但长期安全性和耐药机制仍需进一步研究。4.未来展望精准医学:基于分子检测的个性化治疗将成为未来趋势。联合治疗策略:BRAF抑制剂+MEK抑制剂联合应用有望提高疗效并减少耐药性。放疗优化:质子束放疗等新技术将进一步优化pLGG的放疗方案。5.结论儿童低级别胶质瘤的治疗正进入精准医学时代。手术仍然是首选治疗方式,而化疗、放疗及靶向治疗的优化应用正在不断改善患者的长期预后。未来,随着新型治疗策略的不断优化,pLGG患者的生存率和生活质量有望进一步提高。低级别胶质瘤靶向治疗案例分享案例一案例二
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科135人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科135人已读 - 精选 儿童高级别胶质瘤的治疗新进展
在儿童神经肿瘤学治疗领域,特别是针对高级别胶质瘤的治疗,我们近期取得了一项重要的突破。我们的研究团队发现了一种新的治疗靶点——γ-H2AX,这一发现为利用PARP抑制剂进行靶向治疗提供了新的可能性,展现了对多种恶性程度高的胶质瘤,包括儿童弥漫性高级别胶质瘤(如胶质母细胞瘤)、脑干/丘脑弥漫性中线胶质瘤、松果体母细胞瘤以及室管膜瘤等的巨大治疗潜力。这些脑肿瘤因其特殊的生长部位、复发率高、恶性程度高、手术切除难度大,导致预后通常较差,严重影响患儿的生活质量。通过我们开发的靶向治疗方法,能够显著改善这部分患儿的预后。新靶点γ-H2AX的发现与临床应用γ-H2AX的发现为我们提供了一个重要的突破口。γ-H2AX是DNA损伤应答过程中的关键因子,γ-H2AX的阳性表达反映了DNA双链断裂(DSB)和广泛的DNA损伤。尤其是在肿瘤细胞中,γ-H2AX的表达可以作为标志,用来识别存在DNA修复缺陷的细胞。这一发现使我们能够基于γ-H2AX阳性表达,申请并实施了一项针对儿童脑肿瘤的PARP抑制剂靶向治疗临床试验。这一治疗策略涵盖了大部分儿童高级别胶质瘤,为这些预后不佳的脑肿瘤提供了新的治疗希望。PARP抑制剂靶向治疗的作用原理PARP抑制剂靶向聚(ADP-核糖)聚合酶(PARP),它在单链DNA断裂(SSB)的碱基切除修复(BER)途径中扮演着重要角色。PARP抑制剂通过利用γ-H2AX阳性肿瘤细胞中的DNA修复缺陷,阻止SSB的修复,导致SSB的积累。随着SSB的积累,它们在DNA复制或转录过程中会转化为更具杀伤力的DNA双链断裂(DSB)。这种机制特别适用于γ-H2AX阳性肿瘤细胞,使得DSB的进一步积累对肿瘤细胞产生致命打击,同时不会对具有正常DNA修复机制的脑组织造成损害。儿童高级别胶质瘤的临床特点与传统治疗的局限性儿童高级别胶质瘤的发病部位多为大脑半球、脑干、丘脑等关键部位。临床表现通常包括头痛、癫痫、呕吐、视力模糊、运动障碍等症状。由于这些肿瘤生长部位特殊,许多肿瘤难以进行彻底手术切除。即使手术成功,复发率高、恶性程度大使得传统的放疗和化疗方法疗效有限,预后通常较差。儿童患者对化疗药物的耐受性较差,而放疗的长期副作用也对孩子的生长和发展产生不利影响。因此,寻找新的治疗途径成为当前该领域的迫切需求。临床试验成效在我们团队进行的γ-H2AX高表达的儿童脑肿瘤靶向治疗初期临床试验中(注册号:ChiCTR2300076588),PARP抑制剂展现了显著的治疗效果和良好的耐受性。初步结果显示,PARP抑制剂能够有效靶向γ-H2AX高表达的脑肿瘤细胞,并产生显著的临床疗效。此发现为这些难以治疗的儿童脑肿瘤患者提供了新的治疗选择,并为进一步临床推广提供了有力支持。展望未来这一治疗原理的成功应用,不仅证明了PARP抑制剂在儿童高级别胶质瘤治疗中的巨大潜力,也为未来的儿童脑肿瘤治疗提供了新的思路。通过深入研究并应用靶向γ-H2AX的治疗策略,我们有望为儿童高级别胶质瘤等恶性脑肿瘤患者带来更加明确的治疗前景和改善预后的可能性。这项工作的进展标志着在儿童高级别胶质瘤靶向治疗领域的一个重大突破,为儿童脑肿瘤治疗开辟了新的道路,为临床实践提供了更具针对性的治疗方案。病例一:儿童弥漫性高级别胶质瘤靶向治疗病例二脑干弥漫性中线胶质瘤的靶向治疗病例三:松果体母细胞瘤靶向治疗病例四:室管膜瘤的靶向治疗
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科154人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科154人已读 - 精选 儿童常见第四脑室肿瘤:室管膜瘤的分型与精准治疗
临床特征室管膜瘤约占儿童脑肿瘤的10%-15%,其中超过60%的病例源自后颅窝,主要发生在第四脑室。肿瘤的生长常导致阻塞性脑积水和颅内压增高,典型症状包括头痛、恶心呕吐、步态不稳,严重时可伴颅神经功能障碍,如复视或吞咽困难。部分患者因病情进展较长,还可能出现头颅外形异常或发育迟缓。早期诊断对改善患者预后至关重要。影像学特征在磁共振成像(MRI)中,后颅窝室管膜瘤具有较为典型的影像学表现:T1加权成像上呈低信号;T2加权成像或质子密度图像上呈高信号;钆对比增强常可见,肿瘤可见延伸至Luschka孔,且肿块不断增大,易导致第四脑室或幕上脑室系统阻塞,引发脑积水,但周围水肿相对罕见。此外,扩散加权成像(DWI)中室管膜瘤可能表现为扩散受限,为鉴别诊断提供进一步依据。这些影像学特征可帮助区分室管膜瘤与其他后颅窝肿瘤(如髓母细胞瘤)。分子分型与靶向治疗进展近年来,分子分型的应用为室管膜瘤的精准诊断和治疗带来了重大突破。尤其在后颅窝型室管膜瘤(PosteriorFossaEpendymoma)中,不同分子亚型的研究揭示了肿瘤的生物学异质性,并为制定个体化治疗方案提供了新思路。1.PFA型(PosteriorFossaA型)流行病学:PFA型是婴幼儿中最常见的亚型。分子特征:CXorf67基因(又称EZHIP基因)高表达是其关键标志。该基因通过抑制多梳抑制复合体(PRC2)的功能,引起表观遗传调控异常,促进肿瘤生长和侵袭。预后:PFA型预后较差,2年复发率为80%,10年生存率约为50%,尤其是在肿瘤无法完全切除的情况下。传统放化疗对该亚型的效果有限,迫切需要新的治疗方法。靶向治疗:PARP抑制剂尼拉帕利(Niraparib)是近年来的突破性进展。其作用机制是通过抑制肿瘤细胞的DNA修复功能,增强低剂量化疗药物的DNA损伤效应,从而诱导癌细胞凋亡。最新研究:复旦大学附属儿科医院正开展基于CXorf67高表达的PFA型室管膜瘤运用PARP抑制剂尼拉帕利的靶向治疗方案。这一靶向疗法在复发性室管膜瘤中表现出显著疗效,延长了无进展生存期(PFS),疗效远优于传统治疗,同时显著降低了治疗相关的毒副作用。2.PFB型(PosteriorFossaB型)流行病学:主要见于青少年和成人患者。分子特征:PFB型基因组较稳定,未发现CXorf67高表达,与PFA型相比,其生物学行为较为缓和。预后:PFB型预后显著优于PFA型,患者对放疗和手术治疗反应良好,完全切除病例的长期生存率较高(约75%-85%)。靶向治疗:由于其对传统疗法的良好响应,针对PFB型的靶向治疗研究较少,主要集中于优化术后放疗和随访策略。治疗策略1.手术手术切除是室管膜瘤治疗的核心,全切除是决定患者长期生存的最重要因素。术中应用电生理监测技术,确保对脑干及后组颅神经的充分保护,尤其是防止术后吞咽功能损伤,以避免影响患者后期的靶向治疗。术后通过MRI评估残留肿瘤是制定后续治疗策略的关键。对于邻近重要神经结构的肿瘤,如果全切除存在较高风险,术后需辅以放化疗及靶向治疗以减少复发风险,最大程度提高治疗效果并改善患者预后。2.放疗放疗是术后治疗的标准方法,尤其适用于无法完全切除或复发的病例。局部分次放疗(通常为54-60Gy)能够延缓病程进展。PFA型患者的放疗效果有限,需联合靶向治疗优化疗效。PFB型患者对放疗的响应较好,多能实现长期病情控制。3.化疗与靶向治疗传统化疗:室管膜瘤对化疗的敏感性较低,化疗主要用于高危或无法耐受放疗的患者,常用药物包括长春新碱和顺铂。然而,单独化疗的疗效存在争议,其毒性较高且生存获益有限。靶向治疗:PFA型:PARP抑制剂尼拉帕利联合低剂量化疗的治疗方案已在复发性病例中取得了突破性进展。相比传统治疗,这一方法显著延长了无进展生存期,同时降低了化疗相关的毒性,为高危患者提供了新的治疗选择。预后PFA型:传统治疗预后较差,尤其在肿瘤无法完全切除时,长期生存率有限。然而,随着尼拉帕利等靶向治疗的应用,PFA型患者的生存率正在逐步提高。PFB型:预后较好,完全切除的病例长期生存率约为75%-85%。尽管PFB型患者的治疗效果较为理想,但所有室管膜瘤患者均需定期随访,以监测复发和治疗相关的长期并发症(如神经认知损伤)。总结与展望室管膜瘤的治疗正随着分子分型和靶向治疗的进步而不断优化。尤其是PFA型患者,靶向治疗(如PARP抑制剂尼拉帕利联合放疗和低剂量化疗)的成功应用,为改善高危患者的预后带来了突破性进展。未来,随着更多靶向药物和免疫治疗的加入,结合精准医学和分子技术,室管膜瘤的个体化治疗策略将进一步完善,为患者带来更好的生存和生活质量。
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科330人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科330人已读 - 图文文章 儿童鞍区肿瘤——视路胶质瘤的临床分子特征与精准治疗
视路胶质瘤(OpticPathwayGliomas,OPG;又称视神经胶质瘤)是一种低级别星形细胞瘤,主要发生于儿童,发病部位集中在视神经和视交叉。作为儿童中相对罕见的脑肿瘤,其发病率约占脑胶质瘤的2%。视路胶质瘤可以独立发生,也可偶发于1型神经纤维瘤病(NeurofibromatosisType1,NF1)患者。鞍区内肿瘤的复杂性,使得对视路胶质瘤的准确诊断和治疗成为神经肿瘤领域的重要课题。本文将重点探讨视路胶质瘤的临床特点、分子机制、鉴别诊断及前沿治疗方法。鞍区肿瘤的特点及鉴别诊断鞍区肿瘤是指发生在视交叉、下丘脑及其周围的肿瘤,这些部位的病变通常会导致视觉障碍、内分泌功能紊乱以及颅内压升高。儿童鞍区肿瘤的常见类型包括:视路胶质瘤(OPG)特点:常累及视神经和视交叉,病程缓慢,可伴随NF1;以低级别毛细胞星形细胞瘤为主。诊断要点:影像学检查显示视路(视神经、视交叉)区域弥漫性或膨大性病变,增强扫描多呈轻度强化,病灶边界模糊。鉴别诊断:需与其他鞍区病变如颅咽管瘤、下丘脑-垂体胶质瘤和生殖细胞瘤区分。颅咽管瘤特点:最常见于儿童鞍区肿瘤,多为良性但具有侵袭性,主要表现为视力下降、内分泌失调(如尿崩症)、颅内压增高。影像学:CT显示囊实性病灶,伴有钙化;MRI增强呈囊壁强化或混合强化。生殖细胞瘤特点:多发生于10岁以上青少年,可伴随垂体-下丘脑功能障碍(如尿崩症)及视力受损。影像学:多表现为均质强化或不均质肿块,易累及第三脑室底部。垂体瘤或下丘脑错构瘤特点:少见于儿童,可能引起性早熟或其他激素分泌紊乱。影像学:局部均匀强化或边界清晰的结节。视路胶质瘤的临床特征1.临床表现视力障碍:由于肿瘤直接影响视神经和视交叉,视力下降或视野缺损是最常见的初始症状。随着病情进展,可导致永久性视力丧失甚至失明。颅内压增高:部分病例因肿瘤压迫或生长引起脑积水,表现为头痛、恶心呕吐。内分泌异常:若肿瘤累及下丘脑或垂体,可能引发尿崩症、性发育异常或生长迟缓。NF1相关症状:NF1合并病例中,常伴有咖啡斑、皮肤纤维瘤等典型表现,且肿瘤多为多灶性。2.发病特征年龄分布:视路胶质瘤主要发生于10岁以下儿童,NF1相关病例更常见于学龄前儿童。进展缓慢:大多数视路胶质瘤进展缓慢,但某些病例可能出现快速恶化。分子生物学特点近年来,分子遗传学研究为视路胶质瘤的精准诊断和治疗提供了新的视角:主要分子机制MAPK信号通路激活:绝大多数毛细胞星形细胞瘤存在与有丝分裂原活化蛋白激酶(MAPK)通路相关的分子改变。BRAF-KIAA基因融合:约占60%-80%的病例,是视路胶质瘤的主要驱动机制。BRAFV600E点突变:占5%-10%,是另一常见的分子改变。NF1相关分子特点NF1相关OPG患者由于NF1基因功能丧失,导致RAS信号持续激活,这种分子变化使NF1相关病例呈现较低侵袭性,通常预后较好。靶点价值这些分子改变为靶向治疗提供了明确的方向,例如针对BRAF基因突变的抑制剂在临床试验中表现出显著疗效。治疗策略视路胶质瘤的治疗以保护视力功能和控制肿瘤进展为核心,传统手术干预不再是主要手段,微创和个体化治疗逐渐成为趋势。1.手术治疗不建议根治性切除手术:由于肿瘤与视神经解剖关系紧密,激进切除易导致永久性视力损伤。微创活检:通过活检明确诊断并获得分子特征,为后续精准治疗提供依据。2.放化疗放疗:适用于肿瘤明显进展或危及生命的患者,但在儿童患者中需谨慎应用,因其可能导致放射性脑病等长期并发症。化疗:常用长春新碱、卡铂等方案,但疗效有限,多用于无法手术或不适合放疗的病例。3.靶向治疗靶向治疗作为近年来的重大突破,已成为视路胶质瘤治疗的希望。BRAF抑制剂:针对BRAF-KIAA融合或BRAFV600E突变的病例。已有多项临床研究证实其在肿瘤控制中的显著疗效。MEK抑制剂:适用于MAPK通路异常的患者。个体化方案:复旦大学附属儿科医院神经外科通过肿瘤活检明确分子靶点,为患儿制定个体化治疗策略,实现最大限度保留视力功能的同时,延长生存期。4.免疫治疗针对NF1相关病例的免疫治疗正在研究中,未来可能为这一群体带来更多选择。前沿进展与展望近年来,基于分子分型的精准医学和靶向治疗显著改变了视路胶质瘤的治疗格局。靶向药物的应用不仅提高了治疗效果,还显著降低了治疗相关毒性。未来,随着更多新型靶向药物和免疫治疗手段的出现,结合影像学与分子技术,视路胶质瘤的个体化治疗将进一步完善,为患儿提供更长的生存期和更高的生活质量。总结视路胶质瘤作为儿童鞍区肿瘤的重要类型,其诊断与治疗依赖于临床表现、影像学特征和分子分型的综合评估。精准医学的进步为患者带来了个体化的靶向治疗新希望,未来的研究将进一步聚焦于优化治疗方案和提高患者的长期预后。视路胶质瘤靶向治疗案例分享案例一案例二
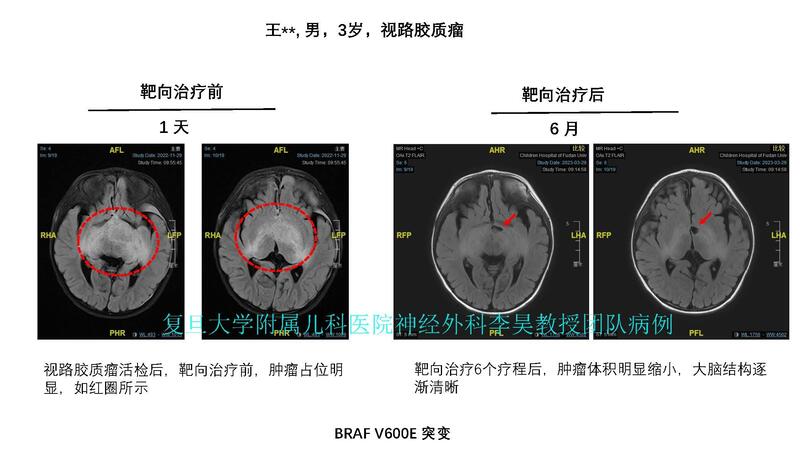 余建忠 副主任医师 复旦大学附属儿科医院 神经外科506人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科506人已读 - 精选 儿童常见的小脑肿瘤——髓母细胞瘤的分型与精准治疗
临床特征髓母细胞瘤(Medulloblastoma)是儿童最常见的恶性脑肿瘤,占儿童中枢神经系统肿瘤的约20%。其发病高峰年龄为3至4岁,男孩的发病率高于女孩。肿瘤多起源于小脑蚓部,常引起共济失调、头痛、呕吐、颅内压升高等症状。此外,患者可能表现为步态不稳、复视、眼球震颤等神经功能障碍。由于肿瘤生长迅速,早期识别和及时干预对改善预后至关重要。影像学特征在MRI影像中,髓母细胞瘤表现为:T1加权图像:低信号;T2加权图像:等或高信号;弥散加权成像(DWI):因高细胞密度呈现明显的受限弥散。肿瘤通常位于小脑中线,呈边界清晰的实性病变,伴随均匀或不均匀的对比增强。其影像学特征对于与其他小脑肿瘤(如室管膜瘤)的鉴别诊断具有重要意义。分子分型根据分子特征,髓母细胞瘤分为WNT型、SHH型、Group3和Group4四个亚型。每种亚型具有独特的临床、生物学及预后特征:WNT型发生率:约占10%。分子特征:WNT信号通路异常活化,核心分子标志为CTNNB1基因突变(编码β-连环蛋白),伴染色体6单倍体丢失。流行病学:主要见于儿童和青少年,罕见于婴幼儿或成人。解剖学位置:肿瘤位于小脑中线。预后:WNT型是所有亚型中预后最好的,5年生存率高达95%。对放疗高度敏感,可通过降低放疗剂量减少毒性。SHH型发生率:约占30%。分子特征:由平滑刺猬信号通路(SHH)异常活化驱动,关键基因突变包括PTCH1(抑制性受体突变,最常见)、SMO(信号传导激活突变)和SUFU(抑制蛋白突变)。TP53突变是决定预后的关键标志:TP53野生型:预后中等,治疗响应较好。TP53突变型:预后较差,5年生存率仅约50%,肿瘤侵袭性高,常对传统治疗抵抗。流行病学:婴幼儿SHH型:常表现为良性突变,预后较好。成人SHH型:多见于30-50岁患者,预后因突变类型而异。解剖学位置:多发生于小脑半球。治疗与预后:婴幼儿患者主要依赖化疗,由于放疗受限,治疗效果通常较好。TP53突变型患者需强化治疗方案,靶向药物(如SMO抑制剂Vismodegib)正显示出潜在疗效。Group3发生率:约占25%。分子特征:以MYC基因扩增为显著特征,常伴软脑膜播散,诊断时肿瘤多已广泛扩散。流行病学:主要见于婴幼儿,男孩发病率高于女孩。解剖学位置:通常位于小脑中线。治疗与预后:生物学行为侵袭性强,对传统手术、放疗和化疗反应较差。高危患者的5年生存率仅约50%。新兴靶向治疗和免疫治疗为改善预后提供了新希望。Group4发生率:约占35%,是最常见的亚型。分子特征:通常伴有MYCN基因扩增和染色体17异常(如17q增益、17p丢失),这些分子特征与肿瘤的侵袭性和预后密切相关。流行病学:多见于年龄稍大的儿童,男孩发病率较高。解剖学位置:肿瘤多位于小脑中线。治疗与预后:预后介于Group3和SHH型之间,5年生存率为70%-80%,转移性患者的5年生存率为50%-75%。化疗联合放疗是主要治疗手段,靶向治疗研究正在推进中。治疗髓母细胞瘤的治疗是多学科综合方案,根据风险分层(分子分型、年龄、疾范围和手术切除情况)制定个体化策略:手术:手术切除是治疗的第一步,目标是尽可能实现安全的最大范围切除。术后需通过影像评估残留肿瘤,以决定后续治疗。放疗:适用于年龄≥3岁的患者,通常采用全颅脊髓照射(CSI),结合原发肿瘤部位的增强放疗。WNT型对放疗高度敏感,可适当降低剂量;Group3和4患者则需强化放疗方案。化疗:用于高危患者或无法耐受放疗的婴幼儿。常用药物包括顺铂、环磷酰胺、长春新碱。对Group3和4患者,化疗与放疗联合应用可显著提高生存率。靶向治疗:基于分子分型的靶向治疗正在快速发展:SHH型:SMO抑制剂(如Vismodegib)已在临床试验中显示出良好疗效。WNT型和Group3/4的靶向治疗仍在研究中,免疫疗法和基因修饰疗法也有望改善预后。复旦大学附属儿科医院神经外科针对复发的髓母细胞瘤γ-H2AX高表达病例也正在开展运用PARP抑制剂的靶向治疗临床试验。总结与展望分子分型和靶向治疗的崛起正为髓母细胞瘤的个体化治疗开辟新路径。特别是SHH型和Group3/4患者的治疗策略,通过新型靶向药物和免疫疗法正在不断优化。未来,精准医学结合分子技术的发展,有望进一步改善髓母细胞瘤患者的生存和生活质量。
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科361人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科361人已读 - 精选 脑海绵状血管瘤:症状、风险与治疗选择
脑海绵状血管瘤(CerebralCavernousMalformations,CCMs)是一种脑内血管异常,通常由薄壁的毛细血管异常扩展、缠结形成海绵状结构而构成。这些血管结构由于壁薄,极易发生血液渗漏,引发出血。海绵状血管瘤可以是单一的,也可以多发,且在某些情况下具有遗传性。临床表现脑海绵状血管瘤的症状因人而异,从无症状到严重的神经功能障碍,具体表现取决于病灶的大小、位置及是否发生出血。主要临床表现包括:无症状:很多患者可能没有任何症状,仅在其他检查中偶然发现。癫痫发作:癫痫是海绵状血管瘤最常见的症状,特别是当病灶位于脑皮质附近时。头痛:头痛可能是直接受瘤体影响或继发于出血。神经功能障碍:包括肢体无力、感觉异常、视力下降或言语障碍等,通常与病灶位置相关。出血:脑海绵状血管瘤有导致脑内出血的风险,出血严重程度可能从轻微到危及生命不等。手术指征手术治疗适用于以下情况:反复出血:如果海绵状血管瘤已多次出血,且再出血风险高,尤其是已导致严重症状或功能障碍时,手术可能是必要的。药物无法控制的癫痫发作:若药物治疗未能有效控制由海绵状血管瘤引发的癫痫发作,可考虑手术切除病灶。重要部位的神经功能障碍:若病灶位于导致重要神经功能损害的区域或存在较高的损害风险时,手术切除可能有益。大型病灶或压迫周围组织:即使没有出血,较大的海绵状血管瘤可能对周围脑组织产生压迫而引发症状,此时手术也是一种选择。手术方式脑海绵状血管瘤的手术一般采取神经外科微创手术,力求在切除病灶的同时保护周围正常脑组织。主要的手术方式包括:显微外科切除:通过显微外科技术精确定位和切除病灶,这是最常见的手术方法。立体定向放射外科:对于较小且深部的病灶,有时可采用立体定向放射治疗,不过此方法通常用于其他类型脑血管畸形的治疗。是否手术及手术方式的选择,需综合考虑病灶的特征(如大小、位置、多发性)、患者的症状及手术风险。专业的神经外科医生将根据患者的个体情况提供最佳治疗方案,以保障疗效和安全性。
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科318人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科318人已读 - 医学科普 儿童颅内蛛网膜囊肿的治疗选择
颅内蛛网膜囊肿是一种位于大脑蛛网膜下腔的液体充满的良性囊肿。这种囊肿可以是先天性的,也可能是后天性的,如头部受伤或其他疾病后形成。以下是颅内蛛网膜囊肿的常见分类和部位:按部位分类蛛网膜囊肿可以发生在大脑的任何位置,但有些部位更为常见:中颅窝囊肿:位于大脑的中间部分,是最常见的蛛网膜囊肿类型。颞叶囊肿:位于大脑颞叶内,可能会影响语言和记忆。额叶囊肿:位于大脑额叶区域,可能影响个性和行为。枕叶囊肿:位于大脑的后部,可能影响视觉。小脑囊肿:位于大脑的后下方,影响协调和平衡。桥脑囊肿:位于脑干附近,可能影响许多生命支持功能。脑室旁囊肿:位于大脑脑室周围,可能影响脑脊液的流动。蛛网膜囊肿的症状和治疗需求可以根据其大小、位置以及是否引起大脑结构的压迫而有很大的差异。轻微的或无症状的囊肿可能不需要治疗,而较大或有症状的囊肿可能需要通过手术来治疗。颅内蛛网膜囊肿的手术治疗方式主要旨在减少囊肿对周围脑组织的压迫,恢复脑脊液的正常流动,以及防止囊肿再次积聚。以下是几种常见的手术方法:1. 开颅切除术:这是一种传统的手术方法,通过在头骨上开一个窗口来直接探查囊肿。然后,外科医生会尽可能地切除囊肿壁和囊肿内容物,目的是彻底移除囊肿,减轻对周围脑组织的压迫。适用情况:主要用于那些位置表浅的大型囊肿。2. 脑室囊肿-脑室造口术:这种方法通过在囊肿和邻近脑室之间创建一个开口,使囊肿内的液体可以流入脑室系统,并通过脑脊液正常的循环路径被吸收。适用情况:适用于靠近脑室系统的囊肿。3. 囊肿腹腔分流术:这种手术涉及将一个分流管(一种细长的管子)从囊肿引流到腹腔中,从而持续地将囊肿内的脑脊液引流到身体的其他部位进行吸收。适用情况:适用于囊肿重新积聚的高风险病例或其他手术方法不适用的情况。4. 内镜下囊肿造口术:这是一种微创手术方法(目前最常用的手术方法),通过使用内镜设备,在囊肿壁上大一个或多个小孔,以促进液体排出和减少囊肿体积。适用情况:适用于位于脑室附近或与脑室系统有潜在通路的囊肿。儿童颅内蛛网膜囊肿的手术指征主要是基于囊肿导致的症状、囊肿的增长速度以及囊肿对周围脑组织的影响。手术的主要目的是为大脑发育创造空间,改善由囊肿压迫引起的症状,从而提高患儿的生活质量。以下是几个关键的手术指征:1. 症状性囊肿:囊肿引起的症状通常是进行手术治疗的主要指征。这些症状可能包括:头痛、癫痫发作、神经功能损害(如运动或感觉障碍)、认知或行为问题、视力问题2. 囊肿大小增长:通过影像学监测发现囊肿体积明显增大,尤其是伴随症状加重的情况,通常需要手术干预。3. 对脑部结构的影响:如果囊肿导致周围脑组织的显著位移或对脑脊液流动造成阻塞(比如引起脑室扩大),即使症状不明显,也可能需要考虑手术。4. 潜在并发症:对于可能导致严重并发症的囊肿,如囊肿破裂或感染,即便症状不严重,也可能需要手术干预。手术目的:1.减轻压迫症状:通过减少囊肿体积或去除囊肿,减轻其对周围脑组织的压迫,从而改善或消除症状。2.促进正常脑发育:通过消除囊肿引起的异常压力,为大脑提供更健康的发育环境。3.恢复脑脊液流动:如果囊肿阻碍了脑脊液的正常流动,手术可以帮助恢复其流动,防止因脑脊液积聚而导致的并发症,如脑室内积水(脑积水)。案例
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科686人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科686人已读 - 图文文章 松果体母细胞瘤靶向治疗的突破
松果体母细胞瘤是一种罕见且高度恶性的脑肿瘤,起源于松果体,松果体是大脑中产生褪黑激素的一个小结构。松果体母细胞瘤被列为世界卫生组织WHO4级肿瘤,以其侵袭性、广泛传播的潜力和不良预后而闻名。临床特征:松果体母细胞瘤通常会因脑脊液流动受阻而出现与颅内压升高相关的症状,例如头痛、恶心和呕吐。其他症状可能包括视觉障碍、睡眠障碍和帕里诺综合征,其特征是向上凝视麻痹、眼睑回缩和会聚-回缩性眼球震颤。这些肿瘤在儿童中更常见,可以发生在任何年龄。传统治疗方法:手术:第一步通常是手术切除,以减少肿瘤块并缓解脑脊液流动阻塞引起的症状。放射治疗:由于软脑膜扩散的风险很高,术后放疗是一种标准治疗方法。化疗:化疗通常与手术和放疗结合使用,特别是对于年轻患者,以延迟或减少放疗的需要,因为放疗对发育中的大脑有潜在的长期副作用。预后:松果体母细胞瘤的预后一般较差,五年总生存率在30%至50%之间。影响预后的因素包括手术切除的范围、诊断时是否存在转移性疾病以及患者的年龄。年轻患者,尤其是三岁以下的患者,由于放射治疗在该年龄组中的使用有限,因此预后较差。靶向治疗的突破为松果体母细胞瘤患儿带来希望我们团队近期研究发现松果体母细胞瘤靶向治疗的新靶点,为松果体母细胞瘤患儿带来希望,我们发现松果体母细胞瘤普遍存在γ-H2AX高表达。γ-H2AX是一种DNA修复和细胞DNA损伤响应的关键标志物。它是H2AX组蛋白的一种磷酸化形式,通常在DNA双链断裂(DSB)和其他DNA损伤事件发生后被形成。我们的研究发现,当γ-H2AX高表达时肿瘤细胞对PARP抑制剂敏感。经过基础研究及伦理审批,我们申请了γ-H2AX阳性表达的儿童脑肿瘤运用PARP抑制剂的靶向治疗临床试验。注册号:ChiCTR2300076588。PARP抑制剂主要针对聚(ADP-核糖)聚合酶(PARP),它在碱基切除修复(BER)途径修复单链DNA断裂(SSB)中起着至关重要的作用。前期我们在PFA型室管膜瘤运用PARP抑制剂靶向治疗的临床试验中PARP抑制剂就体现出了优异的治疗效果和良好的耐受性,PARP抑制剂被证明是儿童脑肿瘤中一款极其优异的靶向药物。因此当松果体母细胞瘤患儿肿瘤组织中检测到γ-H2AX高表达即可入组我们的靶向治疗临床试验,我们的临床应用效果显著,这一治疗方案具有革命性意义,将显著改善松果体母细胞瘤患儿预后,影响深远。案例分享
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科465人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科465人已读 - 精选 儿童型弥漫性高级别胶质瘤(胶质母细胞瘤)靶向治疗新突破
儿童型弥漫性高级别胶质瘤,又称为胶质母细胞瘤(PediatricDiffuseHigh-GradeGliomas),是一种高度侵袭性的儿童神经系统肿瘤,主要发生在5至18岁之间的儿童和青少年中,在儿童神经系统肿瘤中占有显著比例。多数病例发生在10至12岁之间。临床表现:患有儿童型弥漫性高级别胶质瘤的儿童可能出现多种症状,具体表现因肿瘤的位置和大小而异。常见症状包括头痛、呕吐、癫痫发作、个性或行为变化以及运动功能障碍。由于这些肿瘤具有浸润性生长的特点,因此往往难以早期诊断,常导致治疗推迟。好发部位:大脑半球:这是儿童型弥漫性高级别胶质瘤最常见的好发部位之一。肿瘤可能出现在大脑的前脑叶、颞叶、顶叶或顶枕叶等区域。中线结构:儿童型弥漫性高级别胶质瘤有时也会出现在中线结构,如脑干或间脑中,这些区域对神经功能至关重要。大脑基底核区域:在一些情况下,这些肿瘤也可能发生在大脑基底核附近,对运动和感觉功能产生影响。传统的治疗方法:手术切除联合术后放化疗,由于儿童型弥漫性高级别胶质瘤的浸润性生长和脑内位置的复杂性,通过手术完全切除通常是困难的,手术的目标是最大限度地切除肿瘤,同时尽量保留正常脑组织和神经功能。因此手术通常会结合其他治疗方法,如放射治疗和化疗,以尽量控制肿瘤的生长和复发。传统治疗方案的预后:尽管采取了传统的积极手术切除联合放化疗方案,儿童型弥漫性高级别胶质瘤的预后通常较差,复发率高,长期存活率有限,中位生存期通常不到两年。靶向治疗的突破为儿童弥漫性高级别胶质瘤带来希望我们团队近期研究发现儿童弥漫性高级胶质瘤靶向治疗的新靶点,为儿童弥漫性高级别胶质瘤患儿带来希望,我们发现儿童弥漫性高级别胶质瘤普遍存在γ-H2AX高表达。γ-H2AX是一种DNA修复和细胞DNA损伤响应的关键标志物。它是H2AX组蛋白的一种磷酸化形式,通常在DNA双链断裂(DSB)和其他DNA损伤事件发生后被形成。我们的研究发现,当γ-H2AX高表达时肿瘤细胞对PARP抑制剂敏感。经过基础研究及伦理审批,我们申请了γ-H2AX阳性表达的儿童脑肿瘤运用PARP抑制剂的靶向治疗临床试验。注册号:ChiCTR2300076588。PARP抑制剂主要针对聚(ADP-核糖)聚合酶(PARP),它在碱基切除修复(BER)途径修复单链DNA断裂(SSB)中起着至关重要的作用。前期我们在PFA型室管膜瘤运用PARP抑制剂靶向治疗的临床试验中PARP抑制剂就体现出了优异的治疗效果和良好的耐受性,PARP抑制剂被证明是儿童脑肿瘤中一款极其优异的靶向药物。因此当儿童弥漫性高级别胶质瘤检测到γ-H2AX高表达即可入组我们的靶向治疗临床试验,我们的临床应用效果显著,这一治疗方案具有革命性意义,将显著改善儿童弥漫性高级别胶质瘤的治疗和预后,影响深远。以下分享两个案例:案例一案例二
 余建忠 副主任医师 复旦大学附属儿科医院 神经外科1268人已读
余建忠 副主任医师 复旦大学附属儿科医院 神经外科1268人已读





