白求恩国际和平医院普通外科科普号
- 精选 何为浆细胞性乳腺炎?其临床表现及治疗原则各是什么?
浆细胞性乳腺炎是炎性细胞以浆细胞为主的乳腺组织的化学性炎性病变,即是常由于各种原因引起的乳腺导管扩张、阻塞,乳管内脂性物质溢出进入导管周组织导致的浆细胞性无菌性炎症。临床表现是:1.临床上60%的患者有急性炎症的表现,病灶区红、肿、热、痛,腋淋巴结肿大、体温升高,需与急性乳腺炎和炎性乳癌鉴别。2.40%的病人一开始即为慢性炎症表现,多在乳晕旁有边界不清的实质性肿块,可有乳头凹陷、皮肤粘连。肿块破溃形成窦道,经久不愈。3.少数病人有浆液性或脓性、血性乳头溢液。治疗原则是:急性期予以抗炎治疗,一般避免切开引流,以免形成经久不愈的瘘管。慢性期形成的硬块、窦道、瘘管需手术切除,病变范围广者则需行乳房切除。
刘伟 副主任医师 白求恩国际和平医院 普通外科1957人已读 - 精选 乳腺纤维腺瘤是否都要切?
体检发现乳腺纤维腺瘤,不少女性总会担心:有没有癌变的风险?要不要预防性切除?面对诸多患者的困惑,告诉您:乳腺纤维腺瘤属于良性肿瘤,但有一定的恶变率,是否需要手术要考虑多种因素。通常,只有在纤维腺瘤大于3厘米才主张手术,但对于35岁以上的患者,由于患乳腺癌风险增加,即使纤维腺瘤不足3厘米,医生也建议积极手术。 乳腺纤维腺瘤是乳腺良性肿瘤里最常见的肿瘤,好发于30岁以下的年轻女性,具有多发、反复发作的特点。对于它的处理,有医生建议手术,有医生建议观察。我觉得,不同情况要区别对待,通常要考虑5个因素: 1、患者年龄。年轻的女孩,比如16岁发现了纤维腺瘤,这时乳房还没发育完全,如果做手术,很可能将乳核切掉,导致乳房再也无法发育,为了避免对今后的婚姻孕育产生影响,青春期女孩不超3厘米的纤维腺瘤可以密切观察。但年龄上了35岁,乳腺癌风险明显上升,通常主张积极手术,防止漏诊可能。 2、肿瘤大小。3厘米以下的乳腺纤维腺瘤恶变率仅为万分之三,若诊断明确,可以长期观察;3厘米以上的乳腺纤维腺瘤恶变机会增加,应该尽快手术。 3、病人感受。有些病人的纤维腺瘤能明显摸到,病人非常焦虑,及早手术有助于缓解她们的焦虑情绪。 4、是否生育、哺乳。有生育要求的,肿瘤比较接近乳头乳晕位置的,为了保证日后哺乳,对手术要采取谨慎态度。 5、乳腺纤维腺瘤进展的估计。预期纤维腺瘤增大的可能性大的,也可以对小于3厘米的纤维腺瘤进行麦墨通微创手术切除,手术满意度高达97%。 前两个因素最重要,当满足“年龄超过35岁”或“纤维腺瘤大小超过3厘米”任一项条件,就有手术指征。不过,以上手术时机要建立在影像学检查排除恶性可能的基础上,如果不能排除恶性可能,不论肿瘤大小都建议积极手术。一般来说,微创手术仅适用于3厘米以下的乳腺纤维腺瘤,3厘米以上的乳腺纤维腺瘤须做开放性手术才能清除干净。 对于一些年轻、多发乳腺纤维腺瘤的患者,手术后依然可能复发,建议每月至少一次自摸检查,3个月到半年到医院复查一次。至于年轻的、乳腺纤维腺瘤小的患者,可以长期观察,只要肿瘤不增大,半年到一年复查一次即可。但若乳腺纤维腺瘤有所变化,应立即到医院就诊。 此外,还要警惕乳腺分叶状肿瘤被误诊为乳腺纤维腺瘤。它和乳腺纤维腺瘤不太一样的地方在于:乳腺分叶状肿瘤多数长得大而快,35岁以上女性发病率较高。该肿瘤分为良性、交界性和恶性三类,即使是良性的分叶状肿瘤,复发几次也可能发生恶变。因此,在鉴别有困难时,应进行手术活检。
刘伟 副主任医师 白求恩国际和平医院 普通外科1922人已读 - 精选 胃癌是否一定需要手术治疗?
对于这样一个问题不能简单地用“是”或“否”来回答,医生常常要根据胃癌病人的具体情况来作出决定。目前对于早期胃癌病人应做根治性切除手术,这是有可能治愈胃癌的惟一治疗手段,在这点上一直不存在任何异议。I期胃癌的手术治愈率约在90%左右,II期胃癌也可以达到70%左右。对于较晚期的胃癌是否行手术治疗,患者和家属常常存在着较多的顾虑,主要是害怕手术会引起癌肿的扩散,反而促使病情进一步恶化。确切地讲,这种顾虑是毫无必要的。即使是晚期胃癌,尽管已不能做根治性手术,但是只要将主要的癌肿切除掉,由于消除了癌肿可能引起出血、穿孔、梗阻等并发症,减少了癌肿所产生的毒素对人体带来的不利影响,常能起到减轻病人症状,提高病人生活质量,延长生存期的效果。尤其是将主要的癌肿切除后,可以为手术后的中西药物治疗奠定基础,创造有利的条件。所以,胃癌一经确诊,手术治疗是第一位的。只要胃癌病人全身情况允许,而且没有广泛的远处转移,都应积极争取手术治疗,将癌肿切除。 当然,我们强调手术的重要意义,并不是否认其他的治疗方法。恰恰相反,为了提高手术的治疗效果,往往需要联合其他一些治疗方法。最常用的是手术前、中、后配合放射治疗或化学治疗。目的在于:①使病灶局限,为手术创造条件,以提高手术切除率;②减少手术中癌细胞的播散和种植;③作为根治切除后的巩固治疗,消灭可能存在的残留病灶以防止复发和转移;④作为非根治手术后的姑息性治疗,以控制病灶,延长生存。
刘伟 副主任医师 白求恩国际和平医院 普通外科2133人已读 - 精选 疖的治疗
长了疖子怎么治? 疖是细菌感染,当然要抗感染治疗。大家可以常备一支莫匹罗星、夫西地酸软膏,发现小红丘疹,或者有个疖子但没化脓,早涂早好。除了孕妇、哺乳期女性和 2 岁以下儿童需在医生或药师指导下使用外,普通人群都可以放心使用。 如果发现疖时,它已不是小小的红疙瘩,而是化脓了,甚至摸起来像里面有液体似的波动感,那底下十有八九还有一包脓液,则需要就近到社区医院去治疗,必要时可能要切开排脓。如果疖子化脓了同时还有发烧、头痛等全身症状,则表示炎症已经扩散,更需及时就诊,可能需要全身用药。 为什么有的人反复长「疖」? 对于反复发生、此起彼伏的疖子,临床上称之为「疖病」。这多数是因为「自家接种」,通俗地讲,就是手欠! 长了一个疖子,忍不住要摸,摸完后手上沾染了细菌,又去摸其他部位,导致播散。要想终结这个没完没了的噩梦,不需要神丹妙药,需要的是管住手、勤洗手。
刘伟 副主任医师 白求恩国际和平医院 普通外科3634人已读 - 精选 经腹近端胃癌根治回结肠间置代贲门代胃术
经腹近端胃癌根治回结肠间置代贲门代胃术近端胃癌根治术后,利用回结肠间置代贲门代胃术进行消化道的重建,即利用回盲瓣代贲门,利用结肠代胃,能有效的解决反流性食管炎及有效胃容量减少的问题。我科于1997年开展此项技术,取得了满意效果。 1.近端胃切除后消化道常用重建方式存在的主要问题。 贲门癌、胃底癌及靠近贲门的胃体癌行近端胃次全切除后,传统的消化道重建方法为食管与残胃吻合,患者术后普遍存在反流性食管炎及有效胃容量的减少的问题,尤其是反流性食管炎严重影响患者术后的生存质量。王其彰等通过对192例贲门癌切除术后患者进行电子胃镜、食管压力测定、24小时食管pH监测、放射性核素检查和电镜检查等多项指标检测,认为贲门癌切除食管胃吻合术后,广泛存在胃食管反流问题;反流的发生不因手术后期间的增长而减轻或缓解,胃食管反流是一终生存在的问题;术后半卧位睡眠是预防反流的有效方法。Hsu认为近端胃切除患者均存在反流性食管炎,防止反流性食管炎的唯一有效方法是全胃切除,主张胃贲门腺癌除早期外,应避免作近端胃切除。国内外学者对预防返流性食管炎作了许多研究,采用了多种改进术式,进行了一系列改进吻合方式及间置肠管的方法进行消化道重建,有关报告显示,能防止胃食管反流,应该承认在防止反流性食管炎方面空肠或横结肠间置的方法较传统方法有较大进步,但其必竞缺乏有关解剖、生理学方面的支持。 2.回结肠间置代贲门代胃的发展与现状。 回结肠间置代贲门代胃的方法,有相应的解剖、生理学方面的基础,利用回肓瓣这一自然结构代替贲门,使其具备了真正的单向屏障作用,利用结肠代胃有效的增加其容量。该方法最早在上世纪五十年代初国外有报道,主要用于全胃切除病例,Lee1951年报导了 1例,Hunnicut1952年报导了 6例。国内在六十年代以后曾有利用该术式进行食管下段癌及胃贲门癌切除术后消化道重建的报导,疗效满意,但手术入路均为胸腹联合切口,手术过程复杂、创伤大、操作过程有一定难度,使其推广应用受到限制。单纯经腹手术能避免上述不足,具有操作简便实用、损伤小、对心肺功能干扰少的优点,使回结肠代胃术在部分贲门癌手术推广应用成为可能,但经腹手术食管下段操作有一定限制,因此开展此项工作首先要有经腹进行贲门癌手术的工作基础,另外要严格掌握经腹手术的适应症,术前常规进行上消化道造影检查,选择正常腹腔段食管长度>2cm者。对贲门部肿瘤的手术路径选择尚有一些争议,主要围绕如何保证手术切除的彻底性,减少副损伤,最大限度的减少术后并发症,经腹手术相对创伤小,呼吸系统并发症少,患者恢复快的优点,其主要问题是食管残端癌残留,我科开展此项工作以来,由于严格掌握了手术适应症,未发现食管残端癌残留。 3.回结肠间置代胃代贲门的可行性及手术要点。 作为右下腹器官移植于上腹部,血管蒂的长度及解剖变异情况非常重要,资料显示回结肠动脉相对固定,变异少,有较大的游离度。解剖学资料显示回结肠动脉长 65.4±1.7mm,盲肠前动脉 55.6±1.7mm,盲肠后动脉 54.6±1.9mm。我科术中测定回结肠动脉及其盲肠前、后支的长度平均为15.2cm,较解剖学资料要长,使间置肠管能作到无张力吻合。间置肠管的制备及食管回肠吻合是该术式的手术要点,Sakamoto报告29例近端胃切除,间置肠管回肠6.8±2.4cm,结肠12±2.8cm;Uras报告 6例经腹近端胃切除,间置肠管回肠10cm,结肠10 cm,我们认为间置肠管在没有长期功能及病理学观察结果之前,结肠的长度不宜过长,一般不要超过15cm,回肠的长度在与食管吻合口没有张力的前提下,其长度越短越好。消化道吻合重建,食管回肠吻合操作困难,易发生吻合口并发症,使用GF-1型管状吻合器能提高吻合的安全性,但安装吻合器要逆行通过回盲瓣,需要一定的操作技巧,我们体会合理引导,适度加压是顺利完成操作的关键。4.回结肠间置代胃代贲门的优点 回结肠间置代胃代贲门有如下优点:(1)未端回肠与食管管径相近,便于吻合,有利于术后功能恢复。(2)回盲瓣有单向通过作用,既不影响食物的正常通过,又能有效防止返流。回育瓣有明确的抗逆流作用,有专家在行输尿管、回盲肠、乙状结肠吻合术实验研究时,术中测定回盲瓣的抗逆流阻力为 2.92kpa,术后对患者进行钡灌肠,在11.76 kpa的压力下,见钡剂充盈结肠各段,但回盲瓣始终末开放。 Rendleman等曾研究人体回盲瓣抗逆流阻力平均为36.6cm水柱,超过此压回盲瓣才开放。人体胃内压力在空腹及进食后变化不大,等于腹内压,因此回盲瓣能有效防止反流,我科术后上消化道造影资料证实回盲瓣抗返流作用。(3)盲肠肠腔宽大,有较大的容量,能储存 300~400ml,且顺应性良好,能有效的增加胃的储存功能。 附上消化道造影
焦喜林 副主任医师 白求恩国际和平医院 普通外科1633人已读 - 精选 胃肠间质瘤(GIST)
GIST定义GIST是胃肠道最常见的间叶性肿瘤,在分化上具有Cajal间质细胞的表型特征,在免疫组化上通常呈DOG-1 和CD117 阳性,在组织学上由梭形细胞、上皮样细胞、多形性细胞(偶而)排列成束状或弥漫分布。多数由突变的c-kit或PDGFRA(血小板源性生长因子受体)基因驱动,c-kit 与PDGFRA均属于Ⅲ型受体偶联的酪氨酸激酶家族。1998年,GIST分子病理学研究获得重大突破,提示大部分(75%~85%)GIST伴有c-kit基因功能获得性突变,表达c-kit基因蛋白产物CD117 是GIST 分子病理学特征。2003 年,Heinrish 等在无c-kit 基因突变的GIST中,又发现有PDGFRA基因的突变。近年发现,在无c-kit和PDGFRA基因突变的病例中,少数病例(约4%~13%)有BRAF基因突变。好发部位GIST可发生于从食管至直肠的消化道任何部位,此外还可发生于大网膜、肠系膜和后腹膜,胃GIST最常见,约占50%~70%,其次为小肠,约占25%~35%。病理组织学GIST在组织学上由梭形细胞、上皮样细胞组成,偶或由多形性细胞组成。依据细胞形态可分为三大类:梭形细胞型(70%)、上皮样细胞型(20%)和梭形细胞/上皮样细胞混合型(10%)。 (HE 染色下的GIST组织)免疫组化诊断与鉴别诊断对于组织学符合典型GIST、DOG-1和(或)CD117 免疫组化阳性的病例,可作出GIST 的诊断。在Miettinen 报告的1040 例GIST 中,CD117 和DOG1 阳性率均接近95%。值得注意的是,约一半CD117 阴性的GIST 显示为DOG1 阳性;约一半DOG1阴性的GIST显示为CD117阳性;在无c-kit和PDGFRA突变的Ⅰ型神经纤维瘤病相关性GIST 和儿童GIST 均呈CD117 和DOG1阳性。这说明了CD117 和DOG1 在诊断GIST中的互补性和联合应用这两种标志的重要性。在判断一种肿瘤是否为CD117 阳性时,首先应看细胞膜着色,这是因为CD117作为干细胞因子的受体定位于细胞膜,这是其接收生长因子信号刺激进而发挥信号传递作用的前提。此外,在不少胃肠道间叶肿瘤内,常含有数目不等的肥大细胞,其免疫组化特点之一是CD117阳性,不能将肿瘤细胞CD117阴性而仅肥大细胞CD117阳性的病例误诊为GIST,这在食管和胃的平滑肌瘤与GIST的鉴别诊断中尤为重要。若肿瘤细胞呈SMA弥漫阳性、CD117却阴性,其中所含的CD117阳性细胞同时又呈Giemsa和类胰酶阳性,则进一步说明这些CD117 阳性的细胞为肥大细胞。而且,食管GIST少见,在包括平滑肌瘤和所有间叶性肿瘤中,GIST 仅占10%~20%,肿瘤由分化良好、排列成不规则束状的平滑肌细胞构成,常可见嗜酸性胞质内包涵体(结蛋白阳性),细胞核密集程度远较GIST稀疏。平滑肌肿瘤和其他肿瘤(如孤立性纤维性肿瘤)可表达CD34,故CD34阳性作为诊断GIST的特异性不强,且敏感性较差,已不再提倡用其作为诊断GIST的标志物。 (CD117阳性) (Desmin阴性)(SMA阴性)从免疫组化层面出发,在某一肿瘤的DOG-1 和CD117 均为阴性时,若S-100 阳性则应诊断为神经鞘瘤,若SMA阳性则应诊断为平滑肌源性肿瘤。另一种须与GIST鉴别的是肠系膜纤维瘤病,其几乎是肠系膜最常见的肿瘤,可散发或与FAP/Gardner 综合征伴发。多数肠系膜纤维瘤直径大于10 cm,若与GIST 混淆,常被诊断为高度危险性GIST。肠系膜纤维瘤病细胞无异型性,呈梭形或星形,含有密集的胶原纤维间质。由于有文献称肠系膜纤维瘤病可呈CD117阳性,这给鉴别诊断进一步带来了混乱。实际上,肠系膜纤维瘤病呈CD117阴性且β连环素着染肿瘤细胞核,这具有鉴别意义。对于组织学符合典型GIST、DOG-1、CD117 阴性的肿瘤,应交由专业分子生物学实验室检测。若存在c-kit 或PDGFRA基因突变,可协助明确GIST诊断;对于无基因突变的病例,在排除其他肿瘤(如平滑肌肿瘤、神经源性肿瘤等)后也可做出GIST诊断。若甲磺酸伊马替尼实验治疗有效,更支持GIST的诊断。分子病理学检测 既然多数GIST 是由突变的c-kit 或PDGFRA 基因驱动,对这两个基因进行分子病理学检测的意义显而易见。 预后意义c-kit基因第11外显子突变者预后优于c-kit基因第9外显子突变者;c-kit基因第9外显子突变者优于c-kit基因野生型患者。 甲磺酸伊马替尼治疗反应和剂量选择意义c-kit基因第11号外显子突变者疗效最佳,治疗初始剂量一般采用800 mg/d;而c-kit 基因第9 号外显子突变者疗效较差,但初始剂量改为600~800 mg/d可明显改善疗效。 甲磺酸伊马替尼原发性耐药的预测意义尽管报告的病例尚少,有试验表明,PDGFRA基因D842V突变患者可能对甲磺酸伊马替尼治疗无效。 诊断意义对于病理形态学符合GIST、但DOG-1和KIT免疫组化阴性、其他免疫组化结果又不支持神经鞘瘤或平滑肌源性肿瘤诊断者,若检测出c-kit或PDGFRA基因突变,则可确立GIST的诊断。值得注意的是,即使c-kit和PDGFRA基因无突变,也不能完全排除野生型GIST的可能。 此外,突变还可用于鉴别散发性GIST和生发系突变的家族性GIST,鉴别NF1伴发的GIST、Carney’s三联征和儿童GIST。 继发耐药的判断对于甲磺酸伊马替尼治疗过程中发生继发耐药的GIST患者,常存在KIT或PDGFRA基因的二次突变。 鉴别多发性肿瘤之间的相互关系同时性或异时性多发性GIST 可彼此独立发生,也可是原发肿瘤与继发肿瘤的关系。 关于GIST分子病理学检测的主要适用范围,专家组推荐以下情况须行突变分析:① 所有复发和转移性GIST;② 甲磺酸伊马替尼治疗过程中继发耐药的GIST;③ 原发肿瘤可切除、手术后病理为中~高度危险的GIST(且考虑行甲磺酸伊马替尼辅助治疗);④ 疑难诊断病例,例如病理形态学符合GIST,但DOG-1和KIT免疫组化阴性。 基因突变检测位点至少应包括c-kit基因的第11、9、13和17号外显子及PDGFRA基因的第12和18号外显子。 由于c-kit基因第11号外显子是GIST最常见突变,可首先检测,然后依次检测第9、13和17号外显子;由于c-kit基因突变较PDGFRA基因突变常见,首先检测c-kit基因突变,仅对c-kit基因无突变的病例检测PDGFRA基因的第12和18号外显子突变;PDGFRA基因突变更常见于胃和胃肠道外GIST。检测报告应显示具体的突变类型,例如有资料表明,第11号外显子缺失突变的胃GIST较点突变者的生物学行为激进。 对于以上6个最常见外显子的突变检测,推荐采用PCR扩增-直接测序的方法。基因检测应在有条件的实验室进行,以确保检测结果的准确性和一致性。(肿瘤原发部位、大小、是否发生破裂和核分裂象与GIST生物学行为的关系)GIST生物学行为危险度评估 GIST的生物学行为是从良性、低度恶性潜能和恶性的连续谱系。 典型的恶性GIST在腹腔内扩散形成多发性肿瘤结节,最常见的血行转移部位是肝脏,而肺和骨转移相对较少。对于这些已有腹腔内扩散和远隔脏器转移的病例,临床病理应直接诊断为恶性GIST,不必进行生物学行为危险度评估。 对于肿瘤局限且手术能完整切除的GIST,目前国内外采用危险度来评估其生物学行为。评估危险度的标准包括:肿瘤大小、核分裂象、原发肿瘤部位及肿瘤是否发生破裂。 以肿瘤最大径代表肿瘤大小。核分裂计数须包括分裂象较集中的50个高倍视野(HPF)下的核分裂数。 由于50 HPF=10 mm2,若所使用的显微镜视野直径为0.5 mm,单个视野面积为0.196 mm2,则需计数50 个HPF;若所使用的显微镜物镜直径为0.65 mm,单个视野面积为0.332 mm2,则计数30个HPF即可。 规范的标本处理程序和病理诊断报告书 共识强调,合格的标本处理程序是对GIST进行准确免疫组化诊断和分子病理检测的前提。手术标本须及时固定,标本离体后应在30分钟内送至病理科,用足量的中性10%福尔马林(至少3~5 倍于标本体积)完全浸泡固定。对于直径≥2 cm的肿瘤,须每隔1 cm予以切开。固定时间应为12~48 h,以保证后续的免疫组化及分子生物学检测的可行性和准确性。对于有条件的单位,推荐留取未固定的新鲜组织冻存,以备随后的分子遗传学研究使用。GIST生物学行为危险度评估 GIST的生物学行为是从良性、低度恶性潜能和恶性的连续谱系。 典型的恶性GIST在腹腔内扩散形成多发性肿瘤结节,最常见的血行转GIST病理共识的未尽事宜 在实际工作中,仅依靠肿瘤大小、核分裂象、原发肿瘤部位及肿瘤是否发生破裂来评估GIST危险度可能具有局限性。组织学和分子生物学的预后参数,例如肿瘤细胞的异型性、围绕血管密集排列呈古钱币样、肿瘤性坏死、肌层浸润、黏膜层或浆膜层浸润、脉管和神经浸润、瘤栓形成等对GIST生物学行为的评估作用;关于肿瘤分期、分级对生物学行为的影响,现已有一些研究结果,可否将这些指标整合入GIST危险度评估值得进一步探讨。 至于GIST是否存在良恶性的问题已越来越明确,肯定存在着良性GIST,也有研究指出,可对GIST病理指标进行综合分析来确定肿瘤良恶性,这值得进一步深入研究。不过在当前情况下,还是以报告GIST危险度来反映肿瘤生物学行为更为合理、安全,同时也能较合理地指导临床治疗。
刘伟 副主任医师 白求恩国际和平医院 普通外科7950人已读 - 精选 进展期胃癌新辅助化疗的进展
胃癌的术前辅助化疗并非一个新的概念,很早就有相应的理念和做法。主要原因在于胃癌早期发现较为困难,一旦就诊多为进展期胃癌,术后5年生存率多在20-50%[1]。手术切除是目前唯一可能根治胃癌的手段,但仅限于病变较早的I期胃癌,故而提高手术切除率是改善胃癌患者生存情况的切实措施。值得注意的是,从目前研究资料来看,即使是姑息性切除也较未切除疗效好。根据中国医科大学肿瘤研究所报告,未手术和剖腹探查患者的生存期在3.94-4.37个月,平均寿命7.08-12.95个月;而姑息性切除患者则分别为11.35和14.64个月[2]。因此,目前在胃癌外科已经初步达成了这样两个共识:(1)单纯外科手术无法达到生物学意义上的根治, 即便扩大切除和淋巴结清扫范围,仍然如此。(2)没有出现远处转移的胃癌患者,姑息切除的效果较之未手术者效果要好。那么,积极寻求其他可能根治肿瘤的手段和提高手术切除率,尤其是根治性切除率成为改善胃癌患者预后的两大目标。[3] 胃癌新辅助化疗(neoadjuvant chemotherapy),又称术前化疗,主要目的在于使肿瘤缩小,提高手术切除率,改善治疗效果。新辅助化疗的方案均出自胃癌化疗的经验,早期多以5-FU 及PDD 为主要药物,如FAM、EAP、ECF、ELF、FAMTX 等,但上述化疗方案新推出时疗效往往较好,而常常不能重复。近年来在胃癌化疗领域有较多发展,如5-Fu的持续灌注、化疗增敏剂的使用、新型药物的出现、与放疗的结合等,也为胃癌新辅助化疗提供了新的希望,因而又成为进展期胃癌研究的热点。本文结合近年国内外有关胃癌新辅助化疗的研究结果,对该领域的进展情况综述如下。 一、 疗效的总体评价 一般认为,新辅助化疗的有效率为31-70%,切除率因所选病例差异而相差较大(40-100%),中位生存期15-52个月。事实上,对于胃癌的新辅助化疗,由于随机前瞻性的临床对照试验相对较少,限制了对此问题的准确评价。本研究组新近在循证医学图书馆(Cochrane Library)发表的系统综述,筛选出胃癌新辅助化疗的随机对照研究共4 项,结果发现胃癌新辅助化疗的相对危险度OR为1.05(95% CI: 0.73-1.50),不支持新辅助化疗。但是文中也指出,前期随机对照研究采用化疗方案效果不佳,很大程度上影响了对新辅助化疗的综合评价;[4] 另外,如纳入MAGIC 研究的结果,则两组差异可达到统计学显著水平。MAGIC 研究纳入500 名胃癌患者,随机分为围手术期化疗组和单纯手术组。化疗方案是术前和术后均接受ECF 方案化疗3 周期,结果发现围手术期化疗组可使患者5 年总生存率从23%提高到36%。[5] 该研究结果导致2007 年NCCN指南推荐胃癌新辅助化疗作为1 级证据。[6] 该研究后来也受到不少批评,包括胃癌手术不够规范、术前分期不够准确、化疗毒性反应较重等,还有认为MAGIC 研究中的化疗方案ECF(表柔比星、顺铂、5-FU)是80 年代开始流行的胃癌化疗方案,目前已有新替代药物,如奥沙利铂替代顺铂、卡培他滨替代5-FU,新一代药物已显示出很好的疗效。[7] 笔者在前期工作的基础上,[8] 采用以奥沙利铂为主的FOLFOX 方案,组织开展北京市胃癌新辅助化疗多中心对照研究,截至2006 年共纳入99 例胃癌患者,其中新辅助化疗组38 例,临床有效率58%,根治性切除率高于对照组(63% vs 52%)。[9] 除此之外,常用于胃癌新辅助化疗的药物还有紫杉醇、多西紫杉醇、伊立替康和S-1,均显示了良好的抗肿瘤特性。[3] 紫杉醇治疗胃癌单药有效率在20%以上,联合使用氟尿嘧啶、亚叶酸钙、顺铂等药物可进一步提高疗效,最高可达70%。在我们临床应用来看,毒性反应较轻,常规应用抗过敏药物后,最为常见的毒性反应是骨髓抑制和脱发等。奥沙利铂联合用药治疗晚期胃癌的有效率为42.5-64%,主要毒性反应是周围神经损害。对多西紫杉醇治疗胃癌的报告比紫杉醇还早,其有效率17.5-24%,剂量由60-100mg/m2不等,不同用药间隔和剂量有效率似乎相差不多,但其严重的骨髓抑制大大限制了其临床应用,主要是中性粒细胞减少,且多为III/IV度,出现粒细胞减少性发热的患者不少见。依立替康治疗晚期胃癌单药有效率为14-23%,联合用药的有效率为42.5-64%。其主要的毒性反应为致命性腹泻,其次为骨髓抑制。近年来S-1 为主的化疗方案报告较多。S-1是替加氟(tegafur, FT)、吉美拉西(gimeracil, CDHP)和奥替拉西钾(oteracil potassium, OXO)复方制剂的商品名,各组成摩尔比为1:0.4:1。替加氟在吉美拉西和奥替拉西钾两种药物的调节作用下,增强了氟尿嘧啶的抗癌作用,降低了毒副作用。一项1059 名日本胃癌患者参加的多中心临床研究结果显示,在根治性胃癌手术后S-1 辅助治疗组3 年生存率为80.5%,而对照组仅为70.1%,且不良反应较轻,仅为恶心、呕吐、食欲减退和轻度血液学毒性。[10] Satoh S报告使用S-1联合顺铂治疗45 例进展期胃癌患者的结果,根治性切除率80%,其中临床分期IV期的27 例患者中有10例达到了R0 切除,R0切除与未达到R0切除的患者中位生存期分别为22.3 和12.6 个月,临床III期的患者R0切除后2年生存率高达90.9%。[11] 意大利学者D'Ugo D 等报告30 例患者胃癌新辅助化疗的3 年随访结果,其中13 例达到降期,80%根治性切除,切除组3年生存率达到70.8%,全组为56.7%,但文中未提及具体化疗方案。[12] 美国Ajani 等2006 年报告了RTOG9904 的结果,该研究方案为氟尿嘧啶、亚叶酸钙和顺铂两周期化疗后同步放化疗(氟尿嘧啶持续灌注并紫杉醇每周输注)。结果发现,49 例患者(43 例可评价)中,病理完全缓解和R0 切除率分别为26%和77%,获得病理缓解的患者1 年生存率较高(82% vs 69%),但不良反应较多,4 度者占21%。该研究主要问题是D2 淋巴结清扫者仅占50%。[13] 美国斯隆凯特林纪念医院采用氟尿嘧啶联合顺铂并术后腹腔灌注化疗,共38 例患者入组,术前静脉氟尿嘧啶联合顺铂两个周期后接受胃癌根治术(D2 淋巴结清扫),术后腹腔灌注化疗氟脲嘧啶脱氧核苷并亚叶酸钙。该方案耐受良好,R0切除率为84%。中位随访43 个月,15 例患者仍然存活, 病理反应良好者预后较好(P=0.053)。[14] 美国纽约大学Newman等报告同上述报告同样治疗模式的研究结果,术前化疗方案为依立替康联合顺铂,32 例可评价胃癌患者中,中位随访28 个月,14 例存活,25例R0切除患者无局部复发。[15] 综上所述,可以看出,胃癌新辅助化疗研究近年来比较活跃,且能达到提高R0 切除率,有改善患者生存率的可能,但是鉴于目前研究病例数目少,多为临床I/II期研究,真正的随机前瞻性对照研究较少,故而对其评价尚需动态观察。
刘伟 副主任医师 白求恩国际和平医院 普通外科1543人已读 - 引用 乳腺癌病理报告解读:四大关键指标及分子分型
当我们拿到乳腺癌的病理报告时,常常会感到一头雾水。繁杂的中英文术语让人难以理解,其中最重要的四个指标是:ER、PR、HER-2和Ki67。这些指标对于确定治疗方式至关重要。关键指标解读:ER和PR:分别代表雌激素受体和孕激素受体,用于判断内分泌治疗的敏感度。阳性结果推荐内分泌治疗。HER-2:用于判断是否需要靶向治疗,阳性结果表示肿瘤恶性程度较高,需进行靶向治疗。Ki67:代表肿瘤增殖指数,值越高表示肿瘤生长越快,但对化疗更敏感。分子分型:LuminalA型:ER和PR阳性、HER-2阴性,Ki67小于14%,预后较好,仅需内分泌治疗。LuminalB型:ER和(或)PR阳性,Ki67大于14%,治疗手段多样。HER-2过表达型:HER-2阳性,增殖能力强,需化疗和靶向治疗。三阴性乳腺癌:ER、PR和HER-2均阴性,治疗选择较少,仅依靠化疗。其他重要指标:除以上四大指标外,病理报告还包括病理类型、组织学分级、淋巴结转移情况等,这些将影响后续治疗方案的选择。综合分析病理报告中的各项指标是制定治疗方案的关键。手术只是治疗的开始,后续的治疗方案需根据具体情况进行调整,以提高治疗效果。
 刘伟 副主任医师 白求恩国际和平医院 普通外科622人已读
刘伟 副主任医师 白求恩国际和平医院 普通外科622人已读 - 乳腺癌会遗传吗?
导语:当我们谈论乳腺癌时,不得不提及一个令人担忧的问题——乳腺癌是否会遗传?家族中有乳腺癌病史的人,该如何面对这一现实?今天,让我们揭开这个问题的神秘面纱,为患者和家属带来科学的解答。一、乳腺癌的基本概念首先,让我们了解一下乳腺癌的基本概念。乳腺癌是一种发生在乳腺导管或腺叶的恶性肿瘤,多发于女性,男性也可能患乳腺癌。乳腺癌的发生与遗传、激素水平、生活方式等多种因素有关。二、乳腺癌与遗传的关系那么,乳腺癌是否会遗传呢?答案是肯定的。研究发现,具有家族史的女性患乳腺癌的风险较高。具体来说,如果一位女性的一级亲属(如母亲、姐妹)患有乳腺癌,那么她患乳腺癌的风险将增加一倍;如果两位或更多一级亲属患有乳腺癌,风险将增加三倍。然而,遗传只是乳腺癌发病的一个因素,并非决定性因素。遗传因素与环境中其他因素(如生活方式、激素水平等)共同作用,才增加了患病风险。这意味着,即使有家族史,只要调整生活方式、保持良好的生活习惯,也能降低患病风险。三、乳腺癌的预防与筛查健康生活方式:保持健康的体重、均衡饮食、适量运动、戒烟限酒等,有助于降低乳腺癌风险。激素替代治疗:更年期女性在使用激素替代治疗时,应遵循医生建议,确保治疗必要且合理。乳腺癌筛查:定期进行乳腺癌筛查,如乳腺超声、乳腺X线检查等,有助于早期发现、早期诊断、早期治疗。遗传咨询:具有家族史的女性,可咨询专业医生,了解遗传风险,制定个性化的预防策略。四、结语乳腺癌会遗传,但并非唯一决定因素。具有家族史的女性,不必过分担忧,而应关注自身健康,采取科学的预防措施。与此同时,全社会的关注和支持,也能为乳腺癌患者和家属带来更多的关爱和希望。让我们携手,用科学的态度面对乳腺癌,为患者和家属点亮生活的曙光。
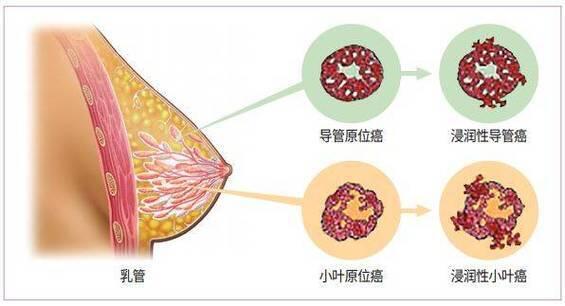 刘伟 副主任医师 白求恩国际和平医院 普通外科38人已读
刘伟 副主任医师 白求恩国际和平医院 普通外科38人已读 - 体育锻炼能降低癌症风险,你知道吗?
研究发现,年轻时积极参与体育锻炼,以及保持终身体育锻炼,有助于降低乳腺癌、结肠癌和子宫内膜癌的风险。在我们的身体里,激素和代谢途径的失衡可能导致癌症的发生。而体育锻炼就像一个调节器,帮助我们平衡这些因素,从而降低癌症的风险。已经有充分的证据表明,中老年时期保持体育锻炼可以显著降低肥胖相关癌症的风险,如乳腺癌、结肠癌和子宫内膜癌。那么,年轻时的体育锻炼和终身体育锻炼到底能不能降低癌症风险呢?最近的一项研究给出了肯定的答案。这项研究包含了超过80篇论文,综合分析了各种类型的体育锻炼与癌症风险的关系。结果显示,年轻时期的高水平体育锻炼确实能降低乳腺癌和结肠癌的风险,而终身体育锻炼则与这两种癌症的风险降低密切相关。值得一提的是,子宫内膜癌的风险降低仅与高终身体育锻炼有关,而与年轻时期的体育锻炼关系不大。这可能是因为,随着年龄的增长,我们的生活方式和身体状况会发生改变,体育锻炼对癌症风险的影响也会有所不同。总之,保持终身体育锻炼,有助于降低乳腺癌、结肠癌和子宫内膜癌的风险。所以,朋友们,动起来吧!让体育锻炼成为我们生活中的一部分,为自己的健康加分!
 刘伟 副主任医师 白求恩国际和平医院 普通外科29人已读
刘伟 副主任医师 白求恩国际和平医院 普通外科29人已读



