上海东方肝胆外科医院放射介入科科普号
- 精选 梗阻性黄疸PTCD治疗后胸腔及腹腔大出血的急诊NBCA-PVE止血
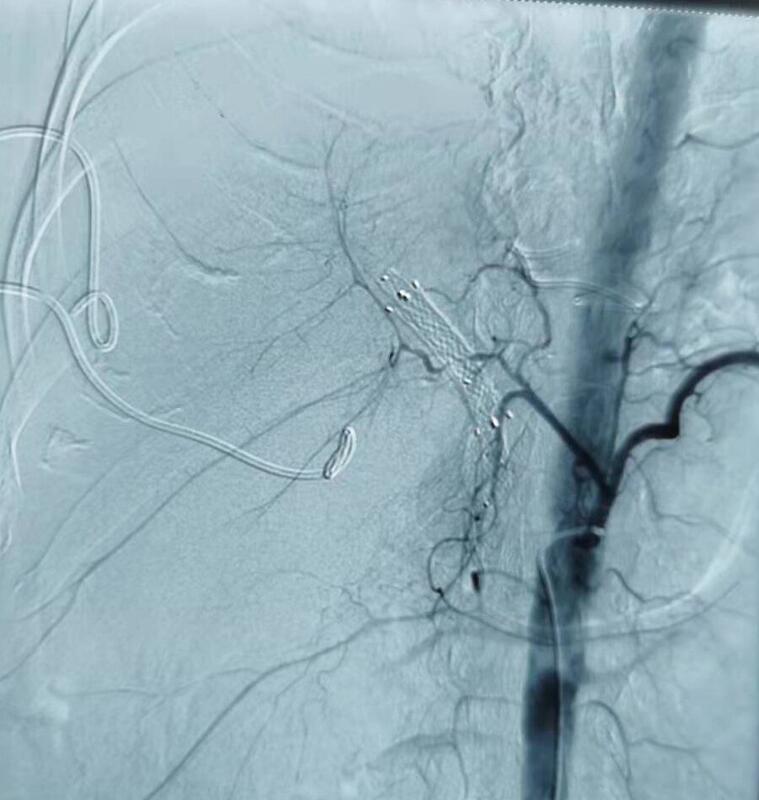
男性,65岁,PTCD术后2周,因引流管脱出更换管子不成功后突发胸腔和腹腔大出血,引出血性液体近5000mL,血压最低60/30,神志不清。急诊动脉造影未发现肝动脉出血(图1),直接门静脉造影发现穿刺窦道有活动性出血(图2),遂急诊行NBCA-PVE,成功栓塞两根出血的门静脉分支后(图3,图4),门静脉主干造影显示出血分支栓塞良好,出血立即停止。术后病人血压平稳(15:30,患者血压升至99/51),神志清楚。术后随访,患者体征平稳,无再次出血!
 徐伟 副主任医师 上海市东方医院 微创介入治疗中心432人已读
徐伟 副主任医师 上海市东方医院 微创介入治疗中心432人已读 - 精选 肝癌不能手术了,该怎么办?
一.为什么很多肝癌不能手术?1.原发性肝癌简称肝癌,早期没有症状或症状不明显,进展迅速,确诊时大多数已经是晚期或发生远处转移,约有85%的患者失去手术根治的机会。肝癌巨大,剩余肝体积过小,难以耐受手术。2.肝硬化严重,肝脏本身就处于失代偿期,即使肝癌较小也难以耐受手术。严重肝硬化伴肝癌3.患者有糖尿病,或者有严重的心肺功能障碍,也是无法耐受手术的。二.肝癌不能手术了,怎么办?1.能不能做肝移植?晚期肝癌多伴血管癌栓、远处转移,肝移植疗效不佳,很快出现复发和转移。2.介入(肝动脉化疗、栓塞)治疗怎么样?介入治疗是不能手术的肝癌首选治疗方法。肝动脉化疗栓塞具有较好的近期疗效。肝癌介入治疗操作简单易行,安全可靠,不须全麻,可以重复进行,而且肝癌介入治疗费用相对比较低。肝癌介入示意图巨大肝癌的肝动脉栓塞载药微球肝动脉栓塞,药效持续到术后近1个月,对于不能接受手术的肝癌患者而言,可显著提高3年生存率,并大幅降低肝动脉化疗栓塞的副作用。治疗前载有吡柔比星的微球载药微球栓塞后肿瘤坏死钇-90微球栓塞。钇 90 微球体是一种带有放射线的微小球体,钇-90微球治疗是将携带有高强度放射性元素钇-90,与微型球体相结合经导管由肝动脉,注入肝脏肿瘤,让钇-90射线杀死肿瘤。钇 90 微球体被注入肝癌肿瘤内钇 90射线杀灭癌细胞门静脉栓塞联合肝动脉栓塞,可为部分大肝癌创造手术切除的机会。肝癌位于右肝,左肝较小,切除右肝左肝不够用门静脉右支栓塞,促进剩余肝增生。3.听说肝癌可以烧掉(消融),晚期肝癌行吗?消融是在影像学设备的引导下,将消融针经皮直接插入肝癌里,通过产热、冷冻作用,使肿瘤组织凝固坏死,瞬间灭活。晚期大肝癌行消融联合肝动脉化疗栓塞,可以取得一定的疗效。严重肝硬化的小肝癌,消融是最好的治疗,可以达到手术治疗相同的效果。肝癌经皮消融示意图动物肝实验射频消融术中超声影像消融前消融后肿瘤及周边肝组织坏死,达到了手术治疗同等的效果4.放射性125I粒子植入碘125粒子植入治疗,是直接将粒子植入肝癌内,是一种放射治疗。碘125粒子能发出低能量γ射线,对肝癌组织进行持续性的、最大程度的毁灭性杀伤。治疗前的肝癌碘125粒子植入治疗后,肝癌明显坏死缩小5.分子靶向治疗与免疫治疗近年来,分子靶向药物治疗肝癌已取得较好的临床效果。目前用于肝癌的靶向药物主要有:索拉非尼(多吉美)、瑞戈非尼(俗称多吉美二代,拜万戈)、乐伐替尼(E7080)等。免疫治疗:PD-1/PD-L1拮抗剂,晚期肝癌的一线治疗,及索拉非尼治疗后疾病进展的晚期肝癌患者二线治疗。靶向治疗、免疫治疗可以联合肝动脉栓塞,联合放射性粒子植入,联合消融治疗等,可以取得比单一治疗更好的效果。
王华 副主任医师 上海市同济医院 肝胆外科中心9693人已读 - 精选 门静脉高压症
什么是门静脉高压 门静脉高压症(portal hypertension,PHT)是指门静脉系统血流受阻和(或)血流量增加,导致门静脉及其属支血管内静水压持续升高所引起的一组临床综合征。大多数由肝硬化引起,少数继发于门静脉主干或肝静脉梗阻。门静脉高压的主要病因肝炎性肝硬化、血吸虫性肝硬化、酒精性肝硬化占肝硬化发病率的90%。其他病因有门静脉血栓形成、门静脉癌栓、先天性肝纤维化、特发性门静脉高压、肝豆状核变性、布加综合征等。门静脉高压有什么表现1.脾大、脾功能亢进 充血性脾大是本病的主要临床表现之一,也是临床最早发现的体征。 脾大伴脾功能亢进时患者白细胞计数减少、增生性贫血和血小板减低。易并发贫血、发热、感染及出血倾向。2.腹腔积液 肝硬化晚期出现门静脉高压时,常伴发腹腔积液,腹腔积液量少时仅有轻度腹胀感,随着量的增多,腹胀加重,并有食欲不振、尿少,甚至因过度腹胀引起腹肌疼痛或呼吸困难、心功能障碍及活动受限。3.门体侧支循环的形成 门体侧支循环的建立和开放是门静脉高压的独特表现。 ①出血。出血是食管胃底静脉曲张后破裂引起的,是严重的并发症。 ②门体分流性脑病。有10%~20%的肝硬化患者,肝细胞代偿功能尚佳,但肠道产生的毒性物质未经肝脏代谢,经肝外门体侧支循环分流直接进入体循环,引起自发性门体分流性脑病,是肝性脑病的一种类型,病人多在摄入大量蛋白质后出现神经精神症状,限制蛋白质摄入病情常可自行缓解。 ③腹壁和脐周静脉曲张。腹壁静脉曲张显著者可呈海蛇头状称水母头征。沿静脉可触及震颤或闻及杂音,称之为克-鲍综合征。4.门静脉高压性胃肠血管病 门静脉高压性胃肠血管病是指长期门静脉高压所导致的胃肠黏膜血管病变,其发病部位依次为胃、小肠、大肠和直肠。根据其发病部位分为: ①门静脉高压性胃病患者常发生胃黏膜炎症、糜烂和溃疡,总发生率约为90%,也是本症患者并发上消化道出血的重要原因之一。目前被公认为门静脉高压性胃病(PHG)。患者不思饮食、腹胀和嗳气,上腹部不适或疼痛,溃疡形成后也不出现典型的消化性溃疡症状,诊断依靠内镜检查。 ②门静脉高压性肠病(PHC)临床有门静脉高压的表现,常伴有下消化道急、慢性出血的潜在因素。弥漫性樱桃红斑点可能因门静脉压力升高引起,而血管扩张和直肠静脉曲张与门静脉压力升高无关。长期药物治疗可减轻肝硬化患者直肠黏膜弥漫性樱桃红斑点,同时降低门静脉压力。门静脉高压如何检查实验室检查血常规、尿液、粪便、肝功能、免疫学检查及其肝纤维化的血清标志物检查等。腹腔穿刺腹腔穿刺抽取腹水,对腹水行常规、生化、培养及瘤细胞检查。超声显像可行实时成像、二维超声和彩色多普勒血流成像相结合对门静脉高压检查。①腹部B型实时超声;②内镜超声检查;③脉冲超声多普勒;④彩色超声多普勒。其超声征象具有显着的特征性,二维超声检查显示曲张静脉呈蜂窝状、网络状或葡萄状无回声结构,而在曲张静脉的异常结构中检测到红蓝相间的彩色血流信号及连续性低流速带状门脉样血流频谱。X线钡餐造影是临床首选X线检查方法,可显示主动脉弓以下食管黏膜呈虫蚀样或串珠样充盈缺损,在食管蠕动时上述现象消失,以区别食管癌。对疑似病人,检查时作Valsalva动作或注射654-2可提高检出率。计算机断层扫描(CT)CT扫描对肝内性及肝外性门静脉高压的诊断均有十分重要的意义。CT扫描不仅可清晰显示肝脏的外形及其轮廓变化,还显示实质及肝内血管变化,并可准确测定肝脏容积。CT扫描图像可明确提示门静脉系有无扩张及各侧支血管的形态变化,注入造影剂之后可显示有无离肝血流。磁共振成像(MRI)磁共振成像可清晰显示门静脉及其属支的开放情况,对门-体侧支循环的检出率与动脉-门静脉造影符合率高。磁共振显像可以比较清晰地显示门静脉及其属支的血栓及门静脉的海绵状变形,对肝外门静脉高压的诊断具有重要意义。核素扫描核素扫描不仅可以确定有无分流,而且还可以区分是肝内分流还是肝外分流,并可进行定量,区别肝硬化性与非肝硬化性门静脉高压。血管造影能了解肝动脉、肝静脉、门静脉和下腔静脉形态、分支及病变。肝固有动脉及左、右肝动脉造影可以避免与其他血管重迭,使病变显影更清晰。因为有创伤,限制了其日常应用。内镜检查胃镜检查;腹腔镜检查。压力测定门静脉压力测定;食管曲张静脉压力测定(EVP)血流量测定全肝血流量测定;肝动脉和门静脉血流分数的测定。肝组织活检肝脏组织变化依然是诊断肝硬化的“金标准”,对于每例肝硬化的病人均应尽可能通过细针穿刺或腹腔镜直视下活检、剖腹探查或经静脉活检等获得活检标本,进行组织学诊断。门静脉高压怎么治疗一般治疗门静脉高压病人病情稳定而无明显其他并发症时,可根据以下原则综合治疗,以针对病因或相关因素治疗为主。治疗包括:休息、饮食、病因治疗,支持治疗、护肝、降酶、退黄治疗等。降低门静脉压的药物治疗药物治疗可降低门静脉及其曲张静脉压力,需要早期、持续和终身治疗以减少其并发症,降低病死率。用于降低门静脉压力的药物主要有三大类:血管收缩药物、血管扩张药物等。内镜治疗随着胃镜的广泛开展,特别是急诊内镜临床应用研究的深入,不仅对门静脉高压所致的食管胃底静脉曲张的诊断及曲张静脉破裂出血的紧急救治取得了显着疗效,而且由于内镜治疗技术的不断发展,可有效的预防出血。内镜下套扎加小剂量硬化剂联合治疗优于单纯使用硬化剂,且副作用小;再在胃底的曲张静脉延伸部分注射组织黏合剂,效果更好介入治疗主要有:①经颈静脉肝内门体静脉支架分流术(TIPSS);②经皮肝穿刺门静脉分支栓塞术(PIE);③经皮经肝门静脉栓塞术(PTO);④经回结肠静脉栓塞术(TIO);⑤脾动脉栓塞术;⑥经气囊导管闭塞法逆行性静脉栓塞术(B-RTO);⑦双重气囊闭塞下栓塞治疗术(DBOE);⑧经肠系膜上动脉灌注垂体后叶素治疗术。三腔二囊管压迫止血法是传统的治疗食管胃底静脉曲张破裂出血的压迫止血法。由于EVB出血来势凶猛、出血量大,紧急应用S-B管局部压迫止血,可起到较好的暂时疗效,可为内镜、介入或外科手术治疗创造条件。外科治疗对门静脉高压的外科治疗选择必须考虑到本病的发病原因、病理生理、血流动力、肝脏功能等诸多因素的影响,以选择合适的外科治疗方式。目前我国的门静脉高压仍主要是由肝硬化引起的,其外科治疗的目的则主要考虑解决食管胃底静脉曲张而引起破裂出血,其次是要解决脾大及脾功能亢进。 在食管静脉曲张急性大量出血时,介入治疗可作为抢救的一线方案; 食管静脉曲张出血药物联合内镜治疗失败时,介入是有效的补救性治疗; 介入是治疗难治性腹水的一线治疗方案; 介入是难治性肝性胸腔积液的重要治疗方法; 对于终末期肝硬化门静脉高压如有条件可行肝移植治疗。
王华 副主任医师 上海市同济医院 肝胆外科中心4505人已读 - 精选 深静脉血栓,无声的杀手
血栓是全球前三位的致死性心血管疾病——心肌梗死、脑卒中和静脉血栓栓塞症的共同发病机制。根据国际血栓与止血学会提供的资料显示:在美国,每年有10~30万人死于静脉血栓,在欧洲,每年有50万人死于静脉血栓,超过艾滋病、乳腺癌和前列腺癌、高速公路交通事故死亡人数之和。在中国,静脉血栓形势也同样严峻。虽然静脉血栓栓塞症位列第三大心血管杀手,但是认知却很低。由于约80%的深静脉血栓是“沉默”的、无临床表现;70%以上的肺栓塞是在死亡后发现,故静脉血栓疾病是人类“无声的杀手”。哪些人容易患深静脉血栓l手术后长期卧床或不能活动病史的l创伤,肥胖,高血脂或年龄在40岁以上l有心肌梗塞,心力衰竭,中风,肾病综合症病史的l有口服避孕药,妊娠,静脉曲张或以往有血栓形成史的l恶性肿瘤如何尽早发现下肢静脉血栓呢?深静脉血栓是指血液非正常地在深静脉内凝结。深静脉血栓引起的腿部胀痛的主要症状有三点:肿、胀、痛。一般是单下肢疾病,以左下肢居多。早期的主要表现为患肢肿胀及疼痛。患肢组织张力高,呈非凹陷性水肿,皮色发红,皮温较健侧高。当下肢深静脉血栓严重时,会出现肢体坏死,甚至发生肺栓塞导致死亡。深静脉血栓形成的治疗方法主要为抗凝、溶栓和介入手术治疗。一旦怀疑发生深静脉血栓,应该及时到医院就诊。介入导管溶栓可以减少深静脉血栓后遗症的发生。下腔静脉滤器的使用,可以预防肺栓塞的发生率,明显提高了治疗的安全性。如何预防深静脉血栓形成呢?1.避免长久的坐立不动,有意识地活动下肢,做下蹲等动作,加快下肢血液流动。2.长期卧床者,可经常按摩下肢促进血液循环,平时可穿弹力袜。3.平时应多进行走路、游泳、骑脚踏车等较缓和的运动,除能改善循环外,还能降低新的静脉曲张、血栓的发生4.在饮食方面,应多吃高纤、低脂饮食及加强维生素C、E的补充5.在日常生活方面,则应控制体重。6.抽烟会使得血压升高及动、静脉受损,应戒烟。本文系王华医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载。
王华 副主任医师 上海市同济医院 肝胆外科中心7184人已读 - 精选 小手术轻拒脑中风
-颈动脉狭窄的治疗在我国,脑卒中仅次于恶性肿瘤,是老年人三大死亡原因之一。统计资料显示,在脑卒中的病人,约2/3的脑梗塞与颈部动脉狭窄有关,因此颈动脉狭窄可谓是造成脑梗塞的一个潜在的不为人知“杀手”。脑卒中可分为出血性脑卒中和缺血性脑卒中两种。出血性脑卒中主要为大脑内的血管硬化、破裂出血所致。而缺血性脑卒中主要由于颅外或颅内的脑部供应血管出现粥样硬化性斑块或溃疡使其管腔明显狭窄、闭塞,或斑块脱落致血管栓塞的缘故。在我们的临床实践中有不少病人颈动脉彩超检查发现颈动脉严重狭窄,正处于脑卒中高发期,但由于患者对治疗颈动脉狭窄与脑卒中的利害关系缺乏正确的认识,未能及时处理,结果发生了同侧脑卒中,半身瘫痪。一次小小的颈动脉支架植入或内膜切除手术,能把绝大多数脑中风拒之门外,但实际做手术的病人尚不足真正需要做手术者的1%,绝大多数人因此错失预防良机。对脑中风来说,最有效的手段是防患于未然,如果改善颈部的血管堵塞,就能有效地预防脑中风发作。首先对于颈动脉狭窄应当高度重视,要积极控制危险因素,坚持抗血小板治疗。对于严重的颈动脉狭窄应该积极采取介入或手术治疗。 颈动脉支架植入术,是近年来广泛开展的微创治疗方法,创伤小、恢复快,尤其适合于年老体弱、冠心病、糖尿病的患者。 哪些颈动脉狭窄病人适合介入或手术治疗:1.颈动脉狭窄严重,达70%以上2.狭窄为50%至69%有症状的患者3.合并有频繁短暂性脑缺血发作的病人4.颈动脉狭窄已发生脑卒中但恢复较好的病人5.检查发现颈动脉硬化斑块不稳定、易脱落
王华 副主任医师 上海市同济医院 肝胆外科中心3314人已读 - 精选 肝脏储备功能检测
肝脏储备功能检测近年来肝脏外科取得了快速发展,在大的肝脏外科中心肝切除的死亡率小于3%,但各种治疗,特别是手术治疗后,肝功能衰竭仍然是外科治疗后主要的死亡原因。因此,治疗前必须准确评估患者肝脏的储备功能。目前术前肝脏储备功能检测及评估方法主要包括以下四个方面:①常规的肝功能检查,如胆红素、胆汁酸以及凝血酶原的变化等;②一些肝脏功能的半定量检测,如吲哚箐绿试验(indocyanine green,ICG)、利多卡因代谢试验(monoethylglycinexylidide,MEGX)、口服葡萄糖耐量试验和胰高血糖素负荷试验、氨基比林廓清实验、13C一美沙西定呼气试验等;③影像学检测方法,包括肝脏体积的测定、功能性肝脏体积测定评价等;④肝脏功能的其他检测包括门脉压力的测定、肝脏纤维化指数等。一、 肝功能的常规检测常规肝功能检查可对肝脏功能进行初步的评价,主要指标胆红素,肝脏酶类检查,如血清谷草转氨酶(aspartate aminotransferase,AST)、血清谷丙转氨酶(alanine aminotransferase,ALT),其他尚有碱性磷酸酶(alkaline phosphatase,ALP),r-谷氨酰转肽酶(γ-glutamyltransferase,γ- GT),亮氨酸氨基肽酶,5’-核苷酸酶,血清白蛋白和转铁蛋白,血脂和脂蛋白等,均可从不同侧面反映肝脏的功能状态。胆红素 红细胞破坏的终末产物。血清胆红素浓度反映了人体内此种代谢终末产物的生成和排泄之间的平衡,试验室检查包括间接(非结合胆红素,肝脏代谢前的胆红素)和直接(结合胆红素,肝脏代谢后的胆红素)两种胆红素。分别具有不同的含义,如间接胆红素升高可提示溶血或肝细胞的损伤或坏死。直接胆红素提示肝脏胆汁排泄障碍或胆道梗阻。少数遗传性疾病也可出现这两种胆红素特殊的代谢异常,如Gilbert病可表现为先天性非结合型高胆红素血症。肝转氨酶 肝脏疾病时受损肝细胞中酶的释放可导致血清转氨酶升高。转氨酶升高的程度通常反映肝坏死的严重性,除酒精性肝炎外一般很少超过200~300IU/L。碱性磷酸酶活性 人体内多种组织细胞均具有ALP的活性,包括肝、胆管、小肠、骨、肾、胎盘以及白细胞等,因此这些组织的病变均可出现ALP水平的改变,非肝胆系统的疾病如妊娠、正常生长期和骨肿瘤等,以及肝胆系统疾病如肝细胞损害和胆道梗阻等均可出现ALP水平升高。具体而言,ALP活性升高具有三方面的含义,一为酶自身的合成增加;二是酶从胆道的排泄障碍、排泄受阻;其三是细胞损伤时酶的释放增加。肝脏外科临床上上述三种情况均可出现,但以肝外胆道梗阻时ALP升高最为明显,其次肝内胆汁郁积以及肝肿瘤等情况也可出现ALP酶的表达异常。研究发现ALP升高的程度可一定程度上预示肝脏疾病或转移病变的严重性。大多数情况下,ALP升高都有明显的原因;但如升高原因不明时,可用电泳等方法检查肝功能中相关酶类,特别是其同种异构酶的变化,以进行鉴别诊断。临床上最常用的方法是同时检测5-核苷酸酶、亮氨酸氨基肽酶以及GGT的活性。这些酶与ALP同时升高时,常提示肝脏疾病的存在。白蛋白 血清白蛋白是评价肝脏合成功能的重要指标。虽然白蛋白的代谢机制至目前为止仍不十分清楚,但在人体中白蛋白仅在肝脏合成,因而其水平的高低可一定程度上反映肝脏蛋白的合成功能。研究发现多种因素可以影响白蛋白水平的高低,临床上用白蛋白对肝脏功能进行分析判断时,需要除外肝脏以外影响因素的作用,如患者营养状态、甲状腺激素或肾上腺皮质类固醇水平的高低、以及某些疾病所致的白蛋白排出过多的情况,如烧伤、败血症、肾病综合症、蛋白丢失性肠病等白蛋白大量丢失的情况。在排除其他上述特殊因素后,血清白蛋白浓度是评价肝脏合成功能变化的较客观指标。由于白蛋白正常合成速率为110~200mg/kg/天,半衰期较长,故白蛋白浓度仅能反映出肝功能的慢性变化过程。血清前白蛋白(pre-albumin,PA) 同白蛋白一样,PA是肝脏合成的一种糖蛋白,属于血清快速转化蛋白,在肝脏的合成率为99%。由于其半衰期短(约1.9天),故能较白蛋白(Alb)更为敏感地反映肝脏炎症及患者肝功能损害的情况,与其他指标如总胆红素相结合,可用于肝脏功能评估及指导治疗。转铁蛋白 在肝脏合成,其半衰期较白蛋白短,故测定血清转铁蛋白,能够反映肝功能亚急性变化的情况。此外,在急性或慢性肝病时脂类和脂蛋白电泳也有改变,主要是由于合成异常所致,有关此类型蛋白的测定方法虽有很多研究,但迄今未在临床广泛应用。 γ-球蛋白 由单核-吞噬系统合成,主要组成成分包括免疫球蛋白(IgG、IgA 和IgM),和C反应蛋白。肝功能损害时往往导致血清白蛋白降低,而由肝外合成的球蛋白增高,尤其是γ-球蛋白。在免疫性疾病时,γ-球蛋白可显著升高,但对肝硬化病人,除外自身免疫性疾病后,γ-球蛋白升高可认为是肝硬化程度或肝功损伤的重要预测指标[2]。认为术前γ-球蛋白>26%,术后发生肝功能衰竭的可能性明显增高。凝血试验 凝血酶元时间可用于肝功能衰竭的判断。凝血酶原时间延长不仅提示缺少凝血酶复合物,而且提示缺少凝血因子IX和XII。对于单个凝血因子检测,如凝血因子V的浓度低于10%,说明肝功能损害严重,预后不良。此外凝血因子VIII与V的比值也具有一定的参考意义二、 肝脏功能的半定量检测除了肝脏的常规功能检测外,一些肝脏的半定量功能检测也可从不同程度反映肝脏的功能。其中ICG和MEGX在临床研究较多,日本、香港、欧美等国家将它们与总胆红素或肝脏残余体积测定结合,用于临床上肝脏功能评估及治疗的选择。1. 吲哚箐绿试验 (indocyanine green,ICG) ICG静脉注入后可选择性地被肝细胞摄取,再逐步排人胆汁中,ICG不从肾排泄,也不参加肠肝循环,因而检测ICG的吸收和排泄情况可以反映肝脏的储备功能。一般正常人静脉注射ICG 15分钟后97%从血中消失,通常以15分钟血中ICG潴留率(ICGR15)或ICG最大清除率(ICGR max)作为衡量肝储备功能的指标,也有研究以ICG血浆消失率作为衡量指标。ICG排泄试验能够客观地反映肝脏吸收及排泄功能,对外科术式的选择、手术时机的确定有一定的作用。有人将ICG与总胆红素结合用于肝脏手术治疗的选择,认为在胆红素正常情况下,ICGR15<10%可行右半肝、扩大右半肝或左三叶切除,ICGR15在10%~19%可耐受左半肝切除,ICGR15在20%~29%可行段切除,ICGR15在30%~39%可考虑行肿瘤局部切除术,在ICGR15>40%则只能行“肿瘤挖除术”。在肝癌合并门静脉高压手术治疗选择方面,当ICGR15<20%,肝脏体积代偿良好者可实施肝切除+门奇断流联合手术;而当ICGR15>20%,实施联合手术前应充分准备,加强肝脏对手术的耐受性;而当ICGR15>25%,特别是肝硬化致肝脏明显缩小者,不宜施行联合术。此外ICG检测目前尚有一些局限性,其原因一是目前ICG的检测标准范围并不一致,其二是术后发生肝功能衰竭病人的ICGR15波动范围较大,而ICG本身只是对肝脏吸收排泄功能的反映,多因素分析显示ICG也不是病人术后肝功能衰竭的相关因素。因此, ICG在肝脏功能评估中的确切作用还有待深入研究。2. 利多卡因代谢试验 利多卡因经细胞色素P-450系统的氧化去甲基化作用后,可生成单乙基甘氨酰二甲苯胺(Monoethylglycinexylidide, MEGX),最终得以清除。静脉注射利多卡因15分钟后测定MEGX清除量,可定量评定肝脏的功能。此方法临床上常应用于肝移植供体和受体肝功能的监测等过程。利多卡因清除率受下列三个因素影响,包括有活力的肝细胞数、肝细胞色素P450酶的活力以及肝血流量。Ercolani等在200例患不同肝脏疾病的患者及23名器官捐赠者中进行MEGX试验,结果显示当MEGX<25 ng/ml时,患者在肝切除术后易发生肝功能不全,而当MEGX<10 ng/ml时,肝硬化患者的平均寿命不超过1年。Ravaioli等也认为术前MEGX值低于25 ng/ml,与肝切除术后肝功能不全及术后并发症有关。此外也有研究发现残余肝脏体积与MEGX的存在一定的相关性,可用术前及术后MEGX的变化来反映肝脏残余体积的变化,进而对术后肝功能进行评估。3. 氨基比林呼吸试验 (aminopyrine breath test,ABT) 体内代谢时氨基比林在肝脏细胞色素P450酶的催化下,去除N位上的两个甲基,最终生成氨基安替比林,代谢去除甲基最终生成二氧化碳。口服同位素14C标记的氨基比林后,间隔2小时收集呼出的CO2样本,通过检测呼出气中CO2可反映肝脏细胞色素P450酶的功能。此试验反映肝脏内微粒体的功能,即有活力肝脏组织的功能,可较敏感地反映肝细胞的代谢功能,准确反映肝细胞的炎症、坏死及纤维化情况,可用于患者判断预后。肝硬化患者ABT值明显降低,若与临床生化指标、Child-Pugh分级相结合,可用于肝衰竭诊断。肝炎后肝硬化患者的ABT值与Child-Pugh分级显著相关,可一定程度上反映肝脏的功能储备并用于病人预后判断。Wojcicki等认为ABT在肝硬化分期方面的敏感性要高于利多卡因代谢试验。监测门静脉分流术患者ABT的结果显示,术后存活一年以上者的ABT值显著高于一年内死亡者。而每日监测肝移植患者的ABT,能较其他肝功能检查更好地预测急性排斥反应。但将ABT作为反映肝脏储备能力的手段也存在其局限性。细胞色素P450可受许多内外因素诱导活化或抑制,如吸烟、药物等,间接影响ABT结果。4.口服葡萄糖耐量试验(oral glucose tolerance test) 肝病患者易发生糖耐量异常,其原因可能是 ①肝细胞破坏,胰岛素受体数减少;②糖原合成酶、葡萄糖激酶等活性下降,葡萄糖利用障碍;③外周组织对胰岛素不敏感。通过葡萄糖耐量试验曲线图型可以反映肝细胞线粒体能量代谢的状态和糖原合成的能力。有研究也将其用于肝切除术后风险的评测,如葡萄糖耐量试验曲线呈P型患者,可行肝切除术,术后恢复顺利;而曲线呈L型者,则对手术的耐受性差,术后易发生肝功能衰竭。5. 胰高血糖素负荷试验(glucagon loading test,GI ) 肝脏是胰高血糖素作用的主要靶器官,胰高血糖素通过刺激肝细胞中cAMP的合成来调节糖、脂肪及蛋白质的代谢。通过测定胰高血糖素刺激后血中cAMP的浓度变化,可以间接反映肝脏功能的状况。如肝硬化患者在胰高血糖素负荷后,血糖调节能力明显减弱,血糖峰值浓度与基础浓度之差,可反映与肝硬化患者的肝功能状况。6. 14C一美沙西定呼气试验 14C一美沙西定口服吸收人血后,在肝细胞滑面内质网(微粒体)内可由加单氧酶系即细胞色素P450、尼克酰胺腺嘌呤二核苷酸磷酸、细胞色素P450还原酶对其进行O位脱甲基反应,产生甲醛,后者继续氧化为14C02经肺排出体外,最后由Breath—Mat呼气质谱仪检测。14CO2排出的速率和量,即能反映肝细胞加单氧酶系的活力。加单氧酶系是微粒体内最主要的生物氧化酶系,肝脏的生物转化功能主要在肝细胞微粒体内完成,所以通过14C一美沙西定肝功能呼气试验可检测加单氧酶系的氧化功能,反映相关的肝细胞器内质网的结构、数量及功能,进而体现了肝细胞的存活状况。有人利用Breath-Mat呼气质谱仪对正常人和肝硬化患者进行了测定,证实该试验能即时反映肝细胞储备及代偿情况,且得到的结果为完全量化的数据,为临床肝脏部分切除患者围手术期肝功能的评价提供了量化的数据指标。三、影像学检查对肝脏储备功能评价1.肝脏体积测定 研究发现肝脏体积与患者肝硬化程度有一定相关性。CT测量发现肝硬化患者肝脏体积随着肝脏硬化程度增高而逐渐减少,Child A、B、C三组平均肝脏体积分别为(1092±276)cm2、(868±162) cm2、(652±76) cm2 (P<0.001)[8]。而外科临床研究发现肝最小剩余体积与肝储备功能相关。肝储备功能好时,即使剩余体积小,也不会发生肝衰竭,反之,即使保留了更多的肝脏,也发生肝衰竭可能。因此准确地评估肝脏剩余体积就是术前准确估计肝储备功能的问题。正常人可切除70%的肝脏,而肝硬化者一般不能超过50%的肝脏体积。因此术前肝脏残余体积测定有助于指导外科手术治疗选择。特别是有研究将肝脏体积和Child分级结合评估,进行外科手术治疗的选择。多项研究认为当无肝硬化患者肝脏残余体积≤25%,而伴有肝硬化患者肝脏残余体积≤40%时,患者术后严重并发症明显增加。Shirabe发现所有死于术后肝衰竭患者的肝剩余肝体积均<250ml/m2。剩余肝体积< 250ml/m2者术后肝衰发生率为38%,而>250ml/m2者肝衰发生率为0。也有作者联合Child-Pugh分级、ICG清除率以及肝脏体积测量等指标,用于原发性肝癌肝切除的指导,但肝脏残余体积多少为安全线,仍然有争议,需通过进一步研究加以认识。2.功能性肝脏体积测定 去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)是一种存在于人和哺乳动物肝细胞表面的特异性受体。用锝标记的去唾液酸糖蛋白半乳糖化人血清白蛋白(technetium galactosyl human serum albumin,99m Te-GSA)可识别ASGPR,作为ASGPR的配体,可用单光子发射计算机断层成像技术(single photon emission computed tomography, SPECT)扫描测定,以反映功能性肝脏体积。研究发现该技术对于手术前的风险评估和预测术后并发症比肝体积测定更有意义。Kokudo等研究了111名肝脏切除术病人的Child-Pugh评分、ASGPR血液廓清率、ASGPR肝脏15 min摄取率、ICGR15、ASGPR浓度、全肝ASGPR量、肝实质体积、切除实质分数、术中出血量、残余肝脏ASGPR量等指标,发现仅残余肝ASGPR量在预测术后肝功能衰竭方面具有相关性,当它低于0.05mmol/L时术后肝功能衰竭发病率为100%四 肝脏储备功能的其他检测方法除上述检测方法在临床应用外,还有多种肝储备功能分析方法曾在临床上试用,如磺溴酞钠排泄试验、动脉血酮体比例检测、半乳糖廓清试验等,但以上方法由于种种原因(如经济性或操作的简便性等)均未能在临床上得到广泛应用。而对肝功能的准确评估目前依然成为临床上研究的热点和难点,特别是肝癌患者绝大多数伴有肝硬化,术前对于肝硬化肝脏的功能评估,目前仍然没有一个十分理想的方法。除了前述检测ICG进行手术风险评估外,欧洲研究者对门静脉压力测定以及肝纤维化的无创测定研究较多,认为可能在肝硬化肝脏功能评估上也起一定作用。(一)、门静脉压力测定 Bruix 最早检测了肝硬化患者的门脉压力变化情况,认为门脉压力可一定程度反映肝脏纤维化和肝实质损害的程度。根据门脉压力的高低可以指导临床上手术治疗的选择。他们认为术前测定肝静脉契压或者肝静脉压力梯度,可以反映肝脏门脉压力的情况,证实当肝静脉压力梯度(hepatic venous pressure gradient, HVPG)≥10 mmHg,时,患者行肝切除术后发生不可逆性肝功能失代偿的机会明显升高。为此欧洲肝癌研究协会制定的BCLC分期中,将门脉压力的测定作为治肝癌治疗选择的重要依据 (二)、肝纤维化的评估 肝脏手术后肝功能衰竭的发生与肝脏肝炎的活动以及纤维化程度密切相关。已有研究证实二者与术后肝功能衰竭的发生密切相关。肝脏炎症以及肝纤维化程度仍难以用较为客观的指标来衡量。转氨酶等现有的肝功指标的变化并不能完全反映肝脏的炎症状况和肝脏本身的纤维化程度。有研究用肝脏的组织学炎症分级来预测术后肝功能衰竭发生的可能,但术前要获取非肿瘤性的肝脏组织较为困难。近期有研究报道一些指标既能反映肝脏肝炎活动程度,又能反映肝脏纤维化程度,因而可能对术后肝功能衰竭发生有较好的预测性。如血清中的IV型7s胶原(7s collagen),其在血中浓度的升高,与术后肝性脑病、不可逆性胸腹水发生密切相关。而当7s collagen≥12 ng/mL时,所有病人都死于术后肝功能衰竭。而也有研究将常规血清学检查组合形成纤维化指数用于肝纤维化的无创评估。自2001年以来,在国际一流杂志上发表的肝脏纤维化诊断模式超过9种,如Fibrotest、Forns指数、纤维化可能性指数、欧洲肝纤维化模型、上海肝纤维化组模型。这些模型中涉及的多数参数是目前实验室常用血液学检测指标,联合应用对于HBV、HCV感染后肝纤维化(肝硬化)的诊断有一定的临床应用价值。其无创特性备受关注,但这种指数与纤维化程度的相关性,与肝功能的储备的相关性,以及是否可用于肝癌手术后风险的预测需要进一步探讨研究。
翟健 副主任医师 海军军医大学第三附属医院 放射介入科2.1万人已读 - 什么是门静脉栓塞(PVE)?
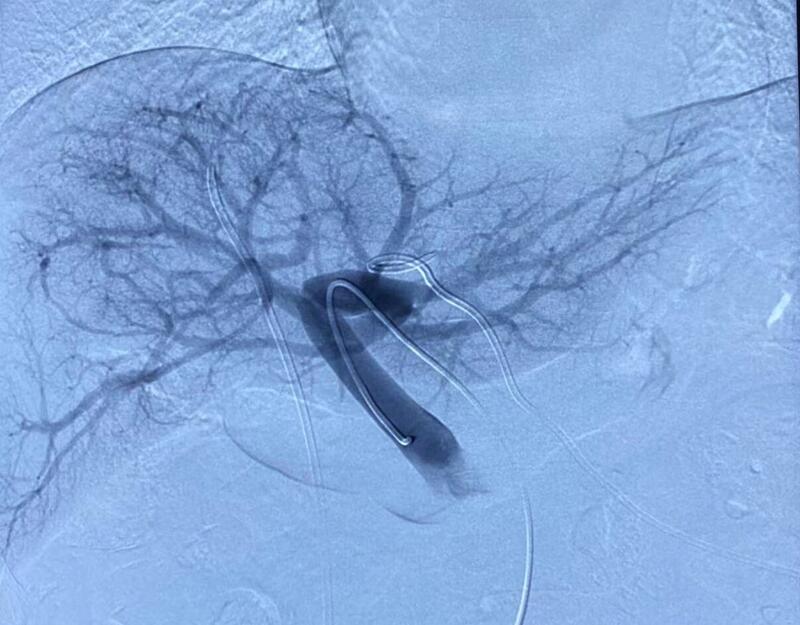
随着肝胆外科手术设备的不断进步及外科手术技巧的提高,行肝部分切除患者的围手术期越来越安全。而扩大肝切除的患者仍然具有较高的并发症发生率,患者恢复缓慢,风险较大。尤其对于巨块型肝癌及肝门部胆管癌,根治术后往往剩余的肝偏小,发生肝功能衰竭的风险较高,甚至可能会导致患者死亡。日本的幕内雅敏(Makuuchi)教授是现代肝脏外科的发展史上享誉世界的肝脏外科手术医生。1984年幕内雅敏(Makuuchi)教授首次将门静脉栓塞(Portalveinembolization,PVE)用于肝门胆管癌以来,在日本和欧美已被应用于转移性肝癌、肝细胞癌和胆道肿瘤。美国的麦道夫教授是世界著名门静脉栓塞术式(PVE)专家,来自世界首屈一指的癌症科研与治疗中心——MDAnderson癌症中心,他改进并发明了新的门静脉栓塞术式,使其风险大幅降低,成功率大幅提高。麦道夫教授在世界范围内累计门静脉栓塞总量第一,他领导的团队所行门静脉栓塞术后肝癌切除手术率高达92%,其结果使得肝癌病人的手术率大幅提高了50%;并使得手术质量的多个方面获得改善。麦道夫教授指出在中国,肝癌术前门静脉栓塞术可使多达3-4万因肝量不足失去根治性手术治疗机会的肝癌病人得到手术治疗的机会,这等同于给与这些病人长期生存甚至完全治愈的机会。近年来,因PVE能有效诱导剩余肝体积(futureliverremnant,FLR)的体积増大和功能增强,PVE术广泛用于外科肝肿瘤的肝切除术前,以扩大手术适应证、减少术后肝功能衰竭、感染、出血的发生。PVE作为一种术前辅助性治庁可以使剩余肝体积增大,可增加肝门胆管癌,转移性肝癌和肝细胞癌手术切除的安全性。PVE是一种介入微创手术。PVE术的4个主要目的:1)扩大外科手术适应证;2)防止肿瘤沿门静脉播散;3)防止门静脉瘤栓形成;4)配合动脉灌注使肿瘤完全坏死;哪些患者可行PVE?2010年肝癌治疗准则会议(AHPBA/SSAT)建议肝功能正常者,FLR<20%;合并脂肪肝、接受化疗患者FLR<30%;代偿性肝硬化,FLR<40%可考虑PVE。PVE的原理:1、血流增加。门静脉栓塞后,门静脉血流重新分布,完全流入未栓寒侧,文献报道未栓塞侧门静脉血流速度明显增快,后逐渐减慢,术后14d流速仍显著高于基线,且肝脏增生速度与血流流速呈正相关。2、促肝细胞生长物质由门脉提供。PVE术常用的常用的栓塞剂有α-氰基丙烯酸正丁酯胶((N-butyla-cyanoacrylate,NBCA)、明胶海绵、金属圈、PVA微粒等。2014年11月至2019年12月,海军军医大学第三附属医院共126例因FLR不足导致无法切除的肝细胞癌(HCC)或肝内胆管癌(ICC)病人,采用α-氰基丙烯酸正丁酯胶((N-butyla-cyanoacrylate,NBCA)、微球、明胶海绵作为栓塞材料的PVE组.最终结果显示,采用NBCA及微球作为栓塞材料的PVE导致FLR增长速率低于ALPPS,两种栓塞材料的PVE二期手术切除率相当.使用NBCA作为栓塞材料的PVE其FLR增长速率高于微球,且这两种栓塞材料的栓塞效果均优于明胶海绵.(肝门部胆管癌合并黄疸患者,行PTCD治疗后)PVE手术经过(图1-图3):局麻,在超声引导下,用18GEV针穿刺门静脉左侧分支,置入单弯导管,于门静脉主干内造影显示门静脉全貌(图1)。单弯导管超选至右侧门脉主干内,为了栓塞的更彻底,应尽量将微导管超选择性进入到门脉右侧分支的最末端,以NBCA胶进行彻底栓塞(图2),栓塞满意后,将单弯导管至于门静脉主干内复查造影,显示栓塞良好(图3)。栓塞结束后,为了降低术后出血的风险和防止误栓塞左侧门静脉,我们将单弯导管头端回撤至肝实质内,手术后第二天分三次逐步拔除造影导管。除非门静脉受累或癌栓形成,临床上很少看到由于门静脉血流增加导致的增生,所以理论上患者均有进行扩大肝切除的可能,那么门静脉栓塞(PVE)就没有绝对的禁忌证。只有相对禁忌证:(1)残余肝、肝外脏器或门静脉周围淋巴结转移;(2)难以纠正的凝血障碍;(3)肿瘤累及到门静脉主干;(4)肝内多发转移灶;(5)存在门静脉血流增加导致的肝增生;门静脉栓塞(PVE)的术后并发症比较少见,主要有:肝包膜下出血、腹腔出血、胆道出血、假性动脉瘤、动静脉漏、动脉门静脉分流等。
 徐伟 副主任医师 上海市东方医院 微创介入治疗中心3574人已读
徐伟 副主任医师 上海市东方医院 微创介入治疗中心3574人已读 - 什么是肝活检?
肝穿刺活检自1883年由德国医师开始最先开始在临床使用,至今已有130多年的历史。肝穿刺活体组织检查术(Liverbiopsy)简称肝活检,是采取肝组织标本的一种简易手段(图1)。由穿刺所得组织块进行组织学检查制成涂片做细胞学检查,经过处理后作病理组织学、免疫组化等染色,在显微镜下观察肝脏组织和细胞形态。现在肝穿刺最常用的方法是超声引导下经皮肝穿刺活检,但有凝血功能障碍及腹水者不适合,这类患者可选择经颈静脉肝活检。在检查过程中,通常只需要进行局部麻醉。超声引导下可直视患者的肝脏部位,有效避开重要血管和其他脏器并准确定位病灶。超声定位后的整个穿刺过程只需要几分钟。肝组织活检的穿刺方法有多种,如一般肝穿刺术、套管针穿刺术、分叶针切取术、快速肝穿刺术等。这些方法各有优缺点,前三种较易造成肝损伤或出血;后者属抽吸式活检针,较安全,多为临床所采用。肝病患者经过病史询问和体格检查,或者在辅以必要实验室和影像学检查,就可确诊。临床诊断疾病往往有一定的偏差,只有病理诊断才更确实可靠。有些不能通过以上检查明确诊断疾病,只有通过肝穿刺活检,进行病理学检查才能准确下结论,为后续的精准治疗提供依据。肝穿刺病理学检查主要用于各种肝脏疾病的鉴别诊断,如鉴别黄疸的性质和产生的原因,了解肝脏病变的程度和活动性,提供各型病毒性肝炎的病原学诊断依据,发现早期、静止期或尚在代偿期的肝硬化,判别临床疗效,尤其在确定肝纤维化严重程度上是国际公认的“金标准”。有些疾病诊断起来有困难,需要肝活检与临床症状相结合,才能作出诊断,如自身免疫性肝炎、慢性肝炎、原发性胆汁肝硬化及肝脏肿瘤等。肝穿刺有无危险,这是许多患者所关心和怀疑的一个问题。任何操作都有风险,肝穿刺也不例外,可能穿刺失败或发生疼痛、出血、恶性肿瘤针道转移等并发症。肝穿刺后出血的发生率在十万分之一左右,由于肝活检技术已经很成熟,只要掌握好适应症、禁忌症,在肝穿刺前做好充分的准备,肝穿刺活检的操作可做到万无一失。近年来多采用Menshini法一秒钟肝穿刺,少数患者于肝穿后除育穿刺点轻微疼痛及肩痛外无任何不适亦不遗留其它并发症。肝穿刺均是很成熟的技术。肝穿刺活检时取的肝组织很少,约为直径1mm、不到20mm长的一小条,约相当于肝脏的五百万分之一。肝穿刺是在超声引导下进行的,可以可避开大的血管等,相对来说是非常安全的。肝穿刺后建议卧床休息24小时,术后4小时内每隔15-30分钟测脉搏、血压一次,出现脉搏增快细弱、烦躁不安、血压下降、面色苍白、出冷汗以及内出血现象时,应赶快进行紧急处理,谨防大出血导致失血性休克等严重并发症。并发症的发生与肝穿前的准备,穿刺后的护理皆有关。因此,必须严密作好肝穿前的各项检查工作,严防肝穿后并发症的发生应列为首要。哪些患者需要做肝穿刺?1.原因不明的肝脾肿大或肝功能异常;2.原因不明的黄疸且已排除肝外胆道梗阻者;3.慢性肝炎随访病情或判断疗效,特别是对于乙肝的患者,肝组织病理是判断是否需抗病毒治疗的重要依据;4.疑有弥漫性肝病或肝外疾病累及肝脏者。5.观察治疗效果及判断预后:观察药物治疗后的病理改变情况,以进一步确定其疗效。也可根据肝脏病理改变判断患者的预后。6.确定肿瘤的来源:通过肝穿刺来判断肝癌是原发的还是继发的;是肝细胞性还是胆管细胞性。结合肿瘤基因检测等检查有助于评估是否用药敏感,可以更有效地实现对患者的“个体化”治疗。7.肝移植术后肝功能的评估等。哪些患者不适合做肝穿刺?⒈用临床常规检查方法已可达到目的者。2.有出血倾向的患者。如血友病、海绵状肝血管病、凝血时间延长、血小板减少达80×10的9次方/L以下者。⒊大量腹水或重度黄疸者。⒋严重贫血或一般情况差者。⒌肝昏迷者。⒍严重肝外阻塞性黄疸伴胆囊肿大者。⒎疑为肝包虫病或肝血管瘤者。8.严重心、肺、肾疾病或其功能衰竭者。9.9.右侧脓胸、膈下脓肿、胸腔积液或其他脏器有急性疾患者,穿刺处局部感染者。10.10.严重高血压(收缩压>24KPa)者。11.不能配合的病者。
 徐伟 副主任医师 上海市东方医院 微创介入治疗中心1093人已读
徐伟 副主任医师 上海市东方医院 微创介入治疗中心1093人已读 - 经皮肝穿刺胆道引流术(PTCD)治疗后最危险的“敌人”-胆道出血及腹腔出血
伴随着胆道外科诊断技术的发展,经皮肝穿刺胆管引流(PTCD)广泛用于梗阻性黄疸等疾病的诊治,这使得医源性胆道出血成为胆道出血首要原因。因此,必须对胆道手术围手术期处理及手术后的严重并发症的防治应给予足够的重视。下面仅对胆道PTCD术后出现胆道出血及腹腔出血的几种常见原因作以下分析。胆道出血是消化道出血的常见原因之一,在发生率上次于溃疡病、门脉高压和急性胃粘膜糜烂,居第四位。近些年,胆道出血在病因、诊断和治疗方法上都发生了重要变化,其死亡率已下降到20%左右。伴随开展胆道PTCD手术的医院逐渐增加,PTCD手术中胆道损伤的机会也就增加,少量胆道及腹腔出血的临床症状往往不明显,它们像是伪装的很好的“刺客”,时刻准备着伤害患者的健康。少量出血时,有的患者仅有少量黑便及腹痛不适。大量胆道出血及腹腔出血往往来势凶猛,他们就像洪水猛兽,凶险无比,有时候会直接危及患者的生命。 PTCD后胆道出血主要原因是坚硬的穿刺针(EV针等)盲目刺入肝实质后,有可能贯穿肝内胆管、肝动脉、门静脉或肝静脉分支,一般拔针后破口被肝实质封闭自行闭合。但如破口较大或上述管道内压高可形成血管胆管内瘘或引起肝内假性动脉瘤破入胆管引起胆道出血。肝脏及胆道恶性肿瘤侵及周围的血管和胆道、胆管内癌栓破裂出血、PTCD引流管打折和脱出、PTCD内引流管长期摩擦胆肠吻合口也是PTCD术后胆道出血的常见原因。 1.PTCD术后胆道出血的治疗 1.1常规治疗方法(1)如出血量较少,病人一般情况尚可,在发生PTCD管引流后胆道出血,可采用直接注入止血药物和暂时夹闭PTCD引流管。(2)术后注意止血药物以及抗生素、输液等的应用,严重贫血时可给与输血治疗。(3)出血停止后,建议透视下观察PTCD管的位置,必要时可行PTCD造影检查。如有PTCD管移位、打折及打结等异常情况,建议给与及时处理。PTCD内引流管长期摩擦胆肠吻合口而导致胆道出血,可考虑更换为PTCD外引流管或放置胆道支架。(4)针对胆道外科手术后行PTCD治疗的患者,建议请胆道外科专家会诊,可结合手术的具体情况给出相应的处理意见。 1.2急诊栓塞疗法(肝动脉栓塞)急诊肝动脉栓塞术为治疗胆道出血的一种最有效手段。国内大部分医院已将其列为治疗胆道大出血的首选方法。优点:(1)出血定位准确。(2)方法简单,免去外科手术的创伤和危险性,尤其多次手术者,剖腹探查更是难事。(3)栓塞后即可得到可靠的止血。 1.3手术治疗经以上治疗止血无效,即可采取外科手术治疗→肝动脉结扎或肝叶切除术或肝包膜修复术。肝动脉结扎适用以下情况:(1)肝内出血部位不明。(2)肝内胆管出血,来自多个胆管。(3)出血量大,可能来自动脉。(4)病变部位不适或难行肝叶切除术。PTCD术后腹腔出血较少见,发生的常见原因是坚硬的穿刺针(EV针等)、导管鞘及超硬导丝等装置损伤肝包膜及肝实质内的动脉,甚至损伤膈动脉、肋间动脉等血管。 PTCD术后腹腔出血的处理原则与PTCD术后胆道出血的治疗原则基本相同。PTCD术后胆道出血及腹腔出血的预防措施:PTCD术前应详细分析患者的影像资料,了解胆道及血管的走形和分布,做PTCD治疗前建议患者做MRCP等检查,必要时需要做胆道三维可视化重建。严格把握穿刺指征,做好术前准备,进行PTCD前确定PT时间,尽量要求在正常值70%以上。PTCD术中尽量采用超声及DSA双重引导,单纯超声下引导更容易损伤周围正常组织。 PTCD术后胆道出血急腹腔出血的处理,方法必需根据病人的病情和临床表现而具体分析,认真分析出现胆道出血的原因,明确出血部位之后作出相应的治疗方案,才能达到最佳的止血效果。
徐伟 副主任医师 上海市东方医院 微创介入治疗中心2812人已读 - 图文文章 胰腺癌术后出血的急诊介入止血
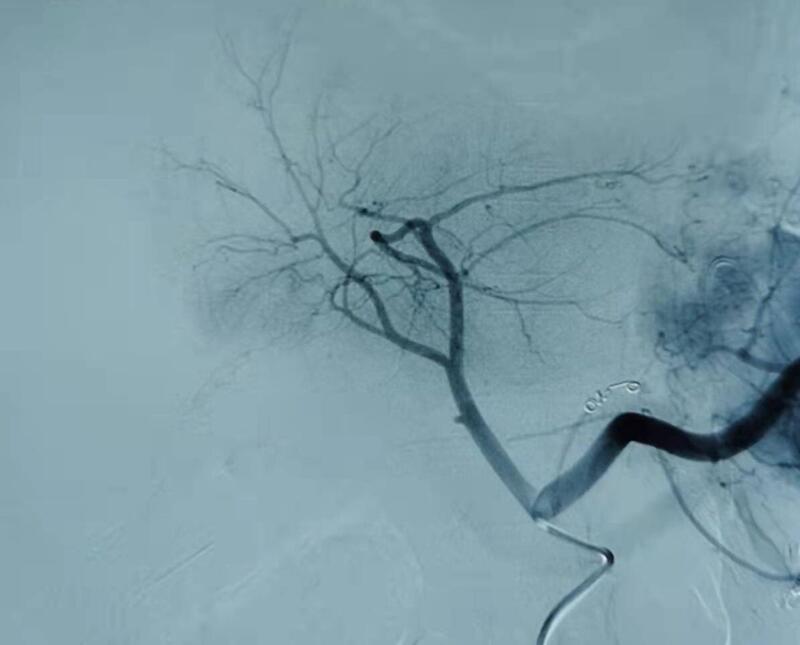
39岁女患者因胰十二指肠切除后一周消化道出血行内镜下检查,未见活动性出血,改行急诊DSA造影也未见出血点,依外科专家意见行胃左动脉栓塞试止血。 术后介入后出血暂停,6天后即昨晚再发消化道出血,T管内有出血,第二次急诊行DSA造影。 腹腔干、脾动脉和肠系膜上动脉造影未见出血。外科医生根据术中情况和临床表现,建议肠系膜上动脉根部的一支胰腺小动脉超选插管造影见造影剂明显外渗,遂给予钢圈栓塞止血。介入手术顺利,病人安返。术后一个月随诊,患者无再次出血! 感想 1.对一次DSA造影和栓塞止血失败者,根据病情变化,必要时应多次重复行DSA造影; 2.外科主刀医生积极现场参与急诊介入止血的意义十分重大。
 徐伟 副主任医师 上海市东方医院 微创介入治疗中心119人已读
徐伟 副主任医师 上海市东方医院 微创介入治疗中心119人已读



