西安儿童医院肿瘤(血管瘤)介入中心科普号
- 精选 血管瘤局部注射过程
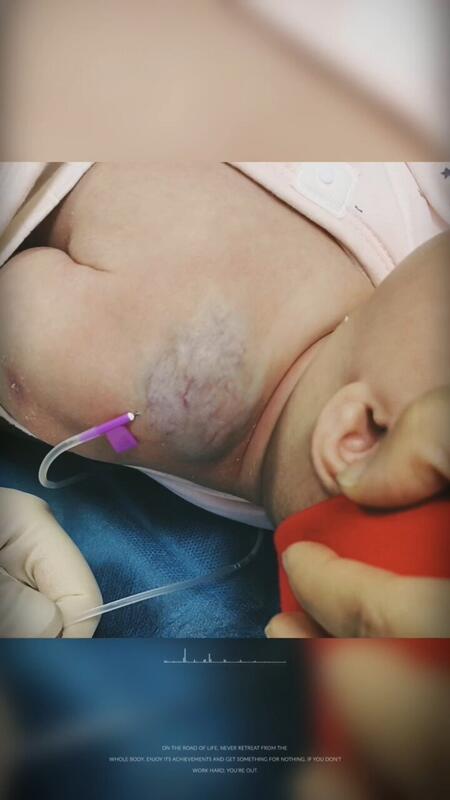 何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心110人已观看
何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心110人已观看 - 精选 普萘洛尔是治疗血管瘤的一线药物,目前存在片剂与口服液两种剂型,有什么区别呢
 何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心97人已观看
何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心97人已观看 - 精选 当血管瘤遇上肺炎/流感该怎么办??
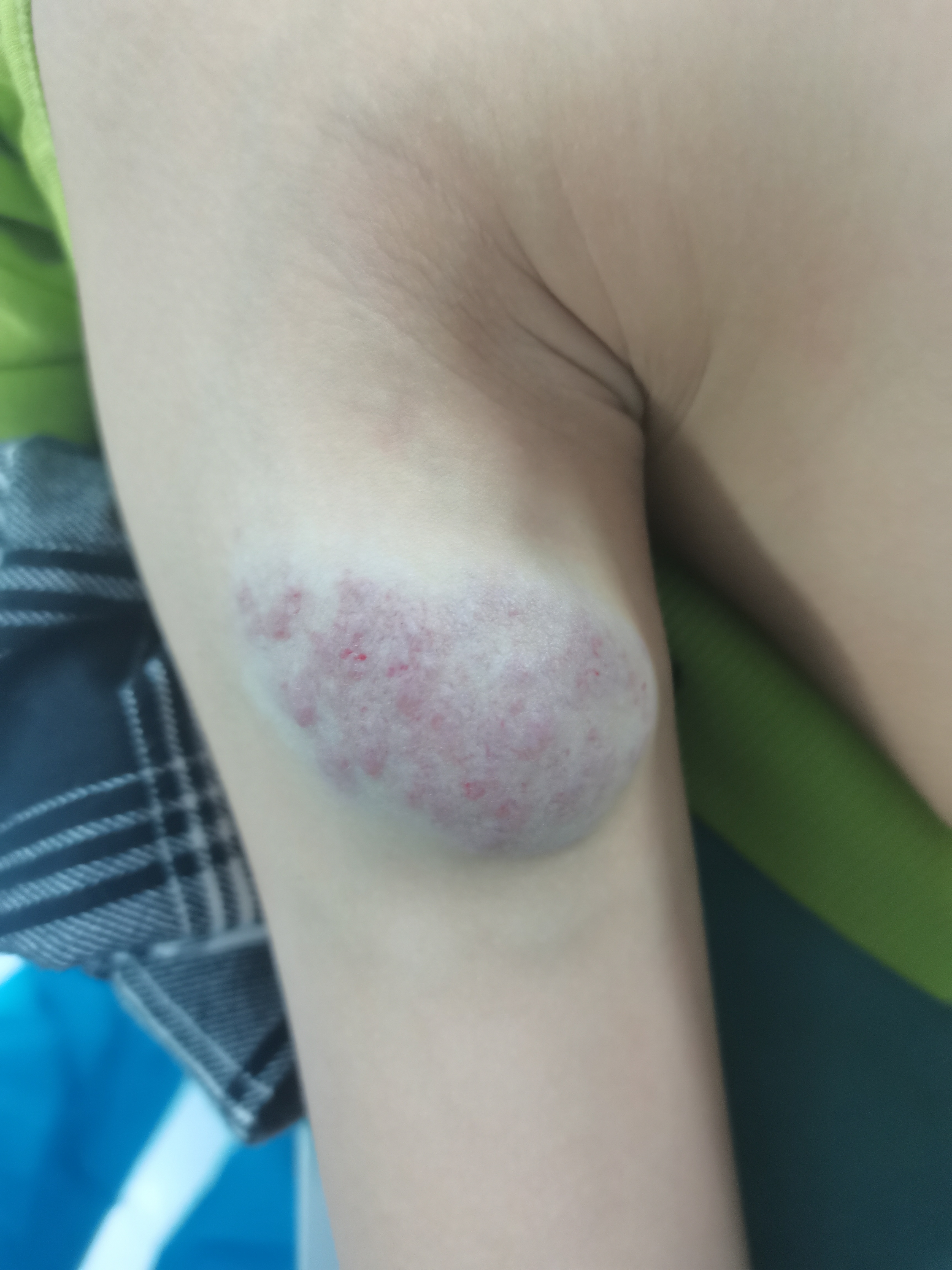
 何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心76人已观看
何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心76人已观看 - 精选 给血管瘤宝宝年轻父母的一份信
尊敬的年轻父母们,您们好!我是您的血管瘤专科医生陈晓峰,专门研究和治疗儿童血管瘤和脉管畸形。今天,我想和您们分享一些关于婴幼儿血管瘤的基本知识,希望能帮助您们更好地理解和应对。首先,婴幼儿血管瘤是一种常见的良性肿瘤,通常在婴儿出生时或出生后不久出现。它们通常表现为皮肤上的红色、蓝色或紫色斑块,或者在皮肤下摸得到的软块。血管瘤可以是平坦的,也可以是凸起的。关于治疗,我们首先会根据血管瘤的大小、位置和类型来制定治疗方案。对于大多数血管瘤,我们通常会采取观察和等待的态度,因为很多血管瘤在婴儿出生后的几年内会自然消退。然而,对于那些较大的、头颈部的、可能影响婴儿生活的血管瘤,我们可能会采取药物治疗或微创介入手术治疗。药物治疗通常包括外敷或口服药物和局部注射药物。外敷药物通常用于表浅的血管瘤,口服药物通常用于治疗较大的血管瘤或那些长在眼睛、鼻子等重要部位的血管瘤,而局部注射药物则用于治疗较深的血管瘤。手术切除主要针对那些不能消退的血管瘤在治疗过程中,我们会与您紧密合作,确保您和您的宝宝都能得到最好的照顾。我们也会定期进行随访,以确保您的宝宝在恢复过程中一切顺利。最后,我想告诉您们,婴幼儿血管瘤虽然可能让人担忧,但只要我们积极面对,正确治疗,它并不会对宝宝的健康产生太大影响。如果您有任何疑问或担忧,请随时联系我。我期待与您们共同面对这个挑战。
 陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心133人已读
陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心133人已读 - 精选 法瓦病(FAVA)
治疗前 患儿女,3岁,右小腿疼痛,肌肉萎缩,跟腱挛缩跛行6月,曾就诊于神经内科,骨科,儿科,康复科多次诊断不清,症状逐渐加重,出现痛觉过敏(VAS 10分),跟腱挛缩,严重影响生活。结合病史及检查考虑FAVA(法瓦病) 治疗中 术中DSA造影提示腓肠肌畸形血管团,手术切除腓肠肌外侧头,充分显露周围神经,血管,可见神经被病变包裹,大体标本可见肌肉脂肪纤维化 治疗后 治疗后1月 疼痛完全消失(VAS,0分),肌肉萎缩/跟腱挛缩逐渐恢复,患儿可正常生活
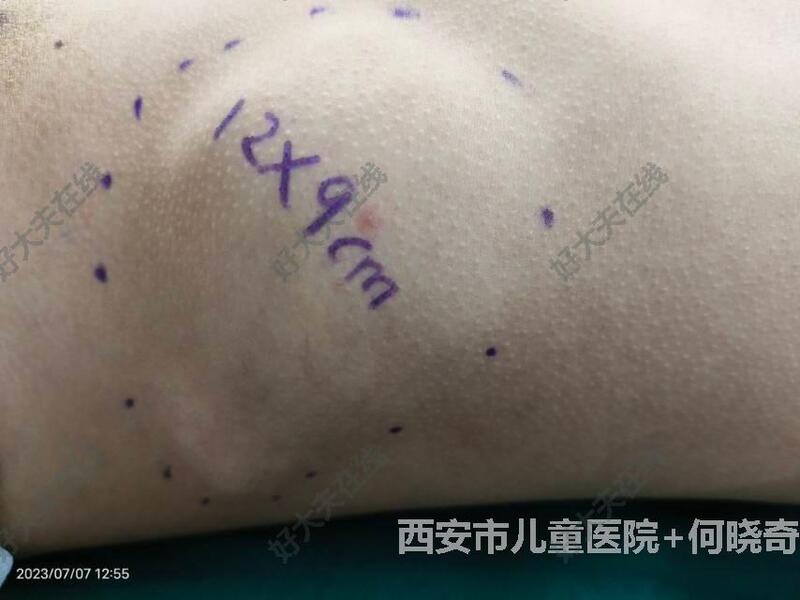
 张强 主任医师 西安市儿童医院 肿瘤(血管瘤)介入中心222人已读
张强 主任医师 西安市儿童医院 肿瘤(血管瘤)介入中心222人已读 - 精选 巨囊性淋巴管瘤
治疗前 患儿,男性,左侧胸壁巨大淋巴管畸形7年,明显隆起,影响外观,局部轻压痛 治疗中 超声及DSA引导下行聚桂醇平阳霉素泡沫硬化治疗 治疗后 治疗后25天 术外观恢复正常,彩超提示囊腔基本消失 治疗后即刻 DSA下可见药物均匀弥散
 何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心84人已读
何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心84人已读 - 精选 口服西罗莫司患儿宣教
西罗莫司是治疗脉管畸形的靶向药物,可通过抑制血管内皮的PI3K/AKT/mTOR信号通路,达到抗血管增殖及促细胞凋亡自噬等作用。有效改善患者的症状,如减轻疼痛、改善凝血功能、减少相关并发症、提高生活质量,控制疾病进展。卡波西样血管瘤、丛状血管瘤、复杂淋巴畸形(弥漫性、微囊性、影响呼吸、吞咽功能、危及生命)、泛发性淋巴管异常(GLA)、卡波西样淋巴管瘤病(KLA)、GSD、弥漫性静脉畸形、Sturge-Weber综合征、PIK3CA相关过度生长疾病(KT综合征、CLOVES综合征、面部浸润性脂肪瘤、巨指/趾、表皮痣、巨颅-脑畸形)、蓝色橡皮泡痣综合征。超声、磁共振、相关血液检查、必要时局部活检及基因检测,部分患者需住院监测常见剂型:胶囊、片剂、口服液(婴幼儿推荐);剂量按照每次0.8mg/m2口服,每日两次;间隔12h,每个疗程为3个月,血药浓度10-15ng/ml。婴幼儿同时预防应用抗生素(复方新诺明20-30mg/kg,分两次口服,隔日服用)常见不良反应:口腔溃疡(最常见)、头痛、血脂增高、皮肤痤疮样改变、血常规异常、月经紊乱;其他不良反应:水肿、发热、间质性肺炎、机会性感染(婴幼儿)、胃肠道反应、伤口愈合慢。以上不良反应与服药剂量相关,多可以自行缓解,但存在个体差异性。患儿存在药物过敏、严重不良反应、严重感染、间质性肺炎、精神状态差,择期手术前14天,局部存在伤口、溃疡、严重外伤等情况需暂停服药。服药前3个月每月随访1次,之后3月随访1次;复查血、尿常规、肝肾功能、凝血、血脂、西罗莫司血药浓度(抽血当天不能服药),局部超声、CT或磁共振;每月定期局部拍照。1.服药后多喝水,漱口;每天规律按时服药;2.片剂、胶囊可常温储藏,不可切开/压碎;口服液需冷藏、喂养困难可用清水稀释;3.漏服或呕吐者建议尽快补服,如果时间接近下次服药时间(小于4h),可不追加;4.服药期间注意保护皮肤,尽量避免晒伤;5.避免食用葡萄汁、西柚类食物,减少高脂饮食;6.尽量避免使用以下药物:钙通道阻滞剂、抗真菌药、克拉霉素、红霉素、抗惊厥药;7.不同厂家/剂型的西罗莫司更换建议2周后复查血药浓度;8.服药期间可接种灭活疫苗(百白破疫苗、肺炎球菌疫苗、流感疫苗、甲肝、乙肝疫苗、脑膜炎球菌疫苗、HPV),但疫苗效应可能减小;9.服药期间不能接种活疫苗(脊髓灰质炎糖丸、卡介苗、麻疹疫苗、流行性腮腺炎疫苗、风疹疫苗、水痘疫苗、伤寒疫苗、带状疱疹疫苗、轮状病毒疫苗),可能导致相关病毒感染,若治疗前接种过上述疫苗,建议间隔4周后服药;
何晓奇 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心1355人已读 - 精选 什么是鲜红斑痣?
鲜红斑痣,又叫微静脉畸形,葡萄酒色斑。出生时就存在,表现为小的红斑到大的斑片,一般不高出皮面,颜色淡红或暗红,形状不规则,压之部分或完全褪色,好发于头面颈部,也可发生于身体的任何部位。发生于面部者,影响美观及心理健康。 目前鲜红斑痣最好的治疗方法是光动力治疗,一般3个疗程左右可以达到临床治愈!2岁即可开始治疗,1-2期的病人效果最好!
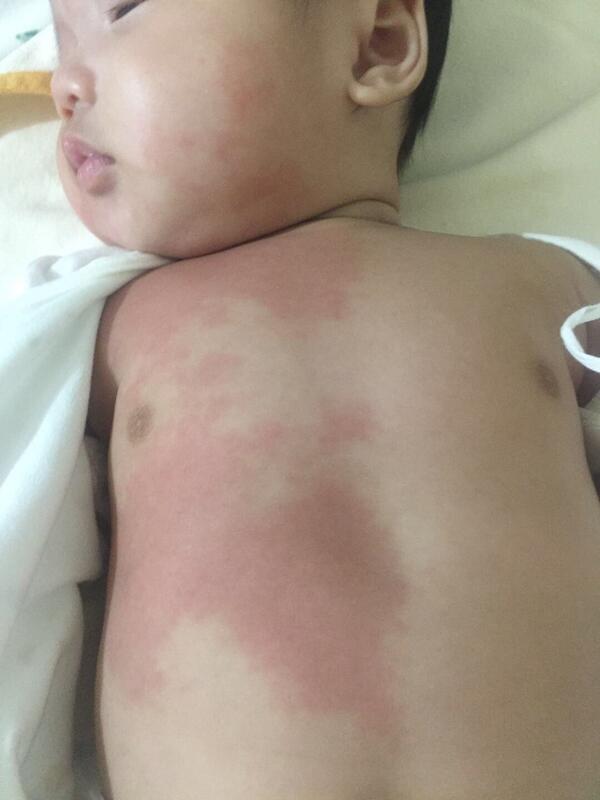 陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心660人已读
陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心660人已读 - 精选 皮肤血管瘤和脉管畸形的分类和治疗进展
综述目的 皮肤血管瘤和脉管畸形是婴幼儿常见的疾病。长期以来这类疾病分类标准不统一,治疗方法各异,这导致不能有效评价不同方案的治疗效果。 综述方法 对近期与皮肤血管瘤及血管畸形相关的文献进行检索与回顾,总结皮肤血管瘤和血管畸形的分类、临床表现及治疗。 最近进展 就皮肤血管瘤和脉管畸形的治疗而言,目前国内外尚缺乏统一的诊疗指南。普萘洛尔是近5年来用于治疗重症婴儿血管瘤的新方法,其疗效和安全性已在临床上得到证实。应用普萘洛尔治疗前,需要对患儿进行综合评估,国内常用的治疗剂量为1.5~2 mg·kg-1·d-1,分2次口服,服药期间要长期监测心率、血压、血糖等,在保证疗效的同时,尽量减少不良反应的发生。 总结 对于皮肤血管瘤和脉管畸形患儿,首先应正确诊断,之后选择合适的干预措施。普萘洛尔作为一种新的治疗方法广泛用于治疗重症婴儿血管瘤,其疗效和安全性已得到证实。 1. 引言 皮肤血管瘤和脉管畸形是婴幼儿常见的疾病。传统的分类方法依据形态学分类,将血管瘤和血管畸形统称为“血管瘤”,并分为:鲜红斑痣、草莓状血管瘤、海绵状血管瘤及混合性血管瘤。20世纪80年代以来,Mulliken和Glowacki[1]提出了依据生物学分类方法,将传统意义上的血管瘤划分为血管瘤与脉管畸形两大类。1996年,国际脉管病变研究学会(International Society for the Study of Vascular Anomalies,ISSVA)在采纳了Mulliken和Glowacki分类方法的基础上,进一步扩展并完善了脉管性疾病的分类方法[2](见表1)。 2. 血管瘤 2.1婴儿血管瘤 婴儿血管瘤是婴儿最常见的良性肿瘤,发病率为4%~5%[3]。婴儿血管瘤通常在婴儿出生时或是出生后不久发生,最早期的皮损表现为充血性、擦伤样或毛细血管扩张性斑片[4,5]。之后会有一个快速增殖期,通常出现在出生后5.5~7.5周[6]。已有前瞻性队列研究表明,血管瘤的增殖期与其亚型、深度无关。若在出生后3个月内出现增殖期,瘤体大小可达到最终面积的80%[7]。早期增殖期后增殖变缓,若在出生后6~9个月出现增殖期为晚期增殖期,最终可在数年后逐渐消退。 除了经典的增殖模式外,婴儿血管瘤还有少数特殊的增殖模式。这类血管瘤称为微小增殖或不增殖血管瘤,它们的典型表现为,微小的斑疹或粗糙的网状毛细血管扩张,常位于一个明显的血管收缩带内[8],增殖面积小于其自身面积的25%。深部和节段型血管瘤的生长轨迹与局限型浅表血管瘤也不一样,深部血管瘤快速增殖期的出现通常比浅表血管瘤晚1个月,快速增殖期结束时间也晚1个月[7]。约有3%的血管瘤增殖期会延长至出生9个月之后,这类血管瘤大部分为深部血管瘤、混合型血管瘤或节段型血管瘤[7,9]。对于高危婴儿血管瘤,应尽早治疗,最好在出生后4周或更早开始治疗,如果能早期治疗,则可以达到一个最佳的治疗效果。 不同婴儿血管瘤的治疗方法亦不同,需要结合病史、临床表现、影像学检查等判断是否为高危血管瘤,从而决定治疗方案。根据Frieden IJ建议[10],可以将血管瘤分为3个风险等级(见表2)。 2.2先天性血管瘤 先天性血管瘤多在出生时即有,或生后不久发生,分为快速消退型先天性血管瘤和不消退型先天性血管瘤两种亚型。快速消退型先天性血管瘤比婴儿血管瘤消退更快[11]。临床表现为血管瘤周围环绕苍白色的边缘,这可能与其迅速消退有关;部分消退后中心可出现凹陷或瘢痕。这些完全先天形成的皮损被公认是典型婴儿血管瘤的临床变异型。但最近有研究显示,这些先天性、非进展性血管瘤的组织结构和免疫表型与典型的婴儿血管瘤不同[12],尽管发病因素尚不清楚,但这些血管瘤与胎盘无关。发病率与血管畸形类似,无性别倾向性。 2.3 Kaposi样血管内皮瘤和丛状血管瘤 Kaposi样血管内皮瘤男女发病率相等。皮损表现为局部浸润性血管斑块或深色、膨出的质硬团块。皮损不会自发消退。出现皮肤受累的平均发病年龄是43个月,这比典型的婴儿血管瘤要晚[13]。这种类型的血管瘤常伴有血小板严重减少,从而引起Kasabach-Merritt现象。迄今为止尚未报道本病有远处转移,但有报道显示患者肿瘤弥散到局部淋巴结[14]。大量证据表明,Kaposi样血管内皮瘤不会出现真性转移,多发病灶可能会沿着局部淋巴结分布,而非真正意义上的转移。50%以上的丛状血管瘤患者在5岁以内发病,其中约15%的血管瘤在出生后即有,晚期发病者罕见。皮损表现为不均匀的粉色至红色斑疹、斑片和聚集成片的丘疹,可累及身体大部分面积,皮损很少自发消退。先天性发病者常伴有Kasabach-Merritt现象。 3. 脉管畸形 皮肤脉管畸形大多在出生时即清晰可见,随着婴儿的生长而成比例地扩展,创伤、感染、激素水平改变,血液或淋巴液压力增大,可以促进病变的生长[15],发病无性别倾向。Mulliken和Glowacki根据受累的脉管将脉管畸形分为五型:动脉畸形、静脉畸形、动静脉畸形、毛细血管畸形(见图4)和淋巴管畸形(见图5)[16]。脉管畸形除了根据组织学分类外,根据其在血管造影中的血流动力学特征可进一步分为“低流”损害和“高流”损害。前者包括毛细血管畸形、淋巴管畸形以及静脉畸形。后者包括动脉畸形、动静脉畸形以及动静脉瘘[16]。组织病理表现为:脉管畸形中血管管腔异常扩张,但内皮细胞扁平,胞核呈扁椭圆形,内皮细胞无异常增生。肥大细胞数目正常。 4. 皮肤血管瘤和脉管畸形的治疗 皮肤血管瘤和脉管畸形的治疗,应依据其分类。婴儿血管瘤在临床上最常见,下文将进行详细阐述。 4.1婴儿血管瘤的治疗 4.1.1治疗原则 由于婴儿血管瘤可自行消退,并且多数在消退后不会出现严重后遗症,所以大部分患儿不需进行治疗。但高危血管瘤可能引起溃疡、毁形性损害、功能损害或重要组织脏器结构改变等并发症;处于增殖期的血管瘤,可能会在很短的时间内从低风险级别增至高风险级别。因此,婴儿血管瘤的治疗一定要平衡治疗的疗效和治疗可能带来的不良反应。应根据其风险级别、是否处于增殖期等因素综合评估,选择相对合适的治疗方法。如需要治疗,则应决定选择局部用药或全身用药。具体治疗原则如下:①局部用药:适用于浅表和局限型血管瘤,也可以用于早期增殖期但无法判断是否存在深部血管瘤的患儿。②系统治疗:适用于大的血管瘤,具有明显生长增殖特征,或伴随严重功能损害者,也用于局部治疗无效的患儿。 4.1.2不同风险级别婴儿血管瘤的治疗方案 高风险血管瘤:应尽早治疗——最好在出生后4周或更早开始治疗。治疗方案:一线治疗为口服普萘洛尔,若有口服普萘洛尔应用禁忌证,则可全身使用糖皮质激素治疗。 中风险血管瘤:应尽早治疗。治疗方案:早期可予外用β受体阻滞剂、局部约束疗法或脉冲染料激光治疗;治疗过程中,若瘤体继续生长或出现溃疡等并发症,则应遵循高风险血管瘤治疗方案。 低风险血管瘤:可先随诊观察,在6个月之内每月进行复诊,观察瘤体大小,必要时定期复查局部超声,了解瘤体的厚度及血供情况,如果瘤体生长迅速,则遵循中风险血管瘤治疗方案。 消退后期血管瘤的进一步治疗:婴儿血管瘤的消退会持续数年,并有可能遗留皮肤永久性改变。未治疗血管瘤消退完成后有40%的患儿残存皮肤及皮下组织退行性改变:瘢痕、萎缩、色素减退、毛细血管扩张和皮肤松弛。大多数研究证明,血管瘤主要在3岁半左右消退完毕,此时血管瘤不会自发改善[17]。如果需要进一步做整形手术,最佳年龄是3~4岁,因为之后血管瘤不会再自发改善。如果推迟治疗,则可能对患儿的心理造成影响[17]。 4.1.3局部外用药物治疗 噻吗洛尔目前是首选局部外用药,国内外报道,0.5%噻吗洛尔溶液治疗小的、浅表型血管瘤具有良好的疗效[18-23]。局部外用咪喹莫特可治疗浅表血管瘤,可能的不良反应有局部刺激、溃疡和结痂[24]。建议用于有外用β受体阻滞剂禁忌证的患儿。 4.1.4局部注射治疗 局部注射药物主要有糖皮质激素、硬化剂(无水乙醇、聚桂醇等)、平阳霉素等。目前建议用于局限性、深部、非重要组织器官周围血管瘤的治疗。 4.1.5 脉冲染料激光治疗 常用的是595 nm脉冲染料激光,通常用于婴儿血管瘤消退期后,减轻血管瘤的颜色或毛细血管扩张性红斑,或加速溃疡愈合;用于增殖期血管瘤,则可控制其生长。 4.1.6系统治疗 4.1.6.1口服普萘洛尔 普萘洛尔治疗婴儿血管瘤的发展过程及现状 普萘洛尔(商品名:心得安)用于治疗血管瘤是2008年由Léauté-Labrèze [25]无意发现的。目前国际上发表普萘洛尔治疗血管瘤相关文章400余篇,国内发表相关文章百余篇。已有系统评价证实,普萘洛尔在安全性和有效性上均优于糖皮质激素——传统的治疗金标准 [26],总体有效率达97%,不良反应较少。普萘洛尔不仅在增殖期抑制血管瘤的生长和减小面积,在生长结束后也能促进其消退(见图6)。普萘洛尔用于治疗溃疡性血管瘤、眼周血管瘤、气道血管瘤和肝脏血管瘤均取得了满意的效果。但尚需国际性大规模随机对照临床试验进一步证明普萘洛尔治疗婴儿血管瘤的有效性和安全性。 作用机制 目前尚不明确,可能的作用机制包括:①普萘洛尔能抑制血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF),而VEGF能促进血管瘤内皮细胞增殖[27]。②普萘洛尔可以通过低氧诱导性因子-1ɑ-血管内皮生长因子-A(HIF-1ɑ-VEGF-A)轴抑制血管瘤,通过HIF-1ɑ通路抑制血管瘤内皮细胞VEGF-A的表达[28]。③信号肽介导通路包括PI3/Akt和P38丝裂原活化蛋白激酶(P38MAPK)能减少内皮细胞迁移和血管发生,最终引起内皮细胞凋亡,最后直接引起细胞毒性效应。④普萘洛尔能通过PMA(一种对细胞产生宽波效应的佛波酯)抑制对基质金属蛋白酶-9(matrix metalloproteinases, MMP-9)的诱导[29]。因此,普萘洛尔的一部分效应可能是被基质金属蛋白酶介导。⑤ 普萘洛尔能使内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)活性和表达降低,低水平的eNOS能直接降低一氧化氮(nitricoxide, NO)的产生,从而导致血管收缩和降低血管紧张度[30]。另外,eNOS的降低能够减少血管瘤内皮细胞增殖和长期预防血管瘤增生。⑥普萘洛尔可通过抑制血管内皮细胞由G0期向G1期转变而导致细胞周期停滞,并可抑制内皮细胞迁移、分化成毛细血管样管状结构,从而抑制血管生成[31]。故本药可治疗增殖期及消退期血管瘤。 临床应用进展 用药年龄:目前国内外应用普萘洛尔治疗血管瘤的最小年龄为出生后3周[32,33]。由于普萘洛尔不良反应更容易发生在年龄小的患儿中,因此,对新生儿进行治疗时一定要慎重,而对于早产儿,一般建议用药年龄为足月后4周。若瘤体位于气道、鼻部等重要脏器周围,并在新生儿期已出现呼吸困难等症状,需在密切监护下小剂量给药,可从起始剂量0.25 mg·kg-1·d-1开始给药,如果患儿未出现明显不良反应,随着患儿年龄和体重增长,可逐渐将普萘洛尔加至足量。 用药剂量:国外报道口服普萘洛尔的安全剂量为1~3 mg·kg-1·d-1[10],而国内剂量多为1~2 mg· kg-1·d-1。关于口服普萘洛尔的起始剂量和监测规范,目前尚无有效的临床随机试验证据,但根据一些临床报道及专家观点,小于2月龄患儿口服普萘洛尔需要住院监测,初始剂量从0.5 mg·kg-1·d-1开始,分3次口服,逐渐增至足量[10]。目前认为最佳剂量为2 mg·kg-1·d-1 [34],并应在治疗前、治疗后1 h和2 h监测血压和心率,患儿应每隔4~6小时进食一次。 起效时间、疗程及疗效:普萘洛尔治疗血管瘤的起效时间很短,大部分在24~48 h内起效,用药1~2周内基本全部起效[25]。关于普萘洛尔治疗婴儿血管瘤的疗程目前尚无统一标准。用药时间多在2~17月之间,早期停止治疗可能会导致血管瘤反弹性生长[35],因此,许多临床医师使用普萘洛尔的疗程一般会持续至瘤体生长期结束,对于大的或深部的血管瘤,可用药至1岁以上。也有学者建议,以剂量3.0 mg·kg-1·d-1至少用药至7~8月龄[36],以剂量1.5~2.0 mg·kg-1·d-1用药至瘤体完全消退或患儿达1岁时方可停药[37]。经普萘洛尔治疗后,瘤体的密度、体积均减小,部分可以消退,治疗有效率达90%以上,停药时应逐渐减量,减量时间应超过2周[38]。因为使用普萘洛尔超过2周后,如果突然停药,24~48 h内有可能发生心脏超敏反应,又称普萘洛尔停药综合征(propranolol withdrawal syndrome),即突然停药后心脏β肾上腺素兴奋性增加,引起血压升高和心率加快,并在4~8 d内达到峰值,2周后逐渐减弱[39]。 有报道显示,普萘洛尔治疗血管瘤的复发率达21%,主要见于用药4个月左右[40]。也有普萘洛尔治疗血管瘤无效的报道,对于一例声门下血管瘤患儿,最初用药时有效,但之后服药期间瘤体仍然生长,因瘤体生长引起呼吸困难症状[41]。 不良反应:普萘洛尔治疗血管瘤的不良反应发生率较低,包括手足发冷、烦躁出汗、便秘、抽搐、昏睡、低体温、低血压、低血糖、胃肠道反应、心率减慢、哮喘发作、腹泻、失眠、梦魇等。不良反应最快可在服药后20 min出现[42]。有学者报道,服用普萘洛尔后最容易在服药2 h后出现低血压,约3 h后可恢复[43]。还有学者报道,普萘洛尔可以引起一种罕见的并发症,即肿瘤溶解综合征 (tumor lysis syndrome, TLS),是指普萘洛尔治疗血液肿瘤或实体肿瘤3~7d内,由于细胞溶解而出现高钾血症、高磷血症、低钙血症和高尿酸血症[44,45]。龋齿也是少见的并发症,原因可能为普萘洛尔的赋形剂为蔗糖,或其减少流涎所致[46]。国外系统综述报道,在1189例应用普萘洛尔治疗患儿中,有371例患儿出现不良反应。最主要的不良反应是睡眠障碍和手足发凉。44例患儿出现低血压,其中5例出现临床症状。9例患儿出现心动过缓,其中1例患儿出现临床症状。35例患儿出现呼吸道症状(感染、哮喘等)。最主要的不良反应是有症状低血糖,有4例患儿出现上述症状,其中1例患儿出现低血糖性癫痫[47],低血糖主要发生于喂养不良患儿,频繁的喂养及避免长时间睡眠可以减少不良反应。北京儿童医院报道的90例血管瘤患儿接受普萘洛尔治疗后,出现的不良反应包括[48]:低血压[3/90例(3.3%)]、部分窦性心动过缓[3/90例(3.3%)]、睡眠障碍[2/90例(2.2%)]、稀便[16/90例(17.8%)]、低血糖[4/90例(4.4%)]、肢端发凉[1/90例(1.1%)]、肝酶升高[26/90例(28.9%)]、可疑心功能不全[1/90例(1.1%)]、心电图P-R间期延长[3/90例(3.3%)]和气道高反应[2/90例(2.2%)]。 治疗其他特殊血管瘤:普萘洛尔除了用于治疗普通婴儿血管瘤外,还可用于治疗一些特殊血管瘤,如溃疡型血管瘤[49-50]、PHACE综合征[51-52]、血管瘤伴血小板减少综合征[53]等,均取得了一定疗效。 4.1.6.2口服糖皮质激素 从60年代起,糖皮质激素一直是治疗高风险婴儿血管瘤的一线药物,由于普萘洛尔的出现,其已很少作为一线药物使用,建议用于有服用普萘洛尔禁忌证的患儿。 治疗方案[54]:口服泼尼松 3~5 mg·kg-1·d-1(总量不超过50 mg),隔日早晨1次顿服,共服用8周;第9周减量1/2;第10周,每次服药10 mg;第11周,每次服药5 mg;第12周停服。完成1个疗程。如需继续服用,可间隔4~6周重复同样疗程。见效时间因人而异,敏感者7~10 d即见病变变软,颜色从紫红色或深红色变为暗紫色。继而瘤体变软,表面开始发白,出现皮肤皱纹,生长停止等,但完全消退需长达数年。对于已进入消退期的血管瘤,没有必要采用糖皮质激素治疗,因为激素只能抑制婴儿血管瘤的生长,不能促进其消退。 不良反应及服药期间注意事项:激素治疗疗程长、剂量大,可引起一系列并发症,应严格掌握适应证。另外,激素治疗还可导致一系列不利反应,如生长抑制、高血压、库欣综合征、免疫抑制、继发感染等,治疗期间应密切监测身高、体重和血压,服药期间应停止疫苗接种,直至停药后6周。 4.2其他血管瘤及血管畸形的治疗 其他血管瘤如不消退型先天性血管瘤、丛状血管瘤、kaposi样血管内皮瘤等,主要以手术治疗为主。在脉管畸形中,以毛细血管静脉畸形最常见,主要采用脉冲染料激光治疗,而其他脉管畸形如静脉畸形、动静脉畸形、淋巴管畸形等,应根据皮损特点、累及区域等,采用硬化
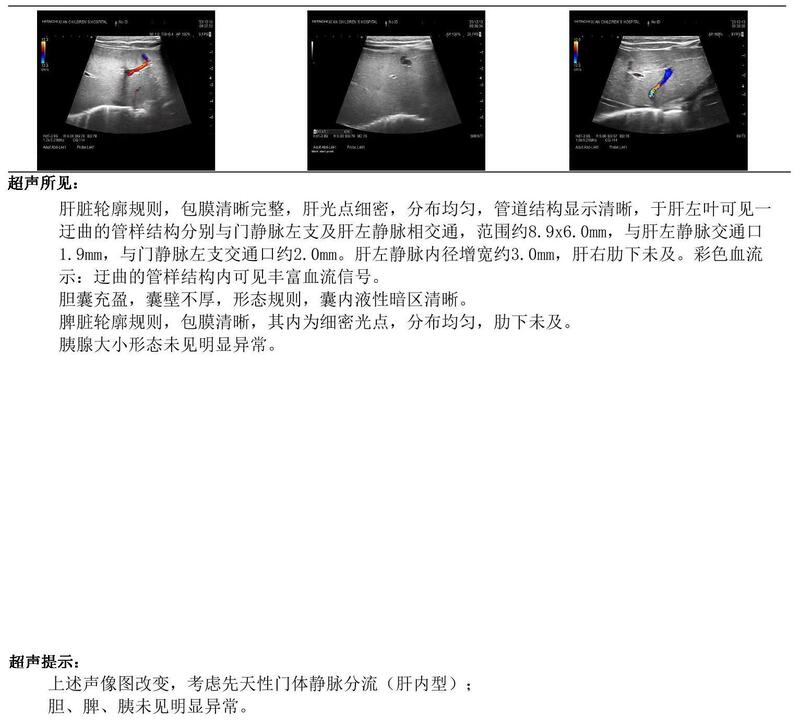
张强 主任医师 西安市儿童医院 肿瘤(血管瘤)介入中心4757人已读 - 引用 先天性肝内门体静脉分流的诊断与治疗
先天性肝内门体分流(Congenitalintra-hepaticporto-systemicshunts,CIPSS)是一种极罕见的血管畸形,其异常分流常位于肝内的门静脉分支与肝静脉之间。先天性门体分流(包括肝外门脉分流和肝内门体分流)的发生率为1∶30000,而肝内门体分流的发生率低于肝外门体分流。先天性肝内门体静脉分流的患者通常会出现肝脏肿大、脾大、腹水等症状。此外,由于门体分流的存在,患者还可能出现低蛋白血症、黄疸等表现。目前,超声检查是诊断先天性肝内门体静脉分流的首选方法。它具有无创、实时、可重复性强等优点,对分流量的评估具有较高的准确性。通过影像学检查,如超声、CT、MRI等,可以鉴别先天性肝内门体静脉分流与其他疾病,如肝海绵状血管瘤、肝硬化等。此外,血氨测定、肝功能检查等实验室检查也有助于鉴别诊断。通过对小儿患者进行多普勒超声、CT、MRI等影像学检查,可以准确观察到肝内门体静脉分流的位置、大小和血流方向等血流动力学特征,为诊断和治疗提供重要依据。有研究表明,门体静脉分流程度与患儿的肝功能、肝纤维化程度密切相关,因此准确评估血流动力学特征对制定个体化的治疗方案具有重要意义。先天性肝内门体分流分类类型1:右门脉与下腔静脉间有恒定直径的管道相连;类型2:局部分流,在单个肝段内有一个或多个小的通道连通外周门脉分支与肝静脉分支;类型3:通过瘤样扩张的囊腔连接的外周门静脉和肝静脉;类型4:外周门静脉和肝静脉在几个节段内的多重连通。类型5:静脉导管持续开放。对于IPVS的治疗,传统的治疗方法包括肝移植和结扎手术,但近年来介入治疗成为了一个新的选择。介入治疗可以通过栓塞或弹簧圈封堵的方式,有效减少门体分流,从而改善患者的临床症状。对于先天性肝内门体静脉分流的患者,应根据患者的具体情况制定个体化的治疗方案。治疗方法包括药物治疗、介入治疗和手术治疗等。药物治疗主要用于控制患者的肝功能和并发症,介入治可用于降低门静脉压力,改善患者的肝功能和生活质量,而手术治疗则主要用于治疗严重的肝内门体静脉分流和合并的肝内其他病变。药物治疗在先天性肝内门体静脉分流的治疗中具有重要地位,约有30%的患者通过药物治疗即可实现门体分流关闭,且副作用相对较小。介入治疗先天性肝内门体静脉分流是一种有效的治疗方法,其成功率可达95%以上。治疗后,患者的生活质量得到显著提高,包括肝功能改善、腹胀等症状减轻等。同时,介入治疗具有创伤小、恢复快等优点,患者术后并发症的发生率较低。这些数据表明,介入治疗先天性肝内门体静脉分流是一种安全有效的治疗方法。手术治疗是严重的肝内门体静脉分的必要手段,但存在手术风险和禁忌症,如肝功能严重受损和凝血功能异常等。新型药物在先天性肝内门体静脉分流治疗中得到广泛研究,具有更好的治疗效果和减少不良反应的优势。手术治疗先天性肝内门体静脉分流主要适用于分流量较大、有明显临床症状的患者。通常在患儿年龄较大、肝功能较好时进行手术,以降低分流量、减轻症状并预防并发症。对于部分复杂病例,可能需要联合其他手术方法进行治疗。
 陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心652人已读
陈晓峰 主治医师 西安市儿童医院 肿瘤(血管瘤)介入中心652人已读



