淮安市第一人民医院老年医学科科普号
- 精选 肺癌靶向治疗与化疗的区别,什么时候可以进行靶向治疗?
靶向治疗和化疗有明显的区别靶向治疗可以用于下列情况:第一、肺癌靶向治疗是针对某些特定的靶点使用的药物,如针对EGFR基因突变的靶向药物,包括吉非替尼、埃克替尼、厄洛替尼或者是第三代的奥西替尼等等。第二、肺癌靶向药物,可以是抗肿瘤血管生成的靶向药物,如贝伐珠单抗、恩度等。第三、肺癌靶向治疗有时候针对某些特定的基因突变,如BCR-ABL融合基因的突变使用伊马替尼、达沙替尼等等。化疗药物主要是细胞毒性的药物,主要是用化学合成的药物针对癌症细胞做非选择性杀伤,因此既可以导致癌细胞被杀灭,也可以导致血液循环当中正常的细胞被杀灭的情况。指通过口服、注射化学治疗药物杀灭癌细胞,从而达到治疗的目的,是治疗肺癌的主要方法,90%以上的肺癌需要接受化疗。小细胞肺癌化疗:无论是早期还是晚期,化疗对小细胞肺癌的疗效均较肯定,有约1%的早期患者可通过化疗治愈。一线化疗药物为依托泊苷、伊立替康联合顺铂?和卡铂,治疗4~6个周期。非小细胞肺癌化疗:化疗一般不能治愈,只能缓解患者症状,改善其生活质量。一线化疗推荐含铂两药方案,治疗通常为4~6个周期。腺癌首选方案为培美曲塞联合铂类(AP或AC方案),鳞癌首选吉西他滨联合铂类(GP或GC)或多西他赛?联合奈达铂。对于年老体弱或恶病质者、心肝肾功能严重障碍者、骨髓功能不佳者、有并发症和感染出血倾向患者等,不推荐化疗。靶向治疗存在着选择性,副作用相对小一些,而化疗则是非选择性的杀伤,毒副作用较大。那么肺癌患者什么时候可以进行靶向治疗?对于晚期非小细胞肺腺癌的患者,如果它的驱动基因是阳性的,那么就可以采用靶向药物进行治疗。所谓的驱动基因阳性,就是指EGFR基因检测,ALK基因检测以及ROS-1基因检测能够检测到突变的。在肺癌的诊治指南中明确规定,对于晚期非小细胞肺腺癌的患者,为了指导临床治疗,其病理标本需要进行EGFR、ALK、ROS-1这三种基因的检测。汪为民专家门诊:周一周三地址:淮安市第一人民医院二楼5号,老年医学科,老年呼吸专病门诊。
汪为民 主任医师 淮安市第一人民医院 老年医学科1360人已读 - 精选 肺毛玻璃结节会不会变成肺癌?
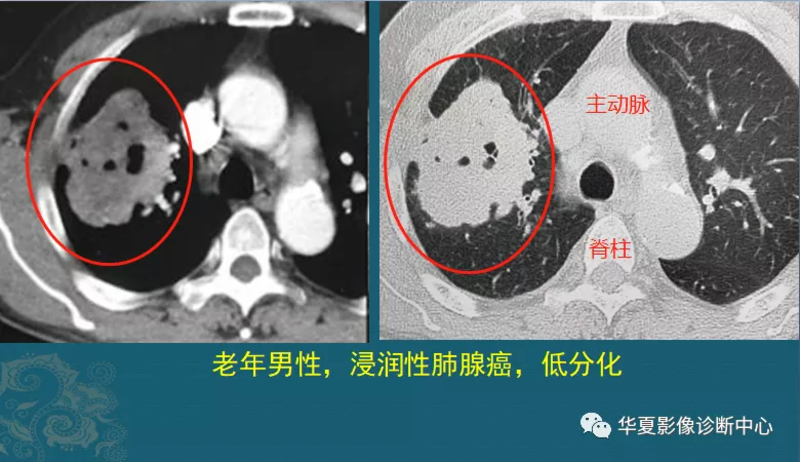
先问大家一个问题:从磨玻璃结节,到7厘米的晚期肺癌,需要长几年? 不着急回答,我们先看一个晚期病例,比较遗憾: 这是一位70多岁老爷子,咳嗽、咳血半个月,CT发现右肺7.0cm大肿块,病理是浸润性肺腺癌,低分化,已经无法手术。 而且肿瘤已经进入加速生长期,仅仅40天后复查,肿块以肉眼可见的速度进一步增大,很麻烦了…… 老人这个肺癌发展到7厘米,长了多少年呢? 我们查询老人既往的检查资料,他7年前曾经做过一次肺部CT,当时发现他有一个混合磨玻璃结节,6.3mm,建议定期复查: 很遗憾,这7年来,老人没有回来哪怕复查一次,这个肺结节利用这段无监督的时间偷偷长大了,变成了7.0cm的晚期肺癌…… 这个病例提醒大家,磨玻璃结节(包括混磨)定期复查很有必要 磨玻璃结节的科学处置 很多朋友问:干嘛要复查?直接切了不更好?复查长大了怎么办? 答案很简单,肺结节太多了,良性远远多于恶性!就算是磨玻璃结节,大多数也是惰性病灶,可以几十年不变化,没有必要过度医疗,花钱、伤肺、甚至发生一些并发症。所以对于比较小的磨玻璃肺结节,首次发现时通常选择先观察。一般首次复查建议间隔3个月,避免漏掉少数生长快速的结节,无变化的话,以后延长复查间隔。 于是很多人就担忧另一个问题:万一这个结节是肺癌,随访观察会不会耽误治疗?癌细胞会不会在观察期扩散,从而失去手术机会呢?毕竟地球上没有后悔药,有也是假药! 今天整理了几个病例,给大家演示一下磨玻璃肺结节的随访结果,包括混合磨玻璃结节,让大家安心。 第一种结局最美丽,结节复查消失 对于首次发现的磨玻璃结节,如果没有确凿的恶性征象,通常是先随访观察,某些良性结节会吸收(这是最好的结果),如下图: 这种情况不少见,多为炎症性结节,可以通过抗炎治疗、增强免疫力等方法促进吸收,甚至有些结节不采取任何措施也能吸收消散。 所以,首次查出的磨玻璃结节,先等等,别着急手术,有些良性结节会吸收,这是第一种结局。 第二种结局:长期不变,结节保持稳定 这种情况是最常见的,也不着急手术,定期复查就好: 即使是多发磨玻璃小结节也不必焦虑。在三项专门针对多灶性磨玻璃结节的研究中,60-95%的纯磨玻璃结节保持稳定,少数减少或消失,仅少数增加或变成部分实性(提示切除)。 第三种结局:复查进展,需要积极治疗 某些磨玻璃结节会进展,变成危及生命的毒瘤,通常表现为密度增加和/或体积增大(混合磨玻璃结节内部实性成分增加,也提示进展),就需要胸外科医生给它执行处罚措施,清理出身体: 这是一位中年女士,体检发现右肺纯磨玻璃结节1.1cm,定期复查,3年后好像增大了一点,直径大约1.2cm,边缘出现少量细索条影,她不想再观察了,做了胸腔镜微创手术,病理是原位腺癌。 与肺癌相关的磨玻璃结节,通常包括:不典型腺瘤样增生(AAH)、原位腺癌(AIS)、微浸润性腺癌(MIA)、贴壁生长型腺癌(LPA)。其中前两种属于浸润前病变(AAH、AIS),大多为惰性病灶,可以长期随访,不会转移扩散。 再举个例子: 这是一位中年女士,体检发现3mm微结节,8个月后增大为9mm的磨玻璃结节,手术病理是微浸润腺癌(MIA)。 磨玻璃结节随访增大、或者密度增加,需要手术治疗,可以治愈!这是第三种结局。 第四种结局,置之不理,少部分进展为晚期肺癌 如果查出肺结节,不遵从医生指导定期复查,只凭保持心情愉悦,或者某些偏方,就有可能出现第四种结局,如同本文第一个病人,7年后进展为晚期肺腺癌了: 这种是最遗憾的,原本通过科学的随访观察手段可以阻止,可以治愈。 最后补充一句:肺结节的复查尽量去同一家医院,使用同一台CT,方便医生对比;另外,对于存在肺结节的人群,不推荐低剂量CT复查,因为低剂量扫描降低了图像清晰度,不利于细节观察。 最近很多网友留言,担忧自己的磨玻璃结节,希望本文内容能为大家解惑。 转载来源:影像科豪大夫 汪为民大夫介绍:汪为民,主任医师,博士,门诊时间:周一,周三全天。老年呼吸科专病门诊。地址:门诊二楼5号诊室 硕士研究生导师,江苏省第五期“333“人才第三层次培养对象。现任中华中医药学会肺系病分会第二届委员会青年委员,中国医师协会中西医结合分会呼吸专业委员会委员,中国研究型医院学会中西医结合呼吸专业委员会委员,中国残疾人康复协会“肺康复专业委员会ICU肺康复专业学组”委员,江苏省中西医结合学会呼吸系统分会委员,淮安市中西医结合分会呼吸专业委员会副主任委员,淮安市医学会呼吸分会秘书长。 主持江苏省科技厅及省中医药管理局课题各1项、主持淮安市科技局立项课题3项,以第二完成人参与省市级课题6项,获得淮安市科技进 步奖三等奖1项。 从事临床工作二十余年,擅长内科常见疾病、老年综合征的防治,特别是呼吸系统常见病、疑难病的诊治及危重症抢救。熟练掌握呼吸衰竭、肺部感染、肺心病、支气管哮喘、慢性阻塞性肺疾病、肺间质疾病、肺部肿瘤、慢性咳嗽的综合诊治。对于老年心脑血管疾病患者合并肺部感染,能够中西医结合,辩证施治,效果明显。
 汪为民 主任医师 淮安市第一人民医院 老年医学科4649人已读
汪为民 主任医师 淮安市第一人民医院 老年医学科4649人已读 - 精选 年纪大了,如何判断是自然衰老,还是生病了?老年病都有哪些?如何综合处置?
老年人,特别是80岁往后,往往各个系统出现功能衰退现象,这些自然的衰老会增加某些疾病的发生率,老年人的衰老主要表现在以下几个方面:1、呼吸系统的变化:由于肺功能逐年下降,肺组织弹性降低,肺活量减小,咳嗽无力,支气管分泌物不易排出,痰液贮留,容易痰堵窒息,反复感染导致老年性慢性支气管炎,或继发肺气肿、慢阻肺肺心病。2、循环系统的变化:随着年岭的增加,心肌细胞逐渐萎缩,心肌收缩力减弱;内膜和心瓣膜的纤维成分增加,弹性降低,瓣膜钙化及关闭不全,心排血量减少,出现心脑供血不足或出现心律失常。同时,动脉壁有脂类沉积和纤维组织斑块形成,血管变窄;小血管纤维组织增生,血管壁的弹性降低,末稍阻力增大,收缩压和舒张压均可升高。3、消化系统的变化:由于牙齿脱落,咀嚼食物受限,胃肠道的消化吸收功能减弱,影响食物的消化和吸收,出现食欲减退、纳差、便秘、大便塘泄。4、骨骼肌肉系统的变化:骨骼的脆性增大,骨质疏松,容易发生骨折;老年性关节变形,颈部及腰椎关节可有骨质增生,压迫神经根,引起疼痛和关节活动不利。骨骼肌可因活动减少而逐渐姜缩,弹性降低,发生肌少症。5、内分泌系统的变化:老年期甲状腺、胰腺、性腺等分泌功能减弱,体内原有的平衡被破坏,需要建立新的平衡。此时容易出现粘液体水肿、糖尿病和更年期综合征等。6、泌尿系统:老年人的肾脏动脉硬化,导致肾小球输人小动脉闭塞或玻璃样变,使肾小球滤过率、肾血流量、肾小管排泄及吸收功能均有明显降低;膀胱壁萎缩易发生膀胱炎;前列腺肥大引起排尿困难,易发生慢性尿储留;肾脏的浓缩能力减退,因此尿多而频,特别夜尿多,有时咳嗽也会出现尿失禁。7、神经系统:老年人大量的神经原细胞萎缩和死亡,神经纤维出现退行性改变,脑血流量减少,因而对周围事物不感兴趣,记忆、分析、综合能力减退,出现神经衰弱、失眠、痴呆等状况。那么常见的老年病有哪些呢?其实这些或多或少与器官功能下降及衰退有关。1、高血压病:老年人血管壁的弹性降低,末稍阻力增大,收缩压和舒张压均可升高,出现高血压病。2、冠心病:老年人动脉壁有脂类沉积和纤维组织斑块形成,血管变窄,部分演变成冠心病或发生急性心肌梗死等严重情况。3、糖尿病:老年人胰腺分泌功能减退,加上胰岛素抵抗,体内原有的平衡被破坏,容易出现糖尿病,如果不加控制,容易出现糖尿病视网膜病变、神经病变、血管病变、糖尿病肾病等并发症。4、骨质疏松:是以骨量减少骨组织微结构退化为特征、致使骨的脆性增加及易发生骨折的一种骨骼代谢疾病。随着人口老龄化的加剧及人均寿命的延长,我国骨质疏松症的发病率逐年增高。5、腰椎间盘突出:腰椎间盘突出症是较为常见的疾患之一,主要是因为腰椎间盘各部分(髓核、纤维环及软骨板),尤其是髓核,有不同程度的退行性改变后,在外力因素的作用下,椎间盘的纤维环破裂,髓核组织从破裂之处突出(或脱出)于后方或椎管内,导致相邻脊神经根遭受刺激或压迫,从而产生腰部疼痛,一侧下肢或双下肢麻木、疼痛等一系列临床症状。腰椎间盘突出症以腰4~5、腰5~骶1发病率最高,约占95%。6、慢阻肺、慢性支气管炎:由于肺功能逐年下降,肺组织弹性降低,肺活量减小,咳嗽无力,支气管分泌物不易排出,痰液贮留,容易痰堵窒息,反复感染导致老年性慢性支气管炎,或继发肺气肿、活动后典型的气喘,肺功能检查可以明确是否合并慢阻肺。7、前列腺增生:前列腺肥大引起排尿困难,易发生慢性尿储留;肾脏的浓缩能力减退,因此尿多而频,特别夜尿多,有时咳嗽也会出现尿失禁。8、慢性肾功能不全:老年人吃药多,加之肾脏排泄药物能力下降,容易出现肾功能不全现象,肾脏动脉硬化,导致肾小球输人小动脉闭塞或玻璃样变,使肾小球滤过率、肾血流量、肾小管排泄及吸收功能均有明显降低。9、尿路感染:老年人特别是女性,如果不讲卫生,膀胱壁萎缩易发生膀胱炎;肾脏的浓缩能力减退,因此尿多而频,特别夜尿多,有时咳嗽也会出现尿失禁。老年人多是患有两种及以上的老年病,如何根据老年人的特点合理安排检查和治疗,往往需要综合考虑,评估目前的主要问题和主要矛盾。老年医学科与专科的不同点在于,老年科医生会从衰老和疾病两者考虑,综合评估患者的一般状况,权衡利弊进行药物或其他康复治疗。专家介绍:汪为民,老年医学博士,主任医师。江苏省第五期“333“人才第三层次培养对象。现任中华中医药学会肺系病分会第二届委员会青年委员,中国医师协会中西医结合分会呼吸专业委员会委员,中国研究型医院学会中西医结合呼吸专业委员会委员,中国残疾人康复协会“肺康复专业委员会ICU肺康复专业学组”委员,江苏省中西医结合学会呼吸系统分会委员,淮安市中西医结合分会呼吸专业委员会副主任委员,淮安市医学会呼吸分会秘书长。 主持江苏省科技厅及省中医药管理局课题各1项、主持淮安市科技局立项课题2项,以第二完成人参与省市级课题6项,获得淮安市科技进步奖三等奖1项,近年来共发表SCI及核心期刊论文10余篇。从事临床工作二十余年,擅长内科常见疾病、老年综合征的防治,特别是呼吸系统常见病、疑难病的诊治及危重症抢救。熟练掌握呼吸衰竭、肺部感染、肺心病、支气管哮喘、慢性阻塞性肺疾病、肺间质疾病、肺部肿瘤、慢性咳嗽的综合诊治。门诊时间:周三周五全天,地点:淮安市第一人民医院老年医学科门诊。
汪为民 主任医师 淮安市第一人民医院 老年医学科2418人已读 - 精选 慢支,肺气肿,慢阻肺,哮喘,区别和联系?
慢性支气管炎,简称慢支,是气管、支气管黏膜及其周围组织的慢性非特异性炎症,临床上以咳嗽、咳痰为主要症状,或有喘息,每年发病持续3个月或更长时间,连续2年或2年以上,并排除具有咳嗽、咳痰、喘息症状的其他疾病。 慢性阻塞性肺疾病(COPD)简称慢阻肺,是一种常见的、可以预防和治疗的疾病,其特征是持续存在的呼吸系统症状和气流受限,通常与显著暴露于有害颗粒或气体引起的气道和(或)肺泡异常有关,肺功能检查对确定气流受限有重要意义,在吸入支气管扩张剂后,第一秒用力呼气容积( FEV1 )占用力肺活量(FVC)之比值FEV1/FVC< 70% 表明存在持续气流受限。 肺气肿是一个病理术语。 慢性支气管炎或肺气肿是慢阻肺最常见的原因,只有在慢支或肺气肿病人并发持续气流受限时,才能诊断为慢阻肺。 支气管哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞、嗜中性粒细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾患。这种慢性炎症导致气道高反应性的增加,并引起反复发作性的喘息、气急、胸闷或咳嗽等症状,常在夜间和(或)清晨发作、加剧,通常出现广泛多变的可逆性气流受限,多数患者可自行缓解或经治疗缓解。
汪为民 主任医师 淮安市第一人民医院 老年医学科4066人已读 - 精选 肺部结节是肺癌吗?
肺部结节如何处理近年来,随着医学影像学的普及因体检发现“肺部结节”来院就诊的患者不在少数,患者最担心的就是这个“结节”是不是恶性肿瘤,发现了结节该怎么办? 为此,我们普及一下肺部结节的相关知识,希望能够帮助大家正确认识肺部结节以及对结节的治疗与随访措施。 肺部结节是指肺部影像学上表现为直径小于3cm,位于肺实质内圆形或类圆形的不透明的密度增高的阴影,称为结节,把大于3cm的类圆形或圆形,边界清晰的阴影叫做肿块。肺部结节可以单发或多发,结节又分实行的、非实性的,非实性结节又分为部分实性的和磨玻璃样结节等。肺内小结节一般是指直径小于1CM的结节。随影像学技术的提高,很多人会在体检或无意中发现,往往很紧张,我们说并非所有的肺部小结节都是或发展为肺癌,有很多都是良性的。但也有一些属于较早期的肿瘤或癌前病变。 肺部结节基本分为良性结节和恶性结节两大类,前者包括良性肿瘤、结核病或结节病,炎性假瘤或炎性结节或机化性肺炎,真菌病或寄生虫病及血肿或血管性病变。而后者包括原发性恶性肿瘤,转移性肿瘤。 肺内小结节绝大多数临床上并无症状,相当部分患者是在每年常规的健康体检被发现的,如果你发现了肺部结节,先不要紧张、惊慌,首先要带CT影像学片来医院就诊,接受呼吸科、胸外科或放射科医生诊断和评估,对肺部结节性质进行判断,并询问包括吸烟史,职业接触史或是家族肺癌史在内的相关危险因素,并由临床医生根据情况制订合理的、诊治策略。特别重要的是需对这类病例的高危因素进行分析,进而根据所出现病灶的大小,形态、密度与周围组织的关系进行鉴别,并根据病情及时进行临床动态观察或治疗措施。 需要了解的是,不是所有小结节在发现当时就需要进行临床处理,定期随访是一种有效的临床策略,进行动态观察尤为重要,一般对不明原因结节要进行定期随访,根据国际和国内肺部结节的诊断治疗标准,应该在3~6月、9~12月以及18~24个月进行 CT扫描,并要将CT扫描结果与以前所有的扫描结果对比,以便早期发现病灶的生长。及时采取措施。尤其对于那些单发的磨玻璃状阴影更要引起重视,采取积极的观察措施。 就年龄而言,小于35岁的人群,恶性肿瘤机率较小,45岁以上人群机率就要高一些,>55岁的人群机率就大大增加了,但是不是绝对的。对于年纪大于55岁,尤其同时又有长期吸烟史或有家族史的人,是肺癌的高发人群,要注意经常做体检,必要时每年做低剂量CT检 另外,我们还应该对于恶性结节的变化规律有所了解,大多数肿瘤细胞按一定时间倍增,不会在三个月之内就长得很快,所以只要在医生指导下CT进行定期随访观察,定期观察肺部结节的变化,是相对安全的措施,不要急于采取不必要的检查和手术给患者带来过多的身体损伤和精神压力。 经过评估以后,如果考虑恶性,需要手术,一定要尽早手术。患者不能手术,或者不愿意手术,也可以接受中医治疗。中医认为正气存内,邪不可干,所谓正气失调,一是指正气的不足,包括机体脏器功能减弱和所需物质的亏虚,二是指正气的壅滞与逆乱。包括各种致病因素引起气机失调,导致功能障碍,概括为一个“郁”字。中医认为气血是人体生命活动的基本物质,气血的虚衰与郁滞,就会影响到人的功能状态。机体很多结节性病变,多是由机体免疫力低下,气虚、阴阳失衡,气滞血瘀、痰浊淤阻而致,因此如果你肺部有了一些结节性病变,在观察期间,采取中医整体调理,调补元气、活血化瘀、软坚散结治疗,可以收到一定疗效。不但有控制结节生长的可能。同时可以调节体质,改善你的免疫力。
汪为民 主任医师 淮安市第一人民医院 老年医学科9396人已读 - 精选 糖皮质激素雾化吸入疗法在儿科应用的专家共识
糖皮质激素雾化吸入疗法概述1 基本概念吸入疗法是目前哮喘治疗首选的给药方法。采用吸入疗法时,药物以气溶胶的形式输出,随呼吸气流进入体内。由于气溶胶具有巨大的接触面,有利于药物与气道表面黏膜上皮细胞接触而发挥药效。其中,直径1-5 μm的药雾微粒最为适宜,>5 μm的微粒绝大多数被截留在口咽部,最终经吞咽进入体内;而< 0.5 μm的微粒虽能达到下呼吸道,但在潮气呼吸时,90%药雾微粒又可随呼气而排出体外。吸人药雾微粒的形态也影响药物在气道内的分布,如雾化吸人布地奈德( budesonide)混悬液时,输出的药雾微粒呈不规则形状,更容易在下呼吸道内分布。2 糖皮质激素雾化吸入疗法的特点及临床地位2.1 给药技术介绍2.1.1 射流雾化 以压缩泵或氧气驱动的雾化器是目前临床最常用的雾化吸入器具,其原理是高速运动的压缩气体通过狭小开口后突然减压,在局部产生负压将药液吸出并形成药雾微粒,其中大药雾微粒通过挡板回落至贮药池,小药雾微粒则随气流输出。药雾微粒的大小与气流的压力和流速有关,增加气流速度可使雾化输出量增加,减小药雾微粒,缩短雾化时间,并使患儿的依从性更好。在应用射流雾化吸入器时,药池的液量要充足,一般用量为3-4 ml,可在5-10 min内输出全部药液。对处于喘息急性发作状态、呼吸困难的患儿,建议以氧气作为驱动力,在雾化给药的同时提供氧气。必须强调,氧驱动雾化吸人的氧气流量以6-8 L/min为宜。2.1.2 滤网式(mesh)雾化 通过振动等方式使药液透过网孔进行雾化。与射流雾化相比,滤网式雾化输出的可吸入微颗粒的比例略低,价格较高,但是装置体积小、重量轻、便于携带,且使用时噪音小,还可以倾斜使用。目前滤网式雾化器的种类有限,滤网耐久性能较低是它的最大缺点。2.1.3 超声雾化 通过压电晶片产生的1~2 MHz的高频超声,从而在储药池的顶层液面形成雾粒,但对于混悬液而言,药雾微粒并不能完全到达能形成雾粒的液面顶层;同时,超声雾化的气雾水粒密度大,有效颗粒少,并可增加气道阻力;超声雾化器的高频还可以转化成热能,可能影响糖皮质激素类药物的活性。因此使用超声雾化器时,药雾微粒输出效能较低,大部分药物最终留存在残留液中,不适用于哮喘等喘息性疾病的治疗。由于不同雾化器输出微颗粒的效能差异较大,并可以直接影响到治疗效果,建议避免选用不能提供确切空气动力学数据及有关临床疗效证据的雾化器。2.2 雾化吸人的给药特点 雾化吸入局部给药治疗指数高、安全性好。吸入药物可以直接作用于气道黏膜,局部作用强,且局部药物浓度愈高、疗效亦愈好。雾化吸人是最不需要患儿刻意配合的吸人疗法,适用于任何年龄的儿童。同时,一般雾化吸入治疗的药量仅为全身用药量的几十分之一,由此可避免或减少全身给药(如糖皮质激素)可能产生的潜在的不良反应。2.3 临床地位 中国《儿童支气管哮喘诊断与防治指南》明确指出,糖皮质激素是治疗气道炎症最有效的药物,推荐吸入疗法为哮喘防治的主要给药途径,并强调ICS是哮喘急性发作和哮喘长期控制的一线药物。2009年版GINA(≤5岁儿童)指出,与年长儿童及成人一样,吸人疗法是≤5岁儿童哮喘治疗的基石。≤5岁儿童控制喘息的初始治疗首选ICS。布地奈德混悬液是目前美国食品药品管理局( Food and DrugAdministration,FDA)批准的唯一可用于≤4岁儿童的雾化ICS。3 雾化ICS简介目前国内已有布地奈德混悬液和丙酸倍氯米松混悬液可以用于儿童雾化吸入。3.1 作用机制ICS的作用机制分为经典途径(基因途径)和非经典途径(非基因途径)。经典途径是指激素与细胞浆内的激素受体(简称浆受体)结合,并转运进入细胞核后影响核酸的转录而缓慢地发挥抗炎作用;非经典途径是指激素与细胞膜激素受体(简称膜受体)结合,在数分钟内就能生效。但膜受体的数量仅占受体总量的10%~25%左右,而且它的解离常数远高于浆受体的解离常数。因此强调,只有更高剂量的ICS才能有效启动数量少/亲合力弱的膜受体快速通道,从而保证疗效。由于ICS作用快,因而不仅可作为长期维持治疗,也可在哮喘等气道阻塞性疾病急性发作时与速效支气管舒张剂联合应用以快速缓解发作。3.2 药理ICS吸人人体后可以通过呼吸道和消化道两条途径进入血液循环。目前所用的绝大多数ICS进入肺部后几乎不被代谢亦不灭活,最终以原型进入血液循环,其中仅有25%左右可通过肝脏首过代谢灭活,而大部分则分布于全身组织。而在吸人时留存在口咽部的ICS,绝大多数经吞咽由消化道吸收进入血液循环,部分可通过肝脏首过代谢迅速灭活,不产生全身作用。因此ICS的全身生物利用度是经呼吸道和消化道进入血液循环的总和。不同药物的首过代谢率不同,如丙酸倍氯米松的首过代谢率仅为60%~70%,而布地奈德则高达90%以上,因此布地奈德混悬液雾化吸人的临床安全性更高。布地奈德的局部抗炎效应强于丙酸倍氯米松,是地塞米松的980倍。目前不推荐使用地塞米松作为哮喘雾化吸入治疗的选择。肺内ICS的作用同时受药物分布、局部药物清除率、药物作用位点等因素的影响。由于不同年龄患儿的生理解剖特点和吸药方式不同,其吸人体内的ICS的药代动力学也有所不同。一般而言,儿童喉部较狭小,药雾更易在咽喉部滞留,年龄越小潮气量和吸气流速越低,肺部沉积的绝对药量也越少;同时,绝大多数吸入药物的代谢率均为儿童快于成人,因此儿童对ICS的清除率也高于成人。研究表明,儿童和成人吸入相同剂量的ICS后,两者的药时曲线下面积相似,因此患儿一般无需按公斤体质量计算用量。3.3 疗效雾化吸入ICS可以有效减轻气道炎症和气道高反应性,控制哮喘症状,改善生命质量,改善肺功能,减少哮喘发作,降低哮喘病死率。吸入ICS的同时还可以联合吸入其他具有协同作用的药物,如β2RA等。联合吸人ICS和β2RA可以既抗炎又解痉,能更好地治疗哮喘、婴幼儿喘息等疾病。研究表明,口服糖皮质激素联合吸入布地奈德混悬液比单用泼尼松龙能更有效地降低哮喘的急性发作。对于雾化吸入ICS在哮喘患儿长期管理中的疗效已有多项研究。一项meta分析结果表明,与孟鲁斯特比较,ICS可使哮喘患儿发生需要使用全身激素的急性发作的风险降低17%。另一项为期52周的开放、随机、对照的多中心研究纳入202例2~4岁轻度持续性哮喘患儿,雾化吸人布地奈德混悬液可显著减少需口服激素治疗的哮喘急性发作的风险。不同雾化吸人治疗药物在肺内分布有所不同,有研究显示幼龄儿童使用布地奈德混悬液吸人治疗的临床疗效更优于其他方法吸入ICS的疗效。3.4 安全性雾化吸人ICS的不良反应很少。个别患儿使用不当可出现口腔真菌感染,通过吸药后漱口或暂时停药(1~ 2d)和局部抗真菌治疗即可缓解。其他还有声音嘶哑等,但停药后可自行消失。ICS的剂量因病情需要可以增加(尤其是急性期的治疗),但即使增加数倍,相对于全身糖皮质激素的应用量而言也是小而安全的,在病情缓解后,推荐以中、小剂量维持治疗。2012年版GINA指出,长期低剂量ICS对儿童生长发育和骨骼代谢无显著影响。研究表明,与安慰剂相比,ICS长期维持治疗的全身不良反应(生长迟缓、肾上腺抑制、白内障、骨密度下降和骨折)的风险未见升高,即使采用ICS治疗7—11年后.哮喘儿童仍可达到正常的成人身高。长期雾化吸人ICS时,应及时调整药物至最小有效维持剂量以进一步提高安全性,减少全身不良反应。3.5 应用范围雾化吸入ICS主要用于气道炎症性疾病的治疗,可有效改善病情,既可以作为医院内缓解急性期发作的主要治疗手段,也适用于家庭的长期控制治疗。3.6 注意事项雾化吸人过程中要防止药物进入眼睛,使用面罩吸药时,在吸药前不能涂抹油性面膏,吸药后立即清洗脸部,以减少经皮肤吸收的药量。此外,在采用射流雾化时,应尽可能使用口器吸人(年幼者应使用面罩吸入器),如使用面罩则以密闭式面罩优于开放式面罩,远离面部的开放式面罩会减少吸人肺内的药雾微粒量。呼吸节律对吸入药雾微粒量亦有影响,儿童哭吵时吸气短促,药雾微粒主要以惯性运动方式留存在口咽部,而且烦躁不安也使面罩不易固定,因此最好在安静状态下吸人。糖皮质激素雾化吸入疗法在儿童呼吸系统疾病中的应用1 支气管哮喘支气管哮喘(以下简称哮喘)按病程分为急性发作期和非急性发作期(包括慢性持续期和临床缓解期),因此,哮喘的治疗也包括急性发作期的快速缓解治疗和非急性发作期的长期控制治疗。1.1 急性发作期的快速缓解治疗1.1.1 哮喘急性发作期的治疗原则 哮喘急性发作可危及生命,即使原来是轻度间歇的哮喘或曾获得较为良好控制的哮喘患儿,也有可能发生严重的甚至危及生命的急性发作。哮喘急性发作时必须尽早采取有效治疗措施进行快速缓解治疗。2012年版GINA指出,在治疗哮喘急性发作时,使用支气管舒张剂联合吸入高剂量糖皮质激素,比单用支气管舒张剂能更有效控制急性症状。1.1.2 雾化吸入布地奈德混悬液治疗哮喘急性发作的用法和疗效 轻度哮喘急性发作时,在吸人速效β2RA的基础上联用雾化吸入高剂量布地奈德混悬液(1 mg)作为起始治疗,能更快速有效缓解急性期症状,起始治疗后按症状改善情况,可在4h或6h后重复给药,直到症状缓解。中重度哮喘急性发作时,相关指南推荐每20-30分钟1次,连用3次吸入速效支气管舒张剂作为第1小时起始治疗。目前研究显示,在第1小时起始治疗中,联用高剂量、短时间间隔雾化吸入布地奈德(1 mg,每30分钟雾化吸入1次,连用3次)能与吸人速效支气管舒张剂发挥协同作用,更快速有效缓解哮喘急性发作症状,改善肺功能,减少全身糖皮质激素使用,降低住院率,在非危及生命哮喘急性发作可替代或部分替代全身用糖皮质激素。若患儿有明显呼吸困难,血氧饱和度< 92%,则应及时给氧,雾化吸人治疗应以氧气作为驱动动力。如经第1小时起始治疗未达到明显缓解,应尽早加用全身型糖皮质激素治疗。对于危及生命哮喘急性发作必须起始治疗时即尽早使用全身用糖皮质激素。第1小时起始治疗后根据症状缓解情况,可2-4h重复1次雾化吸入布地奈德1 mg,急性期症状获得初步控制后可调至间隔6—8h用药,2-3 d后逐渐过渡至间隔8-12 h用药,并建议继续维持该剂量治疗至少3-5 d(在门急诊)或5-7 d(在住院部),然后进入长期控制治疗。临床观察和研究显示,因中重度哮喘急性发作急诊或住院的患儿,在吸入速效β2RA和应用全身型糖皮质激素治疗的基础上联用雾化吸入高剂量布地奈德混悬液,能更快速有效地缓解急性期症状,缩短住院时间,并可能减少全身型糖皮质激素用量,缩短用药时间,从而减少全身不良反应。1.2 非急性发作期的长期控制治疗1.2.1 哮喘长期控制治疗的原则 哮喘治疗是一个长程、规范、个体化的过程。GINA和我国2008年版指南均明确指出:为使患儿的哮喘症状获得完全控制,哮喘急性发作缓解后应使用控制药物进行长程规范治疗,如ICS、白三烯调节剂等。1.2.2 雾化吸入布地奈德混悬液作为哮喘长期控制治疗的用法急性期获得控制后进入长期控制治疗阶段,ICS是目前首选的哮喘长期控制药物。雾化吸入要求患者主动配合程度最低,因此哮喘儿童可选用雾化吸入布地奈德混悬液作为长期控制治疗,可用0.5~1mg/d作为起始治疗剂量。启动起始治疗1-3个月后进行评估,如控制不良应考虑升级治疗,起始剂量为0.5 mg/d的患儿可将剂量上调至1 mg/d,而起始剂量为1 mg/d的患儿建议加用其他控制药物如白三烯调节剂进行联合治疗。升级治疗后至少4~6周应再次评估以指导方案的调整直至达到哮喘控制。如哮喘已达到控制建议每3个月评估1次。哮喘达到控制并维持至少3个月可考虑降级治疗,每次下调ICS剂量25%~ 50%至最低维持剂量,雾化吸入布地奈德的最低维持剂量为0.25 mg/d。ICS下调至最低维持剂量哮喘症状仍能维持良好控制至少1年,可考虑停药。1.3 支气管哮喘急性发作先兆期的预先干预治疗呼吸道病毒感染是支气管哮喘急性发作的主要诱发因素。急性喘息发作前常先有喷嚏、流涕等鼻部症状和明显咳嗽等先兆征象,出现先兆征象至急性喘息发作通常有约平均Sd的“机会窗”时间,在“机会窗”期间尽早给予吸入高剂量ICS进行预先干预,可有效预防后续可能发生的哮喘急性发作。儿童哮喘国际共识(International Consensus on Child-hood Asthma,ICON )也提到,出现感冒症状后吸人高剂量ICS作为预先干预可能对哮喘急性发作有预防作用。在哮喘儿童出现哮喘急性发作的先兆征象时可选用雾化吸入高剂量布地奈德混悬液预先干预治疗,但目前尚无统一推荐的最佳剂量和疗程,可选用MIST( Maintenance vs.Intermittent InhaledSteroids in Wheezing Toddlers)研究中所采用的布地奈德混悬液1 mg/次,2次/d,连用7d的治疗方案。2 咳嗽变异性哮喘( CVA)CVA是一种特殊类型的哮喘,以咳嗽为惟一或主要表现,不伴有明显喘息和气促等症状和体征,但可有气道高反应性,抗哮喘药物治疗有效,是儿童慢性咳嗽最常见原因之一。CVA的本质是哮喘,确诊后应进行规范化的抗哮喘治疗(ICS、β2RA等药物);早期和规范化使用ICS可降低CVA发展为典型哮喘的风险,但使用ICS的疗程尚无定论。临床可以应用布地奈德混悬液雾化吸人治疗<5岁CVA患儿。按其咳嗽的严重程度,分别给予布地奈德混悬液0.5~1.0 mg/次,每天1、2次。CVA咳嗽的完全缓解可能需要布地奈德混悬液治疗数周,因此CVA使用布地奈德混悬液雾化吸入治疗的时间一般不少于6~8周。一项纳入了903例≤5岁CVA患儿的开放性、多中心、非干预性的国内临床研究结果显示:雾化吸人布地奈德混悬液7周,能显著改善CVA患儿的症状评分,减少支气管舒张剂的应用,患儿依从性和安全性良好,值得临床借鉴。3 感染后咳嗽( PlC)PIC是儿童慢性咳嗽的常见原因之一,尤其多见于<5岁的学龄前儿童。急性呼吸道感染、咳嗽症状超过4周可考虑为PIC。PIC的发生可能与气道广泛性炎症和气道上皮完整性受到破坏有关,导致气道黏液分泌过多、气道和(或)咳嗽受体高反应性。PIC -般可自行缓解,大多在8周内症状可缓解;症状严重者可考虑短期使用ICS、白三烯受体拮抗剂或M受体阻断剂。雾化吸人布地奈德混悬液治疗PIC的推荐剂量为0.5~1 mg/次,使用频次依病情而定,疗程可为2—3周。用布地奈德混悬液雾化吸入治疗,可显著改善喘息、咳嗽症状,减少急性复发,改善肺功能和气道高反应性。4 婴幼儿喘息引起婴幼儿时期反复喘息的原因很多,本文所指的是:已排除先天畸形、非感染直接所致者,仅针对病毒感染触发的喘息及反复喘息者,如毛细支气管炎等。<2岁为好发年龄。临床表现主要为咳嗽、气促、喘憋,体征为肺部广泛闻及哮鸣音。治疗主要为支持、维护内环境稳定、改善通气、供氧、抗气道炎症反应、防治并发症及并存症。< p="">病毒感染所致的直接损伤和间接损伤可引起免疫功能紊乱,是气道发生慢性炎症及气道高反应的病理机制。在婴幼儿时期的气道炎症反应中,黏液分泌增加、气道上皮细胞水肿引起气道阻塞、气道功能受阻是主要原因。因此在使用B受体兴奋剂及M受体阻滞剂解除痉挛、舒张支气管的同时,吸入ICS有助于消除非特异性炎症,从而达到改善通气、恢复正常呼吸功能的目的。但应用ICS需遵守适量、有效、足疗程及规范用药的原则。4.1 婴幼儿喘息急性期雾化吸人治疗对于重度喘息患儿,应该给予布地奈德混悬液(1mg/次)和支气管舒张剂(β2RA、M受体阻滞剂)联合吸入。如病情需要可每20分钟1次,连续3次。同时给予全身糖皮质激素如注射甲基泼尼松龙l—2mg/(kg ·d)或口服泼尼松龙1~2 mg/( kg ·d),连续1~3 d。随病情缓解,药物种类及剂量不变,但雾化吸入的间隔时间可逐渐延长为4、6、8至12 h。中度喘息患儿急性期时,同样给予上述联合用药,2次/d,连续2—3d。4.2 婴幼儿喘息缓解期雾化吸人治疗年龄<3岁,但预测可能发展成哮喘的高危儿,需尽量争取长期布地奈德混悬液的雾化吸入,剂量从1mg/d开始,逐渐减量,每1—3个月调整一次治疗方案,直至最小有效维持量(布地奈德混悬液为0.25 mg/d)。疗程个体化,酌情给予3、6、9或12个月吸入。5 肺炎支原体肺炎肺炎支原体肺炎是由肺炎支原体感染引起的肺部炎症。多见于年长儿,咳嗽剧烈,肺部体征少,仅少数肺部可闻及细湿哕音及喘鸣音,肺部X线病变明显,部分患儿合并胸腔积液或出现肺外并发症。在应用大环内酯类药物治疗肺炎支原体感染的同时,给予雾化吸入ICS,可减轻气道炎症反应。促进纤毛上皮细胞功能的恢复,对减轻气道高反应和非特异性炎症能有较好的疗效。同时,吸人ICS还有助于肺炎支原体病原体的清除。对处于肺炎支原体肺炎急性期患儿,如有明显咳嗽、喘息,X线胸片肺部有明显炎症反应及肺不张,应用布地奈德混悬液0.5~1 mg/次,同时联合使用支气管舒张剂雾化吸入,2次/d,用1~3周。对处于肺炎支原体感染后恢复期患儿,如有气道高反应性或X线胸片有小气道炎症病变,或肺不张未完全恢复,可以用布地奈德混悬液雾化吸入,0.5~1mg/d,1~3个月后复查。6 急性喉气管支气管炎急性喉气管支气管炎( croup)是引起儿童上气道梗阻最常见的原因,6个月-6岁儿童最易发生,临床上表现为声嘶、犬吠样咳嗽和吸气性喉鸣伴呼吸困难,其中约2%~15%的患儿需住院治疗,约0.5%-1.5%可能需要气管插管治疗。多数croup患儿由病毒感染引起,尤其是副流感病毒Ⅲ型,其他如呼吸道合胞病毒、流感病毒、肺炎支原体也可引起。循证依据表明,吸入ICS和口服或肌注地塞米松、吸入肾上腺素对中重度croup有肯定的治疗效果。因而多数专家建议常规使用雾化吸人布地奈德混悬液治疗,并可在雾化吸人布地奈德混悬液中加入肾上腺素。ICS雾化治疗能显著减轻喉部水肿和炎症,有助于缓解病情。综合近年来布地奈德混悬液治疗croup的临床研究结果,大多显示雾化吸人布地奈德混悬液与全身糖皮质激素应用效果均优于安慰剂组,并明显改善croup的临床症状和预后。曾有双盲双模拟研究比较口服地塞米松0.6 mg/kg和雾化吸入布地奈德混悬液2 mg的疗效,发现两组在急诊室留院时间及降低严重度评分方面并无差异。多数研究选择雾化吸入布地奈德混悬液的初始剂量为1-2 mg,此后可每12小时雾化吸入1 mg 431。也有研究应用2 mg/次,每12小时一次,最多用4次。7 支气管肺发育不良( BPD)BPD是早产儿呼吸窘迫综合征治疗过程中由于支气管、肺损伤而产生的最为常见的肺部慢性疾病。BPD患儿需要长期的氧疗,并维持血氧饱和度在89%~94%。一般认为,应用β2RA可改善气道通气,但对BPD患儿存活率、机械通气时间,以及此后的氧气依赖度并无明显影响。对于应用机械通气的早产儿,全身糖皮质激素和吸人ICS可减轻因机械通气所致的气道炎症,防止BPD的发生。但基于目前的研究结果,全身激素和吸人ICS预防早产儿BPD的临床疗效尚不肯定。但考虑到ICS的不良反应明显少于全身激素,因而有必要对ICS的有效性和治疗方案进行深入探讨。其他治疗方法可选用利尿剂、维生素A及维生素E等。尽管ICS防治BPD的疗效不确定,但2009年对德国223家儿科医院新生儿病区进行的调查显示,其中46%应用ICS预防和治疗早产儿BPD,且81%选择布地奈德混悬液。雾化吸入布地奈德混悬液防治BPD的剂量与疗程不明确,有研究采用雾化吸入布地奈德混悬液0.5 mg/次,每天2次,共14 d。有关雾化吸入布地奈德混悬液不良反应的报道很少。如应用剂量较大,应适当控制疗程,避免不良反应的发生。8 雾化吸入布地奈德混悬液在气管插管术中和术后的用法和疗效根据患儿年龄,分别于插管前30 min雾化吸入布地奈德混悬液1次,拔管后每30 min雾化吸人布地奈德混悬液,0.5-1 mg/次,4-6次/d;依据患儿病情及拔管后喉部水肿恢复情况而定,一般气管插管术中和术后使用ICS 3~5 d。雾化吸入布地奈德混悬液的疗效明显优于吸入地塞米松。在雾化吸人过程中需要密切观察患儿呼吸道梗阻情况.及时调整合适的雾化吸入糖皮质激素剂量,次数及疗程,一般情况下无不良反应。家庭雾化吸入ICS治疗的应用与管理需要长期雾化吸入ICS治疗的患儿均可考虑家庭雾化治疗。在家庭雾化吸入ICS治疗过程中必须加强对患儿及其家长的教育,使之对长期雾化吸入治疗有一个正确、全面的认识,提高依从性,从而提高疗效和安全性。需要制定完整的家庭雾化治疗计划,并加强随访。此外还需要帮助家长选择合适的雾化吸入装置,指导家长具体操作,告知雾化吸人的注意事项等。对于已能熟练掌握雾化吸入治疗的家长可以进一步指导在患儿病情加重时的药物加量,以及增加吸人次数等,但是对于哮喘持续未能控制的患儿以及需要雾化治疗的其他中重度呼吸系统疾病的患儿,必须在专科医师指导下治疗,不推荐在家中随意自行增加剂量。本文摘自《临床儿科杂志》第32卷第6期2014年6月
汪为民 主任医师 淮安市第一人民医院 老年医学科4748人已读 - 精选 难治性哮喘治疗新进展
难治性哮喘治疗新进展难治性哮喘是指用常规所推荐治疗(如公认的全球哮喘防治创议方案)吸人大剂量糖皮质激素和短效β2受体激动剂治疗后症状仍难以控制的哮喘。其发病机制较普通哮喘更为复杂,目前尚未完全阐明。难治性哮喘的发病率一般报道在5 %~10 %,本文对难治性哮喘的诊断与治疗新进展进行总结。 1 难治性哮喘的定义及诊断 目前对难治性哮喘的定义及诊断标准尚未完全统一,英国胸科学会、欧洲呼吸协会以激素治疗后的临床反应作为主要指标诊断难治性哮喘,至今还没有一项特异性的实验室指标可供临床应用。2000年美国胸科协会定义为经常规治疗(包括推荐剂量的吸人型糖皮质激素治疗)后症状仍难以控制,这些病例被称为难治性哮喘。即refractory asthma或recalcitrant asthma(RA)或difficult to contro1 asthma(DTCA)。美国胸科学会(ATS)对RA的定义为治疗依从性较好、已排除其他疾病引起的喘息或导致哮喘加重的因素已得到治疗,仍具有下列特点的哮喘患者。 (1)主要特点: ①要达到轻至中度哮喘控制水平; ②需要持续应用或接近持续应用(1年中超过半数时间) 口服激素治疗; ③需要应用大剂量吸人激素治疗。 (2)次要特点: ①除每天需应用激素治疔外,还需应用长效β2受体激动剂(LABA)、茶碱或白三烯调节剂治疗; ②几乎每天均需吸人短效受体激动剂(SABA)来缓解症状; ③一秒钟用力呼气量(FEV1) 20%;每年急诊就诊>1次; ④每年需要用口服激素治疗>3次; ⑤口服或吸人激素减量≤25%即可以引起哮喘恶化; ⑥曾有过濒死的哮喘发作。 2006年全球哮喘防治创议(global initiative for asthma,GINA)将经过第4步治疗(缓解药物如短效的β2受体激动剂,2种或更多的控制药物如吸入型激素、抗白三烯类药等)仍未达到可控制水平哮喘的考虑为RA,且要排除由非支气管哮喘引起的喘息,包括声带功能异常、闭塞性细支气管炎和COPD等才能诊断,具有某些哮喘特征的疾病如变态反应性支气管肺曲霉菌病、变应性肉芽肿性血管炎等常影响哮喘的治疗,而哮喘的特殊类型如激素抵抗性哮喘、抗β2受体自身抗体 或β2受体下调性哮喘等,也可以成为哮喘难以控制的重要因素。因此,在评价这类患者是否为RA时,应首先排除上述疾病。 2 难治性哮喘的鉴别诊断 尽管喘息是支气管哮喘的主要症状,但不能把所有具有喘息症状的患者都当作哮喘患者。一方面有许多疾病表现为气流阻塞性喘憋而不是哮喘,一项研究发现多重治疗中心诊治的难治性哮喘,12%的病人不是难治性哮喘;一些伴随性疾病和诱因常影响哮喘的治疗, 而不适当的治疗和哮喘的特殊类型也可以成为哮喘难以控制的重要因素。对于那些给予正规、积极的抗哮喘治疗,症状仍无明显改善的患者,应与下列疾病引起的“哮喘样”症状鉴别。 2.1 心源性哮喘 当怀疑这种不典型心源性哮喘时,应及时通过ECG、动态心电图、二维超声心动图等辅助检查进一步明确诊断外,还可酌情给予小剂量洋地黄或快作用利尿剂试验治疗。对老年患者中的RA应首先排除心源性哮喘。 2.2 慢性阻塞性肺疾病 (COPD)合并张力性气胸尽管给予各种平喘药物(包括大剂量糖皮质激素和β2受体激动剂),这类患者的气喘症状也难以缓解。提高对本病的警惕,作认真、 细致的体检,及时拍摄胸部X线片可明确诊断。患侧胸膜腔插管、作闭式引流可迅速缓解其临床症状。如一味增加平喘药的种类和剂量往往贻误病情。 2.3 气道或纵隔肿瘤 本病与支气管哮喘的鉴别要点: (1)患者既往多无反复发作性喘息史,气喘症状逐渐加重,无明显缓解期; (2)中老年患者多见; (3)多呈吸气性呼吸困难,三凹征明显,哮鸣音多为局限性; (4)常伴有刺激性咳嗽、消瘦、胸痛、持续痰中带血等症状; (5)平喘药物治疗常无效。 如出现下列情况应考虑气管内肿瘤的可能: ①无明显诱因出现喘憋; ②喘憋症状与体位有关; ③有时伴有吞咽不适感; ④颈部有风箱样呼吸音; ⑤解痉药无明显疗效。 及时拍摄胸部X线片可明确诊断。 2.4 变态反应性支气管肺曲霉病 变态反应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)由Hinson等 于1952年首先报道,该病系由熏烟色曲霉菌在特应性机体中引起的一种呼吸道变态反应性疾病。哮喘症状是ABPA患者的常见临床症状,有支气管哮喘症状的患者中1%~2%为ABPA患者,大多数具有长期哮喘病史。ABPA与支气管哮喘的鉴别要点: (1)血中曲霉抗原的IgG沉淀抗体阳性; (2)肺部出现短暂性、游走性浸润影; (3)近心端支气管扩张; (4)咯棕色痰栓病史; (5)多次痰培养或镜检发现熏烟色曲霉; (6)曲霉抗原作皮肤试验呈迟发型变态反应。 2.5 肉芽肿性肺部疾病 肉芽肿性肺部疾病(granuloma lung diseases,GLD)是指一组累及肺部的肉芽肿性疾病,可能出现哮喘样症状,需与支气管哮喘相鉴别。GLD包括: (1)结节性多动脉炎; (2)Churg—Strauss综合征:简称为CSS,又称为变应性肉芽肿; (3)变应性肉芽肿性血管炎:是一种较为少见的系统性血管炎,主要侵犯小动脉和小静脉,常侵犯细小动脉,可累及多种器官,以肺部浸润和周围性血管嗜酸粒细胞显着增多为特征,约98%~100%患者可出现哮喘症状; (4)支气管向心性肉芽肿病等。 2.6 复发性多软骨炎 本病因气管支架软化及气管后壁异常增宽,气道不能维持原来的正常形态,患者在呼气和咳嗽时胸腔内压升高,引起气道狭窄或闭塞,临床上表现为呼气性喘鸣。有时会被误诊为支气管哮喘,通过高分辨CT可鉴别。 2.7 情感性喉喘息 情感性喉喘息(emotional laryngeal wheezing),患者临床喘息症状的发作均与精神因素有关,而不具有支气管哮喘的病理生理特点:如肺泡气一动脉血氧分压差( A-aDO)的增大,胸部X线呈过度充气征,小气道功能异常、气道反应性增高等。这些患者均以颈的喘鸣音最响亮 。 2.8 声带功能紊乱 VCD是由于声带上2/3内收缩造成喉部气道阻塞所致声带闭合不全(尤其在吸气时)常被误诊为支气管哮喘。美国国立犹太医院中25%~30%“重症哮喘”最后被确诊为声带功能不全。流速容量环中吸气支平坦是本病的特征,纤维喉镜也有助于本病的诊断。 因此,临床医师在处理所谓“RA”时,应首先明确该患者是否是支气管哮喘,而不应一味在增加平喘药的种类和剂量等方面下工夫。对于证实为上述非支气管哮喘引起的“哮喘”症状,应针对具体病情分别处理 3 难治性哮喘的流行病学和发病机制 由于研究方法不同,各个国家及地区报告的难治性哮喘患病率差别较大。目前一般认为难治性哮喘占哮喘病人的5%~10%之间。ENFUMOSA报道了大多数的难治性哮喘的病人男女性比例1:4,而Wenzel SE等的报道又认为和性别差别不大。 目前,难治性哮喘的发病机制、病理改变尚未完全阐明,笔者认为难治性哮喘发病机制是由众多相互关联的因素构成的一张错综复杂的网络,目前研究重点集中于糖皮质激素抵抗、 遗传学机制、抗β2受体自身抗体 或β2受体下调性、气道重构和微生物感染等方面,已取得一定的进展和结果,但尚存在许多疑点有待证实。 4 哮喘的治疗 4.1 β2受体激动剂 β2受体激动剂主要作用于呼吸道的平滑肌的β2受体,激活腺苷酸环化酶,松弛支气管平滑肌,故是控制哮喘发作的首选药物。β2受体激动剂分为短效(作用维持4~6h )和长效(作用维持12h)两种, 临床上常用的短效制剂包括沙丁胺醇、非诺特罗、左旋沙丁胺醇、特布他林等。沙丁胺醇气雾剂吸入,成人,每次吸入0.2mg,必要时或每日3次。长效制剂包括福莫特罗、沙美特罗等,福莫特罗片,成人口服40ug,每天2次。短效β2受体激动剂用于缓解哮喘症状,但长期过度使用可能会引起其疗效的部丢失,即产生所谓的耐药。因此应避免长期单独及过量使用β2受体激动剂。 4.2 激素治疗 糖皮质激素具有抑制炎症细胞的迁移和活化、抑制细胞因子的生成、抑制炎症介质的释放等作用。哮喘目前的主要控制治疗是吸人性糖皮质激素(Inhaled Corticosteroids,ICS),ICS是目前最有效的控制哮喘的药物,具有局部抗炎作用强、药物作用直接、剂量较小、全身安全性高不良反应较少等优点。当吸入的推荐的最大剂量,治疗效果欠佳时,可以增加吸人糖皮质激素用量。如气雾剂或干粉吸人糖皮质激素效果不佳,可换用气泵雾化吸人。必要时可以短期口服糖皮质激素或静脉用药,但要注意长期大剂量吸人或口服糖皮质激素有一定副作用。尽管吸入较目前指南推荐剂量更大的剂量也是一种合理的选择,然而不幸的是,Fardon TC等人发现当吸入布地奈德的量明显上升时,疗效的增加没有副作用增长明显。而Dahl R等人发现环索耐德被高剂量时的生物利用度小,这就说明它在高剂量时的全身副作用也较小。 4.3 白三烯拮抗剂 白三烯调节剂包括半胱氨酸白三烯受体拮抗剂和白三烯合成抑制剂,具有轻度舒张支气管、缓解症状、改善肺功能、减轻气道炎症、减少恶化的作用,主要有孟鲁司特。近年研究发现白三烯调节剂是治疗哮喘有很好前途的辅助治疗的药物,由于激素既不能抑制白三烯生物合成也不能抑制其生物学活性。目前主要用于难治性哮喘、过敏性鼻炎哮喘、阿司匹林哮喘,孟鲁司特用法,口服10㎎,每晚一次。Dahle等研究结果特别是已有激素治疗的阿司匹林哮喘则能很好的改善肺功能和生活质量。5 难治性哮喘治疗的新进展 5.1 抗IgE单克隆抗体 2006年GINA把对于经过联合应用大剂量吸人激素和其他各种治疗哮喘药物后,仍未达到哮喘控制的病例主张给予低剂量口服糖皮质激素或给予抗IgE治疗。抗IgE单克隆抗体具有抑制IgE与肥大细胞、嗜碱粒细胞上的受体结合作用,对体内血清IgE水平增高的过敏性哮喘显示良好的疗效。可使血清游离IgE水平降低95%。 Walker S等用回顾性研究方法发现,把索雷尔用到已稳定吸入激素的哮喘病人,能够减少病人加重的次数和持续时间,和减少了96%的住院率。尽管目前在临床试验中证明了索雷尔是治疗哮喘疗效很好的药物,但在难治性哮喘中还需要更多的临床证据。目前国内尚未用于临床,国外已用于临床,因其价格昂贵也使其临床应用受到限制。 5.2 糖皮质激素为主的联合治疗 2006年GINA强调LABA不应单独用于哮喘的治疗,除非与适当剂量的ICS合用。ICS和LABA联合用药具有协同的抗炎和平喘作用。可获得相当于(或优于)应用单纯加倍剂量ICS时的疗效,并可增加患者的依从性、减少较大剂量ICS引起的不良反应。尤其适合于中一重度持续哮喘患者的长期治疗,但应该在医生指导下LABA与ICS联合使用近年来对重度持续哮喘患者并不是一味增加吸人糖皮质激素量,而是主张联合治疗,以免过大的糖皮质激素量导致患者的不良反应。联合治疗的方法:是糖皮质激素与吸人型长效β2受体激动剂联合,如氟替卡松/沙美特罗,布地奈德/福莫特罗;ICS加茶碱可缓解轻中度患者的哮喘症状,改善肺功能及降低气道高反应性,其疗效相当于2倍剂量的ICS;当轻中度哮喘患者吸入低剂量ICS不能控制症状时,也可加用缓释茶碱;ICS和白三烯受体修饰剂扎鲁司特或孟鲁司特,与单用低剂量ICS相比,低剂量ICS+孟鲁司特可显着改善肺功能,减轻日间哮喘症状和夜间憋醒次数。 5.3 支气管热成型术(Bronchial Thermoplasty,BT) 支气管热成型术是一种新的通过介入方法高温消融气道平滑肌的技术,它能降低平滑肌的异常收缩力,从而缓解哮喘发作时平滑肌的痉挛状态从而达到治疗目的。这种治疗手段主要针对经多种药物治疗却收甚微的哮喘病人。该理论首次用于动物体内的研究是在2000年,由Asthmatx公司、美国斯坦福大学、加利福尼亚大学、加拿大麦克马斯特大学等7家单位联合进行。2006年,BT的临床实验正式开始,全球共有包括17家美国医院在内的29家医疗机构共同建立了合作联盟。近年来有由这些不同的机构所做的临床试验得出了相同的结果,即是难治性哮喘的病人在用BT后哮喘症状明显改善、发作的次数减少、发作时用激素的量减少、从而哮喘得到一定的控制及生活质量明显提高。在已进行的动物和人体研究中,虽然没有发现BT造成严重的不良反应,但是作为一项有创性的治疗方法,在操作过程中必须确保安全性。由于研究临床试验的时间较短,对于BT的远期疗效、不良反应以及对生命质量的影响还有待检验。 5.4 生物反馈疗法 生物反馈疗法又称生物回授疗法,或称植物神经学习法,是在行为疗法的基础上发展起来的一种新型心理治疗技术/方法。生物反馈的各种方法中,目前心率变异性生物反馈是有前途的一种。尽管他的生理机制目前还不清楚,但一些随机控制试验发现提高心率变异性的生物反馈能提高肺功能和减少哮喘症状、用药量。尽管在这项研究中有些病人为重症哮喘患者,但严重的后果并没有发生,它可以作为难治性哮喘的一项补充治疗手段之一。 5.5 免疫调节剂的使用 Spahn JD等研究显示长期用口服激素治疗的哮喘患者经长期的静脉内免疫球蛋白的注射能明显降低患者的激素使用量和住院治疗的次数,可能的机制是协同地塞米松抑制淋巴细胞的活化和使用3~6个月后增加激素受体的活性,对激素抵抗性哮喘和非激素抵抗性哮喘具有相同作用。静脉应用免疫球蛋白 ,0.5~1.0g/(kg次) ,每月一次 ,连续 5 个月。虽然这种治疗方法的副作用很小、且病人能很好的耐受,但高昂的费用及连续的静脉注射的不便,使此方法在难治性哮喘应运受到了很大的限制。 免疫抑制剂的使用,Kabra等用甲胺甲氨蝶呤、金盐及环孢素A等对激素依赖性哮喘有替代激素的治疗作用。但这些药物只有约60%的患者有效,且不能改善肺功能,毒副反应较大。而Frew指出金盐的使用可以大剂量减少激素的使用,但伴随着严重的副作用,环孢素A试验表明它可以提高肺功能和减少加重次数、适度减少激素的使用。甲氨蝶呤5~25mg/周,4~6周,需用24周以上,不良反应大,除恶心、呕吐、黏膜溃疡外,肝功能易受损,骨髓易受抑制,且易继发真菌感染。 5.6 干细胞移植术 干细胞是一种具有自我更新和分化潜能的细胞,能够产生高度分化的功能细胞,干细胞可以分化成各种不同类型的细胞和器官。目前,多项研究证明,干细胞移植后能生成免疫调节的产物,并能减少大量的炎症反应。Weiss等发现骨髓来源的间充质干细胞能减少有OVA刺激后的小鼠的气道高反应和支气管灌洗液中的大量嗜酸性细胞。Eva Mezey等研究发现豚草诱发哮喘的小鼠注射了骨髓基质细胞(BMSC,一种多能干细胞),结果发现这种细胞保护了小鼠不出现严重过敏和哮喘症状,并指出这种保护效果很可能是由于这种细胞让人体典型的两阶段炎症反应恢复正常的能力,这种炎症反应在严重哮喘的情况下常变得不平衡。 总之,难治性哮喘的治疗目前仍然是难题,我们临床处理是按分急性发作时的紧急措施和缓解期治疗。急性发作时的紧急措施:首先仍要按重症哮喘急性发作常规处理(详见有关专题) ,吸入足量β2受体兴奋剂,以沙丁胺醇原液为佳可20min一次,连续三次甚至连续雾化,如无β2受体异常问题,症状应该能有所改善。如果有致死性哮喘历史,则考虑及早气管插管,气管内给药,气管插管后的肺泡冲洗。目前用β2受体激动剂效果不佳时,除同时用全身糖皮质激素激外,规范正确使用氨茶碱非常重要。缓解期治疗,首先是糖皮质激素与吸入型长效β2受体激动剂联合;或还可以加缓释茶碱及白三烯受体拮抗剂;或服糖皮质激素及白三烯受体拮抗剂、免疫调节剂、支气管热成型术等很多的新方法和技术根据条件选择性的综合运用。
汪为民 主任医师 淮安市第一人民医院 老年医学科2441人已读 - 精选 慢性阻塞性肺疾病合并骨质疏松常见原因分析
慢性阻塞性肺疾病并发骨质疏松的常见原因分析汪为民 综述 关键词:慢性阻塞性肺疾病;骨质疏松;原因;慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)与骨质疏松(osteoporosis,OP)均为常见性、多发性疾病。COPD具有较高的病死率,在全球范围内,己成为老年人死亡的第四位原因。骨质疏松被认为是世界上发病率、死亡率高及保健费用消耗大的疾病[1]。骨质疏松症是以骨量减少、骨组织显微结构退化(松质骨骨小梁变细、断裂、数量减少;皮质骨多孔、变薄)为特征,以致骨的脆性增高及骨折危险性增加的一种全身骨病[2]。继发性骨质疏松症是由某些疾病或药物病理性损害骨代谢所诱发,如代谢性疾病、内分泌疾病、结缔组织疾病和影响骨代谢的药物等,可由一种致病因素或多种致病因素引起。慢性阻塞性肺疾病是一种气流受限性疾病,气流受限不完全可逆。气流受限通常是不断进展的,并最终导致体力活动减少。COPD逐渐的被认为是一种全身性疾病,肺外的影响包括骨骼肌肉功能障碍、骨质丢失和骨质疏松[3、4]。中重度COPD患者往往合并骨质疏松症[5],有研究显示COPD患者骨质疏松发病率在20%-58%之间[6-8],相对危险度为3.1[9]。 COPD患者容易继发骨质疏松的原因是多方面的,下面就目前国内外研究进展作一综述。一、 吸烟 吸烟是OP独立的危险因素,而COPD患者往往有重度吸烟史。烟草燃烧后可以产生NO,被氧化为NO2,NO2作为趋化因子促使炎症细胞聚集并释放蛋白酶,当超过a1-抗胰蛋白酶中和限度时,可能会影响破骨细胞功能[10],促使OP形成。烟草中的尼古丁、氰化物能干扰成骨细胞功能,使成骨活性减少,破骨活动增加,而且能抑制肠道对钙的吸收,促进OP发生。多家研究报道证实吸烟者骨量大大增加,脊椎骨折危险性增加23倍,髋骨骨折危险性增加17倍[11、12]。 二、 低氧血症与高碳酸血症 COPD是以气流阻塞为特征,严重时出现呼吸衰竭,表现为低氧血症和高碳酸血症。 气流阻塞影响肺通气功能,即出现缺氧,研究发现COPD患者FEV1与骨密度与健康患者相比有显著性差异(P<0.001),而且还发现两者之间存在相关性(r=0.415,P<0.05)[13] 长期缺氧可以造成胃肠道淤血,进食减少,钙磷吸收障碍,缺氧可以导致线粒体氧化障碍,无氧酵解增加,ATP形成不足,影响成骨细胞活力与胶原合成酶功能[14],骨基质成熟障碍,基质分解,钙盐丢失[15]。病情严重者还可出现高碳酸血症,致组织细胞缺氧,抑制肾小管排酸,并使其泌H+功能下降,促使大量阳离子如K+、Na+、Mg2+、Ca2+等从尿中排出,血中游离钙浓度降低,最终引起继发性甲状旁腺功能亢进,从而破骨细胞活性增强,骨吸收增加,导致骨量的丢失,骨密度减低。有人发现慢性阻塞性肺疾病患者骨量的丢失与高碳酸血症和(或)呼吸性酸中毒相关,其骨密度测定值与Pco2呈负相关[16]。三、 营养不良与低体重营养不良是COPD重要的合并症,60%的COPD患者伴有营养状态不良。通常认为老年COPD患者营养不良导致钙的摄入与骨基质蛋白合成不足,从而导致骨形成不足,发生骨质疏松。骨量与人体质量指数(body mass indxe,BMI)有直接关联,营养不良患者通常BMI显著降低。有观察表明,男性和女性BMI高BMD也高[17],这可能与骨承受的负荷增加有关。Incalzi RA等[18]应用双能X线吸收测量法(dual energy x-ray absorptionmetry,DEXA)测定104例慢性阻塞性肺病患者稳定期腰椎和股骨颈骨密度,并用Lgoistic回归分析骨质疏松相关因素,发现体重指数小于或等于22kg/m2与骨质疏作者简介:汪为民,男,1976年出生,医学硕士松发病相关,指出营养状况差的COPD患者更易发生骨质疏松。营养不良引起BMD下降原因可能是由于COPD病变不仅局限于肺部,而且为全身炎症反应[19] 。如TNF-α为一种前炎症细胞因子,可引起COPD患者营养不良[20] 。而TNF-α是有效的骨胶原合成抑制剂和破骨细胞骨吸收刺激因子,造成骨量丢失。四、废用性萎缩慢阻肺患者由于长期处于缺氧状态,特别是急性加重期患者,长期卧床,体力活动受限,户外活动减少,机械应力下降,从而导致成骨细胞活性降低,日晒减少亦导致维生素D合成减少,钙的吸收减少[21],易出现骨质疏松及椎体压缩性骨折。五、糖皮质激素的应用 长期规律的吸入糖皮质激素较适用于FEV1<50%预计值(Ⅲ级和Ⅳ级)并且有临床症状以及反复加重的COPD患者。这一治疗可减少急性加重频率,改善生活质量[22]。多数学者认为,长期应用糖皮质激素可以引起骨质疏松。激素使成骨细胞成骨活力减少,肠内钙吸收障碍,引起甲状旁腺机能亢进,从而使骨质减少。一方面,激素降低卵巢、睾丸、肾上腺的性激素合成与分泌,减少胃肠钙吸收,增加肾脏钙排泄,引起继发性甲旁亢;另一方面,直接抑制成骨细胞的功能,刺激破骨细胞的活动,增加骨组织对PTH和1,25-(OH)2-D3的敏感性,从而造成成骨作用减弱,破骨作用增强,钙盐丢失,导致骨质疏松发生。严重时可发生骨折[23]。有报道认为强的松7.5mg/日连续服用1年或10mg/日连续服用6个月,骨折的发生率可达20-40%。慢性口服糖皮质激素时间大于1个月、剂量≥每天7.5mg者,应该接受骨质疏松筛查[24]。目前主张在COPD急性发作期或缓解期采用吸入激素联合支气管扩张剂治疗,然而有研究报道,通过对骨密度影响的研究,发现吸入激素者股骨颈和腰椎骨密度减少,与安慰剂组相比有显著差异[25]。六、免疫因素和细胞因子的作用 骨质疏松是由于破骨细胞(骨吸收)和成骨细胞(骨形成)之间的平衡被打乱,破骨细胞的功能受骨保护素的调节,骨保护素能够激活核因子-KB和它的配体;T细胞和致炎细胞因子,肿瘤坏死因子-α可溶性受体,IL-1和IL-6,能够诱导其配体的表达,从而促进骨的吸收[26]。的确,在COPD患者中能够检测到高水平的IL-6和TNF-α可溶性受体I和II[27]。而COPD患者存在的系统性炎症能够导致骨质疏松,以低骨质量、骨结构破坏为特征,从而导致骨强度减低、增加骨折风险[28]。七、血液高凝状态 COPD患者多长期卧床,而且长期体内缺氧及应用糖皮质激素亦可造成血液粘度增加,血液流动减慢,导致骨骼血液循环障碍,动脉供血不足或静脉淤血,这些可引起破骨细胞活性增加,从而导致骨质疏松[29]。八、维生素D缺乏 维生素D3可以促进小肠粘膜上皮细胞对钙的吸收,调节甲状旁腺激素的分泌,并对动员骨钙入血及骨在骨中沉积均有重要作用。慢性阻塞性肺疾病患者由于肾脏上皮细胞线粒体羟化酶的功能减弱导致1-25(OH)2D3生成减少,使钙的吸收减少。加之老年慢性阻塞性肺疾病患者,由于并发肺源性心脏病,气喘明显,户外活动较少,日晒不足,导致内源性维生素D3缺乏,从而增加了骨量丢失,导致骨质疏松的发生。Shan E报道[30],20%的慢性阻塞性肺疾病患者可出现维生素D3的缺乏,这也是老年慢性阻塞性肺疾病患者继发骨质疏松症重要原因之一。九、内分泌功能紊乱COPD可以引起内分泌功能紊乱,而内分泌功能的紊乱可以影响OP的发生。目前讨论的最多的为甲状旁腺激素(parathyroid hormonePTH)、降钙素(calcitonin CT)和性激素。COPD患者PTH常明显升高,由于COPD患者存在低血钙及低血磷,低血钙使神经肌肉兴奋性增高,加重支气管平滑肌痉挛,从而导致肺的通气功能下降,氧分压及FEV1均下降。有研究发现,COPD患者的FEV1及PaO2与骨密度呈显著的正相关。当低血磷时,细胞内磷从细胞内移出增多,细胞内缺磷,导致2、3二磷酸甘油酸形成减少,组织供氧降低,造成机体缺氧。PTH是调节钙磷代谢的主要激素,其作用是造成低磷高钙。COPD患者PTH显著增高,结果是磷丢失明显,这样,血钙/磷比值降低,导致成骨作用减弱。性腺机能减退是OP形成的重要原因,长期使用糖皮质激素(Glucocorticoids GC)在男性与女性均可引起性腺功能减退,GC可以降低下丘脑分泌促性腺激素,GC还可以降低对促性腺激素的反应,从而致雌激素产生减少,导致性腺机能减退,骨量丢失加速。CT由甲状腺细胞产生,其与破骨细胞上的降钙素受体结合后,细胞内的环腺苷酸产生增多,激活蛋白酶,抑制破骨细胞活性,并调节成骨细胞活性,促进成骨,并降低血钙,有文献报道[31]COPD急性发作期CT的血清浓度增高,而Shane[32]测定的结果与健康组之间比较无显著差异性。故CT与COPD继发OP是否相关尚不明确,需要进一步的研究。总之,COPD继发骨质疏松的发生是多种因素造成的,多项研究表明两者有极高的相关性,可以将OP当作COPD肺外疾病表现考虑[33],也可以认为COPD是OP的危险因素,COPD患者急性加重的各种原因及各种病理改变互为因果,形成恶性循环,加快和加重了骨质疏松的病情及发展过程。参考文献[1]Inealzi RA Caradonna P,Ranieri P, et al.Correlates of osteoporosis inchronic obstructive pulmonary disease[J]. Respir Med,2000,94:1079-1084.[2] 中国老年学学会骨质疏松委员会,骨质疏松诊断标准学科组.中国人骨质疏松症建议诊断标准(第二稿).中国骨质疏松杂志,2000,6(:1)1-3.[3] Andreassen H, Vestbo J.Chronic obstructive pulmonary disease as a systemic disease: anepidemiological perspective. Eur Respir J Suppl. 2003;46:2–4.[4] BoltonCE, Ionescu AA, Shiels KM,et al. Associated loss of fat-free mass and bonemineral density in chronic obstructive pulmonary disease[J]. Am J Respir CritCare Med. 2004;170: 1286–93.[5] Sin DD, Man JP, Man SF. The risk ofosteoporosis in Caucasian men and women with obstructive airways disease[J]. AmJ Med. 2003;114: 10–4.[6] Jorgensen NR, Schwarz P, HolmeI,.et al. The prevalence of osteoporosis in patients with chronic obstructivepulmonary disease – across sectional study[J]. Respir Med. 2007;101: 177–85.[7] Katsura H, Kida K. Acomparison of bone mineral density in elderly female patients with COPD andbronchial asthma[J]. Chest. 2002;122: 1949–1955.[8] Walsh LJ,Lewis SA,Wong CA,et al. The impact of oral corticosteroid use on bone mineral density andvertebral fracture[J]. Am J Respir Crit Care Med. 2002;166: 691–5.[9] Soriano JB, Visick GT,Muellerova H,et al. Patterns of comorbidities in newly diagnosed COPD andasthma in primary care[J]. Chest. 2005;128: 2099–107.[10] Shnae E,SIIverberg SJ,Donovna D,et al. Osteoporosis in lung transplantation candidateswith end-stage pulmonary disease[J]. The Am J Med 1996,101(3):262一269. [11] Seeman E. Feldeman D,Kelesey J,et al .The effects of tobaccoand alcohol use on bone Osteoporosis[J]. NewYork,Academic Perss,1996,577一597.[12] CooPer C,Atkinson EJ,Jacobsen SJ,et al. Population-based study of survival after osteoporotic fractures[J] .Am J Epidemiol,1993,137:1001一1005.[13] Engelen MP,Schols AM,Heidendal GA,et al. Dual-energy X-ray Absorptiometry in the clinical evaluation ofbody composition and bone mineral densiy in patients with chronic pulmonary disease[J]. Am J Clin Nutr 1998,68(6):1298-1303.[14] 朱砚萍,朱汉民,徐怀玉等.63例老年男性慢性阻塞性肺病患者骨密度和骨代谢的改变.中国骨质疏松杂志[J],2000,(6)l:44一47.[15] Kumedu Y, Lanba M,NlishizawaY. Secondary osteoporosis and its treatment diabetes mellitus[J] .Japan CliniMed,1998,56:1579-1586.[16] Dimai HP, Domej W, Leb G , et al. Bone less in patients with untreated chonic obstructive pulmonary disease is mediatedby an increase in bone resorption associated with hypercapnia [J]. Bone Miner Res,2001,16:2132-2141[17] Cooper C,Atkinson EJ, Jacobsen SJ et al. Population-based study of survival after osteporotic fractures[J].Am J Epidemiol,1993,137:1001-1005.[18] Incalzi RA, et al.Association between corticosteroid use and vertebral fractures in old men withchronic obstructive pulmonary diseases[J]. AM J Respir Crit Care Med,2000,94(11):1079.[19] GanWQ, Man SF,Senthilselvan A, et al. Association between chronic obstructive pulmonarydisease and systemic inflammation: a systematic review and a meta-analysis[J].Thorax, 2004, 59: 574-580.[20] Eid AA, Ionescu AA,Nixon LS, et al. Inflammatory response and body composition in chronicobstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 164: 1414-1418.[21] NishimuraY,Nakata H,Tsussumi M,et al.Relationship between changes of bone mineralcontent and twelve-minute walking distance in men with chronic obstructivepulmonary disease:a longitudinal study[J]. Intern Med 1997,36(7):450-453[22] 中华医学会呼吸病学分会,慢性阻塞性肺疾病学组,慢性阻塞性肺疾病诊治指南(2007年修订版)中华结核与呼吸杂志[J]2007,1(1):8-17 [23] 刘和娣,李恩.糖皮质激素继发骨质疏松的机理.中华骨科杂志[J],1994,4(14):233.[24] 李恩,薛延,王洪复等.骨质疏松鉴别诊断与治疗[M].北京:人民卫生出版社,2005:505。[25]Scanlon PD.Loss of bone density with inhaled triamcinolone in LungHealth Study [J].Am J Resoir Cirt Care Med,2004,170(12)2-9.[26]. Anandarajah AP,Schwarz EM. Anti-RANKL therapy for inflammatory bone disorders: mechanisms andpotential clinical applications[J]. J Cell Bichem. 2006;97: 226–342.[27]. Sabit R, Bolton CE, Edwards PH,et al. Arterial stiffness andosteoporosis in chronic obstructive pulmonary disease[J]. Am J Respir Crit CareMed. 2007;175: 1259–65. [28]. Vogelmeier C,Bals R. Chronic obstructive pulmonary disease and premature aging[J]. Am J RespirCrit Care Med. 2007;175: 1217–21.[29] 王志文.慢性阻塞性肺病和骨质疏松.[J] 四川医学,2003,24(3):363-364.[30] Shane E,Silverberg SJ,Donovan D,etal.Osteeoporosis in patients with chonic obstructive airways disease [J] .Thorax,2004,59(7)574-580[31] 杨福荫,李国忠,黄苗清等. 肺癌病人血清降钙素水平变化的临床意义[J]。北京大学,1991,13(3):132.[32] Shane E, Silverberg SJ, Donovan, et al.Osteoporsis in lung transplantation candidates with end-stage pulmonary disease[J]. The Am J Med 1996,101(3):262-269. [33] A.G.N Agusa, A. Noguera, J. Sauleda, et al.Systemic effects of chronic obstructive pulmonary disease[J]. Eur Respir J.2003,21:347-360.
汪为民 主任医师 淮安市第一人民医院 老年医学科3566人已读 - 精选 卫生部肺癌诊疗指南(2011)
卫生部肺癌诊疗指南(2011)一、概述原发性肺癌(以下简称肺癌)是我国最常见的恶性肿瘤之一。2010年卫生统计年鉴显示,2005年,肺癌死亡率占我国恶性肿瘤死亡率的第1位。河南省肿瘤医院胸外科秦建军为进一步规范我国肺癌诊疗行为,提高医疗机构肺癌诊疗水平,改善肺癌患者预后,保障医疗质量和医疗安全,特制定本规范。二、诊断技术与应用(一)高危因素。有吸烟史并且吸烟指数大于400支/年、高危职业接触史(如接触石棉)以及肺癌家族史等,年龄在45岁以上者,是肺癌的高危人群。(二) 临床表现。1.肺癌早期可无明显症状。当病情发展到一定程度时,常出现以下症状:(1)刺激性干咳。(2)痰中带血或血痰。(3)胸痛。(4)发热。(5)气促。当呼吸道症状超过两周,经治疗不能缓解,尤其是痰中带血、刺激性干咳,或原有的呼吸道症状加重,要高度警惕肺癌存在的可能性。2.当肺癌侵及周围组织或转移时,可出现如下症状:(1)癌肿侵犯喉返神经出现声音嘶哑。(2)癌肿侵犯上腔静脉,出现面、颈部水肿等上腔静脉梗阻综合征表现。(3)癌肿侵犯胸膜引起胸膜腔积液,往往为血性;大量积液可以引起气促。(4)癌肿侵犯胸膜及胸壁,可以引起持续剧烈的胸痛。(5)上叶尖部肺癌可侵入和压迫位于胸廓入口的器官组织,如第一肋骨、锁骨下动、静脉、臂丛神经、颈交感神经等,产生剧烈胸痛,上肢静脉怒张、水肿、臂痛和上肢运动障碍,同侧上眼脸下垂、瞳孔缩小、眼球内陷、面部无汗等颈交感神经综合征表现。(6)近期出现的头痛、恶心、眩晕或视物不清等神经系统症状和体征应当考虑脑转移的可能。(7)持续固定部位的骨痛、血浆碱性磷酸酶或血钙升高应当考虑骨转移的可能。(8)右上腹痛、肝肿大、碱性磷酸酶、谷草转氨酶、乳酸脱氢酶或胆红素升高应当考虑肝转移的可能。(9)皮下转移时可在皮下触及结节。(10)血行转移到其他器官可出现转移器官的相应症状。(三)体格检查。1.多数肺癌患者无明显相关阳性体征。2.患者出现原因不明,久治不愈的肺外征象,如杵状指(趾)、非游走性肺性关节疼痛、男性乳腺增生、皮肤黝黑或皮肌炎、共济失调、静脉炎等。3.临床表现高度可疑肺癌的患者,体检发现声带麻痹、上腔静脉梗阻综合征、Horner征、Pancoast综合征等提示局部侵犯及转移的可能。4.临床表现高度可疑肺癌的患者,体检发现肝肿大伴有结节、皮下结节、锁骨上窝淋巴结肿大等提示远处转移的可能。(四) 影像检查。1.胸部X线检查:胸片是早期发现肺癌的一个重要手段,也是术后随访的方法之一。2.胸部CT检查:胸部CT可以进一步验证病变所在的部位和累及范围,也可大致区分其良、恶性,是目前诊断肺癌的重要手段。低剂量螺旋胸部CT可以有效地发现早期肺癌,而CT引导下经胸肺肿物穿刺活检是重要的获取细胞学、组织学诊断的技术。3.B型超声检查:主要用于发现腹部重要器官以及腹腔、腹膜后淋巴结有无转移,也用于双锁骨上窝淋巴结的检查;对于邻近胸壁的肺内病变或胸壁病变,可鉴别其囊、实性及进行超声引导下穿刺活检;超声还常用于胸水抽取定位。4.MRI检查:MRI检查对肺癌的临床分期有一定价值,特别适用于判断脊柱、肋骨以及颅脑有无转移。5.骨扫描检查:用于判断肺癌骨转移的常规检查。当骨扫描检查提示骨可疑转移时,可对可疑部位进行MRI检查验证。6.PET-CT检查:不推荐常规使用。在诊断肺癌纵隔淋巴结转移时较CT的敏感性、特异性高。(五) 内窥镜检查。1.纤维支气管镜检查:纤维支气管镜检查技术是诊断肺癌最常用的方法,包括纤支镜直视下刷检、活检以及支气管灌洗获取细胞学和组织学诊断。上述几种方法联合应用可以提高检出率。2.经纤维支气管镜引导透壁穿刺纵隔淋巴结活检术(TBNA)和纤维超声支气管镜引导透壁淋巴结穿刺活检术(EBUS-TBNA):经纤维支气管镜引导透壁淋巴结穿刺活检有助于治疗前肺癌TNM分期的精确N2分期。但不作为常规推荐的检查方法,有条件的医院应当积极开展。经纤维超声支气管镜引导透壁淋巴结穿刺活检术(EBUS-TBNA)更能就肺癌N1和N2的精确病理诊断提供安全可靠的支持。3.纵隔镜检查:作为确诊肺癌和评估N分期的有效方法,是目前临床评价肺癌纵隔淋巴结状态的金标准。尽管CT、MRI 以及近年应用于临床的PET-CT能够对肺癌治疗前的N分期提供极有价值的证据,但仍然不能取代纵隔镜的诊断价值。4.胸腔镜检查:胸腔镜可以准确地进行肺癌诊断和分期,对于经纤维支气管镜和经胸壁肺肿物穿刺针吸活检术(TTNA)等检查方法无法取得病理标本的早期肺癌,尤其是肺部微小结节病变行胸腔镜下病灶切除,即可以明确诊断。对于中晚期肺癌,胸腔镜下可以行淋巴结、胸膜和心包的活检,胸水及心包积液的细胞学检查,为制定全面治疗方案提供可靠依据。(六) 其他检查技术。1.痰细胞学检查:痰细胞学检查是目前诊断肺癌简单方便的无创伤性诊断方法之一,连续三天留取清晨深咳后的痰液进行痰细胞学涂片检查可以获得细胞学的诊断。2.经胸壁肺内肿物穿刺针吸活检术(TTNA):TTNA可以在CT或B超引导下进行,在诊断周围型肺癌的敏感度和特异性上均较高。3.胸腔穿刺术:当胸水原因不清时,可以进行胸腔穿刺,以进一步获得细胞学诊断,并可以明确肺癌的分期。4.胸膜活检术:当胸水穿刺未发现细胞学阳性结果时,胸膜活检可以提高阳性检出率。5.浅表淋巴结活检术:对于肺部占位病变或已明确诊断为肺癌的患者,如果伴有浅表淋巴结肿大,应当常规进行浅表淋巴结活检,以获得病理学诊断,进一步判断肺癌的分期,指导临床治疗。(七) 血液免疫生化检查。1.血液生化检查:对于原发性肺癌,目前无特异性血液生化检查。肺癌患者血浆碱性磷酸酶或血钙升高考虑骨转移的可能,血浆碱性磷酸酶、谷草转氨酶、乳酸脱氢酶或胆红素升高考虑肝转移的可能。2.血液肿瘤标志物检查:目前尚并无特异性肺癌标志物应用于临床诊断,故不作为常规检查项目,但有条件的医院可以酌情进行如下检查,作为肺癌评估的参考:(1)癌胚抗原(carcinoembryonic antigen,CEA):目前血清中CEA的检查主要用于判断肺癌预后以及对治疗过程的监测。(2)神经特异性烯醇化酶(neurone specific enolase,NSE):是小细胞肺癌首选标志物,用于小细胞肺癌的诊断和治疗反应监测。(3)细胞角蛋白片段19(cytokeratin fragment,CYFRA21-1):对肺鳞癌诊断的敏感性、特异性有一定参考意义。(4)鳞状细胞癌抗原(squarmous cell carcinoma antigen,SCC):对肺鳞状细胞癌疗效监测和预后判断有一定价值。(八) 组织学诊断。组织病理学诊断是肺癌确诊和治疗的依据。活检确诊为肺癌时,应当进行规范化治疗。如因活检取材的限制,活检病理不能确定病理诊断时,建议临床医师重复活检或结合影像学检查情况进一步选择诊疗方案,必要时临床与病理科医师联合会诊确认病理诊断。(九)肺癌的鉴别诊断。1.良性肿瘤:常见的有肺错构瘤、支气管肺囊肿、巨大淋巴结增生、炎性肌母细胞瘤、硬化性血管瘤、结核瘤、动静脉瘘和肺隔离症等。这些良性病变在影像检查上各有其特点,若与恶性肿瘤不易区别时,应当考虑手术切除。2.结核性病变:是肺部疾病中较常见也是最容易与肺癌相混淆的病变。临床上容易误诊误治或延误治疗。对于临床上难于鉴别的病变,应当反复做痰细胞学检查、纤维支气管镜检查及其他辅助检查,直至开胸探查。在明确病理或细胞学诊断前禁忌行放射治疗(以下简称放疗)或化学药物治疗(以下简称化疗),但可进行诊断性抗结核治疗及密切随访。结核菌素试验阳性不能作为排除肺癌的指标。3.肺炎:大约有1/4的肺癌早期以肺炎的形式出现。对起病缓慢,症状轻微,抗炎治疗效果不佳或反复发生在同一部位的肺炎应当高度警惕有肺癌可能。4.其他:包括发生在肺部的一些少见、罕见的良、恶性肿瘤,如肺纤维瘤、肺脂肪瘤等,术前往往难以鉴别。三、病理评估(一)肺癌的标本固定标准。1.固定液:推荐使用10%中性福尔马林固定液,避免使用含有重金属的固定液。2.固定液量:必须为所固定标本体积的10倍或以上。3.固定温度:常温。4.按照收到标本时肿瘤的部位和状态,可有两种选择:(1)标本直接放入10%中性福尔马林固定。(2)必要时从支气管注入足够量的10%中性福尔马林固定液,结扎或钳住支气管,固定过夜。5.固定时间:活检标本:≥6小时,≤48小时;手术标本:≥12小时,≤48小时。(二) 取材要求。1. 活检标本。(1)核对临床送检活检标本数量,送检活检标本必须全部取材。(2)每个蜡块内包括不超过5粒活检标本。(3)将标本包于纱布或柔软的透水纸中以免丢失。2. 手术标本。(1)局部肺脏切除标本(肺段切除和肺楔形切除标本)。①去除外科缝合线或金属钉。②记录标本的大小以及胸膜表面的情况。③垂直切缘切取肺实质组织块,描述肿块的大小、切面情况(伴有/无出血/坏死/空洞形成)及其与胸膜和肺实质的关系以及肿块边缘与切缘的距离。④根据病变的部位和大小取1-4块组织,切取肿瘤与胸膜、肿瘤与肺实质切缘的组织块。⑤切取非肿瘤部位肺组织。(2)肺叶及全肺切除标本。①检查肺的五大基本结构:气道、肺实质、胸膜、血管和淋巴结。测量大小,以肺门给标本定位。②取支气管切缘、血管切缘及胸膜缘。③全肺切除标本,查找肺门淋巴结。④按照收到标本时肿瘤的部位和状态,可有两种选择:一是用剪刀沿纵轴打开所有的主支气管及其分支,以能最好地暴露病变与周围肺组织结构关系的平面剖开肺组织。二是对主支气管内注入福尔马林的标本,每隔0.5-1.0cm切开,切面应为额平面,垂直于肺门。⑤描述肿瘤大小、切面情况(伴有/无出血/坏死/空洞形成)、在肺叶和肺段内的位置以及与支气管的关系、病变范围(局灶或转移)以及切除是否充分。视肿瘤大小、发生部位、范围等充分取材(常规4块),并切取能够显示肿瘤与周围肺组织关系的组织(常规2块)。⑥切取非肿瘤部位肺组织。(3)淋巴结。建议外科医师采用美国癌症联合会(American Joint Committee on Cancer,AJCC)关于术中分期系统的区域淋巴结分组方式(N)对淋巴结进行分组。N2淋巴结通常单独送检并由外科医师进行准确的分组,因此应当单独报告这些淋巴结。肺切除标本常附带的N2淋巴结,应当根据具体部位区分。沿支气管查找肺门软组织及肺实质中的淋巴结,查找到的全部淋巴结均需取材,记录部位。所有肉眼阴性的淋巴结应当完整送检,肉眼阳性的淋巴结可部分切取送检。(4)推荐取材组织块体积:不大于2 cm x1.5 cm x0.3cm。3. 取材后标本处理原则和保留时限。(1)剩余标本的保存。取材剩余组织保存在标准固定液中,并始终保持充分的固定液量和甲醛浓度,避免标本干枯或因固定液量不足或浓度降低而致组织腐变;以备在病理诊断报告签发后接到临床反馈信息时复查大体标本或补充取材。(2)剩余标本处理的时限。建议在病理诊断报告签发1个月后,未接到临床反馈信息,未发生因外院会诊意见分歧而要求复审等情形后,由医院自行处理。4. 病理类型。(1)肺癌的大体类型:直接描写肿瘤的部位,记录肿瘤距隆突的长度。(2)肺癌的组织学类型:参照2004版WHO肺癌组织学分类(附件1)。5.病理报告内容。(1)活检标本的病理报告内容和要求。①患者基本信息及送检信息。②如有上皮内瘤变(异型增生),报告分级。③如有癌变,区分组织学类型。(2)手术标本的病理报告内容和要求。①患者基本信息及送检信息。②大体情况:测量肺的大小,描述其他附带的结构;描述肿瘤与肺叶、肺段和(或)主气道和胸膜的关系;描述肿瘤距支气管切缘的远近,必要时说明距其他切缘的远近(即胸壁软组织肺门血管);描述肿瘤大小,是否有卫星结节;描述非肿瘤性肺组织。③诊断报告内容:一是肿瘤部位:肿瘤位于哪一侧肺、肺叶,如果可能,说明具体的肺段。二是手术类型:即肺段切除、肺叶切除、肺切除,包括部分肺切除。三是组织学类型,具体包括以下几个方面:组织学分级、切缘的组织学评价、累及胸膜情况、血管淋巴管的侵润情况、神经周围的侵润情况、淋巴结转移情况等。④鉴别诊断相关的主要免疫组化项目:鳞状细胞癌重点筛查CK14、CK5/6、34βE12和p63;肺腺癌重点筛查CK7和TTF-l;肺神经内分泌癌重点筛查CK18、AE1/AE3、CD56、CgA、NSE和Syn。⑤需要时可选做用药及预后相关的检测项目:HER2、VEGF、p53、p170、Top2A、PCNA、Ki-67。完整的病理报告的前提是临床医师填写详细的病理诊断申请单,详细描述手术所见及相关临床辅助检查结果并清楚标记淋巴结。临床医师与病理医师的相互交流、信任和配合是建立正确分期和指导临床治疗的基础。四、肺癌的分期(一)非小细胞肺癌。目前非小细胞肺癌的TNM分期采用国际肺癌研究协会(IASLC)2009年第七版分期标准(IASLC 2009)。1. 肺癌TNM分期中T、N、M的定义。(1)原发肿瘤(T)。TX :原发肿瘤不能评估,或痰、支气管冲洗液找到癌细胞但影像学或支气管镜没有可见的肿瘤。T0 :没有原发肿瘤的证据。Tis:原位癌。T1:肿瘤最大径≤3cm,周围被肺或脏层胸膜所包绕,支气管镜下肿瘤侵犯没有超出叶支气管(即没有累及主支气管)。T1a:肿瘤最大径≤2cm。T1b:肿瘤最大径 >2cm且≤3cm。T2:肿瘤大小或范围符合以下任何一项:肿瘤最大径>3cm; 但不超过7cm;累及主支气管,但距隆突≥2cm;累及脏层胸膜;扩展到肺门的肺不张或阻塞性肺炎,但不累及全肺。T2a:肿瘤最大径≤5cm,且符合以下任何一点:肿瘤最大径>3cm;累及主支气管,但距隆突≥2cm;累及脏层胸膜;扩展到肺门的肺不张或阻塞性肺炎,但不累及全肺。T2b:肿瘤最大径>5cm且≤7cm。T3:任何大小的肿瘤已直接侵犯了下述结构之一者:胸壁(包括肺上沟瘤)、膈肌、纵隔胸膜、心包;或肿瘤位于距隆突2cm以内的主支气管,但尚未累及隆突;或全肺的肺不张或阻塞性肺炎。肿瘤最大径>7cm;与原发灶同叶的单个或多个的卫星灶。T4:任何大小的肿瘤已直接侵犯了下述结构之一者:纵隔、心脏、大血管、气管、食管、喉返神经、椎体、隆突;或与原发灶不同叶的单发或多发病灶。(2)区域淋巴结(N)。NX:区域淋巴结不能评估。N0:无区域淋巴结转移。N1:转移至同侧支气管旁淋巴结和(或)同侧肺门淋巴结,和肺内淋巴结,包括原发肿瘤直接侵犯。N2:转移至同侧纵隔和(或)隆突下淋巴结。N3:转移至对侧纵隔、对侧肺门淋巴结、同侧或对侧斜角肌或锁骨上淋巴结。(3)远处转移(M)。MX:远处转移不能评估。M0:无远处转移。M1:有远处转移。M1a:胸膜播散(包括恶性胸膜积液、恶性心包积液、胸膜转移结节);对侧肺叶的转移性结节。M1b:胸腔外远处转移。大部分肺癌患者的胸腔积液(或心包积液)是由肿瘤所引起的。但如果胸腔积液(或心包积液)的多次细胞学检查未能找到癌细胞,胸腔积液(或心包积液)又是非血性或非渗出性的,临床判断该胸腔积液(或心包积液)与肿瘤无关,这种类型的胸腔积液(或心包积液)不影响分期。2.肺癌TNM分期(IASLC 2009)。肺癌TNM分期(IASLC 2009)分期TNM隐形肺癌Tx,N0,M00Tis,N0,M0IAT1a,b,N0,M0IBT2a,N0,M0IIAT1a,b,N1,M0T2a,N1,M0T2b,N0,M0IIBT2,N1,M0T3,N0,M0IIIAT1,N2,M0T2,N2,M0T3,N1,M0T3,N2,M0T4,N0,M0T4,N1,M0IIIBT4,N2,M0任何T,N3,M0IV任何T,任何N,M1a,b(二)小细胞肺癌。小细胞肺癌分期:对于接受非手术的患者采用局限期和广泛期分期方法,对于接受外科手术的患者采用国际肺癌研究协会(IASLC)2009年第七版分期标准。五、治疗(一)治疗原则。应当采取综合治疗的原则,即:根据患者的机体状况,肿瘤的细胞学、病理学类型,侵及范围(临床分期)和发展趋向,采取多学科综合治疗(MDT)模式,有计划、合理地应用手术、化疗、放疗和生物靶向等治疗手段,以期达到根治或最大程度控制肿瘤,提高治愈率,改善患者的生活质量,延长患者生存期的目的。目前肺癌的治疗仍以手术治疗、放射治疗和药物治疗为主。(二)外科手术治疗。1.手术治疗原则。手术切除是肺癌的主要治疗手段,也是目前临床治愈肺癌的唯一方法。肺癌手术分为根治性手术与姑息性手术,应当力争根治性切除。以期达到最佳、彻底的切除肿瘤,减少肿瘤转移和复发,并且进行最终的病理TNM分期,指导术后综合治疗。对于可手术切除的肺癌应当遵守下列外科原则:(1)全面的治疗计划和必要的影像学检查(临床分期检查)均应当在非急诊手术治疗前完成。充分评估决定手术切除的可能性并制订手术方案。(2)尽可能做到肿瘤和区域淋巴结的完全性切除;同时尽量保留有功能的健康肺组织。(3)电视辅助胸腔镜外科手术(VATS)是近年来发展较快的微创手术技术,主要适用于I期肺癌患者。(4)如果患者身体状况允许,应当行解剖性肺切除术(肺叶切除、支气管袖状肺叶切除或全肺切除术)。如果身体状况不允许,则行局限性切除:肺段切除(首选)或楔形切除,亦可选择VATS术式。(5)完全性切除手术(R0手术)除完整切除原发病灶外,应当常规进行肺门和纵隔各组淋巴结(N1和N2淋巴结)切除并标明位置送病理学检查。最少对3个纵隔引流区(N2站)的淋巴结进行取样或行淋巴结清除,尽量保证淋巴结整块切除。建议右胸清除范围为:2R、3a,3p、4R、7-9组淋巴结以及周围软组织;左胸清除范围为:4L、5-9组淋巴结以及周围软组织。(6)术中依次处理肺静脉、肺动脉,最后处理支气管。(7)袖状肺叶切除术在术中快速病理检查保证切缘(包括支气管、肺动脉或静脉断端)阴性的情况下,尽可能行保留更多肺功能(包括支气管或肺血管),术后患者生活质量优于全肺切除术患者。(8)肺癌完全性切除术后6个月复发或孤立性肺转移者,在排除肺外远处转移情况下,可行复发侧余肺切除或肺转移病灶切除。(9)心肺功能等机体状况经评估无法接受手术的I期和II期的患者,可改行根治性放疗、射频消融治疗以及药物治疗等。2.手术适应证。(1)Ⅰ、Ⅱ期和部分Ⅲa期(T3N1-2M0;T1-2N2M0;T4N0-1M0可完全性切除)非小细胞肺癌和部分小细胞肺癌(T1-2N0~1M0)。(2)经新辅助治疗(化疗或化疗加放疗)后有效的N2期非小细胞肺癌。(3)部分Ⅲb期非小细胞肺癌(T4N0-1M0)如能局部完全切除肿瘤者,包括侵犯上腔静脉、其他毗邻大血管、心房、隆凸等。(4)部分Ⅳ期非小细胞肺癌,有单发对侧肺转移,单发脑或肾上腺转移者。(5)临床高度怀疑肺癌的肺内结节,经各种检查无法定性诊断,可考虑手术探查。3.手术禁忌证(1)全身状况无法耐受手术,心、肺、肝、肾等重要脏器功能不能耐受手术者。(2)绝大部分诊断明确的Ⅳ期、大部分Ⅲb期和部分Ⅲa期非小细胞肺癌,以及分期晚于T1-2N0-1M0期的小细胞肺癌。(三)放射治疗。肺癌放疗包括根治性放疗、姑息放疗、辅助放疗和预防性放疗等。1.放疗的原则。(1)对根治性放疗适用于KPS评分≥70分(Karnofsky评分见附件2)的患者,包括因医源性或/和个人因素不能手术的早期非小细胞肺癌、不可切除的局部晚期非小细胞肺癌、以及局限期小细胞肺癌。(2)姑息性放疗适用于对晚期肺癌原发灶和转移灶的减症治疗。对于非小细胞肺癌单发脑转移灶手术切除患者可以进行全脑放疗。(3)辅助放疗适应于术前放疗、术后切缘阳性的患者,对于术后pN2阳性的患者,鼓励参加临床研究。(4)术后放疗设计应当参考患者手术病理报告和手术记录。(5)预防性放疗适用于全身治疗有效的小细胞肺癌患者全脑放疗。(6)放疗通常联合化疗治疗肺癌,因分期、治疗目的和患者一般情况的不同,联合方案可选择同步放化疗、序贯放化疗。建议同步放化疗方案为EP和含紫衫类方案。(7)接受放化疗的患者,潜在毒副反应会增大,治疗前应当告知患者;放疗设计和实施时,应当注意对肺、心脏、食管和脊髓的保护;治疗过程中应当尽可能避免因毒副反应处理不当导致的放疗非计划性中断。(8)建议采用三维适型放疗(3DCRT)与调强放疗技术(IMRT)等先进的放疗技术。(9)接受放疗或放化疗的患者,治疗休息期间应当予以充分的监测和支持治疗。2.非小细胞肺癌(NSCLC)放疗的适应证。放疗可用于因身体原因不能手术治疗的早期NSCLC患者的根治性治疗、可手术患者的术前、术后辅助治疗、局部晚期病灶无法切除患者的局部治疗以及晚期不可治愈患者的重要姑息治疗方式。I期不能接受手术治疗的NSCLC患者,放射治疗是有效的局部控制病灶的手段之一。对于接受手术治疗的NSCLC患者,如果术后病理手术切缘阴性而纵隔淋巴结阳性(pN2),除了常规接受术后辅助化疗外,也建议加用术后放疗。对于切缘阳性的pN2肿瘤,如果患者身体许可,建议采用术后同步放化疗。对切缘阳性的患者,放疗应当尽早开始。对于因身体原因不能接受手术的II-III期NSCLC患者,如果身体条件许可,应当给予适形放疗结合同步化疗。在有治愈希望的患者,在接受放疗或同步放化疗时,通过更为适行的放疗计划和更为积极的支持治疗,尽量减少治疗时间的中断或治疗剂量的降低。对于有广泛转移的IV期NSCLC患者,部分患者可以接受原发灶和转移灶的放射治疗以达到姑息减症的目的。3.小细胞肺癌(SCLC)放疗的适应证。局限期SCLC经全身化疗后部分患者可以达到完全缓解,但是如果不加用胸部放疗,胸内复发的风险很高,加用胸部放疗不仅可以显著降低局部复发率,而且死亡风险也显著降低。在广泛期SCLC患者,远处转移灶经化疗控制后加用胸部放疗也可以提高肿瘤控制率,延长生存期。如果病情许可,小细胞肺癌的放射治疗应当尽早开始,可以考虑与化疗同步进行。如果病灶巨大,放射治疗导致肺损伤的风险过高的话,也可以考虑先采用2-3周期的化疗,然后尽快开始放疗。4.预防性脑照射。局限期小细胞肺癌患者,在胸内病灶经治疗达到完全缓解后推荐加用预防性脑照射。广泛期小细胞肺癌在化疗有效的情况下,加用预防性脑照射亦可降低小细胞肺癌脑转移的发生的风险。而非小细胞肺癌全脑预防照射的决定应当是医患双方充分讨论,根据每个患者的情况权衡利弊后确定。5.晚期肺癌患者的姑息放疗。晚期肺癌患者的姑息放疗主要目的是为了解决因原发灶或转移灶导致的局部压迫症状、骨转移导致的疼痛、以及脑转移导致的神经症状等。对于此类患者可以考虑采用低分割照射技术,使患者更方便得到治疗,同时可以更迅速地缓解症状。6.治疗效果。放射治疗的疗效评价参照WHO实体瘤疗效评价标准(附件3)或RECIST疗效评价标准(附件4)。7.防护。采用常规的放疗技术,应当注意对肺、心脏、食管和脊髓的保护,以避免对身体重要器官的严重放射性损伤。急性放射性肺损伤参照RTOG分级标准(附件5)。(四)肺癌的药物治疗。肺癌的药物治疗包括化疗和分子靶向药物治疗(EGFR-TKI治疗)。化疗分为姑息化疗、辅助化疗和新辅助化疗,应当严格掌握临床适应证,并在肿瘤内科医师的指导下施行。化疗应当充分考虑患者病期、体力状况、不良反应、生活质量及患者意愿,避免治疗过度或治疗不足。应当及时评估化疗疗效,密切监测及防治不良反应,并酌情调整药物和(或)剂量。化疗的适应证为:PS评分≤2(附件6,ZPS评分,5分法),重要脏器功能可耐受化疗,对于SCLC的化疗PS评分可放宽到3。鼓励患者参加临床试验。1.晚期NSCLC的药物治疗。(1)一线药物治疗。含铂两药方案为标准的一线治疗;EGFR突变患者,可选择靶向药物的治疗;有条件者,在化疗基础上可联合抗肿瘤血管药物。目前可选用的化疗药物见附件7。对一线治疗达到疾病控制(CR+PR+SD)的患者,有条件者可选择维持治疗。(2)二线药物治疗。二线治疗可选择的药物包括多西紫杉醇、培美曲塞以及靶向药物EGFR-TKI。(3)三线药物治疗。可选择EGFR-TKI或进入临床试验。2.不能手术切除的NSCLC的药物治疗。推荐放疗、化疗联合,根据具体情况可选择同步或序贯放化疗。同步治疗推荐化疗药物为足叶乙甙/顺铂或卡铂(EP/EC)与紫杉醇或多西紫杉醇/铂类。序贯治疗化疗药物见一线治疗。3.NSCLC的围手术期辅助治疗。完全切除的II-III期NSCLC,推荐含铂两药方案术后辅助化疗3-4个周期。辅助化疗始于患者术后体力状况基本恢复正常,一般在术后3-4周开始。新辅助化疗:对可切除的III期NSCLC可选择含铂两药、2个周期的术前新辅助化疗。应当及时评估疗效,并注意判断不良反应,避免增加手术并发症。手术一般在化疗结束后2-4周进行。术后辅助治疗应当根据术前分期及新辅助化疗疗效,有效者延续原方案或根据患者耐受性酌情调整,无效者则应当更换方案。4.小细胞肺癌(SCLC)的药物治疗。局限期小细胞肺癌(II-III期)推荐放、化疗为主的综合治疗。化疗方案推荐EP或EC方案。广泛期小细胞肺癌(IV期)推荐化疗为主的综合治疗。化疗方案推荐EP、EC或顺铂加拓扑替康(IP)或加伊立替康(IC)。二线方案推荐拓扑替康。鼓励患者参加新药临床研究。5.肺癌化疗的原则。(1) KPS<60或ECOG>2的肺癌患者不宜进行化疗。(2)白细胞少于3.0×109/L,中性粒细胞少于1.5×109/L、血小板少于6×1010/L,红细胞少于2×1012/L、血红蛋白低于8.0g/dl的肺癌患者原则上不宜化疗。(3)肺癌患者肝、肾功能异常,实验室指标超过正常值的2倍,或有严重并发症和感染、发热,出血倾向者不宜化疗。(4)在化疗中如出现以下情况应当考虑停药或更换方案:治疗2周期后病变进展,或在化疗周期的休息期中再度恶化者,应当停止原方案,酌情选用其他方案;化疗不良反应达3-4级,对患者生命有明显威胁时,应当停药,下次治疗时改用其他方案;出现严重的并发症,应当停药,下次治疗时改用其他方案。(5)必须强调治疗方案的规范化和个体化。必须掌握化疗的基本要求。除常规应用止吐药物外,铂类药物除卡铂外需要水化和利尿。化疗后每周两次检测血常规。(6)化疗的疗效评价参照WHO实体瘤疗效评价标准或RECIST疗效评价标准。(五)非小细胞肺癌的分期治疗模式。1.Ⅰ期非小细胞肺癌的综合治疗。(1)首选手术治疗,包括肺叶切除加肺门、纵隔淋巴结清除术,可采用开胸或VATS等术式。(2)对于肺功能差的患者可以考虑行解剖性肺段或楔形切除术加肺门、纵隔淋巴结清除术。(3)完全切除的IA期肺癌患者不适宜行术后辅助化疗。(4)完全切除的IB期患者,不推荐常规应用术后辅助化疗。(5)切缘阳性的Ⅰ期肺癌推荐再次手术。其他任何原因无法再次手术的患者,推荐术后化疗加放疗。2.Ⅱ期非小细胞肺癌的综合治疗。(1)首选手术治疗,包括肺叶、双肺叶或全肺切除加肺门、纵隔淋巴结清除术。(2)对肺功能差的患者可以考虑行解剖性肺段或楔形切除术加肺门、纵隔淋巴结清除术。(3)完全性切除的Ⅱ期非小细胞肺癌推荐术后辅助化疗。(4)当肿瘤侵犯壁层胸膜或胸壁时应当行整块胸壁切除。切除范围至少距病灶最近的肋骨上下缘各2cm,受侵肋骨切除长度至少应当距肿瘤5cm。(5)切缘阳性的Ⅱ期肺癌推荐再次手术,其他任何原因无法再次手术的患者,推荐术后化疗加放疗。3.Ⅲ期非小细胞肺癌的综合治疗。局部晚期非小细胞肺癌是指TNM分期为III期的肺癌。采取综合治疗模式是III非小细胞肺癌治疗的最佳选择。将局部晚期NSCLC分为可切除和不可切除两大类。其中:(1)可切除的局部晚期非小细胞肺癌包括:①T3N1的NSCLC患者,首选手术治疗,术后行辅助化疗。②N2期肺癌患者的手术切除是有争议的。影像学检查发现单组纵隔淋巴结肿大、或两组纵隔淋巴结肿大但没有融合估计能完全切除的病例,推荐行术前纵隔镜检查,明确诊断后行术前新辅助化疗,然后行手术治疗。③一些T4N0-1的患者:a)相同肺叶内的卫星结节:在新的分期中,此类肺癌为T3期,首选治疗为手术切除,也可选择术前新辅助化疗,术后辅助化疗。b)其他可切除之T4N0-1期非小细胞肺癌,可酌情首选新辅助化疗,也可选择手术切除。如为完全性切除,考虑术后辅助化疗。如切缘阳性,术后行放疗和含铂方案化疗。④肺上沟瘤的治疗:部分可手术患者,建议先行同步放化疗,然后再手术+辅助化疗。对于不能手术的肺上沟瘤,行放疗加化疗。(2)不可切除的局部晚期非小细胞肺癌包括:①影像学检查提示纵隔的团块状阴影,纵隔镜检查阳性的非小细胞肺癌。②大部分的T4和N3的非小细胞肺癌。③T4N2-3的患者。④胸膜转移结节、恶性胸水和恶性心包积液的患者,新分期已经归类为M1,不适于手术切除。部分病例可采用胸腔镜胸膜活检或胸膜固定术。4.Ⅳ期非小细胞肺癌的治疗。Ⅳ期肺癌在开始治疗前,建议先获取肿瘤组织进行表皮生长因子受体(EGFR)是否突变的检测,根据EGFR突变状况制定相应的治疗策略。Ⅳ期肺癌以全身治疗为主要手段,治疗目的为提高患者生活质量、延长生命。(1)孤立性转移Ⅳ期肺癌的治疗。①孤立性脑转移而肺部病变又为可切除的非小细胞肺癌,脑部病变可手术切除或采用立体定向放射治疗,胸部原发病变则按分期治疗原则进行。②孤立性肾上腺转移而肺部病变又为可切除的非小细胞肺癌,肾上腺病变可考虑手术切除,胸部原发病变则按分期治疗原则进行。③对侧肺或同侧肺其他肺叶的孤立结节,可分别按两个原发瘤各自的分期进行治疗。(2)Ⅳ期肺癌的全身治疗。①EGFR敏感突变的Ⅳ期非小细胞肺癌,推荐吉非替尼或厄洛替尼一线治疗。②对EGFR野生型或突变状况未知的Ⅳ期非小细胞肺癌,如果功能状态评分为PS=0~1,应当尽早开始含铂两药的全身化疗。对不适合铂类治疗的患者,可考虑非铂类两药联合化疗。③PS=2的晚期非小细胞肺癌患者应接受单药化疗,但没有证据支持对PS>2的患者使用细胞毒类药化疗。④目前的证据不支持将年龄因素作为选择化疗方案的依据。⑤一线化疗失败的非小细胞肺癌,推荐多西紫杉醇、培美曲赛二线化疗,以及吉非替尼或厄洛替尼厄二线或三线口服治疗。⑥评分为PS>2的Ⅳ期非小细胞肺癌,可酌情仅采用最佳支持治疗。在全身治疗基础上针对具体的局部情况可以选择恰当的局部治疗方法以求改善症状、提高生活质量。(六)小细胞肺癌分期治疗模式。1.I期SCLC。手术+辅助化疗(EP/EC 4-6周期)。2.II-III期SCLC:放、化疗联合。(1)可选择序贯或同步。(2)序贯治疗推荐2周期诱导化疗后同步化、放疗。(3)经过规范治疗达到疾病控制者,推荐行预防性脑照射(PCI)。3.IV期SCLC:化疗为主的综合治疗以期改善生活质量。一线推荐EP/EC、IP、IC。规范治疗3个月内疾病复发进展患者推荐进入临床试验。3-6个月内复发者推荐拓扑替康、伊立替康、吉西他滨或紫杉醇治疗。6个月后疾病进展可选择初始治疗方案。六、诊疗流程和随访(一)肺癌诊疗流程。肺癌诊断与治疗的一般流程见附件8。(二)随访。对于新发肺癌患者应当建立完整病案和相关资料档案,诊治后定期随访和进行相应检查。具体检查方法包括病史、体检、血液学检查、影像学检查、内镜检查等,旨在监测疾病复发或治疗相关不良反应、评估生活质量等。随访频率为治疗后2年内每3~6个月随访一次,2~5年内每6个月随访一次,5年后每年随访一次。附件:1. 2004年WHO肺癌组织学类型2. Karnofsky评分(KPS,百分法)3. WHO实体瘤疗效评价标准4. RECIST疗效评价标准5. 急性放射性肺损伤RTOG分级标准6. Zubrod-ECOG-WHO 评分(ZPS,5分法)7. 常用的NSCLC一线化疗方案8. 肺癌诊疗流程附件12004年WHO肺癌组织学类型鳞状细胞癌鳞状细胞癌,乳头状亚型鳞状细胞癌,透明细胞亚型鳞状细胞癌,小细胞亚型鳞状细胞癌,基底细胞亚型小细胞癌复合性小细胞癌腺癌腺癌,混合型腺泡状腺癌乳头状腺癌细支气管肺泡癌细支气管肺泡癌,非黏液性细支气管肺泡癌。黏液性细支气管肺泡癌,黏液及非黏液混合性或不能确定伴黏液产生的实性腺癌胎儿性腺癌黏液性(胶样)腺癌黏液性囊腺癌印戒细胞癌透明细胞腺癌大细胞癌大细胞神经内分泌癌复合性大细胞神经内分泌癌基底细胞样癌淋巴上皮样癌透明细胞癌大细胞癌伴有横纹肌样表型腺鳞癌肉瘤样癌多形性癌梭形细胞癌巨细胞癌癌肉瘤肺母细胞瘤类癌典型类癌不典型类癌唾液腺肿瘤黏液表皮样癌腺样囊性癌上皮-肌上皮癌癌前病变原位鳞状细胞癌不典型腺瘤样增生弥漫性特发性肺神经内分泌细胞增生附件2Karnofsky评分(KPS,百分法)1009080706050403020100健康状况正常,无主诉和明显客观症状和体征。能正常活动,有轻微症状和体征。勉强可进行正常活动,有一些症状或体征。生活可自理,但不能维持正常生活或工作。生活能大部分自理,但偶尔需要别人帮助,不能从事正常工作。生活大部分不能自理,经常治疗和护理。生活不能自理,需专科治疗和护理。生活完全失去自理能力,需要住院和积极的支持治疗。病情严重,必须接受支持治疗。垂危,病情急剧恶化,临近死亡。死亡。附件3WHO实体瘤疗效评价标准1.完全缓解(CR):肿瘤完全消失超过1个月。2.部分缓解(PR):肿瘤最大直径及最大垂直直径的乘积缩小达50%,其他病变无增大,持续超过1个月。3.病变稳定(SD):病变两径乘积缩小不超过50%,增大不超过25%,持续超过1个月。4.病变进展(PD):病变两径乘积增大超过25%。附件4RECIST疗效评价标准目标病灶的评价:完全缓解(CR):所有目标病灶消失。部分缓解(PR):目标病灶最长径之和与基线状态比较,至少减少30%。病变进展(PD):目标病灶最长径之和与治疗开始之后所记录到的最小的目标病灶最长径之和比较,增加20%,或者出现一个或多个新病灶。病变稳定(SD):介于部分缓解和疾病进展之间。非目标病灶的评价:完全缓解(CR):所有非目标病灶消失和肿瘤标志物恢复正常。未完全缓解/稳定(IR/SD):存在一个或多个非目标病灶和/或肿瘤标志物持续高于正常值。病变进展(PD):出现一个或多个新病灶和/或已有的非目标病灶明确进展。最佳总疗效的评价:是指从治疗开始到疾病进展或复发之间所测量到的最小值。通常,患者最好疗效的分类由病灶测量和确认组成。附件5急性放射性肺损伤RTOG分级标准0级:无变化。1级:轻度干咳或劳累时呼吸困难。2级:持续咳嗽需麻醉性止咳药/稍活动即呼吸困难,但休息时无呼吸困难。3级:重度咳嗽,对麻醉性止咳药无效,或休息时呼吸困难/临床或影像有急性放射性肺炎的证据/间断吸氧或可能需类固醇治疗。4级:严重呼吸功能不全/持续吸氧或辅助通气治疗。5级:致命性。附件6Zubrod-ECOG-WHO 评分(ZPS,5分法)012345正常活动。症状轻,生活自理,能从事轻体力活动。能耐受肿瘤的症状,生活自理,但白天卧床时间不超过50%。肿瘤症状严重,白天卧床时间超过50%,但还能起床站立,部分生活自理。病重卧床不起。死亡。附件7常用的NSCLC一线化疗方案化疗方案剂量(mg/m2)用药时间时间及周期NP:长春瑞滨25d1,d8顺铂80d1q21d×4TP:紫杉醇135-175d1顺铂75d1或卡铂AUC=5-6d1q21d×4GP:吉西他滨1250d1,d8顺铂75d1或卡铂AUC=5-6d1q21d×4DP:多烯紫杉醇75d1顺铂75d1或卡铂AUC=5-6d1q21d×4
汪为民 主任医师 淮安市第一人民医院 老年医学科1418人已读 - 老年人出现营养不良和肌肉减少,如何治疗和预防?
老年人营养不良和肌肉减少(肌少症)是常见的健康问题,需综合干预。以下是治疗与管理的核心要点:一、营养支持1. 高蛋白饮食-目标:每日蛋白质摄入量1.2-1.5g/kg(如60kg老人需72-90g),优先选择优质蛋白(乳清蛋白、鸡蛋、鱼肉、豆类)。-分餐策略:将全天蛋白质分散到3-5餐,每餐至少20-30g(如1个鸡蛋+1杯牛奶约含20g蛋白)。-加餐补充:两餐间添加高蛋白零食(如蛋白粉、希腊酸奶、坚果糊)。2. 热量与营养素-热量目标:每日30-35kcal/kg,确保摄入>基础代谢率(可通过Harris-Benedict公式计算)。-维生素与矿物质:补充维生素D(800-1000IU/天)、钙(1000-1200mg/天)、锌(15mg/天)及复合维生素。-ω-3脂肪酸:每周2次深海鱼(如三文鱼)或补充鱼油(1000mgEPA+DHA/天)。3. 特殊营养干预-口服营养补充剂(ONS):若经口摄入不足,选用高蛋白配方(如安素、能全素)。-肠内营养:严重吞咽障碍或吸收不良者,通过鼻饲管或胃造瘘提供全营养配方。-静脉营养:短期(≤7天)用于无法经肠摄入且存在严重营养不良者。二、运动干预1. 抗阻训练(核心)-频率:每周3次,每次30-45分钟。-内容:针对大肌群(腿、背、胸)的渐进式训练,如深蹲、俯卧撑等-强度:从10-15RM(重复次数最大值)开始,逐步增加负荷。2. 有氧运动-每周3-5次,每次20-30分钟,如快走、太极拳、水中步行。-目标心率:(220-年龄)×60%-70%。3. 平衡与柔韧性训练-每天进行,如单腿站立、瑜伽、拉伸,预防跌倒。三、药物治疗1. 蛋白质合成促进剂-睾酮:男性肌少症患者可考虑(需监测前列腺和心血管风险)。-生长激素:仅用于特定病例(如HIV相关肌少症),副作用显著需谨慎。-选择性雄激素受体调节剂(SARM):研究中,尚未广泛应用。2. 其他药物-维生素D:纠正缺乏状态(目标血25-OH-D>30ng/mL)。-β-受体阻滞剂:可能改善肌肉功能(需医生评估)。-ACEI/ARB:改善胰岛素抵抗,间接促进肌肉合成。四、其他支持措施1. 康复治疗-吞咽功能训练(如冰刺激、舌肌训练)改善进食能力。-物理治疗师指导下的步态与平衡训练。2. 心理与社会支持-改善抑郁状态(必要时药物+心理干预)。-鼓励社交活动,减少独居导致的食欲下降。3. 环境调整-提供安全的运动空间,配备助行器等辅助工具。-调整饮食质地(如软食、糊状),预防呛咳。五、预防措施1. 定期筛查-使用MNA量表(微型营养评定)和握力/步速测试早期识别营养不良和肌少症。2. 健康饮食-多吃蔬菜、全谷物、优质蛋白,避免高糖高脂饮食。3. 规律运动-老年人每周应完成150分钟中等强度有氧+2次抗阻训练(WHO建议)。4. 慢性病管理-控制糖尿病、肾病、COPD等消耗性疾病,避免长期使用糖皮质激素。5. 口腔健康-定期洗牙,及时修复龋齿或义齿,保障咀嚼能力。六、注意事项-个体化方案:根据年龄、合并症、运动能力制定治疗计划。-监测与调整:每3个月评估体重、肌肉量(如生物电阻抗分析)、握力。-预防跌倒:运动时有人陪同,避免空腹运动或过度疲劳。-及时就诊:老年科、营养科、康复科联合干预效果更佳。若老人出现体重下降>5%/月、行走困难或反复感染,需立即就医,早期干预可显著改善预后。
汪为民 主任医师 淮安市第一人民医院 老年医学科2人已读



