北京262医院胃食管反流病中心科普号
- 引用 磁力环治疗胃食管反流病临床试验在火箭军特色医学中心(原第二炮兵总医院)正式启动
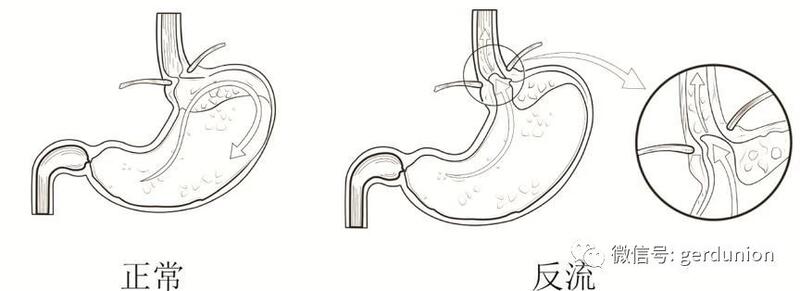
胃食管反流病 (GERD),是指胃内容物反流入食管,引起不适症状和(或)并发症的一类疾病。GERD的典型症状为反酸、烧心,还有一些合并非典型症状,如胸痛、上腹痛、上腹烧灼感、嗳气等,同时还可伴随食管外症状,如哮喘、喉痉挛、慢性咳嗽、咽部异物感和声音嘶哑等,是消化科常见的慢性疾病。 GERD 是常见疾病,西欧和北美GERD 的患病率为10%~20%。日本GERD的患病率约为6.6%。北京和上海两地同时进行的人群调查结果显示GERD 的患病率为5.77%。我国的胃反流检出率正逐年升高,GERD 的治疗越来越受到人们的关注及重视。 根据2014年中国胃食管反流病专家共识意见,治疗胃反流的方式为:改变生活方式及饮食习惯、药物治疗、外科手术治疗、内镜治疗。在这些治疗方式中都存在一些弊端,仍有部分中重度胃食管反流患者对治疗效果不满意。 GERD的根本原因在于食管下括约肌(LES)功能减弱或丧失,使得胃内容物异常反流到食管。因此要治疗GERD疾病,就要恢复或增强LES压力。目前宁波胜杰康生物科技有限公司研制了一种利用磁原理增强LES压力的抗胃食管反流植入器械(又称磁力环)。 磁力环经腹腔镜微创手术植入于患者胃食管交界处--食管下括约肌的位置。在静息状态下,磁力环利用磁珠间的吸引力关闭食管下括约肌,闭合的磁力环的磁力较大且能保证松弛的LES闭合,起到抗反流作用;当患者正常吞咽时,较大的吞咽力又能够轻松克服磁力,使植入的磁珠互相分离以适应食物或液体的正常通过,并且在吞咽时由于磁珠的分离,磁珠间互相的磁力减少,不会过分影响正常吞咽。 与国内现有的术式相比,采用磁力环的新术式,其优点在于: 1、不改变消化道生理结构,不影响对胃食管其他疾病的诊断和治疗; 2、手术快速简单、创伤少,术后恢复快; 3、抗反流长期有效,无长期副作用,减免药物的辅助治疗,手术可逆。 如果您的情况基本符合下列描述,您将可能有机会接受该器械在国内的首批治疗使用: 1、18周岁≤实际年龄<75周岁,且预期寿命大于3年。 2、生理状况可接受外科治疗,如可耐受常规麻醉和腔镜手术。 3、至少6个月以上的GERD病史(包括确诊或有典型GERD症状,如反酸、烧心等),且对药物酸中和或抑制治疗有应答。(烧心的定义:上腹部或胸骨后烧灼样疼痛或不适等感受。) 4、需要每日服用PPI药物。 5、食道pH监测显示酸暴露总时间>4.5%。(在接受该检查前,应停止所有抗反流药物治疗至少7天。) 6、暂停PPI药物治疗期间有GERD症状。 7、愿意配合并完成研究随访及相关检查。 8、自愿参加本试验并书面签署知情同意书。 如果您的基本情况有一条符合以下描述,您可能不适合该器械在国内的首批治疗使用: 1、需行急诊手术者。 2、近3个月内参与过其他研究性药物或器械临床试验者。 3、有如下病史之一者:接受过胃食管手术,接受过抗反流外科治疗,有胃食管癌史或胃癌史。 4、有针对GERD或BE的内镜干预治疗史。 5、疑似或确诊的食管癌或胃癌。 6、经内镜检查确认大于2cm的食管裂孔疝。 7、食道测压检查结果:湿咽后远端收缩积分(DCI)平均值<500,或无效吞咽百分比>30%。 8、食管炎C级或D级(LA分类标准)。 9、身高体重指数BMI>35。 10、最近3个月,平均每周出现吞咽障碍症状不止1次。 11、诊断患有硬皮病。 12、诊断有食管运动障碍(例如失弛缓症、胡桃夹食管、弥漫性食管痉挛、食管下括约肌高压等)。 13、已知有食管狭窄或食管解剖结构异常(如Schatzki环、梗阻病变等),或有相关病史。 14、患有食管或胃静脉曲张。 15、患有BE。 16、无法理解试验要求,或不能完成研究随访计划。 17、孕妇,哺乳期妇女,或打算在研究阶段受孕的。 18、患有可能导致无法依从满足方案要求或较低预期寿命(如少于3年)的疾病(如充血性心力衰竭等)。 19、诊断患有精神疾病(如双相情感障碍、精神分裂症等),但如果是因为使用某些药物而表现出抑郁症状的除外。 20、已知或怀疑对钛、不锈钢、镍或含铁元素材料过敏的。 21、体内有电子类植入物,或腹部有金属类植入物。
 吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)4345人已读
吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)4345人已读 - 引用 胃食管反流性喉痉挛的综合诊治:附64例报道
链接本文:http://yxyjyjy.hbu.cn/CN/10.3969/j.issn.1674-490X.2018.03.003或http://yxyjyjy.hbu.cn/CN/Y2018/V35/I4/11摘要:目的 研究反流性喉痉挛(gastroesophageal reflux laryngospasm, GERL)的临床特点及其对综合诊治的反应。方法 纳入2010年1月至2016年6月连续住院,症状问卷调查符合喉痉挛发作特点,胃镜、测压及24 h pH检查后行PPI、食管贲门射频治疗或胃底折叠术后喉痉挛症状消失,随访观察12个月以上喉痉挛无发作而诊断为GERL的患者,统计分析GERL患者的gastroesophageal reflux disease(GERD)症状谱,喉痉挛发作特点、检查结果及对抗反流治疗的反应。结果 本研究共纳入GERL患者64例,平均年龄48.9岁。71.9%患者伴有反酸、烧心等典型GERD症状,75%的患者伴有咳嗽、哮喘等食管外症状。35.9%患者主诉反酸可致呛咳,继而出现喉痉挛, 73.4%的患者自觉餐后、进食刺激性食物、饱食或饮酒后喉痉挛多发,42.2%的患者喉痉挛多发于平卧睡眠中。24 h pH监测和胃镜检查的病理性酸反流和食管炎的检出率分别为53.1%和48.6%。本组有37.5%的患者对PPI的反应良好,51.6%有部分反应,10.9%对PPI反应不佳;84.4%的患者因不能停用PPI或PPI疗效不佳选择食管贲门射频治疗或胃底折叠术,取得了良好的疗效。结论 喉痉挛可作为GERD的食管外表现之一。GERL患者可合并GERD的典型症状和/或食管外症状,部分患者可自觉喉痉挛发作与反流症状、饮食、体位等因素相关而有助于GERL的诊断。GERL通常对PPI、射频治疗和胃底折叠术等抗反流治疗反应良好。喉痉挛(Laryngospasm)为喉部肌肉反射性痉挛收缩,声带内收,声门部分或完全关闭导致不同程度的呼吸困难,甚至完全性呼吸道梗阻。喉痉挛发作通常为突然发生且毫无预兆,一般持续数秒,可伴有吸气性喘鸣,咳嗽、失声,喉痉挛引起的气道阻塞使患者出现濒死感和恐惧感,进而可造成严重的精神心理创伤,严重的喉痉挛发作还会造成晕厥,喉痉挛发作的持续时间短暂,多于数分钟内缓解,少数严重者可导致窒息甚至威胁生命[1]。喉痉挛的诱发因素包括全身麻醉、神经系统疾病、胃食管反流、离子紊乱等。胃食管反流病(gastroesophageal reflux disease,GERD)为胃内容物反流至食管、口腔(包括咽喉)和/或肺导致的一系列症状、终末器官效应和(或)并发症的一种疾病。GERD已成为一种常见的,甚至是危害极大的慢性疾病[2]。胃内容物经过咽喉反流至咽喉以上可出现溢出、喷洒和喷出现象,从而激惹了以咽喉为中心的上呼吸道和下呼吸道,可引起反流性咽炎、反流性咳嗽、反流性哮喘,若反流物声门反射性闭合,喉部括约肌受伤害性刺激后可出现快速、有力收缩,则可导致反流性喉痉挛(gastroesophageal reflux Laryngospasm,GERL)的发生,严重时可导致患者出现晕厥[3, 4]。由于GERL患者的胃食管反流典型表现通常不明显或容易被忽视而容易造成漏诊和误诊误诊,故很有必要阐述和研究与GERL的临床特点及其综合诊治的反应,以引起各专科医生重视。资料与方法一、一般资料 选择2010年1月至2016年6月火箭军总医院胃食管反流病科收治并符合下列条件而诊断为GERL的患者64例:(1)年龄>18周岁;(2)其临床表现符合喉痉挛发作表现,吸入性糖皮质激素及支气管扩张剂等治疗无明显疗效。(3)均于本中心完善胃镜、高分辨率食管测压和24小时pH监测等GERD术前评估。(4)经过抗反流治疗,包括PPI(proton pump inhibitor, PPI)等抗反流药物治疗,食管贲门射频治疗或腹腔镜下胃底折叠术后喉痉挛症状消失,其他GERD相关症状明显缓解,治疗后随访观察12个月以上喉痉挛无发作。二、方法抗反流治疗前临床调查:采用自拟GERD症状调查表[5],调查内容包括喉痉挛的发作特点;典型GERD症状,如反酸、烧心;食管外症状,如咳嗽、咳痰、喘息、胸闷气短、咽部异物感、声音嘶哑等。同时调查患者的睡眠情况和外院治疗情况。抗反流治疗前客观检查:胃镜:食管炎采用洛杉矶分级标准(LA):正常为食管黏膜无破损;LA-A为1个或1个以上黏膜破损,长径≤5mm;LA-B为1个或1个以上黏膜破损,长径>5mm,但无融合性病变;LA-C为黏膜破损有融合,但<75%食管周径;LA-D为黏膜破损有融合,至少达到75%的食管周径; GEJ和膈肌脚压痕的距离差≥2.0cm时诊断为食管裂孔疝(hiatal hernia,HH)。24 h食管pH监测:DeMeester评分>14.7为病理性酸反流,14.72~50、51~100、>100分别为轻度、中度和中度病理性酸反流。食管高分辨率测压:UES压力(参考正常值范围:34 mmHg ~104 mm Hg,低于或高于正常值为异常),LES压力呼吸平均值(正常参考值范围:13mmHg~43 mmHg,低于正常值为异常),LES-CD压力带分离距离(出现分离为异常,视为HH)和无效吞咽百分比(无效吞咽百分比≥30%为频繁无效蠕动,100%为蠕动缺失)。抗反流药物治疗:给予艾司奥美拉唑肠溶片20mg/次,2次/d餐前口服;同时使用胃动力曲美布丁片0.1g/次,3次/d 餐后口服;铝镁加混悬液1袋/次,3次/d 餐后口服;8周为1个疗程,停药后若症状复发则开始下一个疗程。胃镜下食管贲门射频治疗和腹腔镜下胃底折叠术:方法如前所述[6],射频治疗部位至少覆盖食管齿状线以上2.0cm和一下0.5cm,共6个或以上平面,相邻平面间隔0.5cm。胃底折叠术将胃底以360°包绕食管下端,以不可吸收线固定2-3针,如果合并食管裂孔疝则同时行食管裂孔疝修补术,以不可吸收线缝合缩小膈裂孔进行食管裂孔疝修补。结 果一、临床表现特点(表1)本组64例GERL患者,男性45例,女性,平均年龄为48.9±13.5岁(19-77岁),GERL平均病程为7.7±8.6年(6个月-42年),其中46例患者合并不同程度的反酸、烧心等典型GERD症状,典型GERD的平均病程为11.0±12.1年(6个月-45年),48例患者伴有其他食管外症状,其中伴有咳嗽、哮喘和咽喉炎症状的患者分别为32例、29例和26例。本组10例患者的喉痉挛症状为偶发,既平均一个月以上出现一次,而54例为频发,既发作频率逐渐增加到平均一个月发作一次乃至每天发作数次。本组15例患者的每次喉痉挛发作持续时间均为1分钟以内,而其余49例患者的喉痉挛发作持续时间多为一分钟以上,其中22例患者曾因严重的喉痉挛发作而出现意识丧失,3例患者因严重发作而急诊采取气管切开抢救,这3例患者均被喉镜检查证实存在声门下狭窄,其中合并哮喘的患者喉痉挛发作通常更为严重,1例患者因喉痉挛发作意识丧失而导致头部外伤,而喉痉挛较轻时可仅表现为咽喉部阵发性发紧、憋气和发音障碍。30例为夜间睡眠中发作为主,表现为突发喉紧窒息致醒,同一天发作一次或数次,自头几次发作之后这类患者常因恐惧而不敢平躺从此半卧位或坐位睡眠,另外34例患者则白天和夜间均有发作;所有患者的在喉痉挛明显时均伴有强烈的恐惧感及发作后的持续性恐惧焦虑。本组有52例患者的喉痉挛发作有自觉诱发因素,23例患者可自觉喉痉挛发作与反流物的直接刺激或呛咳有关,47例患者自觉喉痉挛与饮食相关,可于饱餐、进食不当或饮酒后多发,21例患者自觉冷空气、刺激性气体等外界因素可诱发喉痉挛发作。本组患者因喉痉挛发作多于急诊科、呼吸科、耳鼻喉科和心理科等就诊,曾被诊断为喉痉挛、哮喘、咽喉炎、神经官能症和焦虑症等并进行相应的药物治疗,疗效均不满意。所有患者于本中心评估后均以PPI等抗反流药物治疗作为起始流治疗,其中7例患者药物治疗后喉痉挛明显缓解,最终停药;另外17例患者抗反流药物治疗症状明显缓解,不能停药;33例为部分缓解,不能停药;7例患者口服抗反流药物无明显疗效。因停药症状易复发或无效并且同时合并其他明显的胃食管反流相关症状而接受射频治疗或胃底折叠术治疗的患者分别为23例和31例,其中有1例为射频治疗后再次接受胃底折叠术治疗计入手术治疗,3例因喉痉挛及声门下狭窄而气管切开而不能拔管时间长达1年至3年的患者均接受胃底折叠术治疗,分别于术后7天,2个月和3个月拔除气管套管。抗反流治疗后平均随访时间为5.4±1.9年。表1. 本组GERL患者喉痉挛发作特点。项目 例数百分比%仅表现为喉痉挛发作而无其他症状34.7合并反酸烧心等典型GERD症状4671.9合并其他食管外症状4875合并阵发性咳嗽症状3250合并喘息胸闷气短等哮喘症状2945.3合并咽部异物感等咽喉炎症状2640.6喉痉挛偶尔发作/频繁发作11/5317.2/82.8持续时间1分钟以内/1分钟以上15/4923.4/76.6严重发作伴有意识丧失2234.4夜间睡眠中发作为主2742.2白天和夜间均有发作3757.8发作时伴有明显的恐惧感64100自觉诱发因素5281.3反流症状可诱发2335.9饮食相关4773.4外界刺激可诱发2132.8曾经因喉痉挛发作而就诊的科室 急诊科42 65.6 呼吸科5281.3 耳鼻喉科3046.9 心理科57.8PPI疗效明显缓解,最终停药 710.9 明显缓解,不能停药1726.6部分缓解,不能停药3351.6 无明显疗效710.9PPI治疗1015.6射频治疗2335.9胃底折叠术3148.4二、客观检查特点(表2)本组患者抗反流治疗前胃镜检查检出31例食管炎,LA-A为23例,LA-B为8例,无重度食管炎患者,检出食管裂孔疝18例,非食管裂孔疝的患者中有28例患者的贲门关闭不良形态明显松弛。24小时pH监测的DeMeester评分平均为20.94±21.61, 30例为阴性,31例为轻度病理性酸反流,1例为中度,2例为重度。食管测压UES的平均静息压力为53.1±28.8mmHg,其中21例患者压力低于正常;LES的平均静息压力为10.8±4.6mmHg,其中44例患者压力低于正常;30例食管蠕动功能大致正常,30例表现为频繁无效,4例表现为蠕动缺失。表1. 本组GERL患者抗反流治疗前的客观检查。项目 例数百分比%胃镜 NERD3351.6 LA-A2335.9 LA-B812.5食管裂孔疝/明显松弛18/2828.1/43.824 h pH监测 DeMeester>14.723453.1食管测压UES压力低于正常2132.8LES压力低于正常4468.8频繁无效3046.9蠕动缺失46.3 讨 论1977年,Chodosh首先指出胃食管咽喉反流可导致包括声嘶、咽部异物感、吞咽不畅、耳痛乃至喉痉挛的发生[7]。GERD导致的呼吸道和咽喉部表现非常丰富并具有明显的异质性,既常见凶险,其中不乏有喉痉挛症状的患者,但又罕为大众所知,为此汪忠镐提出了以胃食管交接处为启动器、以咽为反应器、以口鼻为效应器、以喉气管为喘息发生器所引起的一系列临床表现,称为胃食管气道反流这一新概念,并进行了大量的后续实践[2, 8]。GERL作为GERD食管外症状的表现之一可单独出现,亦可同时合并GERD的其他表现,,故对疑诊GERL的患者应全面调查其GERD的其他症状。本组仅4.7%仅有GERL症状而没有其他GERD相关症状,绝大部分患者(95.3%)则合并典型症状(71.9%)和/或食管外症状(75%),合并明显而典型GERD症状的GERL患者时相对较易与胃食管反流相联系,从而起始抗反流治疗,但患者和医师如果对反酸、烧心等GERD症状不够重视时,亦容易造成漏诊;然而部分患者GERL患者反酸、烧心等症状比较轻微,而同时合并的反流性咽喉炎、咳嗽和哮喘等食管外症状较为明显时主要到呼吸或耳鼻咽喉科就诊,患者和医师往往仅专注于明显影响患者健康的呼吸道症状,却忽略了GERD的诊断和相关性的探寻,从而使患者失去了病因诊断和治疗的机会[9]。更有部分患者仅表现为喉痉挛发作,其他症状比较轻微时,由于患者的喉痉挛发作的时间短暂、症状偶发或多为轻度发作,至就诊时患者已经无任何症状和体征,但恐惧和焦虑仍然明显,故亦被诊断为“神经官能症”或“焦虑症”等心理疾病。部分GERL患者具有一定的特征性而有助于GERL的诊断,如本组部分患者(35.9%)主诉反酸可致呛咳继而出现喉紧窒息,部分患者(73.4%)自觉餐后、进食刺激性食物、饱食或饮酒后喉痉挛多发,而部分患者(42.2%)喉痉挛多发于平躺位睡眠中。以上诱因促使喉痉挛的发病机制可能为胃食管反流物及咳嗽、精神紧张作为对喉的刺激,诱发声门反射性关闭[10]。胃食道反流物对喉部是一种有害剂刺激诱发咳嗽及反射性声门关闭,反射弧传入支喉上神经,传出支喉返神经,化学感受器位于喉部,通过迷走神经与脑干交通剧烈咳嗽加剧加重反流-喉痉挛的持续发作[11] 。本组有82.8的患者为喉痉挛频繁发作,76.6%的患者发作时间常常超过1分钟,且34.4%的患者曾因严重发作而导致意识丧失,提示GERL的喉痉挛发作相对其他原因的喉痉挛发作更为严重。然而仍有部分GERL患者喉痉挛发作无明显规律,需进通过检查和诊断性治疗一步诊断。本组GERL患者的胃镜检查食管炎的检出率为48.4%,以轻度食管炎为主,亦有28%的食管裂孔疝和43.8%的贲门明显松弛,这些阳性发现均提示胃食管反流的存在[12],而助于GERL的诊断和治疗手段的选择。与不合并食管裂孔疝的GERD患者相比,合并食管裂孔疝的患者更可能在每日一次的抗酸治疗时仍有症状和食管异常酸暴露,而需要更高的剂量以及维持治疗[13] ,故顽固性GERD合并食管裂孔疝的患者有抗反流手术指征[14]。胃镜检查显示贲门结构相对完好(无食管裂孔疝,以松弛为主)适用于射频治疗[15]。本组GERL食管pH监测53.1%有病理性酸反流,而另外46.9%食管pH监测为阴性结果,表明食管pH监测正常并并不能排除GERL诊断。Poelmans等报道GERL喉痉挛症状频繁的患者通常GERD越重,如更容易合并食管裂孔疝以及食管远端和近端的酸暴露总时间可能越高等[16]。研究发现反流物中除了胃酸外胃蛋白酶在食管外反流中亦有重要的作用,咽喉和气管正常pH值是6.5到7.5,胃蛋白酶原在pH值6.5以下就会被激活而胰蛋白酶则不需要酸性环境即可被激活成蛋白酶溶解蛋白质造成细胞膜损害,进而造成气道粘膜组织的非特异性炎症。另有研究发现酸反流和非酸反流均为病理性咽喉反流的重要病因[17],研究发现食管外反流的患者常常有非酸反流或以非酸反流为主,并且通常有更多的高位反流暴露,pH<4的酸度阈值设定并不能完全适用于GERL的诊断,故采用更先进pH-阻抗检查可提高GERL诊断的有效性,并可用于指导抗反流用药和提高手术的成功率[18]。本组GERL患者食管测压显示UES压力过低、LES压力过低和食管体部蠕动功能减退的比例分别高达32.8%、68.8%和53.1%。研究表明在GERD患者中UES压力过低的现象比较普遍(约为50%),而其中咽喉反流患者的UES压力又明显低于典型GERD患者[19],减弱的食管抗反流功能,增加的反流暴露和减弱的UES保护性功能可能会导致更多的经“咽喷嘴”的咽喉反流,反流微吸入,从而导致食管外症状乃至并发症的发生[20]。如果GERD患者的LES压力过低和食管体部蠕动功能障碍为不可逆或进一步退化状态,则GERL也可能随之慢性化[21]。食管外反流在耳鼻喉科称为咽喉反流,咽喉反流性疾病(1aryngopharyngeal reflux disease,LPRD)是指胃内容物反流至食管上括约肌以上部位,引起一系列症状和体征的总称。喉镜可作为喉痉挛的诊断手段之一,发作期可见双声带内收正常,外展受限,非发作期运动正常,另外咽喉反流的反流体征评分量表(reflux finding score,RFS)结合反流症状指数评分量表(reflux symptom index,RSI)也有助于GERL的诊断,若RSI>13分和/或RFS>7分,可诊断为疑似LPRD[22]乃至GERL。杨瑞等[23]报道的一组GERL患者伴有阵发性咳嗽并且喉镜检查均显示环后区域有典型炎症改变,包括黏膜增生、水肿和红斑等咽喉反流喉镜典型表现,通过抗反流药物治疗取得了满意的疗效。PPI试验简便、有效,可作为典型GERD的初步诊断方法。PPI诊断性试验诊断典型GERD的敏感性和特异性达87.7%和42.5%[24]。该方法可操作性强,特别对于缺乏特异性检查手段的单位或患者惧怕检查的情况有较高的临床实践意义。对伴有典型GERD症状的患者强烈推荐应用PPI试验诊断食管外症状(如GERL)已成为共识,要求应用PPI药物双倍剂量至少8周,观察目标症状是否缓解50%以上[25],而对于无典型GERD症状的患者如果呼吸道对症治疗效果不佳亦可积极进行PPI试验,可简便有效的筛查出部分GERL患者[26]。本组患者喉痉挛症状对PPI治疗的反应较为良好,至少有部分疗效的患者的比例高达89.1%,对GERL的进一步诊治有重要的意义。本组GERL患者PPI等药物的初始治疗后,7例可完全停药,另外3例维持用药治疗,其余喉痉挛及其他胃食管反流相关症状停药易复发或疗效不佳者继而接受射频治疗或手术治疗进一步治疗,得到了满意的疗效。Loughlin对12例经食管pH监测证实的GERL患者采用生活调理和PPI治疗,所有患者均完全缓解[27]。Maceri等亦报道了PPI治疗8例GERL患者的疗效,其中2例完全缓解,其余患者发作频率明显减少[28]。Maceri等[16]报道PPI治疗35例GERL患者6周后所有患者的喉痉挛症状均得到有效控制。以上研究表明GERL对PPI治疗的反应良好,GERL对射频治疗和胃底折叠术治疗的反应鲜有报道,本研究显示射频治疗和胃底折叠术可作为顽固性GERL的进一步积极治疗的方式,和其他食管外症状有相似类有良好的疗效[26]。结论喉痉挛可作为GERD的食管外表现之一,对症治疗效果不佳的喉痉挛患者考虑胃食管反流的可能性。GERL患者可合并GERD的典型症状和/或食管外症状,部分患者可自觉喉痉挛发作与反流症状、饮食、体位等因素相关而有助于GERL的诊断。胃镜、反流监测、食管测压和喉镜等可用于GERL进一步诊断。GERL通常对PPI、射频治疗和胃底折叠术等抗反流治疗反应良好,应该给于积极的抗反流治疗。
胡志伟 副主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)4162人已读 - 引用 胃食管反流病的外科手术(腹腔镜食管裂孔疝修补+胃底折叠)
摘要:由于部分GARD患者的发病机制存在不可逆的解剖学和/或功能学基础,故手术治疗应成为这类患者首选。通过术前评估揭示胃食管反流的情况,存在的抗反流功能和解剖异常,以及反流事件与主诉症状的相关程度是选择手术患者的重要参考指标。通过术前评估选择手术方式并掌握一定的术中技巧可有效较少术后并发症的发生。抗反流手术均可以改善典型GARD症状和食管外症状(或咽喉反流症状),尽管典型症状通常比食管外症状的手术疗效更好,但以食管外症状为主的患者获得手术疗效有更好的经济效益可社会效益。背景胃食管反流病(Gastroesophageal Reflux Disease, GERD)的典型表现和食管外表现可统称为胃食管气道反流性疾病(gastroesophagus airway reflux disease,GARD),即消化道反流物对食管和气道等反流通道的刺激和损伤所造成的不适症状、并发症和终末器官效应的一种疾病[1, 2],可表现为典型GERD、反流性胸痛、反流性口腔疾病、反流性咽喉炎、反流性咳嗽、反流性哮喘、反流性喉痉挛和反流性误吸等,症状可为偶发,也可频繁或持续[3] ,并且可引起反流相关的炎症、黏膜损伤、癌前病变乃至肿瘤[4-7]。上海的一项研究显示GERD影响47%患者的饮食,32%患者的睡眠,以及32%患者的工作能力,对患者的健康状况和情绪均有负面影响[8]。而合并咽喉反流症状的GARD患者较无咽喉反流症状的GARD患者,健康相关的生活质量评分更差,治疗满意度更低,工作能力受损更明显[9].胃食管反流症状可造成明显不适,保守治疗可能要求部分患者终生改变生活方式并长期服用药物,降低生活质量,并带来不小的经济负担。由于部分GARD患者的发病机制存在不可逆的解剖学和/或功能学基础,故约50%的GERD应考虑以慢性病管理,约30-35%的GERD可视为外科疾病。GERD应根据患者的个体的严重程度、反流特点、合并疾病、心理情况及社会因素,由内科至外科循序渐进多学科综合诊治[10]。其中胃食管反流病的外科治疗在欧美已经成为一个常规手术,而我国的认识率和开展率均较低。胃食管反流病可增加发生食管腺癌和某些气道肿瘤的风险,但总体而言是一种良性疾病,其外科治疗的主要目标是。的手术治疗成功的关键首要是选择合适的患者进行手术治疗。总体原则是在术前确诊患者希望解决的症状和并发症与胃食管反流相关。GERD的根本发病机制主要包括在以下几个方面:①食管裂孔疝破坏了解剖学结构;②不伴有解剖学结构异常的一过性下食管括约肌松弛增加;③食管下括约肌压力降低和/或食管裂孔功能不全。其他参与机制还包括:食管对反流物的清除能力下降,胃肠胃排空障碍,以及反流物的攻击作用(胃酸、胆汁、各种消化酶及半消化的食物)。这些发病机制是GARD适于手术治疗的理论依据,从手术学的角度来看恢复和加强胃食管交界区的功能是治疗GARD的关键。手术适应症以下四个方面GARD的手术适应症已成为共识[11-13],在欧美发达国家被广泛采用,本中心重点收治了有明显食管外症状的患者,目前已经取得了良好的手术疗效和社会效益[14, 15]。(1)内科治疗失败:症状控制不理想、抑酸药不能控制的严重症状或并发症(中重度食管炎、Barrett食管、食管炎性狭窄等)或存在药物副作用;(2)药物治疗有效但患者要求进一步积极治疗:包括要求改善生活质量、不愿终生服药或认为药物治疗代价较大的;(3)存在明显反流相关症状和疝相关症状的食管裂孔疝;(4)有明显食管外症状,药物症状控制不理想或需要维持治疗:包括哮喘、喉痉挛、咳嗽、鼻咽喉症状和误吸等。应该指出的是,GERD 的病因并非胃酸过多, PPI 并不能解决反流的根本问题,多数患者PPI 是需要长期维持治疗的[16]。并且很多难治性GERD的主要原因是弱酸反流或非酸反流,这类患者对PPI 治疗的反应较差。咽喉反流性疾病弱酸反流往往更为常见,咽喉或气道对弱酸也敏感,而且胃蛋白酶在咽喉反流中所起的攻击作用更为突出和持久。所以,食管外症状往往对PPI 疗效不佳,更需要外科治疗解决反流的根本问题。另外,多数慢性GARD 患者往往伴有不同大小的食管裂孔疝,这些患者的症状并不完全是胃食管反流症状,还包括裂孔疝症状,如吞咽困难、活动后胸闷气促、饭后心悸、消化道出血等,这些裂孔疝的症状并不能通过PPI 药物治疗缓解,而需要通过外科手段解决裂孔疝问题[17]。从某种意义上来讲,难治性GARD 本质上是治疗方向的选择性错误,抑酸治疗往往南辕北辙,远走越远。而且,越来越多的证据表明,长期PPI 治疗可能导致肠道细菌过度生长、消化不良、骨质疏松、社区获得性肺炎、胃底息肉增生、过敏、白细胞降低和关节疼痛等不良反应。外科手术的原理是通过修复胃食管交界处抗反流屏障,理论上可持久控制任何形式的反流,实践证明符合手术指针的GARD患者术后可获得良好的有效性、安全性和满意度[18]。手术原理食管裂孔修补+胃底折叠术构成了完整的抗反流手术。食管裂孔修补即还纳疝内容物至正常位置、恢复和延长腹段食管、恢复食管裂孔正常大小,并对食管裂孔周围结构进行加强。胃底折叠术即用胃底对下段食管进行部分或全周的包裹,在胃食管结合区形成阀瓣样结构,从而达到抗反流的目的。通过折叠瓣对食管下段的包裹增加其压力起到抗反流作用,更重要的是通过重建阀瓣结构,让折叠瓣发挥单向的阀门作用,食物经过阀瓣的时候是很顺畅的,但当胃内容物要反向通过阀瓣的时候,胃内正压传导给阀瓣就会让贲门关闭,从而阻止反流的发生[17]。手术患者的选择准确选择适合手术的患者是手术成功的第一要素,抗反流手术应该紧紧围绕治疗的目标,而明显有别于恶性肿瘤的治疗目标:消除症状提高生活质量、停用抗反流药物、消除和预防GARD并发症,故GARD症状和/或并发症)越重,生活工作越受影响,停药越困难,大量用药仍不能满足治疗需要,解剖学问题(贲门松弛和食管裂孔疝)越明显的患者手术治疗的价值越高。在仔细评估GARD患者的症状谱的严重程度和生活质量受损情况以及长期用药情况后,必须行GARD术前专科检查,进一步明确手术解剖学和功能学,以及反流事件的严重程度和反流事件与个体患者GARD症状的相关性,从客观证据上明确手术指征。胃镜检查是抗反流术前最基础也是最重要的检查,可明确有无反流性食管炎及其程度,是否伴有食管裂孔疝,是否出现胃食管反流病的并发症如食管溃疡、狭窄、食管癌等。胃食管反流病根据其内镜下表现可以分为非糜烂性胃食管反流病、反流性食管炎和Barret食管。如果存在明确的食管炎(食管炎严重程度≥LA-B)或食管裂孔疝则可以确诊GARD,后续的检查工作则是进一步确定反流与各症状谱的相关性的密切程度。如果胃镜检查无明显异常(无明显的食管炎和裂孔疝),后续检查则需要进一步明确是否存在客观反流及反流与症状的相关性,GARD的症状更加困难和谨慎。就手术疗效而言,糜烂性反流性疾病的疾病谱从轻度食管炎到食管溃疡以及Barrett食管。尽管这些亚组的临床表现不同,但典型症状的术后疗效相同[19]。一个前瞻性研究报道食管炎患者两年的随访结果表明手术疗效优于药物,这些食管炎患者包括食管溃疡、狭窄、糜烂性食管炎和Barrett食管[20]。无论是存在食管炎,如果pH监测为病理性反流,则抗反流手术疗效相同[19, 21, 22]。本中心的研究证实合并食管裂孔疝的GARD患者手术疗效良好[15],而无论是否存在食管裂孔疝,通过患者对抗反流药物的反应性及反流监测等手段进一步证实临床症状可能为反流所致后行抗反流手术仍可取得良好的疗效[23]。钡餐检查简单易行痛苦小,可显示有无黏膜病变、狭窄及食管裂孔疝等,并显示有无钡剂的胃食管反流,因而对诊断有互补作用。该方法对GERD敏感度较低,但对食管裂孔疝敏感度很高,可以作为食管裂孔疝的补充诊断方法。食管24小时反流监测是诊断胃食管反流病的金标准。pH监测结果对抗反流手术具有重要的指导意义(表1)[24]。有症状且pH检查阳性患者通常较有症状但pH检查阴性患者的手术疗效要好[25]。 反映患者报告的症状与反流事件关系的SAP作为选择手术患者的一个重要指标,在非典型症状(食管外症状)患者选择手术时尤为重要[26, 27]。然而,食管酸反流异常的患者中仅有一半患者的SAP是阳性的[28] 。在一个严格的对照研究中,患者有典型症状和pH检查异常,根据SAP而随机分为两组。经过3个月和5年的随访SAP阳性和阴性两组之间的术后主观和客观疗效均相似,6年内的再手术率也无显著差异(12.8%比14%)[29]。pH检查证实存在异常反流的该组患者,无论是否有食管炎,手术疗效也是相似的[22],故pH监测严重程度和相关性均为阴性并非手术禁忌。食管酸高敏感定义为24小时pH监测积分阴性,但SAP阳性。尽管临床上对该患者群应持谨慎态度,但有一些研究表明食管酸高敏感患者的手术疗效良好[30]。 48小时无线pH检查和pH-阻抗检查相比24小时pH检查提高了检查的敏感性和SAP。对于初次24小时pH检查阴性以及不典型症状的患者有应用价值。表1:GERD临床表现结合pH检查对抗反流手术相对推荐强度[24]。临床问题24 h pH +24 h pH -GERD 症状反流++++ +++烧心++++反胃和裂孔疝++++ +++ 食管炎+++++吞咽困难+++Barrett食管+/-+食管外症状咳嗽++++哮喘++++声嘶++ +/-咽痛++ +/-肺纤维化++++ +/-注:0 = 避免, + 弱推荐, ++ 中度推荐, +++ 强烈推荐, ++++ 绝对指征。对于pH检查阴性者,可考虑结合多通道腔内阻抗-pH(MII-pH)检查结果进一步判断手术指征。将阻抗技术与传统食管pH联合的MII-pH技术可以同时检测酸性,弱酸性和弱碱性反流,同时区分液体,气体和混合反流。临床症状与胃食管反流事件相关也可作为诊断GERD的间接指标,SI>50%或SAP>95%作为诊断为症状相关性的可靠指标 [10,19,25],依据ROME III标准,当酸反流和酸暴露时间百分比在正常范围时,症状指数(Symptom Index,SI)和症状相关概率(Symptom Association Probability,SAP)阳性可作为NERD的诊断标准[26],亦可准确预测难治性GERD的手术疗效[31]。最重要的是MII-pH能够特异检测非酸反流事件,尤其有助于NERD和食管外症状(或咽喉反流)诊断,再结合症状与反流的相关性分析大大提高了诊断的敏感性和特异性,并可能成为检测反流性疾病的必要辅助检查和诊断 “金标准”,由于咽喉反流患者监测到的反流通常明显少于典型GERD患者,并且常以非酸反流为主,反流高度更高,故MII-pH较单纯pH监测更适用于咽喉反流患者[32]。食管测压:食管测压特别是高分辨率食管测压能帮助评估食管体部的蠕动功能及下食管括约肌的压力,外科医生还可以根据测压结果来选择手术方法,在食管运动功能正常的病人中可做Nlissen手术,对食管蠕动功能减弱的患者宜采用Toupet手术或Dor手术。另外,高分辨率食管测压还可以通过下食管括约肌区域两个压力带的分离来诊断食管裂孔疝。对拟诊患者或怀疑反流相关的食管外症状患者,尤其是上胃肠道内镜检查阴性时,可采用诊断性治疗。质子泵抑制剂诊断性治疗(PPI试验)已经被证实是行之有效的方法。建议用标准剂量的PPI,1天2次,疗程1~2周。如服药后症状明显改善,则支持为与酸相关的GERD;如服药后症状改善不明显,可能有酸以外的因素参与或不支持诊断。本试验的优点是方便、可行、无创、灵敏度高,缺点是特异性较低。抗反流手术要点胃食管反流病是一个功能性疾病,成功的抗反流手术手术要达到以下五个标准:①恢复正常的解剖结构;②手术要达到减少反流,完全控制症状,停止抗反流药物的使用的初衷;③手术要避免发生严重并发症;④要保证正常的进食功能;⑤要允许正常的嗳气和呕吐[33]。因此外科医生在开展该手术前一定要充分了解贲门区域的解剖学特点、引起反流的机制、胃底折叠抗反流的原理、疝复发的原因等,还要具备娴熟的腹腔镜技术,术前要充分评估病情,这样才能最大程度地减少手术并发症和复发,从而达到理想的手术效果。如何预防术后并发症:胃底折叠术后短暂的吞咽困难比较常见,多数症状轻微,一般都能在2~6周自行缓解。我们认为术中充分游离胃底和贲门部,在无张力的情况下进行松短的胃底折叠,术后吞咽困难将会大大减少。亦可在能够进行宽松折叠的基础上考虑尽量较少分离和其他操作创伤。为了减少术后吞咽困难,多数人主张术中放置42~60F食管探条(bougie)以扩张食管,一般认为食管探条越粗,预防吞咽困难的效果越好。但放置探条会影响手术操作,并延长手术时间,更主要的是有可能导致食管和胃穿孔发生。本中心尝试在胃底折叠完成后立即置入探条,即不影响手术操作,又可预防术后吞咽困难的发生。补片在食管裂孔疝修补术中的应用越来越广泛,相应的的并发症时有发生。补片并发症主要有以下几个方面:①补片侵蚀食管或胃壁造成穿孔;②补片皱缩,变形,对食管造成压迫;③补片与周围组织粘连;④补片移位;⑤补片继发感染。笔者认为放置补片应该注意以下几个方面:①补片缝合固定要确切,防止移位;②补片不要直接跟食管接触,之间间隔以折叠的胃底;③食管和胃底也应该与膈肌脚充分固定,以避免食管上下滑动摩擦补片;④补片材质要柔软,避免将粗糙面跟空腔脏器接触;⑤切记用补片对食管进行环周包绕,我科曾经接诊一在外院做完手术严重吞咽困难患者,再次腹腔镜证实为补片环周包绕严重束缚了食管的舒张,在食管上方翦去部分补片后吞咽困难即刻缓解[34]。笔者认为只要合理选择补片的材质,掌握补片放置的一些原则,补片的并发症是完全可以避免的术后胃肠功能紊乱也比较常见,包括胃肠胀气、嗳气困难、放屁增多、腹泻等,一般在一年时间内这些症状慢慢会缓解,不主张重新手术,因为再次手术可能会带来更严重或新的胃肠紊乱[15]。术中应避免折叠瓣过紧、折叠瓣过大、折叠错位、迷走神经损伤可能有助于减少术后胃肠功能紊乱的发生,有文献报道Nissen手术比Toupet和Dor术后胃肠功能紊乱更常见,故权衡手术疗效和可能出现的胃肠功能紊乱的前提下部分患者可采用部分胃底折叠术。如何减少复发:①尽可能充分游离食管,减少食管向上滑动的张力;②缝合缩小膈裂孔至适当大小,留0.5至1.0cm间隙,过于宽松易至疝形成;③利用合成或生物补片加强修补食管裂孔,在一定程度上能减少因裂孔再次裂开导致的复发;④分离食管的过程在某种意义上造成了膈食管膜更大程度的破坏,所以要重视膈食管膜的重建,我们一般要将食管与膈肌脚缝合固定2至3针以封闭裂孔及和避免食管滑动;⑤折叠瓣与膈肌脚缝合3-4针,防止折叠瓣或胃底组织向裂孔内疝入[33]。GARD手术疗效Field等[35]总结了417例哮喘合并GARD患者的抗反流手术疗效,术后GER症状、哮喘症状、抗哮喘药物使用和肺功能改善率分别为90%、79%、88%和27%,其中不乏临床症状完全消失的“治愈”患者,表明对于这类患者抗反流手术可有效控制GER和哮喘,其肺功能改善虽不如症状明显,但可显著提高患者生活质量。Chandra等 [36]总结了GER相关性慢性咳嗽抗反流手术疗效的前瞻性研究,共689例,平均手术有效率达85%。对于咽喉部症状的患者,当合并有典型的GARD症状且通常对PPIs有良好的反应时对抗反流的疗效最佳[37, 38]。该亚组患者术后症状缓解的可能性是仅有咽喉部症状患者的两倍[39],直接喉镜发现有杓间区粘膜和真声带体征的患者对抗反流治疗反应良好[40]。有非心源性胸痛且合并食管裂孔疝患者通常可从抗反流手术获益,并有良好的长期疗效[41]。GERD已被发现和和终末期肺病强烈相关,并且在肺移植术后患者中有更高的合并率。抗反流手术被认为可减缓支气管炎阻塞综合征过程,从而明显减少肺移植失败率[42]。研究表明抗反流手术可改善85%的终末期肺病患者和91%的终末期肺病术后患者和的FEV1,显著减少了终末期肺病术后肺炎和急性排斥的发生率[42, 43]。最近的一项随机对照研究发现Nissen术式对呼吸道症状的治疗效果似乎优于Toupet[44]。笔者则认为应首选Nissen术式,对于术前食管动力异常、吞咽困难明显的患者选择Toupet术可能会减少术后吞咽困难发生率。目前已被公认的是抗反流手术均可以改善典型GARD症状和食管外症状(或咽喉反流症状),然而典型症状通常比食管外症状的手术疗效更好。典型症状的一年随访有效率为99%,相比之下非典型症状的有效率为93%。87%典型症状的患者可完全缓解,而非典型症状完全缓解的患者只有43%[45]。本中心的研究也是类似的结果,这可能是因为许多食管外症状的产生间接性的,以及这些食管外症状可能是多因素共同参与的问题,或多年未得到控制的反流已经造成了不可逆的损害,这就要求对于GARD食管外症状,不但需要严格的抗反流治疗,还需要后续解决其他参与因素(如气道高敏感和炎症反应等)[23]。尽管如此,由于GARD的食管外症状如果得不到正确的诊治患者将长期处于低生活质量,低工作能力中,并辗转于各种低效而费用高昂的治疗方案当中,笔者认为积极改善GARD的食管外症状较典型症状有更高的经济效益和社会效益。
胡志伟 副主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)5570人已读 - 引用 胃食管反流病的检查要点
摘要:胃食管反流病(gastroesophageal reflux disease,GERD)患者的反流物(腐蚀性、刺激性和免疫反应性)不但可到达食管,还可进一步到达口腔、气道等相连的反流通道,继而引起相应部位症状、并发症乃至终末器官效应。GERD的典型症状如反酸、烧心等通常容易识别和治疗,但仍有约30%的患者症状顽固且药物治疗效果不佳。另外,GERD的不典型症状或食管外症状如慢性咽炎、咳嗽、哮喘、胸痛等危害性大,亦非常常见,但人们往往不会把这些症状与来源于胃肠道的胃食管反流这个病因相联系,而容易导致GERD的漏诊。故对于这类患者需要全面的GERD评估和检查以进一步确诊,有助于指导GERD的后续精准治疗。而熟练掌握PPI实验、胃镜、喉镜、造影、反流监测、高分辨率测压和胃蛋白酶检测等则是确立GERD诊断的关键。1. 背景胃食管反流病(gastroesophageal reflux disease,GERD)为胃内容物反流至食管、口腔(包括咽喉)和/或肺导致的一系列症状、终末器官效应和(或)并发症的一种疾病。GERD已成为一种常见的甚至是危害极大的慢性疾病[1]。典型GERD(以反流、烧心为主要表现)在美洲的患病率为18.1%~27.8%,欧洲8.8%~25.9%,中东8.7%~33.1%,澳洲11.6%[2]。亚太各地区低于欧美地区,为3.9%~25%,但有明显的上升的趋势[3]。哮喘患者中30%~90%合并GERD,高于对照人群的24%,慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)患者中19%~78%合并GERD,高于对照人群的18%[4]。21%~41%的慢性咳嗽与GERD相关[5]。GERD患者患慢性鼻窦炎的比例为20.7%,明显高于对照人群的8.5%[6],GERD症状越明显则合并食管外症状的比例越高且症状越明显[7]。现已证实GERD食管外症状非常丰富并且具有普遍性,临床表现极具特异性和复杂性,可统称为胃食管气道反流性疾病(gastroesophagus airway reflux disease,GARD),即消化道反流物对食管和气道等反流通道的刺激和损伤所造成的不适症状、并发症和终末器官效应的一种疾病[8, 9],可表现为典型GERD、反流性胸痛、反流性口腔疾病、反流性咽喉炎、反流性咳嗽、反流性哮喘、反流性喉痉挛和反流性误吸等,症状可为偶发,也可频繁或持续[10] ,并且可引起反流相关的炎症、黏膜损伤、癌前病变乃至肿瘤[11-14]。上述临床情况可为GARD的临床表现,但并非GARD所特有,亦可能是其他病因所致,故对于疑诊为GARD的患者需进行质子泵抑制剂(proton pump inhibitor, PPI)试验和全面的客观检查。较轻的症状每周出现2 d或以上,中、重度症状每周出现1 d以上。胃镜显示明确的GARD并发症,如反流性食管炎、Barrett食管(Barrett esophagus,BE)、消化性狭窄等和/或反流监测阳性和/或PPI诊断性治疗有效,则可诊断GARD。患者可能没有症状,但有反流性食管炎、反流性食管狭窄、BE或声带接触性肉芽肿等并发症,仍可诊断为GARD。如果反流监测阳性,则诊断的准确性越高。解剖学检查发现贲门明显松弛或食管裂孔疝(hiatal hernia,HH),则胃食管反流的证据更充分。2. PPI试验 PPI是一类特异性、不可逆性抑制胃壁细胞H + /K + -ATP 酶的药物,从而抑制胃酸分泌,是目前最主要的抑酸药物[15],通常与胃黏膜保护剂和促动力药物共同应用于GARD的治疗。PPI试验简便、有效,可作为典型GERD的初步诊断方法,敏感性和特异性达87.7%和42.5%[16]。该方法操作简便易行,特别客观检查手段缺乏或患者惧怕检查的情况下有较高的临床应用价值。对伴有典型GARD症状的患者强烈推荐应用PPI试验性诊断食管外症状已成为共识,要求应用PPI药物双倍剂量至少8周,观察目标症状是否缓解50%以上[17],而对于无典型GARD症状的患者如果呼吸道对症治疗效果不佳亦可积极进行PPI试验,可简便有效地筛查出部分以气道症状为主要表现的GARD患者[18]。在怀疑反流性胸痛时,PPI治疗试验是最常用的评估方法,敏感性和特异性均可高达85%[19];系统研究显示71%~100%疑诊为反流性咳嗽的患者对PPI有良好的反应但需要长期用药;部分疑诊为反流性哮喘的患者应用PPI后哮喘症状可得到明显改善,某些患者的肺功能指标也有所改善[20];PPI目前已被广泛应用于咽喉反流症状如咽部异物感、声嘶、咳嗽、咽痛和吞咽不畅等症状的诊断性治疗,可有效降低咽喉反流的症状评分[21]。PPI亦可改善呼吸睡眠暂停患者的症状和睡眠质量[22];据统计31%白天和夜间均有GERD症状的COPD患者规律抑酸治疗可有效减少COPD的急性发作[23]。然而诸多和安慰剂对照的研究则显示出PPI存在明显的“安慰剂效应”,从而使PPI试验对食管外症状的诊断价值难以定论。3. 客观检查GARD的客观检查包括胃镜、喉镜、造影、反流监测、高分辨率测压和胃蛋白酶检测等(图1)。 图1 GRAD评估路径3.1 胃镜检查胃镜及镜下活检是反流性疾病评估的基本检查,不但可观察到反流相关并发症,如反流性食管炎以及更为复杂的消化性狭窄、食管溃疡或BE等,而且还可以显示贲门松弛、食管裂孔增大乃至HH等导致GARD发生发展的解剖学改变。这些解剖学形态学改变对于胃食管反流病的诊断、预后判断和治疗方法的选择至关重要[24]。胃镜检查多推荐用于症状顽固、症状加重、PPI治疗效果不佳、出现吞咽困难的患者,或用于有GERD并发症(如糜烂性食管炎、狭窄、柱状上皮化生和肿瘤等)风险的患者。欧美国家GERD患者食管炎检出率约为35%[25],其中LA-A、LA-B、LA-C和LA-D食管炎的比例分别为45%~55%、25%~30%、10%~15%、< 5%[26]。中国南方症状性GERD的食管炎检出率为12.5%[27], 低于欧美国家,其中LA-A、LA-B、LA-C和LA-D食管炎比例分别为89.3%、6.6%、2.6%、1.5%[28]。食管炎的危险因素包括有GERD病史、超重、男性、吸烟习惯、无幽门螺杆菌感染以及合并HH。其中GERD症状严重、烧心症状超过5年、肥胖、男性、白种人和HH者发生重度食管炎的危险性更高。而PPI和H2受体阻断剂等抑酸药是保护因素[29]。GERD人群中合并BE、炎性狭窄、食管溃疡的复杂型GERD约为5% 。食管裂孔增大,膈食管膜薄弱时,胃食管交界区(gastroesophageal junction,GEJ)向头端移位疝入纵隔则产生了滑动型HH,从而造成GEJ各抗反流结构出现障碍。GERD患者较非GERD患者有更高的HH合并率,据估计高达 50%至90 %的GERD患者合并有HH,有HH患者较无HH患者有更多的GERD发生率、反流症状、食管炎和BE[30-32]。而没有GERD症状和体征的患者合并HH的比例降低。多数研究把GEJ轻度纵向移位的患者纳入正常组或非HH组,然而这种微小HH不应被忽视。有研究发现微小HH(0.5~2cm,短段HH)患者食管炎和BE的检出率均高于正常对照,表明这种GEJ轻度障碍对于GERD的重要意义[33]。对本中心GERD患者的胃镜分析发现中度食管炎HH合并率为50%,重度食管炎(LA-C和LA-D)的HH合并率可高达82.5%,随食管炎加重HH的检出率逐渐增高,说明严重食管炎更倾向于解剖学问题,而非单纯的食管黏膜损伤问题[34]。另外,HH的内镜下所见为三维结构,不应只包括GEJ的上移距离,还应包括食管裂孔的直径和贲门的松弛程度[35]。另外,HH患者合并食管外症状(如咳嗽或声嘶)的情况更为普遍,更容易出现夜间症状[36, 37],更可能在每日一次的PPI治疗时仍有症状和食管异常酸暴露而需要更高剂量以及维持治疗,并且具有抗反流手术指征[38, 39]。HH存在及大小是发生BE、BE向高级别不典型增生乃至腺癌发展的危险因素[40, 41]。HH还与BE抑酸治疗或射频消融后黏膜转复不良相关[42]。以往人们过多强调了对GERD患者食管黏膜(食管炎等并发症)的观察,而忽略了对GERD患者贲门部位的解剖形态学观察,从而在临床实践中缺乏对GERD患者的贲门形态的描述,同时也造成了很多胃镜下HH的漏诊。由于PPI等药物的广泛使用,胃食管反流造成的食管炎等黏膜病变往往可逆,检查的重复性差。而贲门部位的解剖学变化不受药物的影响,检查的重复性较好,故从某种意义上更能反映GERD的疾病状态,从而更准确地指导临床。喉镜检查是耳鼻喉科用于咽喉反流性疾病的常规检查手段。咽喉反流性疾病喉镜下的体征包括声带充血和/或水肿、喉室变浅或消失、喉部黏膜弥漫性充血和/或水肿、假声带沟、杓间区黏膜增生、接触性溃疡或肉芽肿、喉后部炎、喉狭窄、喉内黏稠黏液附着、咽部淋巴滤泡增生等,从而产生了反流体征评分量表(reflux finding score,RFS),结合反流症状指数评分量表(reflux symptom index,RSI)可作为咽喉反流性疾病的筛查量表。这两个量表已得到了广泛应用和认可,若RSI>13分和/或RFS>7分,可诊断为疑似咽喉反流性疾病[43]。然而有研究显示GERD症状评分与RSI和RFS无明显相关性,GERD患者胃镜下反流性食管炎的严重程度与喉镜下RFS无明显的对应性,故咽喉反流的诊断更依赖于RSI和RFS [44]。3.2 钡餐造影钡餐造影具有简便、安全、痛苦小、易被患者接受、直观等特点,成为GERD 重要检查方法。检查过程中可变换不同的体位进行观察,特别头低位等可用于胃食管反流的诱发和滑动性HH的诊断。可直接观察到反流的高度、量、频率以及食管廓清能力。钡餐造影时钡剂反流至食管,持续达1 min以上,或5 min内发生3次以上反流,或钡剂反流后做2次吞咽动作未能廓清,可作为GERD 的诊断标准[45]。由于观察时间短且受检查者的影响较大,钡餐造影对GERD诊断的特异性较低(约30.1%)[46],然而钡餐造影对HH诊断的敏感性和特异性甚至高于胃镜,但对于食管炎的诊治效力则低于胃镜[47]。钡餐造影推荐用于惧怕或不耐受胃镜检查、慢性症状性GERD、药物难治性GERD、巨大HH、抗反流术后复查患者。胃肠超声造影亦被尝试用于诊断GERD,其诊断标准多参照钡餐造影的标准,亦可用于GERD初步诊断。另外,闪烁造影检查亦有报道用于反流性吸入的检查[48],但该方法未能广泛应用。而胸部CT也常用于评估HH的细节,测量出膈肌脚之间的距离即食管裂孔的大小,了解疝囊周围情况以及排除肿瘤等[49]。3.3 反流监测反流监测是诊断GARD的重要专科检查手段,从客观上反映出反流的特征以及反流事件与症状之间的关系,是目前诊断GARD的“金标准”[50]。24小时pH监测主要反映食管内酸性反流物的活动参数及与症状的相关性,曾作为的GERD诊断的“金标准”。pH电极放置于食管下括约肌(lower esophageal sphincter,LES)上缘上5cm处,以监测远端食管酸暴露,同时防止电极意外滑到胃内导致监测失败。24小时pH监测DeMeester积分大于14.72分则诊断为病理性酸反流。然而由于DeMeester积分法敏感度较低,已有研究应用酸暴露时间百分比(acid exposure time percent, AET)>4.2%为作为酸性GERD的诊断标准,提高了诊断的敏感度,但不降低诊断的特异度[51-53]。故在临床应用中应适当降低DeMeester积分的评判阈值,如DeMeester积分大于10.0即可认为是病理性酸反流。另外需要指出的是,导管式反流监测由于活动、吞咽、体位变化等均可改变导管的位置和水平,从而影响pH值测量的准确性或遗漏的反流事件导致误差。近年来出现的无线食管pH胶囊是通过负压吸附的方式固定于LES上缘上方5cm处,通过发射无线信号代替有线信号传输。该技术可明显减轻患者监测时的痛苦,提高患者依从性,并且位置稳定,减少了检查误差。无线pH胶囊可监测48h乃至72h或更长时间,研究显示延长监测时间可增加12.5%的反流事件检出可能性,同时提高5.2%的症状相关性,从而提高诊断敏感性和准确性[54]。24小时咽喉pH监测系统(Dx-pH recorder),pH电极置于咽部,其电极能够直接检测出咽喉部酸性的雾化物,并且电极为泪滴形状,以避免传感器上黏液和食物蓄积或干燥失灵,是监测咽喉部酸暴露情况的专用检查设备,因此认为它在咽喉反流的诊断方面有重要的应用前景[55]。咽喉pH监测分别设定直立位阈值pH<5.5,平卧位阈值pH<5.0为酸反流。通过Dx-pH系统软件可获得达到阈值的时间百分比、反流次数、最长反流发作的持续时间以及症状相关性等参数,并综合形成RYAN评分,直立位>9.41分、平卧位>6.81分为咽喉反流的诊断阈值。本中心将Dx-pH用于GARD气道症状的诊断,并进一步行抗反流药物或手术治疗取得了良好的疗效[56]。但是RYAN评分仍然存在设计不完善等问题,故可能导致评分值设置过于严格而导致检查假阴性结果增多。另外,咽喉和气管正常pH值是6.5到7.5,胃壁主细胞分泌的胃蛋白酶原在pH值6.5以下就会被激活,而胰蛋白酶则不需要酸性环境即可被激活成蛋白酶,溶解蛋白质造成细胞膜损害,进而造成气道黏膜组织的非特异性炎症,故应适当降低咽喉反流pH阈值的设定,以提高检查的敏感度和准确度。有报道显示Dx-pH的监测结果与阻抗-pH监测结果一致性不佳[57],故Dx-pH监测对于咽喉反流的诊断效力仍需进一步验证。上述所有pH监测均单纯显示酸反流,对弱酸、非酸及气体反流检测能力较差为其主要不足。阻抗-pH监测可同时监测酸性和非酸性反流、反流物的性质(液体或气态)、反流的高度和症状反流相关性等反流参数,有助于提高GARD的诊治水平[58]。酸反流在GARD发病中有重要的意义,然而部分GARD患者并无反酸症状,并且部分患者的症状对充分的PPI治疗反应不佳。进一步研究发现酸反流(pH<4.0)并不是GARD的惟一原因,弱酸反流(pH4.0~7.0)甚至碱反流(pH>7.0)、气体反流或混合反流等在GARD发病中也具有非常重要的作用。阻抗技术则是通过检测两个相邻电极之间的阻抗值推测胃肠腔内存在的是液体和/或气体等内容物[59]。气体、消化道管壁、饮用水、唾液、胆汁、胃内容物的阻抗值依次降低,以静息状态的阻抗值(通常为食管壁的阻抗值)作为基线,当流动的食团同时接触到两个相邻的电极环时,测得的阻抗值迅速改变,根据食团不同的阻抗特性可以区分液体、气体及气液混合反流。阻抗监测的反流事件定义为:在食管远心端连续至少两个阻抗通道逆行出现阻抗值下降超过50%为液体反流[60-62];两个相邻的阻抗通道阻抗值瞬间升高>3~5k,或单一个通道阻抗值瞬间升高>7k为气体反流[63,64],气液混合反流为在液体反流过程中发生气体反流或气体反流在液体反流前的瞬间发生。阻抗-pH监测时患者必须及时准确记录临床症状,结合监测到的反流事件,计算症状相关参数症状指数(symptom index,SI)、症状敏感指数(symptom sensitivity index,SSI)和症状相关概率(symptom association probability,SAP)。SI为胃食管反流事件发生时出现的症状次数占该症状总次数的百分比;SAP是以2min为一组时间窗对24h进行划分,统计所有时间窗内是否存在胃食管反流事件、临床症状的频数,并制成2×2表,通过χ2检验计算反流事件对临床症状产生的影响有无统计学意义(P<0.05为差异有统计学意义),SAP=1-P [65, 66]。此外,SSI为有症状的反流事件占所有反流事件的百分比,SSI >20%为阳性结果,作为症状相关性的另一指标[67]。症状相关性指标可独立应用于单纯测酸及阻抗-pH监测。胃食管反流事件超过73次,或SI>50%,或SAP>95%均可视为阻抗检查结果阳性 [ 68, 69]。另外,食团暴露时间百分比(bolus exposure time,BET)超过1.4%时,对食管动力异常也有一定诊断价值。依据ROME III标准,SI和SAP阳性亦可作为非糜烂性胃食管反流病(non-erosive gastrooesophageal reflux disease,NERD)的诊断标准[70]。最近ROME IV标准引入的一种新的功能性食管疾病称为高敏感食管,它的主要特点是胃镜检查和食道活检正常,食道pH检查正常,然而pH-阻抗检查存在患者的烧心症状和反流事件之间密切相关的证据。高敏感食管强调在正常食管酸暴露的背景下症状与酸性或非酸性反流事件相关性阳性,不管是否正在接受PPI治疗。有研究显示烧心患者40%为NERD,24%为功能性烧心,36%为反流过敏感。1d2次PPI失败的烧心患者中功能性烧心和反流高敏感占90%以上[71]。研究发现酸反流和非酸反流均为病理性咽喉反流的重要病因[72],咽喉反流的患者通常有更多的高位反流暴露,并且常常有非酸反流,pH-阻抗检查对咽喉反流患者意义重大并可用于指导抗反流手术患者的选择,提高手术的成功率[73, 74]。最近一项研究显示pH-阻抗-压力检查可更客观准确诊断反流性咳嗽(酸反流或弱酸反流相关的咳嗽)[75]。目前有研究发现平均夜间阻抗基线值(mean nocturnal baseline impedance,MNBI)可用于评价反流性食管黏膜损伤程度(MNBI降低),并用于鉴别NERD和功能性烧心[76]。3.4 高分辨率测压高分辨率测压系统(high resolution manometry,HRM)被认为可简单快捷地用于食管动力的评估和HH的诊断,特别是图形化后直观显示了食管的蠕动功能,上食管括约肌(upper esophageal sphincter,UES)、LES静息和吞咽状态下食管体部的功能,以及LES和膈肌脚(crural diaphragm,CD)的分离现象,并且HRM的HH诊断结果和胃镜有相似的准确性[77],已被广泛应用于胃食管反流病和贲门失弛缓症的食管动力障碍性疾病的诊断和鉴别诊断。HRM可准确反映UES的功能。正常人UES的静息压一般保持在35和200mmHg之间[78, 79]。人类的这个高压区的长度2~4cm。作为咽和食道之间的一道屏障,阻止空气进入消化道,亦防止吞咽时反流物从食道进入咽喉部,还允许在打嗝或呕吐时将食管内容物释放出去[80],而反流时“咽喷嘴”则可使反流物产生“喷雾”现象,从而放大影响范围并造成微吸入[81]。增加的反流暴露和减弱的UES保护性功能(UES压力过低或保护性反射减弱)可能会导致睡眠中、婴幼儿和老年人更多的“咽喷嘴”的反流和微吸入,从而导致食管外症状乃至并发症的发生[82]。一过性下食管括约肌松弛 (transient lower esophageal sphincter relaxations,TLESRs)常常 被认为是导致胃内容反流进入食管的主要机制,GERD患者75%的反流事件发生于TLESRs。但是,GERD越严重,TLESRs参与引起反流事件的作用反而越弱,而LES压力过低的作用却越明显[83, 84]。有研究表明,食管炎患者的LES平均压力显著低于NERD患者[85, 86]。另外,和没有HH的GERD患者相比,TLESRs在合并HH的患者中的作用较为次要。本中心的研究亦显示从NERD至重度食管炎LES压力逐渐下降,NERD和轻度食管炎患者LES压力显著低于重度食管炎,而且胃镜检出为HH的患者较无HH患者的LES压力明显下降。故上述研究表明严重GERD患者的主要反流机制可能是HH的形成和LES压力过低,而不是TLESRs。本研究亦显示胃镜和HRM的诊断一致性一般,对于NERD和轻度食管炎HRM诊断HH的敏感性优于胃镜,而对于中重度食管炎胃镜诊断HH的敏感性优于HRM,原因可能与NERD和轻度食管炎患者的LES和CD压力带显示清晰,通过HRM可以发现更多的微小HH,而中重度食管炎合并更高比例的重度无效食管蠕动(Ineffective esophageal motility,IEM)、LES和CD压力过低,导致分离的压力带在HRM上无法清晰显示而无法判断压力带分离,而导致HH的漏诊,故胃镜结合HRM可以提高HH的检出率。Khajanchee等[87]以腹腔镜术中诊断的HH为金标准,与胃镜和HRM对HH的诊断相比较,发现HRM的假阳性率低于胃镜,假阴性率相似,HRM的特异性高于胃镜。HRM可显示IEM,如无效吞咽或蠕动缺失,可引起食管清除功能障碍。弱蠕动被认为是GERD最常见的食管功能障之一[88-90]。GERD越严重则食管蠕动功能障碍的合并率越高,进一步证实了GERD患者的这种食管动力学特点[91]。中国的研究发现IEM在中国人GERD 患者中的发生率明显高于普通人群及无症状对照组患者,且有呼吸道症状的GERD患者IEM的发生率更高[92, 93]。本中心的研究亦显示从NERD至重度食管炎,不但HH与LES过低的检出率逐渐升高,而且食管蠕动功能亦逐渐减弱,NERD的重度IEM为8.8%,而重度食管炎的重度IEM则高达35.0%,故这类患者应加强夜间抗酸治疗,如夜间服用PPI等药物及抬高床头睡眠等[94]。3.5 胃蛋白酶检测胃蛋白酶原(Pepsinogen,PG)由泌酸腺的胃壁主细胞合成和分泌,是胃蛋白酶的无活性前体。胃蛋白酶只有在酸性环境中才能发挥作用,最适pH为2.0~3.5,在37℃、最适pH环境中胃蛋白酶可保持稳定状态达24h以上,超过24h在自催化作用下发生降解。人胃蛋白酶在pH≥7.8时开始发生变性,在pH6.0~8.0环境中胃蛋白酶虽无活性但仍保持完整的稳定状态,当pH降至6.0以下时可被重新激活。研究显示大剂量PPI可使胃酸的分泌明显下降,胃液分泌量亦有所下降,而胃蛋白酶平均分泌量只有轻微下降,胃蛋白酶的浓度反而有所升高。目前研究报道胃蛋白酶可在GARD患者的食管、咽喉部、气道、口腔、鼻腔、鼻窦、咽鼓管、中耳及泪液等部位检测到,从而支持食管外反流的诊断。检测胃蛋白酶的技术主要有蛋白印迹(Western blot)、免疫测定(immunoassay)。Peptest是已经商业化的体液或分泌液(如唾液/痰液)胃蛋白酶检测技术,利用两种单克隆抗体进行体外检测,几分钟内可得到结果。本中心研究显示以阻抗-pH检查作为金标准,以唾液胃蛋白酶浓度76 ng/mL为诊断阈值,唾液胃蛋白酶对GARD诊断的敏感度为73%,特异度为88.3%[95]。大量的研究显示,胃蛋白酶检测作为一种简便无创的检查方法,对于咽喉反流的诊断价值具有较好的前景,食管外器官或组织胃蛋白酶的检出可以为反流性疾病与肺部疾病、耳鼻喉科疾病的相关性提供直接证据或线索。但取样部位、取样时机、取样次数、检测方法及浓度阈值等尚需进一步规范化,以提高检查的有效性和准确性[96]。4. 小结:GARD表现复杂,诊治难易程度不一,频繁且明显的典型症状(如反酸、烧心),合并或不合并咳嗽、咽部异物感或喘息、胸闷等食管外症状,症状的诱发缓解有明显规律(如饮食或体位相关,可感知到反流引起呛咳或喘憋,控制饮食或口服PPI可明显改善症状)的GARD的诊断较为容易。当患者症状不典型,PPI等抗酸用药症状缓解不明显时则需要多种诊断手段进一步确诊或排除GARD。内镜、X线和食管动力检查主要用于发现GARD的并发症、蠕动功能、括约肌松弛和HH等异常,对患者的预后和治疗方法(生活调理、药物治疗、内镜下治疗和腹腔镜下抗反流手术)的选择有重要的指导作用。而反流监测可以更精确的掌握事件的发生情况以及目标症状与反流事件的相关性,为GARD的诊治提供最重要的客观依据。新的检查方法如胃蛋白酶检测,简便无创,可反映出胃内容物反流到达的部位,有很好的应用前景。以上数种检查手段所提供的参数是诊治GARD的重要依据。但这些检查手段并非完美,其结果均受工艺技术水平、目前的认识水平、患者配合情况等因素的影响而存在客观和主观误差,需要不断更新和提高技术及认识水平。
胡志伟 副主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)4662人已读 - 引用 胃食管反流病的治疗方法和生活饮食注意事项
胃食管反流病胃食管反流病(GERD)即胃十二指肠内容物反流入食管,引起反酸、烧心、反食、嗳气等症状,并可导致食管炎和咽、喉、气道等食管外组织的损害。食管病变可并发食管糜烂、溃疡、食管癌等。食管外表现可见有慢性咽炎、慢性鼻炎、慢性喉炎、慢性支气管炎、支气管哮喘、支气管扩张、肺间质纤维化等,以及非心源性胸背痛、突发性耳聋等表现。根据目前临床现状分析,药物治疗存在停药复发,长期服用产生副作用。手术治疗效果佳,但远期效果受手术者经验影响较大。生活习惯难以改变,更造成了胃食管反流病的时发时止的尴尬现状。药物及手术 1)药物治疗目前为胃食管反流病的主要治疗方法,已有数十年历史,对快速改善该病的反流症状并长期巩固之, 确有较好的疗效,但药物治疗不能根治本病,停药后约70%患者症状复发。长期服药还可带来不可避免的药物副作用。2)胃镜下腔内折叠术(ELGP)治疗胃食管反流病,是将缝合器安装在胃镜前端,于直视下在齿状线附近缝合胃壁组织形成皱褶,增加贲门附近紧张度,使皱褶阻挡反流,发挥治疗作用。此是一项微创治疗新技术,但部分患者有发生出血概率。3)射频治疗用于胃食管反流病治疗是镜下的微创治疗,通过热能治疗后增加下食管括约肌厚度,灭活神经末梢,使迷走神经受体失活,胶原组织收缩,从而增加下食管括约肌厚度和下食管括约肌压力,减少一过性下食管括约肌松弛,起到防止胃食管反流的效果。食管微量射频治疗技术在国外应用于胃食管反流病已有数年。我们首先引入 Stretta 微量射频治疗仪,在国内首次为胃食管反流病患者进行射频治疗,现已完成2000例手术,5年、10年随访结果看,疗效显著,深受广大患者好评。4)腹腔镜下胃底折叠术是目前首选的胃食管反流病外科治疗方法。部分胃食管反流病患者反复发作,无法停药,甚至少数患者药物治疗后症状仍无法缓解,尤其有食管裂孔疝患者,药物治疗难以奏效。对于严重或顽固的 GERD 以往需外科或腹腔镜下手术治疗。外科方法短期疗效明显,症状缓解迅速,约可获得 95%以上的烧心和反食症状缓解率,但远期疗效受手术者经验影响较大。我科室已完成腹腔镜下胃底折叠术3000余例,长期疗效颇佳,5-10年随访,复发率仅有2%-3%,远远低于国内、外其他医院统计数据。膳食指导 合理的膳食结构与习惯,能够帮助患者减少反流的发生,减少食物刺激导致的胃酸分泌过剩,改善食管胃运动功能抑制酸返流,促进食管及胃的排酸功能,保护受伤的食道黏膜。因此,为了减轻反流,您应该做到:1)避免食用高脂食物、巧克力、咖啡、全脂牛奶、蛋黄、干果,高脂肪餐会延迟胃的排空功能,并可以作用于食道下端括约肌,导致酸反流增加。2)避免高蛋白质饮食,或者过多进食肉类、鱼类,高蛋白、富含氨基酸的食物可以通过刺激胃泌素而使酸分泌亢进,故要避免此类饮食。3)避免进食高温油炸食品,减少油脂的摄入。4)避免食用柑橘类果品、甜瓜、番茄汁、绿茶,以及高浓度的酒精饮料,减少对食管黏膜的刺激。5)注重膳食平衡,主食的量要大于辅食。6)吃饭要慢,不要狼吞虎咽,不吃不易消化的食物。改善习惯 胃食管反流病的患者在生活习惯中有很多是容易诱发疾病发生和加重的。例如吸烟、饮酒、肥胖等问题。接受健康的生活方式,可以消除胃食管反流病的危险因素,发挥预防保健的作用。为了缓解胃食管反流,平时要做到:1)减少导致腹压增高的因素,如紧束腰带、便秘;2)为减少夜间及卧位时所发生的反流,可适当抬高床头。3)避免餐后立即卧床,睡前进食,弯腰搬重物,以免增加腹压诱发反流。4)戒烟、禁酒;可少量饮用红茶。5)肥胖的患者请在医生指导下减重。
吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)4671人已读 - 引用 好消息 火箭军总医院解锁治疗胃食管反流病新技能
5月23日,火箭军总医院胃食管反流病科吴继敏教授团队为一位罹患胃食管反流病6年的54岁苑先生实施了内镜下胃底折叠术,手术过程用时40分钟,术后患者病情平稳。火箭军总医院胃食管反流病科再次增加了治疗胃食管反流病的新手段。患者病史苑先生于6年前出现反酸、反食,伴有咽痒、咳嗽、烧心等症状。服药后症状不可完全缓解,生活质量受到极大影响。于1月前就诊于火箭军总医院胃食管反流病科术前检查提示,宛先生存在食管裂孔疝、反流性食管炎(LA-B)、贲门口松弛(GEFV:3级)。食管PH检测显示:DeMeester积分32.74,阻抗检测显示:反流总次数101次,酸反流49次,弱酸反流23次,非酸反流29次。经术前评估,吴继敏教授决定为其实施内镜下胃底折叠术。手术过程吴继敏教授(图左2)胃食管抗反流瓣膜形成为了保证手术的安全性,内镜下折叠术在手术室实施。首先内窥镜经口腔、食管到达胃底,确定齿状线门齿的距离,明确操作部位。然后将内窥镜顶端弯起,把部分胃底向上折叠,顶在食管末端。在通过超声传感完成定位,钛钉从钉盒中发射,将食管末端与被折叠的胃底订在一起。如此反复,通过在内镜下选择3个位置,将患者胃底钉合到食道下段。局部胃底折叠术完成,胃食管瓣阀恢复,阻止胃食管反流的有效屏障建立完成。术后术后18小时患者留影术后患者无明显不适症状,反流症状明显减轻。目前治疗胃食管反流病主要的措施有:药物治疗(ppi)、内镜下射频治疗、腹腔镜下胃底折叠术和最新的内镜下胃底折叠术。
吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)1万人已读 - 引用 全面认识胃食管反流病:知己知彼,百战不殆
1背景胃食管反流病(gastroesophageal reflux disease,GERD)为胃内容物反流至食管、口腔(包括咽喉)和/或肺导致的一系列症状、终末器官效应和(或)并发症的一种疾病。据估计44%的美国人口受到GERD不适症状的影响。GERD患者医疗资源需求更多,工作缺勤率更高,日常生产力下降。据估计,有频繁GERD症状的患者的医疗保健系统的成本用增量式的健康效益成本估计为每年230亿美元,超过非GERD患者的95%[1]。亚太各地区的GERD也是常见病,其发病率低于欧美地区,约为3.9%~25%不等,但正处于明显的上升趋势已成为共识,而超重或肥胖是导致GERD发病率上升的可能原因[2]。GERD的临床表现极具异质性,以其表现的复杂性可称为胃食管喉气管综合征[3]。从轻度症状到更复杂的疾病表现,其疾病谱系相当广泛。从临床表现上可有典型症状和不典型症状(包括食管外症状),又可以根据GERD症状负担而分为症状散发性和症状频繁或持续性的患者,根据症状的加重和减轻因素可表现为有规律性和无规律性;由于发病年龄不同,中老年发病为主,而部分患者为早发型。从检查结果来看又有非糜烂性GERD和糜烂性GERD,以及更为复杂的消化性狭窄、食管溃疡、或Barrett食管等;检查发现有明显的贲门松弛、食管裂孔增大乃至食管裂孔疝(hiatal hernia,HH)等解剖学改变,则胃食管反流可能与这些器质性病变密切相关;若进一步行pH-阻抗检查,则GERD又可分为病理性反流、食管高敏感、以及功能性烧心或胸痛。患者对质子泵抑制剂(proton pump inhibitor, PPI)治疗的反应差异明显,多数患者PPI治疗非常敏感,但仍有一大部分患者仅有部分疗效或疗效不佳,成为PPI难治性GERD;长期存在的GERD症状和胃肠道与神经系统的内在联系,使部分GERD患者有心理不耐受的表现,可导致合并焦虑和/或抑郁状态以及睡眠障碍,从而进一步加重了患者的痛苦程度和社会负担。各GERD亚型随患者自身状况的改变已经治疗的干预亦可发生变化和相互转化(表1)。所以对于每一例患者均需要从多个维度对患者GERD进行评估才能对患者有个体化的精准认识,结合现有的各种抗反流手段,进而采取有效的精准治疗。临床特点、检查发现和患者对治疗的反应可将患者纳入不同的GERD亚型胃食管GERD的临床亚型评估方式典型 非典型症状调查症状偶发性 频繁性 持续性症状调查、PPI治疗规律型 无规律型症状调查、PPI治疗早发型 中老年型症状调查非糜烂性 糜烂性、狭窄、溃疡、Barrett食管胃镜功能性 器质性胃镜、造影、测压单部位 多部位 全身症状调查、胃镜、24小时反流监测病理性反流型 高敏感 功能性烧心和胸痛24小时反流监测PPI敏感性 PPI难治性PPI治疗心理耐受 合并心理障碍心理调查单纯型 合并型(胆汁反流、功能性胃肠病)症状调查、胃镜、胃肠功能、24小时反流监测、造影、测压原发性 继发性(胃肠排空障碍、胃或食管术后、自身免疫性疾病)病史、胃镜、胃肠功能、24小时反流监测、造影、测压2胃食管反流及其症状的发生机制胃食管反流反流的发生与终止取决于抗反流防线与反流进攻能力之间的平衡。2.1 第一道防线:抗反流屏障各组成部分可阻止反流进入反流通道。胃食管交界区的抗反流屏障是一个有赖于多个因素的复杂解剖学区域:下食管括约肌 平滑肌产生的腔内压力、膈肌脚产生的腔外压力、胃食管结合部(Gastroesophageal junction,GEJ)的顺应性、膈食管膜的完整性(将下食管固定于膈裂孔)、以及胃食管形成的“阀瓣”,该构型有赖于保持His角为锐角和一段腹段食管(该锐角由食管和胃大弯构成)[4]。当胃食管压力梯度超过抗反流屏障,促使胃内容物向食管近端逆流时可造成胃食管反流(GER)。反流的趋势依赖于抗反流屏障各组成部分出现障碍,而受影响的抗反流组分越多则GER也会更严重。向近端移位进入膈裂孔则产生了 “I型” 或 “滑动型”食管裂孔疝,从而造成多种抗反流组成部分出现障碍,所以此时有HH患者较无HH患者有更多的GERD发生率、反流症状和食管炎也不足为奇[5]。下食管括约肌一过性松弛(TLESR)也是GERD患者最常见的反流机制,约65%-82 % 的反流事件是TLESR所致。由吞咽诱发的下食管括约肌松弛以及腹腔收紧和/或深呼吸所致的反流所占的比例较小[6]。研究发现在胃扩张时合并HH的GERD患者较无HH者或对照组TLESRs更为频繁,该现象还与HH的大小直接相关[7]。研究显示所有患者无论是GERD患者还是正常对照膈裂孔处是最不可扩张部位,而GERD患者GEJ的顺应性明显高于正常对照。有趣的是,所测量的GEJ的顺应性和胃镜下贲门阀瓣分级的相关性差[8]。这表明膈裂孔不但可出现横向障碍,而且可有纵向障碍。根据流体和开口直径的关系,GEJ的顺应性越高则更易反流,而且反流量更大。根据泊肃叶定律半径是影响流体的主要参数,而长度则与流量成反比的影响力要小。HH患者的LES的长度、GEJ的高压带和腹段食管长度均相对较短[9]。腹段食管承受着腹腔内产生的外部压力,也是阀瓣的关键组成部分,因为体内研究显示腹段食管越长,产生反流所需的压力梯度越高[10]。所以,出现HH时,变短的LES和腹段食管可能进一步加重了抗反流屏障障碍。如同水通过向上的喷嘴,当患者的下食管括约肌功能受损较轻,反流需要较高的压力差才能突破阻力,而该情况下反流物较少但更容易呈喷射状进入食管,进而形成高位反流,如果再突破上食管括约肌则为食管外反流。这就解释了食管外症状患者的胃镜及反流监测更容易呈现阴性结果[11]。GERD患者较非GERD患者有更高的HH合并率,据估计高达 50%至90 %的GERD患者有HH,而没有GERD症状和体征的患者合并HH的比例降低。然而各研究中的HH的诊断方法(胃镜、造影和测压等)和诊断标准(往往要求GEJ-CD的分离距离大于2cm),以及GERD的定义(如,症状、食管炎和pH检查异常)有所不同。在某些研究中GEJ为轻度纵向移位的患者可能被纳入正常组或非HH组,然而这种微小HH不应被忽视。一个研究微小HH(0.5cm-2cm)的研究显示了这种GEJ轻度障碍的重要性,研究发现微小HH的患者糜烂性食管炎和Barrett食管较正常对照更普遍[12]。HH的存在还可能影响GERD症状的样式。如,合并HH的患者可观察到更普遍的GER相关性食管外呼吸道症状(如,咳嗽或声嘶),并且可能更容易出现夜间症状[13]。与不合并HH的GERD患者相比,合并HH的患者更可能在每日一次的抗酸治疗时仍有症状和食管异常酸暴露,故需要更高的剂量以及维持治疗[14]。另外,不但是HH的有无,而且HH的大小也是发生Barrett食管乃至食管腺癌的危险因素[15]。并且Barrett食管向高级别不典型增生或腺癌发展也与HH的大小相关[16]。Barret食管抑酸治疗或射频消融后粘膜转复不良也与HH的存在相关[17]。在食管腔内位于His角处有一块脊状组织看起来可以起到“阀瓣”的作用,而有助于防止GER。Hill 等描述了该“阀瓣”,而且还做了一个研究支持了这个概念,该研究在尸体标本上证实了该“阀瓣”的抗反流功能[4]。I和II级阀瓣在正常对照中较为常见,而III和IV 级阀瓣在GERD患者中较为常见。他们的研究显示如果应用得当,该分级方法可准确预测GERD患者的状态。另一个研究显示该阀瓣分级法与增大腹压的运动时的食管酸暴露增加具有相关性(III和IV级阀瓣患者的酸暴露高于I和II级患者)[18]。而且,这些发现被证明是独立于LES压力降低的。Hansdotter 等研究显示Hill 分级对于GERD的诊断价值略高于传统的胃镜下HH评价(齿状线上移距离)[19],由于内镜观察者往往更注重消化道黏膜的病变而忽略对贲门形态的细微改变的观察,然而贲门形态的细微改变(如功能或形态学松弛)可能是HH形成的早期表现,到成为符合内镜标准的HH往往是一个渐进和连续的自然过程,对于GERD患者极为重要,故GERD的胃镜检查对贲门形态的着重详细描述和评估是非常必要的(图1)。对于合并HH以及重度食管炎,剂量通常需要加倍,因多数停药后容易复发,通常需要PPI长程维持治疗。存在明显GERD症状和疝相关症状的HH还具有抗反流手术指征[20]。本中心一组476例HH患者,其中Ⅰ、Ⅱ、Ⅲ、Ⅵ型HH分别占90.8%、1.1%、5.9%和2.3%。HH修补术加胃底折叠术后平均随访4.4年,手术总有效率为95.5%,胃食管反流典型症状评分和哮喘症状评分下降率分别为76.9%和71.4%。HH抗反流手术能有效控制GERD的典型症状及哮喘症状,并且安全性良好[21]。远端胃切除,胃代食管食管颈部吻合术后56.4%有食管炎,胸内吻合术后88.6%右食管炎,其中75.6%为重度食管炎。尽管所有患者都服用抑酸药,仅35%的患者有效[22]。可见该手术对反流屏障的严重破坏,故采用抗反流吻合方法和加做抗反流装置非常必要[23]。理论上抗反流手术治疗对于客观反流的控制要优于药物。要获得最佳的手术疗效则患者的选择是至关重要的。PPI至少有部分反应、胃镜和pH检查有客观反流发现的患者手术疗效更佳;那些有GERD症状但无客观反流证据,或表现为不典型症状的患者应谨慎选择;反流监测症状相关性指数和48小时pH检查以及pH阻抗等更精确的检查可为选择患者提供更多有价值的参考信息;食管消化性狭窄患者手术治疗疗效更佳,较药物治疗减少了需要扩张的次数;对于Barrett食管患者,手术治疗可非常有效的控制症状和酸反流。至今尚未能证实抗反流手术是否可预防Barrett上皮向不典型增生和癌症转化,然而有些报道提示手术治疗对短段Barrett食管有预防意义[24]。图1: Hill分级和抗反流术后对应的胃镜下和腹腔镜下胃食管交界区的解剖学形态,从Hill分级I级到IV级展示了胃食管交界区从松弛到HH形成的演变过程,以及抗反流手术对解剖学的恢复情况。A1-A4:I级—胃小弯顶端正常而突出的组织边缘或褶皱,紧紧包绕内镜;B1-B4:II级—存在皱褶,但围绕镜身间断开闭(通常与呼吸相关); C1-C4(尚未达到胃镜下HH标准)和D1-D4(已达到胃镜下HH标准): III级—皱褶不明显且膈裂孔自由开放,可见或不可见HH;E1-E4:IV级—皱褶消失,可见大的HH(如,齿状线上移),食管开放。F1-F4:抗反流术后解剖学形态与Hill分级I级相似,且可见抗反流折叠瓣形成。2.2第二道防线:反流通道的清除能力、耐受性、感受性、局部反应和全身反应。反流物进入食管后可引发食管的继发性蠕动,在粘液和重力的协同下对反流物进行廓清还回胃内。反射的完整性,食管蠕动的有效性,以及反流物的形态、量、高度、成分等均可影响食管廓清功能。食管动力障碍被认为是GERD的重要病理状态之一,对酸反流的廓清能力影响最大[25]。食管动力障碍导致的食管廓清障碍延长了反流物与食管的接触时间从而在非心源性胸痛中起重要作用[26] ,GERD患者在进行幽门螺杆菌根除后可出现食管酸暴露增加和远端酸清除延迟[27] ,这可能是少数患者在幽门螺杆菌根除后GERD症状加重的原因。研究显示HH患者食管动力障碍者更加常见,提示食管酸暴露和食管动力障碍(远端收缩低幅以及食团无效传输或障碍)的关系与是否存在HH相比更为密切[28]。当出现HH时食管的酸暴露增加,但这不仅仅是因为上述的抗反流结构缺陷所致。不但有更多的反流和酸通过GEJ,而且还因为HH患者食管的酸清除能力也得到了损害[29]。研究发现在健康志愿者中酸袋均位于GEJ下方,在小HH(<3 cm)患者中,酸袋多数位于GEJ下方(84%),但是在大HH(>3 cm)患者中有一半的患者在检查过程中(2小时)酸袋总是延伸到橫膈之上,而90%的患者的酸袋至少间断移动到橫膈上方。另外,所有这三组患者的TLESRs次数相似,然而那些有HH的患者更有可能出现酸反流(大的HH比小的可能性更大)。当酸袋位于橫膈上方时发生TLESR 则更可能导致酸反流。所以有大HH和酸袋位于橫膈之上的患者据发现有更大的酸暴露。多因素回归分析提示是否存在HH和酸袋位于橫膈上方是食管酸暴露的统计学显著性危险因素,而酸袋与鳞柱上皮交界处的距离是酸反流的保护性因素[30]。某些结缔组织病可累及食管蠕动功能及反流清除能力从而引起或加重GERD,其中系统性硬皮病多侵犯内脏器官。临床上表现为雷诺现象、皮肤硬化萎缩、黏膜损害及多内脏病变。约80%系统性硬化症有消化系统受累,消化道的任何部位均可受累,其中食管受累最为常见,肛门、直肠次之,约50%的患者有胃食管反流和吞咽困难等食管受累的表现[31]。GERD症状明显并发症重的患者可能需要长期使用高剂量的质子泵抑制剂等抗反流药物治疗 [32]。由于患者食管廓清能力差等原因,常导致反流症状控制不佳和食管炎长时间不愈合[33]。若内科治疗失败、药物治疗有效但患者要求进一步积极治疗、合并HH或有明显食管外症状则有手术治疗适应征[34]。反流物进入食管后可引起食管黏膜的损伤和刺激性症状,内镜检查和pH-阻抗检测可区分出,糜烂性GERD(约30%)、真性NERD(约40%)、酸过敏感食管(约20%)、非酸过敏感食管(约15%)和功能性烧心(约25%)[35]。食管对反流的黏膜耐受和感觉耐受往往不同,其中有明显的反流暴露但没有明显症状的患者为食管的感觉耐受性增高。而酸过敏感食管、非酸过敏感食管和功能性烧心者为食管的感受耐受性减低。食管感觉高耐受性者可表现为“静默反流(silent reflux)”,一大部分患者有多次的酸反流,但仅少部分有烧心的主诉;据估计不超过5%的酸反流事件会产生症状[36]。无症状的食管炎在不同地区的胃镜检出率不同,瑞典为12.1%,意大利8.6%,中国6.1%,另外亚洲6个国家为1.6%~ 22.8% [37]。多数关于无症状反流的研究发现好患者仅为轻度食管炎多见,但纵向研究发现其中极少数患者可发展成为严重食管炎和Barrett食管[38]。而主要表现为食管外症状的患者的气道虽然敏感性较低但食管感觉耐受性往往较高,如哮喘中对于不同哮喘严重程度和检测方法,无症状性的酸反流的发生率约为10%-62%不等[39, 40]。约75%胃食管反流相关性咳嗽患者的无烧心等症状[41]。故食管外症状更容易导致胃食管反流的漏诊。国内的一项研究显示年轻人患者的GERD症状较老年患者症状表现更为频繁严重程度更大,提示年龄越小对GERD感觉耐受性可能越低从而对生活质量影响越大[42]。食管高敏感是引起食管反流等症状的原因之一。内镜检查无黏膜病变而且酸暴露在正常范围但症状的相关概率和/或症状指数阳性的烧心症状被定义为食管高敏感。外周与中枢敏感化被认为是食管疼痛和高敏感的重要机制,甚至生理量的酸亦可以导致症状的发生,造成慢性的更持久的症状。其机理包括心理因素、中枢神经对传入信号处理的改变、食管信号传导通路的改变、神经分布改变、神经递质及神经肽的含量及其受体表达的改变、自主神经功能改变、黏膜上皮超微结构改变等。内镜阳性患者中的20 %和NERD 患者对抑酸药物治疗反应不佳,这些症状可能很大程度上由食管高敏感所引起[43]。对于这类患者的治疗除了抑酸治疗之外降低神经的敏感性乃至心理干预则非常重要。当烧心或胸痛症状胃镜和反流检查均为阴性结果时被认为是功能性烧心,研究显示功能性烧心患者的感觉敏感性也是增高的,同样存在内脏高敏感[44]。食管高敏感和功能性烧心是两种发病机制及临床特点不同的异质性疾病,但临床上有时很难区分食管高敏感和功能性烧心。多数情况下食管高敏对PPI的反应性要明显优于功能性烧心。另外,功能性烧心合并其他功能性胃肠病和心理障碍的比例更高[45],临床上应加以重视。当GERD形成食管高位反流,甚至突破上食管括约肌高压带构成的咽喷嘴,形成不同形式经咽喷洒,即3S现象(spilling、spraying、spurting),造成反流物微吸入,从而导致呼吸道即刻激惹和后继高敏状态,乃至防御功能完整性的破坏。通过神经反射途径或免疫炎症途径诱发或加重呼吸道症状(哮喘和咳嗽等)或疾病[46]。许多食管外反流患者胃食管反流的量和持续时间可在正常范围内,无食管症状和食管炎,较食管黏膜上皮耐受性更低的喉黏膜上皮还是出现了损伤。对于食管,1 d出现50次反流都是正常的。但在咽喉部,1周出现3次反流就可产生有意义的病理改变[47]。这种易感性可能是此病普遍存在且常规治疗效果欠佳,严重影响着人们的健康与生活质量重要原因。对于咽喉部症状的患者,当合并有典型的GERD症状且通常对PPIs有良好的反应时对抗反流的疗效最佳[48]。该亚组的患者术后症状缓解的可能性是仅有咽喉部症状的患者的两倍[49]。同样,直接喉镜发现有杓间区粘膜和真声带异常的患者对抗反流治疗反应良好[50]。高剂量PPI的长程治疗可作为反流性哮喘初始治疗,对于PPI治疗不能停药或仅部分疗效的患者可进一步抗反流手术治疗亦可取得良好的疗效[51]。Diaz等通过健康问卷和生活质量问卷对GERD患者进行调查显示38.3%的患者存在心理问题,并且这类患者生活质量较差[52]。相比正常人群,GERD患者患者合并单纯焦虑心理障碍增加了3.2倍,合并单纯抑郁心理障碍增加了1.7倍,而合并焦虑和抑郁心理障碍增加了2.8倍,提示焦虑抑郁等心理障碍和反流症状显著相关[53]。Kimura等研究显示,相比对PPI反应良好的患者,对PPI仅部分有效的患者心理健康状况评分明显降低,焦虑抑郁评分及睡眠质量评分显著更差。非糜烂性GERD和需要双倍剂量PPI的更容易出现部分有效。表明GERD症状持续、PPI部分疗效的患者心理耐受能力低且睡眠障碍越明显,反之心理耐受能力越低,症状感受性越明显,对治疗的满意度越低[54, 55]。对于心理评估存在焦虑和/或抑郁状态的GERD患者,在PPI治疗的同时进行抗焦虑/抑郁药物治疗,可提高药物治疗的成功率和满意度[56]。而抗反流手术GERD症状控制良好的同时还可改善部分患者的焦虑和抑郁评分,然而术前焦虑和抑郁评分较高的患者负面影响手术效果的评价,故合并严重心理障碍的患者选择手术应谨慎[57]。2.3第三道防线:抗反流屏障恢复能力和全身调节能力。超过2/3健康婴儿都曾有过胃食管反流(GER)症状,当其引起一系列不良反应及并发症时则称为GERD。可表现为拒食、反复呕吐、体重增长不良、易激惹、睡眠障碍、常出现呼吸系统症状(上呼吸道感染、喘息)、吞咽困难(吞咽疼痛)、弓背体位(特别是进食时),进食时有哽噎、咳嗽、恶心等症状。胃食管反流多为婴儿的正常生理现象,随肠道的发育到10~12月龄时降至5%以下,但严重者亦可造成不良后果[58]。儿童(1岁~18岁)GERD的发病率较低,据报道在欧美国家每1000人每年的发病率为0.84例和5.4例不等。对于儿童和青春期的患者,强调了解全面的病史,识别早期症状,和彻底的检查。儿童患者的症状,如头痛、腹痛、和/或夜间咳嗽通过2周后的生活方式的调整后仍不能得到满意的缓解者,可从经验性治疗获益[59]。除非合并有食管裂孔疝等解剖学问题,多数年轻患者通过药物治疗的预后良好。GERD的发病率在50岁之后的中老年出现高峰,老年患者的抗反流药的使用率、反流性食管炎、Barrett食管乃至食管肿瘤均的发病率均明显高于非老年患者。另外,老年GERD的表现更不典型,症状严重程度更低,但黏膜病理更为严重。与非老年患者相比,老年患者的食管动力和解剖学障碍(如HH等)更严重,唾液分泌减少,肥胖率更高,以及老年患者的合并症(如糖尿病、帕金森病等)及合并症用药(如减压药等)更多,这与人体衰老过程是一致的。这些均是老年患者GERD发病率高且病情较重的可能原因[60]。GERD被逐渐认识到在很多患者中是一个慢性疾病。就其发病机制而言,胃食管反流的发生与胃肠排空障碍、食管廓清功能障碍、频繁的下食管括约肌一过性松弛、下食管括约肌松弛,乃至HH的逐渐形成等有关[61]。在个体患者中则以上述一种或几种机制为主,轻度的或偶发的反流症状患者抗反流机制相对完整,症状多为一过性的或自限性,多为生活饮食相关。但任何一种机制如果较为严重,则多不可逆,并且GERD多为中老年发病,各抗反流更能有减退的趋势,自身恢复能力有限。另外,GERD还与肥胖明显相关,提示肥胖对胃食管交界区的抗反流机制有破坏作用,而减肥有助于GERD的控制[62]。系统研究显示,GERD人群经过1-22年的随访相当大比例的患者症状如前、更差或仍需抑酸治疗,持续性GERD在“有并发症的GERD”(基线为合并反流性食管炎或Barrett食管)中的平均比例为65%,在“符合定义的GERD”(基线为至少每周都有症状,症状中到重度,经医师诊断为GERD,且食管pH检查为阳性)中为70%,在“症状性反流”(基线为更宽松的症状标准,如包含每月都有症状和轻度症状)中为34%。 若取终点指标为“需要治疗”,“有并发症的GERD”为64%,“符合定义的GERD”为77%。若终点指标为“患者报告有症状”,则 “符合定义的GERD”为98%,“症状性反流”为34%。故“症状性反流”的患者慢性化的可能性相对要低,这和“症状性反流”中包含了轻度的患者有关。反流性食管炎6个月到5年的平均复发率在安慰剂组中为75%,在PPI治疗组中为28%[63]。而症状轻微、偶发或无并发症的患者可短期内得到缓解,且不易复发。然而中至重度症状和/或有并发症的GERD患者症状常常持续数年,所以寻求可长期使用且安全性高的治疗方法非常重要。质子泵抑制剂一天两次,连用4到8周,用于治疗反流症状,可有效90%患者的酸反流,而对约25%患者的症状控制无效[64]。 对于症状持续、有并发症和生活质量低的患者,抗反流手术的远期成本效益比可能优于药物治疗[65]。对于GERD症状持续的患者,腹腔镜胃底折叠术在7年或8年后的成本效益比开始超过PPI治疗。[66, 67] 对于年龄超过70岁的老年患者,腹腔镜抗反流手术仍能取得满意的疗效[68] ,老年患者的手术安全性和疗效与年轻患者相当,故不能轻易拒绝高龄作为手术对象[69]。2.4反流物的进攻能力:反流物的有害成分包括,胃酸、消化酶各种食物成分,如果合并十二指肠胃反流则可增加胆汁和胰酶等成分。正常人餐前胃液的pH值为1~2,餐后不但酸度更高,而且容易在食物上方形成高酸液区,成为“酸袋”,而形成的酸袋非常靠近贲门,故患者往往在餐后症状加重[70]。十二指肠胃反流的反流物为包含胆盐、胆汁酸和胰酶的碱性液体,其中和胃酸的程度取决于反流入胃的量,当患者同时存在胃食管反流,则形成了十二指肠胃食管反流。胆汁混入反流物中比单纯胃液反流的损害性更大,并且和Barrett食管的产生密切相关[71]。 系统研究发现体GERD患者的食管内胆的胆酸浓度明显高于正常对照,食管胆酸的暴露亦可诱发GERD症状,在高浓度或合并酸反流时尤为明显,并且胆汁还可进入气道引起食管外表现。而PPI对部分GERD疗效不佳也可能和反流物中含有胆汁有关。体外和体内实验均表明胆酸可刺激鳞状上皮和Barrett上皮产生炎性介质(如IL-8和COX-2)和氧化应激、DNA损伤和细胞凋亡,胆汁成分可改变鳞状上皮的基因表达促进肠上皮化生,甚至进一步癌变[72]。目前使用的抗反流药物,如PPI,促动力药,黏膜保护剂,以及中和胆汁的药物均衡影响反流物的进攻能力而起抗反流作用。国内的数据显示,多数患者对PPI治疗反应良好,但仍有37.9%的患者可被认为是PPI难治性GERD[73]。而对PPI反应不佳的可能原因包括:对药物治疗方案缺乏依从性,胃肠功能受损,胃排空障碍,夜间胃酸爆发性分泌和药物快速代谢。还有非酸性胃内容物的反流(如:胃蛋白酶,胆汁酸和胰酶等)食管的机械扩张或感觉神经痛觉增敏。以及未经纠正的贲门明显松弛和HH。故某些患者需要进一步调整药物和/或纠正解剖学障碍。胃排空延迟在GERD患者中也较为常见,且糜烂性GERD患者较非糜烂性GERD患者的胃排空时间明显延长[74]。Gourcerol等研究发现胃排空延迟可增加餐后液体/混合反流事件,并且需要调整抗反流治疗方式[75]。胃轻瘫则是更严重的胃排空障碍,表现为严重的恶心、呕吐、嗳气、腹胀和腹痛等而检查没有发现机械性梗阻。虽然原因不明但多认为与胃肠自主神经功能紊乱有关[76]。胃轻瘫的常见原因包括糖尿病胃病(29%)、迷走神经损伤(如手术等)(13%)和原发性(36%)[77]。胃排空障碍引起胃食管反流的机制包括胃扩张导致下食管括约肌松弛,食物潴留导致胃液过度分泌,以及胃内容物增多导致的胃内压过高[78]。对于合并胃排空障碍的患者使用促动力药物、止吐药、控制异常血糖、停用阿片类药物以及饮食调整是非常有必要的[79]。3 小结GERD的主要发病部位为胃食管交界区,但GERD往往还涉及多个器官和系统乃至全身情况,在对个体患者进行诊治时应同时考虑该患者疾病可能涉及的方方面面,才能进一步启动精准而全面的治疗。
胡志伟 副主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)5624人已读 - 引用 专访吴继敏:久治不愈的哮喘、反酸要想到胃食管反流病
7年前,董女士突然出现发作性喘憋,伴咳嗽、咳痰,咳白色泡沫痰,伴呼吸困难、胸闷憋气,伴背痛,无胸痛,无意识障碍,送医院抢救后,症状缓解。次年无明显诱因再发喘憋,到医院进行胸部CT、心脏超声、心电图检查,均未见异常。多年来症状反复,喘憋多在凌晨发作,每次发病时不能躺、坐,只能站着。平时总是反酸,胃灼热感。夜里醒来要吃葱花味的太平苏打饼干或馒头,胃才舒服。医生一直按照哮喘对其进行治疗,每次急性发作后就去输液,用药后症状缓解,停药后又会发作。发病时根本说不出话、喊不出声,即使亲人就在隔壁房间,自己也不能通知家人。就这样,她和她的家人都被病情折磨着,在煎熬中度日如年。 一个偶然的机会,她来到了解放军第二炮兵总医院胃食管反流病中心,经诊断,她患有严重的胃食管反流病,在胃食管反流病中心医生的精心治疗下,她的病情得到了良好的控制,她的生命迎来了崭新的春天。 7年的就诊经历,各大医院都没有怀疑董女士是胃食管反流病,难道这是一种罕见病?它的发病情况如何,如何诊断,对于它的认识与治疗还存在哪些问题?带着这些问题,记者来到了国内首家独立建科的胃食管反流病中心——解放军第二炮兵总医院胃食管反流病中心,采访了中心主任吴继敏教授。 胃食管反流病具有发病率高,而就诊率低的特点 第二炮兵总医院胃食管反流病中心主任吴继敏告诉记者,“胃食管反流病是一个‘实实在在’的常见病,它具有发病率高、就诊率低,误诊率高、认知度低,痛苦程度高、治愈率低的‘三高三低’特点。许多被长期误诊为‘哮喘’的患者,其实就是胃食管反流病。” 在西方国家,胃食管反流病发病率可达30%。美国约有1 900万成人患有胃食管反流病,每年用于治疗该病的费用达19亿美元。2011年由中国医师协会消化医师分会、中国健康促进与教育协会共同发起的胃食管反流病关爱行动在全国范围进行了症状调查。在受访者中,67%的人有明显的消化道症状,其中13.4%被诊断为胃食管反流病,而在67%有明显的消化道症状的人群中只有27%的患者主动就医。 吴继敏教授向记者介绍到,“我国胃食管反流病的医学生教育存在缺陷,内科学第4版之前没有胃食管反流病这一章节,第5版才开始增加,但由于惯性等原因多数医学院校还是没有把该章节作为教学重点,导致很多医生对该病一知半解,老一辈医生和一些老百姓甚至没听说过胃食管反流病。再加上胃食管反流病的食管外症状比较复杂,涉及呼吸、耳鼻喉、心内、口腔等多个学科,许多烧心被当成是胃炎症状,反流引起的胸痛、咳嗽、哮喘、咽异物感等症状很容易被误诊为心绞痛、过敏性哮喘、慢性咽炎等。一种疾病如果在医生中的重视程度不够,那么患者的低知晓率、高误诊率也就可想而知。” 反流导致的烧心、胸痛等症状长期困扰着患者的日常生活,容易出现焦虑、抑郁等症状;反流导致的哮喘多为重症,严重威胁着患者的生命;患者的睡眠质量差,无法自由享受食物,这些都导致了患者生活质量差,痛苦度高。而且,由于本病的治疗需要像高血压、糖尿病一样长期坚持,自我调整,即便治疗措施得当,患者不重视坚持服药和生活调整,病情就会反复,长期以来形成了治愈率低的现象。 胃食管反流病诊断的基础来源于症状甄别 胃食管反流病是指胃内容物反流引起的一系列不适症状和(或)并发症的一种疾病状态。胃食管反流病横跨多个学科,症状具有多样性,同时,部分患者的检查结果常为“未见异常”,因此,胃食管反流病的甄别需要一双“火眼金睛”。 从胃食管反流病发病顺序和机制来看,本病的症状可以分为4期。一是胃食管期:胃内容物进入食管,引起反酸、厌食、烧心、胸痛、背痛、嗳气、吞咽困难等症状;二是咽期:反流物到达咽喉部,引起咽喉疼痛、咽异物感、癔球症、声音嘶哑等症状;三是口鼻腔期:反流物到达鼻腔、中耳,引起流清鼻涕、鼻涕后流、打喷嚏、鼻塞、耳鸣、听力下降等症状;四是喉气管期:反流物进入气管,引起咳嗽、咳痰、憋气、哮喘、吸入性肺炎、肺纤维化等,此期症状最重,严重影响患者生活质量,甚至发生喉痉挛而危及患者生命。 吴继敏教授表示,“胃食管反流的反酸,未必是酸水反到嘴里,有时候是仅感觉有东西反上来,这也是反流。接诊医生下一步要问反酸的伴随症状,如烧心、嗳气等,如果是胸骨后烧心,那么反流可能性就很大。胃食管反流病患者的烧心病程一般较长。1周>2次的反酸或者是1周有≥1次的严重反酸,或平时经常反酸者要警惕胃食管反流病的可能。” “胃食管反流病的咳嗽多数是呛咳,像喝水不小心呛了一样,咳嗽十分剧烈,声音高亢,喘憋感明显。另外,如果反复的肺部检查没有问题,强力的抗感染和止咳、大剂量的激素冲击治疗均无效,要考虑胃食管反流性咳嗽的可能,占慢性咳嗽的10%~20%。部分胃食管反流性咳嗽患者伴有的反酸、烧心、胸痛与进食有明显相关性,如餐后咳嗽、进食咳嗽。”“如果是所谓的“哮喘”患者,要注意他们的症状是否有一些特殊性,如在餐后、餐中、睡眠期间或晨起时发生轻重不等以至剧烈的咳嗽、咳痰,甚至因夜间呼吸不畅或不自主的咳痰而惊醒,被迫居于端坐位或直立位,呼吸困难甚至窒息,这种患者要警惕胃食管反流病。”吴继敏如是说。 诊断胃食管反流病的标准是胃镜和24小时食管pH反流的监测,但对于两项检查结果都正常的患者,也不能排除本病,必须结合病史进行诊断。对于这部分患者可以进行药物治疗诊断,如果服用抑制酸药、胃动力、胃黏膜保护剂后症状缓解,那么患者病情就可能与胃食管反流病有关系。 规范治疗来源于医患的“全局”意识 胃食管反流病的规范治疗需要医患的多种“全局”意识,一是医生要有对疾病本身全面掌握,能识别、会治疗、懂指导的全局意识;二是,医生要有对患者病情全方位思考、多学科协作诊治,以患者为中心的全局意识;三是,医生患者要有与疾病长期“和平相处”的全局意识。 吴继敏教授告诉记者,只要诊断明确,胃食管反流病的治疗并不难,它与其他疾病一样,遵循无创-微创-有创的治疗顺序。首先要告知患者进行饮食、体位控制,其次考虑药物治疗,最后是外科手术治疗,外科治疗也是最直接、最有效的根治性策略。饮食和体位控制是胃食管反流病患者始终要坚持的最基本治疗方法。常用的药物有促动力药、抑酸药和胃黏膜保护剂,其中抑酸药是基础药,抑酸药如果能控制症状,就不用考虑促动力药、胃黏膜保护剂,症状重者考虑使用3种药。饮食、体位和药物治疗无效者要考虑手术治疗。 胃食管反流病中心创始人汪忠镐院士曾表示,“在胃食管反流病与相关呼吸系统疾病如哮喘、慢性咳嗽、鼻炎、咽喉炎等的治疗中存在三方面的问题,一是,认知上的形而上学,只重局部,缺乏整体观,头痛医头、脚痛医脚现象泛滥;二是,学科之间的界限所困,铁路警察——各管一段的现象严重,缺乏跨学发展的思路;三是,一些医院及医生知识更新缓慢,过分依赖仪器设备,没有以病人和病情为中心做到诊断和治疗的个体化予以综合诊治。” 在第三届第二炮兵总医院胃食管反流中心的患友会上,一位患友讲述了自己患病、得到救治的经过后说,“病已经得了,这个是事实,即便治愈,也比平常人有较高的再发生率。所以,无论是药物控制还是手术治疗痊愈,患者都不能忘乎所以,必须时刻关爱自己,改良生活方式。要远离胃食管反流病,就不能忘记它,要与它‘和平共处’。” 手 记 “70 后”的中心主任吴继敏教授年轻有为、温文尔雅、治学严谨,致力于胃食管反流病的专病研究和治疗。当被问到是否想过拓宽自己的专业范围,而不是局限于某个专病时,他笑了,“其实《光明日报》在采访我时也问我,‘为什么我只做一件事情’,包括业内的许多专家、同道也问过我同样的问题。按照我现在的胃底折叠手术量、手术技巧,如果开展一些其他腹腔镜手术,把自己的优势发挥得更大一些,技术上是没有问题的。但是,我觉得就胃食管反流病而言,还有许多未知,而且我也愿意去探索这些。人这一辈子可以做很多事情,但要把一件事情做成精品很难,我不仅要把胃食管反流病手术做到极致,还要将该手术在全国各大医院大力推广,以造福于更多的患者。” 一生只做一件事,专注才能成功,应该就是这个道理吧! 来源:中国社区医师杂志
吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)3757人已读 - 引用 胃下垂诊治小结
胃下垂常是内脏下垂的一个组成部分, 与体型和体质有一定关系, 如瘦长体型和无力型其胃的位置就较其它体型的人低。 轻度胃下垂患者多无明显症状;中度以上胃下垂患者则胃肠动力差,有消化不良的症状,具体如下:腹胀及上腹不适:患者多自诉有腹部胀满感、沉重感、压迫感。腹痛:多为持续性隐痛;常于餐后发生,与食量有关,进食量愈大,其疼痛时间愈长,且疼痛亦较重。同时疼痛与活动有关,饭后活动往往使疼痛加重。恶心、呕吐:常于饭后活动时发作,尤其进食过多时更易出现。便秘:多为顽固性,其主要原因可能由于同时有横结肠下垂,使结肠肝曲与脾曲呈锐角,而致通过缓慢。神经精神症状:由于胃下垂的多种症状导致患者精神负担过重,因而产生失眠、头痛、头昏、迟钝、忧郁等神经精神症状。此外长期胃下垂的患者常有消瘦、乏力、低血压、心悸和眩晕等表现。 胃下垂的诊断 胃下垂确诊主要依靠X线上消化道钡餐造影,根据站立位时胃小弯角切迹的最低点与两侧髂嵴连线的位置分为三度: 轻度:胃小弯角切迹的最低点位于髂嵴连线下1.0~5.0cm; 中度:胃小弯角切迹的最低点位于髂嵴连线下5.1~10.0cm; 重度:胃小弯角切迹的最低点位于髂嵴连线下10.0cm以上; 胃下垂的综合诊断依据包括以下三个方面[1]: 胃位置明显低下, 即站立位充盈像上胃小弯角切迹的最低点低于两髂嵴连线以下/胃下界位置到达骨盆腔; 胃张力极度低下; 伴有或不伴有临床症状/并发症; 胃下垂的治疗 饮食及生活方式调整 胃下垂患者消化功能受到影响, 所以临床中胃下垂患者的饮食是其恢复的一个重要内容。患者的饮食宜少食多餐, 每天3餐变4-6餐,并多食用蔬菜等。进食的时候要养成细嚼慢咽的习惯, 这样可以将食物充分的磨碎, 让患者获得比较好的消化基础;适当进行体育锻炼,增强肌力;改变不良生活习惯比如餐后剧烈运动、暴饮暴食、纠正不良体位等;更为关键的是患者需保持乐观、积极、向上的心态。 药物 上腹不适、隐痛、消化不良等可辅以助消化剂、止痛治疗;腹胀、胃排空缓慢者,可供给吗叮啉或胃复安;合并便秘者可选用莫沙必利等促胃肠动力药或润滑药等。 手术治疗 对于药物治疗无效的重度患者,严重影响生活质量的患者可考虑外科手术治疗,对重度胃下垂患者可行胃大部切除+胃十二指肠吻合术;缩短肝胃韧带行胃悬吊术亦有良好的疗效。
胡志伟 副主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)1947人已读 - 引用 胃食管反流病的外科治疗
就在今晚19:30敬请观看胃食管反流性疾病(GERD)是食管下括约肌压力低或频繁松弛,导致胃内容物反流入食管,反流的胃酸和胃蛋白酶造成食管损伤,引起各级食管炎。在我国存在大量的GERD患者,其发病率也有逐年升高的趋势。GERD外科治疗是通过手术疗法使食管下段形成一个高压带,提高食管下括约肌的压力,阻止胃内容物的反流,因而从本质上解决了GERD的病理异常。
 吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)2342人已读
吴继敏 主任医师 火箭军特色医学中心 胃食管外科(胃食管反流病科)2342人已读




