浙大二院血管外科科普号
- 精选 大动脉炎外科综合治疗
大动脉炎( Takayasu’s Arteritis TA) 是以累及主动脉及其分支为主的系统性血管炎性疾病,其临床表现为全身炎性反应及其受累脏器缺血症状。在不同种族、不同性别和不同年龄均有发病,但最好发于内分泌不平衡最显著的青少年和步入成年早期的女性,男性发病时年龄大于女性,出现急性炎症反应的相对较少,病情活动性及严重程度较女性为轻。大动脉炎疾病是目前治疗颇为困难的疾病,此文报告了我们对22例大动脉炎患者进行外科技术治疗的情况。研究对象及方法本研究收集了我院血管外科自2006年1月至2008年3月收治的22例大动脉炎患者,具有完整的病史、体检、影像学检查和实验室检查。 方法:主要观察指标: (1)临床表现:肢体偏瘫、头疼、头晕、高血压、无脉、视力障碍等。(2)实验室检查:血沉(Erythrocyte Sedimentation Rate,ESR)、C 反应蛋白(C-reactive protain,CRP)及免疫指标等 。(3)血管造影检查:主动脉弓、全脑动脉、腹主动脉、双肾动脉造影。(4)辅助检查:术前、术后经颅多普勒超声(Transcranial Doppler, TCD)检查或CTA检查。(5)手术治疗或介入治疗的具体方法及并发症,药物治疗方案及病情活动指标监测结果。疗效判定:含主观症状改善和客观检查指标,后者主要是治疗前后组织灌流改善情况确定。结果:一般资料: 22例患者,男性5例,女性17例,男:女=1:3.4 ,平均年龄26.3岁,其中30-45 岁10例( 45%),20-30岁7例( 32%),10-20岁4例( 18%),<10岁1例( 5%)。病程10天-22年。实验室检查:ESR>20mm/h者占27.2%(6/22),CRP>0.8mg/dl占31.8%(7/22),纤维蛋白原(Fibrinogen)>4g/l者占31.8%(7/22),血小板计数(platelet count, PLT)>300G/L占59%(13/22)。临床分型及病史特征: 全部患者进行了动脉造影检测,临床分型主要根据造影结果,采用Lupi-Herre综合法分型。其中Ⅰ型15例(68%),为主动脉弓及分支受累,Ⅱ型5例(23%),为降主动脉、腹主动脉及分支受累,Ⅲ型2例(9%) ,为兼有Ⅰ型、Ⅱ型病变特点,均为头臂血管和肾动脉受累病例。(表1)发病特点:所有患者中, 因突发性脑梗塞就诊6例,最终在病史中确定有眩晕、头痛等脑部症状患者共19例;以高血压病就诊6例,最终诊断并发高血压病患者13例,在后期诊断高血压7例患者中,5例为头臂型,双侧锁骨下动脉受累,其余2例为伴有头臂血管病变的混合型。治疗方案及转归:本组病例全部给以正规的糖皮质激素治疗,同时应用扩血管药物及抗血小板药物作为常规基础治疗,其中7例患者加用免疫抑制剂。本组22例病人全部进行了外科干预治疗,根据病情分别进行介入治疗(15例次)(表2)和手术治疗(9例)。介入治疗的技术成功率为93.3%(14/15),1例患者开通闭塞颈动脉未成功,后接受手术治疗;另有1例患者颈动脉全程狭窄,成功扩张后脑部症状缓解,但术后第3天,出现颈动脉急性血栓闭塞,因经济原因放弃后续治疗。介入治疗前目标动脉管径为1.13±0.63mm,治疗后动脉管径为3.78±2.17mm,治疗后管径狭窄率均<50%。配对t检验统计学分析,管径有显著性改善(P<0.001);常规手术治疗技术成功率100%(9/9),7例患者进行手术后同术前TCD检测比较,无论术式如何,脑血流均有所改善,出院时旁路血管通畅良好。全组病人围手术期无死亡,全部病例治疗后主观症状和客观检查均有不同程度的改善。病理检查:本组9例常规手术治疗病人中取得组织活检3份,病理报告其中2例符合大动脉炎活动期病理改变。随访:全组病例中,随访19例,随访率86.3%(19/22),其中有8例手术治疗患者和11例介入治疗患者,随访时间为3月-30月。1例24岁女性患者,接受胸主动脉至左颈总动脉、左锁骨下动脉旁路手术,术后一般情况较好,术后3个月因急性脑出血死亡,其余患者未发现明显并发症,病情较稳定。讨论: 大动脉炎是我国重要的动脉炎性疾病,常见于年轻女性。大动脉炎是原因不明的非特异性动脉全层炎症,外源性刺激可能激惹局部炎性反应或免疫反应,加重或加快疾病进程,因此治疗困难。该病变最常累及锁骨下动脉、降主动脉、肾动脉、颈动脉、肠系膜动脉、升主动脉、腹主动脉等。临床表现包括头晕、头痛、视力改变、肢体疼痛及间歇跛行、无脉、高血压、血管杂音、肢体血压差异以及全身症状、发热、乏力等。公认DSA是大动脉炎最佳检查标准,能确定受累血管的部位及范围,能显示大动脉及其主要分支的狭窄、阻塞和扩张性改变的程度以及侧支循环的形成情况等,从而有利于临床的早期诊断、准确分型、判断预后及指导治疗[1、2]。本组所有病例全部行主动脉弓、全脑动脉、肾动脉、降主动脉血管DSA检查,结果符合大动脉炎的总体特征,以头臂血管受累为最多(77%,含2例复合型)。一般认为,大动脉炎治疗以内科药物治疗为主,而外科干预应尽量处于静止期或炎症相对稳定后实施,或者出现严重的组织或脏器缺血后方实施[3]。由于本病的复杂性,临床对疾病是否处于活动期尚无统一判断标准,也缺乏准确的检验指标标定疾病活动程度[4]。组织活检病理检查对是否处于活动期具有权威判断价值,但大多数病人并没有接受手术治疗,或者术中因纤维化明显,为了减少组织损伤,并不强行活检。本组9例手术病人中仅3例进行组织活检,其中2例患者术前根据经验判断已处于大动脉炎静止期,但活检结果显示:血管周围组织有大量的中性粒细胞、单核细胞和淋巴细胞浸润,按病理特征仍应诊断为活动期大动脉炎。本组病例中其他的临床检验结果对是否处于疾病活动期并无特异性作用,不具有指导意义,同部分文献研究所得结论有不同。无论I型或III型大动脉炎,最突出的表现是脑缺血症状[5]。本组资料中,有6例患者因突发脑梗塞就诊,平均年龄仅28岁。对全组病例仔细检查后发现:有脑部症状的病人占86%(19/22),主要包括口齿不清、头痛、头晕、视物不良等症状,此数值超过了本组中疾病分型中头臂干病变(77%)比例。本组另外一个就诊原因是高血压:其中直接以高血压就诊的病人为6例,而最终发现有高血压的患者达到13例。发现的这7例患者均有不同程度的锁骨下动脉病变,在远离病变部位进行有创血压监测后发现血压增高。我们认为,在相对年轻的患者中发现高血压病变,除了传统理论上肾血管性高血压解释外,头臂干病变引起脑缺血而引起的反应性血压升高,可能也具有重要的意义。而高血压引起的脑部症状可以解释有高达86%的不同分型患者均出现不同的脑部症状。目前CTA、MRI等无创检查技术发展相对快,但我们仍然认为动脉造影对本疾病的诊断治疗具有无可替代的作用[6]。本组患者全部进行了动脉血管造影检查,对患者的脑血流情况进行评估,这也是本组病例治疗效果较好的一个保障。一些研究认为,大动脉炎是慢性缺血病变,发生脑缺血或直接导致死亡的比例较低,其中仅10%的患者需要外科治疗[3、7、8]。而病死原因主要为心功能衰竭、大动脉炎所致动脉瘤破裂和脑栓塞。我们认为早期诊断和早期治疗,对于大动脉炎患者,尤其是重型头臂型大动脉炎患者有积极作用,在血管未发生完全闭塞前利用介入治疗技术进行单纯的血管扩张、成型,可以在一定程度上减少灾难性缺血症状的发生。如果简单遵循以往的原则,一味等待或因无法判断动脉炎症是否活动期而犹豫,可能贻误了手术治疗的时机,引起不可逆的组织病变,使外科干预的预后不佳,本组患者中有6例年龄平均为28岁患者出现了极为严重的偏瘫,严重干扰了其生活质量。在我们治疗中1名23岁年轻女性,因头痛、头蒙1年就诊,诊断为大动脉炎,血管造影证实:患者仅头臂干血管通畅较好,左颈动脉呈线状同心狭窄,左锁骨下动脉闭塞,右锁骨下动脉椎动脉以远闭塞。我们对患者进行了介入治疗,恢复了包括左颈动脉、左锁骨下动脉、左椎动脉、右锁骨下动脉血管的通畅性,半年后怀疑左颈动脉再狭窄,二次行左颈动脉球囊成形术,同时复查其它病变动脉通畅良好,此患者坚持服用激素药物,目前随访一年,生活工作均正常,而没有出现因严重缺血导致的偏瘫等症状。我院从上世纪七十年代开始,在国内率先开展了大动脉炎肾动脉狭窄球囊成型手术[1]。随着介入技术的发展,已成为大动脉炎治疗的重要手段[9]。由于此技术的微创和可重复性,适合应用于大动脉炎的慢性病程。根据我们的经验,早期诊断、早期应用介入技术治疗,在标准药物治疗的基础上可以获得较好的疗效。由于本疾病的特点,支架作为异物可引起较为严重的血管炎性反应,因此我们对应用血管内支架极为慎重,除非病变血管具有不可替代的决定性作用。本组病例中有3例进行了血管内支架治疗。1例为24岁女性头臂干型患者,仅无名动脉通畅,伴有重度狭窄,已发生脑栓塞。在成功开通左侧颈动脉1月后,进行了无名动脉的支架成型,保证了脑血供; 1例为32岁女性,大动脉炎肾动脉狭窄球囊成型术后24年,进行肾动脉支架植入治疗,目前两患者随访20月,血管内支架通畅。1例为男性患者,主动脉至右颈动脉和锁骨下动脉搭桥术后2年,病理证实为静止期病变,因左锁骨下动脉狭窄严重,左椎动脉窃血,进行左锁骨下动脉支架成型,术后3个月随访出现明显内膜增生,给与二次球囊成形治疗,维持血管通畅。对于介入治疗失败或预测无法进行介入治疗的患者,逐步控制激素用量,进行动脉旁路手术,同样具有良好的治疗效果[10]。本组病人中有9例患者进行了主动脉向颈动脉或锁骨下动脉搭桥手术,其中1例为介入开通血管失败患者,其余为判断介入手术不能成功病例。手术技术成功率为100%,为手术期患者症状均有不同程度好转。1例患者术后3月,因急性脑出血死亡。相比较而言,介入治疗可重复性高,创伤小,适合早期治疗;而常规手术治疗创伤较大、可以回避主要病变血管,适合晚期患者或静止期患者。总之,大动脉炎的病情复杂、治疗困难、并发症后果严重。药物治疗是基础,但外科治疗应根据病情实施,特别是微创的介入球囊成型治疗,如早期实施,可以维持病变血管通畅,减少严重并发症,对患者预后较为有利。 患者:女性,23岁,主因双上肢无脉,头晕1年来诊。诊断为大动脉炎。动脉造影检查示,右侧头臂干内膜尚光滑,右颈内动脉有同心性狭窄,右锁骨下动脉于椎动脉以远全程狭窄至肱动脉,左颈总动脉线状全程狭窄,左锁骨下动脉闭塞。介入技术开通了左锁骨下动脉和左椎动脉,对双侧颈动脉、右锁骨下动脉行球囊扩张成形术。术后患者症状迅速缓解。
陈兵 主任医师 浙江大学医学院附属第二医院 血管外科4184人已读 - 精选 外科治疗动脉硬化性肾动脉狭窄围手术期高血压及肾功能变化的研究
随着老龄社会的快速进展,动脉硬化等疾病称为严重影响人群健康的疾病,肾血管性高血压及缺血性肾病的发病逐渐升高,有研究报道65岁以上的老年人中约7%发生肾血管缺血病变[1],在确诊为动脉硬化疾病的人群中,大于50%的患者可发生肾动脉狭窄(renal artery stenosis RAS)[2]。国外研究显示90%的RAS由动脉粥样硬化所致 [3],在中国近年来报道由动脉硬化为病因的RAS为72%[4]。动脉硬化性肾动脉狭窄(ARAS)作为RAS的主要病因,可引起药物难以控制的高血压,如长期缺血影响血流动力学可引起缺血性肾病,增加心血管疾病恶化的风险。然而对肾血管病变处理存在大量争议[5,6],需要更多的研究证据验证治疗结果。本文对我院处理的 ARAS患者围手术期高血压及肾功能病情变化进行总结。对象与方法一、 对象2006年8月至2010年5月我院确诊的80名肾动脉狭窄患者作为研究对象,共108例肾动脉病变进行分析。患者平均年龄64.8±11.1岁,其中男性51例,平均年龄64.3±12.0岁;女性29例,平均年龄65.7±9.4岁。二、 方法1. 临床资料收集和辅助检查:(1)临床资料:临床表现,吸烟史,高血压史,合并糖尿病、高脂血症、脑血管病、冠脉病、外周血管病等疾病情况及治疗情况。(2)实验室检查:术前及术后1周血清肌酐,尿素氮,血糖,血脂,尿蛋白等。(3)确定诊断:选择性肾动脉造影结果作为确诊肾动脉狭窄及狭窄程度的标准。2. 诊断标准: (1.) 肾动脉狭窄:根据选择性肾动脉造影结果判断 ,以肾动脉狭窄程度 ≥50%作为诊断肾动脉狭窄的标准。肾动脉狭窄根据狭窄度分为50%~69%(轻中度)、 70%~99% (重度)和 100% (闭塞) 3个等级。 (2.) 高血压病诊断标准:既往有高血压病史或在不同时间 2次以上血压 ≥140 /90mm Hg 诊断为高血压。 (3.) 肾功能不全诊断标准:血肌酐值>133umol/L诊断为肾功能不全。3. 治疗方式:分为外科治疗和药物治疗,根据患者病情及患者和家属选择决定治疗方式。建议行外科治疗的原则为:肾动脉狭窄大于70%-75%,无手术禁忌证;或肾动脉狭窄<70%,但病变为溃疡性斑块、斑块形态不稳定易脱落、有动脉夹层形成等情况。手术方式包括:单纯球囊成形术、支架成型术、肾动脉旁路术和肾切除术。如患者不接受或有明确手术禁忌症者给以药物治疗。4. 肾动脉狭窄疗效判断标准: (1)高血压转归标准:包括高血压治疗显效、好转、无效。1显效 ,指不服用降压药物,血压 < 140 /90 mm Hg;2好转 ,指服用降压药种类减少,或种类相同但降压药物剂量减小,血压 < 140 /90 mm Hg,或服用相同/减少剂量降压药物收缩压和 /或舒张压较前下降 ≥15mm Hg。3无效,指病人服用相同药物及药量,血压无变化或不能达到以上标准。(2)肾功能转归评价:以肾小球滤过率进行评判,包括显效、好转、无效。1肾小球滤过率较基础值上升> 15%为显效,2上升值<15%为有效,两者相加为获益, 肾小球滤过率下降为无效。肾小球滤过率以内生肌酐清除率和血清肌酐变化情况估算:GFR =[(140-年龄)×体重(k g)]/[0.818×Scr(umol/L)]×[0.85(若为女性)];以血肌酐浓度进行评判, 血清肌酐下降≥16. 7μmol/L为肾功能改善;血清肌酐变化< 16. 7μmol/L为稳定;血清肌酐上升≥16. 7μmol/L为恶化。三、 统计学方法:所有数据采用SPSS16.0统计学软件包进行统计分析,个人数据行配对t检验或配对秩和检验,所有的统计检验均采用双侧检验,p≤0.05将被认为所检验的差别有统计学意义。四、 结果1. ARAS患者术前基本情况(表1): 全部患者均行选择性肾动脉造影,肾动脉硬化狭窄表现为内膜欠光滑,多发内膜斑块、偏心性狭窄等表现,共发现108条肾动脉狭窄病变,其中单侧病变52例,双侧病变28例。根据造影结果对肾动脉进行病变分级,肾动脉轻中度狭窄(50%-69%)20条,重度狭窄(70%-99%)82条,肾动脉闭塞6条。全部患者均有高血压(表1)。根据血肌酐对肾功能分类,肾功能不全13例,平均血肌酐浓度181.0±44.6μmol/L,最高为265μmol/L。其中肾动脉轻中度狭窄2条,重度狭窄15条,肾动脉闭塞1条。本组外科治疗73例79条肾动脉,其中肾动脉支架成型术67例71条(轻中度狭窄6条,重度狭窄65条,)。单纯球囊成形术3例5条肾动脉(均为重度狭窄),其中1例肾动脉狭窄发生在二级分支处。开放手术3例3条肾动脉,1例因右肾动脉闭塞,右肾萎缩并伴有严重高血压,行右肾切除术。自体大隐静脉肾动脉旁路术2例,其中1例重度狭窄,1例完全闭塞,均伴有肾功能不全。药物治疗7例9条肾动脉,3条为轻中度狭窄,5条重度狭窄,1条完全闭塞。双侧病变患者,选择狭窄较重一侧进行治疗,28人中26人接受治疗,18人单侧支架治疗,6人双侧支架治疗,2人双侧球囊扩张,2人保守治疗。2. 治疗结果:全部手术治疗均顺利完成,其中3例支架成形治疗患者发生肾周血肿,均保守治疗成功。余围手术期无明显并发症,无患者死亡。手术前后比较,以肾小球滤过率评价肾功能,获益率38.4%(显效15.1%+有效23.3%),术前后无明确统计学意义;高血压治疗有效率73.9%(治愈8.2%+好转65.7%)(表2),术前/术后收缩压及舒张压差异有统计学意义(p=0.000)(表3)。肾功能不全患者13例,1例双侧肾动脉重度狭窄,单侧治疗后肾功能恢复正常,3例患者术前单侧病变且肾功能正常,术后3天发现肾功能不全,保守治疗后恢复。本组28例双侧肾动脉病变,2例保守治疗,26例外科治疗,其中6例双侧同时进行PTA/PTS治疗。其余20例双侧肾动脉狭窄行狭窄较严重侧肾动脉支架成型术(表4),术后一周肾小球滤过率增加明显优于单侧肾动脉病变PTS治疗后(P=0.038)。表1 ARAS患者术前基本情况基线资料统计值年龄(岁)64.76±11.10体重(kg)65.45±10.37男性人数51(63.8%)吸烟人数39(48.8%)冠心病人数21(26.3%)脑血管病人数25(31.3%)外周血管病人数38(47.5%)高血压病人数80(100.0%)糖尿病人数39(48.8%)高脂血症人数52(65.0%)表2 ARAS术后一周疗效血肌酐(mol/L)肾小球滤过率(ml/min)高血压(mmHg)改善稳定恶化显效有效无效治愈好转无效人 数364611174564819百分比4.1%87.7%8.2%15.1%23.3%61.6%8.2%65.7%26.0%统计值171.00±61.0593.52±36.27179.56±47.5768.26±30.7767.56±34.8460.81±26.80123.00±15.76/68.83±10.32129.04±12.82/70.13±14.41152.75±9.27/75.90±12.94表3 手术前后对比肌酐尿素氮肾小球滤过率血压服药种类收缩压舒张压1种2种3种4种5种术前99.84±44.906.46±2.5266.40±29.35152.93±23.6180.17±13.8514331620术后103.88±47.226.35±2.7864.17±28.94134.76±16.4271.53±13.8520251611P值0.1030.6300.1540.0000.0000.391 aa.使用配对秩和检验表4 单、双侧ARAS解除一侧狭窄后一周疗效比较肾功能(mol/L)肾小球滤过率(ml/min)高血压(mmHg)改善稳定恶化显效有效无效治愈好转无效双侧(人数)11906591145单侧(人数)24054113252913P值a0.2140.0380.897a.使用两独立样本秩和检验五、讨论本研究总结了2006年8月至2010年5月于首都医科大学宣武医院血管外科收治的80例动脉硬化性肾动脉狭窄患者诊疗情况,平均年龄64.8±11.1岁,其中83.8%(67例)的患者行支架成型术;3.8%(3例)的患者行单纯球囊扩张术,3.8%(3例)患者行开放手术,8.8%(7例)的患者行保守药物治疗。总结发现,ARAS经外科干预后可获益,对高血压的控制获益高于肾功能改变获益,双侧肾动脉病变患者在肾小球滤过的改变的获益明显。理论上动脉硬化是动脉血管的同一个疾病,发生在不同部位则表现出不同的症状和体征,因此ARAS与其他部位的动脉粥样硬化具有共同的危险因素 ,如高龄、高血压、 糖尿病、血脂紊乱、吸烟等,诊断有冠心病、脑动脉硬化、周围动脉硬化的患者常伴发肾动脉硬化病变[9-11]。本组80例ARAS患者的发病年龄和性别分布符合ARAS的特征,合并冠心病、脑血管病、外周血管病、高血压病、糖尿病以及高脂血症的患者分别占26.3%、31.3%、47.5%、95.0%、48.8%、65.0%。此结果同国内外报道相近,各危险因素于ARAS发病前存在时间较久(4-10年,资料未显示)。目前诊断肾动脉狭窄的金标准仍然是二维肾动脉造影,平面狭窄>50%可诊断。实际上肾动脉是具有弹性和伸缩性管状结构,因此二维的解剖面狭窄同肾动脉血流动力学改变并非完全正相关。虽然3D血管造影可以更明确是否在血管截面上有狭窄,但受设备、费用、手术时间、造影剂肾病等因素影响难以推广。近年来多普勒超声、肾核素成像、血管显像和磁共振血管显像技术快速发展,建立了多种对肾动脉狭窄或血流动力学变化进行评价的方法,但评价标准还有争议[12-15], 本研究全部诊断和分类依据来源于肾动脉血管造影。ARAS临床治疗包括药物治疗和手术治疗,一般认为轻、中度狭窄(50%-70%)可药物治疗;重度狭窄(>70-75%)时需动脉重建。而后者主要以PTA和PTS治疗为主。本文83.8%(67例)的患者均行此治疗手段,但此技术是否应推广应用仍有争议[16-18]。争议的焦点在于实施PTA或PTS后肾功能并没有像想象的那样迅速恢复。多数情况下肾功能没有明显变化,只有少数明显好转,而约1/3的患者肾功能恶化[19-22]。一些研究对比了药物治疗同PTA/PTS治疗结果对比,并未发现后者的优势,结论并不支持积极外科干预。从本研究观察到的数据来看,术后 肾功能改善的患者占4.1%(3例),大部分患者肾功能稳定86.5%(64例),少数患者肾功能恶化9.5%(7例),与国内外类似研究基本相符。我们认为这种治疗“技术成功”同“肾功能变化”分离的现象可能是因为肾动脉狭窄造成血流动力学改变,通过肾素-血管紧张素及多种细胞因子引起高血压、水、钠潴留等,并引起逐级放大的狭窄后效应,肾实质损害及纤维化可能是造成此现象的根本原因。本组中有28例双侧ARAS病变,其中20例治疗是遵循先处理严重狭窄一侧病变的原则,对比单侧病变PTS治疗的患者结果发现,肾小球滤过率增加明显优于单侧ARAS病变患者(P=0.038),获益最大,类似报道并不多见[23-24]。单侧肾血管性高血压同双侧肾血管性高血压机制不同:单侧ARAS前者为血管紧张素依赖型,表现为血浆肾素活性增加;双侧为容量依赖型,表现为血浆肾素分泌正常。当双侧ARAS解除一侧狭窄之后,血浆肾素水平可迅速升高,而肾动脉狭窄修复后肾脏灌注增加,容量性高血压改变对肾脏灌注的依赖性可能高于血管紧张素依赖的高血压,表现为肾小球滤过增加。ARAS病变治疗后肾功能改善并未呈现正相关,可能是长期高血压等情况已造成肾内动脉硬化或肾实质病变,除肾组织活检外,目前尚不存在可以明确判断肾组织纤维化的指标,因此术前无法对预后进行准确预测。尽管如此,从最直观的角度,狭窄解除后缺血肾脏的血流灌注得到恢复,这对肾实质的营养支持无疑是有好处的。特别是保证肾血管通畅,可以维持即使很少的肾脏滤过功能,而一旦肾动脉闭塞发生,将难以治疗。本组中6例病人就诊时已发现一侧肾动脉闭塞,仅1例在介入技术下成功开通,1例肾动脉无法开通行旁路手术,1例因肾萎缩且伴有难以控制的高血压行肾脏切除。其他3例因肾动脉闭塞后再通率不高选择保守治疗。显然这部分患者的治疗结果不令人满意。术前肾功能不全患者共13例,1例双侧肾动脉病变行单侧支架成型术后1周肾功能恢复正常,其余病人肾功能变化不明显,而术前肾功能正常患者中有3例因单侧肾动脉病变行支架成型术,术后3天至1周出现肾功能不全。因此造影剂对肾功能的影响仍然需要时刻关注,介入治疗前后水化、选用等渗非离子造影剂可能有利于避免造影剂肾病的发生。本组中有3例出现较为严重的肾周血肿,其中1例有明确的导丝过深的情况,PTS后主动发现有造影剂外漏。另外2例手术结束前未发现有异常情况,术后出现严重的腰背部疼痛,血压降低休克,经超声诊断为肾周血肿。因此要求PTS治疗后一定进行确切的肾动脉造影,应明确显示肾实质后期图像,如有疑问应避免使用肝素,积极排除并发症可能。国内外的研究表明PTS对肾血管性高血压的短期疗效肯定 ,可以降低大多数 ARAS患者的血压[25,26],本研究发现ARAS患者PTS后一周 ,口服降压药物种类无明显变化(P=0.391)的情况下,血压可由原来的 (152.93±23.61) / (80.17±13.85) mm Hg下降为 (134.76±16.42) / (71.53±13.85) mm Hg,差异明显(P=0.000),可见肾动脉血运重建术对改善局部的神经内分泌调节有一定的益处。本研究为非随机对照研究,治疗选择主要根据目前临床治疗原则结合患者和家属的意见进行,主体治疗方法是肾动脉支架成型术。仅对术前术后进行对比研究,经外科干预后患者在血压控制获益是显著的,而双侧肾动脉狭窄治疗后肾小球滤过增加也进一步说明外科治疗具有意义。然而肾功能改变同血流动力学改变不匹配的情况缺乏科学严谨的解释,也需要有合理的预期评测指标。如果结合高龄肾动脉患者治疗可能发生的较为严重并发症,如肾动脉夹层、破裂、肾周血肿(本组3例,保守治疗痊愈)、穿刺部位出血等情况,对肾动脉治疗应非常慎重,需有较严格的技术标准保证治疗的安全性。
陈兵 主任医师 浙江大学医学院附属第二医院 血管外科4462人已读 - 引用 种振岳专访:大隐静脉剥脱导管实现剥脱术新的革新
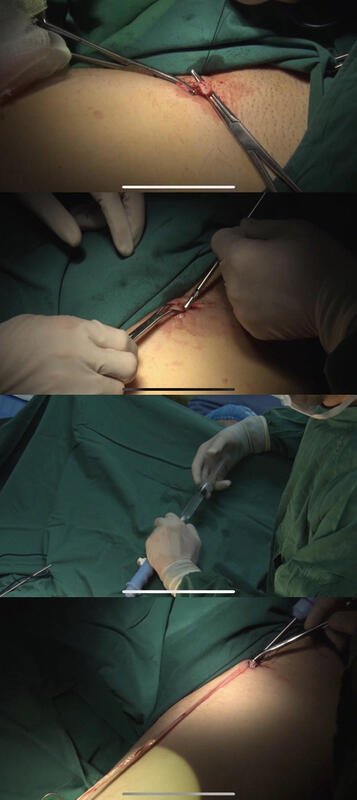
小编:尊敬的种教授,您好,首先特别感谢您于百忙之中接受我们的采访!近一个世纪以来,对单纯性下肢静脉曲张,采用在硬膜外麻醉下行大隐静脉高位结扎剥脱术,此术式一直成为治疗大隐静脉曲张的金典手术方式。随着新科技新技术的发展,目前出现了新的微创治疗方式,也是对传统治疗的补充。您在下肢静脉疾病诊疗方面有着丰富的经验,能否请您根据您的临床经验给我们分享一下当下新的微创治疗方式都有哪些优势? 种振岳教授:静脉曲张是指静脉呈蓝色、膨胀且扭曲成团,其形成原因是原本防止血液倒流的单向瓣膜功能丧失,当这些瓣膜不再发挥作用时,静脉内的血液会淤积,继而使静脉壁扩张,静脉壁可能因不够强韧而无法承受其压力,由此导致了静脉曲张。静脉曲张治疗的目的是使曲张的静脉闭合或去除,从而使血液重新流向健康的静脉。 近几十年来,静脉专家们一直致力于探索一些能够在保证疗效基础上减少手术创伤的方法,即微创手术。近年来出现了以激光、射频、微波等为手段的热消融技术和硬化剂为手段的化学消融技术以及刨吸、剥脱导管为手段的切除技术等多种微创治疗的手术,为静脉曲张患者带来了福音,静脉消融和微创静脉切除术均属于静脉曲张的微创治疗方法。静脉消融,是将一根细管或导管插入曲张的静脉中,利用超声引导,一旦导管的尖端处于合适的位置,由激光纤维或射频波致成的热能,会施加到静脉内壁。其结果是静脉会闭合并最终消失。另外还有硬化剂注射,通过化学作用使曲张的静脉管腔闭塞并最终形成纤维条索。 应用静脉剥脱导管行微创静脉切除,也是近年发展很快的微创治疗方法。 微创治疗方法的优势:治疗有效;内镜下静脉消融术无须住院或住院时间短;不需要外科缝合;通常仅需局部麻醉即可。 微创治疗的不足之处:有的静脉曲张可能无法通过微创手术治疗;可能需要额外的治疗;一些常见的副作用包括出血,感染,静脉炎症;血栓也是静脉腔内治疗的一种很少见的并发症。 小编:静脉曲张传统剥脱术虽然相对简单,但是术后护理的难度增加。近年来,全新外套式剥脱大隐静脉的治疗方法逐渐被越来越多的应用,能否请您根据您的临床经验谈谈传统剥脱术与外套式剥脱的区别,以及全新外套式剥脱术在贵单位的施行现状如何? 种振岳教授:传统治疗下肢静脉曲张的手术方法是高位结扎加剥脱术,具体方法是将大隐静脉从大腿根部高位结扎,阻断血液从此返流,再将大隐静脉主干及曲张的分支静脉剥脱。这一手术解决了静脉曲张手术的三个要点问题:一是阻断返流点,目前最可靠的方法是大隐静脉高位结扎和病变穿通支结扎;二是阻断返流通道;三是去除曲张的静脉团。手术方式的安全性和有效性经受了百余年的临床实践的检验,效果确实而持久,而且手术费用低。但是随着科技的发展及人们生活水平提高,对生活质量的要求越来越高,于是传统的治疗方法的缺陷就不可避免的暴露出来。首先,术后大多数患者会有疼痛活动受限。其次,手术创伤较大,切口不美观。再次,手术创面恢复慢,容易出现创面感染等并发症,术后护理难度大。另外,手术对麻醉的要求也相对较高。 美国医生Dr.Majlessi提出的VenoMerse治疗方式在一定程度上克服了以上不足,使下肢静脉曲张的微创治疗方式更加丰富多彩。其原理是在局麻下做微小切口,用剥脱导管套住需要切除的静脉,通过注射麻醉肿胀液使血管周围产生隧道效应,压迫血管防止出血,在充分静脉血管外剥离后,切除病变静脉血管。此技术为静脉剥脱的微创手术提供全新的解决方案,获得美国国家知识产权局专利授权,得到了国内外专家的临床认可。 手术操作方法:①大腿静脉支点(腹股沟下方一横指处)注射麻醉液②在腹股沟下方一横指处切一公分小口③找出大隐静脉让大隐静脉与周围组织分离、近端结扎、远端通过缝线结扎传入器械④打入麻醉稀释液、器械左右扭动与血管走向平行向前推进 ⑤遇到阻碍或者分支在打入麻醉稀释液然后在推进⑥到达预定位置,推下拨钮截断血管、血管与器械抽出⑦缝合小切口、清洗大腿、然后绷带缠绕大腿。(如下图) 外套式剥脱大隐静脉其优势在于:1.使静脉曲张手术治疗进入微创局麻时代,无需住院,减少医院占床率,契合国家推行的日间手术政策。2.手术除大隐静脉剥脱导管外无需特殊设备及药品。3.腹股沟小切口,腿上无任何切口,不会留下疤痕。4.手术安全、可靠,术后恢复快,操作及各项指标都优于传统內翻剥脱,有利提高患者手术耐受力,加速术后恢复,减少术后并发症。5.局麻替代椎管内麻醉或静脉复合麻醉,降低麻醉风险和成本,降低病人负担。6.外科医生开拓了思路,能掌握更多的手术方法,以便在临床上更加得心应手的选择手术,使患者得到更好的治疗。 2019年初,我们开始引进大隐静脉剥脱导管,在局麻下应用外翻式剥脱大隐静脉手术治疗下肢静脉曲张200余例,取得了良好的效果。 小编:随着全新外套式剥脱大隐静脉的诊治方法逐渐的应用于临床,能否请您根据当下现状,和我们谈谈此术式未来的发展趋势? 种振岳教授:静脉曲张是一类古老的疾病,近20年来,越来越多的微创技术应用于静脉曲张的治疗。治疗理念、治疗方法与技术都有了显著的进步,朝着更有效、更微创的方向发展。但是每种治疗方法各有利弊,每种方法都有其优缺点和适用范围,必须根据病情科学选择。最好的方式是根据患者的具体病情选择合理的治疗方式,尽量减少并发症及复发率。多种方法的联合使用是治疗静脉曲张的发展超势。大隐静脉剥脱导管的出现,实现了剥脱术从主干传统内翻到外套式剥脱的革新,完全改变了既往的剥脱理念,使剥脱术更微创,更便捷,让患者不再惧怕手术带来的痛苦与疤痕,具有良好的应用前景。 内容转载自365医学网
 王坚 主任医师 浙江大学医学院附属第二医院 血管外科2842人已读
王坚 主任医师 浙江大学医学院附属第二医院 血管外科2842人已读 - 引用 您正在服用华法令吗?
华法令是临床常用的口服抗凝药。华法令的治疗窗较窄;不同的患者使用该药后疗效差异较大,应根据患者化验结果——国际标准化比值,在医生的指导下进行药量调整。如果医生和您决定服用华法令,请注意以下几个方面:1. 需要每天定时按照医嘱服药,如果漏服一次应当天立即补服。如忘记补服,第二天不要一次双倍服药,记录并告知医生遗漏服药的次数。漏服三天以上,需要根据化验指标,重新调整服用剂量。2. 华法令达到治疗水平前,应在医生指导下调整服药剂量,并每周监测凝血指标2~3次。若长期治疗,约每4周测定INR,如有波动应告知医生,根据化验指标调整华法令剂量。3. 因维生素K是华法令的拮抗剂。您应限制进食含维生素K高的食物。如猪肉、牛奶、包心菜、莴笋、芦笋、西兰花、菜花、奶酪、芥菜、菠菜、白萝卜、酸奶、豆制品、豆芽。经常食用这些食物可能影响华法令抗凝效果,造成凝血酶原时间(PT)水平不稳定。因此,在服用华法令期间,您应注意膳食平衡。4. 治疗期间尽量避免肌肉注射及做可能会引起受伤的活动。避免摔倒、碰撞等外伤。使用软毛牙刷刷牙、不用牙线、预防牙龈出血。不要采用普通刀片,应选用电动剃须刀。静脉、肌肉穿刺后,需多按压,以预防穿刺部位出血和血肿形成。5. 华法令服用过量时易导致出血,出血可能非常严重,如颅内出血,胸腔、腹腔出血。药物过量的早期症状:血尿、牙龈出血、月经过量及黑便等。若有不正常出血征象或瘀青要及时就诊。6. 服用华法令期间没有医生的建议,不应随意增加、停止或改变自己的任何用药。因为阿司匹林、布洛芬、保泰松、氯霉素、甲硝唑、西咪替丁等会增强华法令的作用,增加出血的风险;而酒精、苯巴比妥、含雌激素的口服避孕药、维生素K等,会降低华法令的作用。7. 不建议经常更换不同厂家的华法令,产品其生物利用度会有差异。如有调换,需在医生指导下重新调整药量。8. 在抗凝治疗期间病人应随身携带抗凝药物使用卡。在接受牙科治疗或其他外科手术前,应告知医生自己正在接受华法令治疗。如有下列情况应先停药并立即至医院诊治1. 刷牙时或割伤后流血不止;2. 无故瘀青且范围扩大;3. 咳血、吐血、血尿、血便或黑便;4. 严重头疼,腹疼;、5. 严重皮疹、皮肤坏死
刘震杰 主任医师 浙江大学医学院附属第二医院 血管外科1839人已读 - 引用 怎么选择合适的弹力袜?
医用弹力袜,既医用循序减压弹力袜,通过从踝部到大腿递减的压力梯度来促进下肢静脉血液向心脏回流,是下肢静脉曲张以及下肢静脉功能不全治疗过程中重要的辅助治疗手段,也是下肢静脉高压的有效预防手段。哪些人需要穿用弹力袜?弹力袜有促进静脉回流的功能,适用人群:l 下肢静脉曲张术前、术后以及下肢深静脉血栓形成患者慢性期的辅助治疗。l 需要长时间站立或坐立的人群,如伴重体力劳动尤其需要。l 孕妇、过度肥胖者腹部压力增高导致下肢静脉压增高者。l 频繁需要乘坐飞机或其他交通工具长途旅行者。l 有下肢静脉曲张家族史的人群l 偏瘫或外科手术后需长期卧床患者、恶性肿瘤患者等深静脉血栓高危人群。下肢静脉曲张手术后为什么还要穿用弹力袜?引起静脉曲张的下肢静脉高压原因复杂,单纯手术无法解决所有诱发因素,因此虽然剥脱或闭合了曲张静脉,仍需以弹力袜加强保护。静脉曲张术后穿用弹力袜可以减少静脉血瘀滞,帮助下肢静脉血回流,消除术后下肢肿胀,防止术后复发,建议长期穿用。弹力袜的压力分级以及相应的适应症是什么?根据弹力袜所产生的压力不同,将之分为3级,其中压力1级为预防型,压力2-3级为治疗型。l 压力1级(16-22mmHg)适用于:工作中长期站立或静坐的人群孕妇、体型肥胖者或经常长途旅行人群没有明显水肿的轻度静脉曲张患者对于术后或长期卧床患者预防静脉血栓l 压力2级(23-36mmHg)适用于:伴有轻度或明显水肿的静脉曲张患者静脉曲张外科手术或硬化治疗后严重的反复发作的溃疡愈合下肢深静脉血栓形成患者l 压力三级(37-46mmHg)适应于:严重的深静脉血栓后遗症患者,不可逆淋巴水肿或下肢高度肿胀患者。弹力袜就是网上说的“瘦腿袜”吗?弹力袜并非网上所说的“瘦腿袜”,它主要通过物理作用来压缩肌肉体积和减轻水肿,因而在外观上有“瘦腿”效果。所谓的“瘦腿袜”因为没有递减的压力梯度,会造成近端高压,不利于静脉血的回流,反而会加重肢体的肿胀。弹力袜需要整天穿着吗?l 弹力袜原起床时穿好,然后进行日常活动,晚上睡觉平卧时可将弹力袜脱下,并不需要24小时持续穿用。l 特殊情况下,如下肢静脉硬化治疗当天需持续穿用24小时。如何选择合适的弹力袜?首先根据穿用者的腿部症状选择合适的压力,根据静脉曲张的部位选择弹力袜的长度,分别测量踝关节周长、小腿肚最粗处的周长以及大腿最大周长,以确定合适的尺码。如何穿戴弹力袜?弹力袜较紧,穿用时比较困难,需掌握一些技巧。如图所示,先把袜子反折到踝部,然后穿戴好足部,再把袜子反折部分向小腿处拉伸穿戴完毕。有些弹力袜有配套的足套,可以先将足套穿戴好。弹力袜日常保养小贴士l 注意在穿脱弹力袜时不要让饰品或指甲刮伤弹力袜。l 洗涤要用中性洗涤剂在温水中水洗,不要拧干,于阴凉处凉干,勿置于阳光下或人工热源下晾晒或烘烤。l 穿着弹力袜时应逐段拉紧、平展,不能拉住袜边强行拉拽。
刘震杰 主任医师 浙江大学医学院附属第二医院 血管外科8489人已读 - 引用 腹主动脉瘤或可药物治疗
随着人口老龄化,腹主动脉瘤的发病率逐年上升。目前,对于腹主动脉瘤的治疗,尚无明确有效的药物,也没有预测其破裂的标记物。因此,对于瘤体较小的患者,主要通过控制血压、血脂等治疗方案;对瘤体较大的患者,则需要进行手术或者介入治疗来预防瘤体破裂。近日,在心血管专业期刊Circulation Research上的一篇研究论文中,来自浙医二院血管外科的刘震杰和威斯康星大学的研究人员通过合作研究揭示,炎症细胞自分泌的基质蛋白TSP1,在腹主动脉瘤的发生及进展中起了重要作用。该研究通过了人体腹主动脉瘤壁标本和动物模型,观测到血管壁上TSP1蛋白高表达。在随后动物模型的研究中,TSP1基因敲除小鼠较之野生型小鼠,虽然血管壁分泌的炎症介质改变不大,但是血管壁内炎症细胞更少,也更不易诱导出腹主动脉瘤。进一步的研究发现,瘤壁内单核细胞和巨噬细胞减少,与这些炎症细胞自分泌的TSP1相关,因为TSP1对炎症细胞的黏附迁移具有重要作用。为了深入研究TSP1的功能,该研究还通过基因工程,构建了TSP1蛋白C端单体、C端三体和N端肽段。发现了TSP1结构和不同部位的肽段,对炎症细胞的黏附和迁移具有不同的作用。由于瘤壁内的炎症细胞,在腹主动脉瘤的发病机制中起重要作用,因此该研究认为,TSP1可能是治疗腹主动脉瘤的一个靶点。来自NIH癌症中心的Roberts教授针对该论文撰写了相关评论,认为该研究的发现为今后腹主动脉瘤预防和治疗提供了新的思路。由于糖尿病、肥胖和高血压患者相应组织中,也存在TSP1升高的情况。因此,通过抑制TSP1的表达或阻断TSP1的受体,如CD47,可能是治疗这些疾病的一种新方法。
刘震杰 主任医师 浙江大学医学院附属第二医院 血管外科2775人已读 - 引用 双侧坐骨动脉未闭导致慢性下肢缺血一例
刘震杰1,沈来根1 (1. 浙江大学医学院附属第二医院 杭州310016)患者,女性,15岁。因“双下肢乏力7年,加重伴间歇性跛行1年”于2009年11月28日入院。患者7年前五明显诱因下出现双下肢乏力,剧烈运动后加剧,休息后缓解;近1年来,患者双下肢乏力加重,并伴有间歇性跛行,跛行距离约500米。既往无外伤史。查体:双下肢股动脉、腘动脉及足背动脉搏动未及,双足皮肤苍白,皮温低。下肢动脉彩超提示双侧股浅动脉血流信号低。入院后,经肱动脉双下肢动脉造影提示:双侧髂内动脉明显较髂外动脉增粗;双侧坐骨动脉未闭(见图1),双侧髂动脉、股总动脉和近端股浅动脉发育不良(见图2),坐骨动脉向下延续与腘动脉交通(见图3)。考虑到患者年龄,及下肢缺血症状,予以门诊定期随访。讨论 在胚胎早期阶段,坐骨动脉为脐动脉分支是下肢主要血供。从胚胎发育第3月起,坐骨动脉蜕化,脐动脉亦蜕化为髂内动脉,下肢血供主要由髂外动脉和股动脉供应,胎儿出生时,坐骨动脉蜕化形成臀下动脉[1]。如果坐骨动脉未蜕化且仍为下肢主要血供来源,称之为坐骨动脉未闭[2-4]。 坐骨动脉未闭可继发形成动脉瘤和导致下肢动脉血栓形成并继发动脉栓塞,从而出现下肢缺血症状[5-7]。1832年,坐骨动脉未闭首次被发现[8]。1960年,Cowie通过血管造影对坐骨动脉未闭进行了详细描述[9]。本病罕见,无性别差异,发病率为0.025%~0.04%[10],其中50%的患者单发于右侧,20%单发于左侧,30%累及双侧[11],15岁~85岁皆有报道。随着年龄增长,患者未闭的坐骨动脉会发生扭曲增粗。同时,由于股动脉发育不良,下肢主要血供来自坐骨动脉,因此髂内动脉通常都粗于髂外动脉。15%~40%的坐骨动脉未闭患者会因为坐骨动脉退行性变而形成坐骨动脉瘤,坐骨动脉瘤可继发血栓形成和动脉栓塞,伴有疼痛的搏动性包块,瘤体破裂和坐骨神经压迫[12]。7%~9%的坐骨动脉未闭患者会发生坐骨动脉狭窄和闭塞,从而出现间歇性跛行,血栓形成或者栓塞导致的下肢缺血,其中8%的患者因此而截肢[13]。体检可发现Cowie's征,即股动脉搏动消失,但是远端腘动脉及足背动脉搏动可及。需要注意的是,坐骨动脉未闭的患者常常伴有股动脉的发育不良,当坐骨动脉血栓形引起下肢急性缺血时,需要与股动脉急性栓塞进行鉴别诊断。血管造影能够明确诊断坐骨动脉未闭,同时可以对坐骨动脉流出道进行评价以明确分型。CTA和MRA能够对坐骨动脉大小、位置、骨性标志、邻近结构进行评价,用于指导手术及术后随访。彩超可以用于评价股腘动脉发育情况,动脉粥样硬化程度,亦可探查坐骨动脉形态,是否与腘动脉相通,以便于鉴别坐骨动脉未闭和股腘动脉栓塞。根据是否为下肢主要血供,未闭的坐骨动脉可分为完全型和不完全型。完全型的未闭坐骨动脉与腘动脉相通且是下肢的主要血供,同时常伴有股动脉的发育不良,股浅动脉多终止于大腿部;不完全型的未闭坐骨动脉与腘动脉不相通,股动脉是下肢的主要血管,未闭的坐骨动脉多终止于大腿部[1,2,4,14]。Pillet等将坐骨动脉未闭分为四型[15]:1型坐骨动脉未闭且股动脉发育良好;2型坐骨动脉未闭且与腘动脉相通,伴股动脉发育不良,2a型股浅动脉与腘动脉不相通,2b型股动脉缺失;3型坐骨动脉未闭,但是仅残留上半部分,未与腘动脉相通,;4型坐骨动脉未闭,但仅残留下半部分。Gauffre等将发自骶正中动脉的坐骨动脉列为第5型[16]。无症状的患者无需手术和腔内治疗,但需要定期随访。有症状的患者根据临床症状,解剖分型,血管闭塞部位或动脉瘤特征可以选择外科手术或者血管腔内治疗。未闭坐骨动脉瘤可以通过结扎,切除、栓塞,或者覆膜支架植入进行治疗;动脉瘤体切除后可以用自体静脉或者人工血管进行血管重建。下肢缺血可以通过股腘动脉旁路,髂腘动脉旁路进行血运重建[17]。 参考文献[1] Sidway AN. Embryology of the vascular system. In: Rutherford RB, editor. Vascular surgery. 6th ed. Philadelphia: Elsevier; 2005. p. 53-63.[2] Kritsch D, Hutter HP, Hirschl M, et al. Persistent sciatic artery: an uncommon cause of interminttent claudication [J]. Int Angiol, 2006, 25(3): 327-329.[3] Patel SN, Reilly JP. Persistent sciatic artery-a curious vascular anomaly[J]. Catheter Cardiovasc Interv, 2007, 70(2): 252-255.[4] Brancaccio G, Falco E, Pera M, et al. Symptomatic persistent sciatic artery[J]. J Am Coll Surg, 2004,198(1): 158.[5] Hiki T, Okada Y, Wake K, et al. Embolization for a bleeding pelvic fracture in a patient with persistent sciatic artery[J]. Emerg Radiol, 2007, 14(1): 55-57.[6] Littler P, Blair SD, Lea S. Angioplasty via retrograde popliteal approach in a stenosed persistent sciatic artery[J]. Eur J Vasc Endovasc Surg, 2007, 34(6): 719-722.[7] Shiwan KS, Nghi BP, Snehal D, et al. Symptomatic persistent sciatic artery in a newborn[J]. J Pediatr Surg, 2008, 43(9): 1741-1744[8] Green P. On a new variety of the femoral artery[J]. Lancet, 1832: 1730-1732.[9] Cowie TN, Mckellar NJ, McLean N, et al. Unilateral congenital absence of the external iliac and femoral arteries[J]. Br J Radiol, 1960, 33: 520-522.[10] Donovn DL, Sharp WV. Persistent sciatic artery: two cases reports with emphasis on embryologic development[J]. Surgery, 1984, 95(3): 363-366.[11] SreeKumar KP, Prabhu NK, Moorthy S. Bilateral persistent sciatic artery: demonstration of the anomayly and its complications with intra arterial contrast enhanced spiral CT[J]. Indian J Radiol Imaging, 2004, 14: 205-207.[12] Ertuk SM, Tatli S. Persistent sciatic artery aneurysm[J]. J Vasc Interv Radiol, 2005, 16(10): 1407-1408.[13] Van Hooft IM, Zeebregts CJ, van Sterkenburg SM, et al. The persistent Sciatic Artery[J]. Eur J Vasc Endovasc Surg, 2009, 37(5): 585-591.[14] Como JJ, Cooper C, Mirvis SE, et al. Penetrating trauma to a persistent sciatic artery[J]. J Trauma, 2005, 59(1): 246-248.[15] Pillet J, Cronier P, Mercier Ph, et al. The ischiopopliteal arterial trunk: a report of two cases[J]. Anat Clin, 1982, 3: 329-331.[16] Gauffre S, Lasjaunias P, Zerah M. Sciatic artery: a case, review of literature and attempt of systematization[J]. Surg Radiol Anat, 1994, 16(1): 105-109.[17] Batchelor TJ, Vowden P. A persistent sciatic artery aneurysm with an associated internal iliac artery aneurysm[J]. Eur J Vasc Endovasc Surg, 2000, 20(4): 400-402.
刘震杰 主任医师 浙江大学医学院附属第二医院 血管外科1709人已读 - 引用 上肢深静脉血栓形成的诊治进展
上肢深静脉血栓形成占DVT(Deep Vein Thrombosis, DVT)发生率的10%,年发病率为0.04-0.1‰[1-3]。随着中心静脉置管和心脏起搏器的广泛开展,上肢DVT发病率呈逐年上升趋势。相对于下肢DVT,上肢DVT的发病机理有所不同,相关并发症的发生率也明显不同。因此,上肢DVT的诊断与治疗有其特殊性。本文通过文献复习,对上肢DVT的诊治进展进行综述。1 病因 上肢DVT的病因分为原发性和继发性,其中继发性占80%。原发性上肢DVT的病因主要有胸廓出口综合征和Paget–Schroetter综合征[4,5],见表1。继发性上肢DVT 的病因主要有导管相关性、肿瘤相关性及激素相关性,常规筛查显示三分之二的患者血栓形成与中心静脉置管相关[6]。根据目前的临床研究数据显示上肢DVT的并发症与下肢DVT有所不同,如肺栓塞(上肢6%[2,7],下肢15~32%[8,9]),一项纳入512例患者的前瞻性研究显示,上肢DVT发病后 3个月内,仅1例患者死于肺栓塞[2];1年内DVT复发率(上肢2~5%[2,10,11],下肢10%[12]);DVT后综合征(上肢5%[13] ,下肢56%[14]),DVT治疗 6个月后,导管相关性血栓的患者出现DVT后综合征相对较低[12]。2 诊断2.1症状与体征 上肢DVT的症状表现为手臂不适、疼痛、感觉异常、无力,典型的症状包括肿胀、水肿、肤色改变以及可见的静脉侧支。当肿瘤细胞浸润上腔静脉后可出现静脉回流障碍,表现为面部肿胀、头痛、恶心及呼吸急促。当手臂抬高后末端浅静脉持续显现也需要考虑锁骨下或无名静脉DVT。2.2 D二聚体检测 D二聚体敏感性高,阴性可以排除静脉血栓形成。由于上肢DVT的病人多伴有癌症及中心静脉置管,D二聚体检测假阳性率高,故不能单独用于诊断上肢DVT。一项纳入52例可疑上肢DVT的患者,其中包括23例癌症患者和18例置管患者,通过酶联免疫方法检测D二聚体,虽然敏感性100%,但只有14%的准确率,假阳性率高达86%[15]。2.3 血管超声检查 血管超声检查发现静脉不能被压陷是静脉血栓形成的重要依据,也是下肢DVT诊断的临床标准,可以作为疑似上肢DVT首选的检查。有研究表明静脉加压超声成像对诊断上肢DVT的敏感性为97%,特异性为96%[16]。然而,锁骨下静脉和无名静脉上方有锁骨及肋骨,因此无法采用以上超声技术进行诊断。上肢DVT患者在Valsalva动作时,多普勒超声可以显示异常多普勒波形或血流速度改变,因此如有异常的多普勒信号存在,则需要进一步的其他检查[16]。2.4 CT、核磁共振检查 当静脉多普勒超声等检查结果不确定:比如肿瘤或相关淋巴结肿大压迫静脉或者静脉胸廓出口综合征时,CT三维血管重建和核磁共振三维血管重建有一定的诊断价值。2.5静脉造影 虽然上肢DVT超声检查已部分取代了常规静脉造影,但静脉造影术在超声诊断不明确、插管溶栓前及静脉性胸廓出口综合征手术减压前仍有较大价值。肢体外展或当肋锁交界处静脉血栓形成造成残余静脉狭窄时,可以用位置性静脉造影加以诊断,但静脉造影术存在造影剂静脉注入、辐射接触和侧支静脉显影不良的缺点,严重的肾功能不全和含碘造影剂过敏者则无法进行静脉造影。3 治疗 上肢DVT治疗的目的是缓解症状,防止血栓进展,避免早期复发,预防肺梗塞和DVT后综合征。主要的治疗方法有抗凝治疗,溶栓,插管溶栓和手术治疗。发生导管相关性血栓形成后并不常规拔除导管。对于需要静脉用药、血液采样或者静脉通路建立困难的患者,往往需要进一步评估后再做决定。只有当导管完全堵塞并发导管相关性感染,存在抗凝禁忌或者抗凝后上肢DVT症状体征无法缓解、导管已无保留必要时才予以拔除导管。上肢DVT患者拔除导管的时机目前尚无定论,一项纳入74例上肢DVT患者的队列研究表明(中心静脉置管77%,植入式输液港19%, Hickman导管4%),抗凝治疗3个月后,57%的患者导管再通,43%的患者因各种原因拔除导管[17]。3.1 抗凝治疗3.1.1 普通肝素与低分子肝素的治疗 上肢DVT患者早期抗凝治疗中,究竟采用普通肝素还是低分子肝素目前尚无定论。目前用于指导上肢DVT患者抗凝治疗的依据主要参考下肢DVT患者的抗凝方案。一项纳入22个试验(8867位患者)比较低分子肝素和普通肝素治疗下肢DVT患者的荟萃分析显示,低分子肝素组患者6个月内血栓复发率和死亡率较普通肝素低;治疗期间,低分子肝素组出血率较普通肝素组低[18]。在4个共纳入209例上肢DVT患者的临床研究中,低分子肝素组复发率为1.9%,出血率2%-4%[17,19],随访中无肺栓塞发生[17,19-21]。因此,对于上肢DVT患者早期推荐低分子肝素进行抗凝治疗,但是目前上肢DVT患者早期低分子肝素抗凝治疗中,采用每日一次还是每日两次还没有相关对比试验数据。普通肝素目前仅推荐用于严重肾功能衰竭的上肢DVT患者。3.1.2 抗凝治疗持续时间 目前对上肢DVT患者最佳的持续抗凝治疗时间尚无随机对照研究数据。在队列研究中提示采用维生素K拮抗剂治疗3~6个月的上肢DVT患者复发率较低[10,19,22]。因此,随访的上肢DVT患者的首选治疗方案仍是口服维生素K拮抗剂,但是癌症患者首选低分子肝素进行抗凝治疗[23]。3.2溶栓治疗 对近期发病、肢体肿胀、功能障碍且出血风险低的上肢DVT患者可以考虑溶栓治疗。目前用于指导上肢DVT患者的溶栓治疗方案主要根据下肢DVT患者的溶栓治疗。在一个纳入473例患者的多中心临床试验提示,对发病10天以内的上肢DVT患者,导管溶栓最为有效[24]。一个纳入35例患者的随机试验中提示插管溶栓组的静脉再通率明显高于单独抗凝组(72%比12%),且深静脉瓣膜破坏后静脉返流率更低(11%比41%)[25]。较之全身溶栓,采用插管溶栓的下肢DVT患者具有较高的静脉再通畅率、较低的出血率和血栓后综合征。 上肢DVT患者溶栓治疗的临床数据很少。一项纳入30名上肢DVT患者的临床试验提示,使用重组组织型纤溶酶原激活剂(rt-PA)插管溶栓的患者,部分或完全再通率是97%,出血率为9%,轻度血栓后综合征为21%[26]。虽然血管再通率尚可,但对于上肢DVT形成的患者来说,在减低血栓复发、肺栓塞及血栓后综合症上,溶栓治疗是否比单独使用抗凝药物更有效尚无对比数据。3.3介入治疗 部分上肢DVT患者经过抗凝和溶栓治疗后,症状和体征仍无法缓解时可考虑介入治疗。介入治疗主要包括血栓吸除术、血栓旋切术、球囊成形、支架植入等。在一项纳入49例上肢DVT患者的临床试验中提示静脉支架植入近期效果良好,但在两年内有62%的患者需要重复干预[27]。对于胸廓出口综合征引起的上肢DVT患者,由于支架变形断裂和血栓复发的比例较高,因此不推荐使用静脉内支架植入[28]。介入治疗的并发症包括血栓的复发、肺栓塞和出血。3.4药物介入溶栓 结合了插管溶栓和介入治疗。在一项纳入93例下肢DVT患者的临床研究显示,药物介入溶栓和插管溶栓效果相近,但药物介入溶栓具有住院时间短的优势[29]。目前尚缺乏药物介入溶栓的大样本临床试验数据。3.5外科手术 部分上肢DVT患者经过抗凝和溶栓治疗后,症状和体征仍无法缓解时也可考虑手术治疗。手术方式主要包括血栓切除术,静脉成形术,静脉旁路术和胸廓出口综合征减压术。目前上肢DVT患者的手术治疗效果尚无临床随机对照试验数据。一项比较手术取栓与髂股血栓患者单独抗凝的随机临床试验显示,术后 6个月,手术组静脉通畅率较高(76%比35%),血栓后综合征较低(7%比42%)[30]。胸廓出口综合征减压术主要通过腋下入路、锁骨上入路或锁骨下入路切除第一肋骨,部分外科医生建议切除肋锁韧带和前斜角肌。两项共纳入240例患者的临床试验显示胸廓出口综合征减压术后的静脉通畅率高,随访的过程中高达85%的患者没有出现DVT后综合征[31]。手术术后并发症包括血气胸,胸长神经或膈神经损伤,血肿,锁骨下动脉血栓形成。3.6个体化治疗 目前,国际上部分研究所已经根据患者的实际情况,采用个体化治疗方案治疗上肢DVT。对于没有症状或有轻微症状的患者采用单独抗凝治疗;有肢体肿胀和手臂功能障碍的患者结合插管溶栓和抗凝治疗。DVT形成后1~3个月,需要对患者进行重新评估。针对血栓后综合征的患者如出现压痛、无力、水肿、静脉侧支形成、红斑或皮肤硬结,通过特殊体位的静脉造影明确诊断有胸廓出口综合征的则选用经皮穿刺球囊成形术进行静脉再通。两项分别纳入22例和50例原发性上肢DVT患者的个体化治疗临床试验显示治疗后无患者出现继发血栓,80%的患者在术后3年随访中没有出现血栓形成后综合征[32,33]。4 预防 目前,对有中心静脉置管的患者不建议常规进行药物预防。一项纳入7个随机对照试验的荟萃分析提示,使用抗凝剂可降低有中心静脉导管的癌症患者血栓形成的风险,但是将单独采用低分子肝素、普通肝素和安慰剂做对比,以及单独采用小剂量华法令和安慰剂做对比均显示对上肢深静脉血栓形成无明显改善[34]。因此,对有中心静脉导管的癌症患者是否要预防性抗凝仍需进一步的临床试验研究。 对于上肢DVT患者是否需要进行上腔静脉滤器植入预防肺栓塞目前尚无定论。一项纳入209例上腔静脉滤器植入的上肢DVT患者回顾分析提示,3.8%的患者出现了严重并发症,包括心包填塞(4例),主动脉瓣穿孔(2例),气胸(1例)[6]。因此,上腔静脉滤器植入仅限于抗凝治疗禁忌或者充分抗凝治疗后仍有肺栓塞的患者。5 目前亟需解决的问题 对于上肢DVT的诊治流程仍需要进一步的优化。目前对于上肢DVT的治疗依据主要根据下肢DVT的循证医学数据,缺乏上肢DVT治疗的临床对照研究;二级预防的持续抗凝时间尚不明确;上肢DVT高危患者是否需要预防性抗凝,缺乏相关研究证据。6 结论对于存在高危因素的患者,如手臂剧烈运动、癌症或DVT病史、中央静脉置管以及起搏器植入,一旦出现急性上肢肿胀需要考虑上肢DVT。当上肢DVT诊断明确时,需要尽早开始抗凝治疗,抗凝方案为低分子肝素每日一次皮下注射。如症状明显且合并上肢功能障碍,则需要进行溶栓治疗。急性期治疗完成后,患者仍需抗凝治疗3~6个月,其中非癌症患者推荐口服华法令,对癌症患者则推荐低分子肝素,见表1。参考文献[1] Joffe HV, Kucher N, Tapson VF, et al. Upper-extremity deep vein thrombosis: a prospective registry of 592 patients . Circulation, 2004, 110(12): 1605-1611.[2] Muoz FJ, Mismetti P, Poggio R, et al. Clinical outcome of patients with upper-extremity deep vein thrombosis: results from the RIETE Registry . Chest , 2008, 133(1): 143-148.[3] Isma N, Svensson PJ, Gottster A,et al. Upper extremity deep venous thrombosis in the population-based Malm Thrombophilia Study (MATS): epidemiology, risk factors, recurrence risk, and mortality . Thromb Res , 2010, 125(6): e335-e338.[4] Aziz S, Straehley CJ, Whelan TJ Jr. Effort-related axillosubclavian vein thrombosis:a new theory of pathogenesis and a plea for direct surgical intervention . Am J Surg ,1986,152(1):57-61.[5] Illig KA, Doyle AJ. A comprehensive review of Paget-Schroetter syndrome. J Vasc Surg , 2010, 51(6): 1538-1547.[6] Verso M, Agnelli G. Venous thromboembolism associated with long-term use of central venous catheters in cancer patients . J Clin Oncol ,2003, 21(19): 3665-3675.[7] Owens CA, Bui JT, Knuttinen MG, et al. Pulmonary embolism from upper extremity deep vein thrombosis and the role of superior vena cava filters: a review of the literature .J Vasc Interv Radiol , 2010, 21(6): 779-787.[8] Kucher N, Tapson VF, Goldhaber SZ. Risk factors associated with symptomatic pulmonary embolism in a large cohort of deep vein thrombosis patients . Thromb Haemost , 2005, 93(3): 494-498.[9] Stein PD, Matta F, Musani MH,et al. Silent pulmonary embolism in patients with deep venous thrombosis: a systematic review . Am J Med , 2010, 123(5): 426-431.[10] Flinterman LE, van Hylckama Vlieg A, Rosendaal FR, et al. Recurrent thrombosis and survival after a first venous thrombosis of the upper extremity . Circulation , 2008, 118(13): 1366-1372.[11] Martinelli I, Battaglioli T, Bucciarelli P, et al. Risk factors and recurrence rate of primary deep vein thrombosis of the upper extremities . Circulation , 2004, 110(5): 566-570.[12] Heit JA, Mohr DN, Silverstein MD,et al. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study .Arch Intern Med ,2000,160(6):761-768.[13] Elman EE, Kahn SR. The post-thrombotic syndrome after upper extremity deep venous thrombosis in adults: a systematic review . Thromb Res , 2006, 117(6): 609-614.[14] Schulman S, Lindmarker P, Holmstrm M, et al. Post-thrombotic syndrome, recurrence, and death 10 years after the first episode of venous thromboembolism treated with warfarin for 6 weeks or 6 months . J Thromb Haemost ,2006, 4(4): 734-742.[15] Merminod T, Pellicciotta S, Bounameaux H. Limited usefulness of D-dimer in suspected deep vein thrombosis of the upper extremities . Blood Coagul Fibrinolysis , 2006, 17(3): 225-226.[16] Di Nisio M, Van Sluis GL, Bossuyt PM,et al. Accuracy of diagnostic tests for clinically suspected upper extremity deep vein thrombosis: a systematic review. J Thromb Haemost ,2010, 8(4): 684-692.[17] Kovacs MJ, Kahn SR, Rodger M, et al. A pilot study of central venous catheter survival in cancer patients using lowmolecular-weight heparin (dalteparin) and warfarin without catheter removal for the treatment of upper extremity deep vein thrombosis (The Catheter Study). J Thromb Haemost ,2007, 5(8): 1650-1653.[18] van Dongen CJ, van den Belt AG, Prins MH, et al. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev , 2004, (4): CD001100.[19] Savage KJ, Wells PS, Schulz V, et al. Outpatient use of low molecular weight heparin (Dalteparin) for the treatment of deep vein thrombosis of the upper extremity.Thromb Haemost ,1999, 82(3): 1008-1010.[20] Karabay O, Yetkin U, Onol H. Upper extremity deep vein thrombosis: clinical and treatment characteristics . J Int Med Res ,2004, 32(4): 429-435.[21] Prandoni P, Bernardi E, Marchiori A, et al. The long term clinical course of acute deep vein thrombosis of the arm: prospective cohort study. BMJ, 2004, 329(7464): 484-485.[22] Hingorani A, Ascher E, Ward M, et al. Combined upper and lower extremity deep venous thrombosis . Cardiovasc Surg , 2001, 9(5): 472-477.[23] Kearon C, Kahn SR, Agnelli G, et al. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) . Chest , 2008, 133 (6 Suppl): 454S-545S.[24] Mewissen MW, Seabrook GR, Meissner MH, et al. Catheter-directed thrombolysis for lower extremity deep venous thrombosis: report of a national multicenter registry. Radiology ,1999, 211(1): 39-49. [25] Elsharawy M, Elzayat E. Early results of thrombolysis vs anticoagulation in iliofemoral venous thrombosis: a randomised clinical trial . Eur J Vasc Endovasc Surg, 2002, 24(3): 209-214.[26] Vik A, Holme PA, Singh K, et al. Catheter-directed thrombolysis for treatment of deep venous thrombosis in the upper extremities . Cardiovasc Intervent Radiol , 2009, 32(5): 980-987.[27] Oderich GS, Treiman GS, Schneider P,et al. Stent placement for treatment of central and peripheral venous obstruction: a long-term multi-institutional experience. J Vasc Surg , 2000, 32(4): 760-769.[28] Meier GH, Pollak JS, Rosenblatt M,et al. Initial experience with venous stents in exertional axillarysubclavian vein thrombosis . J Vasc Surg , 1996, 24(6): 974-981.[29] Lin PH, Zhou W, Dardik A, et al. Catheter-direct thrombolysis versus pharmacomechanical thrombectomy for treatment of symptomatic lower extremity deep venous thrombosis . Am J Surg ,2006, 192(6): 782-788.[30] Plate G, Einarsson E, Ohlin P, et al. Thrombectomy with temporary arteriovenous fistula: the treatment of choice in acute iliofemoral venous thrombosis . J Vasc Surg , 1984 , 1(6): 867-876.[31] Lee JT, Karwowski JK, Harris EJ, et al. Long-term thrombotic recurrence after nonoperative management of Paget-Schroetter syndrome .J Vasc Surg , 2006, 43(6): 1236-1243.[32] Machleder HI. Evaluation of a new treatment strategy for Paget-Schroettersyndrome: spontaneous thrombosis of the axillary-subclavian vein . J Vasc Surg, 1993, 17(2): 305-315.[33] Lee WA, Hill BB, Harris EJ, et al. Surgical intervention is not required for all patients with subclavian vein thrombosis . J Vasc Surg, 2000, 32(1): 57-67.[34] Akl EA, Kamath G, Yosuico V, et al. Thromboprophylaxis for patients with cancer and central venous catheters: a systematic review and a meta-analysis. Cancer, 2008, 112(11): 2483-2492.
刘震杰 主任医师 浙江大学医学院附属第二医院 血管外科5505人已读 - 引用 腔静脉滤器在老年下肢深静脉血栓患者治疗中的应用
急性下肢深静脉血栓(deep venous thrombosis, DVT)形成可阻塞正常生理性静脉回流,引起远端组织肿胀,水肿,严重时可因压力过高影响动脉血供。DVT最严重的并发症是血栓不稳定或受到挤压后脱落,随静脉血进入肺循环,发生肺动脉栓塞(pulmonary embolism,PE)。DVT是临床高发病之一,对DVT的治疗模式和适应症掌握有所不同[1-2]。我们总结2006年1月~2009年12月本院血管外科置入下腔静脉滤器(Inferior Vena Cava Filters,IVCF)处理的DVT患者77例,对DVT的治疗经验进行总结。1. 资料与方法1. 1 研究对象选择2006年1月~2009年12月本院血管外科置入IVCF的急性DVT患者77例,男46例,女31例,年龄18~84(62.9±13.8)岁,病程1~10天。将年龄≧60岁的48例作为老年组,男26例,女性22例,年龄60~84( 71.97±5.33)岁。年龄﹤60的29例为非老年组,男20例,女9例,年龄区间18-59(47.76±9.65)岁。发病部位左下肢49例,右下肢28例。中央型20例,周围型14例,混合型43例。病因明确者48例,主要以外科手术、骨折、长期卧床、肿瘤等因素为主;病因不明者29例。有明确心、脑血管伴发疾病的患者为52例,其中脑卒中偏瘫患者21例。患者主要以患肢肿胀、活动疼痛就诊,皮肤色泽青紫或呈充血状,小腿后群肌张力升高,腓肠肌握痛(+),Horman征(+)。患肢膝关节上15cm周径为(54.75±4.22) cm。适应症选择:患者存在抗凝绝对禁忌症,髂、股静脉大量新鲜血栓形成漂浮性血栓,足量抗凝治疗,仍怀疑发生PTE;已有充分证据证明PTE。1.2 方法常规介入前准备,经预判健侧股静脉顺行穿刺,行髂静脉及腔静脉造影,明确血栓部位、范围,明确双侧肾静脉开口位置。输送下腔静脉滤器( inferior vena cava filter, IVCF)于双肾静脉开口下方0. 5~1. 0 cm处,释放固定。接触性导管溶栓方法:IVCF释放后,经血管鞘沿健侧股静脉、髂静脉导入超滑Cobra导管,配合导丝选择患侧髂静脉。沿血管走行首先以导丝侵入血栓内部,尽量将导管引导至患侧股静脉中段或腘静脉,造影观测患侧血栓情况,留置导管,缝合固定。经留置Cobra导管或溶栓导管以微量泵输注普通肝素及尿激酶,常规用量为肝素12500 U/天,尿激酶20~50万U/次,1次/6~8h。凝血功能监测包括:部分凝血活酶时间(APTT) ,控制在50~90s,纤维蛋白原≧1g/L。溶栓治疗3~5d后,再次造影观察,拔除溶栓导管。外周血管溶栓治疗方法:未进行接触性导管溶栓的患者,均采用外周静脉输注肝素和尿激酶,每日用量同接触性溶栓治疗,用药时间为5~7d。所有接触性导管溶栓患者术后35天再次行髂静脉及腔静脉造影复查。本研究以术后治疗3d患肢膝关节上15cm周径与治疗前比较作为判断疗效的依据,比较2组疗效的差异。1.3 后期治疗停用尿激酶后给与口服华法林,肝素重叠治疗3~4天,监测凝血酶原时间国际标准化比值(pt-INR)>1.5可停用肝素。调整华法林用药,控制pt-INR测定值2.0~2.5。所有患者均行盆腔超声或CT扫描除外血管外压性病变。1.4统计学方法应用SPSS16.0统计软件,数据用均数±标准差(x±s)表示,采用配对T检验和析因方差分析,p﹤0.05为差异有统计学意义。2. 结果2.1老年组与非老年组患者临床资料比较老年组患者就诊时间3~10天,非老年组就诊时间2~7天;老年组有明确发病病因者30例,占62.5%,非老年组18例,占62.1%;病因不明者老年组18例,占37.5%,非老年组11例,占37.9%。有明确心、脑血管伴发疾病的患者为52例,其中老年组46例,占88.5%,非老年组6例,占11.5%;脑卒中偏瘫患者21例,其中老年组19例,占90.5%,非老年组2例,占9.5%。老年组患者有明确心、脑血管伴发疾病和脑卒中偏瘫的比例明显高于非老年组(P<0.01)。 2.2置入IVCF治疗效果77例患者均顺利置入IVCF,技术成功率100%,治疗有效率100%,术后1-3天肿胀缓解,疼痛减弱或消失。29例患者尝试进行接触性导管溶栓治疗,23例成功,其中老年组16例,非老年组7例。未成功6例中,老年组5例,非老年组1例。不成功原因,2例因操作过程中突然出现呼吸困难,心率增快,怀疑发生栓子脱落致PE放弃置管,对症处理后很快缓解(1例为非老年组患者);1例发生导丝穿破股静脉,有造影剂外漏,压迫后未发生血肿。其余3例为患者不配合或操作困难放弃。54例患者采用外周血管溶栓治疗方法。所有患者未出现穿刺部位出血、感染等情况,术后3~5天造影均显示,静脉内密度不均物质减少,部分髂静脉再通或经盆腔建立良好的侧枝循环。2.3 老年组和非老年组患者治疗3d后疗效比较治疗前,老年组和非老年组患肢肿胀差异无统计学意义(P>0.05);与治疗前比较,2组治疗3d后肿胀明显缓解,患肢膝关节上15cm处周径明显下降,差异有统计学意义(P<0.05,表1)。2组治疗前后周径变化差异无统计学意义(P=0.0324)2.4接触性导管溶栓治疗和外周血管溶栓治疗的疗效比较与治疗前比较,2种治疗3d后患者膝关节上15cm处肢周径均明显下降(P<0.05,表2),治疗3d后,接触性导管溶栓较外周血管溶栓治疗患者患肢膝上15cm周径下降更显著,2组周径变化差值有统计学意义(P=0.000)2.5不良反应全部患者术后未出现呼吸困难,胸闷等PE表现,无皮下出血、血尿、穿刺部位血肿等并发症。未发现原有病变症状加重或病情反复,未影响原有疾病治疗。患者术后长期服用华法林,13例次发生抗凝并发症,其中老年组11例次,非老年组2例次,表现为皮下淤血7例次,肉眼血尿2例次,眼底出血2例次,痰中带血2例次,无死亡事件发生。4例非老年组患者术后14~21天尝试取出可回收滤器,1例成功,3例因发现有捕获血栓放弃取出手术。1. 讨论急性下肢深静脉血栓是一种高发外周血管病,病因复杂。本研究老年组患者年龄明显高于非老年组,也高于国内其他报道,但老年组患者治疗3d后,患肢膝上15cm周径与非老年组比较并无明显差异,说明经过积极治疗,老年组和非老年组患者一样,可以达到满意效果。引起DVT主要发病原因为手术后制动、脑梗塞后遗症、外伤、肿瘤等,本组中有手术史为28例,虽然术后应用低分子肝素,但仍然无法阻止此组患者发生DVT[3]。我们认为老年患者手术后活动能力较差,包括顾及心脏功能不全,术后补液不足,引起血液粘稠度较高,可能是易形成血栓的原因。本组中,老年组中有明确心、脑血管并发疾病者高达59.7%,其中19例患者有脑卒中偏瘫,而中枢性病变对外周血管神经支配不良,血管舒缩功能受损,可能也是易发生血栓的原因。DVT受到重视,源于可引起严重并发症-PTE,60%~90%栓子来源于肢体深静脉或盆腔静脉脱落的血栓,有研究表明,DVT和PTE是同一种疾病(血栓栓塞病,thromboembolic disease)的不同阶段[4-5]。欧美国家PE发病率居心血管疾病第3位(仅次于高血压和冠心病),病死率仅次于肿瘤和心肌梗死[6-9]。我国尚缺乏系统的DVT及PE流行病学资料,但临床资料显示,DVT在中国人群中同样发生率较高 [10]。IVCF置入可使重症PE 的病死率从20%~30%降至2%~8%[4-5],西方国家中高危患者接受预防性治疗的比例占17%,而亚洲国家仅为6%。应当注意IVCF仅能预防PTE发生,对DVT并无直接治疗价值,且滤器本身有继发血栓、血管损伤、脱落或移位等并发症,因此IVCF治疗应严格把握适应证。本组患者治疗均遵循美国胸内科医生学会指导原则和我国临床医生对DVT共识进行,适应证主要包括:患者存在抗凝绝对禁忌征;髂、股静脉大量新鲜血栓形成漂浮性血栓;足量抗凝治疗仍然怀疑发生PE或已经有充分证据证明PE。本组全部病例均顺利置入滤器,开放后形态正常,术后随访未发现移位、血管损伤等情况。对于DVT治疗,国内已开展了滤器保护下静脉切开取栓、导管抽吸或粉碎术、置管溶拴术等[1-2、11-13]。考虑到患者年龄和心血管并发症情况,置入IVCF后本组部分患者尝试进行相对温和的置管接触性溶栓操作,将管道置于血栓内部,药物直接作用于血栓,有利于最大限度发挥药物效果。置管接触性溶栓可迅速缓解患肢肿胀,本研究结果显示,接触性导管溶栓治疗效果明显好于外周静脉溶栓的患者,并未发现有并发症增多情况。因静脉切开取栓、导管抽吸或粉碎术等手术相对创伤大,失血较多,不适合高龄重症患者,故在本组研究中,未应用上述方法。本研究中,尿激酶用量根据患者自身情况,最大用量≦200万U/d,同许多国内外报道有差距,主要是考虑到本研究中多为老年的缘故。DVT急性病程过后,血栓同血管壁黏附,不再脱落,静脉滤器成为不良置入物,可能诱发局部血栓形成,造成腔静脉堵塞[12-15]。解决方法主要包括滤器取出或长期服用抗凝剂。本研究置入的滤器多为可回收/永久型滤器,其中4例非老年组患者术后14~21d尝试取出滤器,仅1例成功,余3例均发现滤器捕获大块血栓而放弃取出,此结果提醒严格掌握适应症的重要性[16],特别是对年轻患者,应慎重考虑置入静脉滤器;另一方面也说明我们病例选择较好,滤器有效拦截了脱落血栓,避免更为凶险的PE的发生。对于术后用药,应坚持终生抗凝,通常使用华法林,根据凝血监测结果调控药量。不同于国内外其他单位,我们调控INR-pt在1.6~1.8即可,不强求老年患者、有明确心脑血管病变的患者INR-pt达到2.0~3.0[17-18]。本研究仍有13例次发生因抗凝过量引起鼻钮、皮下血肿、血尿、痰中带血等情况,急诊处理后,未发生严重出血事件。4例患者自行停用华法林药物,发生了双下肢DVT或腔静脉血栓形成。我们认为华法林治疗是非常高效的抗凝治疗,但存在过量或药量不足的现象。老年患者并发严重动脉硬化或血管脆性增加,应控制药物浓度,增加安全性。本组研究以老年患者为主,表现出一些不同于非老年患者的情况,如由于老年患者对疼痛耐受及就诊不方便等原因,老年DVT患者发病后就诊时间较长,一般为3-10天,老年患者特别是有脑血管病变患者,对药物认识不足,故应叮嘱家属辅助或监督患者坚持服用华法林。曾发生多起老年患者随意服药、或服药后忘记自己已服用,又重复服药,引起药物过量,INR-pt最高为14.7,极为凶险。这些情况的发生,使我们认识到应该特别注意对老年患者进行术前、术后治疗指导。随着人口老龄化进程,老年DVT和PE患者将明显增加,医疗安全是最重要的指标,应严格掌握应用IVCF适应证。IVCF保护下的接触性置管溶栓,是安全、有效的治疗方法,可较好地缓解症状,改善老年患者生活质量。开发新型可降解滤器或可控开放滤器,是今后的研究方向。
陈兵 主任医师 浙江大学医学院附属第二医院 血管外科7043人已读



