锦州医科大学附属第三医院科普号
- 精选 耳朵要不要“采”?
最近几年门诊经常遇到采耳后继发外耳道炎的患者,就在想,很多人对外耳道耵聍要不要清理的认识有误区,认为采耳是讲卫生,舒服,是时尚。其实不然。 外耳道皮肤富有毛囊和皮脂腺、耵聍腺,能分泌一些耵聍,它能抑制外耳道内的细菌和真菌,它有保护和清洁外耳道的作用。并且大多数都能自行排除。有人认为很脏,这是误解。看看这个图,它是一个健康的外耳道。 门诊经常遇到这样一些患者,采耳后出现外耳道奇痒,流水,听力下降。耳镜见下图: 正常情况下外耳道皮肤有一些正常菌群存在 ,它们处于平衡状态,采耳打破了外耳道正常菌群的平衡,使真菌过度生长,导致了外耳道真菌病。尤其是出现了外耳道炎症不首先看医生,而是自行外用抗菌素滴耳剂,甚至口服抗生素,会加重真菌感染。 外耳道耵聍要不要取出来呢?少量耵聍会自行排除,较多的耵聍栓塞了外耳道,如下图,可以到正规医院让专科医生来处理。 综上所述,耳朵要不要采呢?想必应该有了答案。
 王岩 主任医师 锦州医科大学附属第三医院 耳鼻咽喉头颈科2542人已读
王岩 主任医师 锦州医科大学附属第三医院 耳鼻咽喉头颈科2542人已读 - 精选 关于听觉过敏 (转载)
1、何为听觉过敏? 听觉过敏是指对日常声音的敏感度增加。听觉过敏患者对高于一定音量的声音非常敏感,常常觉得日常生活中的声音过大、令人不适,有时甚至感到疼痛,如自来水或报纸的沙沙声。很多听觉过敏患者耳内有饱胀感(压力)。 听觉过敏可能逐渐发展,也可能是突发的。可能只影响一只耳朵,也可能影响双耳。对某些人,听觉过敏可能令人厌烦,但能忍受;但对另一些人,听觉过敏可能让人十分痛苦,对他们的生活有很大的影响。 有时可能会将听觉过敏和其他对声音异常耐受的情况混淆: 响度重振:通常与听力损失有关。患者听不到正常响度的安静声音,但能听到正常响度的响亮声音。从没有声音到响亮声音变化太快,从而引起不适和痛苦。许多听觉过敏患者检测不到听力损失,但有可能与其他听力问题有关,如耳鸣和梅尼埃病。 恐声症:即“恐惧声音”。恐音症患者对特定声音过分敏感,并会出现负面情绪,他们担心听到这些声音。对声音忍耐程度很低的人经常会出现恐声症。 厌声症:指厌恶特定声音,如吃饭或呼吸发出的噪音,但不一定有恐惧的心理。 2、听觉过敏的病因 听觉过敏可能有不同的病因,目前仍在研究中。 可能是听觉系统的某些“平衡”声音、保护听觉系统的功能出现问题导致了听觉过敏。身处嘈杂的环境中时,大脑会把嘈杂的噪音信息传回内耳,这样“音量”会被调低,从而保护内耳。这种“反馈机制”受损可能是引起听觉过敏的潜在原因。 大脑还负责处理从内耳接收到的声音信号。处理这些信号的方式出现问题可能是另一个引起听觉过敏的原因。 最近的研究表明,引起听觉过敏的一个原因可能是某种大脑化学物质的减少,这种化学物质控制从感觉器官进入大脑的信息量。因此,一些听觉过敏患者也可能对光线极度敏感(恐光症),如偏头痛患者一样。 我们还知道,有些人在突然暴露在高强度噪音环境下或头部受伤后,开始出现听觉过敏。这种经历可能会破坏内耳的脆弱结构,导致对噪音的敏感性增加。 3、听觉过敏可能和那些疾病相关? 听觉过敏可能独立发生,但公认听觉过敏和很多障碍及听力问题相关,包括梅尼埃病和耳鸣。 梅尼埃病是一种罕见的影响内耳的疾病,通常会引起严重的眩晕、耳鸣、听力损失及耳部深处的压迫感,但具体症状会因人而异。这些症状通常突然发作,持续几个小时。有些人每周会发作几次——有些人每隔几周、几个月甚至几年才发作一次。通常只影响一只耳朵。患者听力因梅尼埃氏病而波动,因此当听力“正常”时,患者可能会出现听觉过敏,而当听力变差时,患者可能会出现重振。 耳鸣是指人们可以在一只耳朵、双耳或头上听到噪音,如没有外部声源的响声、嗡嗡声或哨声。耳鸣并不是一种疾病——在大多数情况下,它是听觉系统出现问题的症状。研究表明,40%的耳鸣患者有听觉过敏,86%听觉过敏患者会出现耳鸣。 听觉过敏还与下列疾病相关: 偏头痛 一些抑郁症 创伤后应激障碍 多发性硬化症 脑损伤后综合征 威廉姆斯综合征——多达90%的威廉姆斯综合征患者可能存在听觉过敏 莱姆病 阻止耳朵正常的声音保护机制工作的病情,如贝尔氏麻痹症 孤独症谱系障碍。 4、可用哪些治疗方法? 如果你认为你患有听觉过敏,去看听力学医生(在耳鼻喉科)或者耳鼻喉科(ENT)科医生。他们会检查你的听力系统,试图找出引起你听觉过敏的原因,并建议最适当的治疗。 你可能需要管理听觉过敏的专业建议——通常会有听力治疗师或听力学专家给出建议。也可能会将你转诊至临床心理学家或行为治疗师处,帮助你管理听觉过敏相关的焦虑、恐惧、压力和逃避,这些情绪有可能会加重听觉过敏。 使用名为“听觉脱敏”疗法,并同时执行旨在减少与声音接触有关的恐惧和焦虑的行为矫正项目,可以最有效地控制听觉过敏(治疗方法具体解释详见第5部分)。 5、听觉脱敏疗法 听力学科室能够进行此治疗,通常由听力学家或听力治疗师执行。 听觉脱敏旨在通过降低耳朵的灵敏度,帮助提高你能忍受的噪音强度。需要每天使用小型发声器,发生器就像助听器一样佩戴在耳后。发声器通过耳模将不同类型的声音传入耳中(如“白噪声”、“宽带噪声”或“粉红噪声”)。虽然发声器可以掩蔽干扰声音,但旨在保持正常接触日常噪音同时,为患者提供长期、低强度噪音接触。由于听觉过敏通常会影响双耳,通常患者双耳都会配备发声器。 治疗先从短时间、低强度噪音开始,然后逐渐增加了使用发声器时间,直到能一天持续使用六小时,并不出现任何不适感及问题。你会慢慢增加音量,增加后的声音量不会引起任何问题,但你可能需要时间去适应。然后,等到你能轻松忍受新的音量时,应该继续增加音量。这种逐渐增加音量的方法将有助于提高你在日常生活中适应不同环境的能力。 没有必须达到的音量标准,但带上发声器后能够忍受所有典型的噪音情况时,没有必要继续增加音量。这时,你可以通过逐渐降低音量或者减少佩戴时间的方法,来减少你对发声器掩蔽噪声的依赖。 只有当你能在不佩戴发声器的情况下应对所有情况时,整个治疗过程才算完成,你大脑的“音量控制”机制已经重置。 整个疗程需要多久?有些人发现,听觉脱敏疗法一开始就能缓解病情,但大多数人通常需要12-18个月的时间才能在不佩戴噪音发声器的情况下,得到长期的改善。 听力学家或顾问会就噪音发声器的使用时间给出建议。 行为矫正项目如果同时进行行为矫正项目,听觉脱敏疗法可能会更有效。临床心理学家可以为你设计个体项目。旨在打破你为了避免嘈杂的环境而养成的习惯。还可以帮助你控制任何因为特定声音引起疼痛及不安而形成的焦虑模式。 6、还有哪些方法有助于听觉过敏的治疗? 除非时必须,尽量不要戴耳罩或耳塞,或者只短时间佩戴(后面将进行详细解释)。 尽量不要回避可能会听到让你不适的声音的场合。 尽量避免在一个完全安静的环境中。听听日常声音是很重要,安静环境反而会加重听觉过敏。 7、耳塞及耳罩 一些听觉过敏患者倾向于使用耳塞或耳塞之类的设备来屏蔽声音。听力学家称之为“衰减器”。这些设备能提供暂时的缓解,但是从长远来看,它们会扰乱你适应声音的任何进展,甚至会让听觉过敏恶化。 但如果你长时间暴露在很响的声音中(如工作环境嘈杂),可能会让听觉过敏恶化。如果你在嘈杂的地方工作,可以戴上特殊的“主动”电子音量衰减器和音乐家专用耳塞可能会有所帮助。听力科室能够提供这些设备,并给出最佳使用的建议。
王岩 主任医师 锦州医科大学附属第三医院 耳鼻咽喉头颈科5665人已读 - 精选 临床笔记:子宫内膜癌
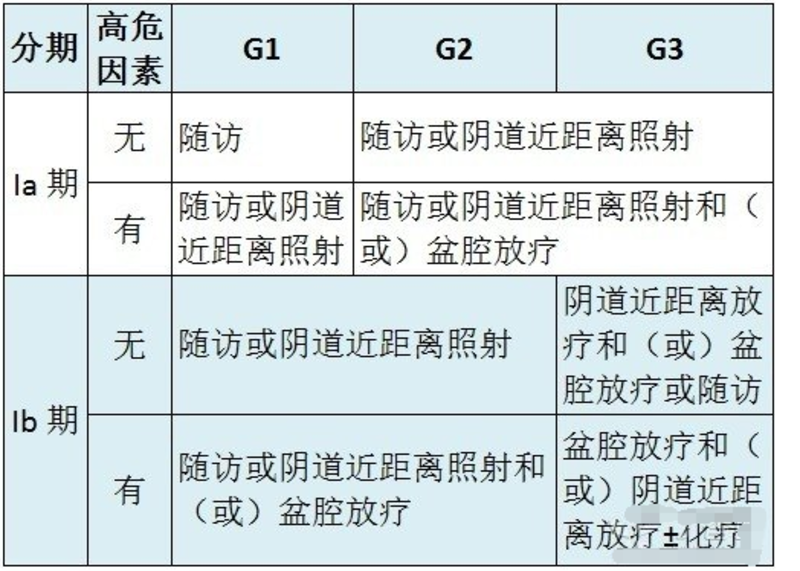
概况 1. 子宫内膜癌也称子宫体癌,多发生于绝经后女性,在我国约占妇科恶性肿瘤的 20%~30%,仅次于宫颈癌。 2. 子宫内膜癌发病原因不明,其发病高危因素包括:(1)长期的雌激素刺激;(2)肥胖、高血压、糖尿病(子宫内膜癌综合征);(3)初潮早、绝经迟、不孕不育及月经失调等;(4)遗传因素;(5)长期服用他莫昔芬。 3. 子宫内膜癌的主要病理类型为腺癌,其中子宫内膜样腺癌最常见(60%~65%),又称 I 型子宫内膜癌。 4. 子宫内膜癌症状:(1)阴道出血:a. 绝经后阴道出血(主要症状);b. 围绝经期月经紊乱或月经不调;c. 一般为无接触性出血;(2)阴道不正常排液;(3)下腹部疼痛及其他症状。 子宫内膜癌的诊治 1. 内膜组织学检查是内膜癌确诊及肿瘤学分级的依据。子宫内膜癌患者 CA125 可能升高,其对诊断及术后病情监测有一定参考价值。 2. 子宫内膜癌以 FIGO2009 手术病理分期为标准,但仅限于初始手术治疗的病例,对于无法手术仅行放化疗或行术前放疗的病例,仍采用 1971 年的临床分期。 3. 子宫内膜癌的预后高危因素包括:(1) G3 级肿瘤(分化差);(2)肌层浸润>50%;(3)淋巴脉管间隙浸润;(4)非内膜样癌组织类型(浆液性、透明细胞、未分化、小细胞、间变性等);(5)宫颈间质浸润。 4.Ⅰ期无论有无切除淋巴结,低危患者(Ⅰ期、G1 或 G2、无肌层浸润或浸润浅肌层)和仅有一个高危因素患者不需要辅助放疗。 5.Ⅰ期中危患者(至少有 2 项高危因素:年龄>60 岁、深肌层浸润、G3、浆液性或透明细胞癌、淋巴脉管间隙浸润)单纯阴道近距离照射比 EBRT 更具优势。 6.Ⅰ期高危患者(有 3 个或 3 个以上高危因素)、Ⅱ 期或 Ⅲ 期患者,辅助化疗加或不加 EBRT,目前尚无定论。 7.Ⅰ期患者术后常规增加孕激素治疗对提高生存率没有显著效果。 8.Ⅰ期子宫内膜癌患者,淋巴结切除术对其总生存率和无复发生存率没有影响。 9.Ⅰ期子宫内膜癌患者,无论存在低、中或高危因素,术后辅助放疗可以减少盆腔复发,但不影响生存率。 10. 阴道近距离照射能有效减少具有高危因素患者的阴道复发。 11. Ⅱ 期发现有明显宫颈浸润患者,推荐根治性子宫切除术加双侧盆腔淋巴切除术和选择性腹主动脉旁淋巴结切除术(缺乏证据支持)。 12. 目前尚没有针对 Ⅱ 期患者术后辅助放疗的随机对照研究。 13. Ⅲ 期患者大部分可选择手术治疗,完整切除所有转移病灶,术后加盆腔外照射和(或)化疗。 14. GOG-184 试验纳入Ⅲ 期和残留病灶大于 2 cm 的子宫内膜癌患者,旨在评价术后全盆腔放射治疗然后给予 6×AP(阿霉素+顺铂)或 6×TAP(紫杉醇+阿霉素+顺铂)的疗效。结果显示三药联合方案并没有提高 PFS,却增加了毒性(GOG-184 试验与 GOG-177 试验在 PFS 上存在差异,需进一步分析)。 15. 阴道或有宫旁浸润受累无法手术切除的 Ⅲ 期患者, 最好选择盆腔外照射放疗作为初始治疗。 16. 腹腔播散为主的 Ⅳ 期患者,能达到无病灶残留的减灭术才有获益,有腹腔外转移证据的患者通常使用以铂类为基础的全身化疗,G1 级和(或)雌激素受体阳性则可以采用激素治疗。 17. GOG-177 试验比较 8×TAP(紫杉醇+阿霉素+顺铂)和 8×AP(阿霉素+顺铂)的疗效,结果显示:TAP 方案在 RR、PFS 及中位 OS 均有显著提高,但由于 TAP 方案毒性太大,需化疗第 4 天常规应用 G-CSF(尽管使用了生长因子,还是出现了治疗相关性死亡)。 18. GOG-0209 试验旨在评价 TC 方案(卡铂+紫杉醇)和 TAP 方案(紫杉醇+阿霉素+顺铂)的疗效,结果显示:TC 非劣效于 TAP 且副作用更低,TC 化疗方案已成为 Ⅲ/Ⅳ 期子宫内膜癌的标准辅助化疗方案。 19. 体积超过 1 mm3 的肿瘤,必须依赖生成新的血管,研究发现 VEGF 过表达与包括子宫内膜癌在内的大部分妇科恶性肿瘤预后不良相关。 20. 目前贝伐单抗用于子宫内膜癌的治疗均为 II 期临床研究: (1)贝伐单抗单药用于复发性或者持续性子宫内膜癌,结果显示:13.5% 获得临床缓解,40.4% 疾病稳定 6 个月; (2)贝伐单抗+TC(紫杉醇和卡铂)方案,用于晚期或复发的有可测量病灶的子宫内膜癌, 15 例患者中有 14 例在 6 个月内疾病无进展。 21. 无法接受手术治疗的患者腔内近距离照射可达到 70% 以上的治愈率;淋巴结受累等高危因素存在的情况下,可以联合盆腔外照射。放疗可较好控制Ⅰ期和 Ⅱ 期内膜癌,降低复发率。 22. 35 岁以下的子宫内膜癌较少见, 且 G1 级子宫内膜癌也易与重度子宫内膜不典型增生相混淆,因此育龄妇女诊断子宫内膜癌应慎重。 23. Ⅲ 期和腹腔残留病灶直径小于 2 cm 的患者,化疗优于全盆腔放疗。 24. 保留生育功能只适用于子宫内膜样腺癌,条件为: (1)分段诊刮标本病理类型为子宫内膜样腺癌,G1 级; (2) MRI 检查(首选)或经阴道超声检查发现病灶局限于子宫内膜; (3)影像学检查未发现可疑的转移病灶; (4)无药物治疗或妊娠的禁忌证; (5)经充分咨询了解保留生育功能并非子宫内膜癌的标准治疗方式,患者在治疗前需咨询生育专家; (6)对合适的患者进行遗传咨询或基因检测; (7)可选择甲地孕酮、 醋酸甲羟孕酮和左炔诺孕酮宫内缓释系统; (8)治疗期间每 3~6 个月分段诊刮或取子宫内膜活检,若子宫内膜癌持续存在 6~9 个月,则行全子宫+双附件切除+手术分期; 若 6 个月后病变完全缓解, 鼓励患者受孕,孕前持续每 3~6 个月进行内膜取样检查,若患者暂无生育计划,予孕激素维持治疗及定期监测; (9)完成生育后或内膜取样发现疾病进展,即行全子宫+双附件切除; (10)9 个条件必须全部符合才能保留生育功能。 25. 子宫内膜癌患者前 2~3 年每 3~6 个月随访 1 次,以后每 6~12 个月随访 1 次;对于Ⅰ期患者来说,无症状阴道复发只有 2.6%,2016 版 NCCN 指南对术后无症状患者不再推荐阴道细胞学检查。 26.Ⅰ期和 Ⅱ 期患者术后复发率约 15%,其中 50%~70% 的复发有症状,孤立的阴道复发经放疗后 5 年生存率达 50%~70%。超出阴道或盆腔淋巴结复发预后较差。 27. 全身治疗包括激素治疗和化疗,主要用于复发、转移或高危患者。激素治疗包括甲地孕酮/他莫西芬(两者可交替使用)、 孕激素类、芳香化酶抑制剂、 他莫昔芬等, 仅适用于分化好、ER/PR 阳性的子宫内膜样腺癌。 附:子宫内膜样腺癌 I、Ⅱ、Ⅲ 期患者术后处理
 李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科1892人已读
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科1892人已读 - 精选 食道癌笔记
概况 1. 我国食管癌以鳞癌多见,约占 90% 以上,多发生在胸中段食管;在西方国家,食管腺癌是最常见的病理类型,并且多发生在食管下段 1/3 段,并常累及胃食管交界处。 2. 食管鳞癌主要的高危因素为抽烟、饮酒;食管腺癌主要与胃食管反流性疾病和 Barrett 食管有关。 3. 食管癌前疾病指与食管癌相关并有一定癌变率的良性疾病,包括慢性食管炎、Barrett 食管、食管白斑症、食管憩室、贲门失弛缓症等。 4. 食管癌前病变指证实与食管癌发生密切相关的病理变化,食管鳞状上皮异型增生与鳞癌相关;Barrett 食管相关异型增生是食管腺癌的癌前病变。 5. 肿瘤位于食管胃交界线上下 5 cm 以内,并已侵犯食管下段或食管胃交界线,归于食管癌;发生在胃食管交界线以下胃近端 5 cm 以内的腺癌,若未侵犯食管胃交界线,则归于胃癌。 6. 早期食管癌目前国内较为公认的定义指病灶局限于黏膜层和黏膜下层,不伴有淋巴结转移的食管癌。早期食管癌症状往往不明显,易被患者忽略,这是早期食管癌较难发现的主要原因。 7. 食管癌分段:(1)颈段食管(上起下咽,下至胸廓入口即胸骨上切迹水平,据上切牙 15~20 cm);(2)胸上段食管(上起胸廓入口,下至奇静脉弓下缘即肺门水平之上;据上切牙 20~25 cm);(3)胸中段食管(上起奇静脉弓下缘,下至肺静脉下缘即肺门水平;据上切牙 25~30 cm);胸下段食管(上起肺静脉下缘,下至食管交界处,据上切牙 30~40 cm)。 食管癌的诊断 1. 内镜下染色辅助多点活检是目前公认的最为准确的诊断早期食管癌的方法。 2. 当病变部位在 PET-CT 的 SUV ≥ 2.5 可考虑为肿瘤灶或转移瘤;但其对 T 分期的诊断不如超声胃镜准确,当转移的淋巴结 ≤ 0.6 cm,易被高浓聚的原发灶遮盖。 3. CT 显示食管壁厚度>0.5 cm,食管壁不均匀增厚,局部软组织肿块是食管的异常表现;食管周围脂肪间隙是否消失是判断 T4 分期最主要的指征之一。 4. CEA、SCC、CYFRA21-1 等可用于食管癌的辅助诊断和疗效检测,尚不能用于食管癌的早期诊断,目前尚没有针对食管癌的特异性血液检查。 5. 根据食管癌病理类型(腺癌和鳞癌)第 7 版食管癌分期分为两个 TNM 系统(简言之,食管鳞癌和腺癌各有自己的分期);多数研究证实腺癌患者的预后好于鳞癌。 6. 2013 NCCN 指南要求食管癌淋巴结清扫至少 15 枚以上,以保证准确的N分期。 7. 锁骨上淋巴结和腹腔动脉干淋巴结不属于区域淋巴结,而属于远处转移。 食管癌的治疗 1. 食管癌患者接受放化疗 14 天内,18F-FDG 的摄取值较少 35% 以上,往往提示治疗有效,其敏感性 93%,特异性 95%。 2. T1a 期淋巴结转移率小于 10%;T1b 期约有 30% 的患者发生淋巴结转移;一旦肿瘤侵犯粘膜下层时,淋巴结转移率达 20%~30%,则需手术根治。 3. 术前放化疗+手术是目前可以手术切除的食管癌国际上推荐的治疗模式。 4. 可切除食管癌包括 T1-3N0-1M0 部分 T4、M1a,可切除 T4 为肿瘤侵犯心包、胸膜、膈肌但可以手术切除;可以手术切除的 M1 包括胸下段食管癌合并腹腔淋巴结转移(注:转移淋巴结没有侵犯腹腔动脉、主动脉和邻近器官),根据治疗前评价可以手术切除。 5. Val Gebskie 的 mata 分析:术前放化疗+手术对比单纯手术 2 年死亡率降低 13%,并且对食管鳞癌和腺癌均有效,该分析奠定了术前放化疗在食管癌综合治疗中的地位;同时发现食管腺癌加入术前化疗,可以提高 7% 的 2 年生存率,对食管鳞癌意义不大,基于此新辅助化疗加入食管腺癌的治疗模式。 6. 术前的新辅助放疗可以提高局部控制率,但 OS 无获益;新辅助放疗有可能增加术后并发症发生率及手术相关死亡率,因此目前的循证医学证据不推荐新辅助放疗。 7. JCOG9907 研究旨在比较术前化疗和术后化疗的疗效。术前给予 2 周期 PF(顺铂+氟尿嘧啶),5 周之内手术;对比术后化疗(术后 2~10 周内开始化疗,方案相同)。结果:5 年的 OS 术前化疗的疗效优于术后化疗(55% 对比 43%),该研究奠定了新辅助化疗在日本食管癌治疗中的基础。 8. CROSS 研究是证实术前同步放化疗能带来生存获益的一项里程碑式的临床研究。放化疗方案为卡铂+紫杉醇同步放疗(剂量为:41.4 Gy,每次 1.8 Gy,共 23 次),结果显示新辅助放化疗组在 R0 切除率,pCR 率和中位 OS 上均有获益,并且对腺癌、鳞癌均有效。 9. Bendell 等证实,术前同步放化疗+贝伐单抗/厄洛替尼较单纯术后放化疗并未增加 pCR 率和生存获益,反而增加药物不良反应。 10. FOLFOX4+C225 联合放疗和尼妥珠单抗+同步放化疗均获得较满意的临床有效率,副作用耐受可,但均是 II 期小样本研究。 11. 治疗前临床分期为 T3N0M0、T1-2 伴淋巴结转移、T3-4 伴或不伴淋巴结转移的可切除的胸段食管癌患者尤其是鳞癌患者,可采用术前放化疗。 12. 食管癌尤其是食管鳞癌可发生跳跃性淋巴结转移(在病变周围淋巴结无转移的情况下发生远离病变处的淋巴结转移),即使术后病理检查为pN0 的患者也有约 40% 的患者发生淋巴结微转移。 13. 术后辅助治疗:(1)对于 R0 切除术后 N+ 的鳞癌或腺癌患者建议行氟尿嘧啶为基础的化疗或放疗;(2)对于 R0 切除术后 N0 的鳞癌患者 T1-2 者建议观察,T3-4 者建议观察或者行铂类/氟尿嘧啶为基础的化疗或者放疗;腺癌 T1 者建议观察,T2 者根据高危因素的有无选择观察或行氟尿嘧啶为基础的化疗,T3-4 者建议行氟尿嘧啶为基础的化疗或放疗(目前认为术后辅助治疗能降低局部复发率,能否带来生存获益尚不明确)。 14. 晚期食管癌中位生存时间仅 6~8 个月,5 年生存率约 5%~7%,化疗是其主要治疗手段。 15. 顺铂+氟尿嘧啶被认为是食管癌标准治疗方案,并且后续探索其他药物疗效的临床研究均是在 PF 方案的基础之上。 16. 基于 REAL-2 研究结果,Xeloda 可代替 5-Fu 作为晚期食管癌联合治疗的选择。 17. 替吉奥单药或联合化疗是晚期胃癌有效的化疗方案之一,但是对食管癌的疗效目前尚没有临床研究,因此,替吉奥对于食管癌的疗效有待进一步研究。 18. 紫杉类药物主要通过促进微管的聚合和稳定,阻断有丝分裂,从而抑制肿瘤细胞生长,并且对于食管鳞癌和腺癌均有作用。 19. Ilson 等证实,紫杉醇(175 mg/m2 d1)+顺铂(20 mg/m2 d1~5)+氟尿嘧啶(750 mg/m2 d1~5)Q4w,食管腺癌 VS 食管鳞癌的有效率 48%对比50%;且食管癌鳞癌的完全缓解率明显高于食管腺癌。但是三药联合并没有带来生存获益,且毒性明显增加。 20. 基于 TAX325 试验结果,FDA 批准多西他赛用于胃/胃食管交界处腺癌的化疗;DCF 方案对于晚期食管鳞癌同样有效。 21. Anderson 等证实,DOX(多西他赛+奥沙利铂+希罗达)对于晚期食管腺癌有效,且给药方便,但是发生肺栓塞的比例较高,需要考虑预防使用抗凝剂。 22. 长春瑞滨主要机制是抑制微管聚合而促进其解聚,从而抑制有丝分裂(和紫杉醇抗肿瘤作用机制相反),对食管鳞癌有较好的疗效。 23. 吉西他滨+顺铂(GP)对晚期食管癌的有效率在 40%~45% 之间,中位 OS 在 7~11 个月。但是目前尚没有数据证实吉西他滨单药对食管癌有效。 24. EGFR 过表达率在食管腺癌中约 27%~50%,食管鳞癌约 40%~50%, 并且和不良预后有关;Her-2 过表达率在食管腺癌约为 15.3%,食管鳞癌约为 3.9%。 25. SAKK75/06(C225+放化疗)和 REAL-3(帕尼单抗+化疗)均提示抗 EGFR 单克隆抗体联合化疗对于晚期食管癌的疗效尚不确定,除临床研究外,目前不推荐用于晚期食管癌的治疗。 26. 肿瘤的生长和转移是一个依赖于血管的过程,当肿瘤体积超过 1~2 mm3 时,维持其生长靠新生血管的生成。 27. III 期 AVAGAST 研究(XP+贝伐单抗)在总有效率和中位 PFS 方面显著优于 XP 方案化疗,但是 OS 改善没有统计学意义。因此该研究结果并不支持贝伐单抗用于晚期食管胃腺癌的常规治疗(亚组分析:获益率美国人优于欧洲人,亚洲人几乎不获益)。 28. 中国的 III 期 AVATAR 研究(贝伐单抗+XP)结果未能改善中国胃/胃食管交界处腺癌的生存。 29. 目前转移性食管癌的化疗由于缺乏大样本试验数据,一般采用胃癌和胃食管结合部癌的治疗方案。 30. CALGB80403/E1206 II 期试验旨在比较 FOLFOX、ECF、IP 联合 C225 在初治转移性食管癌或食管胃结合部癌的疗效,主要终点 ORR。结果 FOLOX+C225 疗效可能更好,安全性最高。但是并没有但来额外的生存获益。
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科1585人已读 - 精选 替吉奥和卡培他滨的 9 大区别
替吉奥与卡培他滨均为氟尿嘧啶类抗肿瘤药,在临床上,有时医生会对他们之间的不同之处及适宜人群产生困惑。为方便大家合理用药,笔者将两种药物的区别归纳整理如下。 药物组分有何不同? 替吉奥:由替加氟(FT)、吉美嘧啶(CDHP)和奥替拉西钾(OXO)三种成分以 1:0.4:1 的摩尔比组成复方。 卡培他滨:为 5-氟尿嘧啶(5-FU)的前药,在体外相对无细胞毒性,在体内肝酶的作用下转化为 5-FU,作为口服药物,能模拟持续静脉注射 5-FU。 适应证有何不同? 替吉奥:批准用于不能切除的局部晚期或转移性胃癌,仅用于适合使用替吉奥与顺铂联合化疗的患者。另据临床用药须知提示,替吉奥可用于晚期头颈癌。 卡培他滨:批准用于结直肠癌的辅助化疗、转移性结直肠癌的一线化疗、联合多西他赛治疗含蒽环类药物化疗方案治疗失败的转移性乳腺癌、单药治疗对紫杉醇及含蒽环类药物化疗方案均耐药或对紫杉醇耐药和不能再使用蒽环类药物治疗的转移性乳腺癌、不能手术的晚期或者转移性胃癌。 用法用量有何不同? 替吉奥:根据体表面积决定成人的首次剂量(BSA
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科7725人已读 - 精选 卵巢癌
卵巢癌是卵巢肿瘤的一种恶性肿瘤,是指生长在卵巢上的恶性肿瘤,其中90%~95%为卵巢原发性的癌,另外5%~10%为其它部位原发的癌转移到卵巢。 由于卵巢癌早期缺少症状,即使有症状也不特异,筛查的作用又有限,因此早期诊断比较困难,就诊时60%~70%已为晚期,而晚期病例又疗效不佳。因此,虽然卵巢癌的发病率低于宫颈癌和子宫内膜癌居妇科恶性肿瘤的第三位,但死亡率却超过宫颈癌及子宫内膜癌之和,高居妇科癌症首位,是严重威胁妇女健康的最大疾患。 卵巢上皮癌患者手术中发现肿瘤局限于卵巢的仅占30%,大多数已扩散到子宫,双侧附件,大网膜及盆腔各器官,所以在早期诊断上是一大难题。 别 称 卵巢癌 英文名称 Ovarian M alignant Tumor 英文别名 ovarian cancer 就诊科室 肿瘤科 常见发病部位 卵巢 更多 组织学分类 卵巢由于组织学的特点,其癌的组织学类型之多居全身各器官首位。根据世界卫生组织(WHO)制定的国际统一分类法,卵巢肿瘤?主要的组织学类型如下: 上皮来源的肿瘤 来源于卵巢的生发上皮,具体类型包括浆液性瘤、粘液性瘤、子宫内膜样瘤、透明细胞瘤、纤维上皮瘤(又称勃勒纳瘤)、混合型上皮瘤等。这些肿瘤既有良性,也有交界恶性和恶性 生殖细胞来源的肿瘤 来源于卵巢的生殖细胞。主要类型有畸胎瘤、无性细胞瘤、胚胎性癌、内胚窦瘤、绒毛膜癌、混合性生殖细胞瘤。其中畸胎瘤有良性的成熟性畸胎瘤及恶性的末成熟畸胎瘤,另外还有比较少见的单胚性和高度特异性畸胎瘤,包括卵巢甲状腺瘤和卵巢类癌。良性的成熟性畸胎瘤可发生癌变。这些肿瘤中除了成熟性畸胎瘤及甲状腺瘤外,其它肿瘤虽然也称为瘤,但实际上都是恶性肿瘤即癌。 特异性性索间质来源的肿瘤 来源于卵巢的特异性性索间质,包括颗粒细胞瘤、卵泡膜细胞瘤、纤维瘤、卵巢睾九母细胞瘤、两性母细胞瘤等。一般情况下,卵泡膜细胞瘤和纤维瘤为良性肿瘤,其它为低度恶性肿瘤。 转移性肿瘤 来源于原发在其它器官的恶性肿瘤,常见的包括消化道和妇科其它器官。 发病原因 如同大多数癌症一样,卵巢癌?的发病原因并不明确。经研究及流行病学调查,一般认为卵巢癌的发生可能与下列高危因素有关。 持续排卵 持续排卵使卵巢表面上皮不断损伤与修复, 可能导致卵巢癌的发生。流行病学调查发现卵巢癌危险因素有未产、不孕,而多次妊娠哺乳和口服避孕药有保护作用。应用促排卵药物可增加发生卵巢肿瘤的危险性。 环境及其他因素 流行病学证据表明, 工业的各种物理或化学产物可能与卵巢癌的发病相关。卵巢癌的发病是否与饮食习惯或成分(胆固醇含量高)相关,目前还无定论。 遗传因素 卵巢癌 上皮性卵巢癌?的发生与遗传因素有密切的关系。5%~10%的卵巢上皮癌具有遗传异常。上皮性卵巢癌的发生与三个遗传性癌综合征有关,即遗传性乳腺癌- 卵巢癌综合征(HBOC),遗传性位点特异性卵巢癌综合征(HSSOC),和遗传性非息肉性结直肠癌综合征(HNPCC)。有卵巢癌、乳腺癌、子宫内膜癌、结直肠癌家族史者,卵巢癌的发病率明显升高。因此对有这些癌家族史者除常规体检外,更应提高警惕,密切监测,甚至预防性卵巢切除。 病理特点 上皮性肿瘤 是最常见的卵巢肿瘤,占50%~70%。发病年龄大多在30~60岁,青春期前罕见,绝经后妇女的卵巢肿瘤80%以上为上皮性。上皮性肿瘤分为良性、交界性和恶性。 1.浆液性囊腺瘤常见,占卵巢良性肿瘤的25%。肿瘤多为单侧性,双侧占15%。肿瘤表面光滑,大小不一,囊内充满淡黄色清澈浆液。分为单纯性及乳头状两型,前者多为单房,囊壁光滑,后者多为多房,内可见乳头。 2.浆液性囊腺癌为所有恶性卵巢肿瘤中最常见者,约占40%~50%。1/3~1/2为双侧。肿瘤常为囊实性,体积较大,表面光滑,灰白色或有乳头生长,切面常为多房性,腔内有乳头生长,囊液混浊,有时为血性。 3.黏液性囊腺瘤 较常见,占卵巢良性肿瘤的20%左右。95%为单侧性,体积较大或巨大,表面光滑。切面常为多房,囊腔大小不一,内含黏液性液体,囊壁可有乳头生长。镜下囊腔被覆单层柱状上皮,能分泌黏液,与子宫颈管上皮相似。恶变率为5%~10%。约2%~5%因肿瘤破裂,瘤细胞广泛种植于腹膜表面,分泌大量黏液,形成腹膜黏液瘤。 4.黏液性囊腺癌 约占卵巢恶性肿瘤的10%。单侧居多,瘤体较大,呈囊实性,表面多无乳头。切面为多房,有实性区域或乳头,组织极脆,囊液混浊或为血性。 5.交界性肿瘤占卵巢上皮性恶性肿瘤的15%,主要是浆液性和黏液性交界性肿瘤,其它类型交界性肿瘤少见,是一种低度潜在恶性肿瘤,在外观上与良性或恶性肿瘤不易区别。 生殖细胞瘤 占卵巢肿瘤的20%,发病率仅次于上皮性肿瘤。生殖细胞肿瘤可见于任何年龄,但以年轻妇女多见。儿童和青春期妇女,60%的卵巢肿瘤为生殖细胞来源,其中1/3为恶性。 1.成熟性畸胎瘤 为良性肿瘤,是最常见的卵巢肿瘤之一。其中95%以上为囊性,实性罕见。囊性成熟畸胎瘤又称皮样囊肿,占生殖细胞肿瘤的85%~97%,好发于生育年龄,约12%为双侧性。肿瘤通常为中等大小,表面光滑,或呈结节状,灰白色,壁薄质韧。切面多为单房,腔内充满油脂和毛发,有时可见牙齿和骨质。囊壁常有实质性突起如乳头,此处常含有多种组织成分。 2.未成熟畸胎瘤 多发生于青少年,几乎都是单侧性的实性肿瘤,体积较大,表面呈结节状。一般将未成熟组织按细胞分化程度及成熟组织与未成熟组织的比例等分为3级,分级越高,恶性程度越高。但未成熟畸胎瘤有自未成熟向成熟转化的特点,即恶性程度的逆转现象。 特异性性索间质细胞肿瘤 约占卵巢肿瘤的5%~10%。此类肿瘤能分泌激素并出现相应症状,又称功能性卵巢肿瘤。其中颗粒和卵泡膜细胞瘤因能分泌雌激素,在女孩可引起性早熟,生育年龄可出现月经紊乱,老年妇女可发生绝经后出血。约15%伴发子宫内膜癌。而睾丸母细胞瘤多能分泌雄激素,病人出现男性化表现。 颗粒细胞瘤:是功能性卵巢肿瘤中最多见者,为低度恶性肿瘤,多发生于50岁左右妇女。肿瘤95%为单侧性,圆形或卵圆形,大小不一,表面光滑或分叶状。颗粒细胞瘤预后较好,但部分病例在治疗多年后仍可复发。 卵泡膜细胞瘤:多为良性肿瘤,常与颗粒细胞瘤合并存在。大多数为单侧,大小不一,圆形或卵圆形,表面光滑。恶性卵泡膜细胞瘤少见。 纤维瘤:占卵巢肿瘤的2%~5%,多见于中年妇女。肿瘤多为单侧性,中等大小,表面光滑或结节状,切面灰白,实质性,质硬。纤维瘤偶可伴有腹水和胸水,称梅格斯综合征(Meigs s syndrome)。胸水多发生于右侧。手术切除后胸腹水自行消失。 卵巢转移癌 卵巢是恶性肿瘤常见的转移部位,约5%~10%的卵巢肿瘤是转移性的。最常见的是来自消化道,乳腺和生殖道的转移癌。转移癌常侵犯双侧卵巢,侵犯单侧卵巢者仅10%。库肯勃瘤(Krukenbergs tumor)是一种特殊类型的转移性腺癌,原发部位为胃肠道。肿瘤为双侧性,中等大小,一般保持卵巢原状。 卵巢癌 转移途径:主要途径是肿瘤直接蔓延至周围脏器以及大网膜和腹腔各脏器表面的种植转移。淋巴道也是重要的转移途径,最初为盆腔及腹主动脉旁淋巴结转移,晚期可累及左锁骨上淋巴结。血行转移少见。卵巢癌转移的特点是扩散早且广泛。往往外观局限的肿瘤,已有腹膜、大网膜、腹膜后淋巴结、横膈等的转移。 临床分期 采用FIGO2009分期标准,为手术病理分期 I期:肿瘤局限于卵巢; II期: 一例或双侧卵巢肿瘤,伴盆腔内扩散; III期:一侧或双侧卵巢肿瘤,伴显微镜下证实的盆腔外的腹腔转移和/区域淋巴结转移,肝表面转移; 卵巢癌 IV期:超出腹腔的远处转移。胸水有癌细胞。肝实质转移。 临床表现 临床症状 最初常无症状,部分病人无意中摸到下腹部包块或妇科检查时偶然发现。可常感下腹部不适,一般无明显腹痛。当出现并发症如蒂扭转、破裂、感染时可出现下腹部疼痛。部分病人可出现月经失调或闭经。如肿瘤嵌顿于盆腔,可引起尿频、便秘。巨大卵巢肿瘤压迫膈肌或出现胸腹水时可出现呼吸困难、心悸。如为恶性肿瘤,病人常出现食欲不振、消化不良等消化道症状,有腹水时可出现腹胀,部分病人因此会到消化内科就诊。另外随着肿瘤的增大和出现腹水,有些病人可感腰围增大,甚至自认为是肥胖而减肥。卵巢癌晚期可出现乏力、消瘦、贫血等表现。 临床检查 1.腹部检查 肿瘤增大时可见下腹部隆起,并于下腹部摸到肿物。肿物可活动,也可固定不动,质地软硬不一,有的会压痛。 卵巢癌 2.妇科检查 妇科医生做检查时可摸到子宫以外的包块。如肿物为单侧,表面光滑,活动,囊性,则良性肿瘤或早期癌的可能性大。如为双侧,表面不规则,实性或囊实性,活动差,甚至后陷凹可触及大小不等的实性结节则恶性肿瘤的可能性大。 疾病诊断 根据病史及检查,卵巢肿瘤?一般不难诊断,但良恶性的诊断有时并不容易,还有可能与其他疾病混淆,需进一步行下列辅助检查: 超声波检查 B超可明确肿瘤的大小、位置、形态、内部结构、来源等,其诊断符合率可达90%,阴道彩色血流多普勒超声的应用使诊断的准确率进一步提高。 细胞学检查 腹腔或后穹窿穿刺以及术中取腹水或腹腔洗液细胞学检查有助于卵巢恶性肿瘤的诊断、鉴别诊断和分期。腹水细胞学检查的阳性率为60%~70%。经阴道或腹部细针穿刺包块吸取细胞检查对卵巢肿瘤诊断的准确率可达90%~95%,但有引起囊液外溢及癌细胞扩散的可能,一般在诊断困难且不具备手术条件时作为最好最后的诊断手段。一般囊性包块不宜做穿刺检查。 腹腔镜检查 可直接窥视盆腹腔脏器,明确有无肿瘤及肿瘤的具体情况,有无转移及转移部位,结合活检组织病理检查具有确诊价值,并可临床分期。 肿瘤标记物测定 在有些卵巢肿瘤病人,血中有些肿瘤标记物可以升高,对肿瘤的诊断及良性与恶性的鉴别有意义。CA125是卵巢上皮性癌的理想标记物,其阳性检测率在浆液性癌可达70%~90%。卵巢黏液性囊腺癌患者50%左右血清中癌胚抗原(CEA)阳性。甲胎蛋白(AFP)在几乎所有的内胚窦瘤明显升高,在部分未成熟畸胎瘤、混有卵黄囊成分的其它生殖细胞肿瘤也有升高。卵巢绒癌血hCG可升高。颗粒细胞瘤、卵泡膜细胞瘤可分泌雌激素,睾丸母细胞瘤可分泌性激素,激素水平检查可发现升高。 放射学诊断 腹部平片检查对卵巢成熟性畸胎瘤可显示牙齿及骨质。如发现盆腔孤立钙化灶,提示曾有盆腔淋巴结结核,可作为卵巢癌与结核进一步鉴别诊断的依据。消化道造影及胃镜肠镜检查可了解盆腔肿物是否为消化道转移癌。淋巴造影可判断有无淋巴结转移。 其它 卵巢癌 计算机体层扫描(CT)和核磁共振成像(MRI)能清楚显示肿物的图像及各脏器、盆腔淋巴结有无转移,对卵巢肿瘤的诊断、协助分期、随访时观察残余瘤的变化和肿瘤有无复发起一定作用。正电子发射断层扫描( positron emission tomography,PET)对肿瘤良恶性的鉴别及复发癌的诊断有帮助,PET-CT具有计算机体层扫描和正电子发射断层扫描的双重作用,其应用正越来越广泛,但因费用昂贵,尚不能常规采用。 鉴别诊断 发现盆腔包块,可能来源于卵巢,也可能来源于妇科其他器官,或来源于泌尿、消化道,可能为良性,也可能为恶性,或可能为其他非肿瘤性包块,因其治疗不同,对其进行鉴别非常必要。 卵巢良性与恶性肿瘤的鉴别 表一:卵巢良性与恶性肿瘤的鉴别(见后) 卵巢良性肿瘤与早期卵巢癌在术前甚至术中有时很难鉴别,需开腹探查或病理方能明确诊断。 卵巢肿瘤与其它疾病的鉴别 1.卵巢滤泡囊肿和黄体囊肿一般为单侧性,直径
 李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科2789人已读
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科2789人已读 - 精选 卵黄囊瘤的诊断与治疗
【摘要】目的 讨论卵黄囊瘤的诊断与治疗。方法 根据患者临床表现结合检查结果进行诊断并治疗。结论 卵黄囊瘤在临床表现方面具有一些特点,如发病年龄轻、肿瘤较大、很易产生腹水、病程发展快。若警惕到这种肿瘤的可能性,则并不难诊断。应根据病史、症状、体征和辅助检查综合判断。原则上还应考虑手术治疗与化疗的综合治疗,术后及时多疗程正规化疗是生存率提高的关键。 【关键词】卵黄囊瘤 诊断 治疗 卵黄囊瘤是指形态上为各种内胚层样结构分化的畸胎瘤样原始内胚层肿瘤,故又名内胚窦瘤,为一恶性程度高的卵巢生殖细胞肿瘤,其发生率国内外报道不一。卵巢恶性生殖细胞肿瘤中,国外报道无性细胞瘤最常见,其次为卵黄囊瘤,而国内报道卵黄囊瘤居首位,占卵巢恶性生殖细胞肿瘤31.9%~60.2%。卵黄囊瘤常合并其他类型的生殖细胞肿瘤,如畸胎瘤、无性细胞瘤和绒癌。多见于儿童及年轻妇女,平均年龄为18岁,大约1/3患者初发病时尚未月经初潮。卵黄囊瘤生长迅速,易早期转移,在顺铂联合化疗问世以前,是卵巢恶性生殖细胞肿瘤中预后最差的肿瘤。随着顺铂联合化疗方案的应用,其存活率得到明显改善,现已达到90%左右。 卵巢卵黄囊瘤又称卵巢内胚窦瘤,是恶性度很高的生殖细胞肿瘤,预后差。本文对我院收治的资料完整的11例卵巢卵黄囊瘤患者的治疗方法作回顾性分析。 1 临床资料 1.1一般资料 本组11例患者,年龄22-56岁,下面将治疗方法进行回顾分析。 2 临床诊断 2.1诊断 卵黄囊瘤在临床表现方面具有一些特点,如发病年龄轻、肿瘤较大、很易产生腹水、病程发展快。若警惕到这种肿瘤的可能性,则并不难诊断。应根据病史、症状、体征和辅助检查综合判断。卵黄囊瘤的诊断要点如下: 2.1.1多见于儿童及青少年,病情进展快,早期发生转移,病程短。 2.1.2症状:由于肿瘤生长快,早期发生转移,易导致腹水、包膜破裂和腹腔内种植,而出现相应的症状。 1)腹水和腹胀:腹水为卵黄囊瘤最常见的症状。肿瘤很早就发生腹腔内浸润、种植,86%的患者产生腹水,常为血性腹水。因腹水增长过快,出现腹胀。 2)腹部包块和腹痛:腹部包块为卵黄囊瘤较常见的症状,由于肿瘤较大,平均直径为15~25cm,约76%的患者由于发现腹部包块而就诊。肿瘤增长过快,血液供应不好,导致肿瘤坏死、出血和破裂,出现急腹痛,有50%的患者因腹痛而就诊。 3)发热和胸腔积液:肿瘤坏死、出血可使体温升高,50%的患者可出现发热症状。少数患者因有胸腔积液而气憋,但胸腔积液并不意味着胸腔转移,胸腔积液产生的原因可能是腹水穿过横膈肌上的微小孔进入胸腔,或是腹水经膈肌上丰富的淋巴丛溢到胸腔。 4)月经和生育功能:患者的卵巢功能和生育功能一般都很正常,月经初潮不延迟,少数患者有短期闭经或月经稀发。如果合并其他生殖细胞瘤,可能出现内分泌功能紊乱、绒毛膜促性腺激素升高和阴道流血等。 2.1.3体格检查:患者消瘦明显,盆腹腔触及较大的囊实性肿瘤,压痛,移动性浊音常为阳性。 2.1.4血清AFP明显升高:卵黄囊瘤可分泌AFP,是一个很特异的肿瘤标志物,故检测血清AFP可有助于诊断。 2.1.5 B超可见不均匀混合回声,见大片网状及囊状暗区,可见典型“破絮状”回声。 2.1.6病理诊断方面,以单纯性为主,有部分合并其他生殖细胞肿瘤成分。 期刊文章分类查询,尽在期刊图书馆 2.2鉴别诊断 2.2.1浆膜下肌瘤囊性变:如果浆膜下肌瘤较大,囊性变且有扭转时,常可出现盆腹腔包块,腹痛等症状,B超回声与卵巢肿物不易区别。可结合妇科检查,子宫肌瘤多随子宫而运动,与子宫关系密切,B超可探及来自子宫的血流信号,且无腹水。 2.2.2未成熟畸胎瘤:与卵黄囊瘤同为卵巢生殖细胞肿瘤,好发于青少年,B超回声均杂乱。但未成熟畸胎瘤B超囊性成分较多,可做血清AFP检测以鉴别。 2.2.3无性细胞瘤:好发于青少年,B超包块以实性为主,内部回声均匀,包膜完整,无典型“破絮状”回声。 2.2.4卵巢上皮性恶性肿瘤:发病年龄多较大,边界不清,与盆壁及肠管多有粘连,内部回声多呈光点密集的强细小光点。当瘤体不大时,盆腔、腹腔已有大量腹水及转移结节。多伴有CA125升高。 3 治疗 原则上还应考虑手术治疗与化疗的综合治疗,术后及时多疗程正规化疗是生存率提高的关键。 3.1手术治疗 3.1.1全面手术病理分期:对卵黄囊瘤进行全面手术病理分期,有助于指导术后治疗和正确评估预后。检查内容包括腹水或腹腔冲洗液的细胞学检查,盆腹腔腹膜的视触诊,有可疑病灶,应予以切除或做病检,腹膜后淋巴结也应仔细视、触诊,有增大或外观可疑的淋巴结,应行切除或取样活检。 3.1.2保留生育功能的手术治疗:绝大多数卵黄囊瘤为单侧性,故手术范围应选择患侧附件切除,对侧卵巢经仔细检查无异常者,可保留对侧卵巢及子宫,以保留其生理及生殖功能。额外进行子宫切除和对侧附件切除并不能改善预后。对已有卵巢外转移的晚期肿瘤,应行肿瘤细胞减灭术。由于卵黄囊瘤恶性度高,对肉眼瘤灶切除力求彻底,争取使残余肿瘤体积控制在直径2cm以下。但有学者提出,当肿瘤侵及盆腹腔脏器时,肿瘤细胞减灭术的创伤往往极大,既然恶性生殖细胞肿瘤对联合化疗高度敏感,那么创伤性过大的手术是否必要值得重新考虑。原则上讲,手术不宜给患者带来过多创伤,残存的小量癌组织可依靠化疗予以消灭。 3.1.3复发性肿瘤的手术治疗:卵黄囊瘤恶性程度高,如果术中分期不准确、术后未及时化疗或虽化疗但用药不规范、剂量小、疗程不足,易导致复发。如果复发瘤比较局限、体积不大,也许单用联合化疗即可奏效;如果复发瘤分布较广而多,或是体积偏大,需要再次手术切除,并联合化疗才能取得满意的效果。 3.2 化疗 卵黄囊瘤对化疗高度敏感。目前认为,所有的卵黄囊瘤均需要化疗,化疗可以作为主要治疗或辅助治疗。在使用联合化疗之前,此病的2年生存率仅为25%,应用 VAC方案联合化疗后,2年生存率提高到60%~70%。美国妇科癌症协作组(GOG)研究发现,大约60%有残余病灶的患者对BVP方案完全反应,BEP方案可使卵黄囊瘤持续缓解率达96%。因此,以顺铂为基础的联合化疗,尤其是BEP方案应该作为卵黄囊瘤的首选化疗方案,在用药过程中特别注意用药“及时”、“足量”,则效果会很满意。化疗应该在初次手术后两周内开始。有关以上用药的疗程数尚无明确的统一意见。有学者提出,Ⅰ期和切除完全者给予3~4个疗程化疗,如手术后残存癌较大,则可能需要5~6个疗程。GOG建议如果手术仅大部分切除,化疗至少应在肿瘤标记物正常后再用2个疗程或以上。复发的患者,术后再次化疗疗程应增至6~8个疗程。 4 讨论 4.1大体:肿瘤多为单侧性,以右侧卵巢多见,偶见双侧。圆形或卵圆形,肿瘤较大,平均直径为15~25cm。切面部分囊性,组织质脆,有出血坏死区,也可见海绵样区,呈灰红、红褐或灰黄色。由于肿块大,柔软而质脆,故易破裂。术时一般可见血性腹水,约有半数已转移。 4.2镜检:结构多样,可见:①微囊状结构;②实性结构,幼稚胚胎性实性上皮团索状;③内胚窦样结构;④腺泡或腺管样结构;⑤间质疏松黏液样;⑥乳头状;⑦大囊状;⑧多囊状卵黄囊样结构;⑨原始内胚层,似肠型上皮分化;⑩肝样结构,似肝癌。这些结构常混合存在,以2~3种结构为主。免疫组化甲胎蛋白(AFP)胞浆阳性,CD30灶性阳性。 总之,卵巢卵黄囊瘤的转移发生率高,Gershenson(1983)报道的卵黄囊瘤15例临床Ⅲ期者,有3例发生腹膜后淋巴转移,占20%。肿瘤转移的途径除了直接浸润及种植扩散外,也有不少通过淋巴结转移。定期做好高发人群的筛查工作,做到早期发现、早期治疗、做好随访工作。
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科7604人已读 - 精选 软组织肉瘤分子靶向治疗药物及新进展
摘要:软组织肉瘤是一组起源于间叶组织的恶性肿瘤,占全部恶性肿瘤1%,恶性程度高和亚类繁多是其主要特点。目前采取的主要治疗手段包括手术、放疗及化疗等。与胃肠间质瘤对伊马替尼的良好反应不同,其他软组织肉瘤的创新治疗面临着更多困难,不同亚型间遗传和临床特点异质性强,生存时间差异巨大。近年来,分子靶向药物在这一疾病领域进展迅速,在个体化治疗和提高患者生存质量等方面的优势明显,为无法手术和不能接受常规化疗的患者提供了新的治疗手段。因此,文本将就近年来软组织肉瘤的靶向治疗药物和相关通路进行简要阐述。 关键词:软组织肉瘤,靶向治疗,精准医疗,帕唑帕尼,PD-1抗体 软组织肉瘤(Soft Tissue Sarcomas, STS)是源于间叶组织的恶性肿瘤,STS占成人恶性肿瘤的1%,儿童肿瘤的10%[1]。根据世界卫生组织WHO的分类,STS包括60多种亚型,最常见亚型包括:多形性未分化肉瘤(UPS)、脂肪肉瘤(LS)、平滑肌肉瘤(LMS)、滑膜肉瘤(SS)、血管肉瘤(AS)、纤维肉瘤(FS)和恶性神经鞘瘤(MPNST)[2]。 目前对于四肢和躯干的原发性STS的治疗仍以手术切除为主,而新辅助化疗、辅助化疗以及术前或术后放疗等手段在局部或系统治疗中的地位也越来越受到重视[3]。在精准医疗大环境下,基因组测序技术不断高速发展,广泛应用于肿瘤发生发展过程中关键信号通路的研究以及药物作用靶点的发现,传统上对于肿瘤疾病的认知也在不断发生变化。第二代测序技术的应用使得个体化疗方案的制定以及相关生物标志物的发现更为便捷,也使得人们对个体化治疗和生物靶向药物的需求大大增加[4]。在软组织肉瘤领域,有潜力的治疗靶点和异常的信号通路被不断发现。已有约140个和STS发生发展相关的潜在靶点被报道,这些靶点涉及细胞的多种生理过程[5]。在这些靶点中,不同类型的激酶是数量最多也是最有希望被开发的治疗类靶点。本文对目前治疗非胃肠道间质瘤(gastrointestinal stromal tumors, GIST)STS的靶向治疗按照血管靶向治疗、细胞靶向治疗和免疫靶向治疗分别进行综述。 1血管靶向治疗 血管生成的过程被定义为从已存在的血管中形成新的血管,并被认为是恶性肿瘤的特点之一[6]。血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(vascular endothelial growth factor receptor,VEGFR)是内皮细胞增殖形成新血管的关键步骤。同时,血小板源生长因子(platelet derived growth factor,PDGF)及其受体(platelet derived growth factorreceptor,PDGFR)对肿瘤基质的调节至关重要。它的激活导致细胞外膜和血管平滑肌的生成和稳定[7]。胰岛素样生长因子(nsulin-like growth factor,IGF)及其受体IGF-R1在VEGF刺激血管生成发挥重要作用,抑制IGF-R1可以抑制血管生成[8]。同样,成纤维细胞生长因子(fibroblast growth factors,FGF)途径激活不仅可导致细胞分化和促生存,同时可促进肿瘤血管生成和抗VEGF的抑制[9]。 1. 1 VEGF/VEGFR为靶点的治疗 VEGF是引发血管形成的起始性因子,它在肿瘤血管形成过程中的重要作用[10]。内皮细胞增殖和血管形成主要是通过VEGFA、VEGFC、VEGFD、VEGFE与VEGFR-2激活信号[11,12]。因此,VEGF及其受体VEGFR成为了极具潜力的靶点而受到了广泛的关注。 1. 1. 1贝伐单抗(Bevacizumab), 贝伐单抗一个人重组VEGF抗体,在直肠癌等恶性肿瘤中的组合方案已被证实具有临床疗效。Agulnik等进行多中心前瞻性、II期临床试验来评价单药贝伐单抗的安全性和有效性[13],纳入30例晚期STS患者,其中血管肉瘤23例和上皮样血管内皮瘤7例。单药治疗患者耐受良好,部分缓解(partial response,PR),2例,疾病稳定(stable disease,SD),15例。两个周期治疗后,中位无进展生存(progression-free survival,PFS)12周,总生存期(overall survival,OS)为52. 7周。这个试验表明,贝伐单抗对于血管肉瘤和上皮样血管内皮细胞瘤患者是安全的有效的。 基于前面II期临床试验的结果,进一步的试验评估贝伐单抗在联合化疗方案的作用。D 'Adamo et al开展单臂2期临床试验,评价贝伐单抗联合阿霉素的有效性和安全性[14]。纳入17例转移STS患者(其中平滑肌肉瘤11例)。试验结果中没有完全缓解(complete response,CR)患者,PR 2例,病理类型是子宫平滑肌肉瘤,SD 11例(65%)。客观反应率(objective response rate, ORR)为12%,中位OS为16个月。药物毒性与之前报告的单药阿霉素方案无差异。然而,比预期的更大的副反应是心脏功能下降。Verschraegan 等进行了一项探索性研究,评价吉西他滨+多西他赛+贝伐单抗联合治疗STS的有效性和安全性分析[15]。纳入STS 38例,ORR31. 4%,临床获益率为82. 8%,新辅助化疗组4年OS 69%。所有4例血管肉瘤患者和40%的未分化肉瘤患者效果更佳。在黏液样脂肪肉瘤(LS),滑膜肉瘤(SS)和子宫平滑肌肉瘤类型中也观察到了PR疗效的患者。这些结果表明,三药方案提高了有效率。安全性方面,一个患者出现药物相关肠穿孔,后来死于肺栓塞。此外,4级不良事件包括气胸和坏死性肺炎各有1例。 1. 1. 2帕唑帕尼(Pazopanib) 帕唑帕尼是一种口服的多靶点的小分子受体酪氨酸激酶抑制剂,是几十年来FDA批准的首个治疗晚期软组织肉瘤(非脂肪肉瘤)的靶向药物。帕唑帕尼是血管内皮生长因子受体VEGFR-1、VEGFR-2、VEGFR-3、PDGFR-α和-β、FGFR-1和-3、细胞因子受体(Kit)、白介素-2受体可诱导T细胞激酶(Itk)、白细胞-特异性蛋白酪氨酸激酶(Lck)和穿膜糖蛋白受体酪氨酸激酶(c-Fms)的一种受体酪氨酸激酶抑制剂。 EORTC报道的一项II期临床试验,针对进展期STS包括4个亚组:LS组、LMS组、SS组和其他组[16]。其中9例达到PR(SS组5例,LMS组 1例,其他组 3例),LMS组、SS组和其他类型组的3月无进展生存分别为44%、49%、39%。LMS组和SS组的总生存分别为11. 8月,10. 3月。由于LS组效果不佳,试验早早关闭了该类型入组通道。Kasper等报道的PALETTE临床试验,是一项III期多中心、随机、安慰剂对照、双盲试验,进一步探讨帕唑帕尼在非GIST的STS治疗情况[17]。纳入了372例患者,按照2:1比例随机进入治疗组和对照组,超过20种亚型的肉瘤,其中LMS 115例,SS 30例,其他101例。结果发现,治疗组的PFS较对照组(4. 6月 v. s 1. 6月,p<0. 0001)长3月,治疗组的OS较对照组(12. 5月 v. s 10. 7月,p<0. 0001)延长1. 8月。治疗组中PR 6%、SD 67%,中位OS为11. 7月,36%的患者PFS超过6个月,34%的患者总生存期超过18个月,中位随访时间达到2. 3年。理想的试验结果使得FDA批准帕唑帕尼应用于晚期肉瘤患者。 1. 1. 3舒尼替尼(Sunitinib) 舒尼替尼是一种口服的小分子受体酪氨酸激酶抑制剂,具有抑制肿瘤血管生成和抗肿瘤细胞生长的多重作用。该药发挥抗癌作用的靶点包括:PDGFR-α和-β,VEGFR1、VEGFR2、VEGFR3,FLT-3,CSF-1R,kit和ret。舒尼替有多个效应通路,使它成为一个非GIST肉瘤可靠的抗肿瘤靶向药物,有两个II期临床试验评估其安全性和有效性。George 等入组非GIST肉瘤患者53例(LMS 11例,MFH5例,SS 4例)进行单药舒尼替治疗[18]。20%患者疾病稳定SD,1例促结缔组织增生小圆细胞瘤(DSRCT)56周后仍在治疗。Mahmood 等评估LS,LMS,MFH患者疗效的II期临床试验[19]。50%的患者试验中需要减量。中位PFS值分别为3. 9月,4. 2月和2. 5月,中位OS分别为18. 6月,10. 1月和13. 6月,12周PFS是69%,62. 5%,44. 4%。 1. 1. 4 索拉非尼(Sorafinib) 索拉非尼是一种口服的多激酶抑制剂。它能同时抑制多种存在于细胞内和细胞表面的激酶,包括BRAF激酶、VEGFR-2、VEGFR-3、PDGFR-β、KIT和FMS样的酪氨酸激酶3(FLT-3)。目前已知有4个临床试验论证单药索拉非尼在非GIST肉瘤安全性和有效性,但和其他TKIs类似,它可能在治疗血管性肿瘤方面有独特优势。Maki等进行了多中心II期临床试验,共纳入122例患者[20]。其中SD(62例,51%),PR(17例,14%), CR 1例,病理类型为血管肉瘤。中位PFS为3. 2月,中位OS为14. 3月。12周PFS最高发生在血管肉瘤(64%),其次平滑肌肉瘤(54%)。在另一项II期临床试验中,Pacey等纳入26例非GIST肉瘤[21]。其中PR 3例(12%),SD 5例(19%),纤维肉瘤、平滑肌肉瘤,软骨肉瘤PFS分别为5. 8个月,11. 7个月和11. 7个月。进一步研究显示,血管肉瘤组和血管内皮细胞瘤组7例(78%)疾病稳定,显示索拉菲尼可以提高血管来源肉瘤患者的预后。Ray-Coquard等进一步研究索拉非尼在血管来源肿瘤患者的II期临床试验,纳入41例患者,其中73%既往接受过化疗[22]。既往未接受化疗的患者并不能从索拉菲尼的治疗中获益。但之前接受过化疗的患者有近40% 患者SD,23%患者CR+PR。这与Mehren等一项II期临床试验研究51例既往接受过0-1线治疗的进展期患者的结果类似[23]。在这项研究中,75%血管肉瘤患者SD, PFS为5个月,比LS组和LMS组的PFS延长2 - 3个月。 1. 1. 5西地尼布(Cediranib) 西地尼布,一种泛血管内皮生长因子受体酪氨酸激酶抑制剂,Kummar等[24]通过一项II期临床研究发现,对于转移性的腺泡状软组织肉瘤显示出良好的疗效,35%的患者达到PR,60%的患者出现SD,24周的总体疾病控制率达84%。 1.1.6安罗替尼 安罗替尼是一个多靶点受体酪氨酸激酶(RTK)抑制剂,可靶向血管内皮生长因子受体(VEGFR1/2/3)、成纤维细胞生长因子受体(FGFR1/2/3)、血小板衍生生长因子受体(PDGFRα/β)、c-Kit、Ret等靶点,近年探索其用于肿瘤靶向治疗的研究不断开展。中国医学科学院肿瘤医院依荷芭丽·迟教授分享了一项多中心Ⅱ期研究评估安罗替尼用于治疗传统疗法无效的晚期软组织肉瘤患者的有效性和安全性。该研究纳入我国的15个中心的166例患者,组织学类型包括滑膜肉瘤(SS)47例,平滑肌肉瘤(LMS)26例,恶性纤维组织细胞瘤(MFH)19例,纤维肉瘤(FS)18例,脂肪肉瘤(LS)13例,腺泡状软组织肉瘤(ASPS)13例,透明细胞肉瘤(CCS)7例,其他类型合计23例。结果显示,12周时的疾病无进展率是68.42%,中位无进展生存期(PFS)是5.63个月,21例患者确认部分缓解(PR),客观缓解率(ORR)为12.65%。总之,安罗替尼在多种组织类型的软组织肉瘤中均有疗效,尤其是滑膜肉瘤和腺泡状软组织肉瘤。此外,安罗替尼的毒副作用耐受性良好。 1. 2 PDGFR为靶点的治疗 血小板源生长因子(PDGF)配体结合激酶受体(PDGFR-α和PDGFR-β)导致激活信号通路(如Ras,PI3K)和转录因子[25]。体外和临床相关研究证明,PDGF家族信号通路的变异和众多STS亚型相关。 在之前的讨论中我们已经提及多激酶抑制剂帕唑帕尼、舒尼替尼、索拉非尼同样具有抗PDGFR的作用。在临床前和临床试验数据的支持下,FDA批准了伊马替尼用于治疗隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)和帕唑帕尼用于治疗非脂肪来源晚期软组织肉瘤[26]。 隆突性皮肤纤维肉瘤(DFSP)的17和22号染色体的转位表达了COL1A1-PDGF-β融合蛋白,驱动了PDGFR自分泌信号循环,促使肿瘤发生[27]。伊马替尼通过抑制PDGFR导致了DFSP细胞的凋亡,抑制了DFSP的生长,达到50%的反应率[28]。在其他非DFSP肉瘤中,PGFR的突变并未显示与抗PDGF方案相关。 有证据表明IMC-3G3(Olaratumab)是人源IgG1单克隆抗体,对PDGFR-α有较高的靶向亲和力。Tap 等开展了一项Ⅰb/Ⅱ期临床研究,评估Olaratumab联合阿霉素治疗晚期软组织肉瘤患者的疗效[29]。Ib期纳入15例患者,Ⅱ期纳入133例患者,随机分配Olaratumab+阿霉素组66例,阿霉素组67例。其中129名患者(97%)接受了至少一次的治疗。中位PFS Olaratumab+阿霉素组为6. 6个月,而单药阿霉素组仅有4. 1个月。中位OS Olaratumab+阿霉素组为26. 5个月,而单药阿霉素组仅有14. 7个月(HR=0. 46)。客观缓解率(ORR)在olaratumab+阿霉素组和阿霉素组分别为18. 2%,11. 9%。Olaratumab联合阿霉素治疗晚期软组织肉瘤的疗效达到预期PFS,且OS有11. 8个月的显著改善。也正是因为Olaratumab良好的临床试验结果,FDA授予其优先审评资格。 1. 3 IGF-1R为靶点的治疗 胰岛素样生长因子(IGF)信号是一个在恶性肿瘤转录和抗细胞毒性、内分泌治疗、放疗中的关键因子[30]。 IGF-1R是酪氨酸激酶受体,通过激活PI3K / AKT / mTOR和Ras /Raf/ MAPK的血管前通路来促进细胞的生长和增殖[31]。大约有50%的LMS、UPS肿瘤表达了IGF-1R[32]。 Cixutumumab(IMC-A12)是人类 Ig G1单克隆抗体,能高亲和性结合到IGF-1R。一项II期临床试验显示,单药Cixutumumab为LS带来一定的临床受益。在LS中,患者PFS达到12. 1周,而其他类型肉瘤则未能达到该疗效。[33]。另一种单克隆抗体R1507,同样的显示出临床获益。在一项II期临床试验研究中,纳入163例患者,其中符合条件的骨肉瘤患者(n = 38),RMS(n = 36),SS(n= 23),其他肉瘤(n = 66)总体客观反映率达到2. 5%,4例PR[34]。 1. 4. FGFR为靶点的治疗 成纤维细胞生长因子受体(FGFR)是一个多基因家族,属于免疫球蛋白基因家族。已经确定4种受体酪氨酸激酶,包括FGFR 1,2,3,4。FGFR信号在细胞迁移和正常细胞的增殖、存活和分化中起着至关重要的作用。在非GIST的STS中,FGFR信号与血管生成,肿瘤生成,淋巴管生成和转移有关[9,35]。利用新一代测序技术,Jour等研究25例STS的患者,其中40%的患者的肿瘤相关FGFR拷贝数增加,特别是在LMS和透明细胞肉瘤中[36]。FRS2这种FGFR通路的底物在FGFR信号传导中起着关键的作用,和CDK4、MDM2一同成为高分化/去分化脂肪肉瘤的重要特征[37]。 帕唑帕尼是非选择性多靶点的药物,它很可能是通过阻止FGFR通路实现抗肿瘤作用的。高选择性抗FGF方案也正在开发研究和临床试验的早期阶段。 2细胞靶向治疗 哺乳动物雷帕霉素靶蛋白(mTOR)整合上游营养和有丝分裂信号来调节细胞生长和细胞分裂。类似于mTOR通路,MEK/ERK信号级联是关键信号通路之一,MEK激活ERK1和ERK2亚型从而导致细胞增殖。一旦细胞周期开始,细胞周期蛋白依赖性激酶(CDKs),同细胞周期蛋白一起,共同负责调节细胞周期的进程。细胞周期途径进一步被p53肿瘤抑制基因控制,P53调控G1到S期,并受MDM2基因负向调节[38]。 2. 1 mTOR / PI3K / AKT为靶点的治疗 mTOR通路整合来自于胰岛素、生长因子和氨基酸的上游通路信息,参与基因转录、蛋白质翻译、核糖体合成和细胞凋亡等生物过程,在细胞生长中发挥了重要作用。mTOR途径激活会导致转移风险增高,降低生存率,意味着预后不良。大量研究显示,可以在各种肉瘤亚型中见到mTOR / PI3K / Akt通路被激活[39,40]。 mTOR抑制剂依维莫司(Everolimus),地磷莫斯(Ridaforolimus),西罗莫司(Sirolimus)和替西罗莫司(Temsirolimus)已经有单药方案的临床试验。一项多中心II期试验评价单药Everolimus有效性和安全性,纳入38例既往接受阿霉素治疗失败的STS患者,PR1例(AS),SD10例, PFS1. 9月[41]。Yoo等发现3例外周血管类上皮细胞肿瘤患者通过Sirolimus治疗,影像学均有缓解[42]。Temsirolimus通过CYP3A4酶转化为西罗莫司,在II期试验纳入40例既往未接受过治疗的转移性患者,PR2例(未分化的纤维肉瘤和子宫平滑肌肉瘤),中位PFS为2月[43]。最大规模的mTOR抑制剂研究在一项III期临床试验,关于Ridaforolimus维持治疗,纳入711例已至少接受4个化疗周期后无进展的转移性软组织肉瘤或骨肉瘤患者,大多数(90%)患者为STS,约2/3属于高级别肉瘤[44]。结果显示,治疗组中位无进展生存期(主要终点)为17. 7周,而安慰剂组为14. 6周,具有统计学差异,维持治疗组相当于疾病进展或死亡风险降低28%。总生存期分别为91 周和85 周,未见显著差异。 mTOR和其他化疗药联合的临床试验正在开展。包括细胞毒性,脂质体阿霉素,环磷酰胺、伊立替康都起到了一定疗效。最令人瞩目的是PI3K / AKT抑制剂和RAS / MEK通路抑制剂的联合。事实上,双重抑制RAS / MEK和mTOR似乎是一个有前途的体外试验。 2. 2 MEK抑制剂 Ras/Raf/MEK/ERK信号级联通路参与细胞增殖、分化、血管生成。分裂原活化蛋白激酶(MAPK)信号通路,发生在RAS的下游,由三个不同的激酶,包括细胞外调节蛋白激酶(ERK)和丝氨酸-苏氨酸激酶(RAF)和分裂原活化抑制剂(MEK)。MAPK通路的变异激活显示在许多STS亚型和临床前试验,发现MEK抑制剂在肉瘤细胞系和小鼠模型研究有抗肿瘤功效。尽管有临床前证据表明MEK抑制剂在特定的STS亚型中的疗效,但几乎没有临床数据证实其疗效可能性。 NCI注册的II期临床试验联合Temsirolimus 和MEK抑制剂,Selumetinib(NCT01206140),纳入71例既往接受小于两种化疗方案的晚期软组织肉瘤患者[45]。患者被随机分配到单药Selumetinib(75mg P. O. bid),进展后交叉到第二组。第二组Selumetinib(50mg口服每日两次)+ Temsirolimus (20 mg 静注,每周一次)。两组患者PFS并无差异(1. 9月和2. 1月)。在平滑肌肉瘤中联合用药组(n=11)优于单药组(n=10),中位生存有差异(3. 7月和1. 8个月,p=0. 01)。 2. 3 CDK抑制剂 细胞周期蛋白依赖性激酶(CDKs)以及细胞周期蛋白,负责调节细胞周期的进展。各种CDK沿细胞周期时相交替活化,磷酸化相应底物,使细胞周期事件有条不紊地进行下去,这个过程的中断在恶性肿瘤中非常常见。 Flavopiridol,一种非选择性的CDK 1、2、4、6、7、9抑制剂,是一种源于原产于印度的植物(Dysoxylum binectariferum)的黄酮类化合物[46]。Morris等进行了单药Flavopuridol的II期临床试验,纳入了18例晚期STS患者[47]。结果显示,CR0,PR0, SD为47%,PFS为4. 3个月。Luke等进行了Flavopiridol结合阿霉素的I期临床试验纳入31例晚期STS患者[47]。其中2例PR,16例SD。在高分化脂肪肉瘤/去分化脂肪肉瘤(WDLS/DDLS)亚组中,67%患者达到SD超过3个月。 研究发现超过90%的WDLS/DDLS与CDK4的扩增有关。Schwartz等研究CDK4/6选择性抑制剂Palbociclib,在I期临床试验纳入33 例RB基因阳性的患者[48]。患者治疗耐受良好,4例WDLS/DDLS患者评效SD。随后,Dickson 等开展一项II期临床试验研究CDK4抑制剂 Palbociclib,纳入29例局部进展期或晚期WDLS/DDLS患者,PR1例,中位PFS为18月,12周PFS为66%。副作用方面,3-4级副作用包括贫血(17%),中性粒细胞减少(50%),以及血小板减少(30%)[49]。随后,Dickson 等开展的一项II期临床试验,纳入60名晚期去分化或高分化脂肪肉瘤患者,最新结果显示,降低Palbociclib服用剂量后,达到12周PFS的患者占57%。中位PFS18周,与第一次试验相仿[50]。其中,CR 1例,并且已经持续超过2年了。副作用方面明显减轻,包括3-4级副作用包括贫血(22%),中性粒细胞减少(36%),以及血小板减少(7%)。试验结果显示高分化/去分化脂肪肉瘤患者中,CDK4基因扩增同时RB(+)的这部分患者Palbociclib显示出较好的疗效。 2. 4MDM2为靶点的治疗 p53是一种转录因子,通过激活多种与DNA修复,新陈代谢,细胞周期重排、细胞衰老、代谢和细胞凋亡的基因来响应细胞内外的压力[51]。它被MDM2和MDM4负调节,MDM2与MDM4通过不同机制协同对p53产生抑制作用,在肉瘤的发生中亦不少见[52],这些治疗方案在治疗各种STS亚型中有很大的潜力,尤其是化疗耐药的肿瘤。 在STS中,WDLS/DDLS与染色体区域12 q13-15的扩增密切相关的突变最终导致p53活性的抑制并引起肿瘤发生。一项I期临床试验纳入20例WDLS/DDLS的患者使用MDM2 、RG7112抑制剂, 30%出现药物相关性的血液毒性。结果1例 PR,14例SD。结果表明MDM2扩增型脂肪肉瘤中,MDM2抑制剂可以激活p53通路,也可以降低细胞增殖[53]。 3. 免疫靶向治疗 细胞程序性死亡受体1(PD-1)主要在激活的T淋巴细胞和B淋巴细胞中表达,功能是抑制细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫病。但是,肿瘤微环境会诱导浸润的T细胞高表达PD-1分子,肿瘤细胞会高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活,T细胞功能被抑制,无法杀伤肿瘤细胞。PD-1的抗体可以阻断这一通路,部分恢复T细胞的功能,使这些细胞能够继续杀伤肿瘤细胞。 Pembrolizumab是一种新型人源化单抗,通过作用于PD-1提升人体免疫力,消灭肿瘤细。STS方面,Burgess已经开展的II临床试验: SARC028 Pembrolizumab (Keytruda)包含2个分组的临床试验[54]。其中一组纳入40个高级别或已转移的软组织肉瘤患者。患者每3个星期单用200mg的Keytruda,直到影像显示疾病进展。 软组织肉瘤组中,40例患者中一共有37位持续用药,其中有11位(29. 7%)出现了不同程度的肿瘤缩小,这其中又有6例(16-19%)达到PR。试验药物获益的患者包括
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科4348人已读 - 精选 肝内胆管癌适合用靶向药物吗?
目前科学家基于二代测序对肝内胆管癌做了一个测序,排名第一位的基因突变是TP53,占15.7%, KARS有9.5%,像这些基因突变的药物都不是特别多。 靶向药物分几种机制: 一种是直接驱动肿瘤发生的基因,比如肺癌的EGFR,是驱动肺癌发生的一个基因;另一种靶向药物是针对血管的,比如阿西替尼,阿法替尼,乐伐替尼等,因为肿瘤必须有血管才能长大,抗血管生成的药物通过抑制肿瘤血管的生成阻止肿瘤的生长。所以就算是没有基因突变,也可以用这些抗血管生成的药物控制肿瘤的生长。按理说这些抗血管生成的药物都有一定的效果,但是有效时间的长短是因人而异的,比如肝癌,基因突变跟肺癌的完全不一样,针对肝癌这个靶点的药物也非常的少,所以肝癌目前的靶向药物,不管是多吉美还是乐伐替尼,其实都是针对抗血管的靶向药物。乐伐替尼的效果还是挺不错的,所以如果肝内胆管癌患者要尝试靶向药物的话,可以从抗血管生成的药物去考虑。 2007年的时候做了一个研究,44例不可切除的晚期肝内胆管癌患者,它是一个前瞻性研究,评估的是索拉非尼(多吉美)联合最佳支持治疗(一般是化疗)的有效性和安全性。 研究者用的是索拉非尼,每日两次,每次100毫克,加上最佳支持治疗,结果显示疾病控制率是15.9%,平均疾病进展时间是5.6个月,中位总生存期(OS)分别是3.2个月和5.7个月。 这个是最近刚发的一个2007年的一个研究,索拉非尼联合最佳支持治疗,在这个不可切除的高级的肝内胆管癌是有一定效果的,是有安全性的。其他抗血管生成的药物,我觉得也是有一定效果的,而且这些抗血管生成的药物是不是还可以和其他的药联合着配合着用呢? 癌度之前发过一篇关于抗血管生成的药物和PD1联合的文章(PD-1+抗血管靶向=更好地控制肿瘤?)。因为肿瘤会诱导血管到它附近,但是肿瘤诱导血管的时候,有可能会把T细胞给阻断掉,不让T细胞到它的病灶旁边,所以这个抗血管生成的药物有可能会把这个血管给阻断掉,不让它生成或者其他的,这样结合着一些免疫治疗或者其他的治疗,可能会有一些协同的效果,也就是1+1>2的效果。 肝内胆管癌患者可以用卡博替尼(184)这个靶向药物吗?哪些患者比较适合? 卡博替尼有MET、VEGFR2以及RET三个靶点,它有一个针对肝内胆管癌的二期临床试验,我们也了解肝内胆管癌也有一部分患者是有MET高表达的,而且卡博替尼也有抗血管生成这个靶点(VEGFR2),也许可以试一试,毕竟现在科学家也在做二期临床了,如果一期临床没有一些数据,可能二期临床也不会开,当然医学更多的是看这个药物的副作用或者是毒副作用。 肝内胆管癌患者可以用2992(一种EGFR-TKI药物)吗?哪些患者适合? 我们了解到有一些肝内胆管癌的患者在尝试2992。有文献表明肝内胆管癌的EGFR突变和EGFR扩增,对EGFR-TKI靶向药物都可能敏感。所以存在EGFR扩增的患者用EGFR-TKI靶向药物可能是有效的。 这也说明为什么EGFR基因突变为阴性,但是EGFR高表达的患者有可能用EGFR-TKI的靶向药物也是有效的,癌度之前有篇文章总结过(什么?没有基因突变,靶向药物也有效!)。EGFR扩增虽然没有EGFR突变的效果好,但还是有效果的。 利用肺癌的这个经验可以验证为什么2992可以用在肝内胆管癌患者身上。虽然看下图数据上, EGFR的突变频率只有2.2%,但有存在EGFR高表达的频率比较高,所以肝内胆管癌患者使用2992有可能会获益。
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科1.3万人已读 - 精选 安罗替尼——肺鳞癌抗血管生成治疗的新希望
2017年正大天晴自主研发的抗血管生成新药安罗替尼用于晚期NSCLC三线治疗的ALTER0303研究结果重磅公布,该研究中入组了部分肺鳞癌患者,这类患者能够从安罗替尼中获益,该部分数据即将在2018年ASCO上公布。这一结果是否会为肺鳞癌的抗血管生成治疗带来了新的希望?【肿瘤资讯】特邀国内肺癌领域的名家,共同探讨晚期肺鳞癌治疗现状及安罗替尼的应用前景,详见下文。 1524901472622161.png 国内外晚期肺鳞癌的治疗现状 陈余清教授:近年来世界范围内肺癌的发病率的整体呈上升的趋势,尤其是腺癌。鳞癌方面男性呈下降趋势,女性在增加。在肺鳞癌的基因突变方面,2017年世界肺癌大会上发表了一项肺鳞癌患者基因组研究,其中发现了一个新的潜在致癌基因突变PTCH1。肺鳞癌的基因突变主要是PIK3CA、EGFR、DDR2和FGFR1的扩增。其中,EGFR的突变率仅占3.6%。在治疗方面,化疗仍然是晚期肺鳞癌的主线。一线的治疗仍然是含铂的两药方案,是身体状况比较好,PS评分0-1分晚期肺鳞癌的标准治疗。但对于身体状况比较差,PS评分大于或等于2分患者推荐单药化疗。在靶向治疗方面,仅少数肺鳞癌有驱动基因突变,这类患者可以从靶向治疗中获益。有关肺鳞癌的免疫治疗,根据KEYNOTE-024研究显示对于PD-L1表达≥50%,且EGFR、ALK均是突变阴性患者推荐接受Pembrolizumab治疗。2014年12月,美国FDA批准雷莫芦单抗联合多西他赛作为晚期非小细胞肺癌二线治疗方案,同时适用于肺腺癌和肺鳞癌。 胡晓桦教授:雷莫芦单抗是近年来国际上比较热门的治疗肺鳞癌药物。REVEL研究结果显示雷莫芦单抗+化疗联合组比单纯化疗组明显提高了PFS和OS,纳入部分肺鳞癌患者仍提示雷莫芦单抗对肺鳞癌也有一定的疗效,尤其在观察过程中并没有发现明显出血的风险,因此雷莫芦单抗是肺鳞癌的抗血管治疗中非常有希望的药物。非常遗憾的是该药目前未在国内上市。恩度是我国自主产权的药物,在II期临床研究中发现与化疗联合能明显延长TTP,尽管没有单独的前瞻性肺鳞癌的临床研究,但在亚组分析当中可以观察到对于鳞癌病人有它的优势,且没有增加出血风险。 肺鳞癌治疗策略的优化 陈余清教授:在探索和优化方面,ECOG1594研究比较了四种含铂两药化疗方案一线治疗非小细胞肺癌疗效差异,研究结果显示吉西他滨、紫杉醇、多西他赛联合铂类一线治疗非小细胞肺癌的疗效相近,但在鳞癌亚组,吉西他滨联合顺铂的方案相比其它方案,无进展生存期和总生存期最长,分别达到了4.3个月和9.4个月。日本LETS研究比较替吉奥联合卡铂与紫杉醇联合卡铂一线治疗晚期非小细胞肺癌的疗效,鳞癌亚组的结果显示替吉奥联合卡铂组相比于紫杉醇联合卡铂组总生存获益更大。 胡晓桦教授:免疫靶向治疗近年来在各种实体瘤取得非常好的成绩,近年来在肺癌方面也取得了相当大的进展。除了KEYNOTE-024研究显示对于PD-L1表达≥50%,且EGFR、ALK均是突变阴性患者推荐接受Pembrolizumab治疗,在二线治疗上,CheckMate 017研究入组了IIIB/ IV期肺鳞癌患者,经随机后分配至Nivolumab组或多西他赛组,Nivolumab能够有效延长晚期肺鳞癌患者的PFS及OS。因此对于肺鳞癌的二线治疗,PD1单抗显示出较大的优势,且与PD-L1表达无明显关系。虽然CheckMate 017研究显示生存期获益,但总有效率没有超过20%,如何对免疫治疗进一步优化是值得关注的问题。PD-L1表达似乎并没有在肺鳞癌治疗上显示出很好的预测作用,部分PD-L1阴性患者仍然有获益。近年来非常重视肿瘤突变负荷(TMB),但是该指标还缺少大型临床研究验证,我们不仅期待大型临床研究的出现,同时也期待有更好的生物标志物。 肺鳞癌抗血管生成治疗的新希望-安罗替尼 陈余清教授:由于肺鳞癌驱动基因的突变发生率很低,因此它在靶向治疗中获益是有限的。恩度Ⅲ期临床研究结果病理亚组分析表明肺鳞癌患者同样获益。恩度2725例大样本的Ⅳ期临床研究结果重现并验证了恩度Ⅲ期临床研究结果,分层分析显示恩度联合化疗对于肺鳞癌保持一致的安全性和有效性。 近期我国另一个抗血管生成新药安罗替尼的三期临床试验ALTER0303研究结果已经公布,该研究入组了部分肺鳞癌患者,该研究达到主要研究终点及次要研究终点,相比安慰剂组,安罗替尼组OS延长了3.33个月,PFS延长了3.97个月;在有效率方面,安罗替尼组ORR为9.18%。在不良事件发生率上,安罗替尼也显示了良好的安全性。 胡晓桦教授:目前对于肺鳞癌,现在一线和二线治疗失败以后没有标准的化疗方案,可供的治疗方案很有限。在安罗替尼的三期临床研究中入组了部分肺鳞癌患者,治疗组总体人群的数据非常好,相比安慰剂组,安罗替尼组明显延长了OS和PFS,这也提示安罗替尼很可能是肺鳞癌治疗的新希望。这项研究的最新数据将会在ASCO上公布,让我们共同期待。在不良事件发生率上,安罗替尼也显示了良好的安全性。因此我们认为安罗替尼是肺鳞癌治疗中的一个非常值得关注的新方法。希望下一步能开展安罗替尼在肺鳞癌的前瞻性多中心临床研究。
李黎 副主任医师 锦州医科大学附属第三医院 肿瘤综合科8046人已读



