上海长征医院血液内科科普号
- 精选 会吃骨头的病--多发性骨髓瘤
多发性骨髓瘤是起源于骨髓内浆细胞的恶性肿瘤,浆细胞定居在骨髓内,血液里面是没有浆细胞的。正常的浆细胞可分泌大量的免疫球蛋白到血液中,发挥免疫功能,起到保护机体的作用。但是如果这些浆细胞发生恶变,变成肿瘤性的浆细胞,也就是骨髓瘤细胞,则不仅不能发挥其正常的免疫功能,还会对人体产生损害。我们都知道,骨髓是人体的造血器官,所有的白细胞、红细胞、血小板都是由骨髓生产,如果骨髓内肿瘤性的浆细胞(也就是骨髓瘤细胞)大量增殖,占据了骨髓的造血空间,骨髓造血就会受抑制,就会出现白细胞减少、贫血和血小板减少,白细胞减少则会导致患者经常出现感染感冒等症状,贫血则会导致患者出现头昏乏力倦怠等症状。同时骨髓瘤细胞还会向它周围的骨细胞发出信号,使骨质生成受抑制,骨质破坏增加,患者就会出现骨质疏松、骨痛等症状,影像学检查可发现骨质破坏。另外,骨髓瘤细胞也会像正常浆细胞一样分泌免疫球蛋白,但这些免疫球蛋白是无功能的,也就是M蛋白,当其大量增殖时,患者血液和尿液内就会检测到大量无功能的免疫球蛋白,患者会出现泡沫尿的症状,这些无功能的蛋白会随着血液循环沉积到人体器官中,尤其是容易沉积在肾脏中引起肾脏受损。多发性骨髓瘤起病非常隐匿,不易发现,当患者朋友们出现不明原因的小便泡沫增多、骨痛、贫血时需及时到医院就诊,以免漏诊。
 何海燕 副主任医师 上海长征医院 血液病科389人已读
何海燕 副主任医师 上海长征医院 血液病科389人已读 - 精选 长征血液肿瘤100问 | 第2问:血清游离轻链测定知多少?
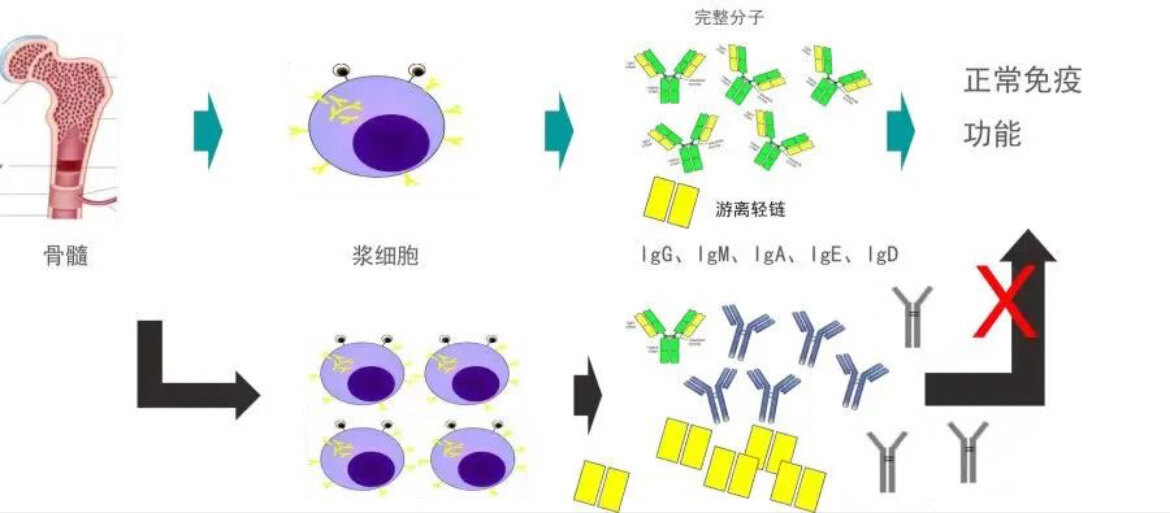
“您先去查个血清游离轻链吧 您在血液科就诊时有时会听到医生的这条建议那么血清游离轻链检测到底是在检查什么呢?为什么这个检查往往伴随着诊疗的始终呢?今天我们就来谈一谈这一位“大侦探”“血清游离轻链”什么是血清游离轻链? 说到游离轻链检测这位“大侦探”,就不得不提到他的“老对手”骨髓瘤了。在骨髓瘤发病初期病人常常无明显的临床表现,而血清游离轻链检测结果正是检测骨髓瘤的重要指标。 免疫球蛋白(Ig)单体由两条轻链和两条重链经二硫键连接而成,其中轻链分为kappa和lambda两个型别,两者正常比例为2:1,正常情况下人体每日产生约为500mg,其分子量显著小于重链,故合成速率大于重链,除了与重链结合组成Ig以外,会有40%的轻链未能与之结合,处于游离状态,即游离轻链(FLC)。 对于多发性骨髓瘤患者来说,合成免疫球蛋白的速度会明显加快,合成1条重链只需2.5min,合成1条轻链仅需1min,每当合成1分子Ig时,即有3条轻链剩余。由此看出骨髓瘤不仅在细胞周期上进入无限增殖的状态,而且还在合成速度上明显加快,导致血清或尿中的单克隆免疫球蛋白或轻链或重链明显增多,其中又以轻链增多最明显,游离轻链主要存在于血浆中也见于尿液、唾液、脑脊液等体液中。游离轻链检查的临床意义? 血清游离轻链κ/λ比值异常,可作为判断良恶性浆细胞病的重要标准。血清游离轻链的检测具有高敏感性和高特异性,相比M蛋白鉴定、尿轻链等指标,它能更早地对治疗效果和疾病复发做出反应。 在疗效判断标准上,游离轻链测定作为骨髓瘤严格完全缓解的标准之一,在IgD型、轻链型、不分泌型骨髓瘤和淀粉样变性的诊治中有独特的、无可替代的价值。国内外骨髓瘤指南已正式推荐血清游离轻链检测用于骨髓瘤的诊断、疗效监测以及预后评估。总结 血清游离轻链测定比M蛋白、血轻链结果灵敏度更高,比尿轻链检测更加及时,比骨髓病理更加易得。在骨髓瘤的诊断中为患者提供了便捷、有效、动态的监测手段,发挥着非常重要的作用。自2010年来,长征医院血液病科搭建了新型的检测技术平台,正式开展血清游离轻链检测项目,为患者开启精准诊断治疗奠定了基础,长征血液在战胜多发性骨髓瘤的路上与患者一路同行!血清游离轻链检测流程是什么?如何领取报告?1血液科门诊挂号就诊,医生开具项目“免疫球蛋白游离轻链测定”2完成缴费3门诊3楼检验科采血每周三、周五出报告,可在门诊一楼大厅自助报告打印或关注长征医院官方服务号查询报告。长征血液微信号 : CZXY41517
 何海燕 副主任医师 上海长征医院 血液病科356人已读
何海燕 副主任医师 上海长征医院 血液病科356人已读 - 精选 上海长征医院血液科研究结果入选2022美国血液年会( ASH)口头发言。
报告如下 •摘要标题:BCMA/CD19双靶点FasTCAR-T细胞(GC012F)作为适合移植新诊断多发性骨髓瘤高危患者的一线治疗方案的I期开放标签单臂研究PhaseIOpen-LabelSingle-ArmStudyofBCMA/CD19Dual-TargetingFasTCAR-TCells(GC012F)AsFirst-LineTherapyforTransplant-EligibleNewlyDiagnosedHigh-RiskMultipleMyeloma •摘要编号:366Abstractnumber:366 •环节名称:细胞免疫治疗-早期和研究性治疗-多发性骨髓瘤中的CAR-T疗法和异基因造血干细胞移植后的T细胞治疗Sessiontitle: CellularImmunotherapies:EarlyPhaseandInvestigationalTherapies:CARTinMultipleMyelomaandT-cellTherapiesAfterAllo-HCT •环节类别:口头报告环节Sessiontype:OralAbstractSession •报告时间:2022年12月10日(星期六),美国中部时间下午4:00-5:30Presentationtime:Saturday,December10,2022:4:00PM-5:30PM 摘要内容 高危(HR)初诊多发性骨髓瘤(NDMM)患者在标准一线治疗中预后较差,治疗较为棘手,即便对于接受干细胞移植治疗的患者,疗效及预后尚不满意。杜鹃教授团队在前期使用BCMA/CD19双靶点、快速制备CAR-T的FasT平台的CAR-T细胞疗法(GC012F)在复发/难治性骨髓瘤患者中取得了较深缓解、较好预后及良好的安全性。因此能否将这种具有前景的细胞治疗新方法前移,在起病阶段达到深度缓解,势必明显改善预后。自2019年起,上海长征医院血液科开启了一项“开放标签单臂I期临床研究,旨在评估BCMA/CD19双靶点CAR-T细胞治疗对于适合移植高危初诊骨髓瘤患者的安全性及疗效。先后对16例初诊HR的骨髓瘤患者接受GC012F治疗(所有患者均具有一个或多个高危特征)。截至2022年10月14日(中位随访7.9个月),总体有效率到达100%,94%患者≥VGPR,sCR率82%,100%均达到微小残留疾病(MRD)阴性;且仅5例患者(29%)出现细胞因子释放综合征(CRS),均为1-2级,无3级以上CRS/ICANS事件发生。在这项适合移植的初诊高危MM患者的I期临床探索中,CAR-T疗法展示了极高的疗效和安全性,在国际上率先开启逆转高危骨髓瘤患者不良预后的新举措和新思路。后续将在更长时间的随访中,进一步论证CAR-T细胞疗法对高危初诊骨髓瘤患者的临床获益性。本研究结果入院2022年全球最高血液领域国际盛会(ASH)口头发言。
杜鹃 主任医师 上海长征医院 血液病科103人已读 - 精选 血小板计数高是什么病?1段语音 共1分钟庄晏 主治医师 医生集团-上海 线上诊疗科4435人已收听
- 精选 白细胞少可以吃什么补?1段语音 共1分钟庄晏 主治医师 医生集团-上海 线上诊疗科3163人已收听
- 精选 血清游离轻链(sFLC)——多发性骨髓瘤的诊治必备
血清游离轻链(FLC)此新型检测技术,国际以广泛提倡,我科从2013年10月在国内首先开展此项检查,为临床提供极大的帮助!sFLC 具有以下优点:北京朝阳医院京西院区血液与肿瘤科黄仲夏1 血清游离轻链κ/λ比值异常可作为判断良恶性浆细胞病的重要标准。其测定比普通M蛋白鉴定、血清蛋白电泳、尿轻链更敏感能更早的发现治疗效果及疾病的复发;2 在疾病复发早期,骨髓活检可能只有5%的浆细胞,X线和MRI扫描无变化,而游离轻链浓度升高是肿瘤复发的明确证据,提示该行化疗了;3骨髓瘤化疗过程中,游离轻链阴性的骨髓瘤患者较免疫固定电泳转阴性(但游离轻链阳性)有更长的生存期,可以达到很深的缓解程度sfLC(严格意义的完全缓解);4. 尤其对于IgD型、轻链型、不分泌型骨髓瘤和淀粉样变性的诊治中有独特的、无可替代的价值;且可作为判断这些患者肾功能的一项指标;5. 目前也可用于淋巴瘤、CLL等疾病的检测!
杜鹃 主任医师 上海长征医院 血液病科2.1万人已读 - 精选 BLOOD:如何治疗冒烟型多发性骨髓瘤-2015
冒烟型骨髓瘤(SMM)是一种临床异质性疾病,一部分患者临床进展缓慢,类似于意义未明的单克隆丙种球蛋白血症(MGUS),另一部分则有更为侵袭的过程,被描述成“早期骨髓瘤”。SMM 诊断需符合血清 M 蛋白≥3 g/L 或骨髓中浆细胞≥10%,现无分子学标志可检测疾病进展相关的危险因素,目前推荐的治疗仍是随访观察或患者自愿加入临床试验。然而,国际骨髓瘤工作组 (IMWG) 达成新的活动性多发性骨髓瘤定义,可能会改变 SMM 治疗的时机。基于现有患者治疗的数据,对于 SMM 患者推荐治疗将成为越来越热的话题。美国波士顿哈佛医学院达纳法伯癌症研究所 Ghobrial 等回顾了这一疾病现有的认知和疾病进展的相关危险因素,同时检测克隆性肿瘤细胞和骨髓基质微环境分子生物学见解及改变。最后,回顾了 SMM 患者临床试验相关结果并提出了对这一独特疾病患者的随访建议。并于 2014 年 11 月 27 日发表于 BLOOD 上。尽管过去十年已可有效的靶向治疗多发性骨髓瘤(MM),但因耐药、克隆性演变、疾病进展阻碍了靶向治疗的临床实用性,要求我们进一步探索这一难以捉摸疾病。 然而,有争议的观点认为当 MM 有症状时开始治疗相当于实体瘤发生转移时才治疗。因此即使临床上应用当前最佳药物联合方案,大部分患者仍不能治愈。所以大多数人开始探讨 MM 前驱无症状期是否需要治疗的问题,最终的目标是阻止疾病进展和达到痊愈。MM 可由前驱状态 MGUS 和 SMM 持续发展而来,这表示在无症状或无终末器官损害迹象时肿瘤负荷仍是一个持续进展的过程。作者回顾了现今对 SMM 的了解,包括临床可促使疾病进展的危险因素。大部分患者现在推荐的治疗仍是长期随访观察或临床注册试验。然而,活动性 MM 定义和治疗适应症由 IMWG 最新达成一致。基于现有治疗 SMM 数据显示,长期和持续缓解明显改善无病进展生存期(PFS)和总生存期(OS)。基于以上合理的介绍,让我们有理由相信不久的将来治疗 SMM 将成为热点话题。病案描述一名 42 岁儿科医生就诊时验血,发现血清中单克隆蛋白存在,平素身体健康,近一年内频发鼻窦感染,自认由于工作中接触感染患儿引起。常规化验发现蛋白水平升高至 9.5 g/dL(参考范围:6.0-8.0 g/dL)。血清蛋白电泳显示免疫球蛋白(Ig)A κ轻链为 3.5 g/dL。无骨痛、发热、体重减轻。血象无异常,血清肌酐水平和钙离子浓度均在正常范围内。κ轻链升高,κ/λ比值为 30。血清 IgG、IgM 水平降低。进一 步的检查未发现溶骨性病变,MRI 未见局灶性损害。骨髓活检见 30% 浆细胞,呈单一、成簇、片状分布。通过免疫表型可分离出 95% 异常浆细胞,这些异常浆细胞流式细胞学表达 CD38、CD138、CD56,细胞质分泌过量κ轻链,染色异常。细胞遗传学和荧光原位杂交显示一条 1 号染色体长臂增加。如何诊断 SMM 患者及初步评估SMM 是一种临床异质性疾病,疾病进展风险较 MGUS 更高,因缺乏符合 MM 诊断标准的终末器官损害,故治疗时机并不明确。在 2003 年,IMWG 形成对 MGUS 和 SMM 统一定义,MGUS 定义为血清 M 蛋白<3 g/dL,同时骨髓中单克隆浆细胞 <10%,而 SMM 定义是血清 M 蛋白≥3g/dL 或骨髓中单克隆细胞≥10%(表一),这两种疾病都无终末器官的损害。终末器官损害 CRAB 定义标准:高钙血症(血清钙≥11.5mg/dL),肾衰竭(肌酐≥1.95,排除其它原因),贫血(血红蛋白≤10g/dL 或者低于正常值低限 2g/dL 以上),骨损害(溶骨性改变、病理学骨折、脊髓压迫)。SMM 患者分级所需检查类同于 MM 诊断所需(表二),SMM 诊断需骨髓中足够量的肿瘤细胞负荷和单克隆蛋白,但缺乏终末器官损害的症状或迹象。最新建议包括脊柱和骨盆 MRI 或低剂量 CT,可更及时的对疾病进行预测(详见 SMM 影像学研究部分)。最近扩充明显进展的 MM 临床诊断和早期治疗标准,包括骨髓浆细胞≥60%,受累游离轻链(FLC)与非受累轻链比值≥100,和 / 或通过功能性成像如 PET-CT 和 / 或 MRI 见局灶性骨髓病变≥2 。SMM 影像学研究CARB 标准其中一项定义有症状 MM 需出现溶骨性损害,既往使用骨骼平片评估,虽然安全廉价,但需当骨质减少 30%-50% 才可检测到。MRI 能够提供实际肿瘤负荷。当 SMM 患者出现局灶性骨髓病变≥2 个时,在极短暂的时间内即可进展为活动性 MM,这也使得它成为 MM 开始治疗的一个新标准。另外,CT 可较早检测到骨损害,部分研究中用低剂量 CT 作为检测终末器官损害的手段。除此之外,功能性技术还包含如 PET(PET-CT 或 PET-MRI)、动态增强 MRI、弥散加权成像 MRI,可提供功能性疾病活动信息。SMM 随访、评估危险因素及进展机率SMM 发病率和流行趋势尚不明确,估测占 MM 的 8% 到 20%。最近回顾了瑞典自 2008 年至 2011 年间骨髓瘤注册中心的 2494 名骨髓瘤患者中,有 360 名(14.4%)符合 SMM。在这些 SMM 患者中 104 名(28.8%)属高危型(定义 M 蛋白≥3 g/dL 和浆细胞浸润≥10%),占所有骨髓瘤患者 4.2%。以世界人口作为参考,SMM 年龄标准化发生率为 0.44 例 /100000 人,高危型发病率为 0.14 例 /100000 人。基于梅奥诊所回顾性研究显示,SMM 进展为 MM 总体风险第一个 5 年为 10%/ 每年,下一个 5 年为 3%/ 每年,最后 10 年为 1%/ 每年,以上显示出目前定义的 SMM 具有生物学和临床上高度异质性。采用何种频率去随访这些 SMM 患者取决于以上提及的疾病进展危险因素。2010 年 IMWG 指南表明 SMM 患者第一年应每 2 到 3 个月检测,随后每年 4 到 6 个月,若临床稳定之后,最终可 6 到 12 月进行评估。本文作者推荐高危 SMM 患者应更密集的随访(若没有接受治疗至少每 3 个月随访一次)。事实上,SMM 是一个异质性临床疾病,指一部分患者处于非常惰性过程,类似于 MGUS 样阶段,然而其它患者有一个更侵袭性临床过程,即被描述成早期骨髓瘤或 CRAB 阴性的骨髓瘤患者。当前无分子学因素可区分这两种从临床到生物学均不同的亚群,需进一步研究确定这些进展患者的标志。目前疾病进展相关的危险因素主要基于 SMM 患者肿瘤负荷水平,通过分析骨髓中肿瘤细胞累及程度和定量外周血单克隆蛋白。梅奥诊所把这两种因素广泛用于危险分层,西班牙 Programa para et Tratamiento de Hemopatias Malignas (PETHEMA) 研究组也对这一疾病进行了分层(表三)。表三 SMM 的危险分层梅奥诊所主要基于血清蛋白标志物水平(血清蛋白电泳和 FLC 分析)和骨髓中浆细胞百分比。PETHEMA 研究组危险分层重点应用骨髓多参数流式细胞学定量骨髓中异常浆细胞比值,和未累及球蛋白的减少。但两个组织的评估结果存在明显差异,即很多患者一种标准提示高危,另一种标准却提示低危。其它可检测的危险因素包括 IgA(vs IgG 型)型、蛋白尿、外周血浆细胞数、骨髓中浆细胞高度增生率及异常 MRI 表现。最新研究显示浆细胞染色体异常也是 SMM 进展的关键因素。两项研究表明 17q 缺失或 t(4;14)与最短的进展时间(TTP)有关,同时三倍体也是进展的危险因素。1q21 染色体增加突变也可提高 SMM 患者进展风险。因此,患者诊断 SMM 首先应进行危险分层(同时应用梅奥标准和 PETHEMA 标准)。另外,其它高风险进展因素如细胞遗传学、外周血浆细胞数量、血清蛋白电泳 M 峰值变化及 MRI 影像学改变均要考虑到。显然,旧的分类方法中“超高危”应重新分类为具有明显进展风险的 MM,需要临床干预治疗。这些患者包括:骨髓浆细胞≥60%,异常 FLC 比值≥100(κ链累及)或<0.01(λ链累及),和 / 或 PET-CT 和 / 或 MRI 成像见局灶性骨病变≥2 个。上文提及的患者根据梅奥诊所和 PETHEMA 评估标准诊断为高危。因此,该患者可能有更快速的临床进展,5 年进展发生率为 70% 到 80%。选择 SMM 治疗方案:观察或早期治疗对于诊断 SMM 患者现今标准疗法是观察等待策略。然而,对于临床试验显示出 SMM 患者不同的 PFS 和 OS,使得这一治疗标准可能要发生改变。上文提及的这例 SMM 患者随访一年后显示快速的进展,骨髓活检提示浆细胞达 70%。基于 CRAB 标准,该患者未出现其它有症状 MM 的证据,但根据现今重新定义高危 SMM 患者,即伴有“骨髓瘤定义事件(MDE)”的具有明显进展风险骨髓瘤,故需开始接受治疗。因此,最新的分类改变将符合 MDE 的患者,按照有症状 MM 的标准进行治疗。未来进行 SMM 临床试验研究应排除这类患者。早期干预治疗可明显改善疗效的设想已检验了许多年。对于干预治疗有两个主要的想法,第一阻止疾病进展;第二病因治疗,即尝试在疾病早期阶段根除亚克隆细胞达完全缓解,甚至治愈目的。早期干预的主要障碍是如何定义真正能从早期治疗获益的患者人群。事实上,如果 SMM 是早期骨髓瘤和 MGUS 样骨髓瘤混合的疾病,早期 MM 才是真正需干预治疗的患者。不幸的是,除了危险分层中肿瘤负荷指标,并无生物学标志提示 SMM 疾病进展。上世纪 90 年代,第一个应用马法兰和强的松验证早期干预治疗假说,但并未在生存率上显示出优势。随后 SMM 研究中,应用双膦酸盐类药物(包括 2 个随机对照研究)在 OS 或进展时间上没有改善,但骨相关事件有所减少。下一个试验药物是沙利度胺。沙利度胺 / 唑来膦酸组较仅应用唑来膦酸组可明显改善 PFS,分别为 29 个月和 14 个月,但根据 CRAB 事件定义两组 PFS(分别 49 、40 个月) 或 OS(6 年 OS, 70%)没有差异。关于 SMM 最重要的研究—PETHEMA 研究组将来那度胺和地塞米松定为干预治疗组,并与观察组进行比较,它的试验结果燃起了极大兴趣。Mateos 等进行一项开放性临床随机试验,119 名高危 SMM 患者,随机分配至观察组或治疗组(来那度胺联合地塞米松),治疗组有更高的 3 年无进展生存(分别为 77%、30%)及 OS(分别为 94% 、80%)。然而,入选需满足 2 套高危疾病定义(梅奥诊所或 PETHEMA 危险分层标准)标准 1 个或 1 个以上。但对这项试验概括性结论存在一些担忧,需注意比较不同临床试验及试验结果。因此,应尽力收集所有疾病进展危险因素的信息。另外,这项研究不足之处在于未明确两组无症状生物学进展情况、放弃组短暂 OS 及放弃组挽救性治疗情况。基于以上原因,在贯彻高危 SMM 干预治疗标准前,还需进一步的研究。然而,这项研究具有足够的挑战性,激发了许多研究高危 SMM 治疗临床试验发展。很多药物已进行了试验,包括卡非佐米 / 来那度胺联合地塞米松,最新的免疫疗法如靶向信号淋巴细胞激活分子家族成员 7—elotuzumab、CD38 靶向抗体、程序性细胞死亡 -1 靶向抗体等。建议基于现在 SMM 定义,SMM 不是一种独特生物学疾病,而是骨髓微环境中肿瘤细胞持续克隆演化、进展,最终导致有症状 MM 中的一步。然而,通过对 SMM 的认识,给予我们了解疾病进展的生物学步骤,故在显著的克隆异质性发生、免疫紊乱及骨髓微环境调节异常前,通过对肿瘤细胞靶向攻击从而干预性治疗,阻止 / 延迟疾病进展甚至治愈。之前,科学家尝试验证早期干预治疗阻止进展或治愈骨髓瘤的假说都以失败告终。直到来那度胺联合地塞米松显示出可喜的研究结果,即早期干预有生存优势。然而,在临床上采纳这一研究结果之前,需要更多试验研究。SMM 目前最大的实践变化是一部分高危 SMM 患者重新分类为具有 MDE 的明显进展风险 MM,这些患者的治疗应等同有症状的患者。对于所有其他 SMM 患者,本文作者建议还应仔细监测或参加临床试验以便更好的评估这类疾病早期干预的作用。我们相信更有意义的分子学特征可用于识别需要治疗的具有高危进展至有症状 MM 的早期骨髓瘤患者,以及不能从治疗中获益的 MGUS 样阶段。尽管还需要正式检测和证实,我们猜测早期骨髓瘤在基因方面不利因素较少,一些患者应用现有的有效药物能够达到治愈。正在进行的和未来的研究有望提供这些问题答案。文章链接:http://hematol.dxy.cn/article/96137
杜鹃 主任医师 上海长征医院 血液病科2001人已读 - 精选 [ASH2014]多发性骨髓瘤的靶向治疗——试验抗体
http://news.medlive.cn/hema/info-progress/show-71634_112.html研究表明,在治疗多发性骨髓瘤的标准疗法中加入一种新药——抗CD38单克隆抗体——可能是一种可行有效的方法。这种药物绑定CD38抗原(表达于骨髓瘤细胞),然后使免疫细胞攻击骨髓瘤细胞。加利福尼亚大学的Thomas Martin博士说,这种抗体绑定细胞表面而且阻碍标志,说“免疫系统,来攻击我”。他展示了试验单克隆抗体SAR650984联合来那度胺和地塞米松治疗复发/难治多发性骨髓瘤的早期数据。这一联合疗法在1b期剂量逐渐增加试验中的总缓解率为58%。Martin博士将其称为“相当激动人心的反应”,鉴于31名患者曾接受过4次之前的疗法。无进展生存期为6.2个月。共15名患者发生无进展生存事件(1名与治疗无关的死亡,14名疾病进展),中位随访6个月。非常明显的是,这种联合疗法治疗复发或最后一次经来那度胺疗法难治的患者总缓解率为62.5%。Martin博士认为抗CD38单克隆抗体是治疗这种癌症很好的添加药物。他说:“我认为CD38药物是一种高效药物。”另外一名临床博士对此并不是太确定。威斯康辛大学的Brad Kahl博士说,现在说它成功还太早。Martin博士说骨髓瘤中仍有未达到的医学需要,他是指这种疗法对复发/难治患者具有显著疗效。据Martin博士报道,这种疗法对免疫介导的炎性疾病(沙利度胺,来那度胺,泊马度胺)和蛋白酶体抑制剂(硼替佐米和卡非佐米)非常有效,可以讲生存期从3年延长至7年甚至10年。但是对于进行过大量前处理的复发/难治患者,平均生存期大约9个月。在这项研究中,复发/难治骨髓瘤患者每两周接受SAR650984的3个剂量水平(3, 5和10mg/kg)中的一个,联合来那度胺和地塞米松。患者第1,15天静脉注射SAR650984,剂量递增,28天为一疗程。第1-21天接受来那度胺25mg,如果基线肌酸酐清除≤60 mL/分,就将剂量调整为10mg,第1,8,15和22天接受地塞米松40mg。18名患者接受最大耐受剂量的SAR650984(10mg/kg)。经Martin博士报道,第一疗程大约三分之一(38%)的患者有输液反应,但是结果只有3%的患者中止治疗。最常见的治疗相关不良反应(任一等级)是疲劳(41.9%),恶心(38.7%),上呼吸道感染(38.7%)和腹泻(35.5%)。
杜鹃 主任医师 上海长征医院 血液病科1411人已读 - “人家都是血小板减少,我血小板增多也不好吗?”——血小板增多的真相
在日常生活中,我们常常听到“血小板减少”可能带来的健康隐患,但当面对“血小板增多”时,有些人可能会感到困惑甚至庆幸,认为血小板增多似乎是件好事。然而,事实并非如此。血小板增多可能是多种疾病的信号,也可能造成多种后果,需要引起重视。今天,我们就来揭开血小板增多的神秘面纱,看看它背后隐藏的健康风险。一、什么是血小板增多?血小板增多是指血液中血小板计数超过正常范围(通常为100-300×10⁹/L)。血小板增多可以分为原发性血小板增多症(EssentialThrombocythemia,ET)和其他原因引起的血小板增多。原发性血小板增多症是一种克隆性骨髓增殖性肿瘤,以血小板过度生成为特征。其他原因引起的血小板增多则多为继发性,可能与多种疾病或状态有关。二、血小板增多的不同原因和临床特点(一)原发性血小板增多症原发性血小板增多症是一种克隆性骨髓增殖性肿瘤,以血小板过度生成为特征。这是一种相对罕见的疾病,年发病率约为1~2.5/10万,发病高峰年龄在50~70岁。患者体内骨髓造血干细胞发生基因突变,导致巨核细胞过度增殖,从而使得血小板计数显著升高。正常情况下,血小板计数在100~300×10⁹/L之间,而原发性血小板增多症患者的血小板计数通常持续≥450×10⁹/L,有些患者甚至达到1000×10⁹/L以上。不同年龄的患者均可能罹患该病,笔者见过几位年龄在20岁以下的年轻人,也见过超过80岁的老人家。理论上讲,这些患者特别是中老年患者血栓形成的风险显著增加,有直接是因为心梗或者脑梗收入医院被发现的,但同时由于假性血管性血友病的风险导致出血的风险也相对增加,所以此前该病还有一个名字,叫出血性血小板增多症。年轻女性不孕不育,有些也与此有关。(二)继发性血小板增多继发性血小板增多是指由其他疾病或状态引起的血小板增多,其实临床上这种患者更多更为多见,常见的原因包括:1.各类炎症性疾病、感染、肿瘤等:如类风湿性关节炎、系统性红斑狼疮等,这些疾病会导致炎症因子释放,刺激骨髓产生更多的血小板;如肺炎、脓毒症等,感染引起的炎症反应会导致血小板增多;这些患者的血小板增多一般都不会特别高,查下炎症指标可能帮助提示诊断,随着原发病的控制一般会得到改善。实体恶性肿瘤如肺癌、胃肠道肿瘤有些可能分泌促血小板生成因子,表现为血小板增多的副肿瘤综合征,或者由于本身合并炎症等多种因素引起血小板增多。。2.缺铁(性贫血):缺铁性贫血的患者也可能出现血小板的增多,特别是由于月经增多或者痔疮等原因导致的缺铁性贫血患者。可能这也是最容易处理的血小板增多了。如果注意到患者有小细胞低色素的贫血,结合患者特征病史等,想到去查一些铁代谢的指标,往往能够很快得到诊断和有效治疗,这类患者的血小板增多一般也都在600×10⁹/L以下。处理起来比较容易,关键是要想到。3.脾切除术后:脾脏是血小板的主要清除器官,脾切除后,血小板的清除减少,导致血小板增多。4.其他血液病、骨髓增殖性疾病:如真性红细胞增多症、原发性骨髓纤维化、慢粒等,这些疾病也会导致血小板增多,甚至巨核系受到影响的急性白血病也都遇到过。 三、如何诊断血小板增多?很明显,首先还是要仔细问病史查体,想一想其他可能导致继发性血小板增多的原因,如感染、炎症性疾病、缺铁性贫血、脾切除术后、实体肿瘤等;必要时开具一些针对性的化验检查,譬如查铁等。但对于不那么明确或者一时难以明确的、或者血小板进行性升高的、特别高的、合并有明显贫血、白细胞变化的患者,必要时还是需要做骨髓穿刺。1.血液检查:检测血小板计数、血常规、血小板功能测试等。2.基因检测:检测JAK2、CALR、MPL等基因突变,必要时NGS也要做的。3.骨髓检查:如果做骨髓穿刺,骨髓活检也一定要做,要考虑到其他血液病的可能,也要考虑到原发性血小板增多症继发骨髓纤维化的可能,这本来就属于评估的一部分内容。4.影像学检查:如超声检查脾脏大小等,如果考虑血液系统的问题,这是必须要做的。四、血小板增多的治疗当然要看血小板增多引起的原因,不同的原因处理方法肯定不同,譬如对于前面说的缺铁导致的血小板增多,补铁就够了;对于本身就是血液系统恶性肿瘤的患者,还要要针对性的化疗或者靶向治疗等。对于原发性的血小板增多症患者,则要综合评估患者年龄、血压血糖血脂吸烟、心脑血管靶器官损害等多个因素,还要结合基因检测的情况,决定下一步治疗了。治疗内容主要是要考虑是否需要抗血栓、抗凝、降细胞处理。提醒一下,不是所有人都需要接受上述治疗(抗血栓、抗凝、降细胞)的,对于血小板>1000×10⁹/L的患者,也先别急着抗血栓抗凝,警惕出血风险。 五、预后如何?原发性血小板增多症患者的预后因个体差异而异。大多数患者的中位生存期可达20年左右,甚至更长。然而,部分患者可能会进展为骨髓纤维化或急性髓系白血病,导致预后不良。通过合理的治疗和管理,许多患者可以有效控制病情,维持较好的生活质量。继发性血小板增多的预后取决于原发病的治疗效果。如果原发病得到有效控制,血小板计数通常会恢复正常。总之,血小板增多虽然可能是一种疾病的信号,但通过科学的诊断和治疗,患者可以有效管理病情,降低风险,提高生活质量。如果你或你的家人被诊断为血小板增多,不要过于担心,积极配合医生的治疗,保持乐观的心态,相信未来会越来越好。
范晓强 副主任医师 上海长征医院 血液病科21人已读 - 骨髓瘤患者的肾功能损害可能恢复吗?
多发性骨髓瘤(MultipleMyeloma,MM)是一种起源于骨髓中浆细胞的恶性肿瘤,常伴随多种并发症,其中肾脏功能不全尤为常见。约20%-50%的患者在确诊时即存在一定程度的肾损伤。这种肾损伤不仅影响患者的生活质量,还可能显著缩短其生存期。那么,经过治疗后,多发性骨髓瘤患者的肾功能是否能够恢复呢?一、肾损伤的原因和机制(一)单克隆游离轻链(FLCs)的毒性作用多发性骨髓瘤引起的肾脏损伤主要归因于单克隆游离轻链(FreeLightChains,FLCs)对肾小管的毒性作用。这些轻链在肾小管中积累,形成管型,阻塞肾小管,导致急性肾损伤。(二)淀粉样变性淀粉样变性是多发性骨髓瘤相关肾损伤的另一种重要病理类型。淀粉样变性是由单克隆轻链错误折叠形成的淀粉样纤维沉积在肾脏组织中,导致肾小球和肾小管间质的损伤。这种沉积物可以引起肾小球硬化、肾小管萎缩和间质纤维化,最终导致肾功能不全。淀粉样变性通常表现为大量蛋白尿,甚至肾病综合征,严重时可进展为终末期肾病。(三)其他多发性骨髓瘤还通过其他机制导致肾脏功能损害;此外,高钙血症、脱水、感染和某些药物的肾毒性也可能导致或加剧肾损伤。二、肾功能恢复的可能性(一)新诊断患者的肾功能恢复对于新诊断的多发性骨髓瘤患者,肾功能恢复的几率较高。根据《LancetOncology》上发表的国际骨髓瘤工作组(IMWG)的指南,新诊断的多发性骨髓瘤患者中,约40%-60%的患者在治疗后肾功能有显著改善。例如,在一些研究中,使用硼替佐米为基础的治疗方案后,患者的肾功能得到了显著改善。硼替佐米是一种蛋白酶体抑制剂,能够快速降低血清轻链水平,从而减轻对肾脏的毒性作用。(二)复发或难治性患者的肾功能恢复复发或难治性多发性骨髓瘤患者的肾功能恢复更具挑战性。然而,新的治疗方法,如蛋白酶体抑制剂、免疫调节剂和单克隆抗体,已被证明可以改善患者的总生存期和肾功能。例如,达雷妥尤单抗(Dara)是一种抗CD38单克隆抗体,联合其他药物(如硼替佐米、地塞米松)在复发或难治性患者中显示出良好的疗效。在一些研究中,使用达雷妥尤单抗联合方案后,患者的肾功能得到了显著改善,部分患者甚至摆脱了透析。(三)自体造血干细胞移植(ASCT)的作用自体造血干细胞移植(ASCT)是适合移植的多发性骨髓瘤患者的一线治疗选择。研究表明,ASCT可以显著改善患者的肾功能,部分患者在移植后能够完全恢复肾功能或显著改善肾功能。即使在肾功能严重受损或透析依赖的患者中,ASCT后也有部分患者成功摆脱透析。例如,一项研究显示,接受ASCT的患者中,约1/3的患者肾功能完全恢复,超过1/4的患者摆脱透析。(四)支持性治疗的重要性除了针对多发性骨髓瘤的治疗外,支持性治疗也是肾功能恢复的重要组成部分。支持性治疗包括高液体输注(每天至少3L或2L/m²),以促进游离轻链的排泄,防止肾小管堵塞;避免使用肾毒性药物,如非甾体抗炎药、氨基糖苷类抗生素等;控制高钙血症,可使用地舒单抗等药物。这些措施有助于减轻肾脏的负担,促进肾功能的恢复。(五)透析和血液净化治疗对于肾功能严重受损的患者,透析和血液净化治疗是重要的支持手段。透析可以帮助清除体内的毒素和多余的液体,维持电解质平衡。高截留量透析(HCO-HD)和高通量透析(HFHD)等先进的透析技术可以更有效地清除血清游离轻链,从而减轻对肾脏的毒性作用。一些研究显示,这些技术可以提高患者的肾功能恢复率,减少透析依赖。 三、影响肾功能恢复的因素(一)治疗前eGFR水平治疗前的肾小球滤过率(eGFR)水平是影响肾功能恢复的重要因素。研究表明,治疗前eGFR较高的患者,肾功能恢复的可能性更大。例如,在一些研究中,治疗前eGFR≥30ml/min的患者,肾功能恢复的几率显著高于eGFR<30ml/min的患者。(二)血液学反应的深度治疗中血液学反应的深度也是影响肾功能恢复的重要因素。研究表明,达到完全缓解(CR)或部分缓解(PR)的患者,肾功能改善的可能性更大。例如,在一些研究中,使用硼替佐米联合方案后,达到完全缓解的患者中,约70%的患者肾功能得到显著改善,而仅达到部分缓解的患者中,约40%的患者肾功能得到改善。(三)高钙血症高钙血症是多发性骨髓瘤的常见并发症,可进一步加重肾损伤。研究表明,高钙血症的存在是肾功能改善的独立预后因素。控制高钙血症,使用地舒单抗等药物,可以显著减轻肾损伤,提高肾功能恢复的可能性。(四)其他因素还有一些患者本身合并高血压、糖尿病、多发肾脏囊肿等疾病,其中有些患者即使骨髓瘤得到很好的控制,由于其他原因所引起的肾脏功能损害难以短时间内完全恢复。四、未来展望随着治疗方法的不断进步,特别是新药的应用,多发性骨髓瘤患者的预后正在逐步改善。未来的研究将进一步探索如何优化治疗方案,以最大化地恢复患者的肾功能,并提高其生活质量。例如,CAR-T细胞疗法和双特异性T细胞衔接抗体等新兴疗法在复发或难治性患者中显示出良好的疗效,有望为肾功能恢复带来新的希望。总之,多发性骨髓瘤患者的肾功能不全在经过有效治疗后有可能恢复。然而,这种恢复需要综合考虑多种因素,包括及时的诊断、恰当的治疗选择以及患者的个体差异。通过积极的治疗和细致的管理,许多患者的肾功能可以得到显著改善,甚至完全恢复。
范晓强 副主任医师 上海长征医院 血液病科8人已读



