上海新华医院肾脏内科科普号
- 引用 狼疮性肾炎的治疗进入新时代
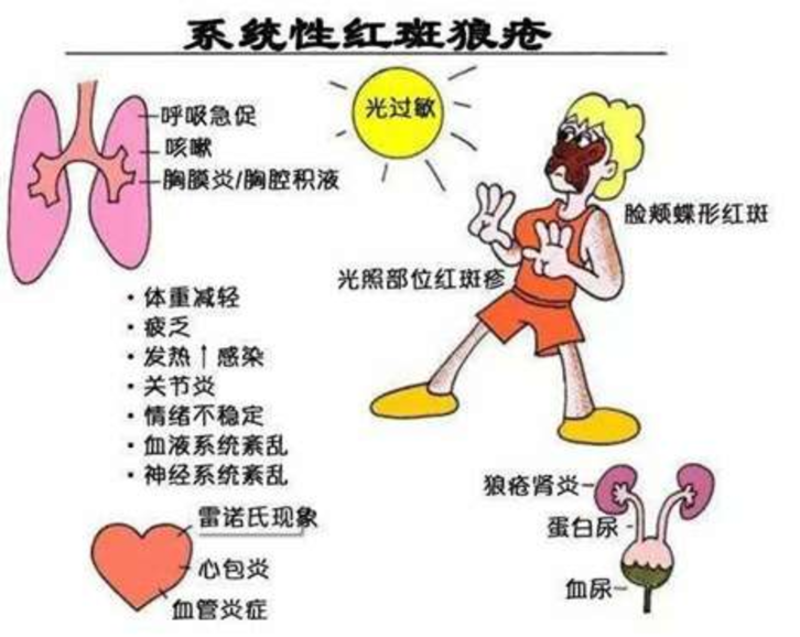
众所周知,系统性红斑狼疮(systemiclupuserythe-matosus,SLE)是一种常见自身免疫性疾病,其发生率在我国约为万分之7,多发于生育年龄妇女。SLE常累及多系统、多脏器,包括皮肤、黏膜、关节、肾脏、血液、神经系统等,具有抗核抗体、双链DNA抗体等多种自身抗体。尽管超过90%的患者为女性,尤其是13~40岁的青年女性,老年、儿童及男性狼疮也并不罕见。SLE的发病机制尚未完全阐明,目前认为在遗传、环境、激素等诸多因素作用的背景下,由于细胞凋亡清除障碍,自身抗原外露,激活免疫系统,继之T、B淋巴细胞相互作用并增殖,浆细胞分泌自身抗体而致病。SLE一旦累及肾脏,即表现为狼疮性肾炎(lupusnephritis,LN),患者的治疗难度明显增加,缓解率降低,临床结局更差,甚至发展为终末期肾脏病,即尿毒症。图1SLE是一种多系统受累的自身免疫病SLE是一种自身免疫疾病,其主要治疗为免疫抑制治疗。对于重症增生性狼疮性肾炎,即肾脏病理呈III或IV型±V型的患者,传统的免疫治疗采用激素联合免疫抑制剂,常用的包括 环磷酰胺(CTX)、吗替麦考酚酯(MMF)、 他克莫司等,改善了LN患者的临床预后,但也存在缓解率低,药物相关并发症等问题。临床研究发现,目前激素+传统免疫抑制剂的1年完全缓解率仅在30%左右。另一方面,激素和传统免疫抑制剂往往存在明显的“靶外”副作用,如糖皮质激素常出现向心性肥胖、股骨头坏死,远期的心血管副作用等;CTX等烷化剂存在骨髓抑制、不孕不育、肿瘤等副作用;他克莫司等钙调磷酸酶抑制剂(CNI)存在复发率高、长期治疗的肾脏毒性等等。临床实践也发现,这些药物的使用会明显增加感染,包括致命性感染的风险。所以,LN的传统免疫抑制治疗像一把“双刃剑”,有利有弊,利在促进疾病的缓解,弊在药物相关的感染与器官损伤。那么,有没有更好的选择呢?有没有更少副作用、更高缓解率的药物呢?多达数十种新型药物,其中主要是生物制剂用于SLE和LN的临床研究,这些临床研究有的已经结束,有的还在进行中。主要包括针对干扰素受体、白介素、B细胞、浆细胞、补体、B淋巴细胞刺激因子(BAFF)等的单抗,还有新型钙调磷酸酶抑制剂等。图2免疫反应过程示意图及免疫抑制剂和生物制剂的靶点阿尼鲁单抗(Anifrolumab)可拮抗所有1型干扰素的相关活性,在3期临床研究中发现,阿尼鲁单抗能改善SLE患者的临床症状,因此2021年美国药品和食品管理局(FDA)批准了阿尼鲁单抗用于治疗中度至重度SLE患者,尤其适用于狼疮性皮损患者。然而Anifrolumab治疗LN的II期临床未达主要终点,III期临床正在进行中。贝利尤单抗是B淋巴细胞刺激因子的单克隆抗体,BLISS-52和BLISS-76研究已经证实了贝利尤单抗在SLE患者中的疗效,使贝利尤单抗于2011年获得FDA批准用于SLE的治疗。2020年公布的BLISS-LN研究评估了贝利尤单抗合并常规治疗在活动性狼疮肾炎(III或IV±V型)成年患者中的疗效和安全性。结果显示,贝利尤单抗联合常规治疗可显著提高LN的缓解率,降低肾脏相关事件或死亡的风险。所以,贝利尤单抗也获得了FDA的批准用于LN的治疗,并进入KDIGO指南LN的一线治疗。目前,贝利尤单抗已经进入我国医保,上海新华医院肾脏内科使用贝利尤单抗有接近三年的丰富经验,贝利尤单抗在明显提升疗效的同时,还能大大减少激素和免疫抑制剂的剂量,减少副作用,对LN治疗半年以上的缓解率高达75%,且没有一例发生重症感染。泰它西普是一种TACI-Fc融合蛋白,它靶向两类对B淋巴细胞发育至关重要的细胞信号分子:BAFF和增殖诱导配体,从而降低B细胞介导的免疫反应,起到治疗SLE的目的。在中国进行的IIb期临床试验提示,对中度至重度的SLE患者,泰它西普在第48周达到SLE应答指数4(SRI-4)响应的患者比例显著高于安慰剂组,并且三个剂量组的泰它西普的严重不良事件和反应的比例都和安慰剂相近,表明泰它西普具有良好的耐受性。由此泰它西普获得中国国家药监局(NMPA)批准在中国的有条件上市,用于治疗系统性红斑狼疮(SLE)。目前治疗LN的III期临床已开始。尽管靶向清除B细胞的利妥昔单抗治疗LN的LUNAR研究未证实疗效,2代的CD20单抗奥妥珠单抗(Obinutuzumab)能更大程度地清除B细胞,已进行的II期临床研究证实,对于狼疮性肾炎III/IV±V型患者,奥妥珠单抗联合MMF+激素治疗的“标准治疗”,76周、104周完全肾脏缓解率优于安慰剂+标准治疗,血清学指标,包括dsDNA滴度、补体水平均较安慰剂组显著改善,安全性方面与安慰剂组基本相似。全球III期的REGENCY研究已启动,让我们拭目以待。伏环孢素(Voclosporin)是一种新型、潜在同类最佳(best-in-class)的CNI。与传统的CNI相比,伏环孢素可能不需要治疗药物监测、效力进一步增加和代谢谱改善。II期临床研究证实,对增生性LN使用剂量为23.7毫克的Voclosporin,24周完全缓解率为32.6%,48周完全缓解率上升至49.4%。该数据几乎是对照组中仅服用MMF+激素患者完全缓解率的两倍。仅服用MMF的患者24周和48周治疗期后完全缓解率分别仅为19.3%和23.9%。进一步III期临床研究也证实,伏环孢素比安慰剂组的蛋白尿缓解率更高,然而伏环孢素组的血清学指标与安慰剂相比无明显差异,这也再次引起了伏环孢素对LN的疗效,至少在部分上,源自于其非免疫抑制作用的争论。2021年1月,VCS成为获FDA批准的第一个治疗LN的口服药。综上所述,SLE和LN应根据患者受累部位及严重程度确定免疫抑制治疗方案,选择能控制病情的最小剂量的免疫抑制药物,使患者缓解并维持长期稳定。随着生物制剂为主的新药在临床研究中取得了良好疗效,贝利尤单抗、伏环孢素已经进入指南推荐的LN一线治疗推荐,利妥昔单抗、奥妥珠单抗乃至阿尼鲁单抗也是非常有希望的治疗药物,对于难治性狼疮性肾炎患者,我中心有过很多成功的案例。SLE和LN患者不再只能用激素和传统免疫抑制剂治疗,新型生物制剂药物使SLE和LN的治疗进入了新纪元!
 张翀 主任医师 上海新华医院 肾脏风湿免疫科315人已读
张翀 主任医师 上海新华医院 肾脏风湿免疫科315人已读 - 引用 肾病综合征老是复发怎么办?
肾病综合征是常见病,可发生于各年龄段,常表现为大量蛋白尿、中重度浮肿。其中部分患者,特别是微小病变型肾病的患者,尽管激素治疗有效,但容易在激素减量过程中、或激素减量以后复发,笔者甚至见过复发十余次的患者。长期的激素使用以及反复复发造成的肥胖、骨质疏松乃至股骨头坏死、糖尿病、感染等问题,困扰着广大患者。对此,医生常常加用CNI类药物(如环孢素或他克莫司)或环磷酰胺治疗。然而,前者也伴随很高复发率,常常是虽然激素顺利减完,但CNI一撤掉就很快复发;后者有性腺抑制、易感染的副作用,而且,累计剂量不能超过12克,否则易患泌尿系统肿瘤。上海交通大学医学院附属新华医院肾脏内科在生物制剂治疗激素依赖或反复复发的肾病综合征方面积累的丰富经验,成功治疗了很多辗转全国、多年不缓解的患者,走在全国乃至全世界领先地位。RTX治疗缓解快,复发率显著降低,是这部分患者治疗的很好选择。对于希望避免大剂量激素暴露或有激素使用禁忌的患者,RTX联合低剂量激素或RTX单用同样可以取得很好疗效,复发率明显低于CNI,严重副作用和远期副作用低于CTX,应作为首选。RTX治疗后复发患者,重新使用RTX治疗仍有较好疗效,且目前为止未发现RTX剂量累积可能导致的不良后果,进一步支持其长期使用。张翀教授还发现,使用利妥昔单抗治疗肾病综合征,采取综合措施预防感染等并发症后,其感染等并发症发生率极低,非常安全。部分患者还需要定期追加使用,何时需要追加,何时提示复发风险增加,要根据临床复发的规律,而不是很多医生认为的单纯按照CD19/20计数结果判断。
张翀 主任医师 上海新华医院 肾脏风湿免疫科128人已读 - 引用 肾穿刺活检术(转自百度百科)
⑴明确诊断:通过肾穿刺活检术可以使超过三分之一患者的临床诊断得到修正。⑵指导治疗:通过肾穿刺活检术可以使将近三分之一患者的临床治疗方案得到修改。⑶估计预后:通过肾穿刺活检术可以更为准确的评价肾脏病患者的预后。另外,有时为了了解治疗的效果或了解病理进展情况(如新月体肾炎、狼疮性肾炎及IgA肾病等)还需要进行重复肾脏病理检查。为明确诊断,指导治疗或判断预后,而又无穿刺禁忌证时,内科各种原发、继发及遗传性肾实质疾病(尤其是弥漫性病变)皆可肾穿刺。⑴原发性肾脏疾病:①急性肾炎综合征,肾功能急剧坏转、疑急进性肾炎时,应尽早穿刺;按急性肾炎治疗2~3月病情无好转应做肾穿。②原发性肾病综合征,先治疗,激素规则治疗8周无效时肾穿刺;或先穿刺,根据病理类型有区别的治疗。③无症状性血尿,变形红细胞血尿临床诊断不清时,无症状性蛋白尿,蛋白尿持续>1g/d诊断不清时应做肾穿刺检查。⑵继发性或遗传性肾脏病:临床怀疑无法确诊时,临床已确诊,但肾脏病理资料对指导治疗或判断预后有重要意义时应做肾穿刺。⑶急性肾功能衰竭:临床及实验室检查无法确定其病因时应及时穿刺(包括慢性肾脏病人肾功能急剧坏转)。⑷移植肾:①肾功能明显减退原因不清时,②严重排异反应决定是否切除移植肾;③怀疑原有肾脏病在移植肾中复发。禁忌症肾穿刺是一种创伤性检查,选择穿刺病例时不但需掌握好适应征,还要认真排除禁忌征。⑴绝对禁忌证:①明显出血倾向,②重度高血压,③精神病或不配合操作者,④孤立肾,⑤小肾。⑵相对禁忌证:①活动性肾盂肾炎、肾结核、肾盂积水或积脓,肾脓肿或肾周围脓肿。②肾肿瘤或肾动脉瘤。③多囊肾或肾脏大囊肿。④肾脏位置过高(深吸气肾下极也不达十二肋下)或游走肾。⑤慢性肾功能衰竭。⑥过度肥胖。⑦重度腹水。⑧心功能衰竭、严重贫血、低血容量、妊娠或年迈者。适应症⑴各种类型的肾小球肾炎,肾小球肾病,肾病综合征,全身疾病引起的肾脏病如系统性红斑狼疮、淀粉样变性、糖尿病、过敏性紫癜、尿酸性肾病、结节性动脉周围炎等。⑵原因不明的持续性无症状蛋白尿和血尿,以及病因不明的高血压。⑶急性肾小管及间质性病变。不典型的慢性肾盂肾炎,特别是与慢性肾炎鉴别有困难时,需要做肾活检,以明确诊断。⑷原因不明的急性肾功能衰竭,在诊断和治疗上有困难时,或慢性肾脏病的原因不明,病情突然加重者,做肾活检可从帮助明确诊断和指导治疗。⑸肾脏移植后,肾活检可帮助诊断排斥反应或者药物如环孢素A毒性反应,指导调整治疗。⑹连续穿刺可以帮助了解肾脏疾病的发展过程,观察药物治疗的反应和估计病人的预后。肾穿刺活检有利于明确诊断、指导治疗、判断预后,探讨临床分型与病理分型的关系,也是提高肾脏病临床与科研水平的重要手段之一。术前准备作好肾穿刺术前准备是减少并发症的一个重要环节。术前应作好如下工作:⑴向病人及家属说明肾活检的必要性和安全性及可能出现的并发症,并征得患者本人及家属同意。向患者解释肾穿刺操作,解除病人的恐惧心理,以取得病人的配合。让其练习憋气(肾穿刺时需短暂憋气)及卧床排尿(肾穿后需卧床24小时),以便密切配合。⑵化验出、凝血时间,血小板计数及凝血酶原时间,以了解有无出血倾向。⑶查肌酐清除率、血肌酐及尿素氮了解肾功能,查同位素肾图了解分肾功能,并作出B超了解肾脏大小、位置及活动度。⑷查血型、备血,术前常规清洁肾区皮肤。⑸术前2~3日口服或肌注维生素K。⑹急性肾衰病人肾穿刺前除化验凝血酶原时间外,还应测定白陶土部分凝血活酶时间,除查血小板数量外,不定期应查血小板功能(聚集、粘附及释放功能),若发现异常,均应在术前矫正。血小板数量及功能异常可于穿刺当日术前输注新鲜血小板。出血时间延长可输注富凝血因子的冷沉淀物矫正。严重肾衰病人最好在肾穿刺前作血液透析数次,在肾穿刺前24小时停止透析,透析结束时应给鱼精蛋白中和肝素,并在肾穿刺前复查试管法凝血时间,以证实肝素作用消失。⑺术前排空膀胱。肾活检通常分三类:⑴经皮肤穿刺肾活检术,是目前临床上被广泛认可和应用的肾活检方法;⑵外科手术直视开放肾活检;⑶经肾静脉穿刺肾活检术。穿刺点定位:多选择左肾下级的外侧缘。定位的方法有:⑴体表解剖定位;⑵X线定位;⑶同位素肾扫描定位;⑷B超定位,是目前最常采用和比较安全的方法。目前我科采用的是B超引导下肾穿刺活检术,操作安全,穿刺成功率高。操作步骤具体操作步骤:患者排尿后俯卧位于检查台上,腹部垫一直径10-15cm,长50-6-cm的枕头,将肾推向背侧固定,双臂前伸,头偏向一侧。一般选左肾下级为穿刺点,以穿刺点为中心,消毒背部皮肤,铺无菌巾。无菌B超穿刺探头成像,用1-2%利多卡因局部麻醉。将穿刺针垂直刺入达肾囊,观察肾脏上下级随呼吸移动情况,当肾脏下极移到穿刺最佳的位置时,令患者摒气,立即快速将穿刺针刺入肾脏内1-2cm,拔出穿刺针,嘱患者正常呼吸。检查是否取到肾组织,并测量其长度,在解剖镜下观察有5个以上肾小球后,送光镜、电镜、免疫荧光。如无肾组织可重复以上步骤。一般2-3次为宜。术后:嘱患者平卧24小时,多饮水,密切观察血压、脉搏及尿色变化情况。有肉眼血尿者应延长卧床时间。并发症⑴血尿镜下血尿发生率几乎为100%,常于术后1-5天消失,无需处理。当肾穿刺针穿入肾盏或肾盂后,可以出现肉眼血尿,大多于1-3天消失。出现肉眼血尿伴血块时,一般在静滴VitK1或垂体后叶素后可以得到缓解,注意此时不要使用止血药,以免出现尿路梗阻造成严重后果。鼓励患者多饮水,保证尿路通畅,对肾功能不全的患者应避免过度饮水造成心衰,同时注意排尿情况。极个别患者出血严重时,应输血或输液,监测血压和血红蛋白。若经过抢救仍不能维持血压者,应考虑行选择性肾动脉造影,以明确出血部位,并决定用动脉栓塞治疗,或采取外科手术。⑵肾周血肿肾周血肿的发生率约60-90%,一般较小,无临床症状,多在1-2周内吸收。较大血肿少见,多因肾撕裂或穿至大中血管尤其是动脉造成,多在穿刺当天发生,表现为腹痛、腰痛、穿刺部位压痛或较对侧稍膨隆,穿刺侧腹部压痛、反跳痛,严重时血压下降、红细胞压积下降,行B超或X线检查可进一步证实,一般采取保守治疗,若出血不止,可手术治疗。⑶腰痛发生率约17-60%,多于一周内消失。⑷动静脉瘘发生率15-19%,多数患者没有症状。典型表现为严重血尿和/或肾周血肿,顽固性高血压、进行性心衰及腰腹部血管杂音。确诊需肾血管造影,大多数在3-30个月自行愈合,严重者及时手术。⑸损伤其他脏器多因穿刺点不当或进针过深损伤脏器,严重者需要手术治疗。⑹感染感染发生率低,多因无菌措施不严,肾周已存在感染或伴有肾盂肾炎所致,如出现发热、剧烈腰痛、白细胞增高需用抗生素治疗。⑺死亡发生率为0-0.1%,因严重大出血、感染、脏器损害或出现其他系统并发症死亡。刺术后护理⑴一般护理①病人肾活检后,局部伤口按压数分钟后,平车推入病房。②每半小时测血压、脉搏一次,4小时后血压平稳可停止测量。若病人血压波动大或偏低应测至平稳,并给予对症处理。③术后嘱病人多饮水,以尽快排出少量凝血块。同时留取尿标本3次常规送检。④卧床期间,嘱病人安静休息,减少躯体的移动,避免引起伤口出血,同时应仔细观察病人伤口有无渗血并加强生活护理。⑤应密切观察病人生命体征的变化,询问有无不适主诉,发现异常及时处理。⑵并发症的护理①血尿:约有60~80%的病人出现不同程度的镜下血尿,部分患者可出现肉眼血尿,为了使少量出血尽快从肾脏排出,除绝对卧床外,应嘱病人大量饮水,应观察每次尿颜色的变化以判断血尿是逐渐加重还是减轻。血尿明显者,应延长卧床时间,并及时静脉输入止血药,必要时输血。②肾周围血肿:肾活检后24小时内应绝对卧床,若病人不能耐受,应及时向病人讲解清楚绝对卧床的重要性及剧烈活动可能出现的并发症。以求得病人的配合。在无肉眼血尿且卧床24小时后,开始逐渐活动,切不可突然增加活动量,以避免没有完全愈合的伤口再出血。此时应限制病人的活动,生活上给予适当的照顾。术后B超检查发现肾周围血肿的病人应延长卧床时间。③腰痛及腰部不适:多数病人有轻微的同侧腰痛或腰部不适,一般持续1周左右。多数病人服用一般止痛药可减轻疼痛,但合并有肾周围血肿的病人腰痛剧烈,可给予麻醉性止痛药止痛。④腹痛、腹胀:个别病人肾活检后出现腹痛,持续1~7日,少数病人可有压痛及反跳痛。由于生活习惯的改变加之腹带的压迫,使病人大量饮水或可出现腹胀,一般无需特殊处理,对腹胀、腹痛明显者可给予乳酶生及解痉药等以缓解症状。⑤发热:伴有肾周围血肿的病人,由于血肿的吸收,可有中等度发热,应按发热病人护理,并给予适当的药物处理。
栗明 主治医师 上海新华医院 肾脏风湿免疫科6205人已读 - 引用 IgA肾病
IgA肾病(IgA nephropathy,IgAN)又称 Berger病,是指肾小球系膜区以 IgA或 IgA沉积为主,伴或不伴有其他免疫球蛋白在肾小球系膜区沉积的原发性肾小球病。其临床表现为:反复发作性肉眼血尿或镜下血尿。疾病分类 1.原发性IgA肾病:由肾脏本身疾病引起,多见。 2.继发性IgA肾病:由肾脏以外的疾病引起,如:紫癜性肾炎,HIV感染,血清阴性脊柱关节炎,肿瘤,麻风病,肝脏疾病,家族性IgA肾病等。发病原因 IgA肾病的确切发病机理尚未完全清楚,多种因素和发病有关。目前比较一致的看法是IgAN属免疫复合物引起的肾小球疾病。 1.与免疫系统的关系:IgA肾病主要是以多聚体 IgA(PIgA)在肾小球沉积,表明了IgA 免疫系统导致了 PIgA 分子的在循环系统中出现和肾小球系膜区的沉积。 2.与骨髓的关系:肾小球系膜区沉积的 IgA1 ,且存在于血液中 IgA1相似的铰链区糖基化异常 ,提示 IgA 肾病患者沉积在肾小球系膜区的 IgA为骨髓源性 IgA。 3.与细胞因子的关系:IgA 肾病患者系膜区沉积的 IgA1 引起系膜细胞分泌炎症因子。[2-3]临床表现 1.反复发作的肉眼血尿(30-40%) 1)发生在上呼吸道感染(胃肠道或泌尿系感染)后数小时到1-2天; 2)多无伴随症状,少数有排尿不适,而被诊为急性膀胱炎; 3)肉眼血尿儿童和青少年(80-90%)较成人(30-40%)多见; 4)与疾病严重程度无关; 5)肾脏病理一般为Lee氏分级Ⅱ~Ⅲ级。 2.隐匿性肾炎型(20-30%) 1)镜下血尿,25%伴有间断发作的肉眼血尿; 2)伴或不伴蛋白尿(+); 3)少数有高血压; 4)肾脏病理一般为Lee氏分级Ⅱ~Ⅲ级。 3.慢性肾炎型 1)镜下血尿,伴或不伴蛋白尿(+-++); 2)常有高血压; 3)肾功能可能有下降; 4)肾脏病理一般为Lee氏分级Ⅱ~Ⅳ级。 4.大量蛋白尿或肾病综合征型 1)肾病综合征,伴有或不伴有镜下血尿; 2)多有高血压; 3)部分患者表现为肾病综合征,肾脏光镜可以为:微小病变和轻度弥漫增殖性肾小球肾炎; 4)肾脏病理一般为Lee氏分级Ⅰ~Ⅳ级。 5.恶性高血压型 1)恶性高血压; 2)蛋白尿(+-++),伴有或不伴有镜下血尿; 3) 常合并肾功能不全; 4)肾脏病理一般为Lee氏分级Ⅲ~Ⅳ级。 6.急进性肾炎综合征型 1)肾功能进行性恶化,有进行性少尿; 2)蛋白尿(+-++), 伴或不伴肉眼血尿; 3) 多有高血压,贫血; 4)肾脏病理一般为新月体肾炎,Lee氏分级 IV~V级辅助检查 1.免疫学检查:50%的病人血清IgA水平升高。37~75%病人测到含有IgA的特异性循环免疫复合物。 2.蛋白尿:蛋白尿定量和分型对IgA肾病病情判断、估计预后很重要。蛋白尿<1g/24 h者常为轻微及病灶性系膜增生为主。中~重度蛋白尿多为弥漫性系膜增生,常伴新月体及肾小球硬化。 3.肾功能:血肌酐上升到1.5mg/dl(132.6umol/L)多为病情进展。GFR<20ml/min时,病理改变属Ⅲ级以上。 4.血尿:尿RBC形态呈多形性,提示血尿来源是肾小球源性。疾病诊断 IgA肾病的诊断必须要有肾活检病理,必须要有免疫荧光或免疫组化的结果支持。其诊断特点是:光镜下常见弥漫性系膜增生或局灶节段增生性肾小球肾炎;免疫荧光可见系膜区IgA或以IgA为主的免疫复合物沉积,这是IgA肾病的诊断标志。鉴别诊断 本病应与以下疾病鉴别: 1.急性链球菌感染后肾小球肾炎:发病前1~3周,有链球菌感染的前驱病史,以血尿、浮肿及高血压为三大主要症状。持续肉眼血尿时间较长,可从数天到数周,这点和IgA肾病发作性血尿不同。实验室检查有补体C3下降,ASO、血沉升高。 2.良性家族性血尿:本病多有家族史,临床90%表现为持续性镜下血尿,仅少数伴间歇性发作性血尿。一般无症状,多在体检或尿常规检查中发现。电镜证实其中一部分为薄基底膜底(基底膜厚度约为正常人数的1/3~2/3)。预后良好。 3.家族性遗传性肾炎:多为持续性镜下血尿,男重于女,呈进行性肾功能减退,50%伴有神经性高频区耳聋,15%有眼部异常,男性死亡率高。 4.左肾静脉压近综合征:属非肾性血尿,无肾小球肾炎的临床表现。 5.特发性高钙尿症:表现为持续性镜下血尿,或伴有发作性肉眼血尿,为非肾小球性血尿,尿Ca> 0.1mmol/kg (4mg/kg/d),尿Uca/Ucr的比值若>0.21可初步诊断本病. 6. 紫癜性肾炎:常表现为镜下血尿。但患者有皮肤出血点,出现在四肢远端、 臀部及下腹部, 多对称性分布, 稍高于皮肤表面, 可有痒感, 1~2 周后逐渐消退, 常可分批出现。
栗明 主治医师 上海新华医院 肾脏风湿免疫科7421人已读



