宁夏医科大学总医院神经中心外科科普号
- 精选 垂体泌乳素腺瘤溴隐亭治疗,可以安全停药吗?
垂体泌乳素瘤是由垂体前叶细胞瘤分泌过量泌乳素(PRL)引起的下丘脑-垂体病中常见的一类肿瘤。其典型临床表现有闭经、溢乳、不孕(育)、高泌素血症,及垂体占位性病变引起症状。具体情况,来看看神外专家怎么说。 女性发病率高于男性。女性催乳素瘤多见于20-30岁,常为微腺瘤。典型临床表现为闭经-乳溢-不育三联征。 男性泌乳素瘤较大,多向鞍上发展,主要表现为完全性或部分性性功能减退,临床上属于“高危垂体瘤”。泌乳素瘤可因瘤体巨大向鞍上扩展,常见的局部压迫症状是头痛、视觉异常。 头痛的原因为大腺瘤引起的颅内压增高,伴恶心、呕吐。更有甚者会发生急性垂体卒中,表现为突发剧烈头痛、恶心、呕吐及视力下降等颅神经压迫症状,甚至昏迷。 泌乳素瘤的治疗手段可分为药物治疗,手术治疗以及放射治疗,其中药物治疗为首选。 多巴胺受体激动剂作为催乳素腺瘤的一线治疗药物,可以有效降低PRL水平,缩小肿瘤体积,从而改善占位引起的神经功能障碍,以及恢复性腺功能。 当前,多巴胺受体激动剂主要包括卡麦角林、溴隐亭、喹高利特、双氢麦角碱、麦角乙脲和甲麦角林,其中卡麦角林和溴隐亭最为常用。 溴隐亭有一个相对较短的消除半衰期,因此,每天服用2次或3次,每次剂量从2.5~15mg不等,且有18%~25%患者表现为溴隐亭耐药。 相比其他多巴胺受体激动剂,卡麦角林疗效更好,且副作用更小。 由于卡麦角林的血浆半衰期约65h,所以每周只要服用两次,这使得患者的依从性大幅度提高。 然而,在我们的外科学教科书上,卡麦角林和溴隐亭是需要终生服药的,那真的不能安全撤药/停药吗? 如果可以,又该如何合理的减药乃至停药呢? 2005年“Pituitary Society”对催乳素瘤诊断和治疗指南中指出,最佳的撤药时机是:PRL恢复正常水平及肿瘤体积显著减少的患者且药物治疗应该持续一年以上。 2011年由国际内分泌学会推出最新指南的停药标准为:多巴胺受体激动剂治疗至少2年,血清PRL水平正常,并在MRI上未见肿瘤残留。 另外,指南还建议使用卡麦角林优先于其他多巴胺受体激动剂,因为卡麦角林能更有效地使PRL水平正常,以及更有效的缩小肿瘤体积。 最近,上海交通大学医学院附属瑞金医院神经外科吴哲褒教授,在泌乳素腺瘤药物治疗撤药策略方面取得重要成果。 相关研究结果以“Optimal timing of dopamine agonist withdrawal in patients with hyperprolactinemia:a systematic review and meta-analysis”为题,于2017年10月17日在线发表Endocrine上论文发表引来国际同行的密切关注。 该杂志同期还发表约翰霍普金斯医学院内分泌和垂体中心主任Roberto Salvatori教授的特约评论,题为“Dopamine agonist withdrawal in hyperprolactinemia:when and how(DOI 10.1007/s12020-017-1469-0)”,对我们的文章进行正面评价,特地指出,今后泌乳素腺瘤撤药需要符合吴哲褒教授文章中提出的几条标准才可以停药。 那么,是哪些停药或者撤药的标准呢?大家切记如下四条停药标准: ① 卡麦角林或溴隐亭至少使用2年; ② 卡麦角林或溴隐亭停药前达到最低维持剂量; ③ 血清PRL水平正常; ④ MRI显示肿瘤明显缩小(50%以上)或者未见肿瘤残留。同时建议患者,卡麦角林或者溴隐亭低剂量维持治疗和肿瘤大小的显著缩小,两者是影响药物撤除成功的两个独立因素。 上述几条撤药标准,为临床实践中高泌乳素血症患者撤药决策提供有用的线索。这一结果也有望改写以往教材书中“泌乳素腺瘤需要终身服药”这一结论。 当然,在临床实践中,仍需临床医生根据每个案例制定个体化停药方案,患者切不可盲目停药,否则易导致高PRL血症的反弹和肿瘤再生。 卡麦角林和溴隐亭如何合理减药乃至停药,4条停药标准相信大家已经熟知了,如果您还有其它关于泌乳素的问题欢迎留言。
2641人已读 - 精选 垂体瘤患者术后要注意哪些问题?
很多患者在就诊的时候都会询问手术风险,效果等问题。事实上,随着近年来显微神经外科技术和神经内镜技术等的发展,垂体瘤的手术治疗不仅能做到尽可能全切肿瘤,还能够做到减小创伤和出血。手术咨询中,经常有患者在手术以后询问:“主任,手术治疗后应该如何护理?多久可以恢复呢?”听到这些问题,我深感欣慰,因为了解他们对于患者的康复尤为重要。 1 体位 术后,病人应绝对卧床休息,麻醉清醒后头部可抬高15°-20°,每两小时翻身一次,防止压疮。 2 病情观察 ①严密观察意识、瞳孔、体温、脉搏、呼吸、血压的变化。术后出现意识障碍、头痛剧烈,烦躁不安、视力恶化并伴有等情况应报告医生及时处理。 ②记录病人每小时尿量、24小时出入量,若尿量成人>200ml/h,小儿>150ml/h,连续2h以上,应及时报告医生。 ③观察伤口情况:开颅手术观察切口敷料的渗血渗液情况,引流的颜色、性质、量等;经鼻蝶手术的病人注意观察鼻腔填塞条有无渗血渗液或松脱。若渗血或渗液较多,引流管或填充条不慎脱出,则应立即报告医生及时处理。 ④观察有无脑脊液鼻漏:观察鼻腔分泌物的颜色,性质、量,注意有无清水样液体流出及有无活动性出血,术后避免剧烈咳嗽和用力擤鼻涕,如出现血性分泌物或有清水样液体流出,应立即报告医生。 3 治疗及用药的护理 按时、定量服药,不能自行停药,更换药物或增减药量(尤其是激素治疗)。通常主治医生会给患者使用下列药物,我给大家简单说说他们的功效。 ①脱水药物:甘露醇是渗透性脱水剂,可降低颅内压,减轻头痛,使用时需要快速输入,15-30分钟内滴完,不能自行调节滴速。 ②抗脑血管痉挛药物:尼莫地平、尼莫同都是钙通道拮抗剂,可预防和治疗脑血管痉挛所致缺血合并症。使用时需足量、全程、持续输入,一般使用微量泵注入。使用时病人可能出现血压下降、面色潮红、发热等现象,一般不需特殊处理。如血压下降明显或较低,可酌情对症处理。另外,尼莫同对血管刺激较大,病人容易出现化学性静脉炎,可更换输液部位,选择粗大的血管进行输液,并酌情使用喜疗妥涂抹。 ③抗菌素:手术病人会预防性地使用抗菌素,或根据细菌培养及药敏试验结果使用抗菌素。 ④抗利尿药:病人出现尿崩后,可遵医嘱使用垂体后叶素、弥凝、尿崩停等抗利尿剂,缓解尿崩症状。使用这些药物后,需注意观察病人尿量有无减少,有无尿少或尿闭现象出现。 4 饮食护理 术后6小时后可给予流质饮食,小量多餐,逐步调整为半流食,普食。逐渐加强营养,多食高蛋白、高营养、富含维生素易消化的食物。 5 日常基础护理 ①皮肤护理:按时翻身,避免局部长期受压,预防压疮。 ②保持呼吸道通畅,翻身时叩背,鼓励咳嗽排痰,预防肺部并发症。 ③口腔护理:经鼻蝶手术病人术后只能张口呼吸,容易出现口干,加之术前后的禁食,应保持口腔清洁,可进行口腔护理,使用润唇膏保护嘴唇,减轻病人不适。 ④鼻腔护理:经鼻蝶术后鼻腔填塞条不能自行取出,避免出现出血、鼻漏。3~5天后根据病人情况由主治医生取出填塞物。取出纱布后,患者鼻腔可能会有少量分泌物流出,一般在一周内停止,可让病人取坐或半坐位,使鼻腔分泌物流出,避免因分泌物逆流引起感染。同时不能用手抠鼻,不能冲洗鼻腔,不用力擤鼻涕,以免造成出血和感染。 ⑤保持会阴部清洁,预防泌尿系感染。术后1-2天病人卧床,可在床上大小便。保持大便通畅,必要时使用缓泻剂。 ⑥康复训练:术后有功能障碍的病人可适当进行康复训练。活动时注意循序渐进,量力而为。训练步骤:被动运动-翻身-床上坐起-床边坐起-床边站立-扶床行走-扶墙行走-室内行走。可循序渐进地增加活动量及范围。注意劳逸结合,避免过度劳累。 ⑦生活规律,注意休息。注意安全,行动不便或视力障碍者家人需陪伴以防跌倒、撞伤、烫伤等意外发生。 通常来说,垂体瘤患者住院时间大概为10-15天,出院后休息1-2月就可以恢复工作。事实上,任何一个外科手术后,影响术后恢复的因素都是比较多的。但是在垂体瘤手术中,肿瘤的大小,是否全切,切除的比例和部位、手术是否顺利、患者体质、有无并发症等都可能影响术后恢复。因此不能武断的说手术后多久患者能够获得较好的预后。 当然,如果手术中对正常垂体组织造成了一定影响,垂体功能受到一定影响,也可能影响患者的恢复。由于各种因素引起免疫系统、胃肠道消化系统、肝、心肾功能等有一定损害作用,重者引起多脏器功能的损害甚至造成衰竭,所以手术后人体需要得到良好的休息。在身体逐渐恢复的过程中,患者可以逐步独立生活、工作,从轻到重,循序发展。 总的来说,垂体瘤患者在接受手术以后不要着急回到工作中来,要逐步恢复,并且由于影响因素较多,患者在出院的时候一定要问清楚病情,并且根据医嘱做好康复工作。
张庆华 主任医师 华中科技大学协和深圳医院 神经外科1428人已读 - 精选 宁夏医科大学总医院神经外科昨日再次完成一例帕金森病手术
病史患者,男,59岁,右上肢不自主震颤3年余,同时出现起步困难,慌张步态,睡觉翻身困难。多年前出现嗅觉减退表现,我科诊断为帕金森病 手术治疗~脑深部电刺激术(DBS )患者术后右侧肢体震颤消失,手术效果理想!
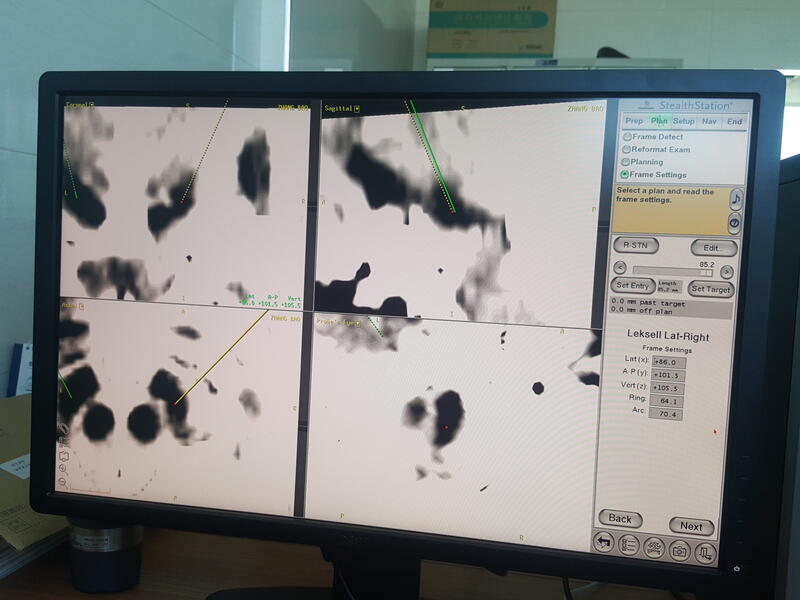 刘阳 副主任医师 宁夏医科大学总医院 神经中心外科1292人已读
刘阳 副主任医师 宁夏医科大学总医院 神经中心外科1292人已读 - 精选 顺利完成一例痉挛性斜颈脑深部电刺激手术
病例介绍(宁夏医科大学总医院神经外科提供)患者,女,71岁。右颈部肌肉间断或持续的不自主的收缩,导致头颈部扭曲、歪斜、姿势异常20年余。 初步诊断:痉挛性斜颈 治疗:双侧脑深部电刺激治疗(DBS) 手术治疗手术过程顺利,术后病人恢复良好,试开机,症状明显控制!继续随访观察。
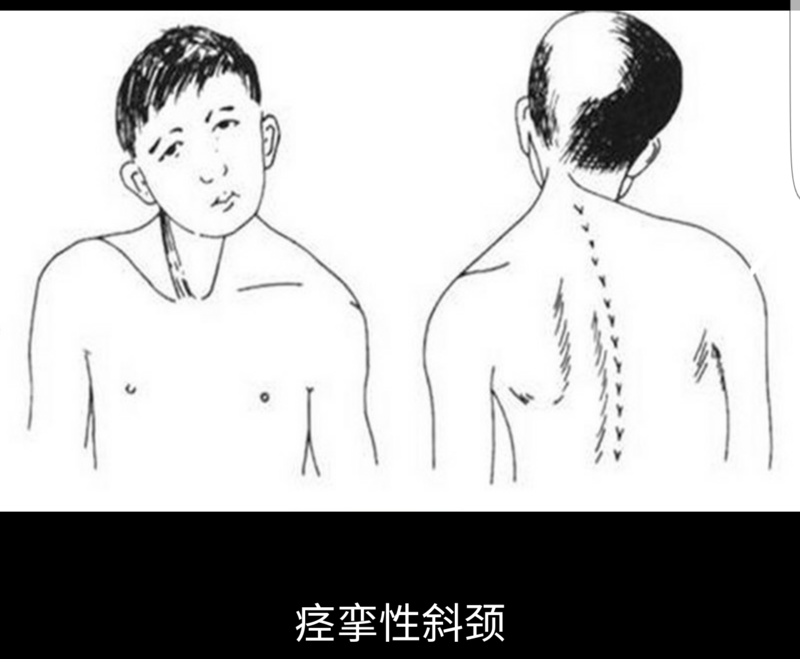 刘阳 副主任医师 宁夏医科大学总医院 神经中心外科3049人已读
刘阳 副主任医师 宁夏医科大学总医院 神经中心外科3049人已读 - 精选 协和医院神经外科主任王任直教授来院交流与指导
宁夏垂体疾病诊疗中心邀请北京协和医院神经外科主任、中国垂体瘤协作组组长、首席专家王任直教授拟定于下周二(8.15)将到我院学术交流及手术示范,如有需要,请联系我13709571930
张庆华 主任医师 华中科技大学协和深圳医院 神经外科1751人已读 - 精选 半椎板开窗,椎管内肿瘤切除术
以往椎管内肿瘤手术是将肌肉从两侧椎板完全剥离,再将棘突、椎板、黄韧带用咬骨钳咬除,这样创伤大,术中失血多,术后卧床时间长,恢复慢,术后由于肌肉、韧带、骨头的损伤还造成脊椎不稳,对日常生活影响大。 现在我们对边界清楚、偏侧的肿瘤采用切开一侧肌肉,椎板开窗显微镜下切除,保留另一侧肌肉、保留棘突、轻微损伤了椎板和黄韧带。不影响脊柱的稳定性。出血少,恢复快,下地早。
徐军 主任医师 宁夏医科大学总医院 神经中心外科1500人已读 - 精选 颅内肿瘤和脊髓肿瘤的年发病率
国外居民调查,原发性颅内肿瘤的年发病率为7.8-12.5/10万人。国内一般认为颅内肿瘤的年发病率为10/10万,即每一万人中每年约有1名颅内肿瘤的病例发生。北京市城区发病率为36.6/10万人中。 脊髓肿瘤每年每10万人口发病2.5人。男女发病率相近,但脊膜瘤女性多见,室管膜瘤男性多见。胸段脊髓发生率较高。(以上摘自王忠诚神经外科学) 按照这样的发病率计算,宁夏640万人口每年脑瘤的发病人数是:640人左右。去年我科做了700例左右但包括内蒙、甘肃、陕北的患者。脊髓肿瘤的人数应该是160人左右,2011年4月26日心脑血管病医院开业,当年我科共做了30余例脊髓肿瘤。2012年我分出脊髓亚专业组后共做了脊髓肿瘤80余例,其中心脑血管病医院神经外科做了50余例,所有患者无一出现严重并发症。随着患者对心脑血管病专科医院的知晓和了解、对脊髓肿瘤手术风险的认识的提高,相信患者一定会选择有资质、水平高的神经外科来做手术,患者每年逐渐增多。
徐军 主任医师 宁夏医科大学总医院 神经中心外科1983人已读 - 精选 岛叶癫痫
岛叶癫痫“岛叶癫痫”概念最早是在20世纪50年代提出的,当时人们发现刺激岛叶后能产生类似于颞叶癫痫的症状,两者之间的临床症状相似性非常容易让人混淆。此后进行多年的跨地区、多中心临床病例统计也表明:在手术治疗的颞叶癫痫患者中,约70%的患者手术预后良好,但20%手术疗效差,更有10%手术治疗无效;而在这些无效患者中,岛叶受累可能是部分难治性癫痫患者在单纯行颞叶切除手术后治疗失败的关键原因。岛叶属于边缘系统,作为第五脑叶,它与内脏活动和情感中枢密切相关,而且毗邻运动、感觉、语言中枢。岛叶具有多种不同的功能,如记忆、驱动、情感及更高的味觉、嗅觉自主控制等;岛叶区域的肿瘤可以诱发多系统的功能障碍,诊治不当可危及生命。但由于岛叶自身深在的解剖学位置、外侧密集的血管墙结构限制,使得岛叶的癫痫发作在头皮电极上是不大可能被记录到的,即对于癫痫诊断极有价值的常规脑电图在研究岛叶癫痫时所扮演的角色相对较弱,区分癫痫发作到底起源于颞叶内侧并迅速扩散至岛叶还是起源于岛叶迅速扩散到颞叶内侧,是非常困难的。所以岛叶癫痫的研究曾一度陷入低谷,甚至有许多人开始否定岛叶癫痫的存在。进入21世纪以来,随着研究思维和方法的不断创新,特别是立体定向脑电图(Stereo-electroencephaloghy, SEEG)电极的小型化和MRI定位技术准确性的提高,使得对岛叶癫痫的关注又逐渐升温,越来越多的研究者开始关注这一领域。历史背景1786年,Vicq首次研究岛叶,他称其为“位于外侧裂和纹状体之间的回旋”。现在得到公认的说法是Reil在1804年第一次明确提出了 “岛叶”这个概念。Clarkl在1896年发表的一篇文章中已有了岛叶的解剖认识,他用“人脑第五脑叶”来描述这个区域。它位于外侧裂的深部,上有额、顶、颞叶形成的岛盖覆盖。岛叶的解剖位置和细胞组成形成了关于其功能的一些最初认识:可能是人脑内孤立的脑叶;属于躯体的自主神经系统;功能主要支配包括味觉、疼痛及其他情感在内的内脏感觉和内脏运动。有实验证实:猴子的岛叶包括Brodmann上的13到16区,这里有明显不同与其他脑组织的细胞结构,即一种颗粒性皮质;在它的上部和后部有非常相似于第二躯体感觉区(SII区,与本体痛觉和听觉有关的区域)的细胞分布,而在它的前上部集中有一种和味觉、内脏感觉功能相关的过渡性异常颗粒,前腹侧有嗜碱性粒细胞,属于颞极和嗅觉皮质的延续,应该和嗅觉与自主神经功能有关。目前,对岛叶功能的研究成果主要来源于:①动物实验;②术中观察刺激岛叶皮质后患者的表现;③分析病变累及岛叶的患者临床表现。在人类,因为累及旁边缘系统的病灶常损伤邻近边缘结构,所以很难明确定位于旁边缘系统的病灶对于神经功能影响的确切程度。在过去的10年中,随着神经解剖学、功能影像学、神经电生理学技术的发展,使得岛叶相关研究逐渐增多。研究者应有各种方法试图证实岛叶和额、顶、颞叶及扣带回的联系。Mesulam等人在对大脑皮质的研究中,提出脑的旁边缘结构包含眶-额皮质尾部、岛叶、颞极、海马旁回-扣带回联合体,这五个旁边缘区围绕大脑半球内侧及基底面形成一条连续带;皮质边缘和旁边缘区,连同下丘脑及基底节、丘脑的边缘成分,一同组成边缘系统,它们对记忆、学习和情感起着至关重要的作用;岛叶作为旁边缘区的一部分,由中间皮质构成,中间皮质插入于不均皮质和同形皮质之间形成逐渐地过渡。1955年,Penfield报道了刺激岛叶下部后可引起内脏运动、内脏感觉、味觉和躯体感觉反应。Wieser首先使用立体定向脑电图(SEEG)进行刺激岛叶皮质的研究,结果显示51%~80%的人可以出现内脏感觉异常,但他未能说明刺激岛叶的准确定位。此后,Oppenheimer证实刺激右侧岛叶皮质会引起心脏节律和动脉血压的改变;Ostrowsky报道在对14例难治性颞叶癫痫患者进行术前评估时,电刺激岛叶皮质后显示在岛叶皮质内存在清楚地特征性地形定位:刺激岛叶前部皮质主要引起内脏运动和内脏感觉反应,而刺激岛叶后部皮质主要引起躯体感觉反应;Ostrowsky的研究表明下丘脑外侧区是起源于岛叶皮质的交感神经反应的初级中继部位,与无颗粒皮质相联系,这种关系就决定了刺激岛叶前部可以引起诸如恶心或喉部不适等内脏感觉异常;也有研究显示对健康志愿者记录食道近端和末端的球囊扩张也可以引起岛叶皮质反应:将气球放置于食道内,气球膨胀所引起的电生理活动提示岛叶和/或岛叶周围皮质存在一个以上的启动区。Reiman等人通过PET 检测不同区域的脑血流量(CBF)研究与正常人类情感反应有关的脑区,在12个健康志愿者中交替进行情感产生任务(快乐、悲伤和厌恶)和情感不确定控制任务,他们发现包括岛叶前部皮质的几个脑区参与了对认知刺激的情感反应。在后期的补充研究中,作者又研究了正常预想忧虑(正常研究对象在接受电休克前,接受电休克时及接受电休克后)的脑区表现,结果显示预想忧虑与岛叶前部皮质附近CBF关联显著性增加。这些研究集中显示了岛叶确实具有以下功能特点:1.通过大量的解剖学、功能影像学以及躯体感觉、疼痛诱发反应和直接电刺激岛叶皮质研究,都证明岛叶具有调节自身躯体感觉和痛觉的功能;2.控制内脏感觉和内脏运动的功能;3.在颞叶癫痫患者行前颞叶切除术时刺激其岛叶,可见约50%的病例中,心率和血压会产生变化,从而考虑在癫痫发作时是由于岛叶的异常放电作用导致患者心律失常,甚至造成猝死;4.综合Penfield的味觉刺激研究、神经影像学研究和动物(猴子)实验,结果表明岛叶神经元上微电极刺激引起的电生理变化与临床上岛叶损害的患者味觉改变情况相一致;5.听力和语言,特别是听觉注意力的定位、接收异常的听觉刺激等相关方面也有岛叶的参与,有研究表明左、右侧岛叶都参与了语言功能的产生。最新的研究报道了岛叶可能还有神经元系统“镜像”特点,即一个受试者在执行一个动作时,当他观察到另一个个体也在进行相同的动作时,大脑会有所反映,而且该区域还会对受试者的感觉(或者情感)进行整合,使得自身也对此产生相应的反应。比如,当看到他人面部有厌恶或痛苦表情时,岛叶区域就会产生于与此有关的内脏感觉或内脏运动反应。综上所述,岛叶和其他大脑脑叶比起来,它代表着更高的组织功能。因此,致痫灶涉及到此区的患者也必然会有特殊的症状发作特征。岛叶是大脑皮质结构的一个部分 和大脑的其他脑叶相比,岛叶的解剖界限是有特征性的,它有明确的界沟(脑岛周围裂隙),而且还有过渡性的细胞结构边界与周边皮质区域甚至更远的皮质区域相连接,形成密集的联络结构。因此岛叶的功能以及它在癫痫发作中所起的作用,不能简单的看成如其名称所示的一个孤立的功能中心(岛)。Augustine的综述中完整说明了岛叶的联系系统:岛叶和周边区域如杏仁核、基底核以及除枕叶之外的所有皮质相联系。在现已证实存在的外侧裂-岛叶、颞叶-边缘系统-岛叶和内侧额眶叶-岛叶结构体系中,引起癫痫研究学者更多关注的就是因为每处痫样放电产生的癫痫发作症状最终都会归于岛叶病变,而这其实才仅仅是岛叶癫痫全部症状的一部分。这样广泛的结构联系也正是在致痫区域超出岛叶范围的癫痫疾病中甄别出岛叶癫痫病例的困难所在。在灵长类动物的实验中,岛叶皮质-组织投射区一般与不同的皮质结构相关联。猴子的岛叶被分为三个细胞结构区:①腹嘴侧无颗粒区(Ia);②过渡乏颗粒区(Id);③背尾侧颗粒区(Ig)。这些不同细胞结构区域与岛叶内不同功能区域有关:①Ia与嗅觉和自律功能有关;②Id和味觉功能有关;③Ig和躯体感觉、听觉及视觉功能相关。为数不多的临床病例及电生理学资料证实在人的岛叶皮质内也存在相似的地形定位组织。Dupont通过PET研究显示,情感感觉(恐惧、苦恼、不安)或内脏症状(上腹部上升感、胸腔压迫感等)就与岛叶不同的区域分布紧密相关。岛叶是一个癫痫症状发作区在20世纪40、50年代,Penfield和Faulk在局麻下开颅行皮质脑电(EcoG)监测的颞叶癫痫患者手术中进行了岛叶刺激研究,EcoG记录显示在这些患者中约有一半人在颞叶手术后仍有大量的阵发性棘-尖样波出现。他们推论:大多数刺激岛叶的阳性反应构成要么是产生与通过刺激其上部外侧裂(SII区)时的相似感觉,要么是产生于胃肠道中胃肠感觉继发胃肠运动后的改变。岛叶皮质起源的癫痫在这方面的表现非常类似于颞叶癫痫,这也部分的解释了诊断为“颞叶癫痫”的患者仅行单纯切除颞叶手术后效果不理想的原因。尽管EcoG可以作为一种系统探索岛叶的方法,但是Penfield也未能成功记录到明确的岛叶皮质局部痫样放电。紧随其后的Guillaume开始呼吁同行关注“岛叶癫痫”的概念。然而,他们都不能提出更多的证据证明与传统颞叶手术相比,岛叶手术可以更加有效地改善顽固性颞叶癫痫患者的症状。于是这种能够反映岛叶放电的特殊症状表现被逐渐淡化、遗忘。直到最近的几则新病例报道中,明确提出“在切除受损的岛叶后痫样放电可以终止”,岛叶作为癫痫症状的发作区又被大家所关注。岛叶癫痫的临床表现定义一个皮质中枢是癫痫症状产生区的关键是要通过侵袭性脑电监测设备来确定监测区是否有与已知资料有相同的放电波形。但在岛叶中,这样的情况很难找到。因为许多岛叶放电是在颞叶、外侧裂或者额叶放电之前或之后发展来的,然后很快传播开来,所以岛叶放电所表现的症状很难同它周围的结构区分。法国学者J.Isnard等人通过直接刺激患者岛叶,观察、总结了岛叶癫痫样发作个体的共有特征:1.意识清醒;2.发作前都有感觉上的先兆症状,多见为局限于口周或范围很大(脸-肩-手和躯干,上肢-躯干-下肢)的电流感或热灼感;3.发作前或发作时可能会有胸骨后疼痛、腹部坠胀感、恶心呕吐、呼吸困难等感觉异常,咽喉部常有趋向于致哑的发音困难或构音障碍表现;4.发作时有咽部的运动和感觉症状,并且伴随着放电区对侧的手或者是双手伸向颈部的抓、挠等动作;5.经常会有放电同侧或对侧的运动症状,如面部或上肢的痉挛、头和眼球的旋转、全身的肌张力障碍。能够总结出一项或多项共有症状对于癫痫放电的定位判断是非常有用的:在再有类似发作时,就可以很快鉴别出它的发作部位。在此基础上进行手术切除病灶,术后控制痫样放电的效果令人满意。在Isnard的研究中,当用低电压(1~3mA)缓冲刺激50例患者的岛叶时,在总计144次的刺激中,125次是在没有任何后放电的基础上就有临床反应,有明确临床反应的报告139次,三分之一的患者通过对比认定,表明符合他们平时自身发作时的症状,有108次报告的症状是不同于他们既往的发作症状。这些发作症状可归为五大类:自身躯体感觉异常、内脏感觉异常、听觉异常、构音障碍和言语缺失以及包括幻觉、幻嗅在内的其他异常等。 这些患者中,躯体或内脏感觉反应异常的约占诱发反应的三分之二,其中又有一半以上局限于喉颈部区域。从这些收集的自身躯体感觉尤其是痛温觉异常的资料数据分析,发作应该牵涉到了岛叶的后部。笔者收集的临床患者资料中也报告了在他们发作时相似的喉部和内脏感觉,这个结论和通常的颞叶癫痫中喉部和内脏感觉发作源于海马和杏仁核的观点是有冲突的。听觉症状目前还是归因于涉及到了颞盖和颞上回。已有研究表明,它们也是岛叶放电的通路之一。但是,迄今为止,仍不能把任何一种类型的幻听或幻觉作为单独的岛叶发作症状,因为刺激Heschl’s回引起的听觉症状非常类似于刺激岛叶产生症状。与此相对的是,虽然发音困难也被认为是额盖放电的表现,但还未有在刺激Broca’s区以外观察到这种症状的报道。与其他发作不同的是,在此之后产生的躯体运动并不是通过刺激岛叶直接产生的,反而可以反映岛叶癫痫传播至了顶叶,它的出现被认为是预示着单纯行颞叶切除后极有可能效果不佳,甚至对于“颞叶癫痫”的诊断也是值得怀疑的。就如典型病例2中的患者是右后侧岛叶的海绵状血管瘤,他的癫痫发作在躯体左侧,在失神发作之后变成大发作。而事实上,单纯起源于颞中回的癫痫症状是极为罕见的,它的发生最终被证实有近三分之二是由于岛叶癫痫引起的。因而,在颞叶癫痫发作的患者中,他们的病因很有可能就是岛叶起始的癫痫。 最终,刺激岛叶诱发的反应中还有10% 的患者可以再次发作岛叶癫痫时的特发症状,比如植物性反应、不真实感、幻味等现象。这些罕见症状的起源和岛叶控制味觉和内脏的功能也是相一致的。在所有岛叶癫痫患者中,他们的癫痫发作症状中没有出现眩晕或躯体站立不稳的报告,刺激岛叶的研究也没有产生前庭感觉异常。这些特征与有这种感觉发作的顶-岛叶病变形成对比。Penfield和Jasper刺激皮质的资料和最近Kahane等人的研究都表明只有在刺激前颞叶皮质和顶下皮质后部时,前庭感觉症状出现最多。建立在以上详细观察的基础上,癫痫分类中用“岛叶”来界定这个特殊的致痫区域是否可行呢?换句话说,这些特殊症状的致痫区域是否能够充分定位于岛叶,能否依此预测在切除岛叶皮质后患者的癫痫症状就可以完全消失呢?视频脑电图是可以回答这个问题少有的工具之一。当岛叶癫痫自然发生时,患者意识完全清醒,他能够说出自己咽和/或喉部不适,胸部压迫或呼吸困难,不舒适的挤压感,口周的发热或疼痛感,甚至扩散到更大范围的躯体疼痛不适,紧接着是构音障碍或发音困难,最终以躯体运动表现结束。而实验研究已经证明,岛叶的不同部位(前部、后部)放电引起的症状是有着显著差异的:内脏运动和喉部感觉以岛叶边缘放电多见,岛叶后部的痫样放电引起的发作多是躯体感觉症状,痛温觉异常则是两侧区域的共同结果。于是Lüders等人依照此种癫痫症状的特点,描述大多数岛叶癫痫症状为“植物性和躯体感觉的联合表现”。岛叶癫痫体系的概念正如许多其他的部分性癫痫发作类型一样,当岛叶皮质被作为一个部分被涉及或作为一个独立的痫灶起源,而不仅仅是癫痫传播的中转结构时,癫痫体系的概念可以用来描述岛叶癫痫。这种情况在临床工作中,要比传统意义上的岛叶区域癫痫发作概念要普遍的多。然而,值得注意的是,确定岛叶起源的癫痫诊断也是不能武断和扩大化的。因此,除了MRI上可以明确癫痫情况的病变如海绵状血管瘤或低度恶性肿瘤以及以临床症状为基础、侵袭性的EcoG直接监测岛叶皮质外,更多的患者诊断,还必须要有针对性的探讨所有可疑的癫痫体系,以便正确评估岛叶在癫痫发作中的作用。涉及岛叶的三种癫痫体系类型区分如下:1.以外侧裂为边界的、涉及不同大脑区域的颞-外侧裂-岛叶体系即环绕岛叶的额、顶和颞部岛盖;2.颞-边缘-岛叶体系,主要包括颞叶内侧结构和/或颞极;3.内侧额眶-岛叶体系,包括岛叶内侧、额眶部分。 这当然仅仅是人为的划分,但是,结合患者的临床特点和辅助检查手段,这样的体系也的确存在,所以详述如下:颞-外侧裂-岛叶体系“外侧裂癫痫” 的概念最初是由Munari等人提出的,他们试图以此与固有的颞叶癫痫概念相区别。因为这种外侧裂致痫区中通常包括颞上回,这就解释了在这种形式的癫痫中经常存在单纯幻听的原因,也说明了为什么“颞-外侧裂”要比“外侧裂”更适合。除了单纯的幻听,颞-外侧裂癫痫其症状特点也反映出额叶和顶叶岛盖(面部运动或躯体感觉症状,幻味觉,多涎)、第二躯体感觉区(不同类型的同侧,对侧或双侧症状)和颞-外侧裂-前庭皮质(眩晕)参与其中。在Munari等人的早期研究中,部分症状最初归因于额叶或顶盖的放电,因为他们并没有安置岛叶的深部电极来实际监测岛叶皮质。这样的一个例子是味幻觉,传统观念认为这是顶额盖放电的反映,但现在通过刺激岛叶的研究已经证实,由此引起的症状要远多于顶额区。此外,岛叶皮质和顶盖躯体感觉(SII)的皮质都可产生类似的躯体感觉症状,即使岛叶中的躯体皮质定位要比SII中大得多。最后,在顶额和颞-外侧裂皮质的相关性研究中,一方面它们有着严格的解剖连接和细胞结构之间的联系,另一方面岛叶的功能也涉及着包括颞-外侧裂体系在内的所有大脑区域。Ostrowsky等的一个研究显示了岛叶在可疑的颞-外侧裂致痫体系中所起的作用,在6例控制癫痫发作不成功的颞叶手术中,术前的颅内脑电图提示颞叶参与了癫痫的成因:在这些患者中,躯体感觉的先兆被解释为反映了顶叶和顶叶下方区域至颞叶的放电,这一点也得了颅内脑电图的证实,但随后的切除颞叶手术却并未很好的控制癫痫。作者后来总结:通过多次观察患者的症状和进一步的检查,他发现所有患者发作期的SPECT上岛叶有明显的灌注显像,这使他重新认识到岛叶在有可能参与了其中各种复杂的致痫体系。但是,由于缺乏在岛叶直接放置脑内电极,他们无法证实这一假说。颞-边缘-岛叶体系尽管现在已经有了对颞叶癫痫典型临床特征及MRI特点的完善研究,但癫痫外科手术中,一个主要的挑战仍是相当大比例的手术后患者癫痫复发问题。岛叶癫痫体系的广泛联系性使得这种问题更加复杂化,部分手术失败可能反映在一个较大的、有颞叶结构硬化的癫痫体系中有岛叶的参与。Isnard报道过一位患者术前已经达到了定义为TLE的主要标准,包括在自动症后很快出现的腹部上升和疼痛感,MRI也显示单侧的海马硬化,同侧发作间期颞-边缘系统的FDG-PET代谢减退,前颞叶头皮脑电图特异性发作表现,等等。然而,也有迹象和症状提示外侧裂区域迅速参与其中,包括有早期单纯性幻听和迅速发生的咀嚼动作以及左面部的强直收缩抽搐。侵袭性脑电图证实患者患有两种癫痫类型,一种是由颞叶内侧结构硬化传播到同侧岛叶和岛盖区引起的,另一种则是在颞叶内侧和盖区侵入之前岛叶后部自身的起源。有趣的是,没有起源于颞叶的岛叶癫痫发作类型总是有选择性地发生在睡眠期间,所以在单纯行颞叶癫痫手术后,控制癫痫症状发作只在有限的几个月中,而且是白天患者症状控制良好,而夜间的发作继续保持不变。这个病例报告说明在有主要临床与MRI特点的颞叶内侧癫痫中,颞-边缘区和岛叶癫痫并存的可能性。这也证实了其他体系如颞-外侧裂区可以强烈、迅速的参与,这表明这些不同体系在同一患者可能是相互交织和重叠的。 与此相对应,更多见的是,其他患者发作的脑电图和影像学资料比较证明致痫区仅限于颞-边缘皮质。大脑EcoG记录证实有颞叶内侧的放电发作很快就集中在了岛叶,这表明岛叶是这个癫痫体系的一部分,这种起源于颞叶内侧的癫痫发作有可能很快传播到同侧岛叶,这种癫痫传播形成后在前颞叶切除的手术后并不受到任何影响。 在颞-边缘系统和岛叶间仍有关于它们连接和发作之间放电传播的几个问题未能解决。由于颞极频繁的参与发作起源,笔者提出使用 “颞-边缘”而不是“颞叶内侧”来命名颞叶内侧和岛叶关系密切的大脑区域。事实上,根据Mesulam描述的旁边缘区域,应该考虑为两个主要部分,一部分包括额眶皮质、颞极、岛叶,而海马旁回和扣带回构成另一部分。事实上,岛叶与颞极、嗅皮质、杏仁核本来就具有很强的相互连接,此外,它还投射到海马前部,但不从这个结构接收直接的传导。目前还不清楚上述区域是如何参与颞-边缘癫痫的。内侧额眶-岛叶体系 最新的焦点问题是岛叶在颞叶癫痫体系中的作用到底是什么?更确切地说,它在NFLE中睡眠期间癫痫发作的主要特点是什么?这种症状提示痫灶来源于额叶,比如夜间阵发性肌张力障碍(NPD)或过度运动发作。有报道说,这种疾病的患者中,8%~43%经鉴定有常染色体显性遗传(ADNFLE)的基因变异。但关于原发性的NFLE依然存在许多不确定因素,因为只有极少数患者能被研究到其颅内脑电图的记录。Isnard报道过3例典型夜间过度运动形式的病例,其中有2例隐性NFLE癫痫发作,另1例是发作起源区被证明位于岛叶前部的常染色体显性遗传NFLE。在隐性NFLE患者中,颅内脑电图记录到发作痫灶集中在同一区域,其中包括高频放电和高振幅峰值的频繁发作。而在ADNFLE患者中,致痫区出现的更大,延伸至岛盖额部。用高频电刺激岛叶的前上部,前2例患者可以得到一个典型的先兆或完全癫痫症状。然而,由于3例患者都没有进行癫痫手术,我们不能充分断定其致痫区的确切范围。3例患者进行的颅内脑电图监测研究中,可以发现他们的夜间过度运动发作都占30%,而MRI上没有脑损害。在同期的报道中,7例被证实是内侧或前额叶癫痫发作起源而行切除手术的患者中,3例术后仍有癫痫发作。一种可能的推测是在这些患者的发作时,没有仔细研究颅内脑电图记录中的岛叶作用。 由此可见,至少在那些抗癫痫药物无效的患者中,癫痫起始区为岛叶可能是所谓隐性NFLE发病的一部分原因所在。目前,除颅内脑电图记录外没有明确的指标可以适当的从NFLE中区分出这些患者。岛叶癫痫倾向于睡眠期间发生,这在以前从未被报道。然而,值得注意的是这种倾向也有在颞-岛叶癫痫的患者中出现过。岛叶在睡眠中生理的作用目前尚不清楚,但最近的功能神经影像学研究已显示了睡眠期间前岛叶的标记明显减弱。 综上所述,岛叶癫痫可能有多种不同的发作类型,反映出岛叶的不同亚区功能受到影响后会涉及到多个脑叶体系:岛叶后和前下部分似乎是大多数参与颞-外侧裂和/或岛叶-颞-边缘癫痫体系,这类似于不同形式的TLE;岛叶前上部分似乎在岛叶-额体系中发挥更重要的作用。岛叶癫痫产生的因素在岛叶癫痫的文献中,有许多病案报道是岛叶部位的占位性病变导致的癫痫发作。这些病变主要包括低级别脑肿瘤,包括神经胶质瘤、胚胎发育不良性肿瘤,海绵状血管瘤和脑皮质发育不良,等等。与此同时,所有潜在的、可能致痫的大脑损害也都能引起岛叶的异常放电发生,如中风或脑炎。 诊断岛叶癫痫的辅助检查无创EcoG根据岛叶深在的位置和特殊的脑回组织,头皮脑电图不大可能检测到起源于此的发作间期或发作期间痫样放电,除非这些放电传播到外侧的新皮质区域。然而,让患者行颞-外侧裂致痫区的头皮脑电图记录,可能会提供一些线索,间接的反应出参与其中岛叶潜在的作用。特别是当发作间期和发作期脑电图都有异常,可以显示分布在外侧裂及其下方之外区域更广泛地放电。发作间期的功能神经影像在典型TLE的患者中,[18F]FDG-PET和 [11C]Flumazenil-PET的研究报告表明,在一些由颞叶传导到岛叶的患者中可以发现发作间歇的代谢性减退与苯二氮受体密度下降。但这一问题仍需要在大宗病例的研究。在不多的岛叶癫痫确定的病例中,[18F]FDG-PET、[11C]Flumazenil-PET和发作时SPECT显示在TLE或NFLE并没有特异性,特别是没有明确的岛叶异常情况。反而,在一些推测致痫区可能涉及岛叶但不能确定具体位置的患者中[18F]FDG-PET 和发作时SPECT显示有异常结果,这其中包括夜间运动过度的癫痫发作患者和有躯体感觉先兆、表面上看发作起源于颞顶叶而忽略了岛叶的患者。总的来说,不论功能核磁成像对岛叶癫痫的临床诊断最终是否有多大用途,它都是一个值得进一步研究的的问题。侵袭性检查在Talairach和Bancaud首次描述立体定向技术时,Talairach用立体定向仪将颅内电极垂直矢状面植入并长期留滞长达15天。由此, Tournoux结合颅骨的冠状MRI片,绘制了每个接触位置相应的切片图集,得到了比例为1/1相应的电极轨迹,在岛叶中也用斜电极轨迹进行了有益的探索。 在过去的50年中,少数经过皮质或深部电极记录到的阵发性岛叶癫痫发作间期有效资料表明,50%的TLE患者中靠近岛叶有尖波或棘波记录。这其中,有偶尔或间歇性TLE发作和经常频繁发作的岛叶癫痫患者,还有一些是明显的局灶性皮质发育不良患者。因为杏仁核、海马或颞极的棘波通常是并存的,尽管它们往往与岛叶发作不同步,但最终定位都集中在外侧裂或其上的盖皮质或相邻的杏仁核-海马结构,这就使得放在外侧裂或靠近颞叶皮质的硬膜下电极不太可能记录到孤立的岛叶阵发波形。在发病的起源、传播和形态学上,岛叶放电模式非常类似于从一种癫痫发作转化到另一种发作形式,这意味着岛叶致痫神经体系是一种独特的形式,它们是一种可能开始的突然快速活动低电压(LvFA),或在发作间期改变前产生的活动。这些发作前的变化可以是一般的棘波之后更有规律和/或节律的棘波频率明显增加。发作的LvFA可以在岛叶保持几秒钟,或在数百毫秒内传播到岛叶之外。当LvFA在岛叶内延伸时,设在邻近接触结构的脑电电极是无法检测到的,特别是在颞-顶-额盖皮质,这种活动是不变的或只显示在岛叶LvFA放电时有节律的、没有急性阵发的慢波。随后,岛叶的LvFA或者逐渐扩散到外侧裂皮质区,更多的是在同侧杏仁核,海马或后内侧额叶皮质突然出现分离。岛叶癫痫的治疗根据脑电图,早在上世纪四十年代后期人们就尝试切除岛叶以改善单纯颞叶切除的手术效果。因为它不能证明比一般的单独颞叶切除术控制术后癫痫症状有更大优势,这一手术被放弃。但随着外科手术技术的进展和对此手术风险水平逐渐接受,切除定位于岛叶的局灶性致痫病灶如恶性肿瘤和海绵状血管瘤,在癫痫发作的控制结果通常是良好的,这样人们又建议尽管没有外科手术中的侵袭性脑电证据,而只要有岛叶病变所致岛叶癫痫发作症状的临床表现,也可以考虑切除岛叶组织来达到控制癫痫的目的。在没有占位性病变的患者中部分或次全切除岛叶是可行的。然而,这仍然需要切除部分额顶岛盖或颞叶皮质,并带来可能损伤深部大脑中动脉的风险。除了术前对可疑为癫痫的整个皮质网络进行脑电研究外,现在缺乏能够证实岛叶受损和进行岛叶有效手术的方法。一种选择是脑电监测引导的射频热凝固法(RF),它能产生最低限度是直径5-7毫米局灶性损害。 (孙涛,刘诤)参考文献1. Guillaume MMJ, Mazars G. Technique de résection de l’insula dans les épilepsies insulaires. Rev Neurol, 1949,81:900–903.2. Penfield W,Faulk ME. The insula, further observations on its function. Brain, 1955,78:445–470.3. Silfvenius H, Gloor P, Rasmussen T. Evaluation of insular ablation in surgical treatment of temporal lobe epilepsy. Epilepsia, 1964,5:307–320.4. Ryvlin P, Minotti L, Demarquay G, et al. Nocturnal hypermotor seizures, suggesting frontal lobe epilepsy, can originate in the insula. Epilepsia, 2006:320-333.5. Isnard J, Guenot M, Ostrowsky K, et al. The role of the insular cortex in temporal lobe epilepsy. Ann Neurol, 2000,48:614–623.6. Morrison I, Bjrnsdotter M, Olausson H. Vicarious responses to social touch in posterior insular cortex are tuned to pleasant caressing speeds. J Neurosci, 2011,31(26):9554-9562.7. Palaniyappan L, Liddle PF. Does the salience network play a cardinal role in psychosis? An emerging hypothesis of insular dysfunction. J Psychiatry Neurosci, 2011,36(4):100-176.8. Riley HA. An Atlas of the Basal Ganglia, Brain Stem and Spinal Cord. Based on Myelin-Stained Material. Baltimore: Williams & Wilkins, 1943:282–310, 576, 582–583.9. Nieuwenhuys R, Voogd J, van Huijzen C. The Human Central Nervous System: a Synopsis and Atlas. 3rd ed. New York: Springer-Verlag, 1988,98: 367.10. Sylaja PN, Radhakrishnan K. Problems and pitfalls in developing countries. Epilepsia 2003, 44 (1):48-50.11. McBain CJ. Differential mechanisms of transmission and plasticity at mossy fiber synapses.Prog Brain Res.2008,169: 225-240.12. Lanerolle NC, Kim JH, Williamson A, et al. A retrospective analysis of hippocampal pathology in human temporal lobe epilepsy: evidence for distinctive patient subcategories. Epilepsia. 2003,44(5): 677-687.13. Isnard J, Mauguiere F. The insular in partial epilepsy. REV Neurol(paris), 2005, 16(1): 17-26.14. Guzowski JF, Timlin JA, Roysam B, et al. Mapp ing behaviorally relevant neural circuits with immediate early gene expression. Curr Op in Neurobiol, 2005, 15(5):599-606.15. Connelly A, Jackson GD, Duncan JS, et al. Magnetic resonance spectroscopy in temporal lobe epilepsy. Neurology 1999, 44:1411-1417.16. Isnard J, Guenot M, Sindou M, et al. Clinical Manifestations of Insular Lobe Seizures: A Stereo-electroencephalographic Study. Epilepsia, 2004, 45:1079-109017. 22. Clar TE. The comparative anatomy of the Insula. J. Comp. Neurol. 1896,6:59 -100.18. Robinson CJ, Burton H. Organization of somatosensory receptive fields in cortical areas 7b, retroinsula, postauditory and granular insula of M. fascicularis. J Comp Neurol 1980,192:69–72.19. Schneider RJ, Friedman DP, Mishkin M. A modality-specific somatosensory area within the insula of the rhesus monkey. Brain Res 1993,621:116–120.20. Burton H, Videen TO, Raichle ME. Tactile-vibration-activated foci in insular and parietalopercular cortex studied with positron emission tomography: mapping the second somatosensory area in humans. Somatosens Motil Res 1993,10:297–308.21. Schreckenberger M, Siessmeier T, Viertmann A et al. The unpleasantness of tonic pain is encoded by the insular cortex. Neurology 2005,64(7):1175–1183.22. Lu CL, Chang FY, Hsieh JC. Is somatosensory cortex activated during proximal stomach stimulation and the role of insula in visceral pain. Gastroenterology 2005,128(5):1529–1530.23. Frot M, Mauguiere F. Dual representation of pain in the operculoinsular cortex in humans. Brain 2003,126:438–450. 24. Ostrowsky K, Magnin M, Ryvlin P et al. Representation of pain and somatic sensation in the human insula: a study of responses to direct electrical cortical stimulation. Cereb Cortex 2002,12:376–385.25. Stickler D, Gilmore R, Rosenbek JC, Donovan NJ. Dysphagia with bilateral lesions of the insular cortex. Dysphagia 2003,18(3): 179–181.26. Aziz Q, Furlong PL, Barlow J. Topographic mapping of cortical potentials evoked by distention of the human proximal and distal esophagus. Electroencephalogr Clin Neurophysiol 1995,96:219–228.27. Kinomura S, Kawashima R, Yamada K et al. Functional anatomy of taste perception in the human brain studied with positron emission tomography. Brain Res 1994,659(1–2):263–266. 28. Kobayashi M, Sasabe T, Tkbeda M,et al. Functional anatomy of chemical senses in the alert monkey revealed by positron emission tomography. Eur J Neurosci 2002,16(5):975–980.29. Verhagen JV, Kadohisa M, Rolls ET. Primate insular/opercular taste cortex: neuronal representations of the viscosity, fat texture, grittiness, temperature, and taste of foods. J Neurophysiol 2004,92(3):1685–1699.30. Pritchard TC, Macaluso DA, Eslinger PJ. Taste perception in patients with insular cortex lesions. Behav Neurosci 1999,113(4):663–671.31. Bamiou DE, Musiek FE, Luxon LM. The insula (Island of Reil) and its role in auditory processing. Literature review. Brain Res 2003,42(2):143–154.32. Ferro JM, Martins IP, Pinto F, Castro-Caldas A. Aphasia following right striato-insular infarction in a left-handed child: a clinico-radiological study. Dev Med Child Neurol 1982,24:173–182.33. Habib M, Daquin G, Milandre L et al. Mutism and auditory agnosia due to bilateral insular damage – role of the insula in human communication. Neuropsychologia 1995,33:327–339.34. Duffau H, Bauchet L, Lehericy S, Capelle L. Functional compensation of the left dominant insula for language. Neuroreport 2001,12:2159–2163.35. Ackermann H, Riecker A. The contribution of the insula to motor aspects of speech production: a review and a hypothesis. Brain Lang 2004,89(2):320–328.36. Chee MW, Soon CS, Lee HL, Pallier C. Left insula activation: a marker for language attainment in bilinguals. Proc Natl Acad Sci USA 2004,101(42):15265–15270.37. Rizzolatti G, Craighero L. The mirror-neuron system. Ann. Rev. Neurosci. 2004,27:169–192.38. Jackson PL, Meltzoff AN, Decety J. How do we perceive the pain of the others? A window into the neural processes involved in empathy? NeuroImage 2005,24:771–779.
刘诤 主任医师 深圳市龙华区人民医院 神经外科9486人已读 - 引用 垂体瘤选择什么样的治疗方法
1、什么样的垂体瘤可以先观察? 垂体瘤的发病率在20%左右,虽然比较高,但它不是癌症,而是一种良性肿瘤。而且,并不是得了垂体瘤就得手术,有些垂体瘤可以暂时观察,有些吃药就能控制。 比如说,一些比较小的垂体微腺瘤,还没有引起明显症状,比如头痛、视力下降,可以先观察,每年复查一次核磁就好,不需要手术。如果患者出现视力下降等症状,就要尽快去医院。 2、什么样的垂体瘤吃药就能治好?什么样的要手术? 垂体可以分泌很多种激素,有些垂体瘤也能分泌激素,根据这一点,通常把垂体瘤分为两大类,一类有分泌激素的功能,称为功能性垂体瘤,比如泌乳素型垂体瘤(PRL腺瘤)、生长激素型垂体瘤(GH腺瘤)和促肾上腺皮质激素型垂体瘤(ACTH腺瘤)等;另一类没有分泌功能,也称为无功能性垂体瘤。 大多数泌乳素型垂体瘤(也称为泌乳素瘤)患者,吃药就能控制肿瘤生长,降低泌乳素水平。少数泌乳素型垂体瘤患者吃药效果不好,或耐受不了药物副作用,或不想长期吃药,也可以手术切除。 除了泌乳素型垂体瘤,其他类型的功能性垂体瘤,首选手术治疗。另外,对于无功能性的垂体瘤,如果已经引起了明显的症状,比如头痛、视力下降等,也建议手术。 3、垂体瘤有哪些手术方式? 垂体瘤手术方式有两类,一类是开颅切除肿瘤,另一类是通过鼻孔操作,切除肿瘤。经鼻蝶的微创手术包括神经内镜下的垂体瘤手术和显微镜下的垂体瘤手术。多数垂体瘤采用经鼻蝶的微创手术,就能达到比较好的治疗效果。 4、哪些垂体瘤只能开颅切除? 要不要开颅,一方面要看肿瘤大小,更重要的是要看垂体瘤的形状和生长方式。有的垂体瘤尽管很大,但在鞍隔上下并没有形成哑铃形,经过鼻子能摘掉,就不必开颅。有的垂体瘤在鞍隔处被卡住,像葫芦一样,上下大、中间小,这种形状的通过鼻子往往很难切干净,就需要开颅。 5、什么样的垂体瘤适合用经鼻蝶的微创手术?效果如何,能根治吗? 除了那种长得像葫芦一样的垂体瘤,或生长方向非常特殊,需要开颅手术的情况以外,多数垂体瘤都可以通过鼻孔摘除。只要将肿瘤切除干净,大多数患者都不会复发,也就是能根治。 6、如果大脑的颈内动脉被垂体瘤包绕了,还适合微创的手术吗? 如果查出垂体瘤把重要的脑血管包住了,或肿瘤侵犯到重要组织,比如海绵窦,手术风险相对较大。但在神经内镜的监视下进行操作,手术过程中用导航和超声等设备引导,找到血管和肿瘤的位置,也能将肿瘤切除,少数患者可以获得非常理想的效果,只是手术风险很大。 实际上,针对这种垂体瘤,神经外科医生也可以采取切除大部分肿瘤,手术风险大的部位有少量残留肿瘤,可以在术后做立体定向放射外科放疗(比如伽玛刀或射波刀等),也能控制肿瘤生长,疗效比较好,相对而言,手术风险也没那么大。 7、如果垂体瘤压迫了视神经,这种经鼻蝶的微创手术能将肿瘤切干净吗? 视神经与垂体的位置比较近,体积比较大的肿瘤,往往会压迫到视神经,导致视力下降甚至失明。经鼻蝶的神经内镜手术同样能够准确地将肿瘤切除干净,达到较好的效果。 8、经鼻蝶的垂体瘤手术比开颅手术更好吗?好在哪里? 开颅手术和经鼻蝶的微创手术各有各的优势,患者的具体情况不同,手术的方式也有所不同。 开颅手术虽然创伤大,可能对大脑造成牵拉、伤害,个别患者还有可能出现颅内血肿,但是对于那些形状或者生长方式比较特殊的垂体瘤,采用开颅手术,治疗更加彻底。 经鼻蝶的微创手术,创伤相对较小,大多数垂体瘤通过这种手术,就能取得较好的效果。 9、这两类手术会影响垂体的内分泌功能吗? 一般在手术前,医生会评估患者垂体的内分泌功能处于什么水平;手术过程中,医生在切除肿瘤的同时,会注意保护垂体,不会影响垂体的内分泌功能。无论是开颅手术还是经鼻蝶的微创手术,如果患者术前的内分泌功能正常,手术时注意保护,术后一般不会出现垂体功能低下的情况。 10、手术对年龄有要求吗? 得垂体瘤的患者一般都是青壮年,儿童和老人比较少。手术对年龄没有特别要求。 少数患者已经七八十岁,也可以手术,但是术前要做充分评估,看患者的身体素质,有没有心脑血管疾病等,充分评估后,才能确定能不能手术。 11、如果女性患者打算怀孕,能不能先怀孕再手术? 泌乳素型垂体瘤会导致女性患者不孕,但多数患者吃药就能控制肿瘤生长,不必手术,通过药物将泌乳素水平调至正常,就可以考虑怀孕。 对于其他类型的垂体瘤,需要手术的时候应该尽快手术。特别是那些比较大的垂体瘤,应该先手术再考虑怀孕。
张庆华 主任医师 华中科技大学协和深圳医院 神经外科1459人已读 - 引用 癫痫治疗的新方法-VNS
顽固性癫痫迷走神经刺激术治疗。患者8岁,女,顽固性癫痫,口服药物治疗6年,无明显好转,每月发作2~3次。经过一年多行迷走神经电刺激(VNS )治疗至今,数月发做一次,发作时间明显缩短。一般情况良好,手术效果十分满意,电刺激疗效正缓慢起效,后期效果会更好。 在这里我想再谈谈迷走神经刺激术治疗癫痫的适应症和禁忌症,以供各位患者及家属参考。 适应症: ① 局限性发作、有或无继发性、全身发作; ② 应用抗癫痫药物进行正规治疗,但未能有效控制病情; ③ 多发病灶或病灶定位不确定; ④ 患者年龄通常在12~60岁。VNS治疗可用于不能定位或癫痫灶分布广泛的患者。 ⑤ 手术治疗不会引起重要的功能缺失; 禁忌症: 存在进行性神经系统疾患、精神疾病、心律不齐、消化性溃疡或全身状况不佳者 迷走神经刺激术(VNS)的手术操作简便,无需开颅,安全性较高,手术风险大大低于传统的癫痫病灶切除手术,并且治疗方法可逆。目前,VNS的问世已有二十余年,应用的病例愈来愈多,我中心开展的手术也越来越多,相信随着研究和临床工作的深入,VNS的临床应用将会更加广泛。将会有更多的癫痫患者受益于这项医疗新技术。
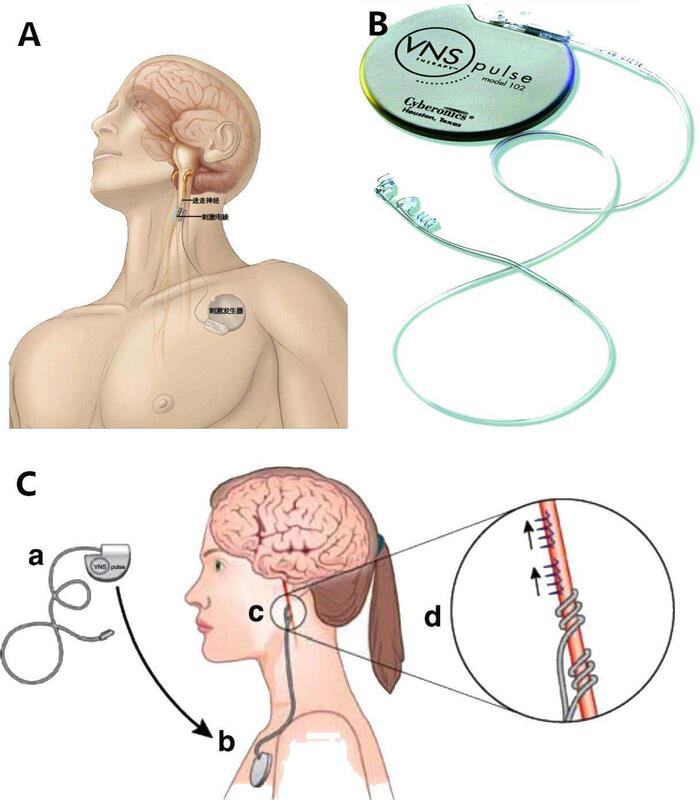 刘阳 副主任医师 宁夏医科大学总医院 神经中心外科1730人已读
刘阳 副主任医师 宁夏医科大学总医院 神经中心外科1730人已读



