上海市华东医院放疗科科普号
- 引用 放疗过程中吃什么?这是许多人关心的问题,下面揭开“冰山一角”
 王湘连 副主任医师 复旦大学附属华东医院 放疗科66人已观看
王湘连 副主任医师 复旦大学附属华东医院 放疗科66人已观看 - 治疗—守得云开篇(肿瘤退去,骨质终现)
2020年6月至今32个多月,原发灶是肾脏,转移至盆腔骨骼,疼痛,生活质量不能保证。 经过放疗与药物治疗后,图一耻骨坐骨终现,疼痛明显减轻,扶持下可行走。个中他们、我们的艰辛与坚持不一一细诉,未来愿如信中所愿🌹
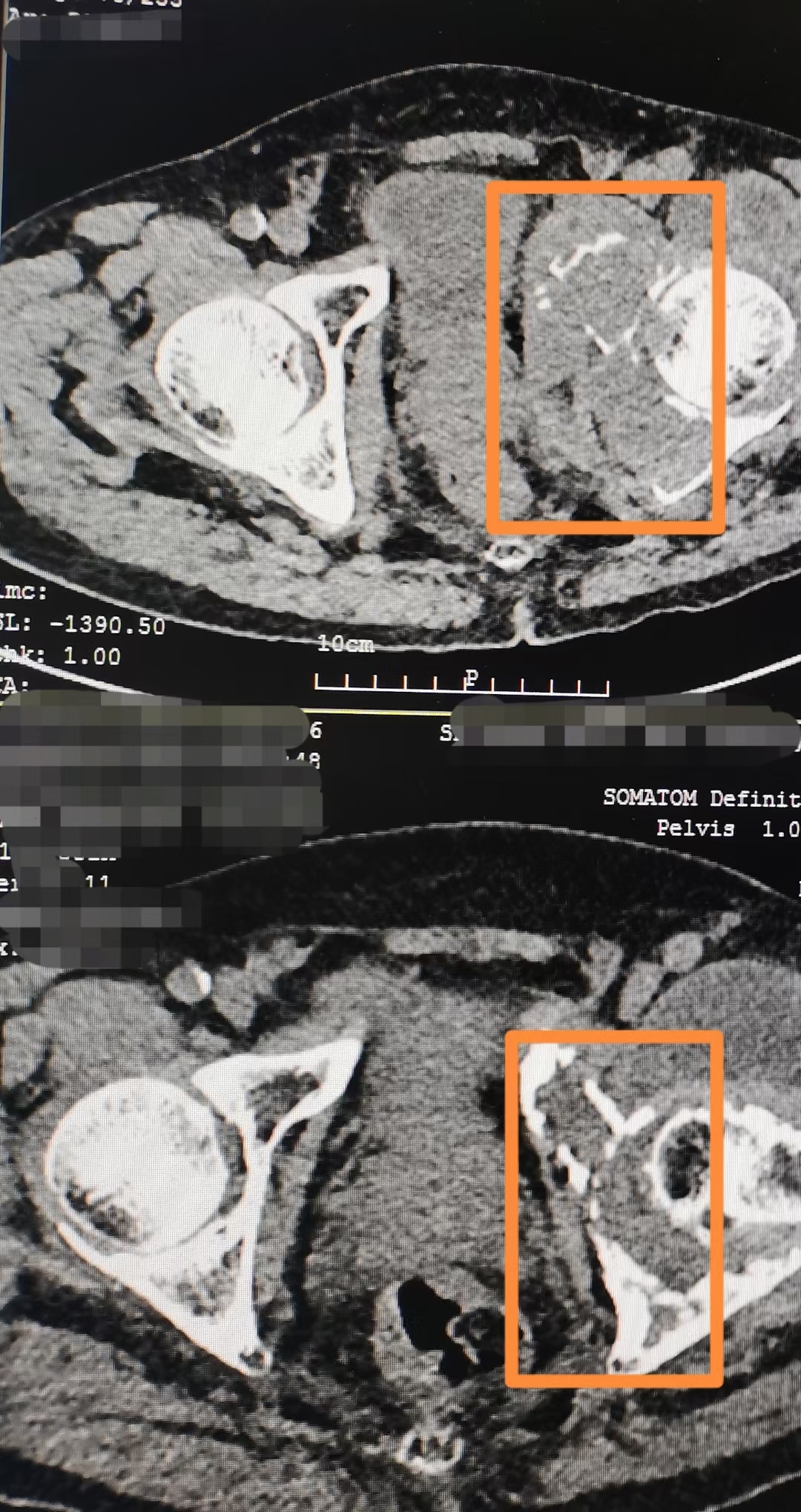 王湘连 副主任医师 复旦大学附属华东医院 放疗科26人已读
王湘连 副主任医师 复旦大学附属华东医院 放疗科26人已读 - 放疗—一把隐形的手术刀
放疗是肿瘤治疗中重要的治疗手段,在头颈部肿瘤,胸部肿瘤,腹盆腔及血液肿瘤中都有广泛的应用。约70%的肿瘤患者在不同时期需要接受放疗。放疗在不同的肿瘤中起着不同的作用,在某些部位,是根治性放疗,如鼻咽癌,宫颈癌,前列腺癌,早期肺癌等,有些是辅助治疗,如直肠癌,淋巴瘤,乳腺癌等,有些能够缓解患者的症状,促进功能修复,如脑转移,骨转移等。在合适的肿瘤合适的阶段,需要放疗的参与。肿瘤的治疗需要多学科讨论,多种治疗方式的联合应用,才能达到治疗效果最优,生活质量最佳的效果。以下是放疗前后肿瘤退缩的对比图
 王湘连 副主任医师 复旦大学附属华东医院 放疗科65人已读
王湘连 副主任医师 复旦大学附属华东医院 放疗科65人已读 - 引用 放疗小科普
身边常常有人问起,什么是放射治疗,哪些疾病需要放疗,放疗具体有哪些流程?接下来,简要地解释一下。 1. 什么是放射治疗? 放疗是放射治疗的简称,其利用聚焦的、高能量的放射线,破坏肿瘤细胞的遗传物质 DNA,使其失去再生能力从而杀伤肿瘤细胞。放疗与手术,化疗并称为恶性肿瘤治疗的三大手段。放疗被誉为 “ 隐形的手术刀 ” ,治疗的目标是最大限度地将放射线的剂量集中到病变内,杀灭肿瘤细胞,同时最大程度地保护邻近的正常组织和器官。近年来,放射治疗既用于恶性肿瘤治疗;也用于少数良性病的治疗。 2. 放射治疗的原理是什么? 放射治疗(RT)是利用聚焦的、高能量的放射线,破坏肿瘤细胞的遗传物质 DNA,使其失去再生能力从而杀伤肿瘤细胞。 3. 放射治疗是在医院的放射科进行吗? 不是,简单来说放射科是使用射线进行诊断的科室,放射科不治病,是检查科室;放疗科是使用射线进行治疗的科室,对肿瘤进行放射性治疗,用放射线杀死肿瘤细胞,目前和化疗,手术并列肿瘤治疗的三大主要手段。 4. 哪些肿瘤患者需要接受放射治疗? 约 70 % 的恶性肿瘤患者在疾病发展的不同阶段需要接受放疗。对于一个具体的患者来说,是否采用放疗应该按照肿瘤的规范化治疗原则,根据肿瘤的类型,发展期别以及患者的身体状况等而定。常见肿瘤,如脑胶质瘤、鼻咽癌及其它头颈部肿瘤、肺癌、食管癌、胃癌、胰腺癌、肝癌、胆囊癌、直肠癌、前列腺癌、乳腺癌、宫颈癌、淋巴瘤、转移性肿瘤以及晚期肿瘤止痛及解除梗阻等视病情均可能有放疗指征,具体情况请咨询肿瘤放射治疗科医生。 5. 非肿瘤病变可以进行放射治疗吗? 部分良性肿瘤或非肿瘤性疾病亦可采用放疗或综合治疗的方法,如疤痕增生(手术或疤痕切除术后24时间内行外照射),足底疣,血管瘤,纤维瘤,鼻咽纤维血管瘤,腮腺术后瘘,骨髓炎,色素绒毛结节性滑膜类,部分突眼性甲状腺肿可行球后照射等。 6. 放射治疗的种类有哪些? a. 射线:X射线,r射线,粒子射线(质子,重离子,中子)等 b. 方式:内照射,外照射 c. 设备:加速器,断层螺旋,r刀,射波刀,质子/重离子等 d. 时间:术前放疗,术中放疗,术后放疗,根治放疗,姑息放疗,急诊放疗等 7. 什么是内放射治疗? 内放射治疗也称近距离放射治疗,指辐射源放在体内,例如微小的种子或胶囊。在近距离放射疗法中,医生将辐射源放在癌症旁边或旁边。辐射仅影响癌症和癌症周围的区域。辐射不影响身体的其他部位。医生可以使用近距离放射治疗来治疗不同类型的癌症,通常包括前列腺癌,子宫颈和子宫内膜(子宫内膜)的癌症。 8. 什么是外放射治疗?患者有辐射性吗? 外放射治疗是指辐射源在体外,从患者外部传送辐射。外部光束放射治疗机器通过诸如钴-60的核素的放射性衰变产生电离辐射,或通过加速电子或其他带电粒子(如质子)产生电离辐射。离开机房,患者本身不带有辐射性。 9. 放射治疗流程包括哪些步骤? 在临床工作里,也遇到很多患者朋友询问“大夫,现在我们在干什么?接下来讲一讲放射治疗的流程: ①制定治疗方案:放疗前,医生根据病人个体情况制定放疗方案。向患者交代放疗注意事项及治疗预期大致效果等医学问题。(由医生来完成) ②体位固定及模拟定位:确定放射治疗方案后,由医生提出定位申请单,由医生、放射物理师、治疗师根据患者具体情况选择合适的体位(重复性好,固定性好、舒适度好)制作固定模具。根据患者病变位置,进行初步中心定位,进行CT扫描,获得影响信息,为医生勾画靶区,物理师做放射治疗计划做好准备。(由医生、物理师、治疗师协同完成) ③影像学资料初步处理及勾画靶区:由物理师接受图像进行三维重建,由医生进行靶区勾画(包括肿瘤,高危区域),及靶区周围的危及器官(正常组织,以便保护,由医生完成) 。 ④计划设计和评估优化:医生勾画完靶区后,有物理师进行设计,反复评估与优化,达到最好的效果(将病灶包全,将正常器官保护好),说起来这个道理很是容易,做起来及其的复杂。(由物理师完成) ⑤计划的验证:放疗前的最后一步工作,由放疗中心位置验证(复位)、射野验证和剂量验证。(由物理师、剂量师共同完成) ⑥最后确保准确无误后,我们就可以实施放疗了。(由治疗师完成)
王湘连 副主任医师 复旦大学附属华东医院 放疗科2291人已读 - 引用 面颈部肿瘤放疗:事前多准备,事后少反应
面颈部肿瘤远处转移相对较少,因此局部控制非常重要,放疗在面颈部肿瘤的治疗中地位举足轻重,可以保留患者的吞咽,发音,面容等等。在放疗过程中,一些患者会出现不同程度的皮肤反应,口腔疼痛或者口干等等,让一些人望而生畏,如果事前多做一些了解和准备,会大大降低不良反应,保证治疗顺利进行,对疗效和生活质量都有获益。 一 饮食指导1.放疗后味觉减退,且因口腔、口咽粘膜反应产生咽痛,宜为患者准备软烂、易于吞咽和消化吸收且营养全面、色香味俱全的食物,以增加食欲。温度适中,不要过冷过热。2.放疗过程中可出现粘膜反应,忌食辛辣刺激、硬质食物。3.高热量、高蛋白、高维生素、低脂肪、易消化的清淡饮食。4.多进蔬菜水果。多饮水。 二 口腔护理1.放疗开始后3年内不可拔牙,所以放疗前进行口腔科会诊,处理龋齿、洁齿及拔牙准备。2.保持口腔卫生,勤用漱口水漱口,如高露洁等(不是西帕依,金果饮)。3.发生口咽、口腔黏膜反应时,可使用天舒欣或利多卡因、维生素B、庆大霉素、地塞米松等混合的溶液口服消炎镇痛消肿。抗炎消肿及氨磷汀治疗。4.使用软毛牙刷。5.吞咽疼痛时进半流质。6.建议使用无糖口香糖,减轻放疗引起的口干。 三 皮肤护理1.穿柔软、低领棉质衣服,避免高领摩擦颈部,引起皮肤破溃。皮肤破溃时,勿使用纱布及衣物包裹,不透气易加重皮肤反应,保持干燥清洁最为重要2.可使用软毛巾轻轻擦拭,勿挠抓。3.勿涂擦沐浴液、肥皂水、碘酒、酒精。4.勿在阳光下暴晒,勿使用红外线等治疗。5.使用专用的放疗皮肤保护剂,比亚芬软膏、伯格曼防护喷剂、富林蜜、康肤生源,勿使用痱子粉及其他药膏。 四 功能锻炼1.张口锻炼:多做张口、咀嚼运动,可避免和减轻张口困难。予病人头颈部按摩,促进血液循环。每日做叩齿、鼓腮、微笑、舌体运动,锻炼咀嚼肌及颞颌关节,以预防肌肉萎缩、关节硬化,提高面颈部肌肉肌力。此为远期反应,强调 放疗结束后仍需坚持。2.咽津:做吞咽动作,可刺激唾液腺分泌,运动舌头及颊部肌肉,防止口腔功能退化。3.颈部锻炼:头颈部侧弯、旋转及按摩等锻炼颈部肌肉。 五 放疗全疗程结束后半月,开始使用洗鼻器冲洗,去除局部分泌物及坏死物
王湘连 副主任医师 复旦大学附属华东医院 放疗科947人已读 - 引用 “华东医院张国桢肺部微小结节诊疗中心”正式成立
随着低剂量胸部CT筛查的普及,偶然发现、无临床症状的肺内微小结节(<1厘米)的检出率越来越高,已经引起社会的广泛关注。肺内微小结节的定性诊断非常重要,直接关系着后续的治疗、预后及随访。准确的诊断与合理的治疗将有助于保证患者的生活质量和预期寿命,对于患者个人及其家庭乃至整合社会都意义重大。目前国内尚未有专门针对肺微小结节的多学科联合诊疗门诊/中心。为了进一步扩大我院的影响,巩固我院的诊疗特色,培养人才梯队,在俞卓伟院长的关心下,正式成立“华东医院张国桢肺部微小结节诊疗中心”。该中心由全国著名的肺内小结节研究和影像诊断权威、上海市“十佳医技工作者”、我院著名专家张国桢教授领衔,影像科李铭博士、胸外科吕帆真主任和放疗科郑向鹏副主任医师共同参与会诊。张国桢教授领导的团队已经在肺小结节的检出和诊断鉴别方面做出了大量的工作,在国内享有很高的威望;我院胸外科在吕帆真主任的带领下,以胸腔镜为代表的早期肺癌微创手术效果良好;我院放疗科郑向鹏副主任医师主持开展的早期肺癌立体定向放疗亦很成熟。必要时还将邀请呼吸科、肿瘤内科和病理科的专家协同会诊。联合诊疗中心将对患者肺内的可疑微小结节作出全面评估,并制定个体化的治疗方案,使患者得到“一站式”的诊疗服务,最大程度地满足患者看病治病的需求。为了方便市民就诊,联合诊疗中心的门诊时间特设在周末。具体时间为每周六的上午8:00-12:00;门诊位于8号楼3楼308室。患者可通过华东医院特需门诊进行预约登记就诊。特需门诊预约电话为:62483180-30201。
郑向鹏 主任医师 复旦大学附属华东医院 放疗科2.4万人已读 - 引用 肿瘤放射治疗的常见问题?
“根据世界卫生组织(WHO)的数据,超过60%的恶性肿瘤及部分良性肿瘤患者需行放射治疗。但由于种种原因,很多患者错失放射治疗时机,导致肿瘤无法彻底根治或过早复发。因此强烈建议肿瘤患者在治疗前寻求多学科会诊,或咨询肿瘤放疗科医师!”Q: 什么是肿瘤的放射治疗?A: 肿瘤放射治疗与手术、化疗并列为肿瘤治疗的三大主要手段。放疗利用射线(X或伽玛射线)聚焦于肿瘤区域而杀灭肿瘤细胞。Q: 进行肿瘤放射治疗的最佳时机?A:根据肿瘤的特点,可行单纯放疗,或于术前、术中或术后进行放疗,或与化疗联合应用,以获得最佳的肿瘤治疗效果。如果已行手术,宜尽早进行,最晚不应迟于术后三个月。Q: 哪些肿瘤及临床症状适合放射治疗?A: 常见肿瘤,如脑胶质瘤、鼻咽癌及其它头颈部肿瘤、肺癌、食管癌、胃癌、胰腺癌、直肠癌、前列腺癌、乳腺癌、宫颈癌、转移性肿瘤以及肿瘤止痛治疗等视病情均可能有放疗指征,详情请咨询肿瘤放疗科医生。Q: 放射治疗如何进行?A:放射治疗基本上分为两类,体外照射和体内照射,分别简称为外放疗和内放疗。外放疗利用直线加速器或伽马射线源从体外对体内病灶进行照射;内放疗则经由静脉或组织穿刺方式向病灶内引入放射性药物,对肿瘤进行照射。Q: 接受放射治疗的患者本身有无放射性?是否需要隔离?A:接受外放疗的患者自身不存在放射性,因此治疗过程中无需隔离;内放疗患者由于使用放射性药物,存在一定的放射性,可能需要进行一定时间的隔离,具体需视所用放射性药物半衰期及治疗剂量由医师决定。Q: 肿瘤放射治疗有无毒副反应?A:肿瘤放疗属局部治疗,治疗过程无创、无痛,无全身性毒副作用,仅可能于治疗部位出现某种程度的反应。视治疗部位不同,症状有异,如头颈部肿瘤患者可能出现口腔溃疡或口干;胸部肿瘤患者可能发生气喘气促和吞咽不适;肠道肿瘤则易发生腹痛腹泻;多数症状较轻微,治疗结束一段时间后即可自行缓解。Q: 放射治疗是否影响血象(或血细胞)?A:与化疗不同,绝大多数放疗方案无血液毒性反应,不会导致骨髓抑制,不会导致血象或血细胞下降。因此很多不能耐受化疗的患者,可以很好地接受放射治疗。Q: 放射治疗是否会导致肿瘤转移?A:“放疗促进肿瘤转移”是很多患者及家属甚至医生担忧的问题,该问题似是而非,以讹传讹。目前尚无证据支持此论点。科学合理的解释是肿瘤内存在放射不敏感细胞(如同耐药细菌),放疗杀灭敏感肿瘤细胞后,这些细胞可能因获得营养增多而增殖。因此,很多肿瘤在行放疗时,需联合化疗或其它药物治疗,以根除此类不敏感细胞。Q: 放射治疗是否需要住院治疗?A:放疗副反应轻微,多数患者可于门诊完成治疗疗程,无需住院。Q: 放射治疗的费用?A:肿瘤不同,病情复杂程度不同,所有治疗技术不同,均可影响放射治疗的最终费用。与化疗一样,肿瘤放疗属大病医保范畴,有专门的医保代码。
郑向鹏 主任医师 复旦大学附属华东医院 放疗科6242人已读 - 引用 【营养支持】肿瘤放/化疗过程中的营养支持
营养支持是癌症治疗的重要组成部分。充足和均衡的营养对于耐受治疗和治疗后的恢复非常重要。目前有关肿瘤患者营养和治疗支持的资讯众多,充斥着很多不负责任的互相矛盾的观点、看法,甚至是谬误,令许多患者无所适从。肿瘤的营养和支持治疗是严肃的科学概念,非简单的食疗。本文及后续数篇文章将参考最具权威性的美国癌症学会出版的《肿瘤患者的营养完全指南》第二版(American Cancer Society: Complete Guide to Nutrition for Cancer Survivors; Second Edition;www.cancer.org),简明扼要地介绍肿瘤患者的营养支持策略。除非特别注明,文中内容均源于上述“指南”。第一部分:均衡营养l.蛋白质蛋白质为身体提供所需的氨基酸,是身体生长、组织修复和免疫维持不可缺少的营养成分。良好的蛋白质来源包括鱼,家禽,瘦红肉,鸡蛋,低脂肪的乳制品,坚果,干豆,豌豆和小扁豆,豆类食品。许多证据显示,对于肾功能不良的患者,植物性蛋白质更为有益。肿瘤患者需要多少蛋白质?与健康人相比,肿瘤患者需要摄取更多的蛋白质。通常,大多数肿瘤患者在治疗过程中每天摄取的蛋白质约为每公斤体重至少1克蛋白质,即对于一个60公斤的患者,其每天应补充的蛋白质不应低于60克。许多治疗开始前已经非常消瘦的患者,蛋白质储备消耗严重,应补充更多。2.脂肪脂肪通常分为两类,饱和脂肪和不饱和脂肪。不饱和脂肪可再分为单不饱和脂肪,多不饱和脂肪,omega-3脂肪酸,omega-6脂肪酸及反式脂肪。单不饱和脂肪酸和多不饱和脂肪优于饱和脂肪或反式脂肪。单不饱和脂肪主要是植物油,如橄榄油,菜籽油,花生油。多不饱和脂肪酸主要是植物油,如红花,向日葵,玉米,和亚麻籽;也是海鲜中的主要脂肪成分。饱和脂肪酸则主要存在于动物,如肉类及家禽,全脂肪低脂牛奶,奶酪,黄油。一些植物油如椰子,棕榈仁油,棕榈油也是饱和脂肪酸。饱和脂肪酸将导致胆固醇升高,增加发生心脏疾病的风险。因此应尽可能避免或减少摄入这些食物。癌症患者应该限制每日摄取能量中来自饱和脂肪酸的比率不超过10%。反式脂肪酸是在植物油经人工处理形成人造黄油或缩短脂肪酸链的过程中产生的。反式脂肪的来源包括部分由氢化植物油或植物起酥油制成的快餐食品和焙烤食品。反式脂肪也存在于一些动物产品,如奶制品。反式脂肪可提高血液内“坏”胆固醇的水平,同时降低“好”胆固醇的水平。研究显示,反式脂肪将增加心血管疾病和肿瘤的发生风险。因此应尽量降低反式脂肪的摄入。3.碳水化合物碳水化合物是身体能量的主要来源。碳水化合物的最佳来源——水果,蔬菜和粗粮,同时也提供了人体细胞所需的维生素和矿物质,纤维素和植物营养素。全谷物粗粮包括麦片,面包,面粉和饼干等含有丰富的碳水化合物。糙米,大麦等也可以作为副食。当在超市中选择全谷物产品,注意下列关键词语,“全谷物”,“全麦面粉”,“全燕麦粉”或“全黑麦面粉”等。碳水化合物的其它来源还有面包,土豆,大米,面条,通心粉,麦片,玉米,豌豆和豆类。甜食(甜点,糖果,饮料用糖)也可以提供碳水化合物,但所含维生素,矿物质等则很少。碳水化合物分为三种:复杂碳水化合物(如蔬菜、坚果、籽、豆子和全麦),简单碳水化合物(如白面包、各种淀粉类食物)和各种糖类(如白糖、红糖、蜂蜜、含糖饮料和甜点等)。所有碳水化合物都在小肠内分解为糖后被身体吸收,进而提高血糖水平。身体通过产生胰岛素调节血糖浓度。研究已经证明,胰岛素水平增高将增加肿瘤发生的风险。虽然所有碳水化合物最终都分解为糖,但不同食物的分解速度并不相同。根据食物摄入后引起血糖变化的快慢和高低以“血糖指数”对碳水化合物进行分类。高血糖指数食物可快速显著地升高血糖,这类食物包括高度加工处理去除麸皮或壳等的食物。而全麦食物等则吸收较慢,对血糖水平的影响较缓,因而为低血糖指数食物。同时食用蛋白质和脂肪可影响碳水化合物分解的速度,从而影响血糖升高的速度以及胰岛素的波动程度。例如,在面包上添加牛油将有助于降低血糖的升高的幅度;而很多甜性碳酸饮料常能迅速升高血糖,导致胰岛素水平快速增高。高血糖指数食物(对血糖影响迅速)包括:土豆白米饭白面包香蕉甜性软饮料精面制品糖,蜂蜜,糖浆,其它天然甜味剂低血糖指数食物(对血糖影响和缓)包括:全麦食品糙米小米全小麦大麦大多数豆类大多数蔬菜对于肿瘤患者,应该更多选择: 低血糖指数食物; 加工程度低的全麦食物; 少食精制食品和糖制品,包括甜性饮料; 可同时食用蛋白质及脂肪制品纤维素不能被人体消化。有2种类型的纤维素:不溶性纤维素有助于通便,可溶性纤维素则通过结合水分,软化大便,不致便秘。某些肿瘤患者在治疗过程中,为了避免加重或减轻胃肠道不适,可能需要限制或增加含纤维素食物量。具体情况应咨询自己的主治医生。4.水每天尽可能多喝水。一个人每天至少应该喝2升水。如果同时有腹泻或呕吐的话,应适当增加饮水。尽可能避免含糖饮料以及含咖啡因的饮料。5.维生素和矿物质人体需要少量的维生素和矿物质以维持其正常机能。在平衡饮食保证足够的能能量和蛋白质摄入的情况下,人体不需要额外的补充维生素和矿物质。对于某些癌症患者,很难维持平衡饮食,在这种情况下,则需要服用复合维生素和矿物质。甚至,某些癌症患者需要服用大剂量维生素、矿物质或其他营养补充剂,以尽可能提高他们的免疫系统帮助摧毁癌细胞。但大剂量应用维生素并不是无害的。一些维生素和矿物质可能会降低化疗和放射治疗的疗效。因此,是否服用维生素和矿物质补充药片,以及服用的剂量需要与医生讨论后决定,不可擅自服用。6.抗氧化剂抗氧化剂包括维生素A,C,E,硒,锌和某些酶,它们可以吸收自由基,防止它们对正常细胞形成伤害。摄取更多抗氧化剂的最佳办法是吃各种水果和蔬菜。化疗或放射治疗时,不建议大剂量服用抗氧化补充剂或维生素强化食物或液体。7.中草药草药用于治疗疾病已数百年,结果好坏参半。今天,在许多产品中可以发现草药的成分,如药丸,液体提取物,茶,和药膏等。许多产品无害,可以安全使用;但部分则可能会导致严重有害的副作用。有些甚至可能干扰癌症治疗,包括化疗,放射治疗以及患者的术后康复。因此在接受肿瘤放/化治疗时,如果希望同时应用中草药治疗,最好首先咨询您的主治医生。8.尽可能限制红肉及加工过的肉类红肉含有蛋白质,铁,维生素及矿物质,同时也含饱和脂肪酸和胆固醇。过量使用红肉和加工过的肉类将增加结肠癌的发生风险。为了均衡营养,可在全麦、蔬菜、鱼、鸡肉饮食内适当添加一定量的红肉。通常每周不应超过三次,每次的红肉量应少于2两(100克左右)。9.限制酒精类饮料的摄入过量的酒精摄入将增加患口咽癌、食管癌、肝癌和乳腺癌的风险。通常,每天的啤酒、红酒或白酒量应分别限制在360ml(一听),150ml(三两)和50ml(一两)以内。
郑向鹏 主任医师 复旦大学附属华东医院 放疗科2247人已读 - 引用 【治疗】肺癌放疗复发后再次放疗
肺癌是目前最常见的恶性肿瘤之一,据统计,2009年美国新发肺癌患者219 440例,死亡159 390例,故也是最主要的癌症杀手(Jemal et al. 2009)。国际癌症研究机构(IARC)最近的数据显示2008年全世界范围内有160万新发肺癌患者(其中男性138万,女性95万),2010年共138万患者死于肺癌(其中男性95万,女性43万)。因此,肺癌对于世界健康卫生组织而言是个巨大的问题和严峻的挑战(IARC 2010)。 人们花费大量时间、精力、财力等以优化其诊疗方式。近十年来,新的诊断方法层出不穷,包括新的分子肿瘤学方法如目前广泛使用的正电子发射断层摄影术(PET)(与CT扫描联合使用)对肺癌进行诊断与分期(Vanuytsel et al. 2000; Videtic et al. 2008),同时其也被用于优化放射治疗计划 (Nestle et al. 1999, 2006; Faria et al. 2008; Schaefer et al. 2008; MacManus et al. 2009; Grgic et al. 2009; Hanna et al. 2010; Riegel et al. 2010; Wu et al. 2010)。在治疗领域,革新的方法主要有电视胸腔镜手术(VATS)、新的精确放射治疗方法(三维适形放疗、调强放疗、立体定向放疗)以及新的化疗药物(第三代细胞毒药物,靶向药物)。这些方法使得肺癌的诊断和治疗变得更加有效,但目前仍然存在一些问题,尤其是只有小部分的肺癌患者被早期发现,从而获得手术治愈的机会。绝大多数的非小细胞肺癌和几乎所有的小细胞肺癌患者发现时已经失去手术机会,对于这些患者来说,放疗和/或化疗,单一治疗或联合治疗在过去的20年中已成为主要治疗方法,并在全世界范围内广泛应用。即使目前出现了新的生物学以及技术学进展,肺癌的诊治依然没有取得质的飞跃,不论组织学(非小细胞肺癌或小细胞肺癌),分期(早期,局部晚期或晚期转移性),初始治疗(手术,放疗,化疗或联合治疗),复发仍然是肺癌治疗后出现的主要事件。很多报道显示肺癌初始治疗后迅速出现复发,或几年后即出现治疗失败。所有复发的原因大致分为三类,局部(如肺实质、支气管残端或胸壁)复发、区域(如纵隔淋巴结)复发和远处转移(脑、肝、肾上腺、骨或对侧肺)。同一患者可能出现多种复发情况,一旦发生,都是致命性事件且无有效的治疗手段。另外,复发会导致很多临床症状的出现,需要进一步对症支持治疗,同时会出现生活质量急剧下降和治疗增益比的下降。 单纯肺实质内出现的复发(同侧或对侧肺),应当将治疗后肺实质内复发与异时性肺内第二原发肿瘤区别对待。异时性第二原发肺癌在原发肺癌治疗后出现,其有特殊的诊断标准以区别于复发或转移性肺癌(Martini and Melamed 1975)。第二原发肿瘤有以下特征:(I)组织学不同或(II)组织学与原发肺癌相同,但(a)距原发肿瘤发生至少2年,(b)第二肿瘤起源于原位癌或(c) 第二肿瘤位于不同肺叶或对侧肺,但确诊时无淋巴管癌栓及肺外转移。虽然本文不涉及第二原发肿瘤的讨论,对早期(I-Ⅱ期)非小细胞肺癌 (Jeremic et al. 2001)和Ⅲ期非小细胞肺癌(Kawaguchi et al. 2006)的研究发现,随着时间的推移,肺癌幸存者罹患第二原发肺癌的风险增加。放疗在第二原发肺癌治疗中亦发挥重要作用(Jeremic et al. 2001)。 首要的问题很简单:治疗或是不治疗?如今看来这个问题似乎有点过时,尤其是在西方国家,延长患者的生命是第一位的。最近Hung等(2009)再次证实积极的治疗优于单纯支持治疗。下一个问题是采用根治性治疗还是姑息性治疗?更多的会选择根治性方法,特别是手术和放疗。许多研究由于样本量过小而无法获得对治疗决策有贡献的预后指标,然而复发后疾病分期以及体力状况影响着治疗方式的选择。 肺癌经任何治疗模式(外科、放疗和化疗)或联合治疗后都可能出现复发,同样,以上的任何治疗手段也能治疗肺癌复发。是否考虑外科(再次手术)治疗复发性肺癌,既往完全切除与否是主要因素,同时无其它复发灶,无伴随疾病。另外,肿瘤复发部位及分期对治疗决策起重要作用。已进行了一系列大型的外科研究(Gabler and Liebig 1980; Dartevelle and Khalif 1985; Watanabe et al. 1992; Voltolini et al. 2000),6000多例局部复发患者,1%-1.7%患者接受了根治性手术,大多数再手术患者为肺内复发。大多数再手术患者预后不佳,2年生存率仅23%(Pairolero et al. 1984),中位生存时间7-26个月(Becker et al. 1990; Lesser et al. 1997; Voltolini et al. 2000; Westeel et al. 2000)。最近的小样本研究(n = 12)报道5年生存率为15.5%(Voltolini et al. 2000)。分期较早的复发性肺癌在肺全切术后具有更高的局部控制和总生存率,虽然病例中包括第二原发肺癌,I期的5年生存率约50%,II期达40%(Regnard et al. 1999)。Hung等(2009)报道I期肺癌患者初始手术治疗后再次复发的1、2年生存率分别为48.7% 和17.6%。研究显示对于局部复发患者采取根治性手术生存率优于采取放疗和/或化疗患者,更优于不采取任何治疗的患者。然而,单纯局部复发患者治疗后生存时间与同时存在局部复发和远处转移的患者无明显差别。尽管研究采用更新的治疗策略包括更完善的随访程序以及可选的治疗方式,但得出的结果仍不尽人意。近年来出现了一些新的治疗理念,例如对既往放化疗或立体定向放射治疗后复发患者采取外科模式治疗。Bauman等(2008)报道24例放疗后(其中22例为同步放化疗)复发患者进行手术治疗,中位生存时间30个月,3年生存率47%。最近的两例来自日本的个例报道(Suzuki et al. 2007; Neri et al. 2009)显示I期非小细胞肺癌患者采用三维适形放疗或立体定向放射治疗后复发采取肺叶切除术,无瘤生存时间超过12个月。 放疗可以用来治疗手术后胸腔内各个部位的局部或区域复发肺癌。胸腔内局部或区域复发分为胸壁/胸膜、肺实质、支气管残端和纵隔淋巴结复发,单一或合并出现。许多报道显示了其有效性(Green and Kern 1978; Kopelson and Choi 1980; Law et al. 1982; Shaw et al. 1992; Curran et al. 1992; Yano et al. 1994; Leung et al. 1995; Emami et al. 1997; Kagami et al. 1998; Kono et al. 1998; Jeremic et al. 1999a, b)。这些研究显示,与复发部位一样,剂量强度尤其是高剂量对治疗效果具有重要影响。支气管残端复发预后好于胸壁/胸膜或纵隔淋巴结复发。Jeremic 和 Bamberg(2002)对仅有支气管残端复发而无胸内其它部位复发的有关文献进行分析,发现中位生存时间近28.5个月,5年生存率为31.5%。该研究明确了外照射可作为这类复发患者的治疗选择。在Jeremic 等的 (1999a, b)一个早期(如I期:T2N0)支气管残端复发的小型亚组研究中(n = 7),仅7例样本的早期(T2N0)支气管残端复发病例中,使用高剂量外照射(≥60 Gy),5年生存率达57%,几乎接近非小细胞肺癌首诊后单纯手术治疗效果(Mountain 1986; Naruke et al. 1988)。一个有趣的难以解释的现象是这一生存率几乎优于首次治疗时采用高剂量常规照射或超分割照射治疗同期别非小细胞肺癌的结果(Ono et al. 1991; Morita et al. 1997; Jeremic et al. 1997; Sibley et al. 1998; Hayakawa et al. 1999; Jeremic et al. 1999a, b)。Law等(1982)对气管、支气管广泛复发进行了研究,结果也进一步支持外照射在支气管残端复发治疗中的有效性。患者中位生存时间达19个月,1年、3年生存率分别为75%和12.5%。结果表明,尽管病灶广泛,只要仍是局部疾病(无淋巴结转移),仍然能从放射治疗中获益。一旦残端合并其它部位复发,例如区域淋巴结,则生存率立即出现下降(Curran et al. 1992; Jeremic et al. 1999a, b; Kagami et al. 1998; Kono et al. 1998)。 外照射也用于治疗既往曾接受放疗的胸腔内局部或区域复发性肺癌,尤其是非小细胞肺癌。到目前为止,仅有9篇英文文献报道249例患者的治疗结果。尽管文献报道对于胸部疾病,可采用放疗进行再次治疗,但到底哪部分原先接受胸部放疗的患者在疾病自然进程中可进行再程照射仍不明确。Estall等(2007)研究了接受多次放疗的肺癌患者,尽管预期首次治疗时采用放疗的比率为76%(Delaney et al. 2003),但实际比率为52%。首程放疗应用于大部分胸内病灶局限的病例(79%),二程、三程放疗患者比例分别为22%和21%。治疗疗程增加,各疗程之间的时间间隔缩短,总剂量以及分割次数同样减少,反映了终末期患者体力状况和预后变差。尽管这些数据有助于完善胸部肿瘤治疗模式,但研究仅覆盖两年时间(1993、1996),没能进一步延长研究时间。另外,不同地区/国家/研究所对于肺癌具有不同的首程和再程放疗比率,但是其它地区/研究所没有类似的研究以提供更详细的数据。 一些观点认为,应用再程放疗具有挑战性。首先,极少的数据能证实再程放疗的有效性,难以确定达到根治性或姑息性治疗的剂量和疗程,同时不能忽略再程放疗导致的毒性反应,尤其是既往曾接受高剂量的根治性放疗。然而,早期研究报道了复发性肺癌再程放疗的可行性和有效性(Green and Melbye 1982; Jackson and Ball 1987; Montebello et al. 1993)。这些回顾性研究偏向于手术后复发以及术后辅助放疗后转移或第二原发肺癌的病例。首程放疗剂量范围25-80 Gy,复发时照射剂量6-70 Gy,累积剂量43-150 Gy。几乎没有患者接受第三程放疗(二程再放疗)。首程放疗或多或少对未累及淋巴结进行预防照射,而再程放疗时治疗靶区明显限制在可见的复发区域,安全边界1-2cm(Green and Melbye 1982; Jackson and Ball 1987; Montebello et al. 1993; Gressen et al. 2000; Okamoto et al. 2002)。为防止过多的毒性反应发生,尤其是肺和脊髓,应控制再程放疗的总剂量和照射范围。再程放疗的主要目的是减轻症状,2000年Gressen等(Gressen et al. 2000)综述了此类相关报道,再程放疗对咯血控制率为83%,咳嗽为65%,呼吸困难和胸痛的控制率分别为60%和64%,再程放疗引起的并发症发生率低于预期,仅有5%(Green and Melbye 1982; Jackson and Ball 1987; Montebello et al. 1993; Gressen et al. 2000; Okamoto et al. 2002)。最常见的并发症为放射性肺炎,发生率为3%,放射性脊髓病及肋骨骨折罕见。最近的研究报道了较高的放射性肺炎发生率 (Okamoto et al. 2002),该研究对有症状和无症状的患者进行了再程放疗,在接受累积剂量12-150 Gy后发生2级(中度)放射性肺炎。这使得研究者能有机会使用更高剂量的照射,患者接受中位照射剂量45 Gy,症状缓解率为75%,而既往研究中平均剂量为30 Gy(Green and Melbye 1982; Jackson and Ball 1987; Montebello et al. 1993; Gressen et al. 2000),症状缓解率为48%-72%。这意味着高剂量在不增加重度(≥3)放射性肺炎发生率情况下可能带来高缓解率,该研究中位生存时间达8个月,2年生存率为27%,接近根治性和高剂量治疗的效果,其中位生存时间15个月,2年生存率51%。而早期研究(Green and Melbye 1982; Jackson and Ball 1987; Gressen et al. 2000)中位生存时间为5个月。另外,研究发现70岁以下和70岁以上的患者其治疗效果无差异(Gressen et al. 2000),意味着外照射在复发性肺癌上具有更广的适应症,尤其是姑息性治疗或可忽略发生严重远期副反应时。Krame等最近的研究(2004)证实了这一观点,研究采用8 Gy分2次照射,一周完成。中位生存时间为5.6个月,71%的患者获得一个或一个以上症状部分或完全缓解。呼吸困难、咯血和咳嗽的缓解率分别为35%、100%和67%。45%的患者治疗后KPS评分增加,症状缓解时间达4个月。 与Kramer等(2004)的研究不同,Tada等(2005)采用根治性治疗,19例Ⅲ期非小细胞肺癌患者接受50 Gy/25F,1次/天照射,有1例接受60 Gy/30F,1次/天照射,5例患者未完成处方的再程照射剂量。首程放疗与再程放疗之间的时间间隔为5-60个月(中位16个月)。再程放疗照射野平均大小为64 cm2 (30-204 cm2)。结果总缓解率为43%,1、2年生存率分别为26%、11%,中位生存时间为7.1个月。研究发现体力状况对生存时间存在影响,各组生存时间分别为12.6个月(PS 0–1)、7.1个月(PS 2)和1.1个月(PS 3)。有14例患者完成处方剂量照射,其中位生存时间为10.5个月。除了1例胸痛患者,其余所有患者症状均得到改善,1例患者发生3度放射性肺炎,2例患者发生2度食管炎。2003年Wu等(2003)首次报道了外照射后局部复发肺癌患者进行再程放疗的前瞻性I–II期临床研究结果。研究共入选23例患者,年龄43-79岁,中位年龄68岁,9例鳞癌,7例腺癌,7例小细胞癌。原分期Ⅱ期7例,Ⅲ期16例。首程放疗与复发间隔时间6-42个月(中位13个月)。首程放疗中位总剂量为66 Gy(30-78 Gy),再程放疗使用三维适形技术,常规分割,靶区主要为可见复发区域,中位总剂量51 Gy(46–60 Gy)。再程放疗后,中位生存时间14个月,2年生存率21%,2年局部无进展生存率42%。9%的患者发生1-2度食管炎,22%患者发生1-2度肺炎,随访期间未发生3度以上毒性反应(再程放疗结束后中位随访时间15个月),17例(74%)发生0-1度远期毒性,6例(26%)CT检查发现肺纤维化,其中2例患者存在相应症状(3度)。这一研究使用了新的、广泛应用的适形技术,值得进一步推广,适用于局部区域复发患者,可以不考虑首程放疗的影响,但远期毒性需要更长时间的观察才能获得结论。 近年来,首次报道了使用高度精确放疗技术治疗非小细胞肺癌。Poltinnikov等(2005)首次通过大分割立体定向技术治疗17例放疗后复发患者,所有患者首次治疗为同步放化疗,中位剂量52 Gy(50-66 Gy)。首程放疗完成至再程放疗开始之间中位时间间隔为13个月(2-39个月)。大分割中位总剂量为32 Gy(4-42 Gy),中位分割剂量为4 Gy(2.5-4.2 Gy),每周3-5次照射。5例患者进行同步化疗,5例(29%)患者影像学证实肿瘤缓解,5例(29%)疾病稳定,再程放疗后中位生存时间为5.5个月(2.5-30个月)。11/13例 (85%)患者症状缓解,2例(15%)患者症状未缓解,研究未观察到3度或以上的副反应。 2008年另两篇文献也同时报道了采用立体定向放疗治疗复发性非小细胞肺癌的结果。Chang等(2008)采用基于四维CT的放疗计划治疗14例孤立性复发肿瘤,给予40-50 Gy的照射剂量,这些患者既往已接受根治性放疗,或联合化疗以及手术。中位随访时间17个月(6-40个月),治疗区域接受50 Gy照射的局部控制率为100%,其中3例(21%)患者出现纵隔淋巴结转移,5例(36%)出现远处转移,4例(29%)患者出现2度放射性肺炎。Coon等(2008)报道了类似的分次立体定向放射治疗技术,其采用新的照射技术赛博刀,共入组复发病例12例,总剂量60 Gy,分3次照射,大部分患者使用PET/CT来勾画肿瘤区。所有患者通过CT或PET/CT进行疾病随访。结果总缓解率75%,17%的患者疾病稳定,1例(8%)患者7个月后出现局部复发,9例 (75%)患者出现局部、区域复发或远处转移,中位疾病进展时间3个月(2-7个月)。中位随访时间11个月,局部控制率92%,总生存率67%。图1示赛博刀剂量分布。2008年Zimmermann等(Zimmermann et al. 2008)报道了研究的进展摘要,全文值得期待。这些数据为大分割立体定向再程放射治疗的应用带来了曙光。 Beavis等(2005)首次报道了另一放疗技术-束流调强放疗(IMRT)在非小细胞肺癌复治中的作用。虽然调强放疗技术与常规放疗技术相比,对于危及器官的剂量分布相似,但靶区剂量分布,IMRT具有优越性。由于调强放疗的优越性(如肿瘤的部位和外形同样适合再程放疗),其应用越来越广泛,在肺癌的再程放疗中将起重要作用。 最近Cetingoz等(2009)报道了目前最大宗病例使用再程外照射治疗38例非小细胞肺癌的研究,大部分患者(81%)由于存在不良预后因素如疾病晚期、体力状况差、显著的体重下降、既往接受了姑息放疗。首程放疗时剂量范围28.8-67.2 Gy(中位30 Gy),分割数9-33次(中位10次), 分割剂量2.0-3.2 Gy。首程放疗与再程放疗中位间隔时间仅8个月(1-42个月),再程放疗为姑息性目的。再程放疗中位总剂量25 Gy(5-30 Gy),中位分割次数10次(1-10次),中位分割剂量3 Gy(2-10 Gy),中位总生存时间(首程放疗开始计算)13.5个月(4-65个月),而再程放疗后的中位生存时间为3个月(0-65个月)。疾病确诊后的1年生存率57.8%,2年生存率28.8%,再程放疗后的1年生存率8.7%,2年生存率5.8%。80%的患者症状改善,咯血、咳嗽、呼吸困难及胸痛缓解率分别为86%、77%、69%和60%。接受再程放疗的时间间隔在35周及以上者的生存时间长于时间间隔在35周以内者。仅1例患者发生3度食管炎。图2示1例行姑息性再程放疗患者情况。 综合目前相关文献,尤其是最近的研究使用了高度精确的放疗计划和先进的放疗技术,如下问题仍然应当考虑:1.由于使用不同的照射技术导致照射参数存在较大差异,尤其是照射总剂量、分割剂量和处方剂量的差异,以及剂量不均匀性是否得到修正的问题;2.目前的趋势是肿瘤外放边界尽量小,但是否是为某个特殊的复发肿瘤而设定或是常规技术要求不得而知;3.应用不同的毒性反应评分系统报告再程放疗期间及结束后出现的毒性事件已成为一种趋势;4.近期的研究对首程放疗与再程放疗的时间间隔进行了详细描述(Okamoto et al. 2002; Wu et al. 2003; Tada et al. 2005; Poltinnikov et al. 2005; Cetingoz et al. 2009),但并非每个研究均对此进行了描述(Chang et al. 2008; Coon et al. 2008)。对于首程放疗与再程放疗时间间隔的研究对理解自然病程、潜在的预后因素以及减少两次照射期间预期发生的毒性反应的严重程度具有重要作用。各项研究中,再程放疗最早开始于首程放疗后1-6个月,最迟39-87个月,中位值13-16个月(Wu et al. 2003; Tada et al. 2005;Poltinnikov et al. 2005),而Cetingoz等(2009) 的报道为8.5个月,Okamoto等(2002)报道为23个月。确定首程放疗与再程放疗时间间隔研究的重要性来自于Tada等 (2005)的研究结果,除了体力状况,两次照射之间的时间间隔也是影响疗效的重要因素。时间间隔在12个月以下、12-18个月和18个月以上的患者中位生存时间分别为2.1个月、7.1个月和11.5个月。虽然Gressen等(2000)的研究未发现这一影响,但Cetingoz等(2009)的研究采用多变量分析表明,时间间隔是影响总生存率的唯一独立预后因子。这些发现意味着时间间隔长者可能肿瘤侵袭性较低,但放射肿瘤医生更偏向于使用更高剂量来治疗这类患者。 放疗通常不用来治疗局部复发的小细胞肺癌。对于既往接受同步放化疗的局限期患者,再程放疗只会增加毒性而不能使患者获益。对于广泛期患者,首次化疗后出现复发同时伴有症状的患者,可考虑放疗。一些回顾性研究(Ihde et al 1979; Ochs et al. 1983; Salazar et al. 1991)分析了使用21-60 Gy剂量照射治疗复发的局限期和广泛期小细胞肺癌。尽管照射野内的病灶缓解率为52%-77%,但其中位生存时间仅3-4个月,与早期进展的生存率相似。然而较宽的剂量分布使得一些学者认为更高剂量(≥40 Gy)的照射可能为患者有限的剩余生命里带来更高的姑息缓解率。【来源】《肿瘤再程放疗》,Carsten Nieder,Johannes A. Langendijk,eds;许亚萍,郑向鹏 主译。人民军医出版社,北京,2012.
郑向鹏 主任医师 复旦大学附属华东医院 放疗科9302人已读 - 引用 【治疗】影像引导精确放射治疗(IGRT)
过去十年间,影像引导放射治疗技术取得了根本性的进展,而且已在临床中得到应用。能实时指导和确保射野准确性的成像技术也得到了紧锣密鼓的研究和发展。最近,这些图像数据又被用于对计划的每日治疗剂量进行评估和修正。应用IGRT的目的是提高肿瘤控制率和降低正常组织的副反应,这也是放射治疗的最终目标。IGRT的最重要优势在于避免治疗过程中出现照射剂量不足或者过高等意外情况的发生,因此其已经被整合到许多临床放射治疗的计划设计和实施中。影像引导放射治疗(IGRT)的基本原理 影像引导放射治疗技术已经取得了根本性进步,正在临床治疗中得到应用。然而,关于如何有效地利用IGRT技术仍然存在很多问题需要探讨。为了准确引导和确证放射治疗中射束的准确性,业已对影像技术展开了深入地研究并获得了巨大进展。最近,这些图像数据又被用于评估和修正每日的放射治疗剂量。影像引导技术已经被迅速整合到用到放射治疗的各种软/硬件中,为日常使用提供了诸多机会,但同时也导致了在与放疗日常工作流程的优化整合方面的问题。从临床上对目前IGRT技术的应用结果进行评估可以为后续基础技术研究和临床应用探索提供指导,而且将实际地影响新一代IGRT技术的发展。在本书的其它章节中已经回顾了IGRT技术当前的局限和面对的挑战,本章将主要从临床医生的角度探讨IGRT技术及其在临床中的应用。影像引导放射治疗的需求 从三维适形放疗(3D-CRT)发展到调强放射治疗(IMRT),提高治疗效益比始终都是放疗技术不断完善的目的。放射剂量沉积愈趋集中则更有助于提高肿瘤区的剂量和/或减少正常组织的受照。技术的进步已经显著地降低了邻近的重要正常组织的接受剂量,改善了头颈部及某些其它肿瘤患者的生活质量。采用IGRT进行治疗的目的亦是如此,与IMRT或3D-CRT的结合,提高了治疗的可靠性和准确性。IGRT的目标是减少实际治疗中靶区对位和治疗实施的不确定性,即残余几何不确定性(residual geometric uncertainties),以期将实际实施剂量与计划设计剂量间的误差减少到最小乃至可以忽略不计(或不具临床意义),使IMRT和3D-CRT的治疗优势得以体现。 治疗时进行影像采集可以显示肿瘤的位移程度和范围,从而确定了IGRT在放射治疗中的核心作用。在分割放射治疗中,由于呼吸运动、肠道蠕动及其它功能性运动引起的器官移动,以及肿瘤退缩或患者体重减轻所致的器官几何或解剖形状的改变或可非常显著。IMRT和3D-CRT比二维放射治疗对这些移动和改变更加敏感,由此所致的潜在临床风险是靶区实际所受剂量低于计划而邻近正常组织接受的剂量过高。如果没有图像引导,IMRT和3D-CRT技术的实际治疗获益可能比普通放射治疗还低。有效地应用IGRT可以在治疗时避免与计划不一致的过高或过低剂量,这也是IGRT最重要的优势。在许多临床放射治疗中,IGRT已成为应用先进放疗计划和实施技术时的必不可少的组成部分。 IGRT技术从三个方面为开展新的放疗实践提供了机会。(a)正如前述,如果能够实现放疗剂量与肿瘤靶区的高度适形,则可以在降低正常组织受量的同时提高肿瘤组织的照射量,进而改善肿瘤的局部控制率,减少毒副反应。(b)可以减少治疗的分隔次数,更安全地实施大剂量低分隔治疗。体部立体定向放疗(SBRT)是最常见的大剂量低分割治疗方式,这种治疗的实施必须有严密的影像引导,否则微小的误差都可能显著影响临床治疗结果。虽然SBRT的应用还很局限,但低分割治疗和剂量递增的原则则适用范围广泛。事实上,由于IGRT和其它相关技术的发展,全部或者绝大多数肿瘤的放射治疗剂量与分割模式将可能会在一定程度上出现变化。(c)低分割治疗方案可以降低治疗成本,提高治疗疗效以及增加治疗患者量。居住于远离治疗中心的患者可能无法接受传统的疗程较长的放疗方案,随着治疗次数的下降,这些患者的放射治疗将成为可行。总之,这些都是支持IGRT与其它先进放疗计划和实施技术相结合使用的有力依据。放射治疗实践:降低照射剂量的波动 IGRT的潜在优势在于可以减少实际投照剂量与计划处方剂量之间的差异,这对于以相同治疗方案(相同剂量和相同技术)接受放疗的成组患者尤其重要。为了减少患者间实际投照剂量的变异,需要从以下三个方面着手:(a)进一步明确控制肿瘤所需的剂量;(b)更好地理解与毒副反发生相关的剂量-体积关系;(c)明确放疗调节剂(如放射增敏剂)在治疗中的效用。在临床试验中,放疗方案在对照组和试验组内实施的一致性的提高,可以减少各研究组内临床反应的不均一性,从而有助于发现研究组间的结果差异。 降低放疗投照剂量的变异亦有助于改善治疗结果,这类似与治疗计划的变异对治疗结果的影响。在一项针对头颈部肿瘤的大型随机临床试验中,所有的治疗计划都经由专家组审阅。计划方案偏差越大,肿瘤控制的效果越差。上述结果反映了治疗计划质量控制(QC)和质量保证(QA)的重要性。但是,如果临床试验中出现的剂量变异是由于治疗实施过程的不一致所导致,那么IGRT的应用将便于对治疗计划实施的过程执行质量控制及保证。因此,在今天的放射治疗中,针对放疗计划和实施过程的每一步都有质量控制的标准以及质量控制执行和审查的标准。 IGRT更具潜在意义的临床价值在于提高了医生对肿瘤组织和正常组织的实际受照剂量的关注,从而有助于更好地理解受照剂量与正常组织毒副反应和肿瘤控制率(tumor control probabilities,TCP)之间的关系。但随着IGRT技术充分地整合应用于临床试验和相关结果的成熟,对上述关系的认识或将不同于既往。随着对正常组织剂量/体积毒性反应风险关系的深入理解,将有助于确定需要保护的器官及体积,从而更好地发挥IMRT的治疗优势。目前,临床医师面临的问题之一是需要在对正常组织部分体积受照时的耐受量认识有限或不完整的基础上决定对组织的保护和规避。放射治疗实践:影像引导放射治疗信息的应用 IGRT是一个动态的过程。在遵守肿瘤放射治疗基本原则的同时,治疗的监控和基于IGRT的放射治疗决策需要大量训练和技巧培训。为了审慎治疗,需要对治疗靶区有清晰的认识,这通常借助于先进的影像技术。影像参与了IGRT的各个主要环节,包括放疗计划设计、实施以及监测肿瘤对治疗的反应等。根据影像资料,可以对患者的治疗进行在线评估(每次治疗开始前)、实时评估(在治疗中)和离线评估(在两次治疗间进行。通常在几次分割照射后对前后采集的多个图像进行分析)。通过每次评估,可以获得更多的患者信息,必要时可以对临床治疗进行干预。这种干预可以是简单地在评估当天于治疗前对患者进行重新摆位;也可能因为发现肿瘤退缩或者增大,或者是出现了新的转移灶,而需要对整个治疗方案和治疗目标进行重新考虑或彻底调整。在IGRT时代,治疗过程中的影像所见可以从三个方面影响干预决策,(a)PTV的边界;(b)放疗计划设计,包括重新调整计划,剂量分布调整和处方剂量;(c)总体治疗目标。具体的实施方式可能因治疗机构不同及其治疗的患者群体不同而有差异。 图1总结了IGRT技术在放射治疗过程中的作用。左边的圈代表了对患者持续的医疗评估和治疗。首先,接诊患者,明确治疗目标:控制肿瘤,降低复发风险或者姑息减症治疗。然后设计治疗方案,开始治疗。在治疗过程中,通过临床评估和诊断性影像对患者进行监测。监测的重点根据不同情况可能是正常组织的毒副反应或者是肿瘤组织的反应。IGRT在此过程中居于核心位置。首先IGRT影像将用于对治疗计划的准确性进行评估,组织变化(肿瘤或正常组织)影像信息可能会导致对治疗计划进行调整或重新设计。影像评估可以离线、在线或实时等方式进行。总之,影像评估的结果可能要求对治疗进行修正,包括改变照射技术、调整计划甚至改变治疗的总体目标。如果能够对IGRT进行有效应用,其可以在放射治疗中乃至肿瘤的整体治疗中发挥至关重要的作用。影像引导放射治疗的发展 尽管对IGRT的了解和应用主要发生在过去的十年中,但“影像引导”并非一个新概念。X线透视和平片影像早已存在,数十年前就已经引入到放疗机房辅助对患者的治疗。图2为1958年安装于多伦多一台配有kV级射野成像功能的钴治疗机及其原理图。虽然当时已经可以进行治疗室内kV级成像,但该功能并未得到很好的利用,这与当时的放疗技术比较简单、计划适形度和治疗剂量均比较低等有关,几何不确定性对治疗效果的影响较小。此外,当时图像采集和分析的过程远不如现在先进和快速,无法达到临床工作所需的效率和能力。现在,很多成熟的IGRT技术已经触手可得,更多融合了图像引导功能的先进治疗装置也在不断发展中。或许如何最好地应用现在的技术以最大程度造福患者已经超出了我们的能力范围。 过去的十年中,IGRT技术取得了惊人的进展,对出现在不同患者间的摆位不确定性效应已经有了很多了解;而对在放疗过程中肿瘤或正常组织的变化程度和类型则才刚刚开始认识。对患者连续的三维容积影像数据进行观察分析有助于发现可能存在的几何形变。【来源】《IMRT, IGRT, SBRT-肿瘤放射治疗进展》,John L. Meyer,eds;郑向鹏,许亚萍,邢力刚 主译。人民军医出版社,北京,2013.
郑向鹏 主任医师 复旦大学附属华东医院 放疗科5156人已读



